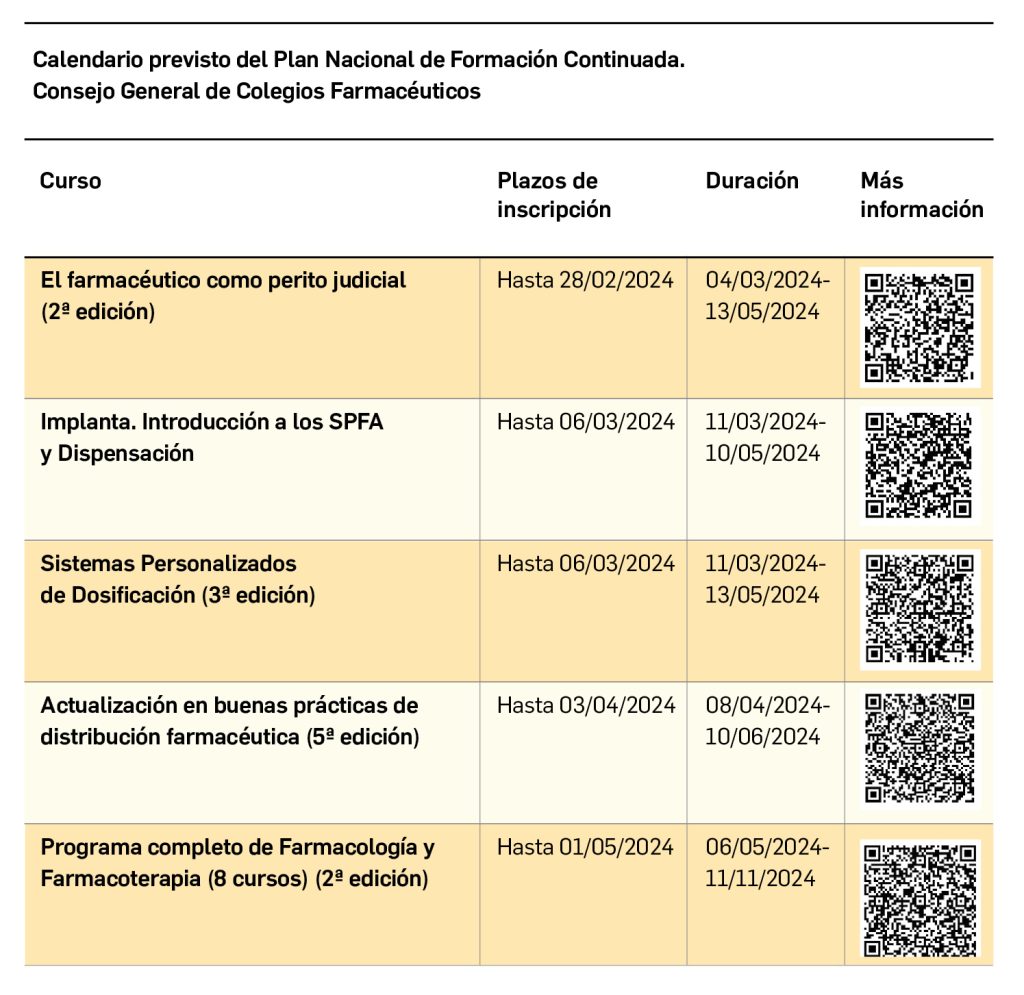
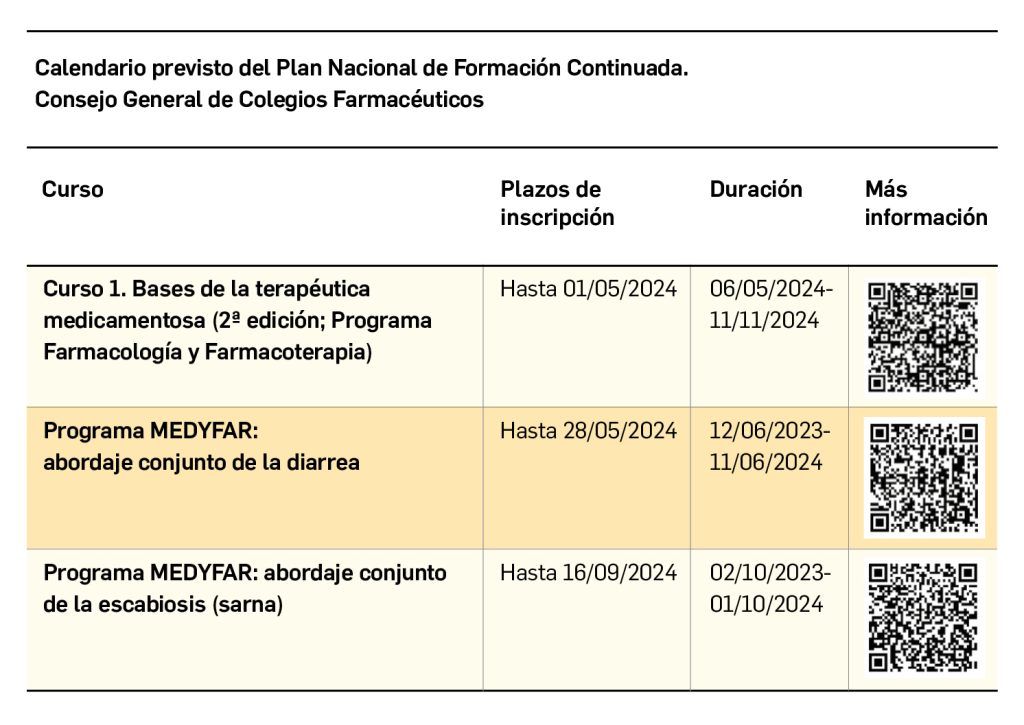
Si bien el aumento de la supervivencia de los pacientes es un resultado fundamental de cualquier intervención sanitaria, en el contexto de los análisis coste-efectividad (ACE), el hecho de prolongar la vida de los pacientes genera el potencial consumo de recursos sanitarios y otros bienes y servicios que deberían ser considerados. Los costes de este consumo en los años de vida ganados (AVG) se denominan costes futuros y su inclusión en los ACE podría tener un fuerte impacto en sus resultados, incluso pudiendo alterar las decisiones de adopción de nuevas tecnologías sanitarias. Los costes totales futuros representan la suma de los costes sanitarios futuros, divididos en costes relacionados y no relacionados con la enfermedad, y los costes no sanitarios futuros. Comúnmente, los únicos costes considerados en los modelos económicos son los costes sanitarios futuros relacionados con la enfermedad y las ganancias en productividad derivadas de vivir más tiempo (si se adopta la perspectiva de la sociedad).
Aparte de las discusiones teóricas sobre el papel de los costes futuros en las evaluaciones económicas, una razón importante para su exclusión es la escasez de estimaciones y herramientas fácilmente disponibles que faciliten su inclusión. Para superar esta barrera práctica, Mokri y cols. estimaron y compararon los costes futuros para cinco países europeos: Países Bajos, Alemania, España, Grecia, Países Bajos y Reino Unido, poniendo de manifiesto el impacto que tendría la inclusión de estos costes en la eficiencia de las intervenciones destinadas a prolongar la vida de los pacientes.
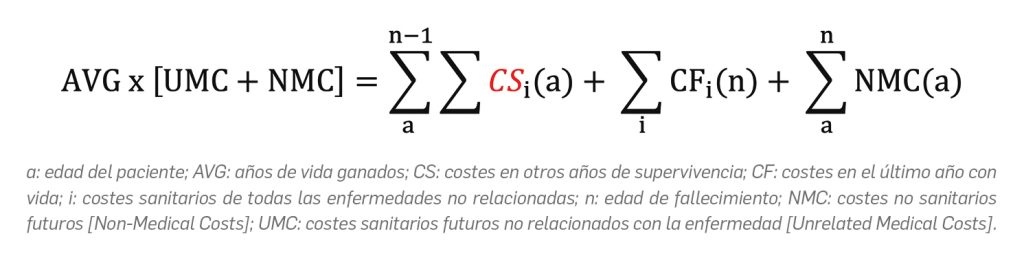
A partir de modelos y fundamentos teóricos desarrollados y publicados previamente, Mokri y cols. estimaron los costes futuros para un individuo como la suma de los costes no relacionados con la enfermedad y los costes no sanitarios, teniendo en cuenta su edad (a) y la edad de su muerte (n), tal y como se representa a continuación:
Los costes no sanitarios futuros se calcularon como el consumo de recursos no sanitarios por equivalente familiar, ajustando el consumo de los hogares a las economías de escala en el consumo de alimentos y otros bienes en el hogar.
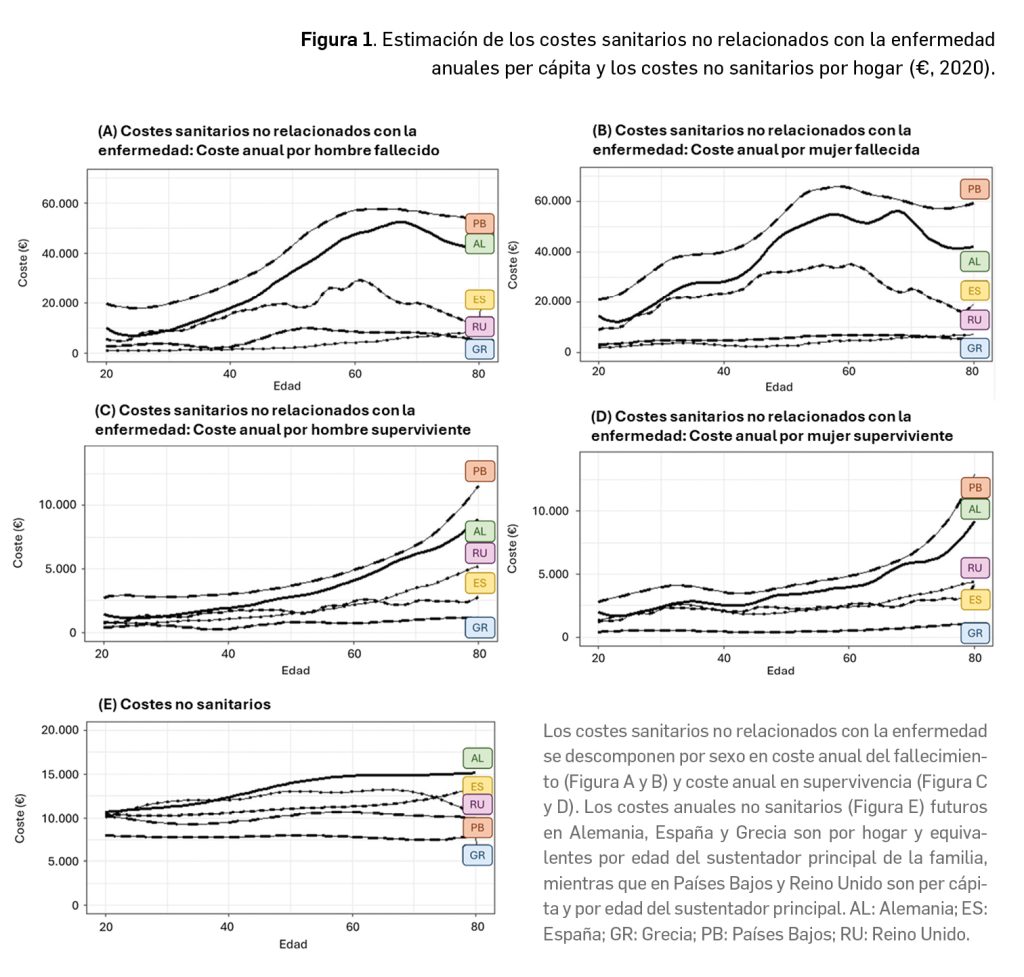
Los resultados mostraron que los costes sanitarios futuros no relacionados con la enfermedad asociados a las intervenciones que prolongan la vida (representados en la Figura 1 A, B, C y D) son significativamente más altos que los costes no sanitarios (representados en la Figura 1 E) en todos los países analizados. El coste promedio no sanitario por hogar en Alemania, España y Grecia se situó alrededor de los 13 300€, 11 100€ y 7800€, respectivamente. En el caso de los Países Bajos y Reino Unido, el coste promedio no sanitario por edad se situó en torno a los 10 000€ y 12 200€, respectivamente.
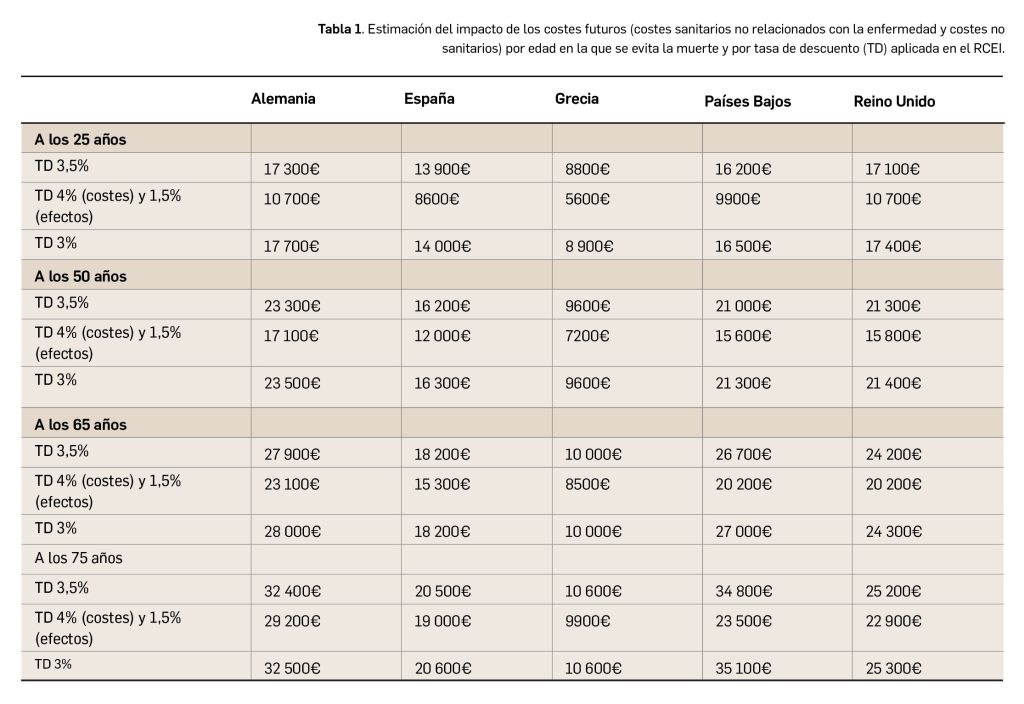
El impacto de incluir los costes futuros en el ACE de una hipotética intervención destinada a prolongar la vida varió entre países, estimándose un ratio coste-efectividad incremental (RCEI) parcial (valor adicional al RCEI estimado de forma convencional) que abarcó desde menos de los 1000€ hasta los 35 000€ por año de vida ajustado por calidad (AVAC) ganado, dependiendo de la edad en la que se evita la muerte y de los costes futuros que se hubiesen incluido (Tabla 1).
COMENTARIO
Mokri y colaboradores han proporcionado estimaciones estandarizadas de los costes sanitarios futuros no relacionados con la enfermedad y los costes no sanitarios futuros, observándose un impacto parcial en el RCEI de hasta 35 000€ por AVAC ganado. Si bien el impacto en cada país es relativamente alto en relación con los umbrales de disponibilidad a pagar comúnmente empleados, la variación en magnitud entre países es considerable. Las diferencias existentes en la financiación de los sistemas sanitarios podrían explicar en parte la variación en los costes sanitarios futuros no relacionados con la enfermedad, especialmente entre Grecia y el resto de los países.
A pesar de las diferencias metodológicas derivadas de la escasez de datos de los costes sanitarias no relacionados con la enfermedad, de la falta de disponibilidad de datos a nivel individual de los costes no sanitarios y de la comparación directa de los diferentes países, los resultados obtenidos tienen importantes implicaciones en la toma de decisiones, en relación con las intervenciones destinadas a prolongar la vida. Ante el aumento de la esperanza de vida de la población española y la disponibilidad cada vez mayor de terapias innovadores con tendencia a un aumento de los AVG, los costes futuros, tanto sanitarios como no sanitarios, deberían ser un aspecto fundamental a tener en cuenta en la eficiencia de las nuevas tecnologías sanitarias, sin dejar de considerar la importancia de los resultados en salud obtenidos, medidos en AVG o en AVAC.
A la vista de los resultados, sería necesario adaptar las políticas de salud y la evaluación de la eficiencia de las tecnologías sanitarias hacia la búsqueda del equilibrio entre los costes futuros por muerte evitada y el beneficio asociado a la ganancia en años de vida. En este sentido, otros aspectos económicos y sociales, como el posible retorno de la inversión al prolongar la productividad de los pacientes, deberían tenerse en cuenta a la hora de estimar la eficiencia de las intervenciones sanitarias.