Verificación de Medicamentos en la Oficina de Farmacia
Sistema de autenticación de medicamentos
La normativa relativa a la prevención de falsificación de medicamentos establece que todos los fabricantes y titulares de autorización de comercialización, ya sean laboratorios de innovación, genéricos e importadores paralelos, tendrán que incorporar dos tipos de dispositivos de seguridad en todos los envases de medicamentos sujetos a la obligación de ser verificados.
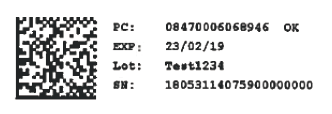
- Un código datamatrix que identifica individualmente el envase (IU, identificador único) y permite verificar su autenticidad mediante consulta al repositorio nacional de SEVeM. La información incluida en este código bidimensional (bidi) también vendrá impresa en formato legible para las personas, es decir: Código de Producto (PC), Número de Serie, único por envase (SN), Lote y Fecha de Caducidad.
- Un dispositivo contra manipulaciones (DCM), que permitirá verificar si el envase ha sido objeto de manipulación.

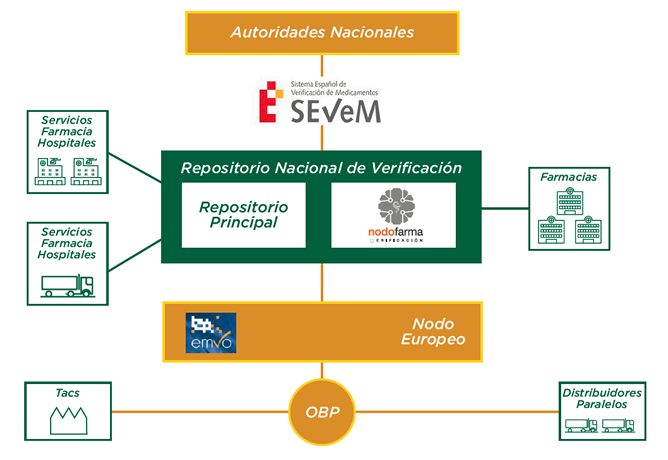
Los fabricantes y titulares de autorización de comercialización introducirán estos identificadores únicos, para todos los envases sujetos a la obligación de verificación que se vayan a comercializar en la Unión Europea y Espacio Económico Europeo, en una base de datos central, el Sistema Europeo de Verificación de Medicamentos (EMVS), también denominado “Plataforma europea”. Dicha plataforma conectará con los sistemas nacionales asegurando la interoperabilidad entre ellos. Los códigos de los medicamentos serializados se descargarán en el mercado de destino, por ejemplo, en España se transferirán al SEVeM, el Sistema Español de Verificación de Medicamentos.
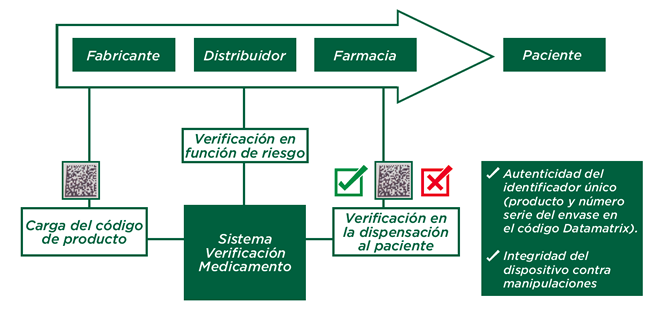
En su circuito a través de la cadena del medicamento, el envase será verificado y/o autenticado. Los distribuidores solo verificarán en los casos previstos en la normativa europea y nacional, en base a un análisis de riesgo.
En el caso de las oficinas de farmacia la normativa antifalsificación establece la obligación de verificar en el momento de la dispensación los dispositivos de seguridad (identificador único y dispositivo contra manipulaciones) de los envases de los medicamentos de uso humano que, de acuerdo con dicha normativa, tienen la obligación de llevarlos; desactivando el identificador único en el momento de la dispensación.
Guía para la Oficina de Farmacia en el cumplimiento de la normativa antifalsificación

Marco legal
- Directiva 2011/62/UE del Parlamento Europeo y del Consejo, de 8 de junio de 2011, que modifica la Directiva 2001/83/CE por la que se establece un código comunitario sobre medicamentos de uso humano, en lo relativo a la prevención de la entrada de medicamentos falsificados en la cadena de suministro legal.
- Reglamento Delegado (UE) 2016/161 de la Comisión, de 2 de octubre de 2015, que completa la Directiva 2001/83/CE del Parlamento Europeo y del Consejo estableciendo disposiciones detalladas relativas a los dispositivos de seguridad que figuran en el envase de los medicamentos de uso humano.
- Corrección de errores del Reglamento Delegado (UE) 2016/161 de la Comisión, de 2 de octubre de 2015, que completa la Directiva 2001/83/CE del Parlamento Europeo y del Consejo estableciendo disposiciones detalladas relativas a los dispositivos de seguridad que figuran en el envase de los medicamentos de uso humano.
- Real Decreto 717/2019, de 5 de diciembre, por el que se modifica el Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente.
Fin del periodo de estabilización
Durante la fase de puesta en marcha del sistema de verificación surgieron numerosas alertas no relacionadas con sospechas de medicamentos falsificados. Teniendo en cuenta que en España nunca se han detectado medicamentos falsificados dentro del canal legal del medicamento (según indica la AEMPS), y para atender a la necesidad de garantizar la continuidad del suministro de los medicamentos, se aceptó por las autoridades la dispensación de medicamentos que tras la verificación del identificador único generasen una alerta en el sistema, siempre que:
- La alerta fuera generada por errores técnicos, procedimentales o humanos causados fundamentalmente por problemas en la carga de códigos de IU en el repositorio, errores en la codificación del datamatrix, por la existencia previa en el mercado de envases con códigos incompletos o no conformes con el Reglamento Delegado, así como por el desconocimiento de los usuarios en el manejo del sistema, y
- El IU no estuviera desactivado, y se hubiera comprobado la integridad del dispositivo contra manipulaciones del envase, así como la legalidad del proveedor del medicamento que generó la alerta.
Después del trabajo realizado a lo largo de estos años en el marco de SEVeM y tras los avances técnicos implementados para una mejor funcionalidad del sistema, se ha logrado reducir significativamente el número de alertas generadas, motivo por el que la AEMPS considera que se ha alcanzado la estabilización del sistema en España.
Por ello, a partir del 30 de septiembre de 2024, tal y como anunció la propia AEMPS el 1 de julio, se ha puesto fin al periodo de estabilización en nuestro país. El fin de este periodo de estabilización supone que a partir de dicha fecha dejarán de permitirse las excepcionalidades expuestas en los párrafos anteriores lo que implica que no se podrá suministrar ni dispensar ningún medicamento para el que no se obtenga una operación de verificación/desactivación satisfactoria y genere una alerta que no pueda ser descartada como sospecha de falsificación.
Aspectos Operativos en la Oficina de Farmacia
Incidencias y resolución de problemas en la autenticación
Enlaces de interés
- Instrucciones para farmacias para notificar sospechas de medicamentos falsificados en relación con la verificación de la autenticidad del identificador único.
- Web de contingencias.
- Listado puntos de contacto de la autoridad competente (AEMPS)
- Listado puntos de contacto de titulares de comercialización (AEMPS)