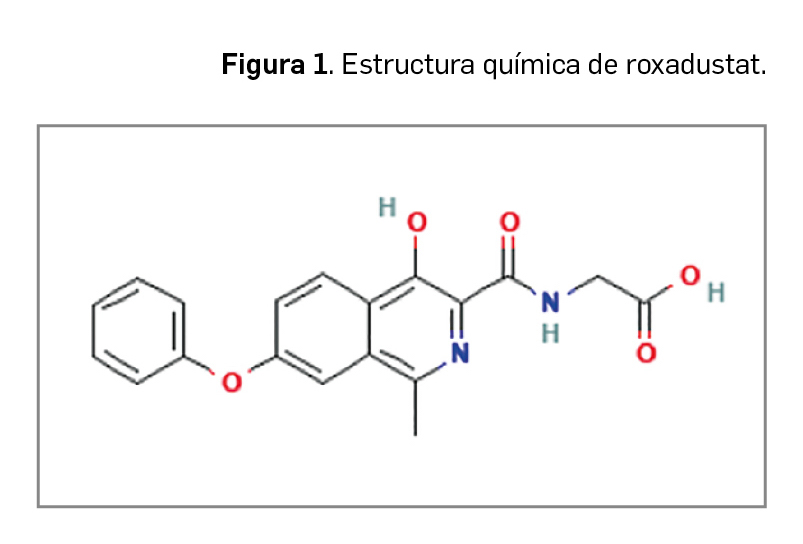
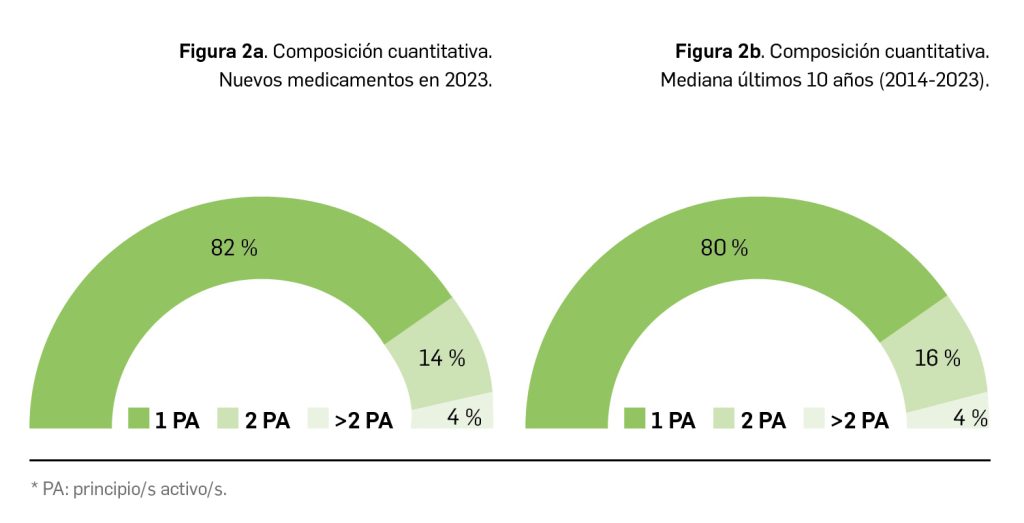
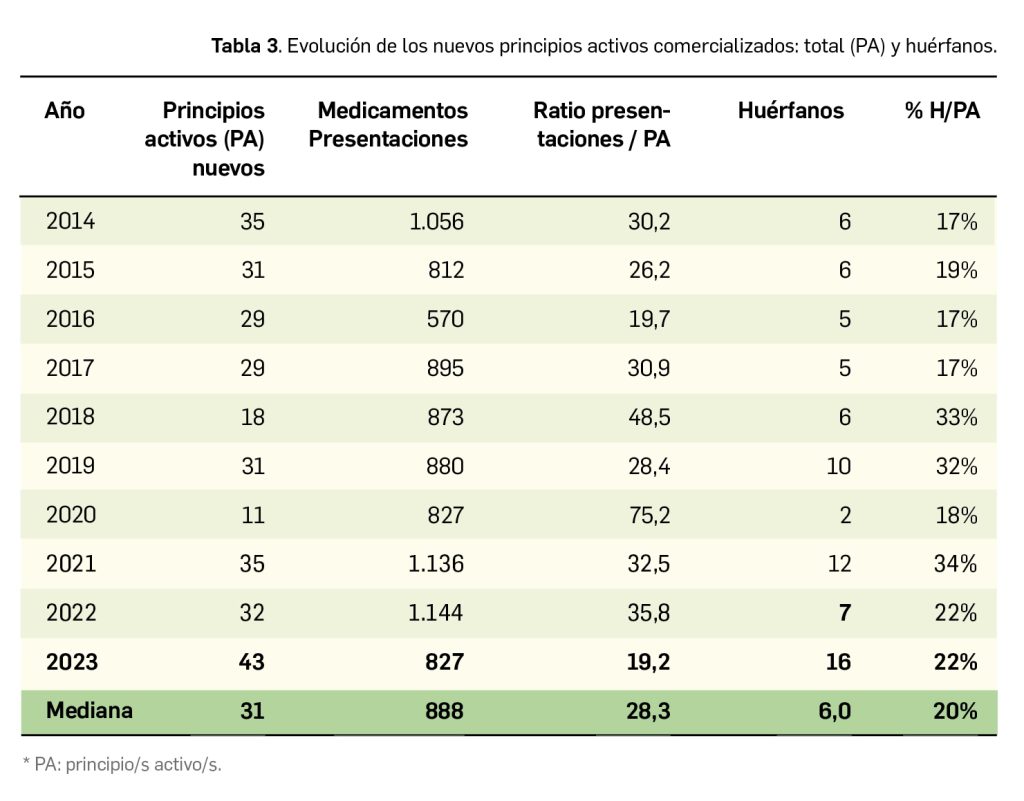
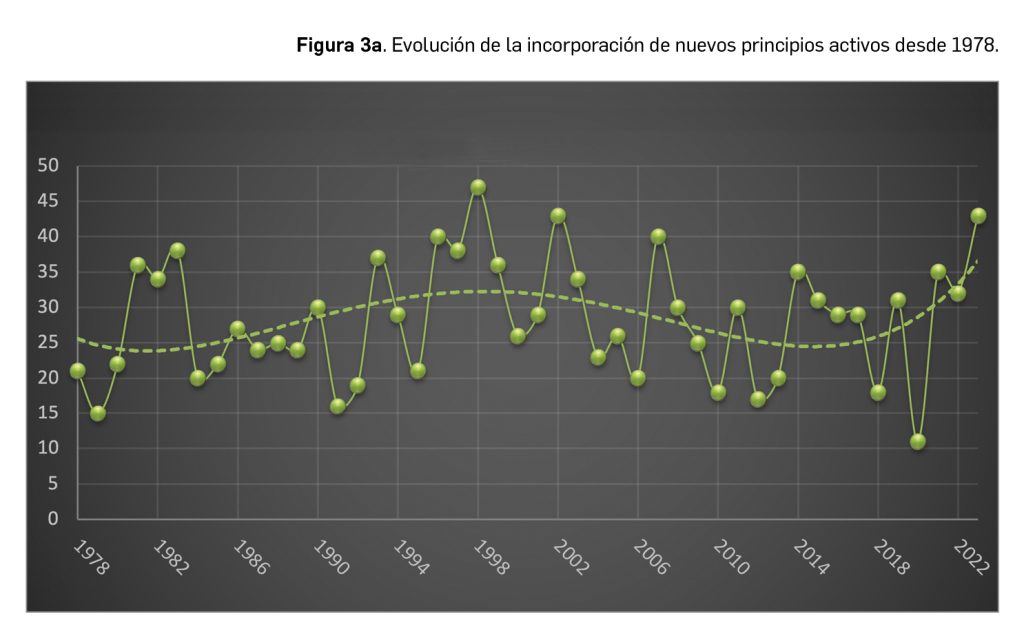
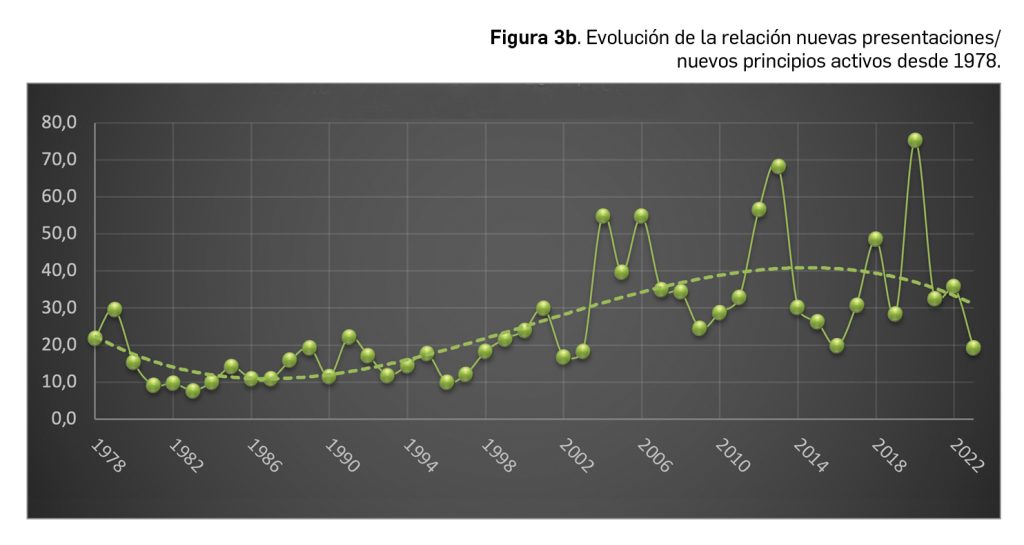
Inclisirán es un nuevo ácido ribonucleico pequeño de interferencia (ARNpi) bicatenario que, mediante el mecanismo de interferencia del ARN, degrada el ARN mensajero de la proproteína convertasa subtilisina/kexina de tipo 9 (PCSK9). De esta manera inhibe la producción de esta enzima, la cual actuaría degradando los receptores de las LDL, impidiendo así su metabolismo y, en consecuencia, dando lugar a mayores niveles plasmáticos de colesterol LDL (c-LDL) y a un mayor riesgo de aterosclerosis. En base a esta acción farmacológica opuesta a la de la PCSK9, inclisirán ha sido autorizado en la UE para el tratamiento por vía subcutánea de pacientes adultos con hipercolesterolemia primaria (heterocigótica familiar y no familiar) o dislipidemia mixta, como adyuvante de la dieta: en combinación con una estatina o una estatina y otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar los objetivos de c-LDL con la dosis máxima de una estatina; también se puede administrar solo o en combinación con otros tratamientos hipolipemiantes en pacientes que son intolerantes a las estatinas, o las tienen contraindicadas.
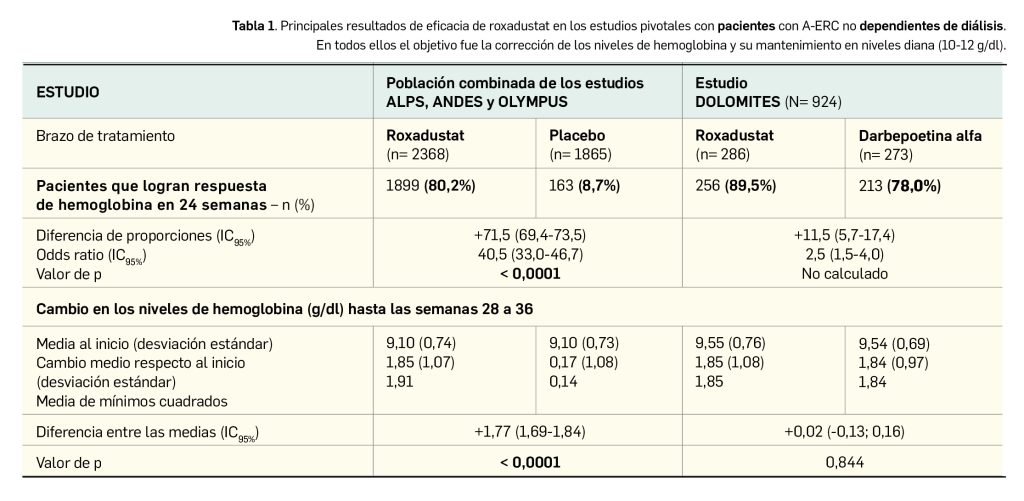
Su eficacia clínica fue adecuadamente evaluada en tres estudios pivotales de fase 3 de similar diseño –doble ciego, controlados por placebo y aleatorizados– con el objetivo principal de evaluar la eficacia del fármaco en la reducción de c-LDL. En todos ellos, inclisirán fue superior a placebo en las variables coprimarias de eficacia, al producir una reducción notable y estadísticamente significativa en comparación con placebo de los niveles de c-LDL tanto hasta el día 510 respecto al nivel basal (de entre -49,5 puntos porcentuales (p.p.) y -57,6 p.p.; p< 0,0001), como en el promedio entre los días 90 y 540 respecto al nivel basal (entre -44,3 p.p. y -53,8 p.p.; p< 0,0001).
Los resultados disponibles relativos al perfil de seguridad de inclisirán no han revelado aspectos de especial preocupación. De acuerdo a un análisis agrupado de los tres estudios pivotales, la frecuencia de pacientes con al menos un evento adverso fue similar en los grupos de inclisirán y placebo (77-78%), así como la de pacientes con al menos un evento adverso grave (20-23%, respectivamente). Los únicos eventos adversos que presentaron una frecuencia claramente superior en los grupos de inclisirán fueron las reacciones en el lugar de administración (eritema, dolor o inflamación) y fueron por lo general leves o –menos frecuentemente– moderadas en intensidad y transitorias, sin casos de hipersensibilidad grave o de reacciones alérgicas sistémicas. Los eventos adversos más frecuentemente detectados fueron diabetes mellitus, nasofaringitis, infecciones respiratorias e hipertensión.
En definitiva, se trata del primer ARNpi dirigido a la PCSK9; aunque frente a esa diana ya se dispone de dos anticuerpos monoclonales con similares indicaciones, inicia una interesante vía en el tratamiento de la hipercolesterolemia y la aterosclerosis, profundizando en el gran potencial que tiene la terapéutica a base de ARN. Los datos de eficacia son indicativos de un importante efecto en la reducción del nivel de c-LDL, aunque la correlación de este efecto con la prevención del riesgo cardiovascular es todavía un elemento de incertidumbre. Por ahora, inclisirán se posiciona como una alternativa a otros –sobre todo, a evolocumab o alirocumab– en un régimen combinado con al menos una estatina en dosis altas, salvo contraindicación de ésta. Es decir, se limitará por ahora a una segunda línea de tratamiento, si bien su pauta –inyecciones subcutáneas cada 6 meses en fase de mantenimiento– puede beneficiar en gran medida el cumplimiento terapéutico.
Aspectos fisiopatológicos
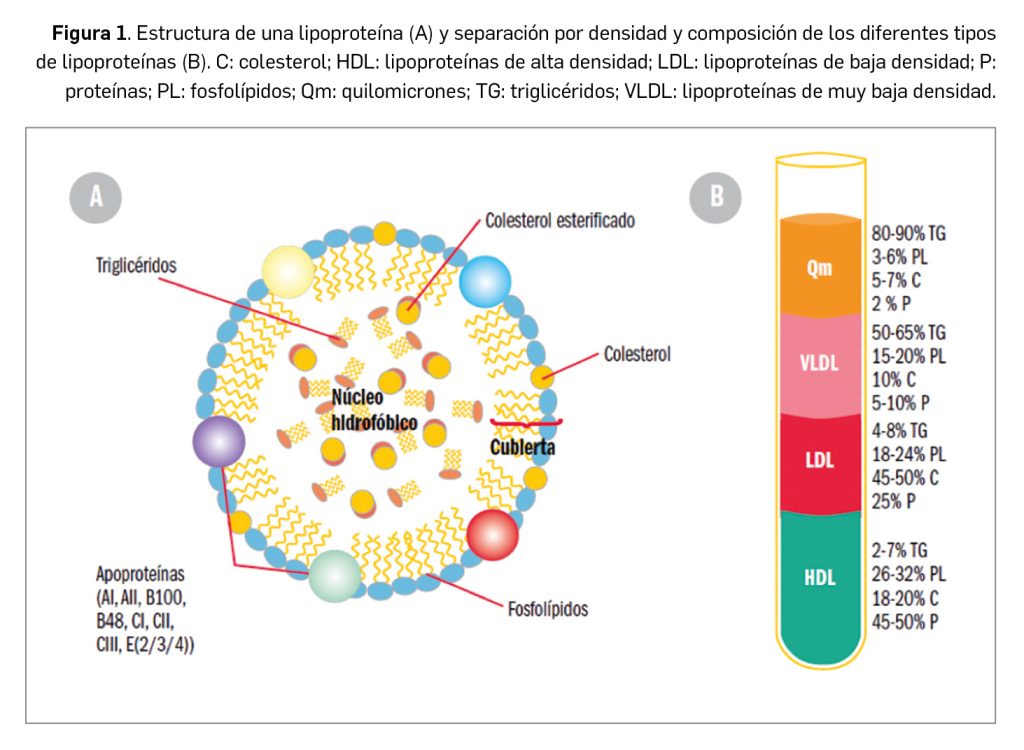
Los lípidos son sustancias que nuestro organismo emplea como almacén de energía y que desempeñan importantes funciones (formación de membranas celulares, modificación de proteínas, producción de hormonas, etc.). Por su carácter liposoluble precisan para su transporte –en el medio acuoso que constituye el plasma– de un vehículo adecuado: colesterol, triglicéridos y fosfolípidos se transportan en el plasma formando macrocomplejos en los que las moléculas más hidrófobas se disponen en el centro y se recubren de otras hidrófilas, como fosfolípidos y apolipoproteínas. Estos complejos son lo que conocemos como lipoproteínas (Figura 1), entre las que se diferencian varios tipos en función de la composición del núcleo lipófilo y del tipo de apoproteínas que presentan (algunas constituyen la tarjeta de presentación a su receptor). Los niveles plasmáticos de lipoproteínas reflejan, por tanto, los de los lípidos que contienen.
Las lipoproteínas y el colesterol
Los ácidos grasos constituyen la base de los lípidos del organismo. Son ácidos orgánicos con cadenas hidrocarbonadas de diferente longitud y grado de saturación, que se esterifican con otras sustancias como glicerol y ácido fosfórico, para dar lugar entre otros productos a triglicéridos y fosfolípidos, o bien son metabolizados a esteroles, dando lugar al colesterol. Los ácidos grasos no esterificados se asocian a la albúmina, mientras que los restantes constituyen las lipoproteínas que permiten movilizar los triglicéridos desde el intestino y el hígado hasta los puntos de utilización o almacenamiento (tejido adiposo y músculo) y transportar el colesterol allí donde se necesita: por ejemplo, para la síntesis de membranas, la producción de hormonas esteroideas o la síntesis de ácidos biliares.
Las lipoproteínas se clasifican según su densidad (a mayor densidad, mayor contenido en proteínas, y a mayor diámetro, mayor contenido de lípidos) y cada tipo ejerce distintas funciones:
- Quilomicrones: se forman en el intestino, contienen apoproteína B48 y transportan fundamentalmente los triglicéridos, los fosfolípidos y el colesterol procedentes de la dieta y de la síntesis en el epitelio intestinal. En los tejidos periféricos ricos en lipoproteína lipasa (LPL), liberan ácidos grasos.
- Lipoproteínas de muy baja densidad (VLDL, very low density lipoproteins): contienen apoproteína B (ApoB), C y E y transportan triglicéridos y colesterol, sintetizados en el hígado, hacia los tejidos periféricos, cediendo igualmente ácidos grasos en tejidos periféricos.
- Lipoproteínas de baja densidad (LDL, low density lipoproteins): proceden de las VLDL (presentan, pues, las mismas apoproteínas) y representan el principal sistema de transporte del colesterol hacia las células de los tejidos periféricos.
- Lipoproteínas de alta densidad (HDL, high density lipoproteins): sintetizadas en su mayoría en hígado e intestino, contienen fundamentalmente apoproteína A (ApoA), C y E. Transportan el colesterol cedido por las células de los tejidos periféricos al hígado, en un transporte inverso que es un mecanismo hipocolesterolemiante, y la razón por la que los niveles altos de c-HDL se asocian a un menor riesgo de cardiopatía isquémica.
Los enterocitos liberan los lípidos absorbidos tras la ingesta de alimentos a la linfa en forma de quilomicrones ricos en triglicéridos. En los capilares del tejido adiposo y muscular esquelético, ricos en lipoproteína lipasa (LPL), los lípidos contenidos en los quilomicrones son hidrolizados a ácidos grasos, que son asimilados por las células de estos tejidos, donde se almacenan, constituyendo un depósito de energía, o se emplean como materia prima para la síntesis de otros lípidos (Figura 2). Los quilomicrones remanentes, que no han perdido su colesterol, sufren un proceso de endocitosis en el hígado.
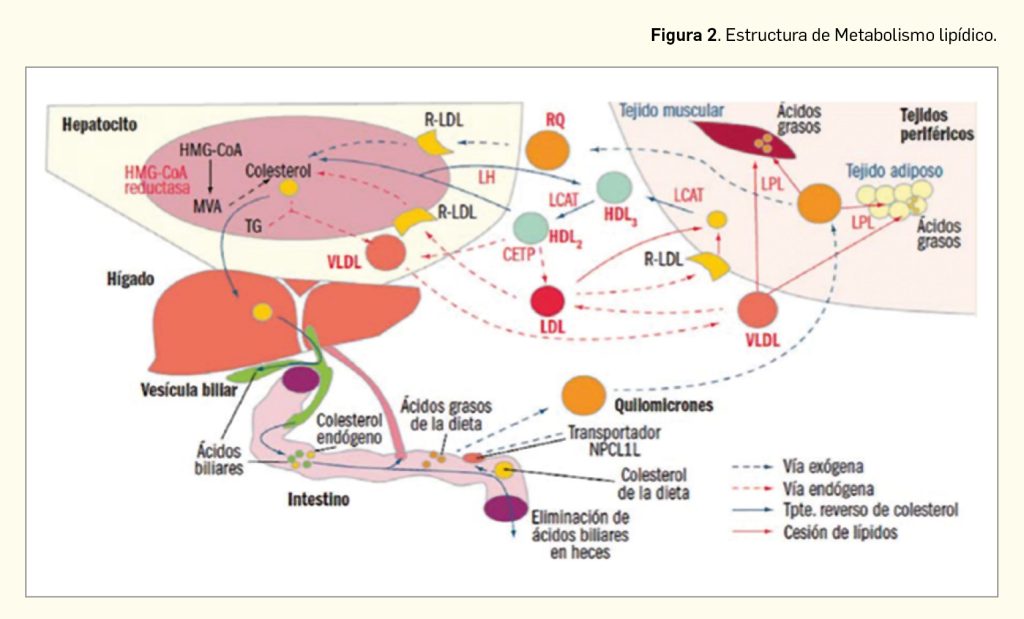
El colesterol hepático, endógeno o exógeno, puede ser esterificado y almacenado, excretarse en la bilis como colesterol libre o ser transformado en ácidos biliares, constituir nuevas lipoproteínas o incorporarse a las membranas plasmáticas de los hepatocitos. Aproximadamente el 80% del colesterol endógeno procede de síntesis hepática y se libera a la circulación en forma de VLDL; en los capilares del músculo esquelético y del tejido graso, las VLDL sufren el ataque de la LPL, que hidroliza los triglicéridos y libera ácidos grasos, que son captados por los tejidos y convierten a las VLDL en LDL. Los niveles elevados de LDL y su oxidación forman parte de la base etiopatogénica de la aterosclerosis. Las LDL circulantes son reconocidas por receptores presentes en las membranas celulares (R-LDL), produciéndose su endocitosis al interior celular, donde se convierten en sustrato de enzimas lisosomales, cediendo colesterol libre.
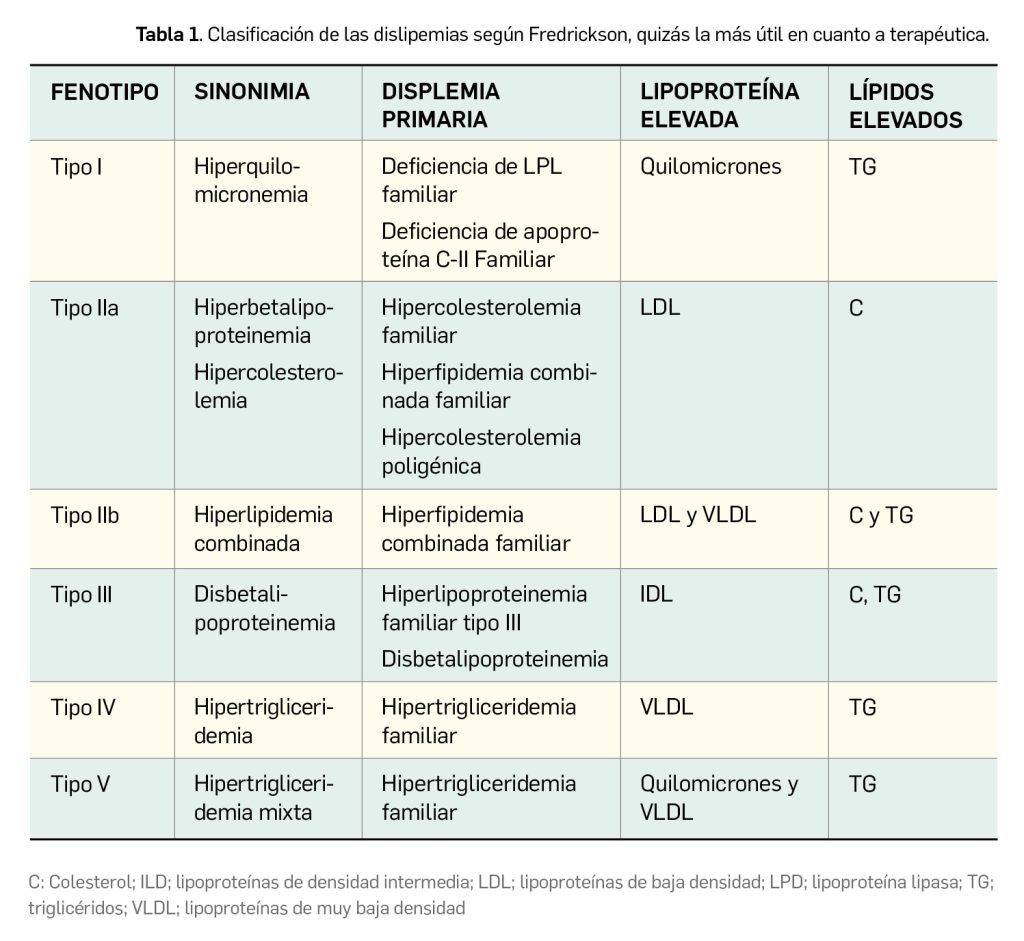
Las dislipemias o dislipidemias son alteraciones del metabolismo lipídico que conducen a desviaciones de los valores normales de las lipoproteínas o los lípidos en sangre. Aproximadamente uno de cada cuatro pacientes adultos que acuden a consultas de atención primaria o especializada presentan algún tipo de dislipemia. Se denominan primarias cuando se deben a una alteración genética o a una dieta inadecuada, y secundarias cuando están relacionadas con patologías que alteran el metabolismo lipídico1, como son la diabetes mellitus, trastornos renales, hipotiroidismo o la administración de algunos medicamentos (por ejemplo, los antirretrovirales inhibidores de la proteasa, la ciclosporina o las tiazidas).
Las dislipemias han sido objeto de distintas clasificaciones (Tabla 1), pero se sabe que en cada uno de los tipos se pueden encontrar distintas enfermedades (primarias o secundarias a otras patologías) que pueden dar lugar a la alteración de los niveles de un tipo de lipoproteína. La reducción del nivel del colesterol unido a LDL (en adelante, c-LDL) y los triglicéridos retrasa la progresión e incluso puede reducir la placa de ateroma. Todos los datos disponibles indican que el control de las dislipemias es esencial en la prevención primaria y secundaria de las enfermedades cardiovasculares.
La hipercolesterolemia es la dislipemia más frecuente, presentándose bien en su forma pura (70%) o bien como dislipemias mixtas en que también se elevan los niveles de triglicéridos (25%). El incremento de los niveles de c-LDL y la disminución de los de colesterol unido a HDL (c-HDL) constituyen, junto con la hipertensión y el tabaquismo, los principales factores de riesgo modificables para el desarrollo de aterosclerosis, una enfermedad sistémica que afecta a las arterias, alterándolas progresivamente y formando placas esclerosadas que llegan a reducir la luz vascular (estenosis) y conducen a situaciones con mayor o menor grado de isquemia del área afectada y riesgo de eventos cardiovasculares.
La forma más común de hipercolesterolemia primaria es la hipercolesterolemia no familiar o poligénica (HP), que representa el 80% de los casos; en ella intervienen factores poligénicos en interacción con factores ambientales, especialmente la dieta. Por su parte, la hiperlipidemia familiar es un trastorno genético en el que se agrupan varias patologías, entre las cuales la más común es la hipercolesterolemia familiar (HF), caracterizada por la presencia de elevadas concentraciones sanguíneas de c-LDL y por el desarrollo prematuro de xantomas2 y enfermedades cardiovasculares. Se trata de una enfermedad hereditaria de transmisión autosómica dominante y que se manifiesta desde el nacimiento, debida a la existencia de mutaciones del gen del receptor de LDL (R-LDL) en el 95% de los casos, aunque también se asocia con mutaciones de los genes codificadores de apolipoproteína B (ApoB) y de la PCSK9 proprotein convertase subtilisin/kexin type 9), una enzima que se une al R-LDL presente en los hepatocitos y facilita su internalización y degradación.
En su forma heterocigótica, la HF tiene una prevalencia en la UE de 1:200 a 1:500 y, a pesar de un tratamiento hipolipemiante intensivo, incrementa el riesgo de mortalidad hasta el doble respecto a la población general; se estima que en España afecta a unas 100 000-190 000 personas, existiendo un enorme infradiagnóstico. La forma homocigótica es aún mucho más grave, cursando con niveles de c-LDL y colesterol total extraordinariamente elevados, lo que determina una alta mortalidad incluso en edad infantil y juvenil. Afortunadamente, es mucho más infrecuente que la forma heterocigótica, con una prevalencia de entre 1:300 000 y 1:1 000 000; se estima que en España puede afectar solo a unos 150 pacientes.
Existe abundante evidencia que demuestra que los niveles plasmáticos altos de colesterol se relacionan con un aumento de la incidencia de la morbimortalidad cardiovascular. Según se ha sugerido anteriormente, el principal riesgo del mantenimiento de niveles altos de lípidos en sangre se asocia con el desarrollo de la placa de ateroma y la consecuente aterosclerosis: la primera causa de muerte e incapacidad en los países desarrollados. Se considera éste como un proceso inmunoinflamatorio crónico de origen multigénico y multifactorial, que comienza tempranamente por una disfunción del endotelio vascular y modificaciones oxidativas de los lípidos sanguíneos atrapados en el subendotelio. Los lípidos depositados en las lesiones ateroscleróticas provienen fundamentalmente de las LDL circulantes, que ingresan en la pared vascular a través de este endotelio lesionado o disfuncional. La enfermedad se desarrolla de forma intermitente en el tiempo, observándose un crecimiento discontinuo de las placas (se intercalan periodos de inactividad con otros de rápida evolución), modulado por factores ambientales y genéticos. El resultado final es que aparecen y se desarrollan lesiones con mayor o menor contenido lipídico, presencia de colágeno, fibras elásticas y calcio. La localización y el grado de desarrollo de estas lesiones determinan las diferentes formas clínicas, con manifestaciones correspondientes a la disminución del flujo y aparición de isquemia crónica, o bien a la obstrucción de dicha luz por rotura/fisura de la placa y aparición de fenómenos trombóticos (el núcleo lipídico de la placa desencadena la activación de las cascadas de la coagulación y de la adhesión y agregación plaquetarias) e isquemia aguda.
La prevención y tratamiento de las dislipemias debe contemplarse como parte fundamental de la prevención de la patología cardiovascular (la primera causa de muerte en todo el mundo, según la OMS). Como tal, sus objetivos deben ajustarse atendiendo al riesgo cardiovascular que presenta el paciente concreto. A lo largo de numerosos y amplios ensayos clínicos, se ha evidenciado que la reducción de los niveles séricos de colesterol total y de c-LDL comporta una reducción del riesgo cardiovascular, por lo que esto se convierte en objetivo prioritario del tratamiento3, al que pueden seguir los valores de otras fracciones lipídicas asociadas a la aterosclerosis. Así, el criterio principal subrogado para evaluar la eficacia del tratamiento –reducción del riesgo cardiovascular en sus diversas manifestaciones patológicas (número de eventos de infarto de miocardio, accidente cerebrovascular, etc.)– es el descenso de la fracción LDL y el aumento de la fracción HDL.
Los pilares del abordaje de las hipercolesterolemias son la dieta, el ejercicio y la terapia farmacológica hipolipemiante. La justificación de esta última en todos los casos de hipercolesterolemia es aún hoy objeto de polémica y está lejos de haberse demostrado esta máxima terapéutica para todos los fármacos disponibles: hay una tendencia a no considerar solo los niveles de c-LDL, evitándose la farmacoterapia en pacientes jóvenes sin factores de riesgo cardiovascular; en cambio, se suele optar por intensificarlos en pacientes que hayan sufrido un episodio coronario o presenten, en general, un nivel de riesgo coronario y/o cerebrovascular de moderado a elevado.
En general, con cifras de disminución del c-LDL del orden del 25-30% hay un retardo significativo en la progresión de la arteriosclerosis en arteria coronaria y carotídea (la regresión de las lesiones se produce pocas veces). Clásicamente, se han considerado como objetivos terapéuticos los siguientes niveles plasmáticos: colesterol total < 200 mg/dl, c-LDL < 100 mg/dl, c-HDL > 60 mg/dl y triglicéridos < 150 mg/dl. Algunas guías clínicas fijan objetivos del tratamiento en función de la presencia o no de enfermedad coronaria y de la existencia de factores adicionales de riesgo. En todo caso, la terapia hipolipemiante parece evolucionar a tratamientos cada vez más selectivos, pero también más intensivos. Se dispone actualmente de distintas opciones farmacológicas descritas a continuación.
Los denominados inhibidores de la HMG-CoA reductasa, más comúnmente referidos como estatinas, constituyen el tratamiento de elección de las hipercolesterolemias. Actúan inhibiendo competitivamente uno de los enzimas claves en el proceso de síntesis del colesterol en el organismo: la HMG-CoA reductasa. Su inhibición produce una activación de las proteínas reguladoras SREBP (sterol regulatory elements-binding proteins), que activan a su vez la transcripción de proteínas e incrementan la expresión del gen del receptor de LDL y un aumento en la cantidad de receptores funcionales en el hepatocito, dando lugar a una mayor eliminación de las LDL circulantes, lo que disminuye las concentraciones de c-LDL.
El tratamiento con estatinas produce una reducción rápida e un descenso moderado de triglicéridos (10-25%; de hasta 35% en sujetos con niveles de > 250 mg/dl) y un ligero ascenso (4-10%) de c-HDL. El orden de potencia hipolipemiante a nivel equimolecular es: pitavastatina > rosuvastatina > atorvastatina > simvastatina > pravastatina = lovastatina > fluvastatina; sin embargo, cuando se utilizan dosis equivalentes, el efecto terapéutico es similar. Al doblar la dosis de cualquier estatina, el aumento relativo en la reducción de c-LDL es, en general, del 6-7%. Estos fármacos actúan rápidamente, inhibiendo la enzima limitante en pocas horas; asimismo, más del 90% del efecto reductor de c-LDL se consigue las primeras 4 semanas de tratamiento, sin que sea haya evidenciado tolerancia farmacológica con el tratamiento crónico. Además de sus efectos sobre el perfil lipídico, las estatinas tienen otros efectos cardiovasculares beneficiosos, especialmente sobre la pared arterial, que explicarían el beneficio adicional no atribuible a la reducción del c-LDL observado en muchos estudios (efectos pleiotrópicos)4.
Hay una amplia experiencia de la buena tolerabilidad con el uso de estos fármacos, aunque ocasionalmente producen un aumento de las transaminasas séricas (reversible al suspender el tratamiento) o miositis. No obstante, un porcentaje significativo de pacientes (se estima en 10-15%) presentan intolerancia a estatinas, principalmente por mialgia acompañada de elevaciones significativas de creatina kinasa (CK), que pueden desembocar en rabdomiólisis en los casos más severos.
De igual modo, muchos pacientes no alcanzan el nivel objetivo de c-LDL a pesar del tratamiento intensivo. Antes de cualquier intensificación del tratamiento, las guías clínicas recomiendan reevaluar la adherencia del paciente a la farmacoterapia y a los cambios en el estilo de vida (dieta, ejercicio). En caso de que sea necesario intensificar el tratamiento, la aféresis de LDL es un tratamiento a considerar, pero presenta limitaciones prácticas, y es más común recurrir a otras alternativas farmacológicas, como las siguientes:
- Los fibratos son derivados del ácido clofíbrico que reducen fundamentalmente los niveles de triglicéridos (30-50%), y consecuentemente, los de c-VLDL, y aumentan los de c-HDL (10-20%). La acción reductora sobre colesterol total (10-20%) y c-LDL (5-10%) es comparativamente mucho menor, y variable según el fármaco. Los únicos que permanecen en el mercado son: fenofibrato, bezafibrato y gemfibrozilo. Este último es un poco distinto: tiene escaso efecto sobre el colesterol, pero una acción más pronunciada sobre triglicéridos, y en ciertos casos produce una elevación significativa de la fracción c-HDL.
- Los secuestrantes de sales biliares –colesevelam y colestiramina– son polímeros de intercambio aniónico que constituyen el grupo de hipolipemiantes más antiguo, aunque con probada eficacia. Reducen los niveles de c-LDL en un 10-30% y en combinación con estatinas pueden alcanzar el 60%. Actúan uniéndose a los ácidos biliares presentes en la luz intestinal, formando complejos no absorbibles que son eliminados con las heces y, por tanto, impiden la reabsorción de dichos ácidos biliares. A medida que la reserva orgánica de estos se agota, el enzima colesterol 7α hidrolasa experimenta una regulación al alza, incrementado la tasa de conversión de colesterol en ácidos biliares, lo que a su vez provoca un aumento de la demanda de colesterol por parte de los hepatocitos, dando lugar a un incremento tanto de la expresión como de la actividad de la HMG-Coa reductasa y del número de receptores hepáticos de LDL. Estos efectos compensatorios potencian la eliminación de c-LDL de la sangre y, por consiguiente, reducen sus niveles. Su principal inconveniente es una elevada tasa de discontinuidad en el tratamiento por las molestias gastrointestinales; sobre todo, el estreñimiento, que alcanza hasta el 40% de los pacientes.
- El interés por los aceites poliinsaturados de pescado surgió de estudios epidemiológicos que sugerían que poblaciones con dietas ricas en pescado (esquimales, japoneses) tienen una incidencia de enfermedades cardiovasculares significativamente inferior a otros grupos de población con consumo equivalente de grasas animales o vegetales. Los preparados de aceite de pescado son mezclas de los ácidos eicosapentaenoico y docosaexaenoico, en que la acción farmacológica principal la ejerce el primero; el segundo actúa fundamentalmente de reserva transformándose lentamente en el primero, si bien puede tener funciones biológicas aún no bien conocidas. A dosis terapéuticas ambos se comportan como hipolipemiantes, pero también desarrollan otros efectos preventivos cardiovasculares de naturaleza compleja: modifican la proporción de los diversos tipos de prostaglandinas del organismo, lo que puede traducirse en acción vasodilatadora e inhibición de la agregación plaquetaria.
- La ezetimiba es otro agente hipolipemiante, que actúa situándose en las microvellosidades del intestino delgado, donde inhibe la captación del colesterol por los enterocitos a través de la inhibición del transportador de esteroles Niemann-Pick C1-Like 1 (NPC1L1), que actúa en la absorción de colesterol y fitoesteroles. Reduce la absorción intestinal del colesterol procedente de la dieta y de la secreción biliar en más de un 50%. En general, reduce los niveles de c-LDL en un 17-20% en monoterapia, y en más del 40% en combinación con estatinas; tiene una acción reductora moderada sobre triglicéridos (10%) y aumenta modestamente los niveles de HDL (5-10%).
- Otra incorporación más reciente en el tratamiento de la hipercolesterolemia o enfermedad vascular establecida (cardiopatía isquémica, enfermedad cerebrovascular isquémica y enfermedad arterial periférica) han sido los inhibidores de la PCSK9 evolocumab y alirocumab, dos anticuerpos monoclonales con propiedades hipolipemiantes que actúan mediante su unión a la citada proteína PCSK9 y provocan una reducción de la degradación intracelular de los receptores de c-LDL y, en consecuencia, una reducción marcada de los niveles de c-LDL en sangre. Se emplean fundamentalmente en pacientes que tienen niveles de c-LDL fuera de los objetivos terapéuticos (> 100 mg/dl) a pesar de un tratamiento intensivo con estatinas, o en caso de intolerancia o contraindicación a estatinas. Suelen ser eficaces y seguros en la gran mayoría de pacientes tratados, asociándose a posibles reacciones en el lugar de la inyección subcutánea.
- El fármaco de más reciente introducción ha sido el ácido bempedoico: es un profármaco que, al activarse por unión a la coenzima A, se convierte en un inhibidor de la enzima adenosina trifosfato-citrato liasa (ACL), de forma que reduce la síntesis hepática de colesterol y la concentración plasmática de c-LDL mediante la regulación al alza del número de receptores de LDL en la superficie celular. Aunque cuenta con un buen perfil de seguridad, su eficacia parece modesta, teniendo en cuenta que su adición a un régimen combinado con estatinas y ezetimiba en pacientes de alto riesgo permite reducir hasta un 20% la concentración plasmática de c-LDL, que es insuficiente en la mayor parte de los casos para llevar a estos pacientes al nivel objetivo (Fernández Moriano, 2023).
Acción y mecanismo
Inclisirán es un nuevo ácido ribonucleico pequeño de interferencia (ARNpi) bicatenario que, mediante el mecanismo de interferencia del ARN5 , degrada el ARN mensajero de la proproteína convertasa subtilisina/kexina de tipo 9 (PCSK9) e impide su síntesis proteica. La función de esta proteína madura es esencial en la homeostasis del colesterol al actuar degradando los receptores de las LDL, lo cual impide su metabolismo y resulta en una mayor concentración plasmática de colesterol LDL (c-LDL), aumentando el riesgo de aterosclerosis.
En base a ese mecanismo que impide la acción normal de la PCSK9, inclisirán ha sido autorizado por vía subcutánea en el tratamiento de pacientes adultos con hipercolesterolemia primaria (heterocigótica familiar y no familiar) o dislipidemia mixta, como adyuvante de la dieta: en combinación con una estatina o una estatina y otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar los objetivos de c-LDL con la dosis máxima de una estatina; o administrado solo o en combinación con otros tratamientos hipolipemiantes en pacientes que son intolerantes a las estatinas, o para aquellos para los que las estatinas están contraindicadas.
En estudios preclínicos se pudo evidenciar que la administración subcutánea del fármaco a hembras de un tipo de macaco (Macaca fascicularis) producía una reducción dosis-dependiente de los niveles séricos de PCSK9 de hasta el 85%, acompañada de una reducción de los niveles de c-LDL de hasta el 68% con dosis de 6 mg/kg y 10 mg/kg, produciéndose la concentración mínima aproximadamente en el día 20 post-administración. Los niveles de PCSK9 y c-LDL volvieron a los niveles basales aproximadamente en el día 100 post-administración con la dosis de 6 mg/kg y se mantuvieron por debajo del nivel basal hasta el día 180 con la dosis de 10 mg/kg.
Aspectos moleculares
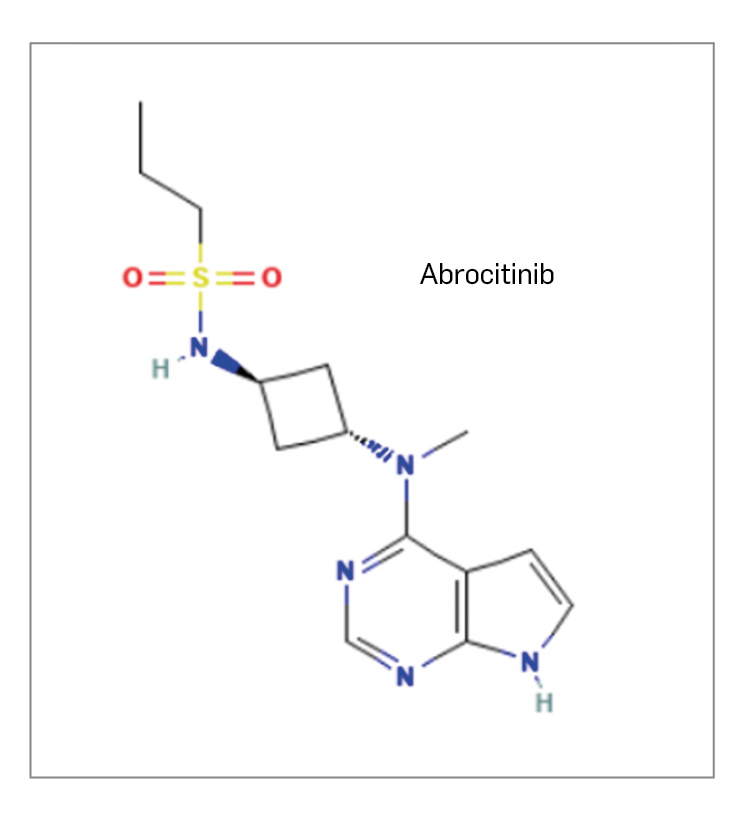
Inclisirán (Figura 3) es un nuevo ARN pequeño de interferencia (ARNpi) compuesto por una hebra sentido de 21 nucleótidos y una hebra antisentido de 23 nucleótidos. En el extremo 3’ de la cadena sentido se encuentra unida de manera covalente una molécula de N-acetilgalactosamina triantenaria que facilita su captación por los hepatocitos.
La fórmula molecular de inclisirán –formulado comercialmente como sal sódica– es C529H664F12N176Na43O316P43S6, y su peso molecular es de 17 285 g/mol. Se presenta en estado puro como un polvo blanco o amarillo pálido higroscópico y con una solubilidad en agua de al menos 300 mg/ml a temperatura ambiente. En cambio, debido a su polaridad, inclisirán es prácticamente insoluble en disolventes orgánicos como el acetonitrilo o el alcohol isopropílico.

Eficacia y seguridad clínicas
La eficacia y la seguridad de inclisirán han sido evaluadas en tres ensayos clínicos pivotales (estudios ORION)6 de fase 3, doblemente ciegos, controlados con placebo y aleatorizados en pacientes con hipercolesterolemia familiar heterocigótica o aterosclerosis con niveles elevados de c-LDL a pesar de recibir las dosis máximas toleradas de terapia hipocolesterolemiante.
Los pacientes incluidos en los estudios pivotales (N= 3660) fueron aleatorizados en cada uno de ellos en proporción 1:1 para recibir placebo o una dosis de 300 mg de inclisirán por vía subcutánea en el día 1, en el día 90 y posteriormente cada 6 meses con el objetivo co-primario de evaluar la respuesta al fármaco en términos del cambio porcentual respecto a la línea de base del nivel de c-LDL hasta el día 510 y el cambio porcentual promedio desde la línea de base en el nivel de c-LDL en el periodo comprendido entre el día 90 y el día 540.
La edad media de los pacientes incluidos en los estudios pivotales se situó entre los 55 y los 66 años, con mayoría de varones (67%). En general, las características demográficas de los pacientes estuvieron equilibradas entre los dos brazos en cada uno de los estudios. Con relación a las características basales de la enfermedad, más del 90% de los participantes se encontraba en tratamiento con al menos un fármaco hipolipemiante al inicio de los estudios, mayoritariamente con, al menos, estatinas en dosis elevadas, aunque una proporción no desdeñable de pacientes del 22-25% en dos de los tres estudios, era parcial o totalmente intolerante –mayoritariamente por dolores musculares– a las estatinas7.
De acuerdo a los resultados publicados de los tres estudios, en todos ellos el tratamiento con inclisirán se asoció con una reducción estadísticamente significativa de los niveles de c-LDL en comparación con la administración de placebo (Tabla 2).
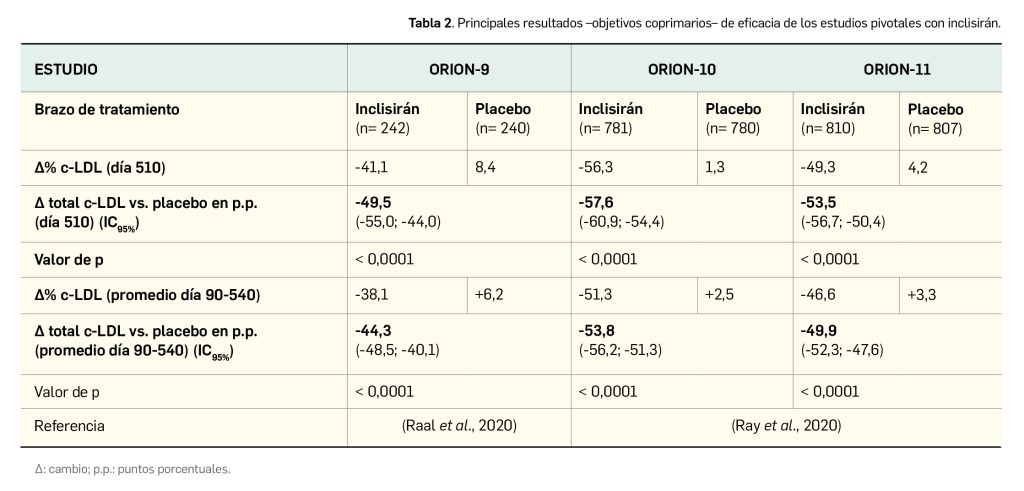
El cambio absoluto frente a placebo en la concentración de c-LDL hasta el día 510 fue uno de los principales objetivos secundarios. Sus hallazgos respaldan a las variables coprimarias, pues en todos los estudios se obtuvieron diferencias estadísticamente significativas a favor de inclisirán: -68,9 mg/dl en ORION-9 (p< 0,0001), -54,1 mg/dl en ORION-10 (p< 0,0001) y -51,9 mg/dl en ORION-11 (p< 0,0001). También se analizó como variable secundaria el cambio en los niveles proteicos de PCSK9 hasta el día 510, con una reducción de entre el 78,3% y el 83,3% en los estudios (p< 0,0001) frente a placebo respecto al nivel basal.
De cara al análisis de la seguridad de inclisirán se dispone fundamentalmente de los datos agrupados de 3655 pacientes, de los cuales 1833 recibieron al menos una dosis de inclisirán y 1822 recibieron placebo; el 91% de los pacientes recibieron las 4 dosis programadas del fármaco o del placebo. La frecuencia de pacientes con al menos un evento adverso fue similar en el brazo de inclisirán (78,0) y de placebo (77,3%), así como la de pacientes con al menos un evento adverso grave (23,0% vs 20,4%, respectivamente). Se reportaron 54 fallecimientos durante el desarrollo de los estudios pivotales, distribuidos con igual frecuencia entre los grupos de placebo e inclisirán.
Los eventos adversos más comunes (diabetes mellitus –11%–, nasofaringitis –7,5%–, infecciones del tracto respiratorio superior –5,7%– e hipertensión –5,7%–) presentaron una incidencia similar en ambos brazos de tratamiento.
Los considerados como relacionados con el tratamiento fueron algo más comunes con inclisirán (15,6%) que con placebo (9,7%), si bien esta diferencia se explica fundamentalmente debido a las reacciones en el lugar de inyección. En todo caso, no se observaron reacciones alérgicas sistémicas o de hipersensibilidad asociadas a la administración de inclisirán y la inmunogenicidad del fármaco no parece preocupante: la presencia de anticuerpos anti-inclisirán se produjo con una baja frecuencia y con bajos títulos de anticuerpos, sin que se haya podido asociar con un diferente perfil de eficacia o seguridad.
Aspectos innovadores
Inclisirán es un nuevo ácido ribonucleico pequeño de interferencia (ARNpi) bicatenario que, mediante el mecanismo de interferencia del ARN, degrada el ARN mensajero de la proproteína convertasa subtilisina/kexina de tipo 9 (PCSK9). De esta manera inhibe la producción de esta enzima, la cual actuaría degradando los receptores de las LDL, impidiendo así su metabolismo y, en consecuencia, dando lugar a mayores niveles plasmáticos de colesterol LDL (c-LDL) y a un mayor riesgo de aterosclerosis. En base a esta acción farmacológica opuesta a la de la PCSK9, inclisirán ha sido autorizado con indicación en el tratamiento de pacientes adultos con hipercolesterolemia primaria (heterocigótica familiar y no familiar) o dislipidemia mixta, como adyuvante de la dieta: en combinación con una estatina o una estatina y otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar los objetivos de c-LDL con la dosis máxima de una estatina; también se puede administrar solo o en combinación con otros tratamientos hipolipemiantes en pacientes que son intolerantes a las estatinas, o las tienen contraindicadas.
La eficacia clínica de inclisirán por vía subcutánea ha sido adecuadamente constrastada en tres ensayos de fase 3 y similar diseño –doble ciego, controlados por placebo y aleatorizados– con el objetivo principal de evaluar el efecto del fármaco sobre la reducción de c-LDL, en términos del cambio porcentual del nivel de c-LDL hasta el día 510 respecto a la línea de base y el cambio porcentual promedio del nivel de c-LDL desde la línea de base en el periodo comprendido entre el día 90 y el día 540. Se trata, por tanto, de dos variables comprimarias subrogadas consideradas aceptables en base a las pruebas disponibles de la relación inversa entre los niveles de c-LDL y el riesgo cardiovascular.
En los tres estudios pivotales, inclisirán produjo una reducción notable y estadísticamente significativa en comparación con placebo de los niveles de c-LDL tanto hasta el día 510 respecto al nivel basal (de entre -49,5 p.p. y -57,6 p.p.; p< 0,0001), como en el promedio entre los días 90 y 540 respecto al nivel basal (entre -44,3 p.p. y -53,8 p.p.; p< 0,0001). Estos resultados se ven apoyados por la reducción de otros parámetros del perfil lipídico, como el nivel de PCSK9 (de alrededor del 80% respecto a placebo) o en la concentración plasmática de colesterol (entre -52 mg/dl y -69 mg/dl en comparación con placebo desde el nivel basal).
A falta de datos respecto a la capacidad de inclisirán de reducir el riesgo de eventos cardiovasculares, que son los de mayor relevancia clínica y provendrán de estudios clínicos aún en marcha cuyo objetivo es evaluar la morbimortalidad cardiovascular como variable principal, la reducción del nivel de c-LDL obtenida en los estudios pivotales se puede considerar relevante. Sin embargo, las comparaciones indirectas con los inhibidores de PCSK9 (alirocumab y evolocumab), con indicación similar a la autorizada para inclisirán, además de presentar una limitada robustez estadística se ven dificultadas por el diferente diseño de los estudios, por ejemplo con un mayor intervalo de tiempo hasta el análisis de la variable principal en los ensayos con inclisirán. No obstante, en una revisión sistemática y metaanálisis que incluyó datos derivados de 54 estudios clínicos con más de 87 000 participantes, se observó una reducción mediana comparable de los niveles de c-LDL entre los inhibidores de PCSK9 e inclisirán vs. placebo (superior al 40% en la semana 24), si bien para alirocumab y evolocumab ya se dispone de evidencia clínica que respalda una capacidad de prevención de eventos adversos mayores cardiovasculares y de reducción de la mortalidad por cualquier causa (Imran et al., 2023).
La mayor amplitud temporal para el análisis de la eficacia se justifica en la posología de inclisirán, administrado en una dosis inicial, seguida de una dosis a los 90 días y, posteriormente, de una dosis cada 6 meses. Evolocumab, en cambio, se administra con una dosis de 140 mg por vía subcutánea cada 2 semanas o una dosis de 420 mg una vez al mes, y alirocumab se administra con una dosis de 75 mg (o 150 mg en caso de que la dosis inferior sea insuficiente) por vía subcutánea cada 2 semanas o de 300 mg una vez al mes. En este sentido, se puede considerar a inclisirán superior en términos de conveniencia a los dos inhibidores de PCSK9 disponibles.
Los resultados disponibles relativos al perfil de seguridad de inclisirán no han revelado aspectos de especial preocupación. De acuerdo a un análisis agrupado de los tres estudios pivotales, los únicos eventos adversos que presentaron una frecuencia claramente superior en los grupos de inclisirán, respecto a placebo fueron las reacciones en el lugar de administración (tales como eritema, dolor o inflamación) y fueron por lo general leves o –menos frecuentemente– moderados en intensidad y transitorias, sin detectarse casos de hipersensibilidad grave o de reacciones alérgicas sistémicas. Los eventos adversos más frecuentes fueron, en todo caso, diabetes mellitus, nasofaringitis, infecciones del tracto respiratorio superior e hipertensión. Este perfil de seguridad benigno está en línea con el conocido para los inhibidores de PCSK9.
En definitiva, inclisirán es el primer ARNpi dirigido a la PCSK9 e inicia, por tanto, una interesante vía en el tratamiento de la hipercolesterolemia y de la aterosclerosis, trastornos que actualmente representan un importante problema de salud pública, con una creciente relevancia. Los resultados de eficacia con inclisirán son indicativos de un importante efecto en la reducción del nivel de c-LDL, aunque la correlación de este efecto con la prevención del riesgo cardiovascular –confirmada para otros tratamientos hipolipemiantes– es todavía un elemento de incertidumbre para el nuevo fármaco. Con un perfil de seguridad aparentemente benigno, en el que por ahora no destaca ninguna señal preocupante, inclisirán se posiciona como una opción que se usará principalmente en adición a un régimen combinado con al menos una estatina en dosis altas, salvo contraindicación de ésta, constituyendo una alternativa al uso de los inhibidores de PCSK9. Es decir, se limitará por ahora a una segunda línea de tratamiento, para pacientes que no puedan usar o no respondan al tratamiento con estatinas, si bien su pauta –inyecciones subcutáneas cada 6 meses en tratamiento de mantenimiento– puede beneficiar en gran medida el cumplimiento terapéutico.