La evaluación económica de las intervenciones sanitarias se ha convertido en una herramienta imprescindible para la toma de decisiones, ya que permite priorizar políticas sanitarias, de manera eficiente. En este sentido, existe un interés creciente en la incorporación de costes no sanitarios, como aquellos generados por la atención informal o la pérdida de productividad laboral, ya que han demostrado tener un impacto relevante en la relación coste-efectividad incremental (RCEI). Por tanto, el no considerarlos, podría llevar a subestimar el beneficio real de las intervenciones, fundamentalmente, en aquellas personas que padecen una enfermedad que les genera limitaciones para realizar sus actividades de la vida diaria, como es la enfermedad de Alzheimer (EA). Sin embargo, en las guías metodológicas de evaluación económica de tecnologías sanitarias no existe un consenso amplio sobre el tipo de perspectiva que debería utilizarse en las evaluaciones económicas y, en consecuencia, en los tipos de costes a considerar.
Las pérdidas de bienestar causadas por la EA no se limitan, exclusivamente a los pacientes, sino también afectan a sus cuidadores, que soportan cargas importantes sobre su salud, su situación laboral y sus relaciones sociales y familiares. En esta línea, Peña-Longobardo et al. realizaron una revisión sistemática con el fin de analizar cómo afecta la inclusión o no de los costes sociales en los resultados de las evaluaciones económicas en EA durante las últimas 2 décadas.
Para ello, elaboraron una estrategia de búsqueda en PubMed y, además, emplearon el Registro de Análisis de Coste-Efectividad (ACE) de la Universidad de Tufts. En las estrategias se emplearon los siguientes términos: (“costs” AND “cost analysis” OR “cost–effectiveness” OR “cost–utility” OR “cost–benefit” OR “economic evaluation” OR “economic analysis” OR “QALY” OR “quality-adjusted life years”) AND (“Alzheimer Disease” OR “Alzheimer`s disease” OR “dementia”). Finalmente, se incluyeron los estudios económicos publicados entre el año 2000 hasta noviembre de 2018, escritos en inglés, que estimaban costes de atención informal o la pérdida de productividad laboral, además de los costes sanitarios, cuyos resultados de salud reportados fueran en años de vida ajustados por calidad (AVAC) y que proporcionasen por separado los resultados del análisis coste-utilidad, según la perspectiva aplicada (pagador o social).
La perspectiva del pagador incluía solamente los costes sanitarios, tales como los derivados de consultas, medicación, seguimiento del paciente, ingresos, urgencias, pruebas de imagen o laboratorio, estancias en diferentes centros o residencias y los servicios sociales o ayudas comunitarias. Por otro lado, la perspectiva social incluyó los costes no sanitarios con mayor impacto económico, así como el tiempo de cuidado informal y/o la pérdida de productividad del paciente debido a la enfermedad, evaluados a través de diferentes métodos como coste de oportunidad o coste por reemplazo.
Finalmente, se incluyeron 27 publicaciones con resultados en AVAC (Tabla 2), en el que se analizaron 55 intervenciones con evaluaciones completas; y cuyos resultados estaban desagregados para ambas perspectivas. Además, tres de ellas incluyeron también un análisis coste-efectividad (ACE).
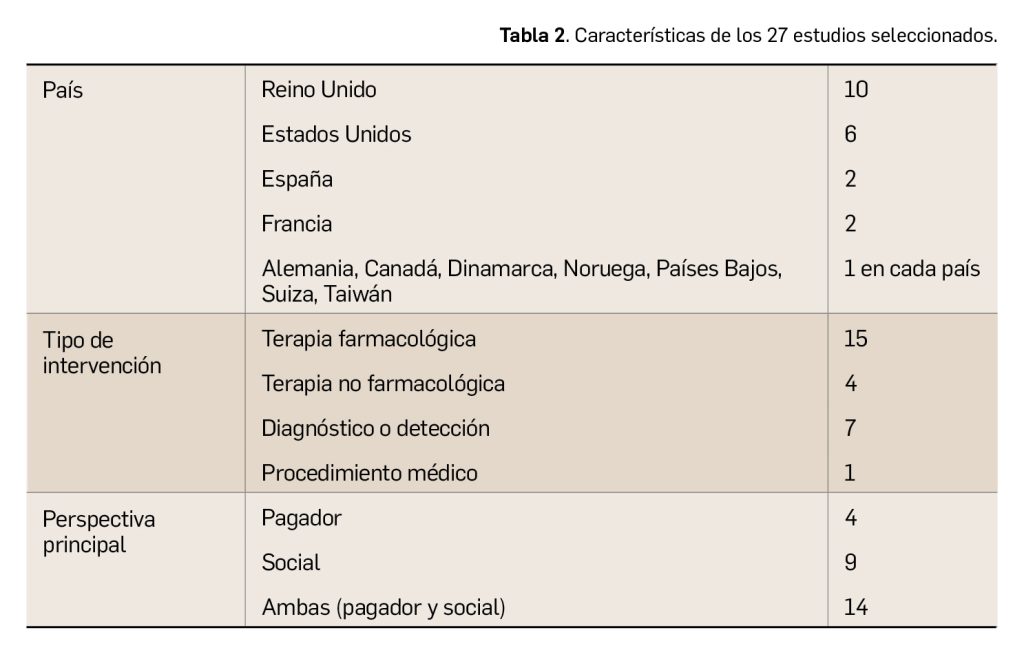
El horizonte temporal y las tasas de descuento aplicadas variaron ampliamente entre los estudios. El análisis de sensibilidad más común fue el análisis de sensibilidad determinístico (ASD) univariante.
Para el análisis desde la perspectiva social, solamente un estudio consideró la pérdida de productividad laboral y 20 estudios incluyeron los costes derivados de los cuidados informales (12 empleando el método de coste de oportunidad, 2 por el coste de reemplazo y 4 emplearon ambos métodos).
En un 11% de las evaluaciones económicas analizadas desde la perspectiva del pagador, los resultados del RCEI cambiaron cuando se incluyó la perspectiva social. En 3 de las evaluaciones, se observó que la nueva intervención era coste-efectiva cuando se consideró la perspectiva social, al contrario de lo que ocurrió cuando se empleó únicamente la perspectiva del pagador de salud. Sin embargo, en 3 evaluaciones económicas se observó el patrón opuesto, produciendo un ahorro de los costes desde la perspectiva de los pagadores de salud, pero aumentando el coste al analizar la intervención desde la perspectiva social.
Comentario
Tal y como han evidenciado los autores de este trabajo, es importante analizar los costes sociales de las enfermedades crónicas o discapacitantes, como la EA. La inclusión de estos costes ya sea como perspectiva principal o a modo de análisis de sensibilidad, brindaría información más amplia para ayudar a la toma de decisiones (por ejemplo, cuando la intervención evaluada supone un alto impacto fuera del ámbito sanitario). Sin embargo, cabe señalar que, en ocasiones, la inclusión de esta perspectiva no siempre beneficia a la nueva intervención, ya sea porque puede requerir de un mayor compromiso de cuidados informales, o porque los costes analizados no incluyan todas las variables significativas, como puede ser el impacto en la calidad de vida del cuidador.
En este sentido, teniendo en cuenta que los sistemas para la atención de pacientes crónicos están evolucionando hacia un modelo mixto, donde la responsabilidad del cuidado del paciente recae tanto en la familia como en la asistencia pública proporcionada por el Estado; no es razonable que se ignoren estos recursos. Por estas razones, la inclusión en las evaluaciones económicas de variables que permitan analizar los cambios en la salud de los cuidadores informales, e identificar los efectos indirectos de estos programas, son aspectos de mejora metodológica que deben considerarse en estudios futuros.