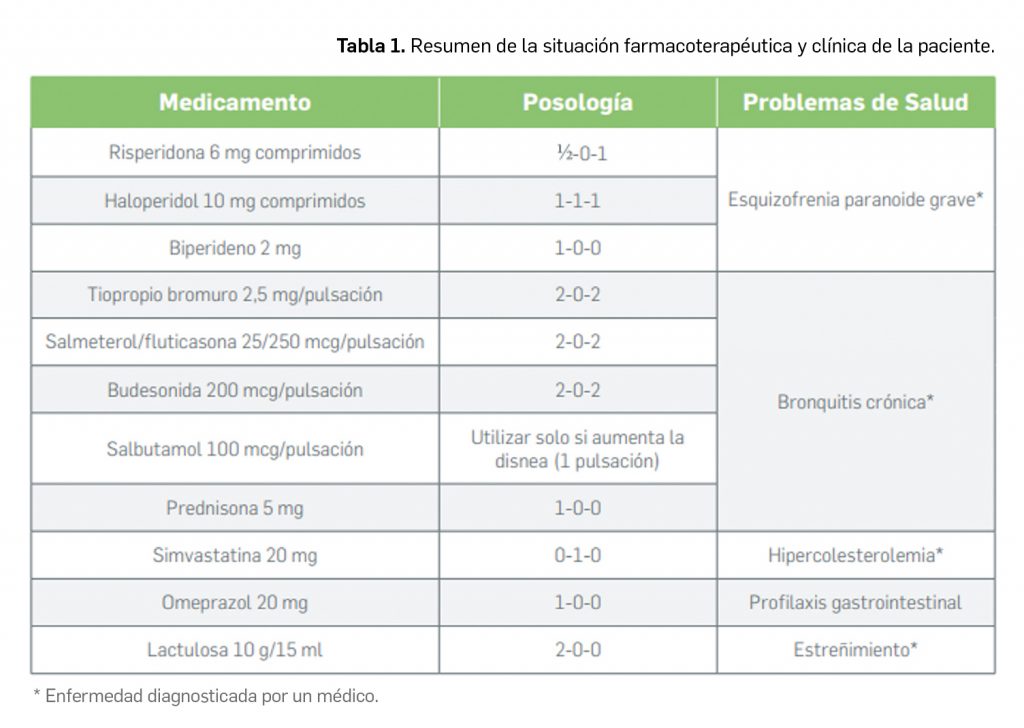
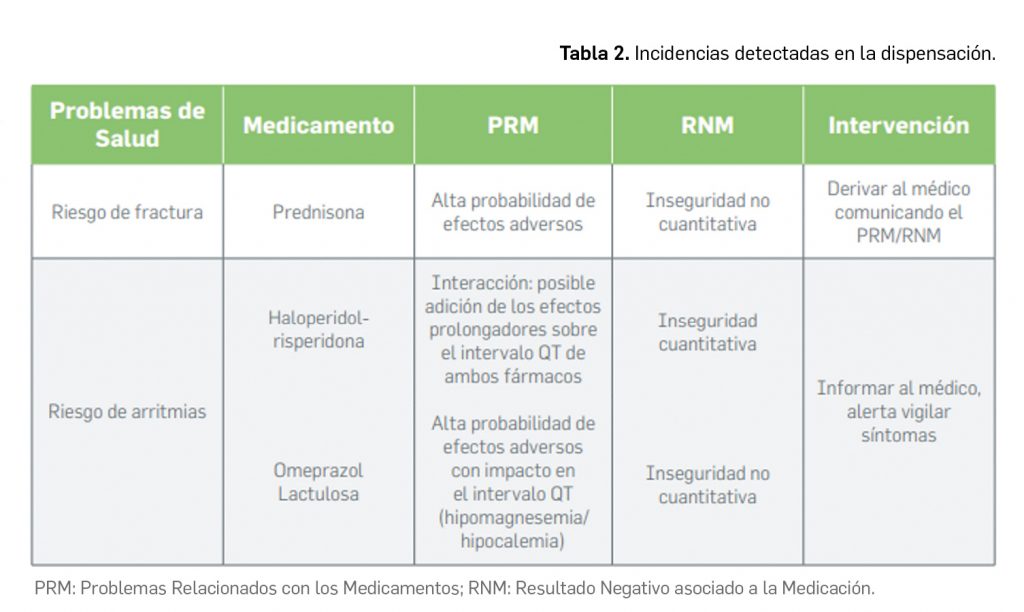
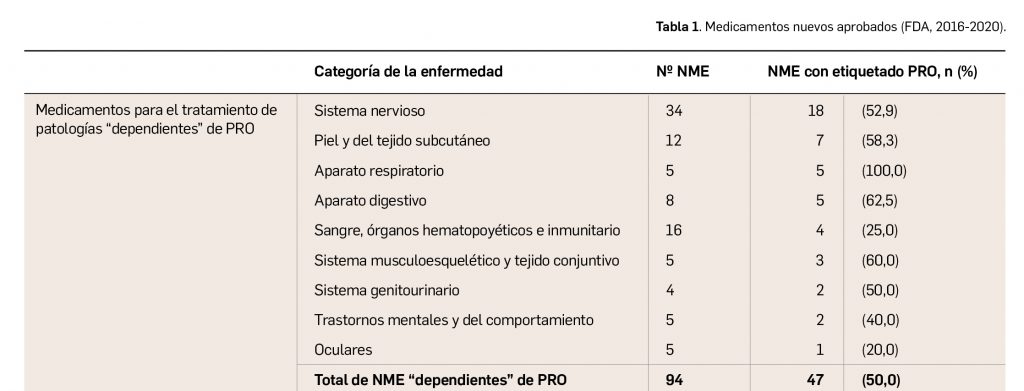
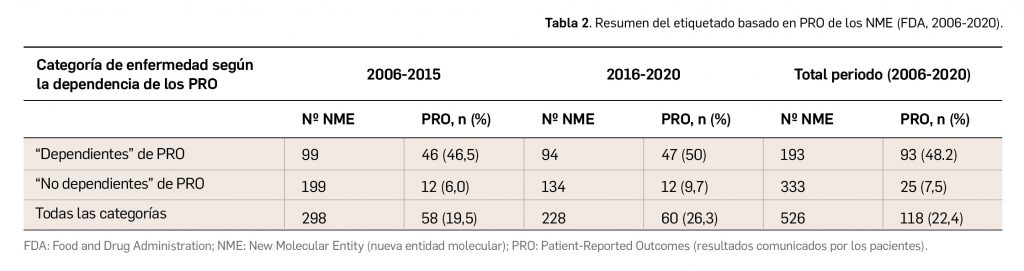
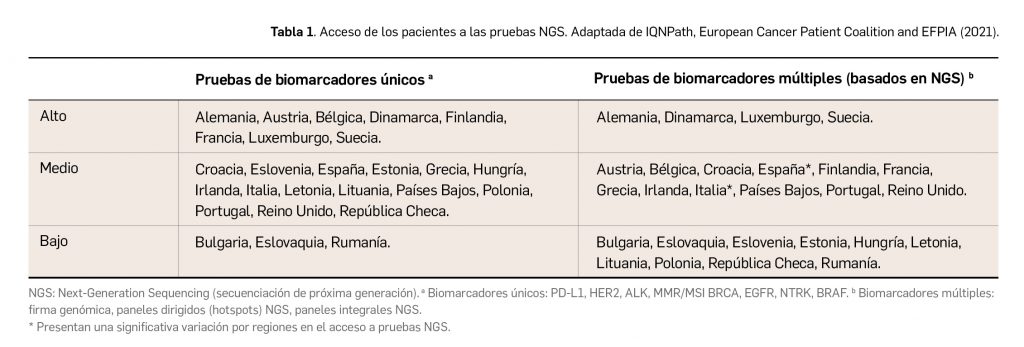
En las reuniones mensuales del PRAC –Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia– se deciden cambios en la información autorizada de las fichas técnicas y de los prospectos de los medicamentos europeos por motivos de seguridad. Una vez que se revisan y evalúan los datos de los informes periódicos de seguridad (IPS, en inglés PSUR) de forma colaboradora entre todas las 27 agencias nacionales, el Estado miembro principal que realiza la evaluación única de los IPS, o PSUSA (Periodic Safety Update report Single Assessments), propone los cambios que, en su caso, se aprueban en las reuniones mensuales del PRAC. Cuando afectan a medicamentos de registros nacionales se validan por el CMDh (Coordination Group for Mutual Recognition and Decentralised Procedures – Human), de la red de Jefes de todas las Agencias de Medicamentos (HMA, Heads of Medicines Agencies) en sus reuniones mensuales, durante 3 días. Se cierra así un procedimiento único, complejo y colaborativo de las 27 agencias nacionales de medicamentos de la UE.
El Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha acordado cambios en las fichas técnicas y los prospectos de los siguientes medicamentos, siendo los más importantes los que se describen en la Tabla 1, según informa la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en sus Boletines mensuales de Seguridad de Medicamentos de Uso humano del mes de noviembre y de diciembre de 2022 (AEMPS, 2022a; AEMPS, 2022b).
Las fichas técnicas y prospectos de los medicamentos pueden consultarse en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos.

Esta información que se incorpora a las fichas técnicas y prospectos de los medicamentos, supone una actualización permanente, por lo que es necesario consultar sus datos y la fecha de la actualización, al final del texto de las fichas técnicas y prospectos, cuando se consultan en la web de la AEMPS (sección CIMA: Centro de Información Online de Medicamentos).