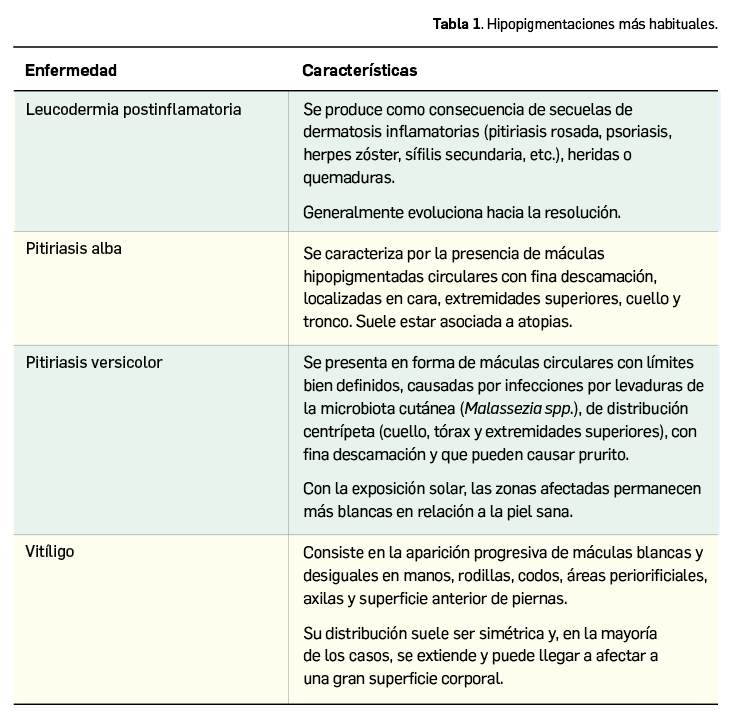
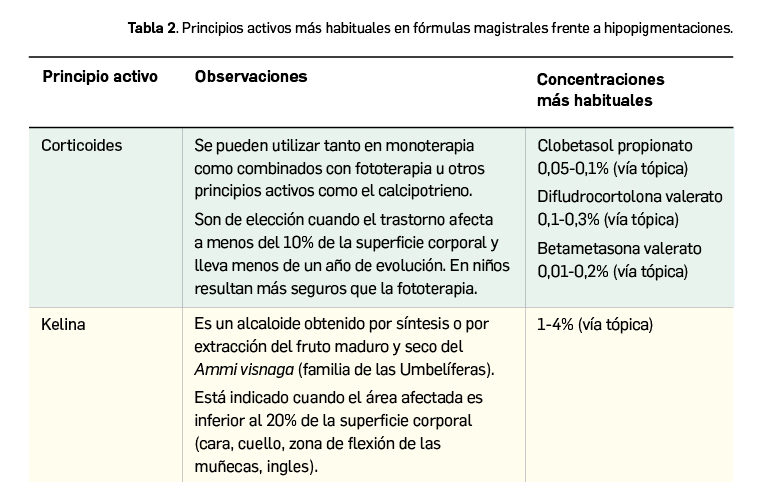
La agencia de medicamentos de Irlanda (HPRA) ha informado de las restricciones en las indicaciones terapéuticas del medicamento con rucaparib (▼Rubraca®). A la vista de los datos actuales, la relación beneficio/riesgo de rucaparib ya no puede considerarse favorable en la indicación de tratamiento de tercera línea. Solo sigue autorizado como monoterapia para el tratamiento de mantenimiento de pacientes adultos con cáncer de ovario epitelial de alto grado, de trompas de Falopio o peritoneal primario sensible al platino en recaída que responden (completa o parcialmente) a la quimioterapia basada en platino.
La agencia reguladora de medicamentos irlandesa, Health Products Regulatory Authority (HPRA), ha informado (HPRA, 2022) sobre las restricciones en las indicaciones del medicamento ▼Rubraca®, con rucaparib, un inhibidor de las enzimas poli-(ADP-ribosa)-polimerasa (PARP), como PARP-1, PARP-2 y PARP-3, que desempeñan un papel en la reparación del ADN.
Las nuevas restricciones se pueden resumir así:
- Este medicamento ya no se debe usar como tratamiento de monoterapia en pacientes adultos con cáncer de ovario epitelial de alto grado, de trompas de Falopio o peritoneal primario sensible al platino, en recaída o progresivo, mutado en BRCA (línea germinal y/o somático), que hayan sido tratados con dos o más líneas previas de quimioterapia basada en platino, y que no pueden tolerar más quimioterapia basada en platino.
- Se ha observado un efecto perjudicial de rucaparib en la supervivencia general (SG) en comparación con el control de quimioterapia en el análisis final de los datos del estudio de fase 3 CO-338-043 (ARIEL4) para el tratamiento de pacientes con cáncer de ovario avanzado y recurrente. (HR = 1,31 [IC 95%: 1,00, 1,73]).
- Se debe reconsiderar el tratamiento en curso en este entorno y se debe informar a los pacientes sobre los últimos datos y recomendaciones.
- ▼Rubraca® sigue autorizado como monoterapia para el tratamiento de mantenimiento de pacientes adultos con cáncer de ovario epitelial de alto grado, de trompas de Falopio o peritoneal primario sensible al platino en recaída que responden (completa o parcialmente) a la quimioterapia basada en platino.
Según los resultados de la tasa de respuesta general (ORR, por sus siglas en inglés) de una población combinada de dos estudios de fase 2 de un solo brazo (CO-338-010 y CO-338-017), rucaparib recibió una autorización de comercialización condicional (CMA) en mayo de 2018 para las siguientes indicaciones: “Tratamiento en monoterapia de pacientes adultos con mutación BRCA (germinal y/o somática) sensible al platino, recidivante o progresiva, cáncer epitelial de ovario, trompa de Falopio o peritoneal primario, que han sido tratados con dos o más líneas previas de quimioterapia basada en platino, y que no pueden tolerar más quimioterapia basada en platino”.
Esta autorización condicional estaba sujeta a la confirmación de la eficacia y seguridad de rucaparib en el estudio CO338-043 (ARIEL4); un estudio de fase 3, multicéntrico, abierto, aleatorizado (2:1) de rucaparib 600 mg dos veces al día (N=233) versus quimioterapia (N=116) en pacientes con cáncer de ovario epitelial de tubo, o cáncer peritoneal primario, que recibieron dos o más líneas previas de quimioterapia. Los pacientes incluidos en el estudio se estratificaron en el momento de la aleatorización según la sensibilidad al platino (totalmente sensibles al platino frente a parcialmente sensibles al platino frente a resistentes al platino). Además, los pacientes inicialmente aleatorizados a quimioterapia tenían la opción de pasar al tratamiento con rucaparib después de la progresión de la enfermedad; en el análisis de SG final, el 69 % de los pacientes (n=80/116) del grupo de control habían recibido tratamiento posterior con rucaparib.
En la población ITT (Intention-to-treat) del estudio ARIEL4, se observó una diferencia a favor de rucaparib para el criterio principal de valoración de supervivencia libre de progresión por parte del investigador (invPFS), con una mediana informada de invPFS de 7,4 meses para el grupo de rucaparib en comparación con 5,7 meses para el grupo de quimioterapia (HR= 0,665; IC95% 0,52-0,86; p=0,0017). Sin embargo, en el análisis final del criterio de valoración secundario de SG, se observó un efecto perjudicial para los pacientes aleatorizados a rucaparib. La mediana de SG fue de 19,4 meses en el grupo de rucaparib en comparación con 25,4 meses en el grupo de quimioterapia, lo que resultó en un HR de 1,31 (IC95% 1,00-1,73; p= 0,0507). Los HR para la SG en los subgrupos de totalmente sensible al platino, parcialmente sensible al platino y resistente al platino fueron 1,24 (IC95% 0,62-2,50; p= 0,5405), 0,97 (IC95% 0,58-1,62; p= 0,9129) y 1,51 (IC95% 1,05-2,17; p= 0,0251) respectivamente.
Se reconoce que, en el contexto de la indicación de tratamiento aprobada, el subgrupo de pacientes sensibles al platino (particularmente aquellos parcialmente sensibles) representa la población más relevante. Aunque no se observaron diferencias estadísticamente significativas en la SG (HR= 1,07; IC95% 0,71-1,62; p= 0,5405) en este subgrupo de pacientes (combinados) sensibles al platino, no se consideraron los resultados tranquilizadores.
Recomendaciones
A la vista de los datos anteriores, la relación beneficio/riesgo de rucaparib ya no puede considerarse favorable en la indicación de tratamiento de tercera línea.
Rucaparib (▼Rubraca®) sigue autorizado como monoterapia para el tratamiento de mantenimiento de pacientes adultos con cáncer epitelial de ovario, de trompas de Falopio o peritoneal primario de alto grado en recaída sensible al platino que respondes (completa o parcial) a la quimioterapia basada en platino.