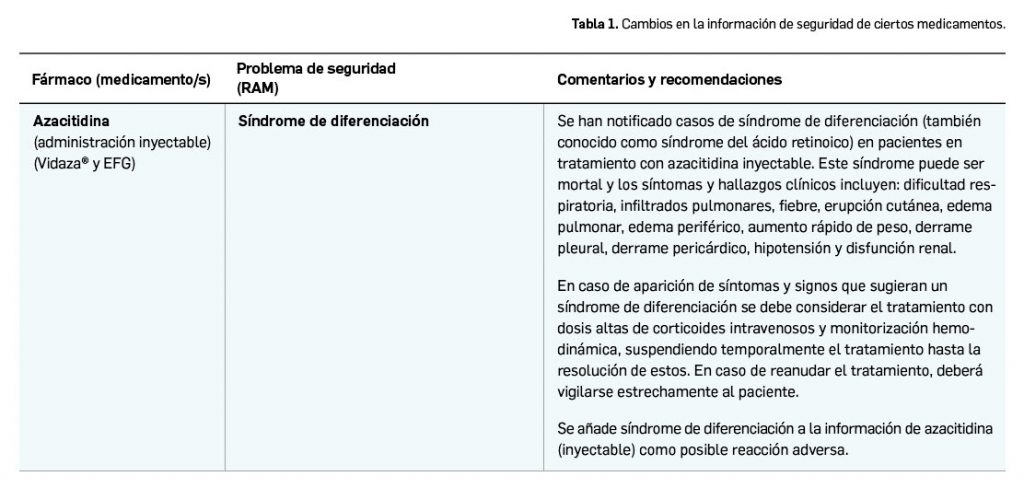
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado que, tras la evaluación de los datos más recientes de utilización delos medicamentos que contienen hidroxietil-almidón en diversos países europeos, se ha concluido que siguen utilizándose en grupos de pacientes en los que el riesgo supera su beneficio. Por ellos, el PRAC ha recomendado la suspensión de la autorización de comercialización de los medicamentos con hidroxietil-almidón en la UE. Esta recomendación deberá ser ratificada por el Grupo Europeo de Coordinación (CMDh) del que forman parte todas las agencias de medicamentos de la UE pacientes en los que el riesgo supera su beneficio. Por ello, y, en su caso, por la Comisión Europea.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha remitido información mediante nota informativa (AEMPS, 2022) de los resultados de la evaluación continua que se lleva a cabo en el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC, por sus siglas en inglés).
Hidroxietil-almidón o HEA (Isohes®, Volulyte®, Voluven®) es un expansor plasmático coloidal, autorizado para el tratamiento de la hipovolemia causada por hemorragia aguda cuando el tratamiento solo con cristaloides no se considere suficiente.
La AEMPS ha venido informando sobre las conclusiones de las revisiones europeas del balance beneficio/riesgo del uso de HEA. En 2013 ya se introdujeron restricciones en sus condiciones de uso autorizadas, debido al incremento de riesgo de insuficiencia renal y de mortalidad en determinados pacientes [veánse las notas de seguridad MUH (FV) 18/2013 y MUH (FV) 29/2013)]. Posteriormente, en 2018 ] notas de seguridad MUH (FV) 1/2018 y MUH (FV) 12/2018)], como resultado de una nueva revisión, el uso de soluciones de HEA se restringió a aquellos hospitales y centros sanitarios validados según un programa de acceso controlado [nota de seguridad MUH (FV) 4/2019].
Más tarde se incorporaron otras advertencias en la información de estos medicamentos para recordar a los profesionales sanitarios que no deben utilizarse en pacientes en estado crítico, con sepsis o en pacientes con daño renal. Adicionalmente, se estableció que los titulares de las autorizaciones de comercialización (TAC) de las so- luciones de HEA realizaran un estudio para evaluar su uso y, sobre todo, el cumplimiento de las condiciones de uso autorizadas.
El PRAC ha revisado ahora los resultados de dicho estudio, que ha sido realizado en varios países europeos. Los resultados muestran que las soluciones de HEA tienen un uso relevante en situaciones en las que su administración está contraindicada. En base a ello, el Comité ha concluido que las restricciones introducidas en 2018 no han garantizado suficientemente que estos medicamentos se utilicen de forma segura y que se siguen utilizando en determinados grupos de pacientes en los que se ha demostrado un daño grave.
Teniendo en cuenta que el cumplimiento del conjunto de medidas acordadas en 2018 era una condición para el uso seguro de las soluciones de HEA, y que los resultados del estudio muestran que esto no ha sucedido, ya no se considera que los beneficios de estos medicamentos superen sus riesgos, por lo que se ha recomendado la suspensión de la autorización de comercialización en la UE.
El PRAC ha valorado de nuevo posibles medidas adicionales de minimización de riesgos, pero ha concluido que no hay otras medidas viables que se puedan considerar suficientes para proteger a los pacientes. La recomendación del PRAC se hizo llegar al Grupo Europeo de Coordinación para el Reconocimiento Mutuo y Procedimientos Descentralizados (CMDh) para su ratificación en su reunión de febrero de 2022.
Recomendaciones para profesionales sanitarios
Hasta que la decisión del PRAC sea ratificada, la AEMPS recomienda a los profesionales sanitarios seguir estrictamente las condiciones de uso autorizadas para las soluciones de HEA, recogidas en sus fichas técnicas, en particular, las siguientes:
- No utilizar soluciones de HEA en pacientes con sepsis, en estado crítico, quemados o con insuficiencia renal, por un mayor riesgo de insuficiencia renal grave y de mayor mortalidad.
- ⦁Usar las soluciones de HEA solo en caso de hipovolemia debida a hemorragia aguda, siempre que no se considere suficiente el tratamiento exclusivo con soluciones de cristaloides, utilizando la menor dosis eficaz posible (< 30 ml/kg/día), durante un máximo de 24 h y vigilando la función renal durante al menos 90 días.
Información para los pacientes
- Las soluciones de HEA son sustitutos del volumen plasmático que se administran a pacientes que han perdido sangre después de una lesión o cirugía.
- El PRAC ha recomendado que estos medicamentos se retiren del mercado de la UE a la vista de los graves riesgos de daño renal y muerte en ciertos pacientes (por ejemplo, aquellos que están muy enfermos o que tienen una infección grave generalizada o daño renal), y a la falta de medidas que puedan prevenir adecuadamente estos riesgos.
- Existen disponibles otras opciones de tratamiento similares.