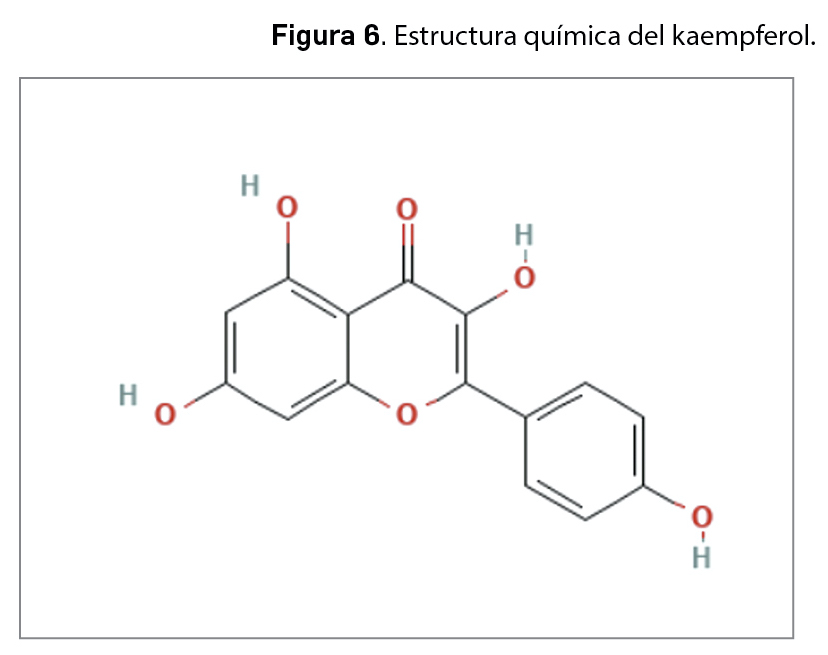
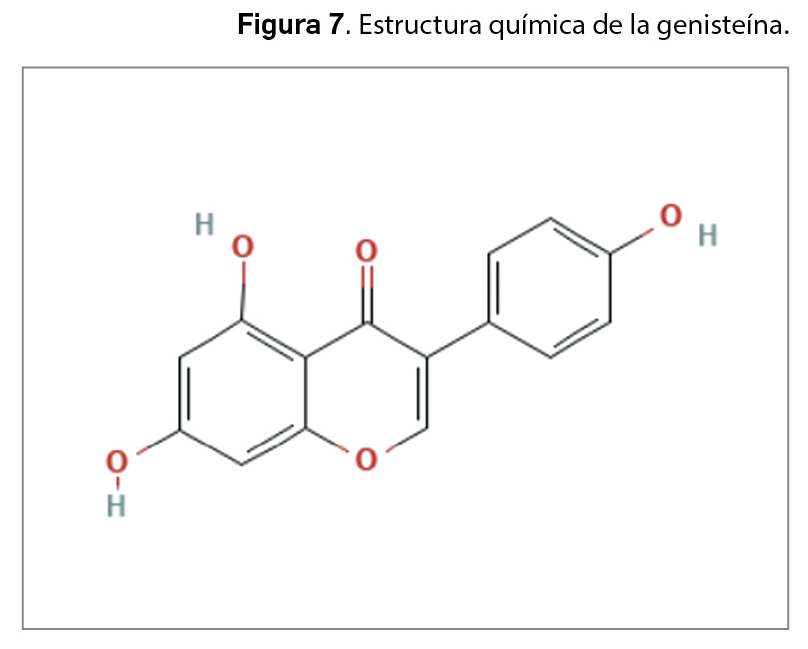
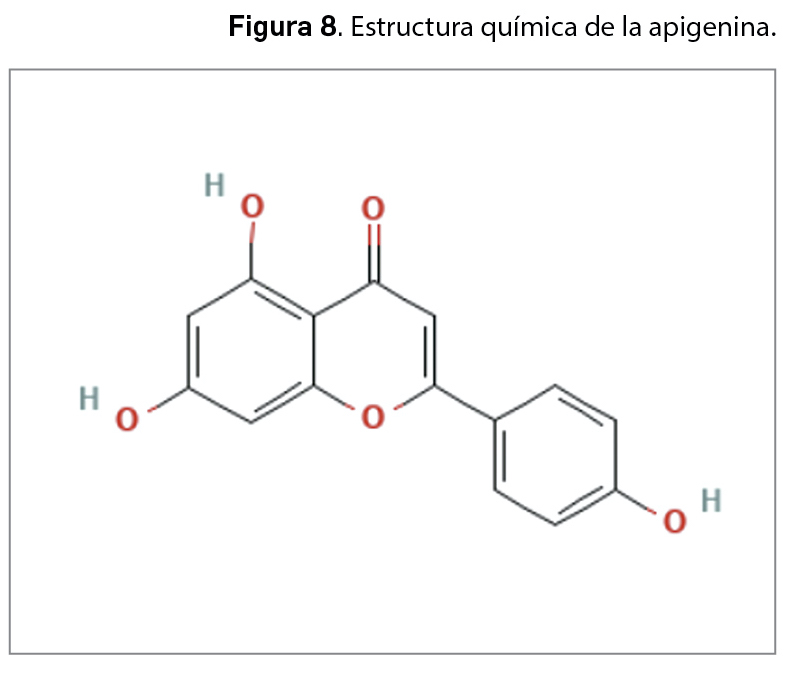
La resistencia a los antimicrobianos (en adelante, RAM) provocada por el aumento del consumo y una inadecuada utilización de los agentes antiinfecciosos es una de las 10 amenazas para la salud identificadas por la Organización Mundial de la Salud (OMS). En 2019, las infecciones producidas por bacterias resistentes a antibióticos causaron aproximadamente 4,95 millones de muertes, de las que 1,27 millones estuvieron directamente relacionadas con RAM. Se estima que en 2050 esta cifra podría aumentar a los 10 millones de muertes, superando al cáncer como primera causa de mortalidad entre la población.
El coste sanitario relacionado con las RAM, que representa tan solo una parte del coste total, es elevado y está relacionado fundamentalmente con la evolución de las enfermedades, lo que produce estancias hospitalarias más prolongadas, una mayor utilización de medicamentos y un incremento en la realización de pruebas. Al coste sanitario también hay que sumarle los costes relacionados con la pérdida de productividad, debido a la discapacidad producida como consecuencia de la RAM.
Las vacunas pueden ser una poderosa herramienta en la lucha contra la RAM. El desarrollo de nuevas vacunas dirigidas contra agentes resistentes a los antimicrobianos se considera una estrategia idónea de prevención. La prevalencia de muchas enfermedades infecciosas se ha reducido gracias a la vacunación, lo que ha provocado, al mismo tiempo, una disminución de la utilización de antimicrobianos, obstaculizando el desarrollo y propagación de cepas resistentes. Sin embargo, a pesar de esta evidencia, en las evaluaciones económicas no se suele incluir el valor que aportan las vacunas en la lucha contra las RAM, lo que podría obstaculizar su utilización debido a una subestimación de su eficiencia.
Una revisión sistemática llevada cabo en Pubmed localizó la evidencia disponible de estudios que informaran sobre estimaciones económicas, utilización de recursos o análisis coste-efectividad en el contexto de la RAM de vacunas que estuvieran en desarrollo o comercializadas a 1 de junio de 2022. Se obtuvieron 184 posibles registros para su selección. Finalmente, de estos 184 tan solo 2 estudios (realizados en Etiopía y China) fueron seleccionados para su revisión. En ellos se estimaban los costes relacionados con la RAM evitados por la vacuna antineumocócica. Así, los dos estudios modelizaron el cambio de la RAM a través de las diferentes probabilidades de supervivencia de las cepas resistentes y susceptibles bajo la exposición a los antibióticos, con diferentes concentraciones inhibitorias mínimas (CIM) para los distintos agentes bacterianos. Se consideraron costes directos sanitarios y no sanitarios, pérdida de productividad de los cuidadores y pérdida de productividad por muerte y discapacidad.
El primero de los estudios llevado a cabo en Etiopía estimó que la vacunación antineumocócica había supuesto un ahorro de 32,7 millones de dólares entre 2011-2017, al evitar fracasos de tratamiento y muertes relacionadas con la RAM. Con una cobertura del 68 %, la vacunación supondría un ahorro anual de 7,67 millones de dólares en un periodo de 5 años y un ahorro anual de hasta 11,43 millones de dólares si se alcanzara una cobertura de vacunación del 85 %.
El segundo de los estudios realizado en China consideró 3 escenarios con la vacuna antineumocócica entre 2021 y 2026. El primero de los escenarios mantuvo la cobertura de vacunación actual del 4,74 %, el segundo escenario consideró el aumento constante de cobertura de vacunación hasta el 99 % a lo largo de los 5 años y el tercero fue un escenario acelerado con un aumento de cobertura de vacunación hasta el 85 % en los dos primeros años y hasta el 99 % en los 3 años restantes. La vacunación antineumocócica evitó 371 millones de dólares en costes relacionados con la RAM a pacientes y cuidadores en el escenario escalonado con aumento constante de la cobertura de vacunación y de 586 millones de dólares en el escenario acelerado. Asimismo, se ahorraron 37 y 67 millones de dólares en cada escenario, respectivamente, al tener en cuenta la pérdida de productividad evitada por muerte y discapacidad debidas a la RAM.
Además de los dos resultados comentados anteriormente, se identificaron estudios de análisis coste-efectividad sobre la vacuna antineumocócica que no se seleccionaron ya que estaban centrados exclusivamente en los efectos del reemplazo de serotipos no vacunales y no en las RAM. La mayoría de los estudios concluyeron que la vacunación antineumocócica era una estrategia eficiente, incluso teniendo en cuenta los efectos del reemplazo del serotipo. En los estudios en los que la relación coste-efectividad no fue favorable, factores como la reducción del precio podrían hacer que las vacunas fueran una opción coste-efectiva.
En la revisión sistemática aquí reseñada quedó patente la falta de evidencia relacionada con estudios que directamente evaluaran la eficiencia de las vacunas en la prevención de RAM y el elevado número de limitaciones, principalmente relacionadas con la disponibilidad de datos de entrada para los modelos, lo que dificulta la estimación del impacto económico de las vacunas sobre las RAM. Así pues, se necesitan estudios específicos en cada país que proporcionen información sobre epidemiología y costes de las RAM y datos sobre la utilización de antibióticos para alimentar los modelos con una mayor calidad. Además, sería necesario conceptualizar cómo se deberían medir los costes de las RAM e incorporarlos en las evaluaciones de eficiencia de las intervenciones.
COMENTARIO
Con las vacunas tenemos en nuestras manos una poderosa herramienta para prevenir y combatir una de las principales amenazas en cuanto a discapacidad y mortalidad en los próximos años. Las RAM requieren medidas por parte de las autoridades sanitarias y de la sociedad en relación con la correcta utilización de las vacunas que están disponibles y su inclusión en los calendarios de vacunación, el desarrollo de vacunas dirigidas a patógenos multirresistentes y la inversión en nuevas vacunas contra patógenos de la lista de prioridades de la OMS como Salmonella enterica ser. Typhi, Streptococcus pneumoniae, Haemophilus influenzae tipo b (Hib) y Mycobacterium tuberculosis potencialmente peligrosos para el desarrollo de RAM. La escasa evidencia disponible pone de manifiesto la falta de información de datos específicos de cada país en relación con las RAM y el uso de antibióticos y enfatiza la necesidad de llevar a cabo estudios que consideren vacunas contra otro tipo de agentes microbianos diferentes al neumococo.
La posibilidad de utilizar las vacunas en el tratamiento de microorganismos multirresistentes supone un cambio de paradigma en el manejo de los pacientes, pasando de una intervención curativa a una intervención preventiva. Obviamente ello supone un acercamiento terapéutico a un mayor número de personas e implica unos requisitos mayores de seguridad, eficiencia e impacto presupuestario. Las lecciones extraídas durante la pandemia de COVID-19 y el desarrollo de las vacunas frente al SARS-CoV-2 podrían acelerar la aparición de vacunas frente a la amenaza que supone las RAM para la humanidad. Al mismo tiempo, sería necesario la realización de estudios a largo plazo y modelos de decisión que evalúen la eficiencia de las vacunas en el ámbito de las RAM.