El pasado día 6 de noviembre de 2023 se celebró la reunión de trabajo del Jurado para la concesión de los Premios Panorama 2023, formado en esta ocasión por los siguientes miembros:
- D. Jesús Aguilar Santamaría. Presidente del Consejo General de Colegios Farmacéuticos de España (Presidente del Jura-do).
- D. Santiago Cuéllar Rodríguez. Exeditor científico de Panorama Actual del Medicamento. Académico correspondiente de la RANF y de la RAFC.
- D. Antonio L. Doadrio Villarejo. Presidente de la Real Academia Nacional de Farmacia (RANF).
- D. Carlos Fernández Moriano. Coordinador de Panorama Actual del Medicamento. Respon-sable de Divulgación Científica del Consejo General de Colegios Farmacéuticos (Secretario del Jurado).
- D. Juan Enrique Garrido Olmedo. Vocal Nacional de Oficina de Farmacia del Consejo General de Colegios Farmacéuticos de España.
- Dña. Ana M. Herranz Alonso. Vocal Nacional de Farmacia Hospitalaria del Consejo General de Colegios Farmacéuticos de España.
- D. Joan Permanyer Fábregas. Presidente de la Reial Acadèmia de Farmàcia de Catalunya (RAFC).
- Dña. Cristina Tiemblo Ferreté. Directora de Panorama Actual del Medicamento. Tesorera del Consejo General de Colegios Farmacéuticos de España.
- D. Jorge Vázquez Valcuende. Vocal Nacional de Industria del Consejo General de Colegios Farmacéuticos de España.
- D. Francisco Zaragozá García. Vocal Nacional de Investigación y Docencia del Consejo General de Colegios Farmacéuticos de España.

Los Premios Panorama valoran el grado de innovación. Conviene recordar que todos los medicamentos, tanto los no innovadores como los innovadores, tienen utilidad terapéutica en tanto que su autorización por las autoridades sanitarias (AEMPS a nivel nacional y EMA a nivel de la Unión Europea) implica que han demostrado rigurosamente su eficacia, su seguridad, su calidad y las condiciones de uso, incluyendo la información contenida en la ficha técnica –sumario de características– y en el prospecto del medicamento. Por tanto, la valoración que se hace en el informe previo a la deliberación del Jurado se refiere a la incorporación, en el grado indicado, de algún elemento innovador con respecto a otros medicamentos autorizados previamente para iguales o similares indicaciones terapéuticas o, en su caso, cubriendo la ausencia de alternativas farmacológicas.
Asimismo, debe considerarse que ésta es una evaluación que se practica coincidiendo con la comercialización inicial del medicamento. Se trata, por consiguiente, de una valoración provisional de la innovación, realizada en función de la evidencia clínica disponible hasta ese momento; lo cual no prejuzga, en ningún caso, la disponibilidad futura de nuevos datos clínicos o la posible autorización de nuevas indicaciones terapéuticas, así como tampoco la potencial aparición de aspectos desfavorables previamente desconocidos (efectos adversos graves, contraindicaciones, interacciones, etc.).
Se consideran tres posibles niveles, adjudicados en función en de la naturaleza de la(s) innovación(es) presentes en el nuevo medicamento, siempre en relación al arsenal terapéutico disponible en España en el momento de la comercialización:
- SIN INNOVACIÓN (*). No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas.
- INNOVACIÓN MODERADA (**). Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar.
- INNOVACIÓN IMPORTANTE (***). Aportación sustancial a la terapéutica estándar.
Se distinguen dos niveles de evidencia científica para los aspectos innovadores de los nuevos medicamentos:
- Evidencia clínica: mediante estudios controlados con placebo o comparadores activos, de buena calidad metodológica y específicamente diseñados y desarrollados para demostrar lo que pretende ser un avance o mejora sobre la terapia estándar.
- Potencialidad: existencia de aspectos en el medicamento que racionalmente podrían mejorar la terapéutica actual, pero que no han sido adecuadamente demostradas mediante ensayos clínicos, bien por motivos éticos o bien por imposibilidad de realización en el momento de la comercialización del nuevo medicamento: perfil de interacciones, mecanismos nuevos que permiten nuevas vías terapéuticas, nuevos perfiles bioquímicos frente a mecanismos de resistencia microbiana, posibilidad de combinar con otros medicamentos para la misma indicación terapéutica, efectos sobre el cumplimiento terapéutico (por mejoras en la vía, número de administraciones diarias, etc.), mejora de la eficiencia económica, etc.
El rigor de los datos contrastados mediante ensayos clínicos controlados (evidencia clínica) sobre el grado de mejora de los resultados de la intervención con el nuevo medicamento en relación con la terapia estándar es determinante en la valoración global de la innovación, mientras que las potencialidades solo tienen un carácter accesorio en esta valoración. En ningún caso, un medicamento es valorado con un nivel de innovación importante en función de sus ventajas potenciales, si no aporta otras ventajas demostradas clínicamente. Se analizan cinco aspectos de la innovación: clínica, molecular, toxicológica, físico-química y económico-tecnológica, aunque, como ya se ha indicado, la fundamental y determinante es la novedad clínica.
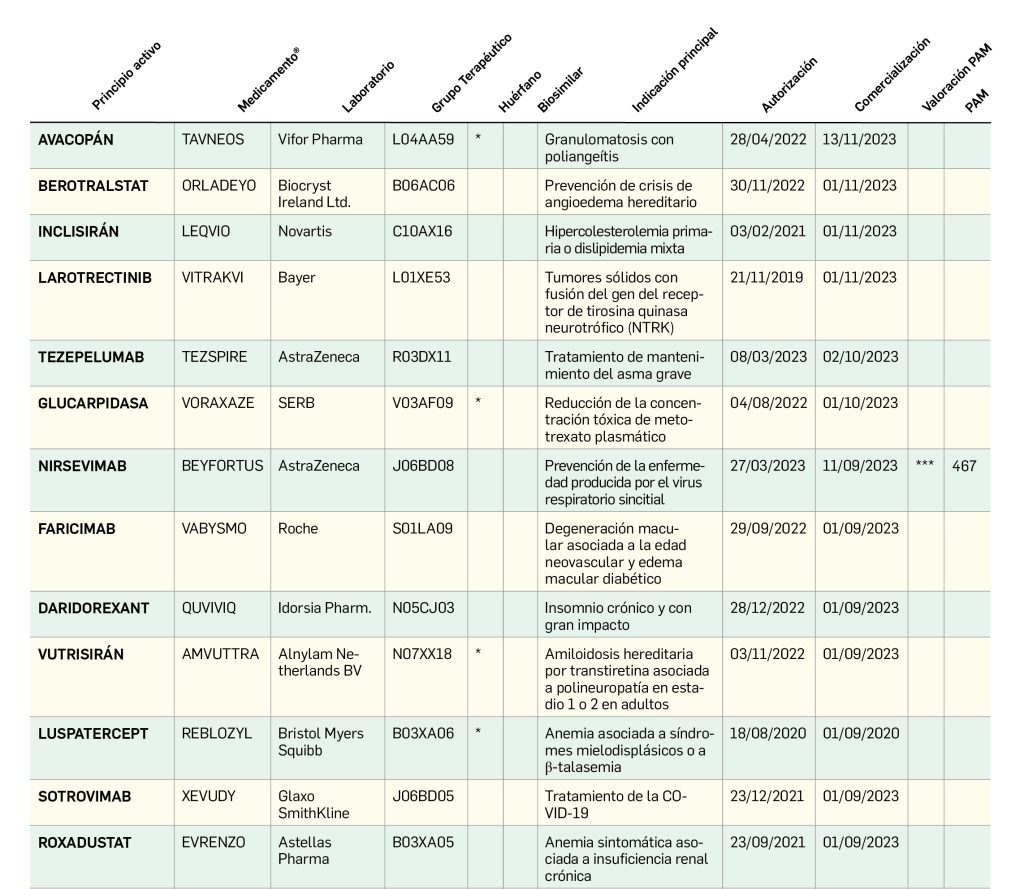
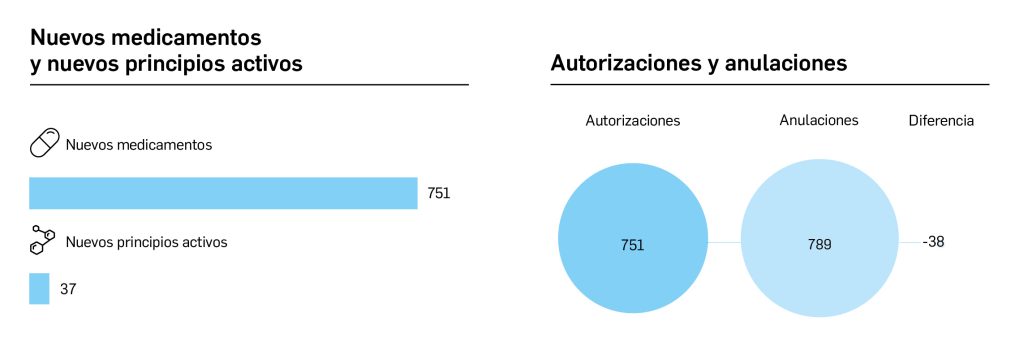
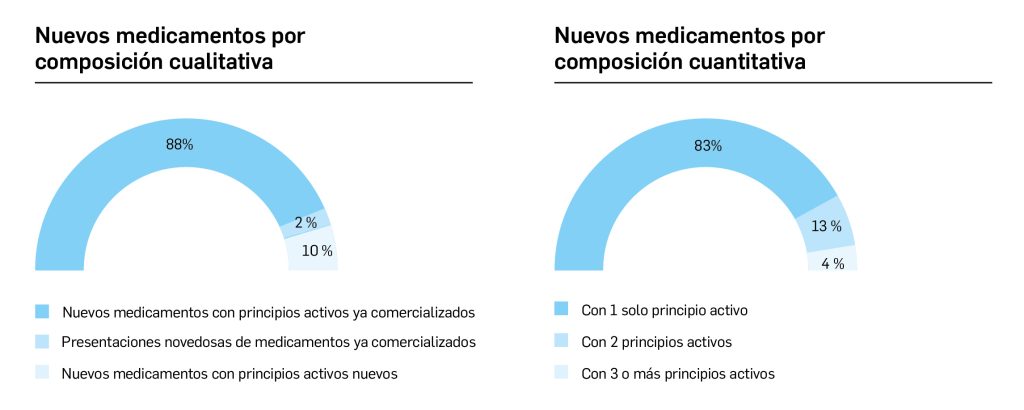
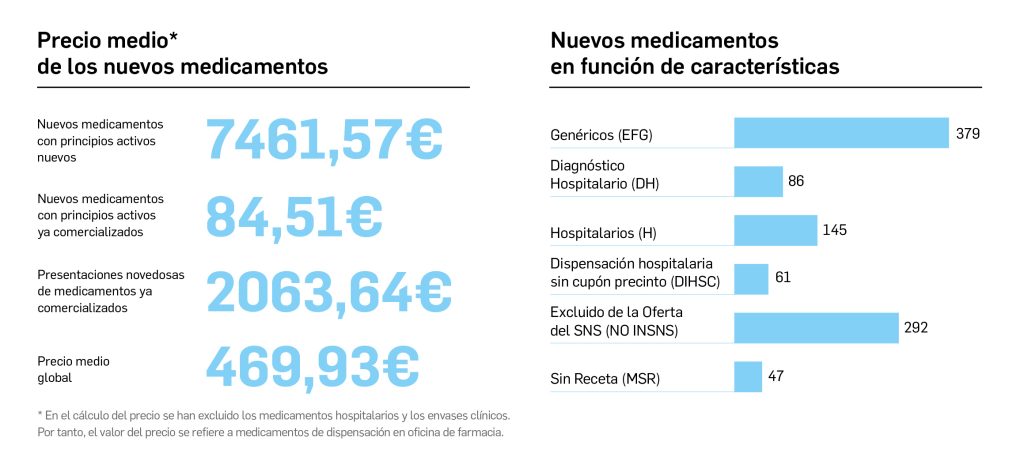
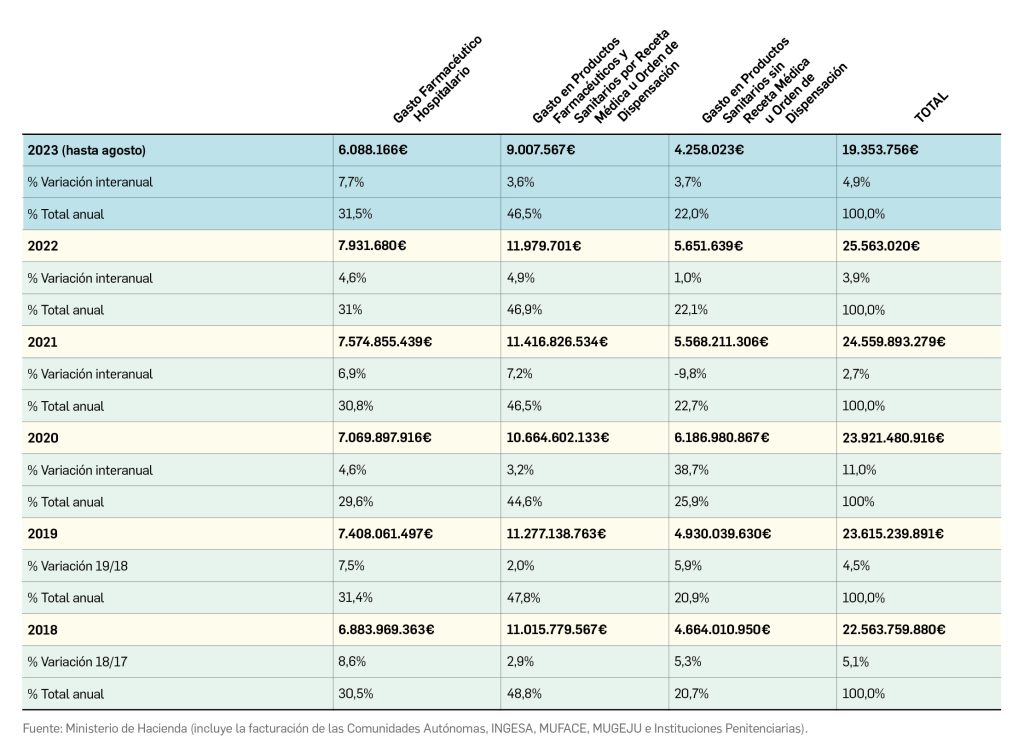
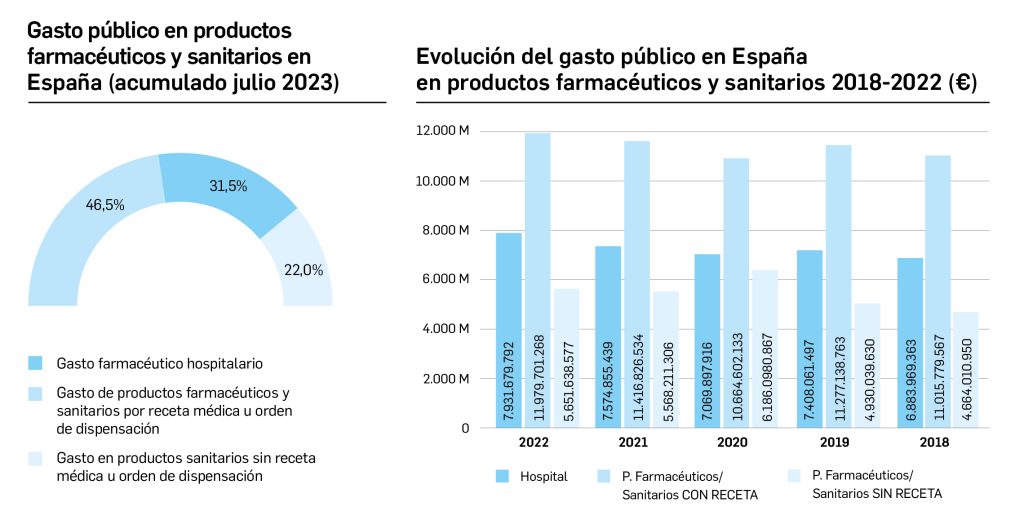
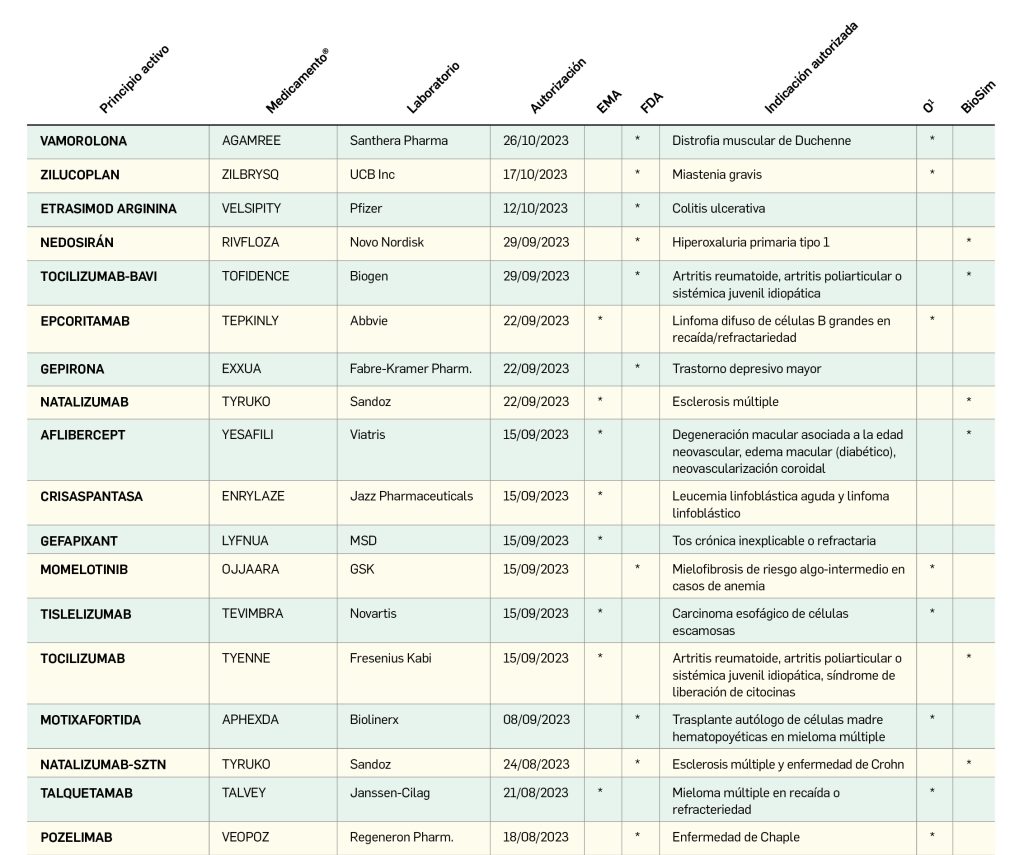
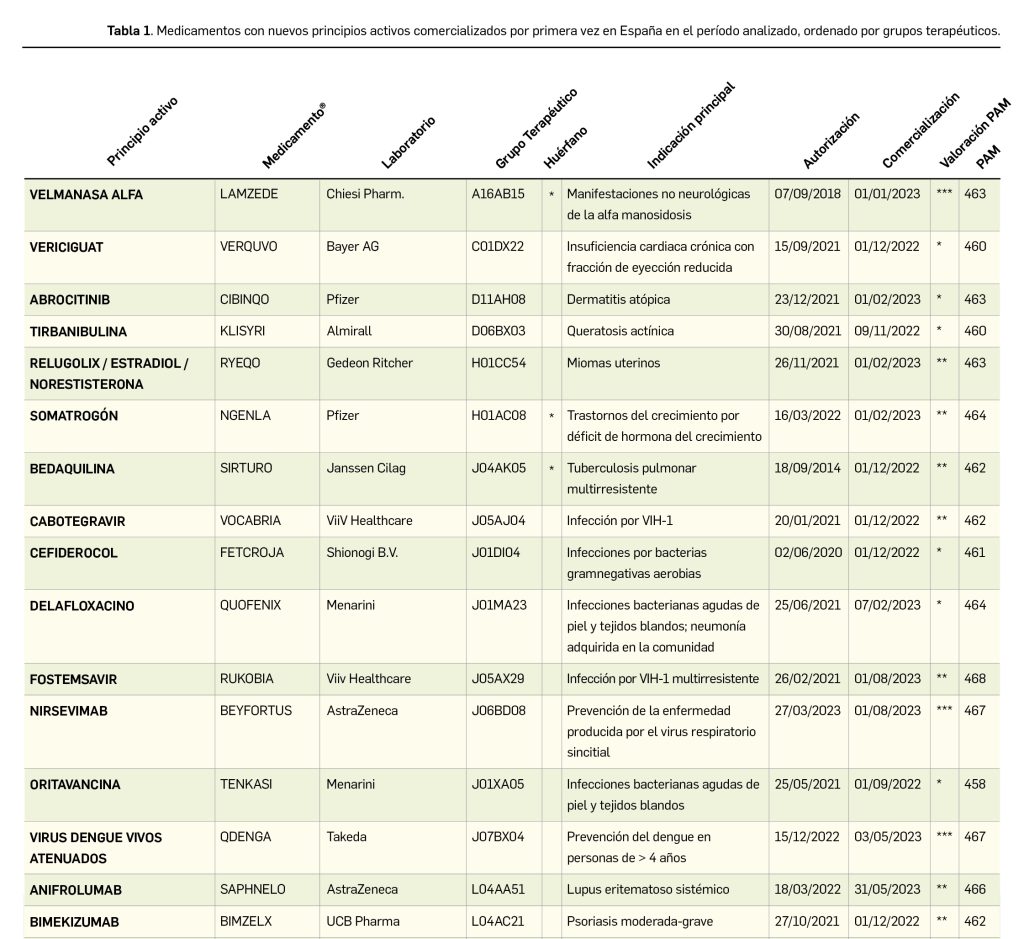
El periodo analizado en esta nueva edición de los Premios Panorama transcurre entre el 1 de septiembre de 2022 y el 31 de agosto de 2023, a partir de los datos recogidos en el Nomenclátor Oficial de la Prestación Farmacéutica del Sistema Nacional de Salud. En estos 12 meses, un total de 40 medicamentos con nuevos principios activos han sido comercializados por vez primera en España (Tabla 1), todos los cuales han sido revisados y evaluados, y sus correspondientes monografías publicadas en Panorama Actual del Medicamento a lo largo del periodo mencionado.
Tras la discusión de los méritos de cada uno de los medicamentos estudiados, en la que participan todos los miembros del Jurado, éste acuerda por unanimidad, atendiendo a los méritos específicos de cada uno de los medicamentos reseñados, conceder el Premio Panorama 2023 a:
Nirsevimab (▼Beyfortus®) de AstraZeneca
Por ser el primer medicamento preventivo de la enfermedad de vías respiratorias inferiores por el virus respiratorio sincitial (VRS) que permitirá cubrir con una única administración intramuscu-lar toda la temporada de circulación del virus, confiriendo una protección superior al 75% fren-te a la enfermedad que requiere atención médica. Puede administrarse a todos los neonatos y lactantes antes o durante su primera temporada de exposición al virus, incluso junto a otras vacunas infantiles, con un perfil de seguridad muy aceptable.
Nirsevimab tiene una capacidad de neutralización al menos 50 veces mayor que la de palivizumab, la otra opción de inmunización pasiva frente al VRS, y supera sus limitaciones: este último requiere una dosis mensual y tiene un uso restringido a bebés de especial riesgo de enfermedad grave, en quienes, además, nirsevimab es significativamente más eficaz. Es previsible que tenga un gran impacto como medida de salud pública y reduzca sustancialmente la carga sanitaria, social y económica asociada a la infección por VRS, segunda causa de muerte infecciosa en niños pequeños en todo el mundo y principal causa de hospitalización pediátrica en Europa en periodos epidémicos (el 70% de ingresos por bronquiolitis se deben al VRS), que afecta a 1 de cada 56 niños menores de 2 años.
Adicionalmente, se concede una Mención de Honor a dos medicamentos:
Imlifidasa (▼Idefirix®) de Hansa Biopharma
Por ser el primer medicamento que permite la reducción rápida del nivel de anticuerpos específicos contra donante en pacientes con enfermedad renal crónica en estadio terminal y en lista de espera de trasplante. Ha sido aprobado, con designación de huérfano, en el tratamiento de desensibilización de pacientes adultos sometidos a un trasplante de riñón hipersensibilizados con prueba cruzada positiva frente a un donante fallecido disponible, quienes tendrían una muy baja probabilidad de trasplante y verían prolongado su tiempo en lista de espera de donante vivo compatible, con alto impacto en su calidad de vida y supervivencia.
Imlifidasa incorpora un mecanismo de acción novedoso: es una proteasa derivada de una enzima bacteriana que degrada todas las inmunoglobulinas G humanas y elimina sus funciones inmunitarias, sin afectar al resto de inmunoglobulinas. En ensayos clínicos, una dosis única por vía intravenosa ha mostrado una alta capacidad para negativizar las pruebas de anticuerpos, con una probabilidad de casi el 100% a las 6 h. Datos a 3 años revelan que el órgano se mantiene funcionan-te en una alta proporción de pacientes (85%).
Vosoritida (▼Voxzogo®) BioMarin International
Por ser un novedoso análogo del péptido natriurético de tipo C que se dirige específicamente frente a la etiopatogenia de la acondroplasia, causa de hasta el 90% de los casos de enanismo. El medicamento, también huérfano, ha sido aprobado para el tratamiento de la acondroplasia en pacientes de 2 años de edad y mayores cuyas epífisis no se han cerrado. Con un perfil de seguridad aparentemente benigno, es un claro avance para estos pacientes, cuyo abordaje hasta ahora se limitaba a seguimiento clínico y terapias de soporte, como fisioterapia y cirugía.
Pese a que todavía hay diversas incertidumbres, referidas a su capacidad para prevenir las complicaciones de tipo traumatológico y neurológico asociadas a la enfermedad y a su beneficio como intervención temprana en bebés de menos de 2 años, el fármaco ha demostrado una pro-metedora capacidad para incrementar la velocidad de crecimiento, con datos que sugieren que su eficacia se mantiene a largo plazo, aportando un crecimiento superior a 9 cm tras 5 años.
___________________________________________________________________
Las monografías con la evaluación de estos nuevos medicamentos han sido publicadas previamente en los números 467 (nirsevimab) y el presente 468 (imlifidasa y vosoritida) de Panorama Actual del Medicamento. Los tres han sido considerados como opciones que representan una innovación importante (***), suponiendo una aportación sustancial a la terapéutica estándar. A modo de recordatorio y resumen, se recogen a continuación los principales aspectos innovadores del medicamento premiado, con datos referentes a la evidencia clínica disponible en el momento de su comercialización. Se recomienda consultar los artículos monográficos que se incluyen en páginas posteriores en relación a los dos medicamentos con Mención de Honor.
Nirsevimab
Es un novedoso anticuerpo monoclonal humano recombinante de segunda generación dirigido frente a la proteína F del virus respiratorio sincitial (VRS) que ha sido modificado para reducir su antigenicidad y prolongar su semivida plasmática. Ha demostrado una actividad neutralizante de larga duración de la conformación prefusión de la proteína F del VRS mediante su afín unión a un epítopo altamente conservado en el sitio antigénico Ø de dicha proteína (sitio de unión distinto al de palivizumab, con el que no se superpone). Así, inhibe el paso esencial de fusión de membrana en el proceso de entrada viral, neutralizando el virus y bloqueando la fusión célula-célula. En base a ello, el medicamento ha sido aprobado para la prevención de la enfermedad de las vías respiratorias inferiores producida por el VRS en neonatos y lactantes durante su primera temporada de circulación del virus; debe usarse siguiendo las recomendaciones oficiales.
La eficacia del fármaco en su pauta intramuscular monodosis –ajustada según peso– ha sido adecuadamente contrastada en dos ensayos pivotales de adecuado diseño (multicéntrico, doble ciego, aleatorizado y controlado por placebo), que han incluido, respectivamente, lactantes moderadamente o muy prematuros (edad gestacional de al menos 29 semanas) y lactantes nacidos a término o prematuros tardíos, expuestos a su primera temporada del VRS.
En el primero de ellos (N= 1453, mayoría de edad gestacional entre 32 y 35 semanas), los resultados tras 5 meses de seguimiento revelaron que la administración de nirsevimab se asocia, en comparación con placebo, con una eficacia protectora del 70% frente a la infección de las vías respiratorias bajas por VRS atendida médicamente (variable primaria), alcanzando significación estadística. Esa protección aumenta hasta el 78% para los casos que requieren hospitalización y hasta el 88% para los que, además, requerían aporte adicional de O2 suplementario o líquidos intravenosos. Por su parte, en el segundo de los estudios (N= 1490, mayoritariamente con edad gestacional > 37 semanas) se halló una eficacia protectora del 75% frente a las infecciones que requerían atención médica a los 5 meses, también una diferencia estadísticamente significativa a favor de nirsevimab. En ese perfil de pacientes de más larga gestación, la protección frente a hospitalización (eficacia del 62%) y frente a infecciones muy graves por VRS (64%) tuvo también una tendencia favorable, pero no alcanzó significación estadística.
De manera interesante, otro análisis con una mayor muestra de pacientes del estudio MELODY (N= 3012 lactantes nacidos a término y prematuros tardíos) tuvo resultados más reveladores: frente a placebo, se veía una reducción del 76% del riesgo relativo de infección atendida médicamente, del 77% en las que requerían hospitalización y del 79% en los casos muy graves. La eficacia protectora del fármaco se muestra consistente en los distintos subgrupos de pacientes, con independencia de factores como edad gestacional, sexo o raza de los niños.
Por otro lado, el perfil toxicológico de nirsevimab, caracterizado por datos de casi 3000 niños, parece relativamente benigno. Hasta casi un año desde la inyección, la incidencia de eventos adversos es muy similar a placebo, incluso más baja en lo referente a eventos graves (6,8% vs. 7,3% con placebo). Son muy escasos los eventos posiblemente relacionados con el tratamiento (1,6% vs. 1,8%), y la práctica totalidad son leves-moderados en severidad, reflejo de una reactogenicidad leve. Con una inmunogenicidad a priori escasamente relevante, la reacción adversa a nirsevimab más frecuente es la erupción cutánea (0,7%), seguida de pirexia (0,5%) y reacciones en el lugar de la inyección (0,3%, como dolor o inflamación), concentradas en los primeros días postadministración.
Se dispone de una comparación directa de nirsevimab con palivizumab en un ensayo controlado de soporte, de fase 2/3 y similar diseño (multicéntrico, doble ciego y aleatorizado), que enroló pacientes (N= 925) con mayor riesgo de enfermedad grave, incluidos los extremadamente prematuros (< 29 semanas de gestación) y aquellos con enfermedad pulmonar crónica o cardiopatía congénita. Sus hallazgos apuntan a una reducción del riesgo de incidencia de infección por VRS atendida médicamente del 40% con nirsevimab en los primeros 5 meses (0,6% vs. 1,0% con palivizumab). El perfil de seguridad de ambos fármacos en lactantes con elevado riesgo de enfermedad grave es semejante.
Así pues, además de demostrar una eficacia aparentemente mayor que palivizumab en niños de alto riesgo, la principal ventaja que incorpora nirsevimab es su pauta de dosis única, que puede administrarse antes o durante la temporada de circulación del VRS a todos los lactantes y aporta una protección duradera por periodo de al menos 5 meses, mientras que el primero requiere una administración intramuscular al mes durante todo el periodo previsto de riesgo, lo que puede suponer un problema de adherencia, y su uso se restringe principalmente a bebés de alto riesgo nacidos pretérmino (≤ 35 semanas), lo que limita la carga sanitaria que puede atenuarse con su uso. Además, aunque alcanzan niveles séricos similares, la capacidad neutralizante de nirsevimab frente al VRS es al menos 50 veces mayor que la de palivizumab.
En definitiva, pese a tener un mecanismo de acción similar al de palivizumab (unión a la proteína F del VRS), nirsevimab puede cambiar el paradigma en el manejo estándar de la enfermedad por VRS y transformar la prevención de esta infección, al menos hasta que se disponga de una vacuna segura y eficaz, lo cual parece cercano en el tiempo. De hecho, a inicios de octubre de 2023 se están realizando amplias campañas de inmunización pasiva en diversas Comunidades Autónomas con este fármaco, y se prevé que pueda minimizar el impacto de la enfermedad por VRS en la población pediátrica, reduciendo sustancialmente la carga sanitaria y socio-económica. También tiene la ventaja de que se puede administrar con el resto de vacunas infantiles.