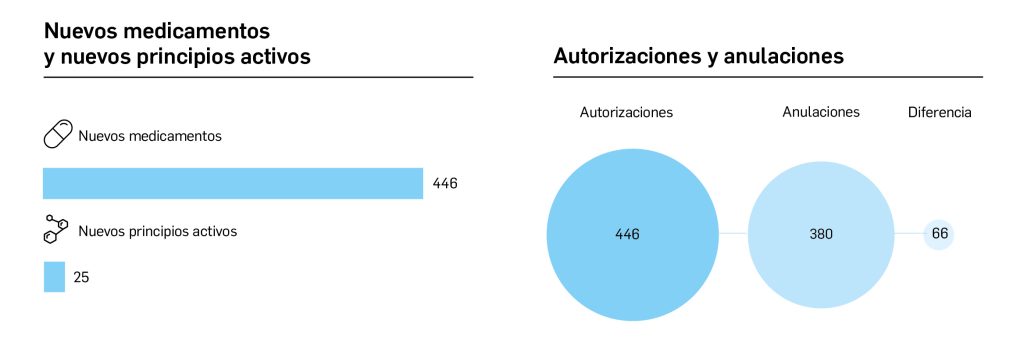
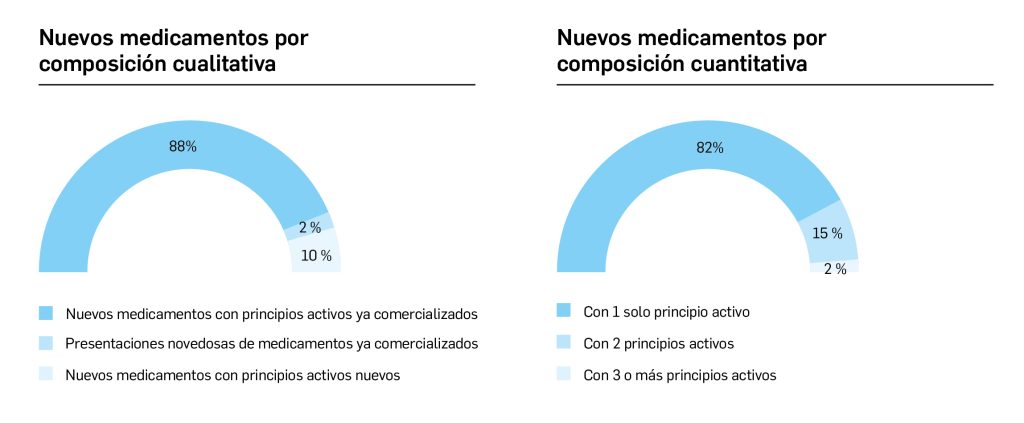
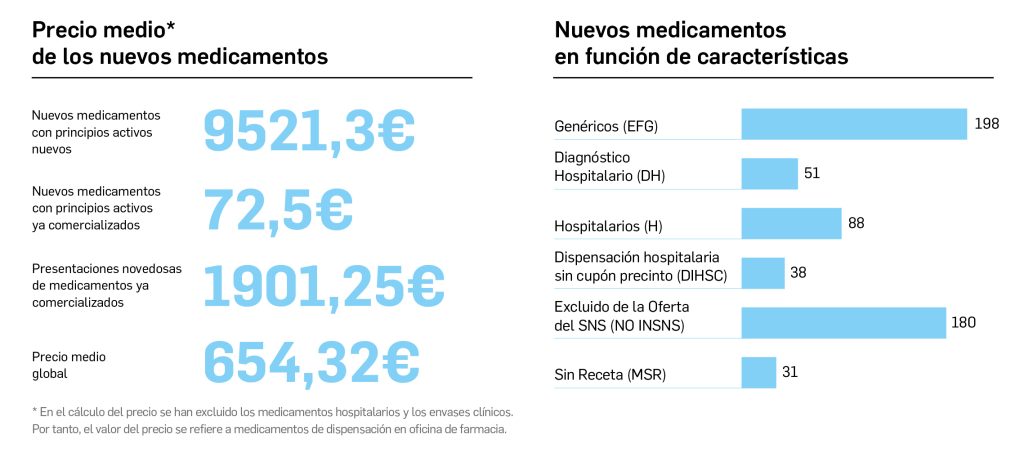
Número 465, Julio – Agosto 2023
Alertas debidas a defectos de calidad observados en medicamentos de uso humano, publicadas por la AEMPS desde el anterior número y que suponen la retirada o inmovilización de ciertos lotes de medicamentos. En BOT PLUS puede encontrar más información detallada, con acceso al documento de la AEMPS.
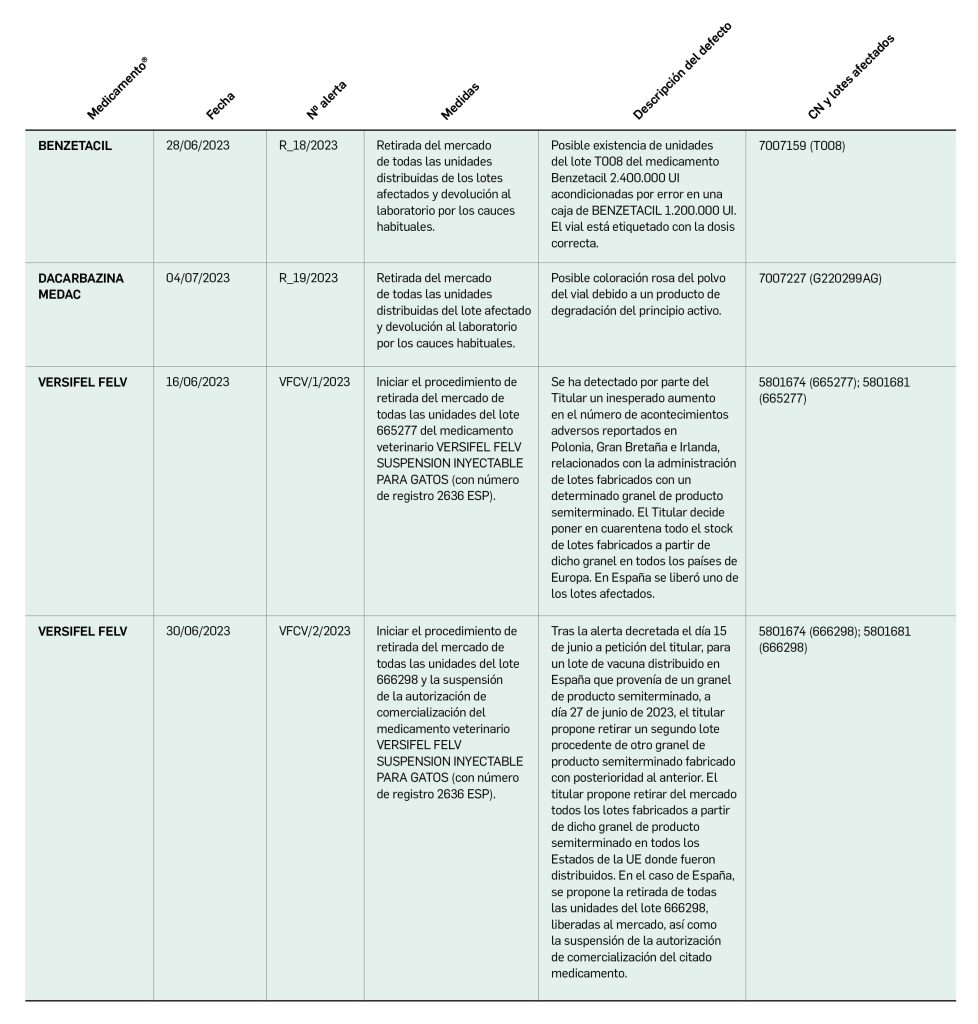
Continúa la tabla aquí
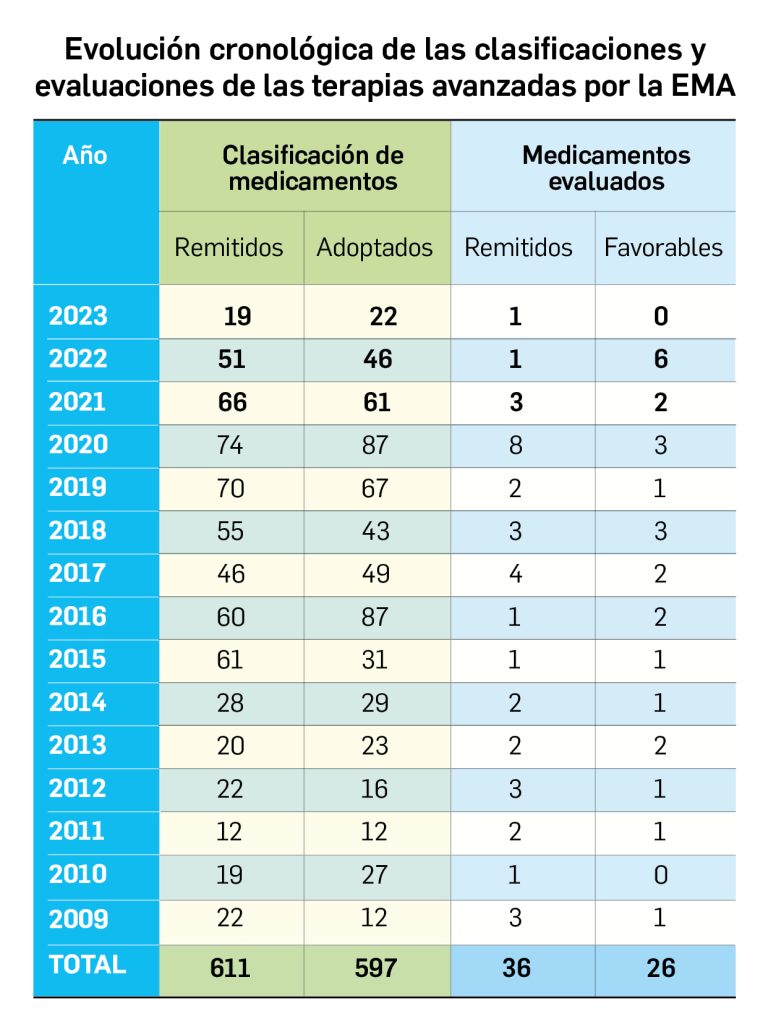
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
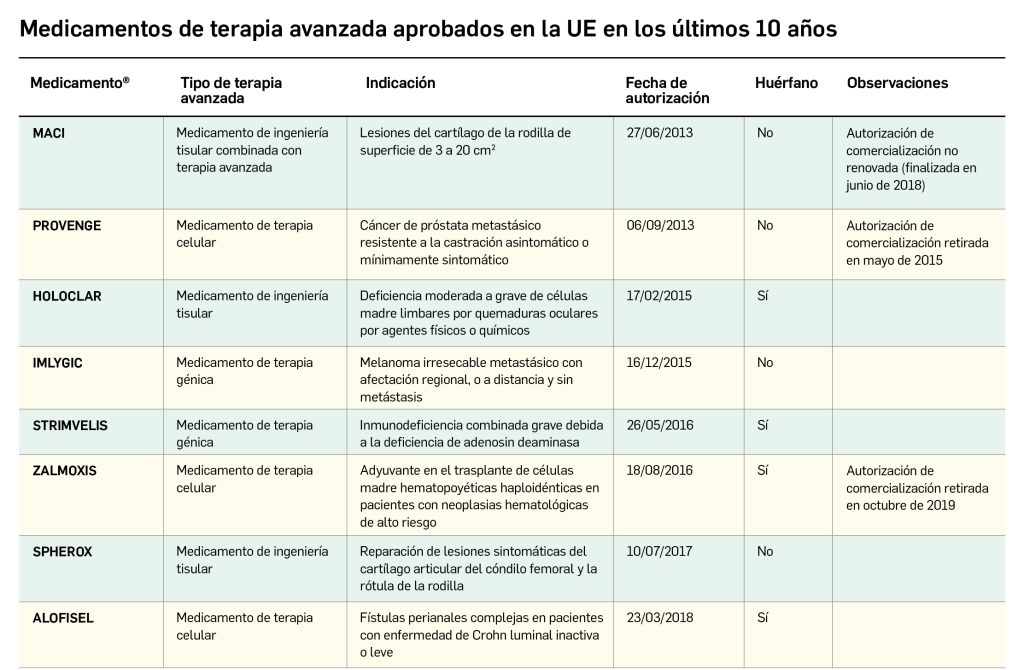
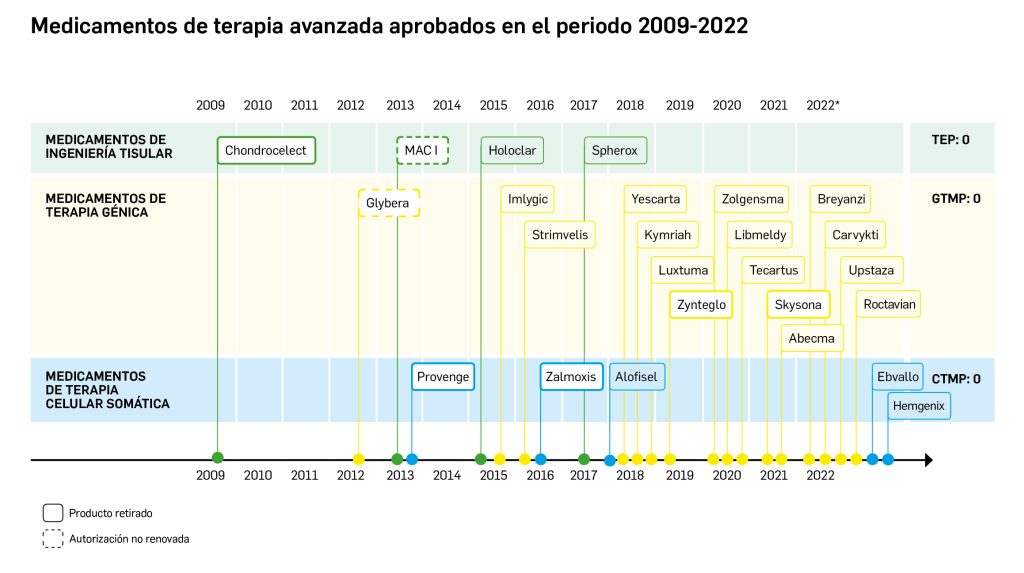
La siguiente tabla recoge los medicamentos de terapia avanzada que han recibido autorización de comercialización en la UE durante en los últimos 10 años (2013-2023).
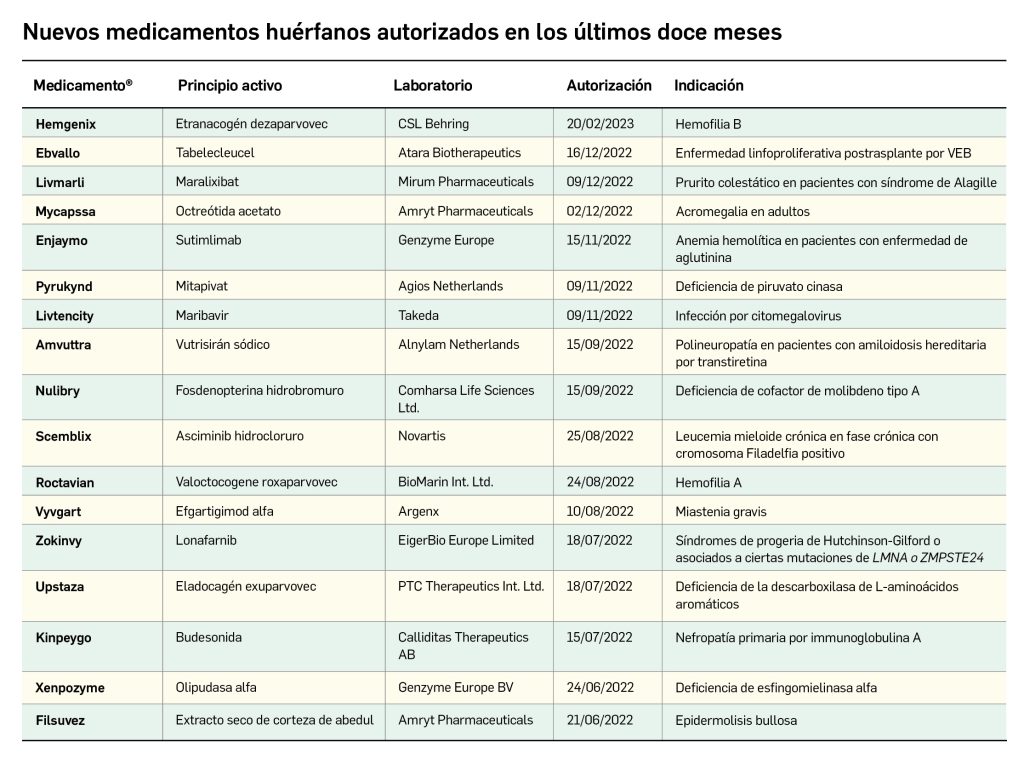
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas. La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios solo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
La agencia reguladora de Canadá (Health Canada) ha propuesto incluir el riesgo de rotura de tendones en la información de los medicamentos con anastrozol, exemestano y letrozol, tres fármacos del grupo de inhibidores de la aromatasa de tercera generación, indicados en diversos tipos de cáncer de mama.
En España no se describen estos riesgos, salvo en los medicamentos con letrozol, cuyas fichas técnicas ya lo describen desde 2019, después de la revisión llevada a cabo por el PRAC.
La autoridad canadiense reguladora de medicamentos, Health Canada, ha anunciado que la información de seguridad de los medicamentos con los inhibidores de la aromatasa de tercera generación, anastrozol (Amenur®, Arimidex® y EFG), exemestano (Aromasil®, Gepex® y EFG) y letrozol (Allenda®, Femara®, Galdar®, Loxifan® y EFG), se actualizará para incluir el riesgo de trastornos de los tendones. Los trastornos de los tendones incluyen inflamación del tendón (tendinitis), inflamación de la vaina del tendón (tenosinovitis) y desgarros del tendón (rotura del tendón) (Health Canada, 2023).
Los inhibidores de la aromatasa de tercera generación están indicados para el tratamiento del cáncer de mama en mujeres que han llegado a la menopausia.
Health Canada, impulsada por una actualización por parte de la EMA en 2019 que incluyó los riesgos de tendinitis y ruptura del tendón como reacciones adversas (RAM) en la información de seguridad de los medicamentos con letrozol, revisó la siguiente información:
La revisión concluyó que es probable que exista un vínculo entre el uso de inhibidores de la aromatasa de tercera generación y los riesgos de tendinitis y tenosinovitis. Además, no se puede descartar un vínculo con la rotura del tendón.
En España se describen estos riesgos en los medicamentos con letrozol (Allenda®, Femara®, Galdar®, Loxifan® y EFG), cuyas fichas técnicas ya los describen desde 2019, después de la revisión llevada a cabo por el PRAC. Esta información se describe tanto en la sección de advertencias, como entre las reacciones adversas identificadas (AEMPS, 2021).
En síntesis, se debe tener presente durante los tratamientos con estos tres inhibidores de la aromatasa de tercera generación, anastrozol, exemestano y letrozol, la posibilidad de producirse casos de tendinitis y de rotura de tendones (raras). Se debe vigilar estrechamente a los pacientes y adoptar las medidas adecuadas (p. ej., inmovilización) con el tendón afectado.