La mielofibrosis primaria (MP) es un trastorno mieloproliferativo crónico poco común caracterizado por la presencia de un tejido fibroso en la médula ósea. Se considera un tipo de leucemia crónica y los signos y síntomas más comunes son los relacionados con el síndrome anémico (cansancio, dificultad para respirar), tendencia al sangrado, esplenomegalia y sudoración nocturna. La mediana de supervivencia actualmente es inferior a 10 años tras el diagnóstico, aunque muchos pacientes pueden vivir más tiempo. El único tratamiento con potencial curativo actualmente disponible es el trasplante alogénico de precursores hematopoyéticos, que se asocia a una elevada toxicidad, por lo que generalmente los únicos candidatos a este tratamiento son los pacientes más jóvenes y de alto riesgo de progresión. En el abordaje de la enfermedad se pueden seguir otras estrategias, como el uso de inhibidores de la vía JAK-STAT, como ruxolitinib, que permite mejorar la supervivencia y la sintomatología, pero no la anemia. Con el propósito de mejorar la anemia se recurre en ocasiones a danazol, un andrógeno que estimula la eritropoyesis. A pesar de los avances terapéuticos, la mielofibrosis sigue siendo para la gran mayoría de pacientes una enfermedad incurable, por lo que se requiere de nuevos tratamientos que permitan mejorar el control de la enfermedad y la supervivencia.
En este sentido, se ha llevado a cabo un estudio de fase 3, aleatorizado, doble ciego y controlado en el que se evaluó la eficacia de momelotinib en comparación con danazol con el objetivo de estudiar la eficacia en el tratamiento de la MP. Momelotinib es un inhibidor selectivo de JAK1/JAK2 y del receptor de activina A de tipo 1 (ACVR1), cuyas mutaciones se relacionan con el desarrollo de la MP. Se aleatorizó a 260 pacientes en proporción 2:1 para recibir momelotinib o danazol, ambos por vía oral. Respecto a la eficacia, en la escala de evaluación de la sintomatología total symptom score (TSS)1, el 25% de los pacientes tratados con momelotinib vs. el 9% de los tratados con danazol logró una reducción del 50% o superior en la puntuación (p= 0,0095), permitiendo mejorar la anemia, la esplenomegalia y previniendo la necesidad de transfusión de glóbulos rojos. Los eventos adversos graves descritos durante el estudio con momelotinib fueron poco frecuentes, siendo los más comunes anemia (3,9%) e insuficiencia renal aguda (3,1%).
Aunque el tratamiento con momelotinib se asoció en este estudio a un mejor control de los síntomas, este estudio presenta algunas limitaciones, como la ausencia de datos respectivos a la supervivencia y la evaluación con un comparador menos activo en el control general de la enfermedad que ruxolitinib. Aunque momelotinib podría ser una terapia adecuada en algunos casos, especialmente en pacientes con anemia, su posicionamiento en clínica deberá estar condicionado a la disponibilidad de comparaciones con ruxolitinib que permitan caracterizar de manera más precisa su utilidad clínica.
Archive
Revista PAM: 464
Número 464, Junio 2023
Leucemia aguda: revumenib, un inhibidor de una interacción clave en varios tipos de leucemia aguda
Las leucemias constituyen un vasto y diverso grupo de neoplasias hematológicas caracterizadas por la acumulación de células malignas en la médula ósea y en la sangre. Más concretamente, las leucemias agudas tienen una alta capacidad invasiva y la tendencia a la malignización se produce en estadios precoces de la diferenciación de los progenitores hematopoyéticos, con una tasa de mortalidad alta en ausencia de tratamiento. Los tratamientos actuales se basan generalmente en la determinación del tipo de leucemia (mieloide o linfoide) y de las mutaciones concretas, de modo que el abordaje y el pronóstico puede diferir ampliamente entre individuos.
Una estrategia novedosa es la restauración de la función normal de los tejidos a través de fármacos dirigidos de manera específica a determinados reguladores epigenéticos. En el caso de las leucemias agudas, la interacción de la menina con la metiltransferasa 2A de lisina (KMT2A) puede ser uno de estos reguladores epigenético como consecuencia de mutaciones en varios genes, que se producen en alrededor del 10% de las leucemias agudas y se relacionan usualmente con un peor pronóstico.
Recientemente se ha llevado a cabo un ensayo de fase 1 con revumenib, un inhibidor oral de la interacción entre la menina y KMT2A en 68 pacientes con leucemia aguda refractaria o recidivante (82% con leucemia mieloide aguda, LMA; 16% con leucemia linfoblástica aguda, LLA). En el estudio, entre los pacientes que completaron el estudio (n= 60) se produjeron remisiones completas de la enfermedad en 18 casos (30%), en 14 de los cuales se pudo constatar mediante citometría de flujo la ausencia de enfermedad residual. La tasa de respuesta global fue del 53%. El único parámetro de toxicidad limitante de la dosis identificado fue la prolongación del intervalo QT, descrito en un 56% de los pacientes tratados con revumenib. Otros eventos adversos comunes fueron náuseas (50%), vómitos (40%) y neutropenia febril (31%).
A pesar de tratarse de un estudio de fase 1, los resultados son prometedores para una población altamente pretratada y con escasas alternativas terapéuticas. En futuros ensayos deberá caracterizarse de manera más exhaustiva el tipo de pacientes susceptibles de beneficiarse de una terapia de este tipo. Sin embargo, más allá de los resultados concretos obtenidos en este estudio, su principal interés radica en la selección de una diana terapéutica novedosa, aprovechando los avances en biología molecular. Estas estrategias permiten diseñar tratamientos muy selectivos y con un alto potencial de efectividad.
Estimación del coste de por vida de la vacunación en 23 países europeos: un estudio de modelización
La prevención de la morbilidad y mortalidad por enfermedades mediante la vacunación es uno de los mayores logros de salud pública en la historia de la humanidad. La Organización Mundial de la Salud (OMS) y los planes de acción de la Unión Europea dan prioridad a la vacunación señalando que son claves para los sistemas sanitarios y, especialmente en el contexto actual, en la atención primaria debido a la pandemia COVID-19.
Los programas de vacunación infantiles o universales de enfermedades prevenibles, además de evitar infecciones, generan ahorros relacionados con los costes directos y sociales y tienen beneficios clínicos a corto y largo plazo, resultando coste-efectivos en la mayoría de las evaluaciones económicas realizadas. Estos resultados son también favorables cuando se comparan con medidas preventivas como, por ejemplo, los programas de detección de enfermedades cardiovasculares o de cáncer, o con tratamientos alternativos, como estrategias de sustitución o intercambio de medicamentos.
El objetivo del estudio fue (1) estimar el coste individual de por vida de la vacunación cumpliendo el calendario publicado en 23 países europeos, según las vacunas recomendadas y financiadas en sus Programas Nacionales de Inmunizaciones (PNI) más recientes; (2) estimar el coste individual de por vida de la vacunación (adquisición y administración) ampliando el PNI de cada país para personas sanas, incluyendo la financiación universal para todas las vacunas recomendadas; (3) contextualizar los costes de vacunación anual por persona comparándolos con el coste anual per cápita de hospitalización por cualquier causa y con el coste anual per cápita de los medicamentos antiinfecciosos para cada país.
La metodología utilizada fue un análisis de costes mediante una modelización en Microsoft Excel. Se incluyeron un total de 23 países miembros de la UE (27 estados actuales excluyendo a Estonia, Hungría, Irlanda, Italia, Lituania y Malta, por falta de datos públicos disponibles sobre los costes de las vacunas) más Reino Unido y Suiza. Los parámetros necesarios para la realización del análisis comprendieron información demográfica, tasa de natalidad, esperanza de vida por sexo, calendarios nacionales oficiales de vacunación a enero de 2022, costes de adquisición de las vacunas, costes directos de administración y costes anuales per cápita de la hospitalización por cualquier causa (periodo 2017-2019) y de los medicamentos antiinfecciosos. Las vacunas incluidas en el análisis se muestran en la Figura 1. Los costes individuales de por vida para cada vacuna se calcularon a partir de los costes de adquisición y de administración y el número de dosis de vacunas por cada receptor elegible. Los costes anuales por persona se calcularon dividiendo los valores de por vida por la esperanza de vida al nacer de cada país.
La definición de los escenarios fue la siguiente: a) caso base (individuo sano), se incluyó todas las vacunas recomendadas y financiadas universalmente según el PNI que recibiría una persona sana; b) caso base (individuo con condiciones subyacentes), igual que el anterior, pero para una persona con todas la condiciones médicas subyacentes u otros factores de riesgo (edad, sexo, embarazo, condiciones subyacentes y lugar de nacimiento o residencia); c) escenario adicional, con personas sanas asumiendo la cobertura universal de todas las vacunas recomendadas independientemente del estado de financiación actual.
Los resultados del caso base mostraron una variación en la cantidad de vacunas recomendadas y financiadas y en el número de dosis de por vida, así como en el coste de adquisición y administración, además de diferencias en los calendarios recomendados para cada vacuna financiada, según los PNI más recientes de los 23 países.
Grecia y Reino Unido fueron los países que incorporaron más vacunas financiadas universalmente, mientras que Dinamarca, Rumanía y Suecia los que menos. Las vacunas de difteria, Hib, VPH, influenza (Ad), sarampión, paperas, tosferina, neumonía (pediátrica), polio, rubeola y tétanos son financiadas universalmente por todos los países. Las vacunas mayormente no recomendadas por los países son Encefalitis T por transmisión de garrapatas, meningocócica B y zoster (Figura 1).
En términos económicos, el coste medio de por vida de adquisición de la vacuna y el coste medio de la vacunación en los 23 países para una persona sana fue de 1203€ y 1663€, respectivamente, siendo el coste más alto en Alemania (3049€ y 3504€) y el menor en Polonia (350€ y 717€) y en Rumanía (511€ y 592€). En el caso de las personas con condiciones subyacentes u otros factores de riesgo que reciben todas las vacunas financiadas estos costes oscilaron entre 6306€ (Alemania) y 648€ (Bulgaria) para la adquisición y 9081€ (Suiza) y 744€ (Bulgaria) para la vacunación, respectivamente.
El coste anual por persona de adquisición de la vacuna osciló entre 5€ y 38€ en personas sanas y entre 9€ y 78€ en personas con condiciones subyacentes, siendo Alemania en ambos casos el país con mayor coste. El coste anual por persona de la vacunación varió entre 8-43€ (personas sanas) y 10-109€ (personas con condiciones subyacentes).
En el escenario adicional con cobertura universal para todas las vacunas recomendadas, el coste de adquisición individual de por vida para una persona sana en el país de mayor coste (Alemania) paso de 3049€ a 3454€ y el de vacunación ascendió a 3981€. En el país con menor coste de adquisición (Polonia) varió de 350€ a 819€, y el de vacunación de 717€ a 1299€.
Para contextualizar los costes de vacunación anual por persona, el coste anual per cápita de la hospitalización por cualquier causa fue de 585€ (mediana)y el de todos los medicamentos antiinfecciosos, 33€ (mediana).
El estudio concluyó que la variación que existe en los PNI entre los diferentes países europeos produce diferencias en el número de vacunas y dosis financiadas y recomendadas, tanto para personas sanas, como con condiciones subyacentes o factores de riesgo, generando una variación en el coste individual. Esto muestra la importancia de hacer un seguimiento continuo de los costes de las vacunas, así como de otros factores relacionados con los cambios demográficos y la economía que afectan a la actualización de los PNI y a su rentabilidad a lo largo del tiempo.
Comentario
Los virus son transmisibles y no entienden de fronteras. Las vacunas son un medio eficaz y eficiente para prevenir enfermedades infecciosas. Un claro ejemplo es la situación de pandemia vivida por la COVID-19 en todo el mundo, que ha enfatizado la importancia de las vacunas y de los programas de vacunación para satisfacer la mayor demanda posible. Desafortunadamente, las vacunas recomendadas y financiadas, así como su coste, y el calendario vacunal difiere entre los países europeos, generando desigualdades potenciales. Por ello, sería necesario una evaluación continuada de los programas de vacunación.
El enfoque de este artículo permite conocer esas diferencias y sirve como instrumento de ayuda para la planificación y evaluación de los programas de vacunación europeos y para la realización de análisis de costes y beneficios económicos, orientados a conseguir la eficiencia en la financiación universal de todas las vacunas.
Pérdidas de producción por ausentismo y presentismo: la influencia de los mecanismos de compensación y efectos multiplicadores
Las evaluaciones económicas se emplean habitualmente para la toma de decisiones en la atención sanitaria, pero su metodología en relación con la perspectiva utilizada genera controversia. Cuando se opta por una perspectiva social deben incluirse todos los costes y beneficios sociales, independientemente de si impactan en el presupuesto del financiador o no. Los costes de productividad, definidos como “los costes asociados con la pérdida y reposición de la producción debido a enfermedad, discapacidad y muerte de las personas productivas, tanto remuneradas como no remuneradas”, son un elemento destacado y un claro ejemplo de lo anterior.
Las pérdidas de productividad en el trabajo remunerado pueden ser a causa de ausentismo (ausencia de trabajo) o presentismo (reducción de la productividad en horario laboral). No incluir los costes asociados a estas pérdidas puede influir en los resultados de las evaluaciones económicas y, por tanto, no mostrar la eficiencia real de la intervención a evaluar.
También existe debate sobre cómo medir la productividad remunerada, a través del método del capital humano o de los costes de fricción, y sobre la dificultad de incluir y cuantificar los costes de productividad, debido a que no todas las horas de un empleado enfermo se traducen en pérdidas de producción. En relación con esto, existen mecanismos de compensación como son los empleados que trabajan más tiempo, los compañeros que realizan las tareas del trabajador enfermo o la contratación temporal que pueden disminuir las pérdidas reales de producción debido a la enfermedad, y los efectos multiplicadores relacionados con el efecto negativo en la producción de los compañeros que pueden aumentarlas.
El objetivo del estudio fue estimar los mecanismos de compensación y los efectos multiplicadores sobre las pérdidas de productividad. La estimación se hizo a través de la recogida de datos mediante una encuesta en línea usando medidas autoinformadas sobre la pérdida de productividad (año 2015) de un total de 877 personas (15-65 años) de los Países Bajos que trabajaban al menos 12 horas/semana y que habían estado ausentes o experimentando problemas de salud mental o física mientras estaban en el trabajo, en las últimas 4 semanas. La encuesta incluyó preguntas sobre las características laborales, los ingresos netos, ausentismo y presentismo, mecanismos de compensación y efectos multiplicadores, además de datos demográficos y nivel de estudios de los encuestados.
Los resultados del estudio mostraron que la media de edad de los encuestados fue de 45 años y que un 56,4% eran mujeres. La media de horas semanales de trabajo remunerado fue de 31,7 y un 94,3% tenían compañeros en su trabajo.
En relación con las pérdidas de productividad durante las 4 semanas, del total de la muestra, un 24% experimento ausentismo y el 54% presentismo derivando en un promedio de 48,7 h (2 a 800 h) y una media de 10,7 h (0 a 259 h) de trabajo perdido, respectivamente. La pérdida de productividad promedio fue 30,3 h (0 a 800 h) por semana, representando el 24% del total de horas de trabajo de la muestra.
La prevalencia de los mecanismos de compensación mostró que en el 41% de los encuestados los compañeros se hicieron cargo del trabajo durante la jornada laboral y el 5% fuera de la jornada, un 27% recuperó las horas durante su jornada y un 10% fuera de ella. En un 10% aproximadamente, la empresa contrató personal temporal y en un 18% el trabajo perdido no fue compensado. Esto supuso un promedio de 24,4 h (76,4% de total) de trabajo perdido compensadas a través de los mecanismos de compensación.
Al analizar los efectos multiplicadores, el 23% (207) de los encuestados reflejaron que su ausentismo y presentismo afecto a la productividad de sus compañeros, con una pérdida del 27% de su trabajo (que correspondería a un efecto multiplicador de 2,1). Esto derivó en una pérdida de productividad media de 31,1 h, que se incrementaría a 63,3 h al aplicar el efecto multiplicador. El 56% de los encuestados indicaron que un compañero había estado enfermo en las 4 semanas anteriores, pero que podía hacer su trabajo con normalidad y un 9% habían experimentado pérdidas de productividad (31% de su trabajo) por esta ausencia (duración promedio de 7,3 días). En un 12% de los encuestados, cuando un compañero estuvo enfermo, el trabajo se paralizó completamente.
Los autores concluyeron que los resultados del estudio mostraron la importancia de considerar los mecanismos de compensación y los efectos multiplicadores al estimar la pérdida de productividad real por ausentismo y presentismo, así como los costes debido a la enfermedad.
Comentario
Los análisis de evaluación económica deben tener en cuenta no solo los efectos relacionados con la salud de los pacientes y sus costes, sino también los cambios generados en la productividad a causa de la enfermedad. Incluir la perspectiva social, además de enriquecer su metodología, aporta valor en los procesos de toma de decisiones. Aunque las Agencias de Evaluación de Tecnologías Sanitarias recomiendan incluir los costes sociales en las evaluaciones económicas, su uso es escaso, siendo la perspectiva del financiador la más utilizada, al menos en España.
Actualmente, en las evaluaciones económicas la pérdida de productividad generada por el ausentismo y presentismo a causa de una enfermedad se calcula multiplicando el número de días de trabajo perdidos por la remuneración salarial estimada. En este estudio, los autores enfatizan en que los costes de productividad reales pueden diferir si se contemplan mecanismos de compensación o efectos multiplicadores relacionados con el reparto de tareas a los compañeros o la contratación de personal temporal, entre otros, para cubrir la ausencia. La evidencia científica sobre ello es escasa y debería de profundizarse más sobre este tema.
Coste-efectividad de la vacunación universal infantil frente a la Hepatitis A en España: un enfoque dinámico
La hepatitis A es una infección vírica del hígado que afecta a más de 100 millones de personas y causa 15 000 muertes anuales en todo el mundo. Su incidencia, relacionada con su modo de transmisión (por vía oral o fecal) es mayor en países con malas condiciones higiénico-sanitarias. En la actualidad, España es un país de baja endemia, pero en los últimos años se ha incrementado en la población masculina, en concreto en los hombres que tienen sexo con hombres. La población joven es más susceptible de contraer el virus pudiendo agravar la enfermedad a largo plazo y derivar en un incremento de la carga de la enfermedad. La estrategia de vacunación frente a la hepatitis A recomendada por la OMS se fundamenta en la inmunidad selectiva de grupos de riesgo, pero en Cataluña y Ceuta está incluida dentro del calendario vacuna infantil.
El objetivo del análisis fue evaluar si la introducción de un programa de vacunación universal infantil frente a la hepatitis A en España es una opción coste-efectiva desde la perspectiva del sistema nacional de salud. Se utilizó un modelo dinámico determinístico SEIRV y un árbol de decisión, con un horizonte temporal de toda la vida (lifetime) y ciclos semanales para comparar tres estrategias: no vacunación, vacunación universal infantil con una dosis y con dos dosis (intervalo de tiempo de 6 meses). Se asume que la vacuna se administra al cumplir 1 año. Los estados del modelo son definidos como: a) susceptibles, individuos sanos que pueden ser infectados; b) expuestos, personas infectadas asintomáticas en periodo de incubación con capacidad de infectar a otras personas; c) infectivos, individuos infectados capaces de transmitir; d) recuperados, personas recuperadas de la enfermedad no transmisores (inmunes); e) vacunados, individuos vacunados protegidos frente a la enfermedad hasta que pierdan el efecto de la vacuna.
Solo se incluyeron costes directos sanitarios. El consumo de recursos sanitarios se calculó a partir del árbol de decisión, diferenciándose entre casos asintomáticos y sintomáticos (pueden ser hospitalización y requerir un trasplante de hígado en el estado fulminante o pueden ser ambulatorios).
Los parámetros incluidos en el modelo relacionados con la hepatitis A fueron: incidencia (Informes RENAVE), seroprevalencia, número de casos no informados (estimados a partir de datos de la literatura), tasa efectiva de contagio (determinada a través del algoritmo de minimización Random Particle Swarm Optimization), duración del efecto de la vacuna (10 años en una dosis y 14 en dos), probabilidad de complicaciones en casos asintomáticos (número de infectivos entre número de casos non informados). Los costes unitarios (€, 2018), las utilidades y desutilidades se obtuvieron de la literatura. Se realizaron análisis de sensibilidad con el precio, la duración, la efectividad de la vacuna y las desutilidades.
Los resultados del caso base mostraron una disminución de casos al introducir la vacunación infantil de la hepatitis A para ambos análisis, una y dos dosis frente a la no vacunación y un incremento en el coste promedio por individuo resultando una ratio coste-efectividad (RCEI) muy por encima del umbral de disponibilidad a pagar aceptado (25 000€/AVAC) (Tabla 1). Por tanto, los autores consideran que la estrategia de vacunación frente a no vacunación es no coste-efectiva.

Comentario
Las vacunas son una herramienta en la prevención de enfermedades y tienen una notable repercusión en la morbimortalidad, en especial en la infantil, y en la transmisión. La recomendación de su uso, basada principalmente en la prevalencia y la carga de la enfermedad, entra dentro de las estrategias de salud pública de las comunidades autónomas; esto provoca que no todas las autonomías tengan los mismos programas de vacunación. Las políticas de salud pública deberían basarse en evidencias científicas. En este sentido, una forma de evidenciar estas recomendaciones sería realizar evaluaciones económicas basadas en modelos estáticos o dinámicos que sirvan de ayuda para la toma de decisiones sobre estas intervenciones sanitarias. Por ejemplo, el análisis presentado se ha realizado basándose en las recomendaciones de la International Society for Pharmacoeconomics and Outcomes Research (ISPOR) sobre el uso de modelos dinámicos en los análisis coste-efectividad para simular las intervenciones que tienen un impacto directo en la transmisión de la enfermedad.
Aunque los resultados del análisis mostraron que la vacunación infantil de la hepatitis A en España no es coste-efectiva debido a su baja prevalencia, este estudio podría extrapolarse a países de alta endemia para mostrar sus beneficios clínicos y económicos a largo plazo. Por otro lado, sería interesante replicar el análisis para ciertas poblaciones, como por ejemplo los hombres que practican sexo con hombres, con prevalencias más elevadas. De esta forma, se podrían realizar recomendaciones específicas por subgrupos.
Plantas medicinales utilizadas para trastornos del sueño y la ansiedad (I)
Resumen
Los trastornos del estado de ánimo han experimentado un auge en los últimos años, pudiendo ocasionar un impacto significativo en la calidad de vida y el bienestar general de los individuos que los padecen. Estos trastornos generalmente se asocian con una peor calidad del sueño, lo que a su vez retroalimenta el estado negativo del ánimo.
Las plantas medicinales utilizadas en el tratamiento de trastornos de ansiedad y sueño suelen contener principios activos, como flavonoides, alcaloides y aceites esenciales, que han demostrado tener propiedades sedantes, ansiolíticas y relajantes. Estos compuestos pueden actuar sobre el sistema nervioso central promoviendo la relajación, reduciendo la excitabilidad y mejorando la calidad del sueño. Entre las plantas medicinales más comúnmente utilizadas para tratar estos trastornos se encuentran valeriana, pasiflora, manzanilla, lavanda y melisa, además de la hierba de San Juan, entre otras. Estas plantas se han utilizado durante siglos en diferentes culturas tradicionales, y en la actualidad, siguen despertando un gran interés en la comunidad científica, que busca comprender mejor su eficacia y mecanismos de acción.
Esta revisión se centrará en la Valeriana officinalis, una de las plantas medicinales más reputadas y utilizadas en medicina tradicional para el tratamiento del insomnio y la ansiedad, principalmente por sus propiedades sedantes y tranquilizantes.
Introducción
Los rápidos cambios sociales han provocado un aumento general de la presión psicológica y el estrés, sin olvidar los múltiples retos individuales a los que las personas se enfrentan, lo que da lugar a trastornos del estado de ánimo, cognitivos y conductuales, además de otros problemas relacionados. Estos trastornos, que afectan a un gran número de personas en todo el mundo, pueden tener un impacto significativo en la calidad de vida y el bienestar general de los individuos que los padecen, sin olvidar que los efectos del sueño no se limitan al propio organismo, sino que afectan el desarrollo y funcionamiento normal de un individuo en la sociedad (rendimiento laboral o escolar, relaciones sociales, seguridad vial, etc.). En los últimos años, se ha observado un creciente interés en el uso de plantas medicinales como alternativa natural para el tratamiento de trastornos del sueño y la ansiedad.
El insomnio es uno de los trastornos del sueño más preocupantes, afecta al 30% de la población mundial y se caracteriza por la incapacidad para conciliar el sueño y/o una duración inadecuada del mismo, acompañado de despertares repetidos durante la noche. Puede ser causado por varios factores que conducen a alteraciones del ritmo circadiano. Entre los principales mediadores implicados en la fisiología del sueño podemos citar noradrenalina, histamina, dopamina, glutamato y GABA, además de otros como serotonina (5-HT), orexina A y B, adenosina, acetilcolina (ACh) y melatonina.
Es un problema que, además, puede contribuir significativamente a la progresión de varios trastornos, algunos de ellos de tipo neurológico. Así, estudios recientes indican que el insomnio puede influir en la incidencia de enfermedades neurológicas como la enfermedad de Alzheimer, provocar ideas suicidas y estados de ansiedad, además de ser un factor de riesgo para la obesidad, la hipertensión y la diabetes mellitus.
En las guías actuales sobre el tratamiento del insomnio se recomiendan varias opciones con eficacia probada en la rectificación de los patrones de sueño de los pacientes, entre ellas, el uso de derivados de benzodiazepina y de los no benzodiazepínicos. Los agonistas de los receptores de benzodiazepinas, los antagonistas de los receptores de melatonina y orexina y los antagonistas de la histamina (antagonistas H1 selectivos como la doxepina) son los fármacos más comúnmente indicados para tratar el insomnio.
Hasta la fecha, los medicamentos habituales para el tratamiento del insomnio provocan efectos secundarios como somnolencia durante el día y, por tanto, alteraciones en las actividades que requieren la cognición y la conciencia. Además, en muchos casos, los pacientes se vuelven tolerantes a estos medicamentos, lo que conduce a un consumo significativamente mayor de los mismos, asociándose frecuentemente con agentes ansiolíticos.
La ansiedad puede ser una respuesta adecuada a situaciones estresantes, pero se considera un trastorno patológico cuando afecta al funcionamiento físico, psicológico y social cotidiano. El trastorno de ansiedad es una de las enfermedades mentales más frecuentes, que se caracteriza por una preocupación excesiva e incontrolable. El trastorno de ansiedad generalizada es el trastorno de ansiedad crónico más frecuente, cuya característica principal es la ansiedad persistente y excesiva durante al menos 6 meses. Presenta una prevalencia general considerable (3,8%-25%), más frecuente en mujeres (5,2%-8,7%), adultos jóvenes (2,5%-9,1%) e individuos con enfermedades crónicas (1,4%-70%).
A medida que aumenta la conciencia sobre los posibles efectos secundarios y la dependencia asociados con algunos de los medicamentos tradicionales utilizados para tratar la ansiedad y los problemas de sueño, se buscan enfoques más holísticos y menos invasivos. En este contexto, además de los medicamentos estándar y las intervenciones psicológicas, las plantas medicinales se presentan como una opción, basada en muchos casos en su larga historia de uso tradicional y en los posibles beneficios terapéuticos que ofrecen para tratar tanto el insomnio como problemas de ansiedad.
Las plantas medicinales utilizadas en el tratamiento de trastornos de ansiedad y sueño suelen contener principios activos, como flavonoides, alcaloides y aceites esenciales, que han demostrado tener propiedades sedantes, ansiolíticas y relajantes. Estos compuestos pueden actuar sobre el sistema nervioso central, promoviendo la relajación, reduciendo la excitabilidad y mejorando la calidad del sueño.
Entre las plantas medicinales más comúnmente utilizadas para tratar estos trastornos se encuentran valeriana, pasiflora, manzanilla, lavanda y melisa, además de la hierba de San Juan, entre otras. Estas plantas se han utilizado durante siglos en diferentes culturas tradicionales, y en la actualidad, siguen despertando un gran interés en la comunidad científica, que busca comprender mejor su eficacia y mecanismos de acción.
Aunque existe una creciente evidencia científica que respalda el uso de estas plantas medicinales para el tratamiento de la ansiedad y los trastornos del sueño, es importante tener en cuenta que su efectividad puede variar según el individuo y la formulación específica utilizada. Además, no hay que olvidar que es fundamental consultar con un profesional de la salud antes de iniciar cualquier tratamiento a base de plantas medicinales, especialmente si se está tomando de forma simultánea otros medicamentos o se tienen condiciones de salud preexistentes alteradas.
El empleo de productos naturales en el tratamiento del insomnio y la ansiedad constituye una alternativa eficaz y segura para el tratamiento de estos trastornos, con la ventaja de que no alteran la estructura del sueño, ayudando a recuperar en el individuo el patrón fisiológico del mismo.
Se incluirán en esta revisión las plantas medicinales útiles en el tratamiento del insomnio leve a moderado, de carácter generalmente transitorio, así como en la ansiedad leve o moderada acompañada de nerviosismo, cuyo uso está avalado científicamente.
Valeriana officinalis L.
Resumen
Valeriana officinalis L. (Figura 1) es una de las plantas medicinales más reputadas y utilizadas en medicina tradicional para el tratamiento del insomnio y la ansiedad, principalmente por sus propiedades sedantes y tranquilizantes. Su composición química es compleja, conteniendo iridoides, conocidos como valepotriatos, mono y sesquiterpenos, flavonoides, lignanos y alcaloides. Entre ellos, el ácido valerénico es uno de los principales responsables de la acción ansiolítica de la planta según se desprende de los numerosos estudios in vitro e in vivo realizados. La modulación de los receptores del ácido gamma-aminobutírico (GABA) parece ser el principal mecanismo molecular de su actividad. Además del ácido valerénico, también se ha propuesto que el ácido isovalérico, el didrovaltrato, el borneol y algunos lignanos contribuyen al efecto ansiolítico de la planta. Son necesarios más estudios clínicos con un diseño adecuado y estandarizado, así como más estudios preclínicos para seguir estudiando los mecanismos de acción.

Introducción
El género Valeriana, perteneciente a la familia Caprifoliaceae, contiene 289 especies, de las cuales, la más importante es Valeriana officinalis L. (conocida comúnmente como valeriana). Es una especie nativa de Europa y Asia occidental, que crece tanto en lugares húmedos como secos. Su cultivo se ha introducido en el Este de Norteamérica.
El término valeriana procede del latín valere, que se puede traducir como “tener buena salud”.
Se encuentra recogida en la Real Farmacopea, la cual indica, junto con sus controles de calidad, que la droga “consiste en los órganos subterráneos de Valeriana officinalis L. s.l., comprendiendo el rizoma, las raíces y los estolones cuidadosamente desecados a una temperatura inferior a 40ºC. Debe contener como mínimo 5 ml/kg de aceite esencial”.
Desde el punto de vista de su morfología, la valeriana es una planta con algunas diversidades. En el segundo año de crecimiento, la planta forma un tallo floral redondo, surcado y hueco, de 80 a 120 cm de altura y ramificado en la parte superior. Las hojas son pinnadas, lanceoladas, de color verde pálido y se unen en pares a cada lado del tallo. Los tallos terminan en umbelas muy ramificadas, con flores muy pequeñas de color blanco y rosa pálido. Posee un rizoma y una raíz con muchas raíces secundarias y estolones.
La droga la constituye el rizoma con raíces fasciculadas, de 1,5 a 2,5 mm de diámetro.
Las raíces de V. officinalis se han usado como sedante en medicina tradicional en Europa desde tiempos antiguos. Ya en la antigua Grecia y Roma, Galeno e Hipócrates utilizaban esta planta para tratar diversas dolencias, como problemas digestivos y enfermedades del tracto urinario, pero también se empleaba en el siglo XVI para tratar trastornos como la aceleración del ritmo cardiaco, el dolor de cabeza y el nerviosismo.
Tradicionalmente se ha empleado en casos de ansiedad, excitabilidad e insomnio y como antiespasmódico. Asimismo, se ha utilizado en cólicos intestinales, dolores reumáticos, dismenorreas; por vía tópica en cortaduras, pequeñas inflamaciones y para el acné. La medicina tradicional china incluye además su utilidad en resfriados, contusiones y problemas de la menstruación.
Además de V. officinalis, se utilizan otras especies del género para la obtención de principios activos, entre ellas, principalmente, V. edulis Nutt. spp. procera o valeriana mejicana y V. walli-chii DC. o valeriana de la India. La medicina tradicional china y japonesa utiliza V. fauriei, mientras que la medicina tradicional africana emplea V. capensis.
Composición química
La composición química de la raíz de valeriana incluye principalmente sesquiterpenos e iridoides, todos ellos compuestos de naturaleza terpénica. Contiene aceite esencial y sus derivados sesquiterpénicos (ácidos valerénicos), ésteres epoxi iridoides (valepotriatos), alcaloides, flavonoides y lignanos, localizados principalmente en la raíz y el rizoma. Entre estos constituyentes, los ácidos valerénicos y los valepotriatos son considerados los principales responsables de su actividad.
Aceite esencial
El aceite esencial está compuesto por unos 150 constituyentes, entre los que se incluyen monoterpenos, sesquiterpenos y ácidos carboxílicos sesquiterpénicos menos volátiles. El borneol, principalmente en forma de éster (acetato de bornilo e isovalerato de bornilo), el canfeno, el alfa y el beta-pineno son los principales monoterpenos presentes en el aceite esencial de V. officinalis. Los sesquiterpenos que contiene son oxigenados e incluyen cetonas (valeranona), aldehídos (valerenal), ésteres (éster del valerianol), alcoholes (valerianol, alcohol kesílico), y ácidos (ácidos valerénico, acetoxivalerénico e hidro-xivalerénico), además de bisaboleno, cariofileno, pacifigorgiol y ledol.
Los ácidos valerénico (Figura 2), acetoxivalerénico e hidroxivalerénico son ácidos carboxílicos sesquiterpénicos menos volátiles presentes también en el aceite esencial. Los ácidos isovalérico e hidroxiisovalérico se liberan en los procesos de secado y almacenado de la planta, lo que confiere a la valeriana su olor característico (un aroma desagradable) que no se observa en la planta fresca.
Valepotriatos
Los valepotriatos son ésteres epoxi iridoides cuyo contenido total se encuentra generalmente entre el 0,5 y el 1,2%; entre ellos se encuentran valtrato (en una proporción que supone aproximadamente el 80% de los valepotriatos) (Figura 3), acevaltrato, dihidrovaltrato, isovaltrato, isovaleroxi-hidroxi-dihidrovaltrato. Son compuestos muy inestables, pudiendo descomponerse fácilmente por el calor, la humedad o incluso las variaciones del pH, por lo que solo se encuentran en la planta fresca. Sin embargo, existen pequeñas cantidades de estos compuestos cuando el material vegetal se deseca a una temperatura inferior a 40ºC. Al ser insolubles en agua, los valepotriatos solo podían obtenerse en preparaciones no acuosas. Aunque inicialmente se pensó que los valepotriatos eran los principios activos, se comprobó posteriormente que estos compuestos, al ser químicamente inestables, se degradan con facilidad, se absorben mal y no se encuentran en infusiones y tinturas. En cambio, sus productos de degradación, los baldrinales (aldehídos insaturados), se encuentran en dichas preparaciones y pueden explicar gran parte del efecto sedante de la valeriana. El baldrinal (Figura 4) y el homobaldrinal son los productos de degradación del valtrato y el isovaltrato respectivamente.
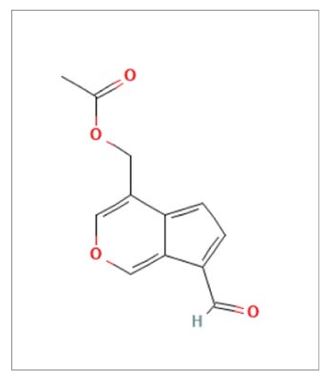
Otros componentes
Además del aceite esencial y los valepotriatos, ya mencionados, la planta contiene diversos compuestos bioactivos como aminoácidos, alcaloides, flavonoides y lignanos, entre otros. Entre los aminoácidos más importantes presentes en la planta podemos citar la arginina, la glutamina, la tirosina y el ácido gamma-aminobutírico (GABA).
En cuanto a los flavonoides, los principales presentes en V. officinalis son la linarina, la metilapigenina y la hesperidina. Los constituyentes de naturaleza alcaloídica incluyen chantinina, valerina, valerianina y actinidina. Entre los lignanos podemos citar el hidroxipinoresinol. Se ha reportado también la presencia de taninos.
Otros componentes de la valeriana son los ácidos cafeico y clorogénico, además del alfa-sitosterol.
Actividad farmacológica
El extracto de raíz de valeriana se utiliza desde hace mucho tiempo para tratar los trastornos del sueño, la ansiedad y el estrés. Entre los diversos neurotransmisores que intervienen en la patología de la ansiedad (GABA, norepinefrina y serotonina, neuropéptidos, como la colecistoquinina, la hormona adrenocorticotrópica, la hormona liberadora de corticotropina o el neuropéptido Y), la modulación de GABA parece ser el principal mecanismo implicado en el efecto de V. officinalis, tal como se desprende de la mayoría de los estudios realizados. Además de los efectos sedantes, hipnóticos y ansiolíticos que actúan mejorando el proceso del sueño, algunos estudios han demostrado su eficacia frente a la migraña, en procesos depresivos, en enfermedades neurodegenerativas o frente al cáncer.
A continuación, se mencionan los estudios in vitro/in vivo que analizan los mecanismos implicados en la actividad frente a trastornos del sueño y la ansiedad de esta especie.
Estudios in vitro e in vivo
Los datos publicados sobre la actividad farmacológica de Valeriana basados en estudios in vitro e in vivo son muy abundantes. Como resultado de los mismos se puede concluir que induce el sueño y mejora la calidad del mismo, reduciendo la frecuencia de los despertares, además de mostrar un efecto ansiolítico.
Los estudios más recientes indican que el ácido valerénico es uno de los principales responsables de la actividad ansiolítica, actuando a través de receptores GABAA, tal como se ha comprobado en diferentes modelos animales, entre ellos en un modelo de ovocitos de Xenopus laevis (comúnmente conocida como rana acuática). En este modelo se comprobó que este compuesto actúa estimulando subunidades α1β2 de GABA, siendo menos eficaz sobre las subunidades α4. Estudios similares han comprobado que la actividad ansiolítica de las raíces de valeriana está directamente relacionada con la cantidad de ácido valerénico presente en las mismas, ya que las fracciones que contenían una cantidad elevada del mismo provocaban una activación más intensa sobre los receptores GABAérgicos mencionados.
Estudios realizados en ratones macho CD-1, empleando la prueba del laberinto, confirman que el ácido valerénico es el principal responsable del efecto ansiolítico de V. officinalis, confirmando que este efecto se realiza a través de su acción sobre los receptores GABA.
El efecto del extracto de valeriana sobre la ansiedad y el estrés también se ha estudiado en otros modelos in vivo, como el pez cebra (Dario rero), empleando como modelo experimental un ensayo de preferencia por la oscuridad/luz. Los datos obtenidos indican que el extracto de raíz de valeriana y el ácido valerénico poseen un notable efecto ansiolítico, manifestado a través del control de los cambios de comportamiento de los peces, que evitaban el espacio luminoso y preferían mantenerse en el espacio oscuro. Los autores indican que este efecto está mediado por la modulación de la neurotransmisión de glutamato a través de receptores de glutamato metabotrópicos (mGluR I, II, 1/5, 2/3).
Diversos estudios in vitro, realizados tanto con el extracto de raíz de valeriana como con el ácido valerénico, muestran efectos GABAérgicos. Así, estudios realizados comparativamente con el agonista GABAA muscimol, concluyeron que el ácido valerénico es el principal responsable de la acción ansiolítica del extracto de raíz de valeriana y que esta acción se realiza por unión al receptor GABAA a través de la subunidad β2/3. Los datos apuntan también que la unión del compuesto se realiza con los residuos de aminoácidos β3N265, β3F289, β3M286 y β3R269 localizados en la subunidad β3.
Además, estudios realizados en ratones, indican que el valerenol contribuye, junto con el ácido valerénico, al efecto ansiolítico del extracto de la raíz.
De forma similar, se comprobó que el extracto acuoso de V. officinalis provocaba la liberación de [3H]-GABA en sinaptosomas aislados de la corteza cerebral de rata. Este efecto ansiolítico, mediado por modulación de GABA, ha sido confirmado para los extractos metanólico, etanólico y de acetato de etilo de la raíz, inhibiendo los dos primeros los potenciales postsinápticos inducidos en preparaciones de cerebro de rata, a una concentración de 0,1-15 mg/mL, mientras que el efecto del extracto de acetato de etilo (1-10 mg/mL) no fue significativo sobre los citados potenciales.
Por otra parte, varios estudios indicaron que el efecto ansiolítico podría deberse a diferentes componentes del extracto la de raíz y no solo al ácido valerénico, entre ellos, los aminoácidos presentes en el mismo.
Recientemente se ha realizado un estudio mediante técnicas de cribado in silico con varios componentes de V. officinalis. El estudio examinó el potencial inhibidor de los compuestos ácido isovalérico, didrovaltrato, acetoxivaleranona, acetocivaltrato, valtrato, isovaltrato, mertenil isovaltrato, valeranona, valerianol, homobaldrinal, baldrinal, ácido valerénico, ácido acetoxivalerénico, ácido hidroxivalerénico, kessano, acetato de valerenilo, valerenal y valeranol frente a la GABA aminotransferasa. De todos los compuestos ensayados in silico, solo el ácido isovalérico y el didrovaltrato inhibían la GABA aminotransferasa en el modelo computacional tridimensional desarrollado, si bien con una actividad menor que el ácido valproico y la vigabatrina, utilizados como fármacos de referencia. Se determinó que Lys357 era el residuo de aminoácido clave de unión en el punto activo. Los autores llegaron a la conclusión de que el marcado efecto ansiolítico de V. officinalis podría deberse a interacciones sinérgicas o aditivas entre sus componentes. De hecho, el borneol, monoterpeno presente en la raíz, ha mostrado potencial modulador de los receptores GABAA, de forma que, a la concentración de 1,5 mM, tanto el (+) como el (-) borneol fueron capaces de activar los receptores GABAA en porcentajes del 89% y el 84%, respectivamente.
Mecanismo de acción
Debido al uso histórico de la valeriana como sedante, anticonvulsivante, para el tratamiento de la migraña y como analgésico, la mayor parte de la investigación científica básica se ha dirigido al estudio de la interacción de los componentes de la valeriana con el sistema receptor del neurotransmisor GABA, tal como se recoge en el apartado anterior. El mecanismo de acción preciso de la valeriana en general, y como sedante suave en particular, sigue siendo desconocido.
Los extractos de valeriana y algunos de sus componentes, principalmente el ácido valerénico, han mostrado afinidad por el receptor GABAA, pero aún se desconoce el mecanismo de acción exacto, aunque en los últimos años se ha descrito un sitio de unión específico en los receptores GABAA con afinidad nM para el ácido valerénico y el valerenol. Ambos agentes potenciaron la respuesta al GABA en múltiples tipos de receptores GABAA recombinantes, datos avalados por estudios que indican que una mutación puntual en la subunidad beta2 o beta3 de los receptores recombinantes redujo de forma muy significativa la respuesta al fármaco. In vivo, el ácido valerénico y el valerenol tienen actividad ansiolítica marcada en el modelo experimental de laberinto elevado plus maze y en la prueba de elección luz/oscuridad en ratones.
Las neuronas que expresan receptores GABAA beta-3 parecen ser un sustrato celular importante para la acción ansiolítica de los extractos de valeriana, ya que, se ha obserado que ratones con mutaciones puntuales beta3, la actividad ansiolítica del ácido valerénico es nula. Como se ha comentado anteriormente, el ácido valerénico es un modulador de los receptores GABAA, ello implica que esta molécula y sus derivados activos, el ácido acetoxivalerénico y el ácido hidroxivalerénico, tienen que atravesar la barrera hematoencefálica e interactuar con este receptor en el cerebro para ejercer su acción. A fin de determinar el mecanismo implicado, el transporte de estos ácidos terpénicos se comparó con la permeabilidad del modulador GABAA diazepam, que se sabe que penetra en el sistema nervioso central transcelularmente por difusión pasiva. Los estudios realizados al respecto son muy escasos, indicando que probablemente estos compuestos presentes en valeriana solo pueden atravesar la barrera hematoencefálica mediante un sistema de transporte aún desconocido y no por difusión pasiva transcelular.
Estudios clínicos
Diferentes estudios clínicos han demostrado los efectos de la valeriana sobre la estructura del sueño y en la percepción subjetiva del sueño de los pacientes con insomnio.
A principios de la década de 1980 se empezaron a publicar numerosos estudios clínicos con preparaciones de raíz de valeriana (extracto acuoso, extracto etanólico o material vegetal triturado). Sus resultados confirmaron que los extractos hidroalcohólicos tienen un efecto clínico sobre los trastornos del sueño, especialmente en pacientes de edad avanzada, confirmándose que los constituyentes presentes y, por tanto, responsables de la actividad son los iridoides, el aceite esencial (monoterpenos y sesquiterpenos) y los flavonoides. Las observaciones clínicas indican que para que el tratamiento tenga el efecto esperado, debe durar varias semanas. En base a todo ello, la Agencia Europea del Medicamento publicó la monografía sobre la raíz de valeriana, con la categoría “uso bien establecido” y la indicación “para el alivio de la tensión nerviosa leve y los trastornos del sueño” y para la categoría “uso tradicional” la indicación “para el alivio de los síntomas leves de estrés mental y para ayudar a dormir”. Ambas indicaciones están claramente relacionadas con los efectos in vitro sobre el sistema GABAérgico descritos anteriormente.
Posteriormente, los estudios clínicos publicados pueden ser catalogados en dos grupos: los que contienen raíz triturada y los que se basan en el extracto acuoso-etanólico. Entre los ensayos realizados cabe mencionar un estudio llevado a cabo durante dos semanas en 16 mujeres y 4 hombres voluntarios (43 a 72 años), con diagnóstico de depresión mayor o trastorno primario del sueño. Para el estudio se pidió a los pacientes que continuaran con todos los medicamentos concomitantes, incluidos los sedantes prescritos, en su dosis inicial durante las 2 semanas de duración del ensayo. Se les indicó que tomaran una cápsula de raíz de valeriana (470 mg) cada noche, 30 a 60 minutos antes de acostarse. Esta posología fue aumentada a tres cápsulas durante la segunda semana del ensayo. Los resultados mostraron que el efecto hipnótico subjetivo de la valeriana fue superior en la semana 2 que en la 1. La mayoría de los pacientes (80%) consideraron que la valeriana fue al menos “moderadamente” útil, mientras que el 30% la consideró “extremadamente” útil. Ninguno de los pacientes atribuyó efectos secundarios a la valeriana.
En un estudio de diseño prospectivo, triple ciego, aleatorizado, controlado con placebo se comparó la eficacia de las cápsulas de valeriana (400 mg de raíz seca, 0,58 mg de contenido de ácido valerénico) sobre la calidad del sueño y la gravedad de los síntomas en pacientes que padecían el síndrome de piernas inquietas, con manifestación de síntomas graves (38,9 %) o muy graves (19,4 %). Los pacientes (37 años, con edad media de 50 años) recibieron dos cápsulas de valeriana o un placebo durante ocho semanas. La calidad del sueño se evaluó mediante el índice de calidad del sueño de Pittsburgh y la somnolencia mediante la escala de somnolencia de Epworth. Todos los pacientes que tomaron valeriana experimentaron una mejora en la calidad del sueño, su latencia y duración, así como en la gravedad del síndrome de piernas inquietas durante el transcurso del estudio.
Los estudios realizados analizando los efectos de valeriana sobre el insomnio, usando parámetros de sueño tanto objetivos como subjetivos, concluyeron que solo los pacientes que habían recibido dosis múltiples mostraron un aumento significativo en el sueño. En otro ensayo clínico con pacientes con insomnio, se comprobó un efecto similar cuando los pacientes recibieron valeriana u oxazepam.
En la misma línea, se han realizado diversos estudios sobre el efecto de valeriana en la ansiedad provocada ante procedimientos quirúrgicos de diversa índole. En uno de ellos se evaluó la eficacia de la raíz (dosis única oral de 100 mg) en 20 voluntarios (12 mujeres y 8 hombres, rango de edad entre 17 y 31 años), midiendo el grado de ansiedad del paciente mediante cuestionarios validados y parámetros físicos (frecuencia cardiaca y presión arterial sistólica y diastólica). Como resultado se concluye que la administración de raíz de valeriana tuvo un efecto mayor en el control de la ansiedad que el placebo.
Un estudio prospectivo, aleatorizado, doble ciego, incluyó a 20 pacientes (11 mujeres y 9 hombres, edad media de 23 años) con indicación de extracción bilateral de los molares mandibulares que requerían osteotomía, determinó que aquellos pacientes que recibieron por vía oral cápsulas que contenían extracto de valeriana (100 mg) antes de los procedimientos quirúrgicos redujeron la frecuencia cardiaca, la presión arterial y la frecuencia respiratoria frente a los pacientes administrados con midazolam (15 mg), no observándose diferencias estadísticamente significativas en la saturación de oxígeno.
Siguiendo con el empleo de valeriana relacionado con procesos quirúrgicos, un estudio reciente, realizado en 76 pacientes sometidos a cirugía de injerto de arteria coronaria, comparó el efecto del extracto de raíz de valeriana (530 mg) frente a placebo, concluyendo que los pacientes del grupo de valeriana mejoraron significativamente la calidad del sueño. Ambos grupos habían tomado desde tercera noche después de la cirugía, 2 h antes de dormir y durante 30 noches después de la cirugía el respectivo tratamiento.
También se han evaluado diversos parámetros neuropsiquiátricos (sueño, ansiedad, depresión, pensamientos suicidas y psicosis) en un ensayo clínico piloto aleatorizado, doble ciego, controlado con placebo, en 51 pacientes con VIH (17 mujeres y 24 hombres), incluidos en dos grupos: valeriana (n = 25, edad media 36 años) o placebo (n = 26, edad media 34 años); además, recibían tratamiento antiviral con el fármaco efavirenz. Los parámetros neuropsiquiátricos mencionados fueron evaluados en la semana 0 y la 4 utilizando cuestionarios validados (Escala de calificación de depresión de Hamilton, Escala de calificación de ansiedad de Hamilton, Escala de síndrome positivo y negativo, Ideación suicida positiva y negativa, y el Inventario de Calidad del Sueño de Pittsburg). Los pacientes incluidos en el grupo de valeriana recibieron una cápsula (530 mg de polvo de raíz de valeriana) todas las noches durante 1 hora antes de acostarse. Como conclusión, los pacientes que recibieron valeriana mejoraron significativamente el sueño y la ansiedad, además, los pensamientos suicidas mejoraron de manera poco significativa, mientras que no se detectaron cambios en los síntomas de psicosis.
Valeriana ha demostrado, así mismo, ser eficaz frente a pacientes con trastorno obsesivo-compulsivo con diferencia significativa entre el extracto y el placebo al final del tratamiento.
Thomas et al., realizaron un estudio aleatorizado, controlado con placebo, doble ciego, con objeto de determinar los efectos de una dosis única sobre los efectos de la sedación subjetiva y los parámetros de rendimiento del simulador de conducción en 40 participantes adultos sanos (edad media 28,3 años) (24 mujeres). Los participantes recibieron una dosis de valeriana (1600 mg de extracto de raíz que contenía 0,8% de ácido valerénico) o placebo. No hubo diferencias entre las condiciones de exposición en las puntuaciones medias obtenidas, manifestando los sujetos del grupo placebo que se sintieron “alertas” y los del grupo valeriana “más bien alertas”. No hubo diferencias en las puntuaciones medias de la Escala de somnolencia de Stanford, y los sujetos que recibieron valeriana manifestaron sentirse “relajados, despiertos, pero no completamente alertas, sensible” mientras que los que recibieron placebo manifestaron estar “funcionando a un alto nivel, pero no al máximo y todavía capaz de concentrarse”. No se observaron diferencias entre los grupos expuestos a valeriana y placebo en el tiempo medio de reacción en las pruebas realizadas, lo que permitió concluir que no se espera que una dosis única de administrada de valeriana tenga efecto sobre la conducción. Así pues, una dosis única de 1600 mg de valeriana, frecuentemente utilizada para tratar el insomnio, no parece afectar al rendimiento en el simulador de conducción.
El efecto sobre la ansiedad y el estrés se evaluó en un estudio clínico de cuatro semanas, doble ciego, aleatorizado y controlado con placebo con 64 voluntarios que padecían estrés psicológico. Recibieron cápsulas (100 mg de un extracto de raíz de valeriana que contenía 0,8% de ácido valerénico) o placebo tres veces al día. Se evaluaron los efectos sobre la ansiedad y los constructos psicológicos relacionados con el estrés. La muestra grupal de raíz de valeriana y los grupos de placebo mostraron mejoras significativas posteriores a la intervención en todas las escalas clínicas. En comparación con el grupo de placebo, el grupo de valeriana mostró resultados que se correlacionaron con una disminución significativa de la ansiedad.
La actividad ansiolítica también ha sido demostrada en un estudio realizado en estudiantes universitarios con edad media de 30 años, que participaron en un estudio cruzado, aleatorizado, doble ciego, a los que se administró un extracto de valeriana que contenía 0,8 mg de ácido valerénico. La administración de 3 cápsulas (900 mg de extracto en total) durante tres semanas y la determinación de parámetros de excitabilidad permitió concluir la actividad ansiolítica de valeriana.
El estudio de Mineo y colaboradores mostró que una sola dosis oral de extracto de Valeriana officinalis provocó una reducción significativa en la facilitación intracortical, un cambio asociado con una reducción de la ansiedad.
En relación con los trastornos del sueño asociados a la menopausia, los datos publicados son controvertidos, indicando algunos autores el efecto positivo sobre la calidad del sueño frente a placebo, mientras que otros autores manifiestan no haber observado mejoría significativa.
En pacientes con trastornos obsesivo-compulsivos, la valeriana mejoró significativamente la ansiedad y otros síntomas psiquiátricos, incluido el insomnio, pero los efectos no resultaron significativos frente al placebo.
Los datos de las pruebas clínicas anteriores sugieren que sus resultados también pueden interpretarse en el contexto de la acción GABAérgica de los constituyentes de la raíz de valeriana.
Teniendo en cuenta los resultados de los numerosos estudios clínicos realizados, se puede concluir que la valeriana tiene un efecto ansiolítico y, como consecuencia, mejora tanto la calidad como el tiempo de sueño, aunque se sería necesario realizar más estudios antes de que pueda recomendarse clínicamente.
Conclusiones
La valeriana (Valeriana officinalis L.) es una planta medicinal que se ha utilizado durante siglos debido a sus propiedades sedantes y ansiolíticas. La composición química de la valeriana incluye sesquiterpenos, iridoides (valepotriatos), alcaloides, flavonoides y aminoácidos libres. Los estudios realizados señalan que el ácido valerénico es el componente clave de sus efectos sobre el sistema nervioso central. No obstante, aunque se cree que los componentes sesquiterpénicos son los responsables de la mayoría de los efectos biológicos de la valeriana, es probable que varios componentes activos actúen de forma sinérgica para producir una respuesta clínica.
Los datos acumulados de los estudios científicos mencionados en esta revisión han demostrado el efecto ansiolítico y tranquilizante de la raíz de valeriana. La Agencia Europea del Medicamento (EMA) ha demostrado el “uso bien establecido” de la raíz de valeriana para los trastornos del sueño, el estrés mental y el alivio de la tensión nerviosa leve. Los estudios in vitro e in vivo proporcionan una base científica sobre los efectos mencionados para su uso tradicional. La EMA también informó de que su uso tradicional debería complementarse con un mayor número de estudios clínicos adecuadamente diseñados.
