Número 461, Marzo 2023
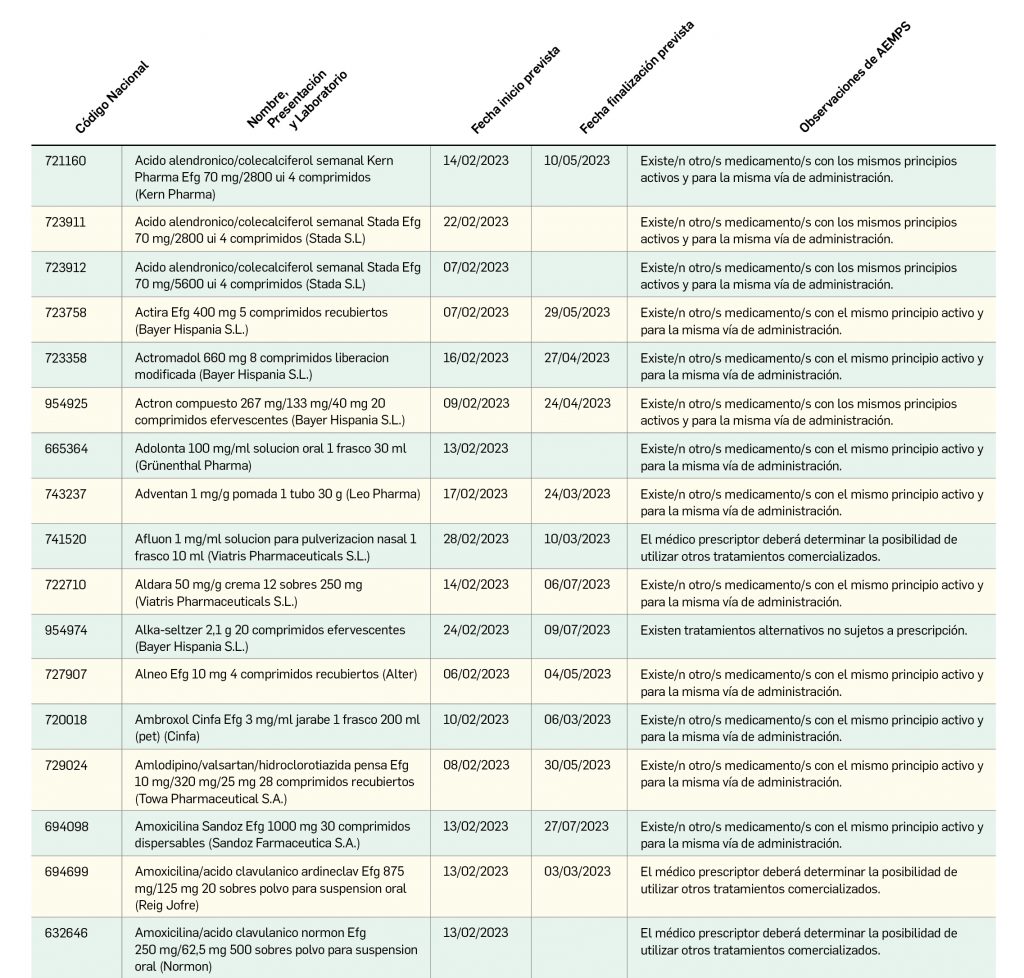
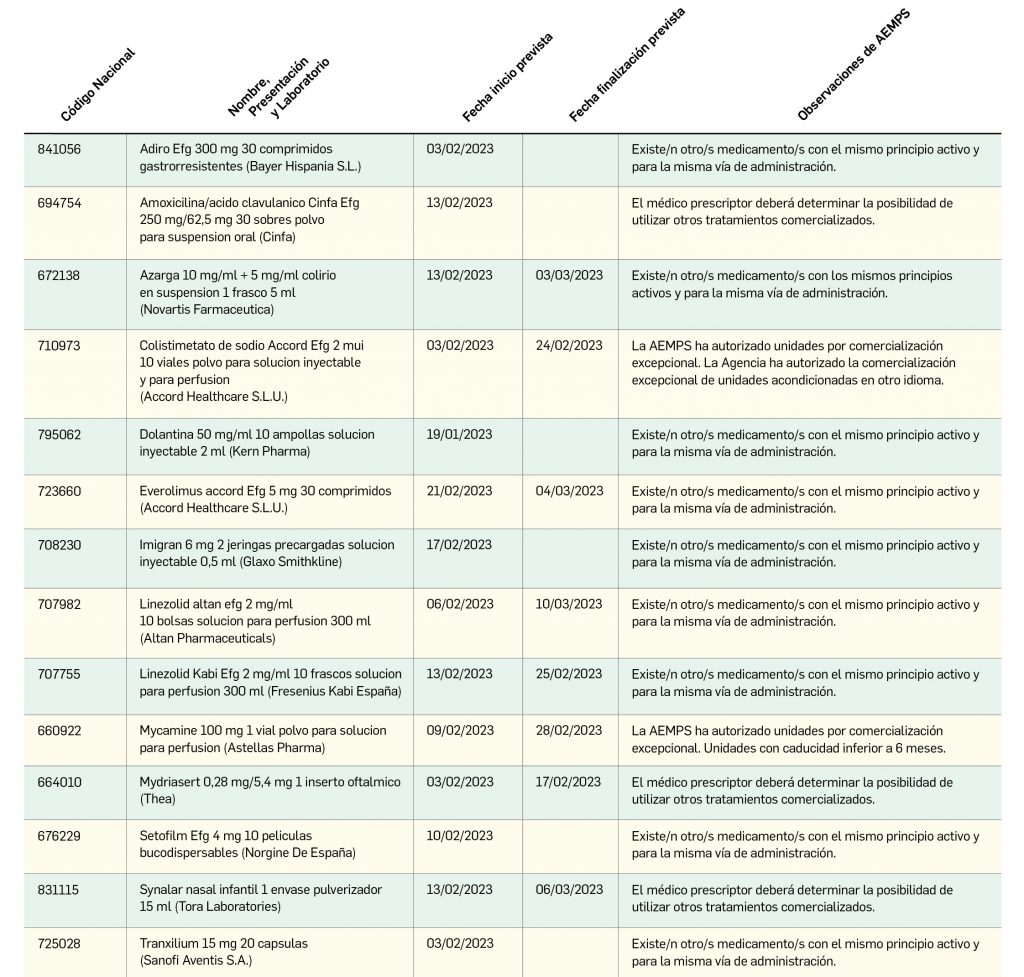
Listado de medicamentos con problemas de suministro publicado por la AEMPS, a fecha de cierre de este número. En BOT PLUS se puede encontrar la información completamente actualizada, al tratarse de una información que varía de forma continua.
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
La siguiente tabla recoge los medicamentos de terapia avanzada que han recibido autorización de comercialización en la UE durante en los últimos 10 años (2012-2023).
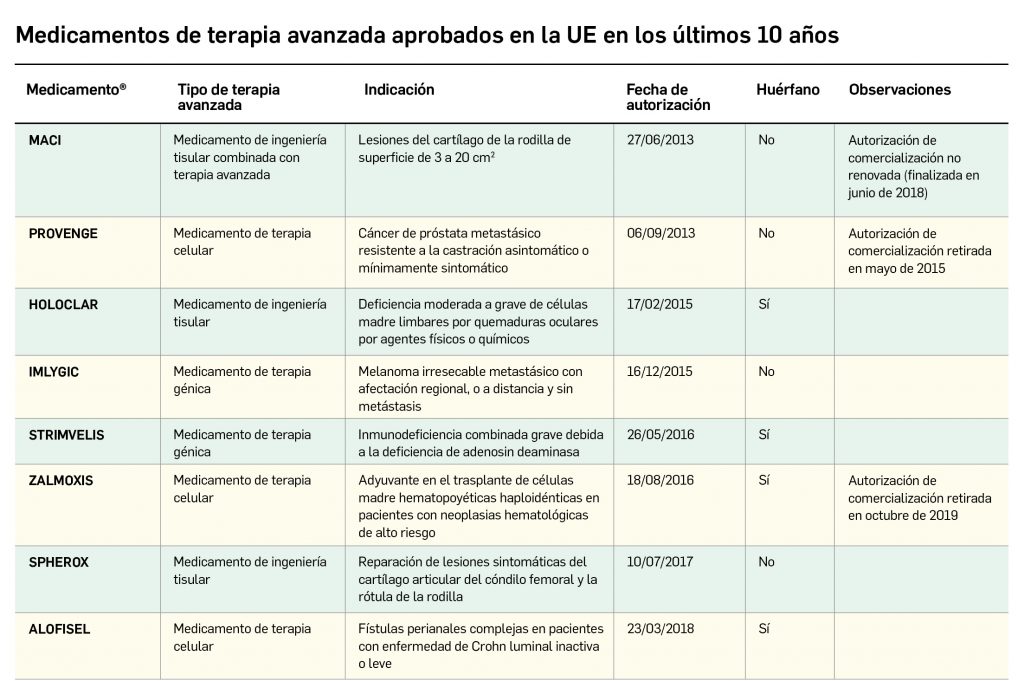
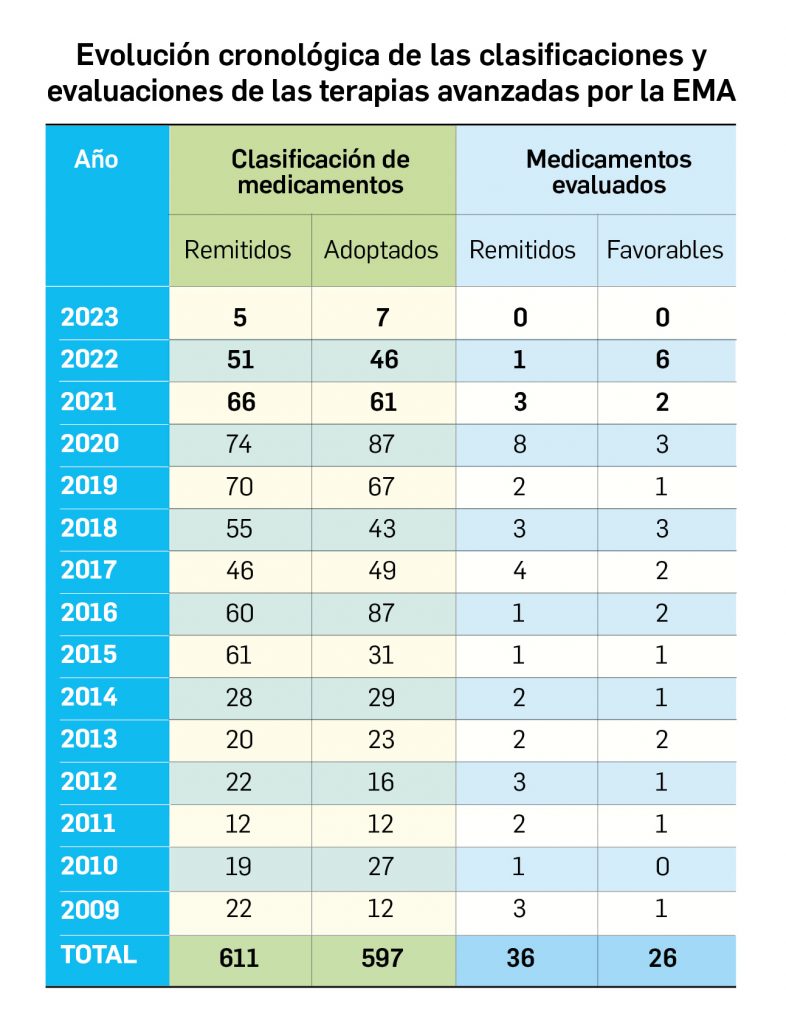
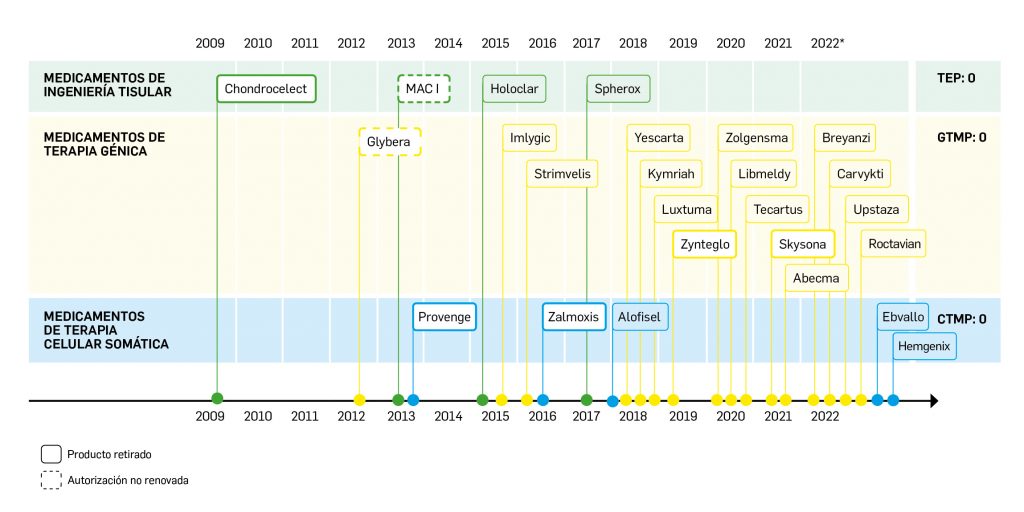
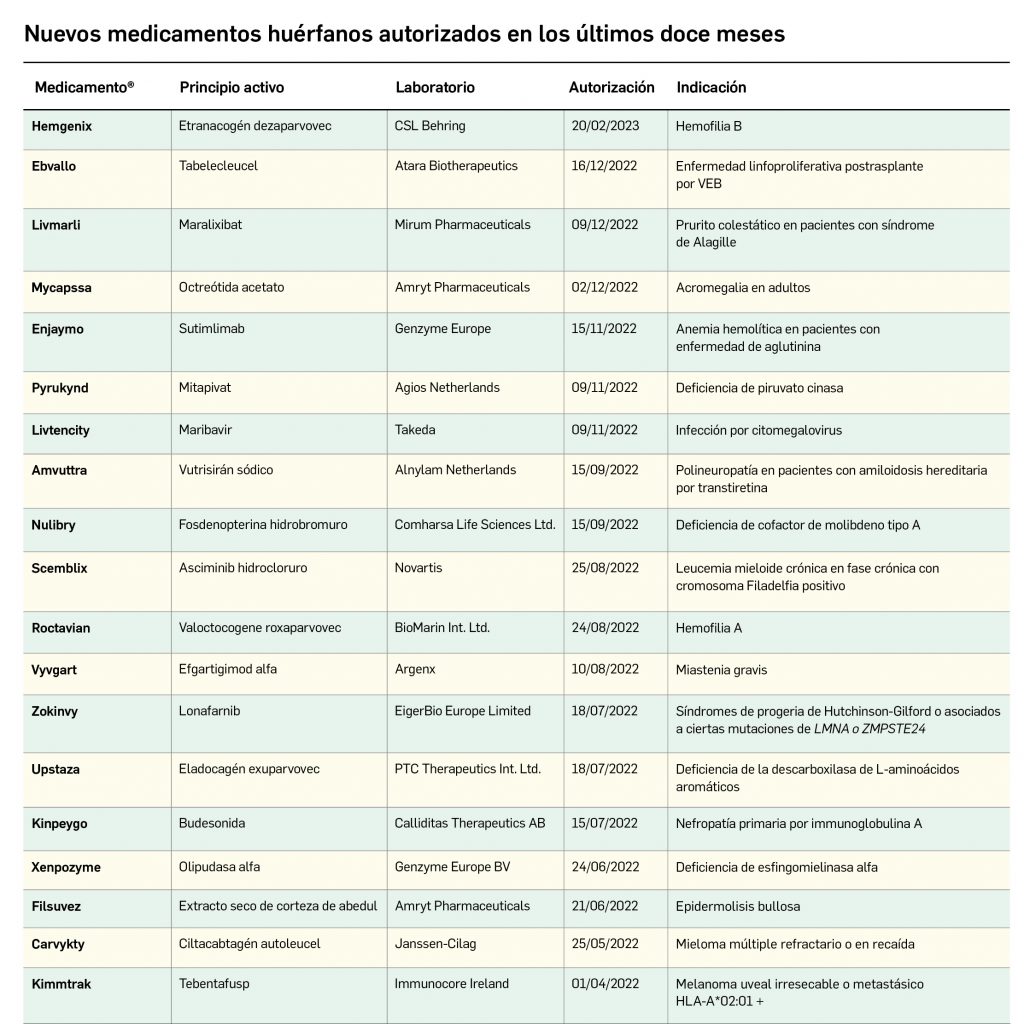
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas. La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios solo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
► Instituto de Salud Carlos III (Ministerio de Ciencia e Innovación):
Instituto de Investigación en Enfermedades Raras:
https://www.isciii.es/QuienesSomos/CentrosPropios/IIER/Paginas/default.aspx
CIBERER (Centro de Investigación Biomédica en Red de Enfermedades Raras): https://www.ciberer.es/
► Instituto de Mayores y Servicios Sociales (IMSERSO, Ministerio de Derechos Sociales y Agenda 2030):
http://www.imserso.es/imserso_01/index.htm
► Federación Española de Enfermedades Raras (FEDER): www.enfermedades-raras.org
► Asociaciones de pacientes en España: https://enfermedades-raras.org/index.php/asociaciones/nuestros-socios
► Agencia Europea de Medicamentos (EMA; Europea Medicines Agency). Apartado de Medicamentos Huérfanos (inglés):
https://www.ema.europa.eu/en/human-regulatory/overview/orphan-designation-overview
https://www.ema.europa.eu/en/committees/committee-orphan-medicinal-products-comp
► Comisión Europea: web oficial de la Comisión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://ec.europa.eu/health/rare_diseases/policy/index_es.htm
► Orphanet: Portal de información oficial de la Unión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://www.orpha.net/consor/cgi-bin/index.php?lng=ES
► Eurordis: Federación Europea de Asociaciones de Pacientes con Enfermedades Raras (español). http://www.eurordis.org/es
► Food & Drug Administration (FDA, Estados Unidos). Apartado de Medicamentos Huérfanos (inglés):
http://www.fda.gov/ForIndustry/DevelopingProductsforRareDiseasesConditions/default.htm
► Pharmaceuticals & Medical Devices Agency. Agencia de Medicamentos y Dispositivos Médicos, de Japón (inglés):
http://www.pmda.go.jp/english/index.html
La Agencia Europea de Medicamentos (EMA) ha publicado las conclusiones de su comité PRAC sobre la evaluación de los datos de seguridad respecto a toxicidad renal de omeprazol. Al igual que con otros fármacos de este grupo (esomeprazol, lansoprazol, pantoprazol, rabeprazol), el uso prolongado de omeprazol puede originar nefritis tubulointersticial aguda (NTI), un trastorno renal que puede derivar en una insuficiencia renal crónica, progresando a enfermedad renal terminal y hemodiálisis. El PRAC ha informado de la recomendación de suspender rápidamente el uso de omeprazol en caso de sospecha de NTI, ante signos y síntomas como disminución del volumen de orina o sangre en la orina y/o reacciones de hipersensibilidad (por ejemplo, fiebre, erupción cutánea y rigidez articular), debiéndose iniciar tratamiento adecuado.
La Agencia Europea de Medicamentos (EMA) ha publicado las recomendaciones acordadas en el Comité Europeo para la Evaluación de Riegos en Farmacovigilancia (PRAC, por sus siglas en inglés) en relación con la revisión de todos los datos acumulados sobre toxicidad renal asociada al uso de omeprazol (EMA, 2023).
El omeprazol es un inhibidor de la bomba de protones (IBP), grupo de fármacos indicados para tratar úlceras gástricas, úlceras duodenales, enfermedad por reflujo gastroesofágico y síndrome de Zollinger-Ellison como antiulcerosos.
Aunque el omeprazol, como otros IBP, es generalmente bien tolerado, se han notificado efectos adversos graves como insuficiencia renal. Este riesgo de alteraciones renales que se asocia a la utilización de los IBP ya es bien conocido desde inicio de este siglo XXI (Myers et al., 2001). Sucesivamente, algunos estudios habían detectado este potencial riesgo renal. De hecho, en 2016 apareció un estudio observacional en la revista científica Journal of the American Society of Nephrology, en el que tras analizar datos de 200 000 pacientes entre veteranos del ejército estadounidense, después de cinco años de seguimiento, comprobaron que los que consumían omeprazol tenían hasta un 96% más de riesgo de sufrir un problema renal, como insuficiencia renal, fallo renal grave o enfermedad renal crónica, incluido la progresión a enfermedad renal terminal y hemodiálisis (Xie et al., 2016).
A nivel epidemiológico podemos decir que, entre los fármacos más utilizados en España, el omeprazol es, sin duda, uno de los que se encuentra en las primeras posiciones. Datos publicados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) constatan que el grupo de los IBP es el mayoritario entre todos los antiulcerosos, con un 92% del total del consumo durante 2021, en pacientes ambulatorios, a través las recetas del SNS. Y dentro del volumen que representan los IBP en el año 2021, el omeprazol representa el 76,9%. En números absolutos, representa 102 DHD (Dosis Diarias Definidas por cada 1000 habitantes y día) durante 2021. Esto es, cada día de los 365 del año 2021, 102 de cada 1000 españoles estaban tomando 20 mg de omeprazol (AEMPS, 2021).
Este remedio en la lucha contra la acidez estomacal, ocasional o crónica, llegó como un avance muy importante en el campo de la medicina para combatir los efectos de nuestra digestión. Una vez aplicados los antihistáminicos-H2 en el mismo tipo de patologías, los IBP irrumpieron como potentes alternativas. Si bien su uso se considera seguro en ocasiones puntuales, incluso alcanzando categoría de uso sin receta o de medicamentos publicitarios en España (conocido como EFP hace años) o como OTC (over-the-counter) en otros países mucho tiempo antes que en España, la AEMPS no adoptó las decisiones liberalizadoras del Reino Unido, donde se autorizó como OTC el uso de omeprazol en comprimidos de 20 mg a principios del siglo XXI.
La utilización del omeprazol y otros IBP durante periodos de tiempo prolongados ha reportado efectos nocivos para la salud. Hasta ahora los más preocupantes tenían que ver con riesgo de osteoporosis, la aparición de pólipos gástricos, el aumento del pH gástrico por reducción de la acidez gástrica (que se asocia con un mayor riesgo de infecciones del tracto digestivo por Salmonella y Campylobacter), la deficiencia en la absorción de la vitamina B12 o de magnesio (hipomagnesemia). Así mismo, desde hace años se han ido notificando casos de nuevos efectos secundarios renales, tales como la nefritis tubulointersticial aguda (NTI), un trastorno renal que puede derivar en una insuficiencia renal grave, enfermedad renal terminal y hemodiálisis. Así mismo, otros países ya han incluido estas reacciones adversas (RAM) en la información de producto de los IBP, como India en 2020 (Madurga, 2020). En España, las fichas técnicas de los IBP (esomeprazol, lansoprazol, omeprazol, pantoprazol, rabeprazol) recogen la sección de Reacciones Adversas (RAM), entre los “trastornos renales y urinarios”, la “nefritis intersticial” como infrecuente; pero progresivamente se han ido incorporando datos sobre los posibles casos de nefritis tubulointersticial aguda.
En la revisión realizada en el PRAC a través del Estado miembro principal, responsable de la evaluación del PSUSA (Periodic Safety Update report Single Assessment), a la vista de los datos disponibles sobre nefrotoxicidad procedentes de la bibliografía y de notificaciones espontáneas, se considera que una relación causal entre el omeprazol y la nefritis tubulointersticial (con posible progresión a insuficiencia renal) es al menos una posibilidad razonable. El Estado miembro principal ha concluido que la información sobre el producto de los medicamentos que contienen omeprazol debía modificarse en consecuencia. Posteriormente, reunido el CMDh (Coordination Group for Mutual Recognition and Decentralised Procedures – Human), que coordina las acciones reguladoras para medicamentos de registro no centralizado, con expertos de las 27 agencias, está de acuerdo con las conclusiones científicas del PRAC. De conformidad con las conclusiones científicas para omeprazol, el CMDh considera que el balance beneficio-riesgo del medicamento o medicamentos que contienen omeprazol no se modifica por los cambios propuestos en la información del producto, en ficha técnica y en prospecto.
El CMDh concluye que se deben modificar las autorizaciones de comercialización de los medicamentos en el ámbito de la evaluación única de su IPS (informe periódico de seguridad). Por lo que se refiere a otros medicamentos que contienen omeprazol y que están actualmente autorizados en la Unión Europea, o vayan a ser objeto de futuros procedimientos de autorización en la UE, el CMDh recomienda que los Estados Miembros concernidos, así como el solicitante/titular de la autorización de comercialización, tengan en cuenta las consideraciones del CMDh.
En la Ficha Técnica o Resumen de las Características del Producto (SmPC, por sus siglas en inglés) de los medicamentos con omeprazol se debe incluir la información con la siguiente redacción. En la Sección 4.4, debe añadirse una advertencia como la siguiente:
Así mismo, en la Sección 4.8, deben añadirse o modificarse las siguientes reacciones adversas (RAM) bajo el “SOC Trastornos renales y urinarios” con una frecuencia de “raro”:
En el prospecto de los medicamentos con omeprazol, sean de prescripción médica, de 20 mg o 40 mg (Arapride®, Aulcer®, Belmazol®, Dolintol®, Gastrimut®, Losec®, Nuclosina®, Parizac®, Pepticum®, Ulceral®, Ulcesep® y EFG), como en aquellos medicamentos sin receta médica de 20 mg (Improzol®, Omekaste®, Omeprazol FarmaMabo®, Omeprazol HealthKern®, Omeprazol Pensavital®, Omeprazol Sandoz Care®, Omeprazol Stadapharm®, Omeprotect®), en la Sección 2, en la subsección “Advertencias y precauciones” debe añadirse lo siguiente:
Al tomar omeprazol, puede producirse inflamación en el riñón. Los signos y síntomas pueden incluir disminución del volumen de orina o sangre en la orina y/o reacciones de hipersensibilidad como fiebre, erupción cutánea y rigidez articular. Debe informar de dichos signos al médico que le trate.
El PRAC de la EMA ha iniciado una revisión de la seguridad de los medicamentos con pseudoefedrina. El procedimiento especial de revisión o arbitraje (referral, en inglés) se contempla en la legislación europea para actualizar la información de seguridad de un fármaco, de forma similar y simultánea, en toda la Unión Europea, con implicación de las 27 agencias nacionales. En breve se conocerán los resultados.
El Comité Europeo de Evaluación de Riesgos en Farmacovigilancia (PRAC, por sus siglas en inglés) ha iniciado el pasado 10 de febrero de 2023 un proceso de revisión de los datos de seguridad del fármaco pseudoefedrina. El PRAC ha iniciado la revisión de los medicamentos que contienen pseudoefedrina tras las preocupaciones sobre el riesgo del síndrome de encefalopatía posterior reversible (PRES, por sus siglas en inglés) y el síndrome de vasoconstricción cerebral reversible (RCVS, por sus siglas en inglés), enfermedades que afectan a los vasos sanguíneos del cerebro.
Los síndromes PRES y RCVS pueden implicar un suministro de sangre reducido (isquemia) al cerebro y pueden causar complicaciones graves y potencialmente mortales en algunos casos. Los síntomas comunes asociados con PRES y RCVS incluyen dolor de cabeza, náuseas y convulsiones. La citada revisión se lleva a cabo con nuevos datos de un pequeño número de casos de PRES y RCVS en personas que usan medicamentos que contienen pseudoefedrina, y que se notificaron en las bases de datos de farmacovigilancia y en la literatura médica.
La pseudoefedrina se toma por vía oral y se utiliza sola o en combinación con otros medicamentos para tratar la congestión nasal (nariz tapada), que puede ser una manifestación de procesos como resfriado, gripe o alergia. Actúa estimulando las terminaciones nerviosas para que liberen la sustancia química noradrenalina, que hace que los vasos sanguíneos se contraigan (estrechen), lo cual reduce la cantidad de líquido liberado de los vasos, resultando en menos inflamación y menos producción de mucosidad en la nariz.
Los medicamentos que contienen pseudoefedrina están autorizados en varios Estados miembros de la UE solos o en combinación con medicamentos para tratar los síntomas del resfriado y la gripe, como dolor de cabeza, fiebre, dolor o rinitis alérgica (inflamación de las fosas nasales) en personas con congestión nasal. Dentro de la UE, los medicamentos que contienen pseudoefedrina están disponibles con varios nombres comerciales. En España se dispone de medicamentos con solo este principio activo (Pseudoefedrina Farmalider® 30 mg chicles y Respidina® 120 mg comprimidos), pero también de unos 30 medicamentos en combinaciones con antihistamínicos (cetirizina, clorfenamina, ebastina, loratadina, triprolidina), analgésicos (ibuprofeno, paracetamol), antitusígenos (dextrometorfano), mucolíticos (guaifenesina) y, a su vez, mezclas de varios de estos grupos.
Los medicamentos que contienen pseudoefedrina tienen un riesgo conocido de eventos isquémicos cardiovasculares y cerebrovasculares (efectos secundarios que implican isquemia en el corazón y el cerebro), incluidos accidentes cerebrovasculares y ataques cardiacos. Las restricciones y advertencias ya están incluidas en la información del producto de los medicamentos para reducir estos riesgos, tanto en sus fichas técnicas como en sus prospectos.
Teniendo en cuenta la gravedad de los síndromes PRES y RCVS, el perfil de seguridad general de la pseudoefedrina y las indicaciones para las que se aprueban los medicamentos, el PRAC revisará la evidencia disponible y decidirá si las autorizaciones de comercialización de los medicamentos que contienen pseudoefedrina deben mantenerse, modificarse, suspenderse o retirarse en toda la UE.
La revisión (referral) de seguridad de los medicamentos que contienen pseudoefedrina se ha iniciado a petición de la agencia francesa de medicamentos (ANSM), en virtud del artículo 31 de la Directiva 2001/83/CE. La está llevando a cabo el Comité de Evaluación de Riesgos de Farmacovigilancia (PRAC), el responsable de la evaluación de los problemas de seguridad de los medicamentos de uso humano, que hará una serie de recomendaciones. A continuación, las recomendaciones del PRAC se remitirán al Comité de Medicamentos de Uso Humano (CHMP), también en la EMA, responsable de las cuestiones relativas a los medicamentos de uso humano, que adoptará un dictamen. La etapa final del procedimiento de revisión es la adopción por parte de la Comisión Europea de una decisión jurídicamente vinculante aplicable en todos los 27 Estados miembros de la UE.
Durante el tiempo que tarde en concluir la revisión del PRAC, se recuerda que la utilización de estos medicamentos con pseudoefedrina debe hacerse teniendo en cuenta lo descrito en sus fichas técnicas y prospectos. Se recuerda que algunos de estos medicamentos son sin receta médica, esto es, de dispensación y consejo farmacéuticos. En particular, se debe recordar que los síntomas comunes asociados con PRES y RCVS incluyen dolor de cabeza, náuseas y convulsiones. En su caso, se interrumpirá el tratamiento y se consultará con el médico.