Número 459, Diciembre 2022
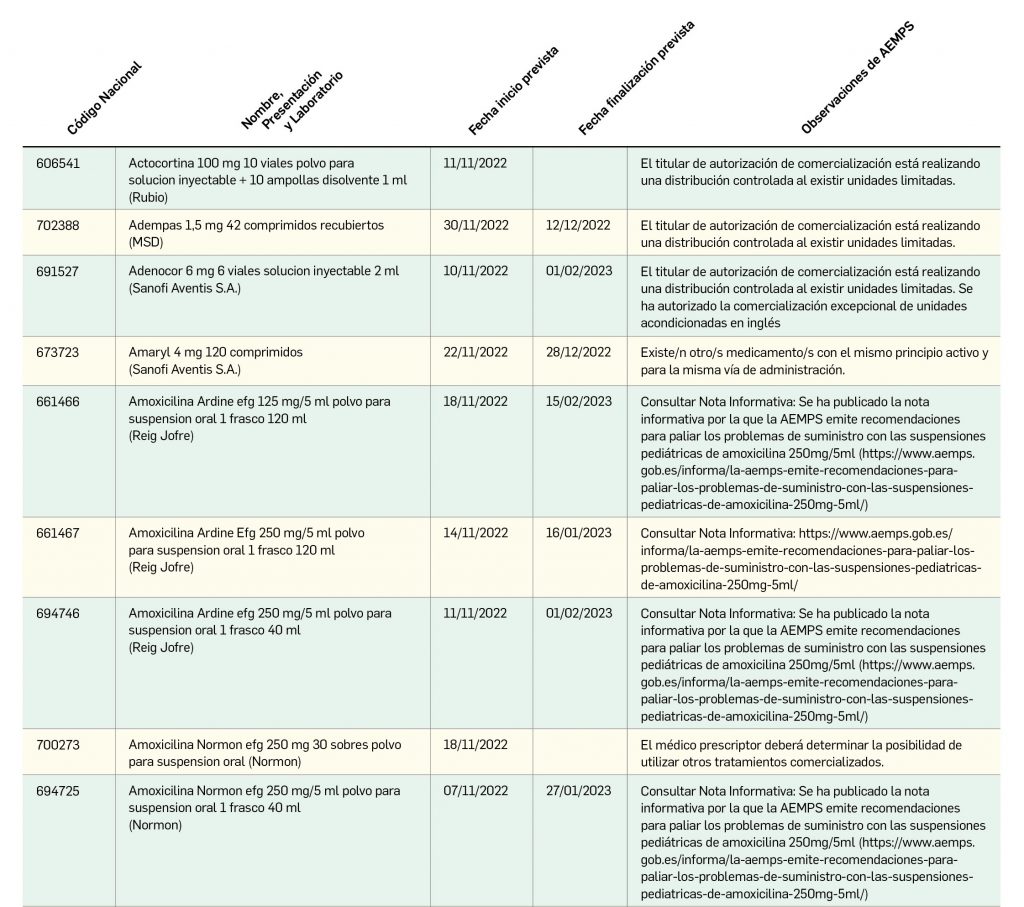
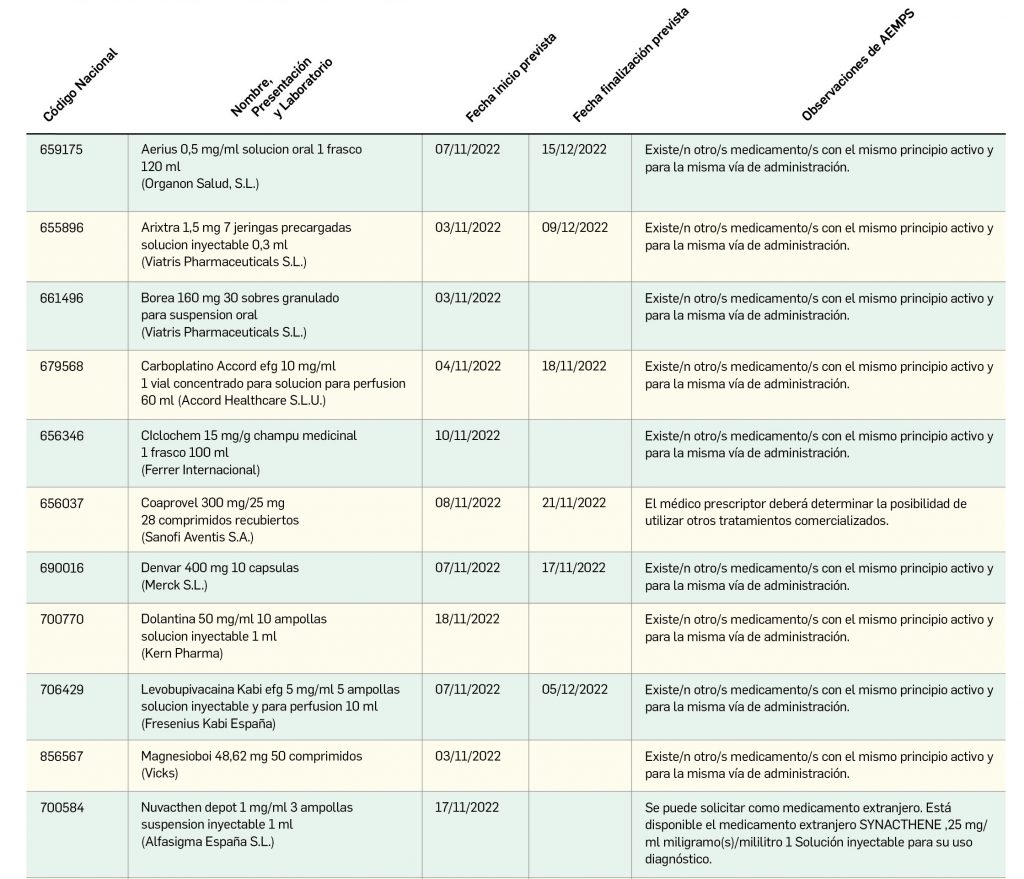
Listado de medicamentos con problemas de suministro publicado por la AEMPS, a fecha de cierre de este número. En BOT PLUS se puede encontrar la información completamente actualizada, al tratarse de una información que varía de forma continua.
La epilepsia, entre otros trastornos neurológicos, se relaciona con una activación descontrolada y excesiva de las neuronas. Esta actividad neuronal anómala suele producirse solo en una pequeña parte de las células cerebrales (el foco epileptógeno), por lo que de manera ideal el tratamiento debería dirigirse únicamente a aquellas que se encuentran afectadas. Sin embargo, los fármacos habitualmente utilizados con el objetivo de reducir la excitabilidad neuronal actúan de manera inespecífica, lo cual puede provocar diversos efectos secundarios; además, hasta un tercio de pacientes epilépticos no responde adecuadamente al tratamiento, lo que revela la necesidad de desarrollar nuevas terapias.
Para tratar de mejorar la especificidad y la eficacia del tratamiento, un grupo de investigadores ha desarrollado una terapia génica dirigida únicamente a las neuronas que presentan una actividad desregulada y provocan las crisis epilépticas. Usando líneas celulares y modelos animales de epilepsia han observado que la terapia no afecta a las neuronas cuya función fisiológica no está alterada. Esto lo han conseguido uniendo el gen KCNA1, que codifica para un canal de potasio denominado Kv1.1, a un promotor que regula su actividad (expresión), de modo que mientras la actividad neuronal es normal el gen es inactivo, pero, cuando se produce la hiperexcitabilidad característica de la epilepsia, se activa favoreciendo la entrada de iones potasio al interior celular, que resulta en la hiperpolarización de la neurona y la inhibición de su excitabilidad. Una vez que la actividad cerebral vuelve a su estado fisiológico normal, el gen KCNA1 se inactiva y la función neuronal se recupera.
El tratamiento tarda aproximadamente una hora en comenzar a hacer efecto, de modo que no serviría como tratamiento de una crisis, pero una vez administrado tiene efecto a largo plazo, por lo que podría prevenir futuros episodios. A pesar de que por ahora no ha sido testado en ensayos clínicos, los investigadores sugieren que el efecto podría permanecer durante toda la vida con una única administración. En el modelo murino utilizado, el tratamiento no afectó a funciones cerebrales como la memoria, el aprendizaje o la movilidad, ni aumentó el nivel de ansiedad.
Hasta que resultados similares se confirmen en humanos, el mayor interés de este trabajo reside en la inauguración de nuevas vías de tratamiento para otras enfermedades neurológicas, como el párkinson o las migrañas, mediante la modificación de la actividad neuronal específicamente dirigida a aquellas células con una función desregulada.
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
La siguiente tabla recoge los medicamentos de terapia avanzada que han recibido autorización de comercialización en la UE durante en los últimos 10 años (2012-2022).
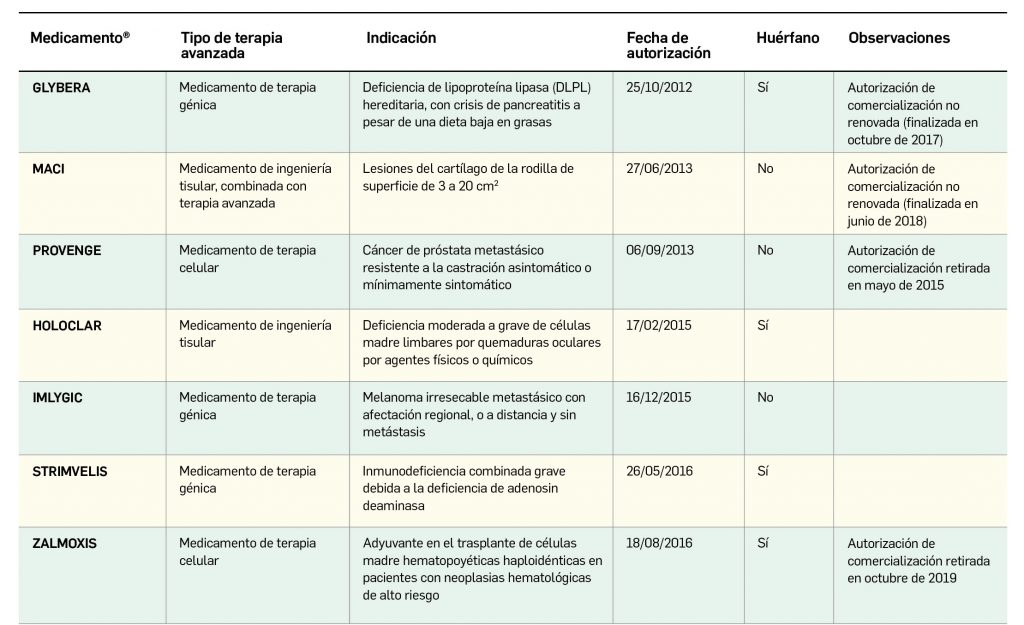
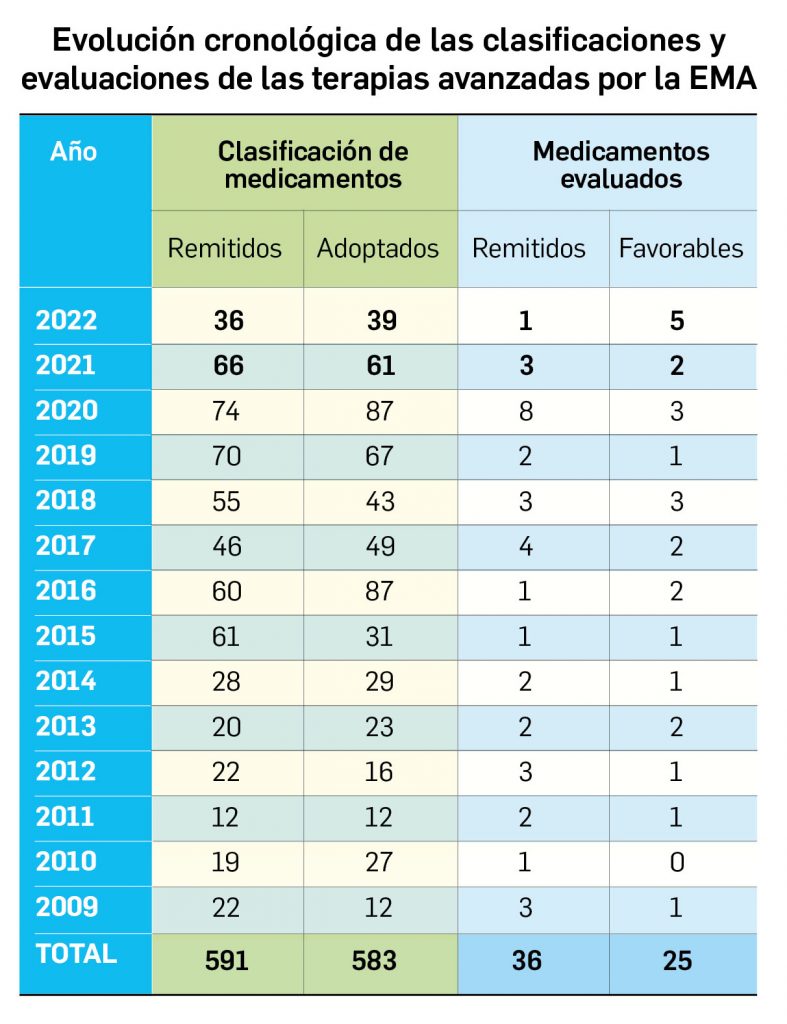
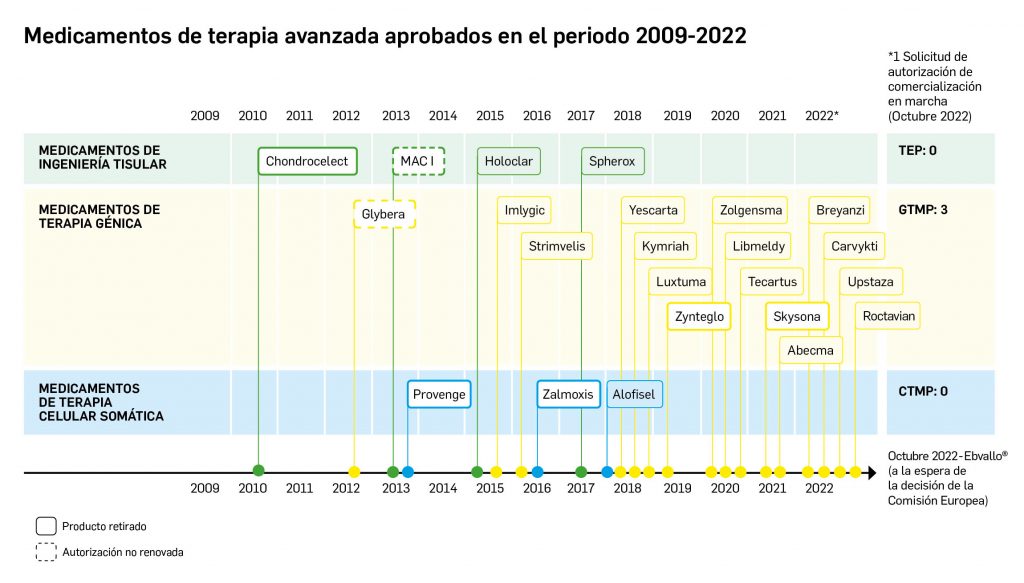
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas. La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios solo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
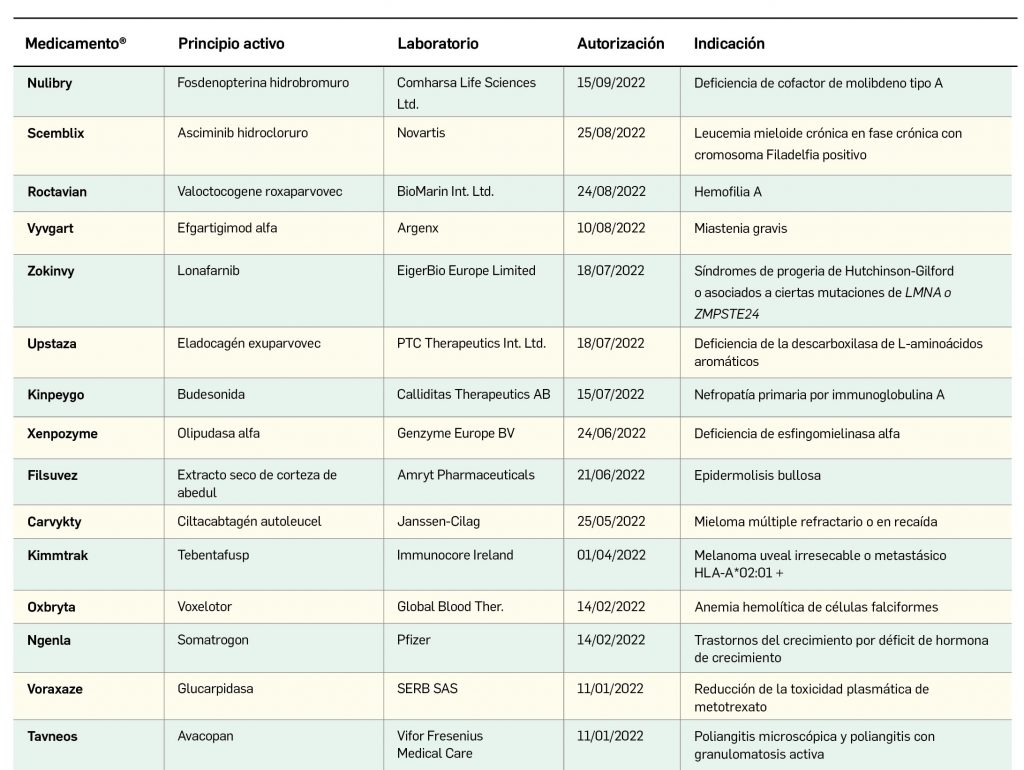
En los Países Bajos se ha incorporado a la información de los medicamentos con dimetil fumarato (o fumarato de dimetilo) el riesgo de ocasionar casos de alopecia areata. Se puede presentar esta reacción adversa tanto en su uso en el tratamiento de pacientes adultos y pediátricos de 13 años y mayores con esclerosis múltiple remitente-recurrente (EMRR) (Tecfidera® y EFG) como en el tratamiento de psoriasis en placas, de moderada a grave, en adultos que precisan de un tratamiento, con un medicamento sistémico (Skilarence®).
El Centro Nacional de Farmacovigilancia Lareb, de los Países Bajos, ha recibido 92 casos de alopecia en pacientes relativamente jóvenes que utilizan dimetil fumarato (Lareb, 2020). La mayoría de las notificaciones procedían del laboratorio titular de la autorización de comercialización (TAC) y la mayoría de las notificaciones se recibieron en los últimos 2 años, lo cual posiblemente también está relacionado con el aumento del número de pacientes que utilizan el fármaco, pero que no se describe en las fichas técnicas (o Resumen de las Características del Producto, RCP) holandesas de los medicamentos que contienen dimetil fumarato. En la mayoría de los casos se continuó con el tratamiento y la mayoría de los pacientes no se habían recuperado de la alopecia en el momento de su notificación. El tiempo hasta el inicio de su aparición osciló desde varias semanas hasta meses después de instaurarse el tratamiento.
Aunque se ha descrito alopecia areata en pacientes con esclerosis múltiple e incluso se ha demostrado que el dimetil fumarato es un posible tratamiento para la alopecia areata, la mayoría de las notificaciones recibidas por Lareb se refieren a la alopecia difusa y no a la alopecia areata.
Dimetil fumarato es un agente inmunomodulador que se utiliza en el tratamiento de la psoriasis en placas (Skilarence®) y en la esclerosis múltiple remitente-recurrente (Tecfidera®). Se ha demostrado que activa la vía del factor nuclear derivado de eritroide 2 (Nrf2) mediante el agotamiento del glutatión. La vía Nrf2 es una vía protectora contra el daño oxidativo. En la psoriasis en placas, la inhibición de la depleción de glutatión en las células involucradas en la patogénesis de la psoriasis conduce a la inhibición de la producción de citocinas proinflamatorias, la disminución del infiltrado inflamatorio en las placas psoriásicas por inducción de eventos pro-apoptóticos, la inhibición de la proliferación de queratinocitos y a una expresión reducida de moléculas de adhesión. En la esclerosis múltiple, se desconoce el mecanismo exacto del efecto terapéutico, pero se ha demostrado que dimetil fumarato disminuye la activación de las células inmunitarias y la liberación de citocinas proinflamatorias en los pacientes. Los estudios preclínicos también indican que las respuestas farmacodinámicas de fumarato de dimetilo parecen estar principalmente mediadas por la activación de la vía del Nrf2, habiendo demostrado regular al alza en los pacientes la expresión de los genes antioxidantes dependientes de este (por ejemplo, NAD(P)H deshidrogenasa, quinona 1; [NQO1]).
Así pues, dado que dimetil fumarato activa la vía Nrf2, es posible que provoque la dilatación de los folículos pilosos y la caída del cabello durante la fase catágena y telógena, lo que coincide con el tiempo de inicio en la mayoría de las notificaciones recibidas por el Centro de Farmacovigilancia Lareb de los Países Bajos.
En líneas generales, los medicamentos pueden afectar dos fases del ciclo del folículo piloso: la fase de crecimiento (anágena) y la fase de reposo (telógena). La alopecia causada por medicamentos que afectan la fase anágena puede ocurrir días o semanas después del inicio. La alopecia por interferencia telógena suele aparecer de 2 a 4 meses después del inicio. La alopecia inducida por fármacos generalmente mejora después de la suspensión del fármaco, especialmente cuando la alopecia es causada por interferencia telógena. Pero conviene recordar que muchos otros factores pueden causar alopecia, tales como la nutrición, el estrés y los trastornos de la tiroides.
Se justifica prestar atención a la alopecia como una posible reacción adversa al fármaco dimetil fumarato. El tiempo hasta el inicio de la alopecia puede ser de varias semanas después de iniciar el tratamiento o incluso hasta meses después de ese comienzo.
En España, el medicamento Skilarence® (30 mg/comprimido y 120 mg/comprimido) recibió la autorización de comercialización en 2017 (AEMPS, 2017), y el medicamento Tecfidera® (120 mg/cápsula y 240 mg/cápsula) recibió la autorización de comercialización en 2014 (AEMPS, 2022). Posteriormente, desde el primer semestre de 2022, se dispone de dos medicamentos genéricos indicados en esclerosis múltiple remitente-recurrente (EMRR): Fumarato de dimetilo Neuraxpharm® y Fumarato de dimetilo Mylan®.
En los 4 medicamentos españoles, la información de las fichas técnicas no incluye siempre descripción de esta reacción adversa, alopecia difusa y alopecia areata. Pero debe tenerse presente, y el médico debe valorar con el paciente cada caso.