Número 458, Noviembre 2022
Listado de medicamentos con problemas de suministro publicado por la AEMPS, a fecha de cierre de este número. En BOT PLUS se puede encontrar la información completamente actualizada, al tratarse de una información que varía de forma continua.


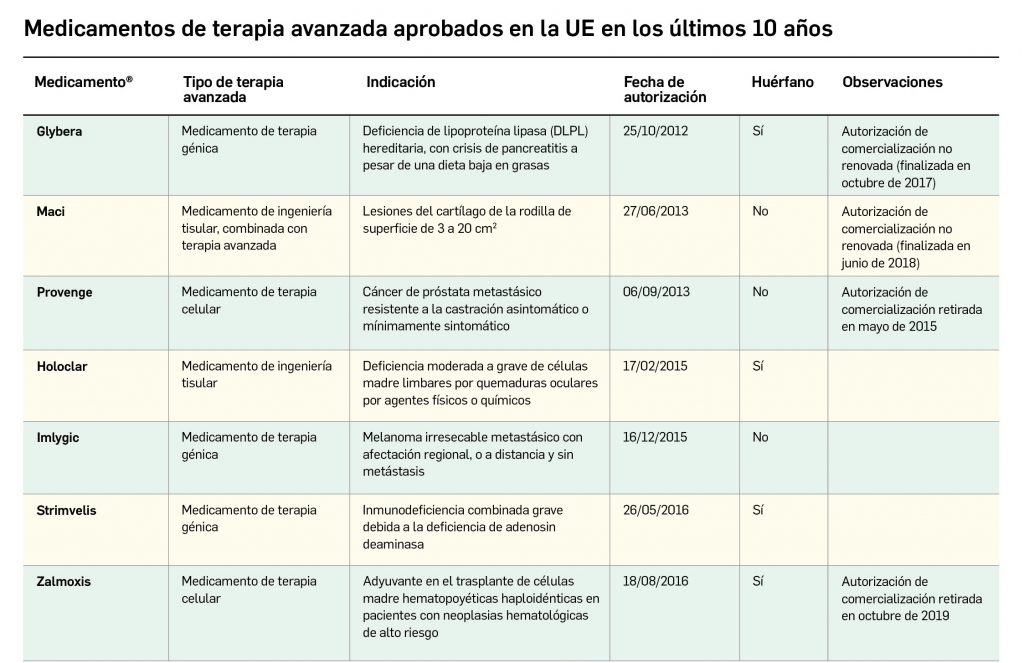
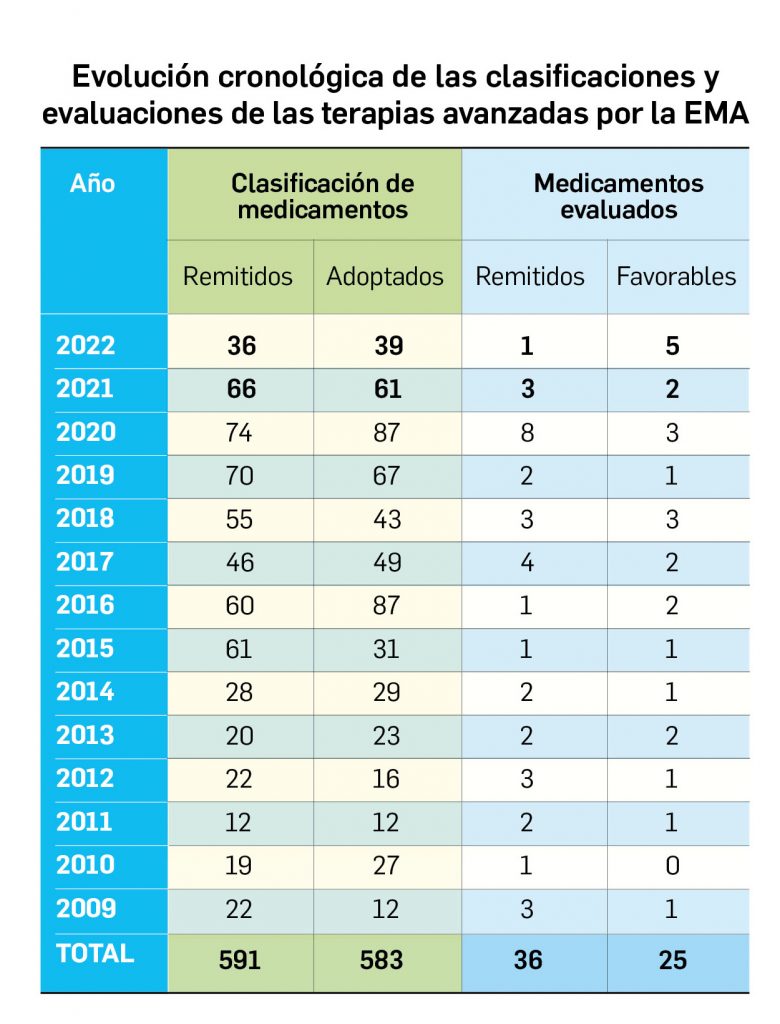
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
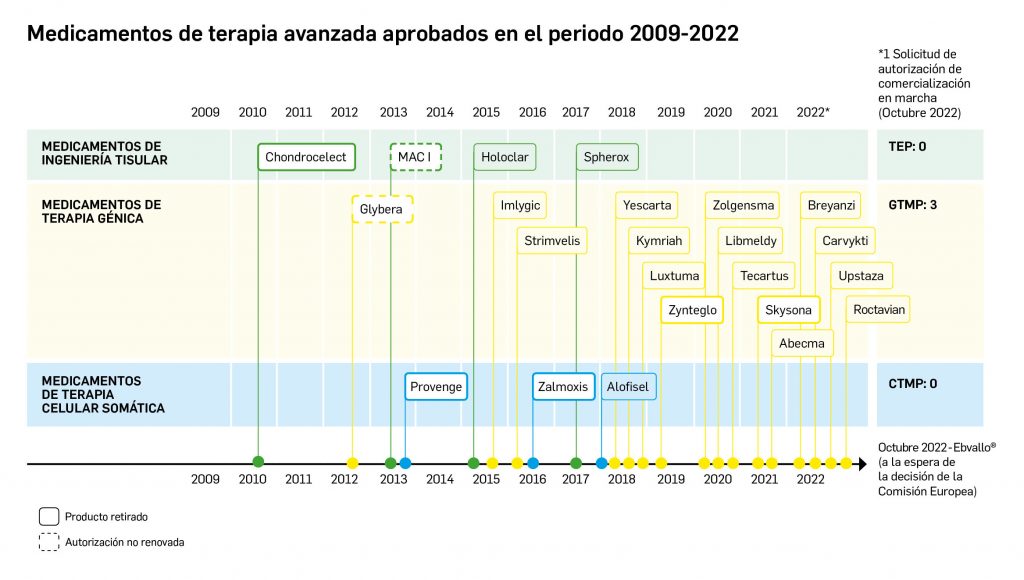
La siguiente tabla recoge los medicamentos de terapia avanzada que han recibido autorización de comercialización en la UE durante en los últimos 10 años (2012-2022).
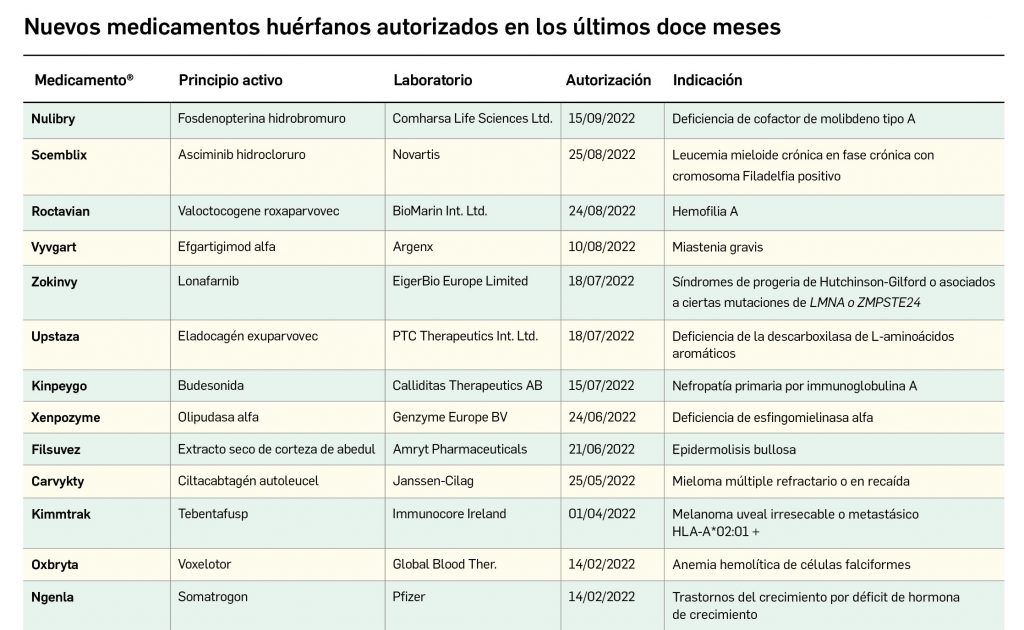
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas. La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios solo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
La AEMPS y el resto de las agencias de la UE han informado sobre las recomendaciones del Comité Europeo de Farmacovigilancia, PRAC, acerca de los tratamientos con medicamentos con codeína más ibuprofeno, para evitar el abuso y dependencia a la codeína, lo que ocasionaría uso continuo de dosis cada vez mayores, con toxicidad renal, gastrointestinal y metabólica por el ibuprofeno.
En España, estos medicamentos son de prescripción médica y su nivel de uso es bajo en relación con otras combinaciones de analgésicos a dosis fijas. Hasta la fecha, no se ha registrado ningún caso de reacción adversa similar a las descritas en este contexto. Por ello, se recuerda que el uso de esta combinación está limitado a un máximo de 3 días, y se recomienda informar a los pacientes sobre los riesgos y signos de abuso y dependencia, y de sus posibles efectos clínicos graves.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado sobre la revisión que ha llevado a cabo el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC, por sus siglas en inglés) acerca de casos de toxicidad renal, gastrointestinal y metabólica, algunos con desenlace mortal, en asociación con situaciones de abuso y dependencia de codeína, asociados al uso de medicamentos que contienen una combinación de codeína e ibuprofeno (AEMPS, 2022a).
La combinación de un analgésico opioide (codeína) y un antiinflamatorio no esteroideo (ibuprofeno) está indicada en el tratamiento del dolor moderado, que no se alivia con analgésicos monocomponentes (para una información más detallada consultar la ficha técnica y el prospecto de estos medicamentos). En España se encuentran comercializadas actualmente bajo los nombres comerciales de Astefor® y Neobrufen® con Codeína (AEMPS, 2021a).
La utilización repetida de esta combinación puede provocar dependencia (adicción) y abuso debido a la codeína, y, en consecuencia, un consumo por encima de las dosis recomendadas, aumentando así la toxicidad del ibuprofeno y la posibilidad de aparición de reacciones adversas dependientes de la dosis. En este sentido, se han notificado casos graves, algunos con desenlace mortal, de hemorragias gastrointestinales, perforaciones gastrointestinales, anemia grave, insuficiencia renal, acidosis tubular renal e hipopotasemia grave.
El Sistema Español de Farmacovigilancia de medicamentos de uso humano (SEFV-H) no ha recibido ninguna notificación con sospechas de reacción adversa similar a las descritas anteriormente para esta combinación, relacionada con el abuso y dependencia a la codeína; los casos evaluados proceden mayoritariamente de países donde estos productos están disponibles sin receta médica. En España, estos medicamentos están todos sujetos a prescripción médica o de odontólogo, es decir, solo se dispensan con receta, y además tienen un uso bajo en relación con otras combinaciones a dosis fijas de analgésicos (AEMPS, 2021b).
La ficha técnica y el prospecto de estos medicamentos, disponibles a través del Centro de Información online de Medicamentos de la AEMPS (CIMA), se actualizarán para reflejar esta nueva información.