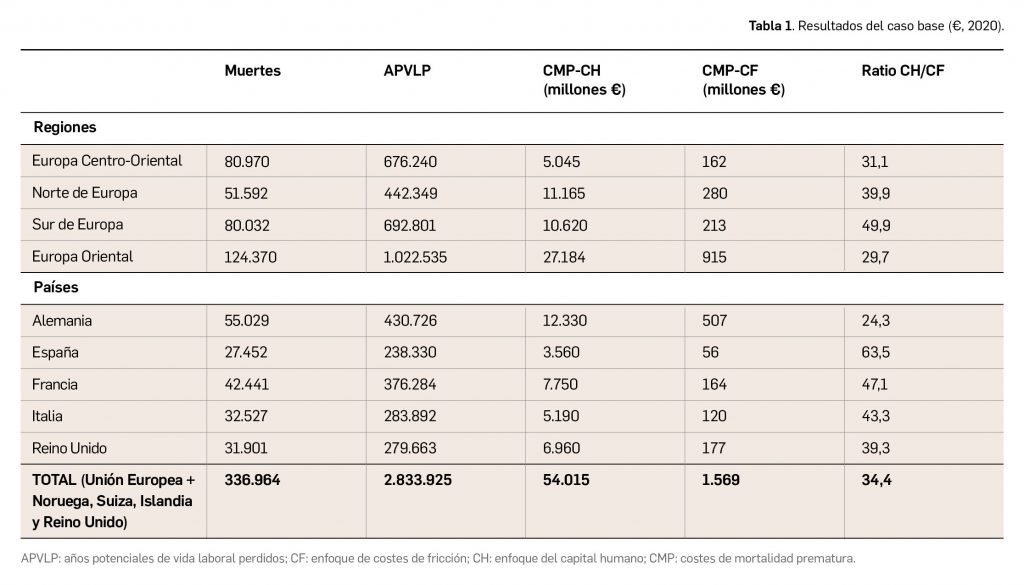
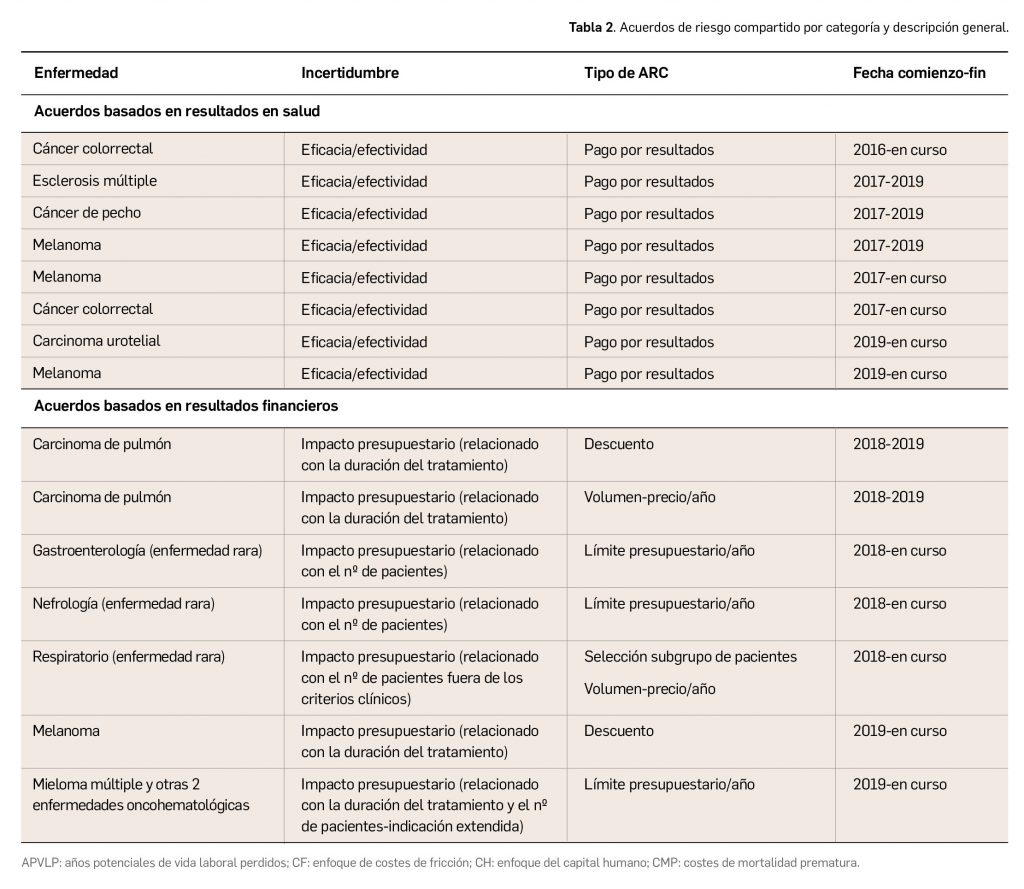
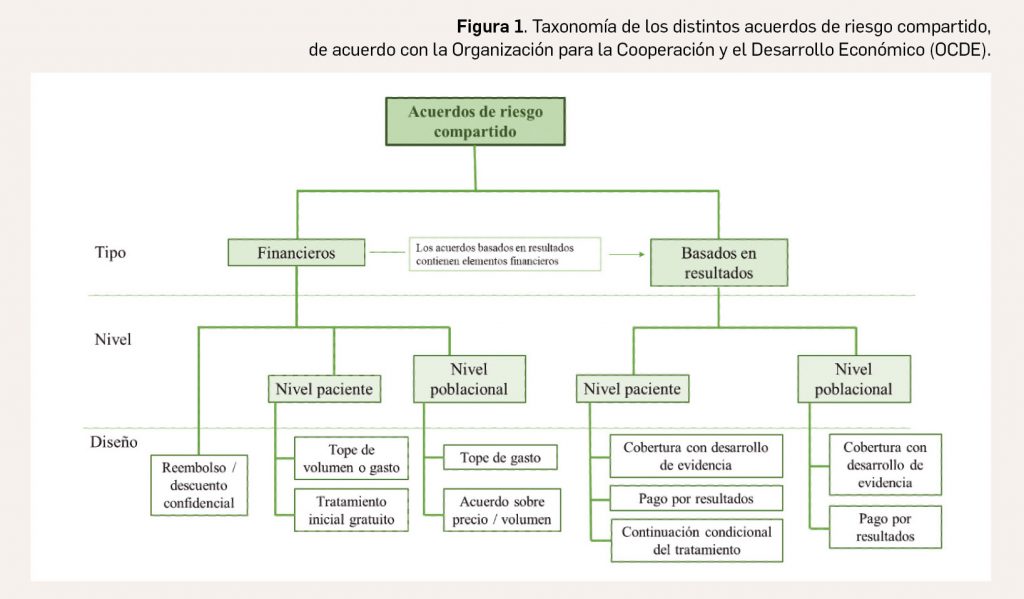
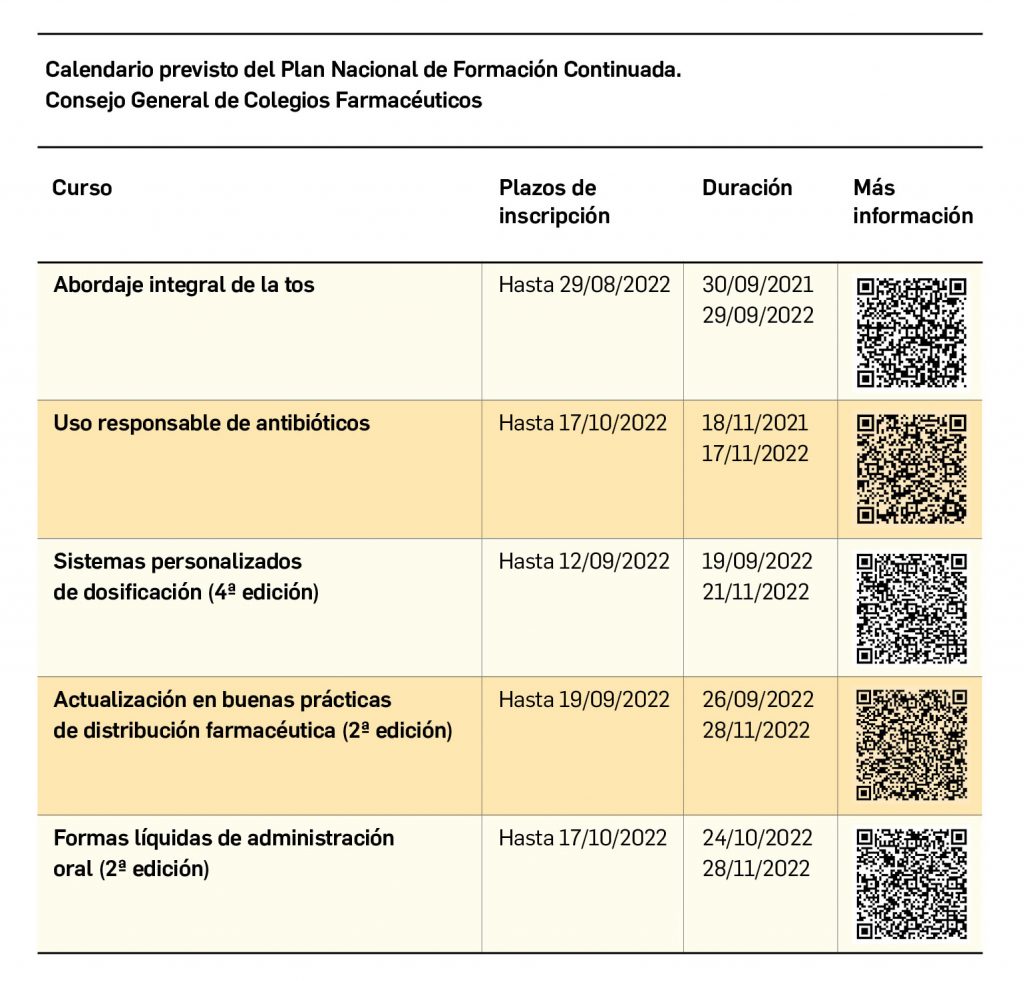
Los medicamentos desarrollados para el tratamiento de enfermedades raras ofrecen importantes beneficios para la salud. Sin embargo, continúan “desafiando” la evaluación de tecnologías sanitarias (ETS) tradicional, el reembolso y la fijación de precios en todo el mundo. La evidencia sobre la eficiencia de estos fármacos es, a menudo, limitada, por el reducido número de pacientes y la heterogeneidad de este tipo de enfermedades, lo que conlleva una importante incertidumbre en la toma de decisiones.
En respuesta a estos desafíos, en Canadá se han propuesto recientemente una serie de procesos modificados que ayuden a manejar esta incertidumbre, al mismo tiempo que mejoran el acceso de los pacientes a este tipo de fármacos. Sin embargo, los pasos específicos sobre los términos y condiciones de dichos procesos todavía no han sido establecidos. Con la finalidad de obtener información de experiencias similares que puedan ser de utilidad para guiar las deliberaciones realizadas por los principales decisores de Canadá y asegurar que cualquier proceso modificado refleja la evidencia disponible en el mundo real, se desarrolló un estudio en el que se compararon los procesos de fijación de precio y reembolso de medicamentos huérfanos en diferentes países con un perfil socioeconómico y demográfico similar al de Canadá.
El estudio se llevó a cabo mediante una revisión de alcance de documentos relevantes sobre la ETS, publicados en inglés, en los que se informase sobre el proceso de precio y reembolso de medicamentos huérfanos, a partir del año 2010, en Alemania, Australia, Canadá, España (Cataluña), Francia, Italia, Nueva Zelanda, Países Bajos, Reino Unido (Inglaterra, Escocia y Gales) y Suecia. Además, se desarrollaron entrevistas con miembros de los comités de revisión de Alemania, Australia, Cataluña, Francia, Italia y Reino Unido. De forma paralela, desde un enfoque de estudio de casos, se analizó el proceso de precio y reembolso de un conjunto de siete medicamentos para enfermedades raras evaluados por varios países y por la Canadian Agency for Drugs and Technologies in Health (CADTH) en los últimos 5 años. Por último, se celebró una reunión virtual de reflexión con múltiples decisores (pacientes, pagadores, especialistas de ETS, industria y ámbito académico).
Tras el análisis se observó que, de todas las jurisdicciones incluidas en el análisis, únicamente el Sistema Nacional de Salud de Inglaterra –a través del Highly Specialized Technologies Programme– presenta un proceso específico para evaluar los costes y beneficios de un limitado número de fármacos para enfermedades muy raras. En el resto de las jurisdicciones, se han modificado algunos pasos del proceso genérico de precio y reembolso para facilitar el rápido acceso de este tipo de medicamentos. De forma específica, en Francia, Alemania y Países Bajos, una vez que el medicamento huérfano recibe la aprobación regulatoria, su valor terapéutico se considera probado, es decir, no se requiere de la ETS, permitiendo su acceso a los pacientes a un precio fijado por el fabricante, siempre y cuando su impacto presupuestario anual no supere los 30 millones de euros en Francia, 50 millones de euros en Alemania y 2,5 millones de euros en Países Bajos. En Italia, los medicamentos huérfanos, así como aquellos con una importancia social y terapéutica excepcional, o empleados únicamente de forma hospitalaria, son seleccionados para la evaluación acelerada (100 días desde la presentación de la solicitud en lugar del periodo estándar de 180 días).
La gravedad de la enfermedad, la ausencia de alternativas, el valor terapéutico, la calidad de la evidencia y el valor monetario son factores que se han tenido en cuenta en todos los procesos de toma de decisiones. Únicamente el National Institute for Health and Care Excellence (NICE) británico ha definido un umbral de coste-efectividad, que se sitúa en un rango de 100.000 a 300.000 libras por año de vida ajustado por calidad en tecnologías altamente especializadas. El impacto presupuestario se considera en todas las jurisdicciones, excepto en Suecia. De los siete medicamentos huérfanos incluidos en el estudio de casos, el país con mayor número de recomendaciones positivas fue Francia, seguido de Alemania.
Basándose en los hallazgos obtenidos, en el estudio se propusieron siete recomendaciones de posibles acciones a aplicar en Canadá en el proceso de fijación de precio y reembolso, las cuales se centraron en: 1) mejorar de forma específica el acceso de los medicamentos huérfanos; 2) determinar cuándo es necesaria una ETS; 3) mejorar la coordinación ente los grupos decisores durante la toma de decisiones sobre precio y reembolso; 4) desarrollar un marco canadiense para el manejo de planes de acceso; 5) crear una infraestructura de manejo de datos de medicamentos para enfermedades raras; 6) asegurar el compromiso continuo de grupos de pacientes y clínicos; y 7) favorecer la investigación con la finalidad de mejorar el entendimiento acerca de la implementación de diferentes opciones de decisión y financiación, como pueden ser los programas de pago por resultados u otro tipo de modelos de financiación.
Comentario
A pesar de que el estudio se centra únicamente en la revisión de los procesos desarrollados por un selecto grupo de países, sin recoger la totalidad de aproximaciones realizadas en el mundo, y que tan solo un grupo representativo de medicamentos huérfanos fueron seleccionados para su análisis, los resultados alcanzados permiten mostrar las tendencias actuales en las estrategias de precio y reembolso en el mundo, pudiendo servir de aprendizaje para su aplicación en Canadá y, por extensión, en otros países.
La variabilidad existente en los mecanismos desarrollados por los diferentes países en el proceso de precio y reembolso de los medicamentos huérfanos pone de manifiesto la necesidad de aunar esfuerzos en lograr una financiación selectiva, pero que incorpore la equidad y que cuente en su evaluación con criterios clave establecidos de forma específica y transparente, con la participación de todos los agentes decisores y que permita la reevaluación mediante la recopilación y revisión de datos observados en la práctica clínica real (real-world evidence, RWE) que respalden los programas de reembolso innovadores