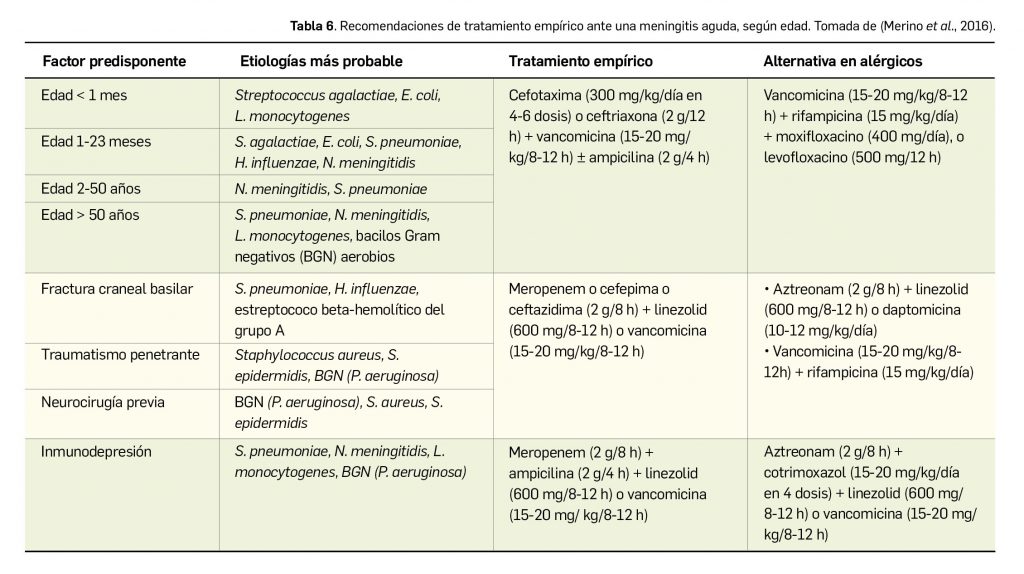
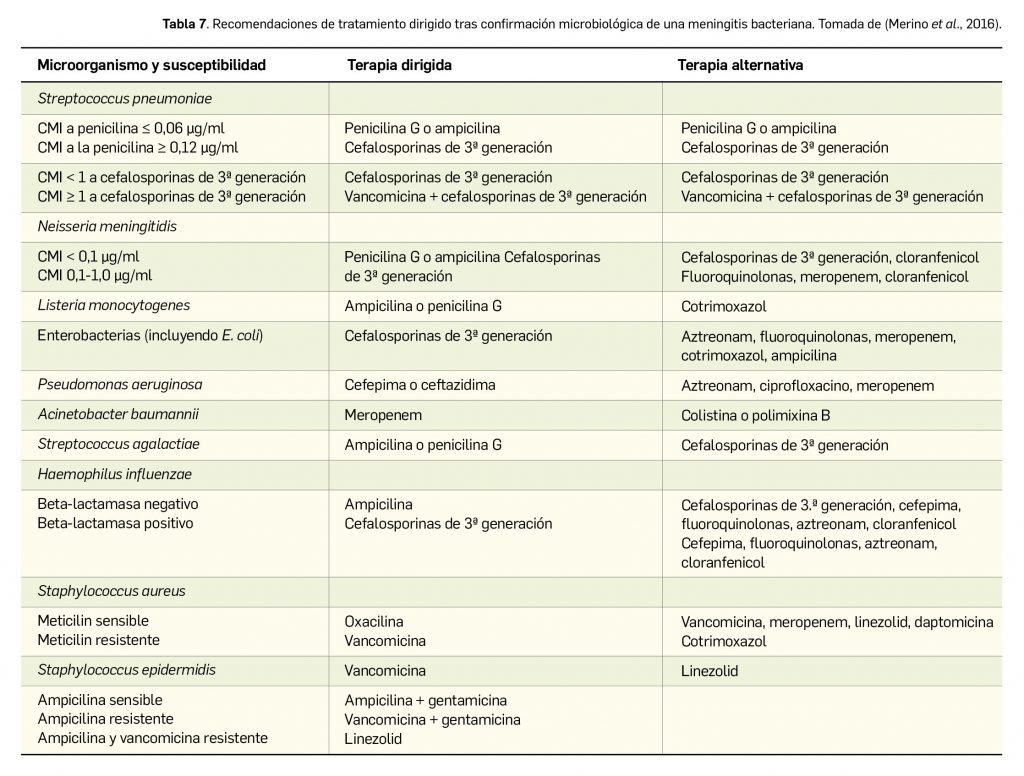
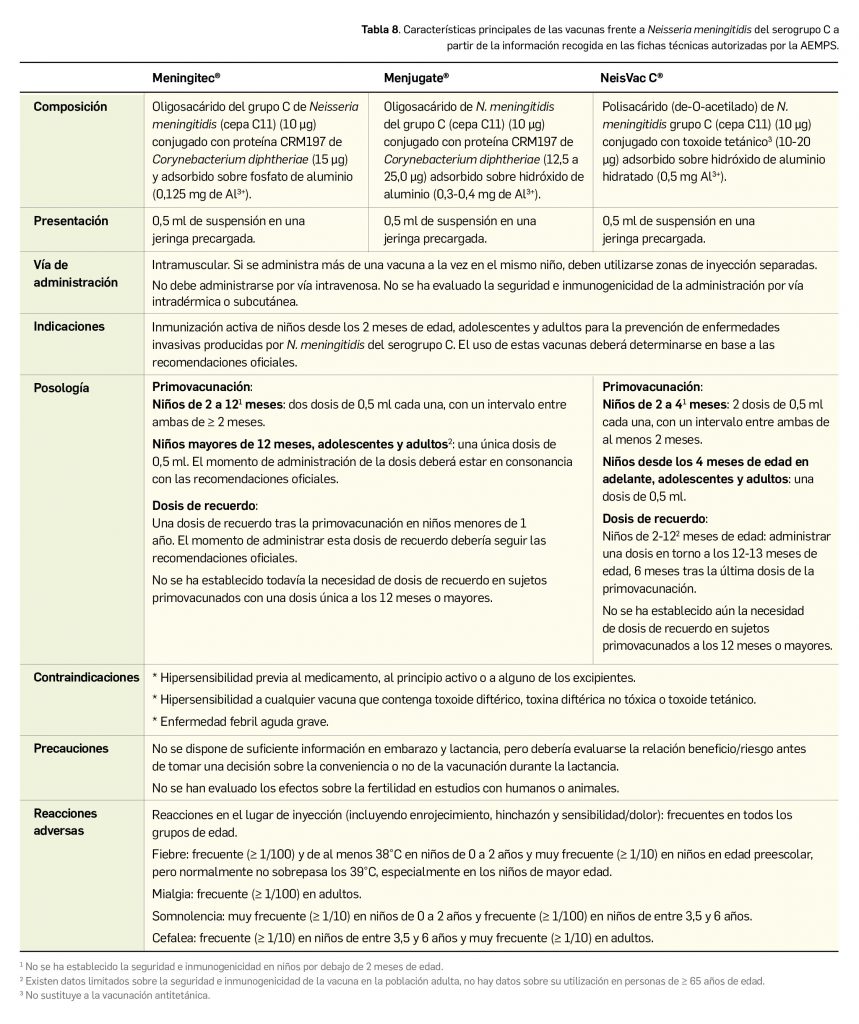
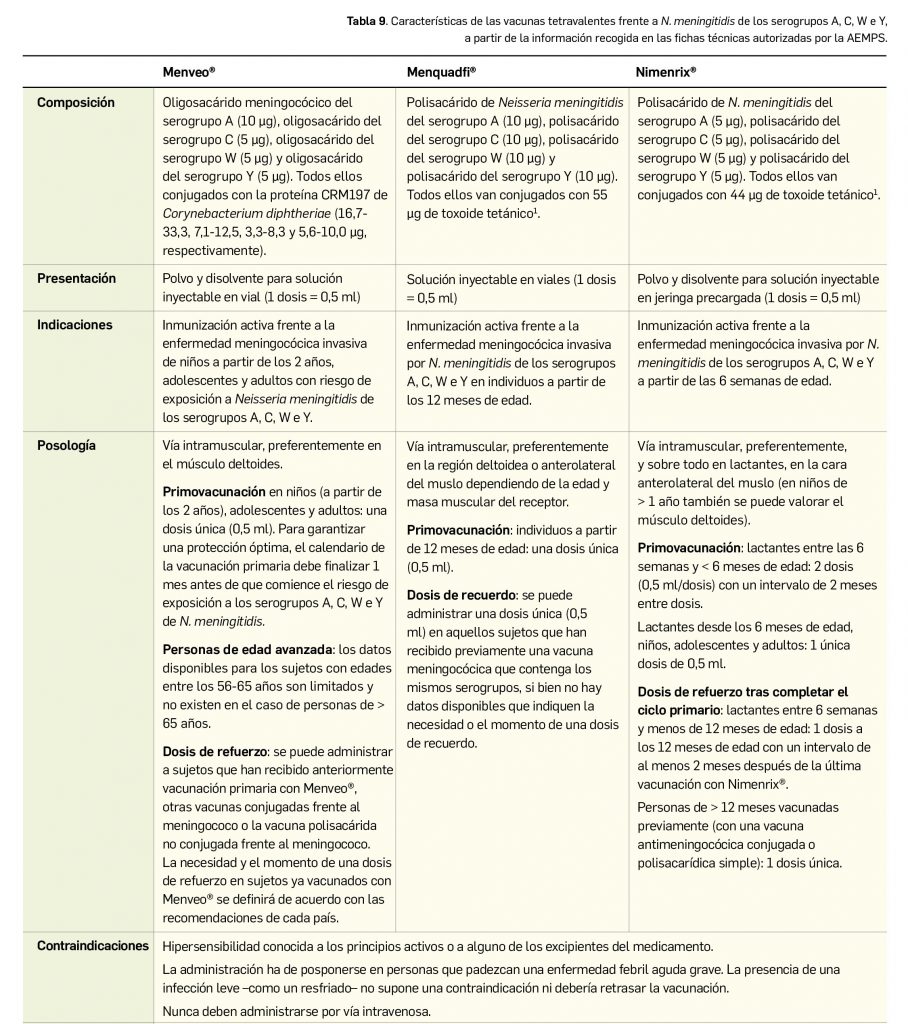
Resumen
Lumasirán es un nuevo ARN pequeño de interferencia bicatenario que se dirige específicamente a los hepatocitos, donde se une al ARNm del gen HAO1 codificante para la enzima hidroxiácido oxidasa 1 o glicolato oxidasa y promueve su degradación mediante el proceso de interferencia del ARN. Por tanto, reduce los niveles de síntesis de esa proteína y provoca una disminución de la cantidad de glioxilato disponible: este es un sustrato de la producción de oxalato, de modo que también reduce los niveles de oxalato en orina y en plasma. Designado como huérfano, el medicamento ha sido autorizado para el tratamiento por vía subcutánea de la hiperoxaluria primaria de tipo 1 (HP-1) en todos los grupos de edad.
En un estudio pivotal (N= 39) con pacientes de > 6 años y función renal relativamente conservada, el tratamiento con lumasirán durante 6 meses fue superior a placebo en la tasa de reducción significativa de los niveles urinarios promedio de oxalato (65% vs. 12%). Así, el 52% y 84% de los pacientes tratados con lumasirán consiguen niveles de oxalato en orina normales o próximos a la normalidad, respectivamente. El tratamiento se relacionó, además, con una reducción del 40% en los niveles de oxalato en plasma, que apenas cambiaron con placebo. Los resultados de un segundo estudio de fase 3 con pacientes pediátricos de < 6 años (N= 18) respaldan esos hallazgos, pues el tratamiento abierto durante 6 meses con lumasirán redujo el cociente oxalato:creatinina en orina un promedio del 72% respecto al nivel basal, y la mitad de los pacientes alcanzó un valor casi normal; además, también se vio un descenso del 32% en el nivel plasmático de oxalato, con estabilidad en la funcionalidad renal durante ese periodo. En términos de seguridad, se trata de un fármaco bien tolerado cuyo perfil toxicológico, similar en adultos y en niños, se caracteriza por la incidencia de eventos adversos (42% vs. 8% con placebo) leves-moderados que no conllevan una tasa reseñable de interrupciones: las reacciones adversas más frecuentes son las del sitio de inyección (25%, sobre todo eritema, dolor y prurito transitorios) y el dolor abdominal (15%).
Bien es cierto que la eficacia de lumasirán, que es rápida y parece mantenerse en tratamientos de al menos 1 año, se ha evaluado a través de variables bioquímicas intermedias; no se tienen datos de variables de mayor relevancia clínica –calidad de vida o mortalidad, por ejemplo– o en pacientes con enfermedad renal grave, pero es bastante plausible que tales resultados se correlacionen con una reducción de los depósitos extrarrenales de oxalato y menor incidencia de comorbilidades asociadas a HP-1, e incluso que se traduzcan en una reducción de la progresión de la patología. Pero por ahora no se ha observado un beneficio a nivel de eventos renales ni de la funcionalidad renal, probablemente debido al pequeño tamaño muestral y los cortos periodos de seguimiento.
En ausencia de datos a largo plazo y de comparaciones directas o indirectas entre lumasirán y las otras opciones usadas en práctica clínica (hiperhidratación, inhibidores de la cristalización o piridoxina), no se puede concluir sobre su superioridad, pero es evidente que el nuevo fármaco inaugura una vía terapéutica en una indicación para la que no se disponía de tratamientos farmacológicos aprobados en la UE y puede cambiar en un futuro la terapéutica estándar de forma notable. No representa una cura, pero permite combatir las manifestaciones clínicas de la HP-1 debidas a la acumulación de oxalato, posicionándose como una alternativa terapéutica en aquellos pacientes sin antecedentes de trasplante y con enfermedad renal leve o moderada que no responden a las opciones de tratamiento estándar. La evidencia es aún escasa, y habrá que esperar a los datos procedentes de los ensayos en marcha para definir mejor su balance beneficio-riesgo a largo plazo.
Aspectos fisiopatológicos
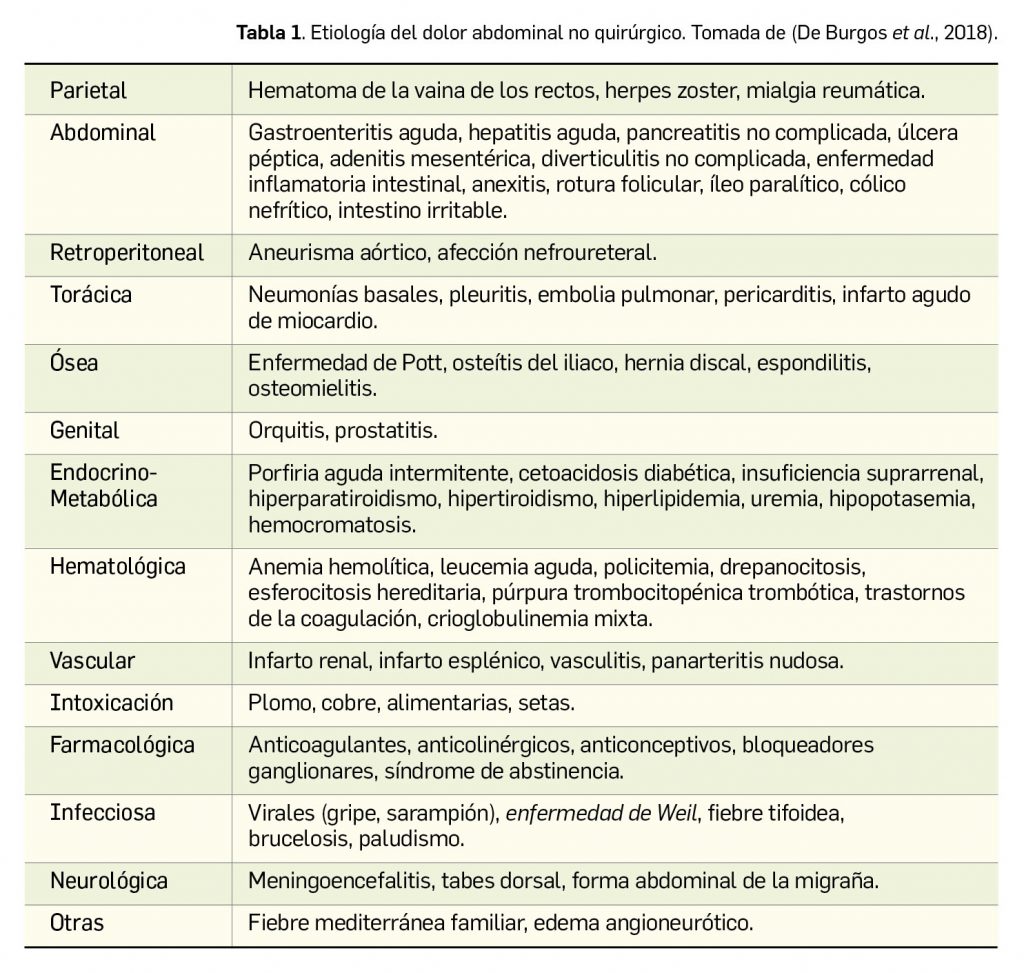
La hiperoxaluria primaria (en adelante, HP) es una enfermedad genética, de herencia autosómica recesiva, desarrollo progresivo y potencialmente mortal, que se produce por un error innato en el metabolismo resultante en una producción hepática de oxalato anormalmente incrementada. La acumulación tóxica de ese metabolito es la causa responsable de las manifestaciones clínicas de la enfermedad. De entre los tres tipos identificados de HP, el mayoritario es el tipo 1 (80%), que además es la forma clínica más grave.
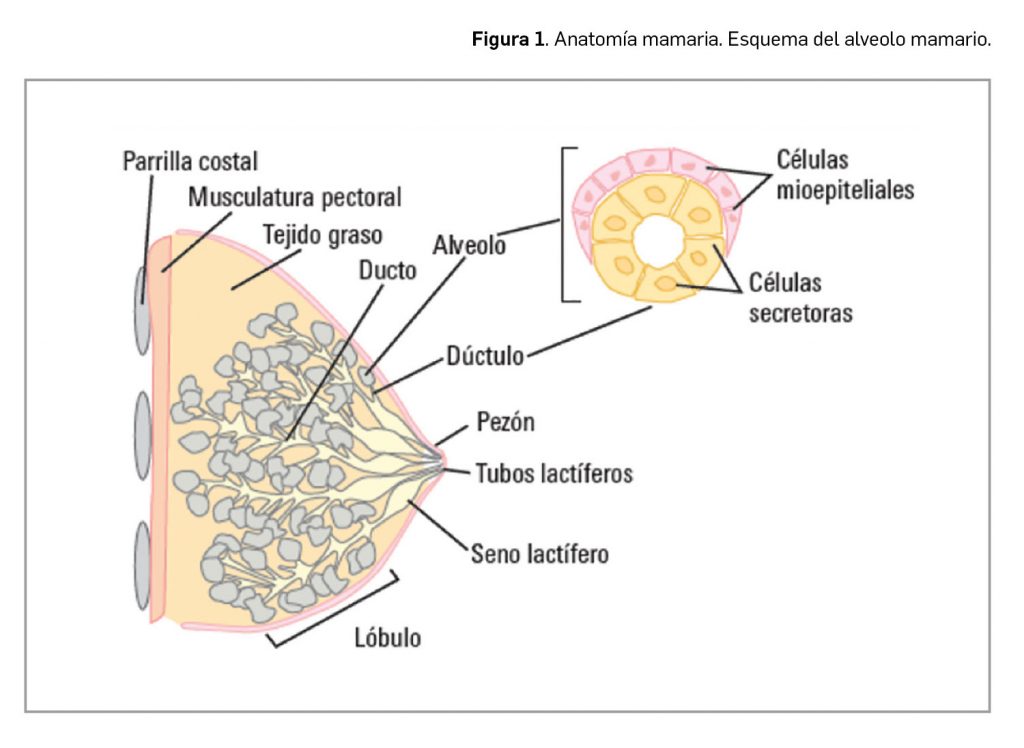
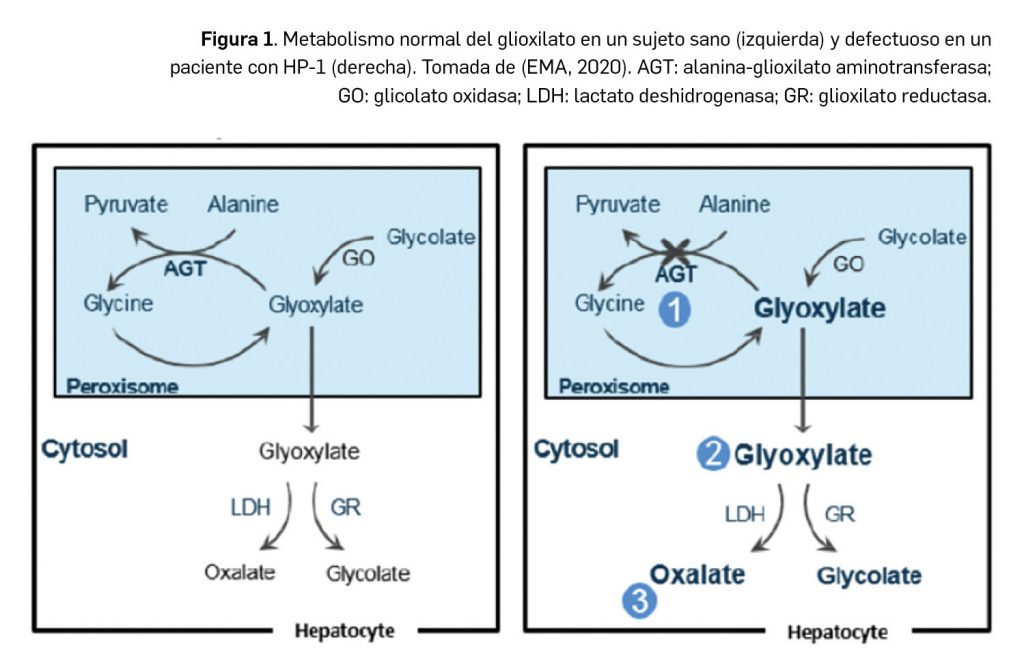
La etiología de la hiperoxaluria primaria tipo 1 (en adelante, HP-1) es una mutación en el gen codificante para la alanina-glioxilato aminotransferasa (AGXT) que determina una actividad baja o nula de la enzima: esa deficiencia impide que el glioxilato se convierta en glicina, de modo que el exceso de sustrato –glioxilato– se convierte en oxalato, con un aumento de varias veces sus niveles normales en plasma y orina (Figura 1). Hay una gran diversidad de mutaciones subyacentes y, en consecuencia, también del curso clínico de la patología. Así, la HP tipo 1 se considera como una enfermedad con un fenotipo –expresión clínica– altamente variable, incluso entre familiares con el mismo genotipo. En cualquier caso, con independencia de la expresión clínica de la enfermedad, la fisiopatología es compartida por la totalidad de pacientes.
El oxalato sobreproducido a nivel del hepatocito no se metaboliza, sino que se excreta por vía renal, produciéndose una saturación excesiva de oxalato urinario. Por ello, el riñón es el principal órgano afectado cuando se supera el umbral de saturación1: se forman cristales de calcio que producen urolitiasis (cálculos renales) y nefrocalcinosis, y en última instancia, los pacientes pueden desarrollar fibrosis intersticial e insuficiencia renal, la cual puede relacionarse con otras manifestaciones sistémicas multiorgánicas de la patología y conducir, en los casos más graves, a nefropatía terminal.
Según se ha sugerido, cuando el riñón ya no tiene más capacidad de filtración, el oxalato cálcico forma también depósitos en tejidos extrarrenales (oxalosis sistémica), tales como retina, miocardio, vasos sanguíneos, piel, hueso y sistema nervioso, lo cual se traduce en manifestaciones clínicas que pueden variar desde cardiomiopatía y trastornos en la conducción cardiaca o vasculopatía con necrosis distales, hasta retinopatía, sinovitis o enfermedad ósea de alto remodelado (dolor articular y óseo, anemia, fracturas espontáneas), que son complicaciones tardías graves e implican un pronóstico de mortalidad precoz de los pacientes.
La HP-1 se presenta en formas diferentes en función de la edad, siendo la mediana al debut de las manifestaciones de 5,5 años (más de la mitad de los casos aparecen antes de los 6 años de vida), si bien la edad al diagnóstico puede oscilar entre menos de 1 año y hasta más de 50 años. En base a la edad del paciente, se diferencia entre formas de aparición en la infancia, con nefrocalcinosis temprana y una rápida progresión a insuficiencia renal2 (por una creciente sobrecarga de oxalato y una tasa de filtración glomerular inmadura) e incluso la muerte, de aquellas en la adolescencia o adultez temprana, que se manifiestan con cálculos renales recurrentes y rápido deterioro de la funcionalidad renal, y de aquellas de debut tardío en que los cálculos renales son esporádicos y solo en escasas ocasiones debuta con nefropatía terminal.
Esa heterogénea presentación justificaría el retraso en el diagnóstico de algunos pacientes, unido al hecho de que muchos diagnósticos se hacen solo tras la progresión a nefropatía terminal (hasta un tercio) y el trasplante renal, tras el cual también padecen acumulación de oxalato en el riñón trasplantado. Además, una minoría –aproximadamente el 10%– de los pacientes asintomáticos o con formas subclínicas se identifican mediante cribado familiar, teniendo en cuenta que los hermanos de pacientes con HP-1 tienen un riesgo del 25% de padecer la enfermedad.
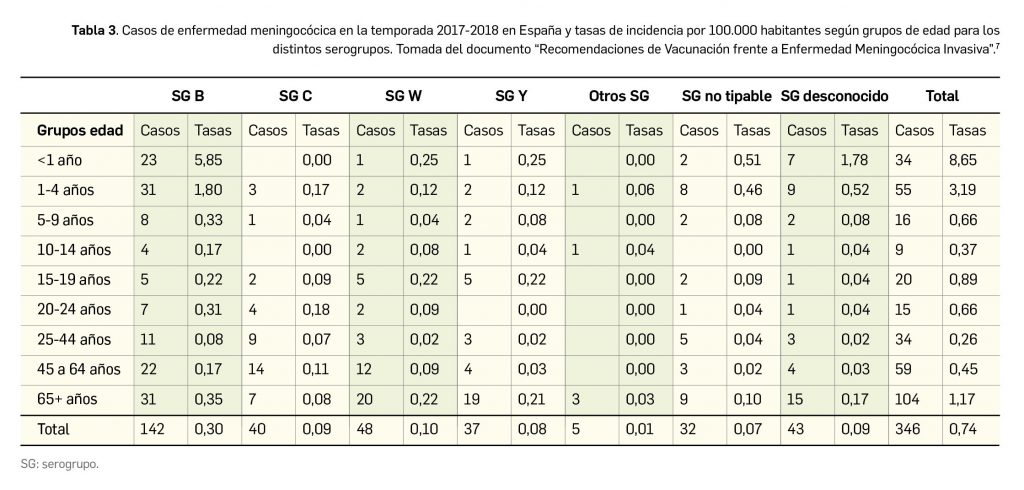
Desde el punto de vista de la epidemiología, se trata de una enfermedad rara con una incidencia baja, estimada en 1 caso por cada 100.000-120.000 nacidos vivos, y cuya prevalencia se sitúa en 1-3 pacientes por cada millón de habitantes en Europa y Estados Unidos. Es más frecuente en aquellas regiones donde los matrimonios con consanguinidad son más frecuentes, incluyendo Oriente Medio y el norte de África. Con una prevalencia cercana a 0,05 casos/10.000 habitantes, se estima que en la UE puede haber un total de 2.600 paciente afectados por HP-1.
Con respecto al abordaje de la HP-1, el objetivo del tratamiento precoz es reducir la concentración urinaria de oxalato de calcio, así como disminuir esa producción para prevenir la formación de cálculos renales y retrasar la progresión de la lesión renal. En la actualidad no se dispone de ningún medicamento específicamente autorizado para el tratamiento de la HP-1, pero entre algunas de las estrategias terapéuticas habituales se encuentran las siguientes:
- En pacientes con función renal preservada se puede recurrir a la hiperhidratación o hidratación forzada, que busca reducir la saturación urinaria de oxalato cálcico (y la subsiguiente formación de cálculos renales), y a la administración de inhibidores de la cristalización, como citrato potásico, ortofosfato o magnesio, que aumentan la solubilidad del oxalato. La hiperhidratación continua de pacientes pediátricos, sobre todo en niños más pequeños, requiere cantidades de fluidos generalmente elevadas, de modo que suele ser necesaria una sonda nasogástrica o gastrostomía. El uso de inhibidores de la cristalización se ve dificultado por su desagradable sabor, por lo que para enmascararlo también se hace conveniente la sonda nasogástrica.
- Tratamiento con piridoxina (vitamina B6): es quizás la opción más usada en estos pacientes. Se emplea porque actúa como cofactor de la alanina-glioxilato aminotransferasa (AGT) en la transaminación de glioxilato a glicina, corrigiendo potencialmente la incorrecta localización –del peroxisoma a la mitocondria– de la AGT, que se asocia con algunas de las mutaciones del gen AGXT. Por su mecanismo, este tratamiento solo es eficaz en una parte de los pacientes con HP-1: el 30-50% de los pacientes responden al tratamiento con piridoxina con reducción de los niveles de oxalato en orina, sobre todo los pacientes homocigotos G170R. En todo caso, la literatura del uso de la piridoxina en HP-1 es escasa, dificultando los estudios comparativos.
- Terapia de reemplazo renal (TRR): se suelen practicar en pacientes con una función renal severamente deteriorada. A menudo la hemodiálisis convencional (3 sesiones/semana) y la diálisis peritoneal son insuficientes para compensar la producción de oxalato, cuyos niveles plasmáticos exceden con frecuencia el umbral de saturación de 30 μmol/l entre tratamientos de diálisis, aumentando así el riesgo y la progresión de la oxalosis sistémica. Suele recurrirse a la intensificación de la TRR: 6 sesiones de diálisis a la semana, además de diálisis peritoneal. En todo caso, los pacientes continúan evolucionando hasta la necesidad de un trasplante.
- Trasplante hepático o trasplante combinado hepato-renal. El trasplante hepático es la única intervención a priori curativa para la HP-1 (corrige el defecto enzimático hepático que constituye la base etiológica) cuando la nefropatía progresa a estadios graves. Algunos expertos defienden el trasplante hepático preventivo, a día de hoy en controvertido debate, para evitar complicaciones de oxalosis sistémica antes de que el paciente presente enfermedad renal crónica en estadio 4 (tasa de filtrado glomerular de 15 a 30 ml/min/1,73 m2). Pero hay que recordar que el trasplante hepático tiene en sí mismo complicaciones asociadas (en parte debidas a la inmunosupresión crónica) y que la mortalidad perioperatoria en pacientes con trasplante combinado ronda el 17%. El trasplante simultáneo o secuencial hepato-renal se consideraba hasta ahora la opción terapéutica de elección –la más utilizada sobre todo en niños– para corregir la enfermedad de base y suprimir la sobreproducción de oxalato, aportando una mayor supervivencia del injerto respecto al trasplante renal aislado; los resultados clínicos son probablemente mejores cuando se realiza con una tasa de filtrado glomerular (TFG) de < 40 ml/min/1,73 m2 y antes de la excesiva acumulación tisular de oxalato.
En definitiva, los tratamientos que solían emplearse para tratar a pacientes con HP-1 tienen importantes limitaciones, tales como problemas de adherencia (con la hiperhidratación o el uso de inhibidores de cristalización), beneficio en una proporción reducida de pacientes (con el uso de piridoxina), y/o una importante disminución de la calidad de vida y exposición a procedimientos invasivos (gastrostomía o sonda nasogástrica) o inmunosupresión crónica (trasplantes). Por todo ello, es evidente que la HP-1 representa una necesidad médica no cubierta (EMA, 2020; AEMPS, 2022).
Acción y mecanismo
Lumasirán es un ácido ribonucleico pequeño de interferencia (siRNA, por sus siglas en inglés) bicatenario, que se dirige a los hepatocitos donde se une específicamente al ARNm del gen HAO1 codificante para la enzima hidroxiácido oxidasa 1 (también llamada glicolato oxidasa), promoviendo su degradación mediante el proceso de interferencia del ARN. Así, reduce los niveles de síntesis de esa proteína, lo cual se traduce en una menor cantidad de glioxilato disponible: dado que este es un sustrato de la producción de oxalato, el efecto de lumasirán también se correlaciona con menores niveles de oxalato en orina y en plasma. Por abordar la causa subyacente de las manifestaciones de la hiperoxaluria primaria, el medicamento ha sido autorizado para el tratamiento por vía subcutánea de la HP tipo 1 en todos los grupos de edad.
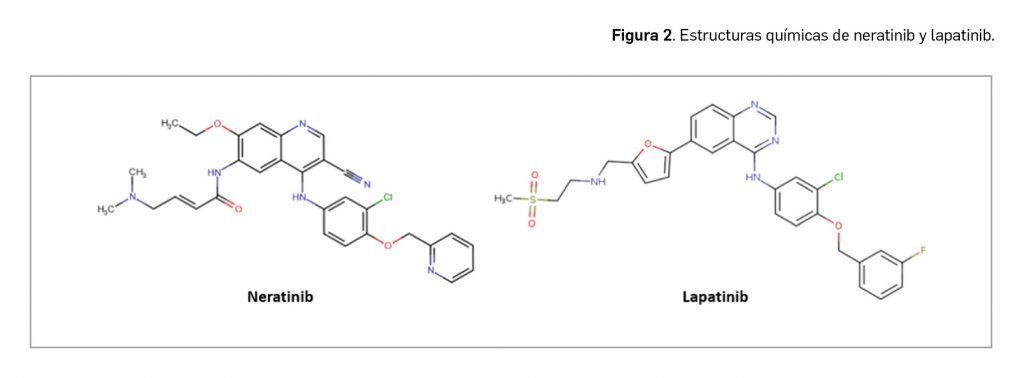
De modo interesante, el mecanismo de acción de lumasirán es independiente de la mutación del gen AGXT subyacente, habida cuenta de que la enzima glicolato oxidasa está por encima en la ruta metabólica de la alanina-glioxilato aminotransferasa deficiente, causa primaria de la HP-1 (Figura 2).
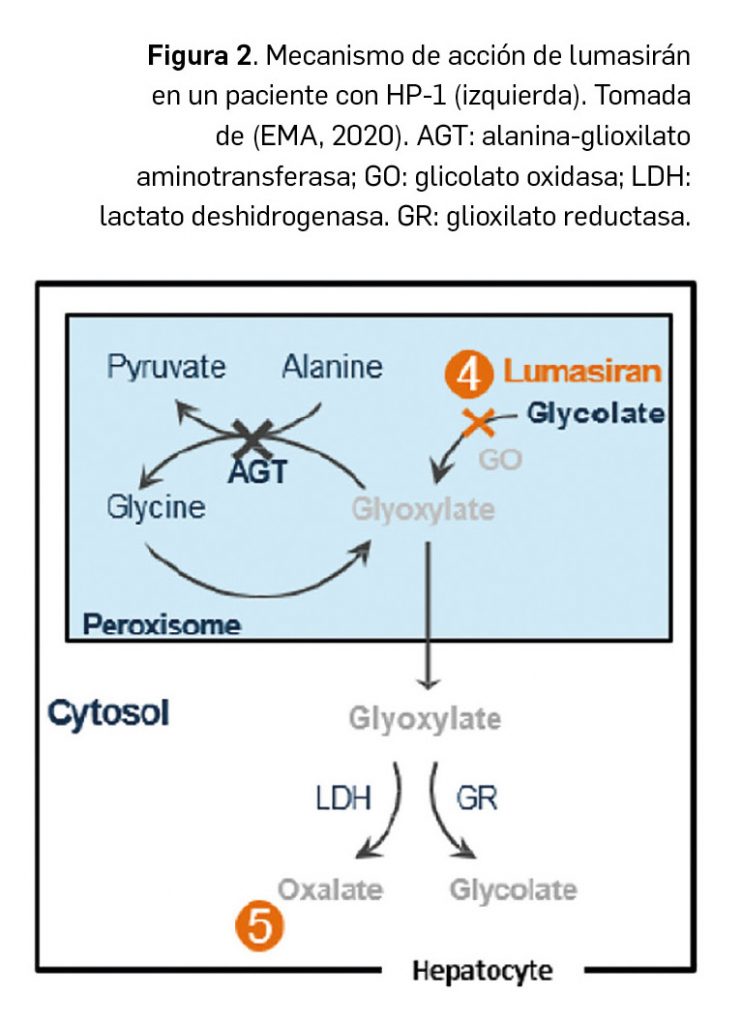
En base al mecanismo de acción descrito para otros agentes siRNA previamente comercializados para otras enfermedades (por ejemplo, patisirán o givosirán), se plantea que el proceso de interferencia del ARN ocurre cuando, una vez liberado en el citoplasma de los hepatocitos –a los cuales se dirige específicamente– por un proceso de endocitosis mediada por receptor, el ARN de doble hélice que conforma la molécula de lumasirán se desenrolla y la cadena antisentido se une de forma específica a una secuencia conservada genéticamente en la región 3’ no traducida del ARNm de la proteína hidroxiácido oxidasa 1 o glicolato oxidasa. Esto ocurre una vez que el siRNA se incorpora al complejo enzimático multiproteico conocido como RISC (complejo de silenciamiento inducido por el ARN de interferencia) en el citosol, donde ciertas enzimas –como la endonucleasa argonauta-2– son capaces de degradar catalíticamente el ARNm diana en un proceso específico y altamente eficiente3 que da como resultado una reducción de la síntesis de proteína glioxilato oxidasa.
Aspectos moleculares
Según se ha avanzado, lumasirán es una molécula de ARN pequeño de interferencia (siRNA) formada por una doble hélice que está unida covalentemente a 3 residuos de N-acetilgalactosamina, la cual se conjuga con la cadena sentido del ARN y es la que permite la liberación selectiva del fármaco en el hígado a través de la captación por los receptores de asialoglicoproteína4. Estos receptores se expresan mayoritaria y abundantemente (0,5-1 millón por célula) en la superficie de los hepatocitos y favorecen la posterior endocitosis del fármaco mediada por receptor.
Seleccionado a partir de una serie de 49 candidatos identificados por métodos bioinformáticos, lumasirán se sintetiza químicamente como la sal sódica de un oligonucleótido de doble cadena, en el que la cadena sentido y antisentido se componen de 21 y 23 nucleótidos, respectivamente. Es el extremo 3´ de la cadena sentido el que se une al dominio “triantenario” de N-acetilgalactosamina; además, esa cadena sentido contiene dos enlaces de fosforotioato en el extremo 5´ (este tipo de enlaces con átomos de azufre protegen a los enlaces fosfodiéster normales de la escisión por exonucleasas). Por su parte, la cadena antisentido presenta 4 enlaces de fosforotioato, dos en cada extremo. Se hibridan entre sí 21 nucleótidos complementarios de cada cadena para formar la doble hélice de 21 pares de bases, quedando un extremo de 2 bases “colgando” en el extremo 3´ de la cadena antisentido.
El fármaco se presenta como un polvo higroscópico de color blanco a amarillo pálido, ampliamente soluble en agua. En su forma de sal sódica presenta un peso molecular de 17,28 KDa (de los cuales 9,17 KDa corresponden a la cadena sentido y 8,11 KDa a la cadena a antisentido) y una fórmula molecular de C530 H669F10N173O320P43S6Na43 (Figura 3). La molécula exhibe estereoisometría por la presencia de diversos centros quirales en las unidades de D-ribosa incluidas en todos los nucleótidos.

Eficacia y seguridad clínicas
La eficacia y seguridad clínicas de lumasirán por vía subcutánea a la dosis autorizada en pacientes con hiperoxaluria primaria tipo 1 han sido adecuadamente contrastadas en dos ensayos clínicos pivotales de fase 3, que se resumen a continuación.
El estudio ILLUMINATE-A fue un estudio multicéntrico e internacional, que constó de una fase inicial de tratamiento de 6 meses, con diseño doblemente ciego, controlado por placebo y aleatorizado (2:1), que incluyó un total de 39 pacientes adultos y niños de > 6 años con diagnóstico genético de HP-1, y una fase posterior de extensión en su mayoría abierta de 54 meses de tratamiento con lumasirán (solo los 3 primeros meses de la extensión fueron simple ciego).
Los pacientes debían tener una tasa de filtración glomerular estimada (TFGe) ≥ 30 ml/min/1,73 m2 y niveles de oxalato urinario ≥ 0,70 mmol/24 h/1,73 m2, pero sin evidencia clínica de oxalosis sistémica extrarrenal. Presentaron las siguientes características demográficas basales: mediana de edad de 14,9 años (41% entre 6 y 12 años, 15% de 12 a 18 y 44% entre 18 y 65), el 67% eran varones y el 77% de raza blanca. Se les permitió continuar con los tratamientos recibidos con anterioridad, pero se excluyeron del estudio pacientes trasplantados de hígado o riñón. Un tercio de los pacientes (33%) tenía una función renal normal (TFGe > 90 ml/min/1,73 m²), mientras que casi la mitad (49%) tenía insuficiencia leve (TFGe de 60-90 ml/min/1,73 m²) y el 18% insuficiencia moderada (TFGe de 30-60 ml/min/1,73 m²); además, una mayoría notificó antecedentes de cálculos renales sintomáticos (85%) y de nefrocalcinosis (54%), y hasta un 26% y 41% de ellos presentaba pielonefritis e infecciones del tracto urinario, respectivamente, en el momento basal. Las características demográficas y clínicas estuvieron bien balanceadas entre grupos de tratamiento.
La variable principal de eficacia fue el porcentaje de reducción desde el momento basal en la excreción urinaria de oxalato en orina de 24 h, corregida en función del área de superficie corporal (normaliza de forma efectiva la variación relacionada con la edad), como promedio de los meses 3 a 6. Entre las variables secundarias de interés se incluyeron la reducción de los niveles absolutos de excreción urinaria de oxalato, el cociente oxalato:creatinina, los niveles de oxalato plasmático y la funcionalidad renal.
Los resultados de la primera fase (Garrelfs et al., 2021) demuestran que el grupo de pacientes tratados con lumasirán5 (n= 26) mostró un descenso rápido y sostenido en los niveles de oxalato urinario en 24 h corregidos por superficie corporal: una reducción estadísticamente significativa en el 65,4% de los pacientes en comparación con un 11,8% de entre los tratados con placebo (n= 13), verificándose una diferencia de 54 puntos porcentuales a favor del fármaco en la variable principal (IC95% 44,8-62,3; p< 0,0001). En línea con esos datos, el cambio absoluto de oxalato en orina de 24 h tuvo resultados estadísticamente favorables a lumasirán a los 6 meses, con una diferencia de medias respecto a placebo de -0,975 mmol/24 h/1,73 m2 (IC95% -1,18 a -0,77).
Asimismo, tras 6 meses se confirmó una disminución del 60,5% en el cociente oxalato:creatinina en orina en el grupo de lumasirán frente a un aumento del 8,5% en el grupo control (diferencia de -52%; IC95% -64,3 a -39,3). Por todo lo anterior, se comprende que una mayor proporción de pacientes tratados con lumasirán alcanzó niveles normales de oxalato en orina (inferiores al límite superior de normalidad de 0,51 mmol/24 h/1,73 m²): un 52% vs. 0% con placebo (p= 0,001); esto se relacionó con una reducción del -40% en los niveles de oxalato en plasma respecto del periodo inicial con el uso de lumasirán, mientras que permanecieron casi sin cambios con placebo (diferencia de -39,5%; p< 0,001). Cabe destacar que no hubo diferencias en términos de eficacia de lumasirán en ningún subgrupo de pacientes, corroborándose el beneficio en la variable principal con independencia de factores como la edad, el sexo, la raza, el deterioro de la funcionalidad renal, el consumo inicial de vitamina B6 o los antecedentes de eventos sintomáticos de cálculos renales.
Los datos disponibles sugieren que la eficacia del fármaco sobre la reducción de los niveles de oxalato se mantiene en el tiempo. Con un seguimiento hasta un total de 12 meses, incluyendo el periodo de extensión abierto, se vio que la tasa de filtración glomerular se estabiliza en los pacientes que reciben lumasirán, en quienes la tasa promedio de eventos asociados a cálculos renales –visita a centro médico, uso de medicamentos o sangre visible en orina–se redujo desde 0,87 eventos/100 personas-día antes del estudio hasta aproximadamente 0,27; también disminuyó notablemente esa incidencia en pacientes que recibieron placebo en la fase ciega y lumasirán en la fase de extensión (desde 0,18 a 0,05). No obstante, la fase de extensión está aún en marcha y habrá que esperar a los resultados definitivos para extraer conclusiones sólidas.
Por otra parte, el estudio multicéntrico, multinacional y abierto ILLUMINATE-B incluyó en un solo brazo de tratamiento con lumasirán un total de 18 pacientes pediátricos de < 6 años con HP-1 una TFGe promedio de > 45 ml/min/1,73 m2 (niveles normales en el caso de menores de 12 meses). Con unos criterios principales de inclusión y de exclusión similares a los descritos para el principal estudio pivotal, se diseñó igualmente en 2 fases: una inicial de 6 meses de duración y una de extensión –aún en marcha– de 54 meses.
La mediana de edad de los pacientes al inicio fue de 50,1 meses (rango 4-74; 14 pacientes tenían entre 2 y 6 años), dos tercios de los pacientes pesaban entre 10 y 20 kg, el 56% eran mujeres y el 89% de raza blanca. Desde el punto de vista clínico, al inicio la mediana basal del cociente oxalato:creatinina en orina fue de 0,47, una mayoría de pacientes (78%) presentaba nefrocalcinosis, un 17% había tenido cálculos renales en el año previo y un 61% tomaba piridoxina; no obstante, la mayoría (78%) presentaba una tasa de filtración glomerular normal.
La reciente divulgación de los resultados de la primera fase del estudio (Sas et al., 2022) revela que, tras 6 meses de tratamiento con lumasirán, los pacientes lograron una reducción media del 72% (IC95% 66,4-77,5) en el cociente urinario oxalato:creatinina (promedio del mes 3 al 6) respecto al inicio, alcanzándose el objetivo primario de eficacia. En coherencia con los datos del ILLUMINATE-A, el fármaco se asoció con reducciones rápidas y sostenidas en el cociente oxalato:creatinina, similares en todos los subgrupos por peso; de modo interesante, 9 pacientes (50%) alcanzaron casi la normalidad en dicho cociente (≤ 1,5 × límite superior de normalidad). Además, con datos promedio desde el mes 3 al 6 se evidenció una reducción del oxalato en plasma de -31,7% respecto al inicio (IC95% 23,9-39,5). En ese periodo la TFGe se mantuvo estable y se notificaron 2 eventos asociados a cálculos renales en 2 pacientes, frente a la notificación de 4 eventos en 3 pacientes en el año anterior al estudio. Los datos de la ecografía renal en el mes 6 muestran una mejoría interesante en 8 pacientes (bilateral en 3 de ellos).
Finalmente, su seguridad ha sido caracterizada en base a los datos de 75 pacientes que han recibido el tratamiento en tres estudios de fase 3, 54 de ellos pacientes pediátricos. Para los datos disponibles, la media de exposición a lumasirán ha sido de 5,9 meses; la mitad (2,7 meses) si solo se consideran los menores de 6 años. Su perfil toxicológico es consistente en adultos y niños pequeños y parece benigno, pues no se observó ningún evento adverso grave relacionado con el tratamiento, ni tampoco una tasa destacable de discontinuación o interrupción (solo 1 paciente se retiró en ILLUMINATE-A por fatiga y alteración de la atención).
La frecuencia general de eventos adversos de cualquier grado relacionados con el tratamiento fue mayor con lumasirán que con placebo (42% vs. 8%), pero la práctica totalidad fueron de gravedad leve o moderada. Las reacciones adversas más comunes con lumasirán fueron reacciones en el lugar de inyección (25% vs. 0% con placebo), que ocurrieron en aproximadamente el 10% de inyecciones; sobresalen el eritema, el dolor, el prurito y el malestar, todas las cuales fueron leves y transitorias (comenzaron mayoritariamente el mismo día de la administración y se resolvieron en 1-2 días siguientes) y no provocaron interrupciones del tratamiento. También predominó el dolor abdominal de intensidad leve-moderada (15% vs. 7% con placebo), bien fuera superior o inferior, molestia o sensibilidad abdominales. No se han detectado cambios relevantes en parámetros clínicos (hematológicos, de bioquímica, electrocardiograma o pruebas de funcionalidad hepática y renal) ni tampoco parece que la inmunogenicidad del fármaco tenga influencia en su eficacia o seguridad (se vio una tasa de anticuerpos anti-lumasirán del 6%).
Aspectos innovadores
Lumasirán es un nuevo ARN pequeño de interferencia bicatenario, que se dirige a los hepatocitos (por incorporar en su molécula un residuo de N-galactosamina), donde se une al ARNm del gen HAO1 codificante para la enzima hidroxiácido oxidasa 1 o glicolato oxidasa y promueve su degradación mediante el proceso de interferencia del ARN. Por tanto, reduce los niveles de síntesis de esa proteína –encargada de transformar glicolato en glioxilato– y provoca una disminución de la cantidad de glioxilato disponible: este es un sustrato de la producción de oxalato, de modo que su efecto también se correlaciona con menores niveles de oxalato en orina y en plasma. Designado como huérfano, el medicamento ha sido autorizado para el tratamiento por vía subcutánea de la hiperoxaluria primaria de tipo 1 (HP-1) en todos los grupos de edad.
Su autorización se sustentó en los datos de un estudio pivotal de fase 3, aleatorizado y controlado por placebo, en cuya primera fase se trataron con doble cegamiento 39 pacientes adultos y niños > 6 años con función renal relativamente conservada. Los resultados promedio revelaron que, tras 6 meses de tratamiento, el nuevo fármaco reduce significativamente los niveles urinarios de oxalato respecto al nivel basal –variable principal– en una mayor proporción de pacientes (65% vs. 12% con placebo; p < 0,00001). El cambio absoluto de la excreción urinaria media de oxalato mostró una diferencia interesante: reducción de casi 1 mmol/24 h/1,73 m2 respecto a placebo. En esa comparativa se vio una disminución del 61% en el cociente oxalato:creatinina en orina (vs. 8,5% con placebo), de modo que el 52% y el 84% de los pacientes tratados con lumasirán consiguen niveles de oxalato en orina corregidos por superficie corporal normales o próximos a la normalidad, respectivamente. El tratamiento se relacionó, además, con una reducción del 40% en los niveles de oxalato en plasma, que no cambiaron sustancialmente con placebo.
Adicionalmente, se dispone de los resultados de un ensayo abierto de fase 3 y un solo brazo que apoyó su extensión de indicación en pacientes menores de 6 años. Un tratamiento con lumasirán durante 6 meses a 18 pacientes, en su mayoría con edades entre 2 y 6 años, redujo en promedio un 72% el cociente urinario oxalato:creatinina respecto al inicio; la mitad de los pacientes alcanzó un valor casi normal en dicho cociente. Asimismo, decreció en un 32% el nivel plasmático de oxalato respecto al estado basal, manteniéndose estable la funcionalidad renal durante todo el tratamiento.
Los resultados de ambos estudios revelan una eficacia rápida del fármaco, que es consistente en todos los subgrupos de pacientes (con independencia de factores basales como el peso, la edad, otros tratamientos concomitantes o la afectación renal) y parece mantenerse en el tiempo en las fases de extensión de los estudios, durante periodos de tratamiento de al menos 1 año.
Por otra parte, los datos de seguridad disponibles, también restringidos en tiempo de seguimiento, apuntan a que lumasirán es un fármaco bastante bien tolerado por los pacientes con HP-1. Su perfil toxicológico, similar en adultos y en niños, se caracteriza por la incidencia de eventos adversos (42% vs. 8% con placebo) que son en su mayoría leves-moderados y no conllevan una tasa reseñable de interrupciones o discontinuaciones. Predominan como reacciones adversas más frecuentes las reacciones en el sitio de inyección (25%, sobre todo eritema, dolor y prurito transitorios) y el dolor abdominal (15%), sin otros aspectos –como alteración de parámetros clínicos o inmunogenicidad– que afecten decisivamente a la seguridad del fármaco.
Cabe destacar que la muestra reducida de pacientes y el escaso periodo de seguimiento para el contexto de una patología crónica y progresivamente debilitante han sido aceptados por la EMA teniendo en consideración que se trata de una enfermedad rara y potencialmente mortal sin ningún tratamiento expresamente autorizado en la UE. Pese a que se han empleado variables bioquímicas intermedias6, se asume que es altamente plausible que los resultados comentados puedan asociarse a una reducción de los depósitos extrarrenales de oxalato y a una menor incidencia de comorbilidades asociadas a la HP-1, e incluso que puedan traducirse en una reducción de la progresión a oxalosis sistémica, por lo que se consideran clínicamente relevantes.
Entre las principales limitaciones de la evidencia sobresale la ausencia de datos de su influencia sobre variables de mayor relevancia clínica, tales como la calidad de vida, la mortalidad e incluso la necesidad de trasplante hepatorrenal, ni tampoco se conoce el efecto del fármaco en pacientes con HP-1 y enfermedad renal grave (en torno a un tercio de los nuevos diagnósticos), que fueron excluidos de los estudios y a priori son quienes podrían beneficiarse en mayor medida de la reducción de los niveles plasmáticos de oxalato. Otro aspecto controvertido es que no se vio mejora con el uso de lumasirán sobre el desarrollo de nefrocalcinosis o cálculos renales. Por todo ello resulta necesario disponer en un futuro de nuevos estudios con un periodo mayor de tratamiento y seguimiento para una mejor caracterización de su perfil beneficio-riesgo.
Los tratamientos usados en la práctica clínica para tratar la HP-1, como la hiperhidratación, los inhibidores de la cristalización o la piridoxina, pueden disminuir la incidencia de cálculos renales y retrasar la progresión de la enfermedad, pero no son eficaces en todos los pacientes (algunos fracasan en más de la mitad de los pacientes) y tienen importantes condicionantes relacionados con la falta de adherencia o reducción importante de la calidad de vida por requerir procedimientos invasivos. No se dispone de comparaciones directas ni indirectas entre lumasirán y esas otras opciones usadas, por lo que no se puede concluir sobre su superioridad clínica, si bien en el estudio pivotal se verificó una reducción en los niveles de oxalato urinarios en el subgrupo de pacientes que recibía inicialmente piridoxina.
En resumen, el nuevo fármaco inaugura una vía terapéutica en una indicación para la que no se disponía de tratamientos farmacológicos aprobados. No representa una cura de la HP-1 (no proporciona una secuencia normal del gen alterado, sino que buscar reducir el sustrato y evitar el desvío metabólico a la síntesis de oxalato), pero permite combatir las manifestaciones clínicas de la enfermedad debidas a la acumulación de oxalato, con independencia del tipo de mutación en el gen AGXT. El IPT de la AEMPS posiciona a lumasirán como una alternativa terapéutica en aquellos pacientes pediátricos y adultos sin antecedentes de trasplante y con enfermedad renal leve o moderada que no responden a las opciones de tratamiento estándar, por su capacidad de reducir los niveles urinarios y plasmáticos de oxalato, lo cual podría reducir las comorbilidades asociadas a la enfermedad. Sin embargo, los datos disponibles son por ahora escasos, y habrá que esperar a los procedentes de los ensayos en marcha para definir mejor su eficacia y seguridad a largo plazo.
Valoración