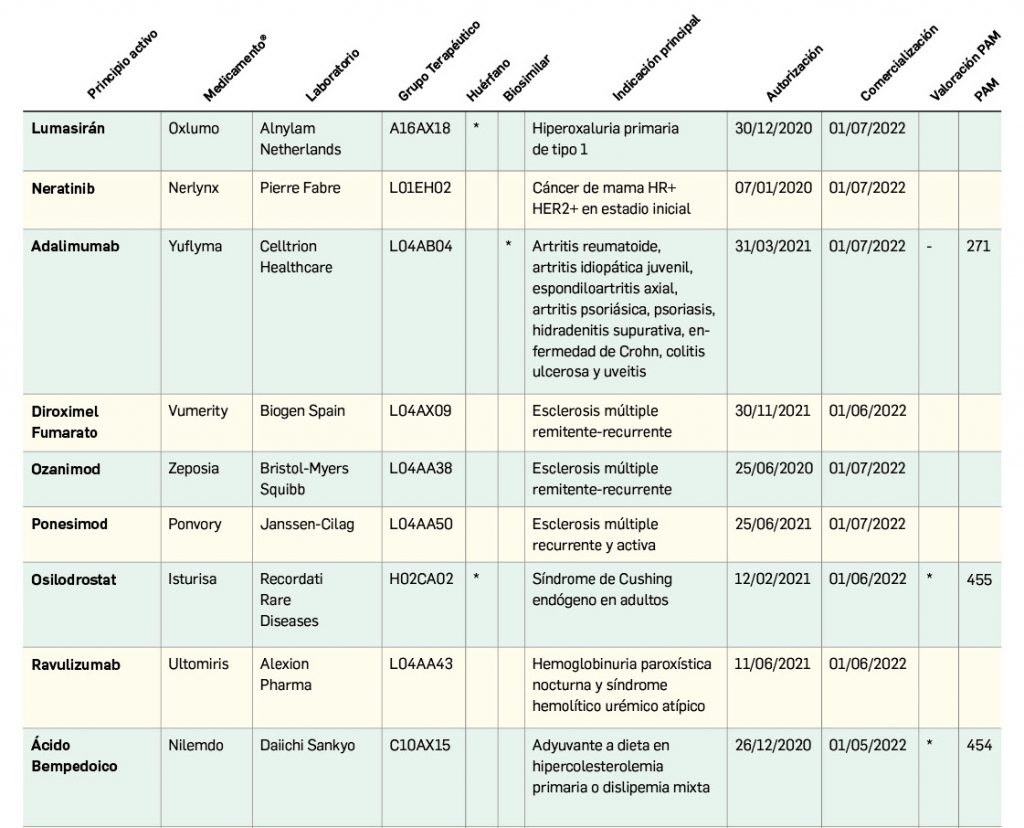
Resumen
Volanesorsén es un nuevo oligonucleótido antisentido diseñado específicamente para unirse al ARNm e inhibir la síntesis de la apolipoproteína C-III (apoC-III), de modo que favorece el aclaramiento hepático de los quilomicrones y otras lipoproteínas ricas en triglicéridos. Designado como huérfano, el medicamento ha recibido la autorización condicional como complemento a la dieta en pacientes adultos con síndrome de quilomicronemia familiar (SQF) confirmado genéticamente y con riesgo alto de pancreatitis, en quienes la respuesta a la dieta y al tratamiento de reducción de triglicéridos no ha sido suficiente. Esa combinación era, precisamente, la única terapia hasta ahora viable en el tratamiento a largo plazo del SQF, con eficacia limitada.
En un estudio pivotal de fase 3, un tratamiento semanal con volanesorsén indujo a los 3 meses una reducción significativa de -77% en los niveles de triglicéridos respecto al estado basal (vs. +18% con placebo; diferencia de -94%). La práctica totalidad de pacientes responden al tratamiento y una gran parte alcanza el objetivo de trigliceridemia de < 750 mg/dl (77% vs. 10% con placebo). Con un inicio rápido, el efecto reductor de triglicéridos del fármaco se atenúa con el tiempo de tratamiento (diferencia de -53% a los 6 meses y -40% a los 12 meses), lo cual puede deberse al menos en parte a la mayor tasa de interrupciones del tratamiento por motivos de seguridad. La superior eficacia del fármaco se mostró consistente con independencia del uso de hipolipemiantes y fue respaldada por los datos del estudio abierto de extensión, también en tratamientos de más de 1 año. Por otra parte, en su perfil toxicológico –manejable clínicamente– sobresale el riesgo de trombocitopenia (> 30%), que, aunque suele ser leve-moderada y tratable y no se asocia con hemorragias graves, determina a menudo la interrupción del fármaco. Junto a la alta incidencia de reacciones locales en el punto de inyección (> 80%), otros efectos adversos frecuentes durante el tratamiento son: cefalea, fatiga, dolor abdominal, diarrea o náuseas. Aún persisten incertidumbres sobre la relevancia de su inmunogenicidad y la seguridad –y eficacia– en mayores de 65 años.
En resumen, volanesorsén inaugura una ruta farmacológica en su indicación, siendo el primer fármaco específicamente autorizado frente al síndrome de quilomicronemia familiar; continúa la idea terapéutica de los nucleótidos antisentido iniciada en 2018 por nusinersén (usado en atrofia muscular espinal), aunque tiene mejor perfil de seguridad de lo que sería esperable en este tipo de terapias génicas (no provoca toxicidad hepática o renal sustancial). No obstante, por las limitaciones de la evidencia disponible (relativas al uso de un variable subrogada o a la representatividad de la población de participantes) y las incertidumbres sobre su beneficio-riesgo a largo plazo (el efecto decae con el tiempo y hay una alta tasa de interrupciones), su utilidad real en práctica clínica en el uso crónico que requeriría el SQF puede verse seriamente comprometida, a falta de disponer de datos adicionales de efectividad y tolerabilidad.
Aspectos fisiopatológicos
El síndrome de quilomicronemia familiar (SQF) o hiperlipoproteinemia de tipo 1 es una enfermedad ultrarrara y crónica del metabolismo de los lípidos que se caracteriza por una alteración de la metabolización de las lipoproteínas ricas en triglicéridos y, por extensión, por niveles séricos de triglicéridos anormalmente altos (> 880 mg/dl). Estos triglicéridos se transportan en sangre principalmente en quilomicrones, unas partículas de lipoproteínas grandes (1 µm diámetro) que dan nombre a la enfermedad y cuyo aumento patológico puede dar lugar a varias manifestaciones cínicas; también se encuentran elevados los niveles de proteínas de muy baja densidad (VLDL) ricas en triglicéridos.
La persistencia en plasma de los quilomicrones después de un periodo de ayuno de 12 a 14 h es característica de este trastorno (en condiciones fisiológicas se eliminan tras 3-4 h de ayuno), y se asocia directamente con los altos niveles de triglicéridos. La base fisiopatológica del SQF es la deficiencia o alteración funcional de la lipoproteína lipasa (LPL), una enzima esencial en la hidrólisis de los triglicéridos plasmáticos, que es un prerrequisito para un aclaramiento efectivo de los quilomicrones.
Se trata de una patología en ocasiones monogénica (5%) y de debut durante la infancia o adolescencia, causada en tal caso por mutaciones homocigóticas en los genes que codifican para la propia LPL o en los genes codificantes de otras proteínas necesarias para su correcto funcionamiento1 , como sus cofactores la apolipoproteína C-II o la apolipoproteína A-V, la LMF1 (del inglés, LPL chaperone lipase maturation factor 1) o la proteína GPIHBP1 (glycosylphosphatidylinositol-anchored high density lipoprotein-binding protein 1). No obstante, la forma más frecuente de presentación es como enfermedad de inicio tardío (95%), cuando tiene un origen poligénico, es decir, la causa reside en la acumulación de mutaciones en varios genes que pueden ser exacerbadas por factores secundarios, como la dieta, la obesidad, el consumo de alcohol o la diabetes no controlada. Se ha descrito que los niveles elevados en plasma de apolipoproteína C-III constituyen el principal factor de riesgo para la hipertrigliceridemia.
De herencia autosómica recesiva, se estima que el SQF afecta a entre 3.000 y 5.000 personas en todo el mundo (1-2 casos por cada millón de habitantes), mientras que la quilomicronemia primaria puede afectar a 1 de cada 600 individuos adultos. Con independencia del origen, la presencia continuada y excesiva de quilomicrones en la circulación reduce el flujo sanguíneo en los microvasos, que sería el evento patológico subyacente a la mayoría de las manifestaciones. Así, el SQF cursa con la aparición de numerosos xantomas eruptivos de pequeño tamaño en la piel, y en el fondo de ojo los vasos retinianos adquieren un típico aspecto rosado-blanquecino (lipidemia retinal). Es también muy común que se produzca una pancreatitis aguda (65-80% de los pacientes, la mayoría experimenta episodios recurrentes), consecuencia de los cambios inflamatorios causados por la quilomicronemia excesiva, que puede provocar daño e insuficiencia del páncreas o incluso llegar a ser mortal (5‑6%); se considera la manifestación más grave del SQF.
Además, los pacientes suelen presentar una serie de complicaciones graves y potencialmente mortales asociadas con niveles de triglicéridos mantenidos largos periodos por encima del umbral de 500 mg/dl (5,6 mmol/l). Entre las complicaciones de la pancreatitis a largo plazo, pueden figurar: pancreatitis crónica, diabetes pancreatogénica y hepatoesplenomegalia. Pero la quilomicronemia afecta a otros varios tejidos corporales, entre ellos el sistema nervioso central, el sistema musculoesquelético y el gastrointestinal, resultando en una variedad de manifestaciones tales como deterioro cognitivo (niebla mental, falta de concentración y deterioro de la memoria) y emocional (miedo y preocupación), y otros trastornos físicos que incluyen dolor y distensión abdominal, esteatorrea, astenia, fatiga, ansiedad y depresión, todos ellos frecuentes y de magnitud moderada a muy grave. La forma poligénica de la enfermedad también puede relacionarse con un mayor riego de patología cardiovascular. Todas estas complicaciones merman la calidad de vida de los pacientes, aumentan los días de trabajo perdidos y reducen la capacidad y las opciones de encontrar y mantener un empleo.
En relación con el tratamiento, en 2012 se autorizó la primera terapia génica para esta indicación (Glybera®, alipogén tiparvovec), con una autorización restringida a los pacientes con deficiencia hereditaria de LPL confirmada por prueba genética, que sufrían ataques de pancreatitis graves o múltiples y presentaban niveles detectables de proteína LPL. Sin embargo, este medicamento fue retirado de su uso en la UE desde octubre de 2017 tras la decisión del titular de la autorización de comercialización de no solicitar una renovación por razones comerciales.
El abordaje actual a largo plazo de un paciente con SQF es una estricta restricción de la ingesta total de grasas, que deben suponer menos del 10-15% de las calorías diarias (esto es, 15-20 g/día) para que permitan mantener los niveles sanguíneos de triglicéridos por debajo de 880 mg/dl. El uso de los fármacos clásicamente usados como reductores de grasas en hipertrigliceridemias, como las estatinas, los fibratos y los ácidos grasos omega-3 (también el uso off label de lopitamida) tienen una utilidad limitada en esta enfermedad, debido al menos en parte a que su efectividad depende de la existencia de niveles mínimos de enzima LPL funcional (notablemente deficitaria en una gran proporción de los pacientes con SQF). De forma similar, aunque la aféresis de lipoproteínas puede reducir los niveles muy altos de triglicéridos a corto plazo, su eficacia ha sido cuestionada por los resultados de los ensayos clínicos y no se recomienda de forma sistemática su uso en SQF, por lo que esta enfermedad representa una necesidad médica no cubierta (EMA, 2019).
Acción y mecanismo
Volanesorsén es un oligonucleótido antisentido diseñado específicamente para inhibir la formación de la apolipoproteína C-III (apoC-III), encargada de regular el metabolismo de los triglicéridos y el aclaramiento hepático de los quilomicrones y de otras lipoproteínas ricas en triglicéridos. Mediante su unión a la región no traducida 3´ del ARNm de la apoC-III, provoca la degradación de dicho ARNm e impide la traducción proteica, consiguiendo activar así el metabolismo de los triglicéridos por una vía independiente de la lipoproteína lipasa. El medicamento, designado como huérfano, ha sido autorizado como complemento a la dieta en pacientes adultos con síndrome de quilomicronemia familiar (SQF) confirmado genéticamente y con riesgo alto de pancreatitis, en quienes la respuesta a la dieta y al tratamiento de reducción de triglicéridos no ha sido suficiente.
La apoC-III es un regulador clave del metabolismo de los triglicéridos que actúa como inhibidor del mismo; reside en la superficie de las lipoproteínas que contienen apoB y de las lipoproteínas de alta densidad (HDL). Sus niveles están elevados en pacientes con SQF, estando la mayoría de las moléculas de apoC-III asociadas con lipoproteínas ricas en triglicéridos. Se entiende, por tanto, que la disminución de la producción y los niveles de apoC-III que provoca la terapia con volanesorsén conduce a una menor inhibición del aclaramiento de triglicéricos, o sea, al aumento de su metabolismo y a la reducción de sus niveles en plasma. Los resultados de estudios clínicos han evidenciado que volanenorsén reduce sustancialmente las concentraciones plasmáticas de los triglicéridos en ayunas (-72% vs. +24% con placebo), el colesterol total, el colesterol no HDL, la apoC-III, de la apoB-48 y de los triglicéridos de los quilomicrones (-77% vs. +38% con placebo); en cambio, aumenta las del colesterol-LDL, el colesterol-HDL y la apoB.
Aspectos moleculares
El nuevo fármaco es un oligonucleótido antisentido de cadena única, que ha sido diseñado Y sintetizado con una secuencia de bases específica para unirse con alta afinidad y de forma complementaria a la diana del ARNm de la ApoC-III, concretamente a las bases en posición 489-508 de la región no traducida de su extremo 3´. A partir de esa unión, favorece la degradación del ARNm e interrumpe el proceso de producción proteica. Volanesorsén comprende la siguiente secuencia de 20 bases (Figura 1): 5’AGMeCMeUMeUMe CTTGTMeCMeCAGMeCMeUMeUMeUAMeU-3′, donde A= adenosina, AMe= 2´-O-metiladenosina C= citosina, Cme= 2ʹ-O-metilcitosina, G= guanosina, Gme= 2ʹ-O-metilguanosina, T= timina; TMe= 2ʹ-O-metiltimina; U= uracilo, y UMe= 2ʹ-O-metiluracilo; cada uno de los 19 enlaces entre nucleótidos son de tipo fosforotioato diéster, de 3’-O a 5’-O.
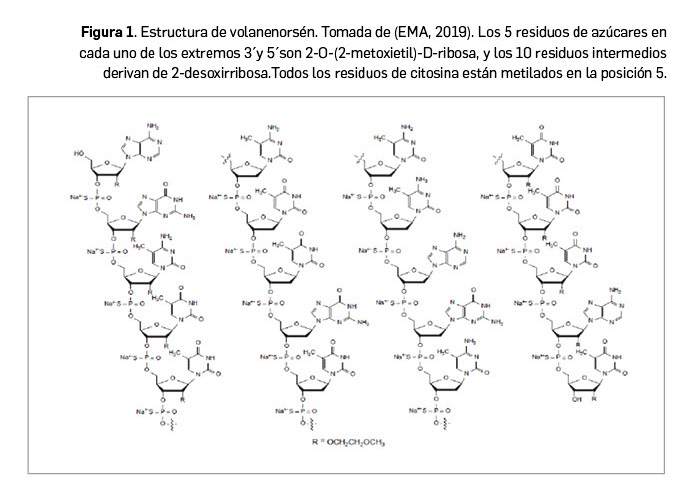
En el medicamento, el fármaco se presenta en su sal nonadecasódica y se corresponde con la fórmula molecular C230H301N63O125P19S19Na19 y con un peso molecular de 7,6 KDa. Se presenta como un sólido amorfo e higroscópico de color amarillo o blanco, ampliamente soluble en agua y en un tampón de acetato sódico a pH 3. Es una mezcla de 219 diastereoisómeros, si bien no se han observado polimorfismos de la molécula.
Eficacia y seguridad clínicas
La eficacia y la seguridad clínicas de volanesorsén por vía subcutánea han sido adecuadamente contrastadas en la indicación y la pauta posológica autorizadas mediante un ensayo clínico pivotal de fase 3 (APROACH), multinacional y multicéntrico (40 centros en 12 países), doble ciego y controlado por placebo, de 52 semanas de duración, que aleatorizó (1:1) a 66 pacientes con diagnóstico confirmado2 de síndrome de quilomicronemia familiar (SQF) y antecedentes de quilomicronemia (triglicéridos en ayunas ≥ 750 mg/dl). Al entrar en el estudio, los tratamientos hipolipemiantes en curso, que tenían más de la mitad de los pacientes (55%), no se modificaron (48% con fibratos, 29% con aceite de pescado y 20% con estatinas).
Entre las características demográficas basales de los pacientes, bien equilibradas en los dos brazos del estudio, se puede citar que la edad media fue de 46 años (solo 5 pacientes tenían ≥ 65 años), el 55% eran mujeres, el 80% de raza blanca y el 17% asiáticos, y tenían un índice de masa corporal medio de 25 kg/m2. La mediana de edad al diagnóstico fue de 27 años, los niveles medios de triglicéridos eran 2.209 mg/ml (tras 6 semanas de preinclusión con dieta pobre en grasas y restricción de alcohol), un cuarto de los pacientes (23%) carecía de mutaciones genéticas conocidas y, en cuanto a las manifestaciones clínicas, un 76% tenía antecedentes de pancreatitis aguda, un 15% de diabetes, un 21% de lipemia retiniana y un 23% de xantomas eruptivos. Se excluyeron pacientes que habían recibido plasmaféresis en las 4 semanas previas o Glybera® en los 2 años previos (sí la habían recibido con anterioridad el 11% de pacientes), los que tenían diabetes o hipertensión no controladas, pancreatitis activa o enfermedad hepática o renal.
La variable primaria de eficacia fue el cambio porcentual en los niveles de triglicéridos en sangre tras 3 meses de tratamiento. Otras variables secundarias fueron el efecto sobre los niveles de triglicéridos a los 6 y a los 12 meses, la tasa de respuesta (fijando como objetivo una reducción de la trigliceridemia por debajo de 750 mg/dl, cifra considerada como el límite a partir del cual la acumulación de quilomicrones es significativa y aumenta el riesgo de pancreatitis aguda), la aparición de pancreatitis aguda y de dolor abdominal, entre otras.
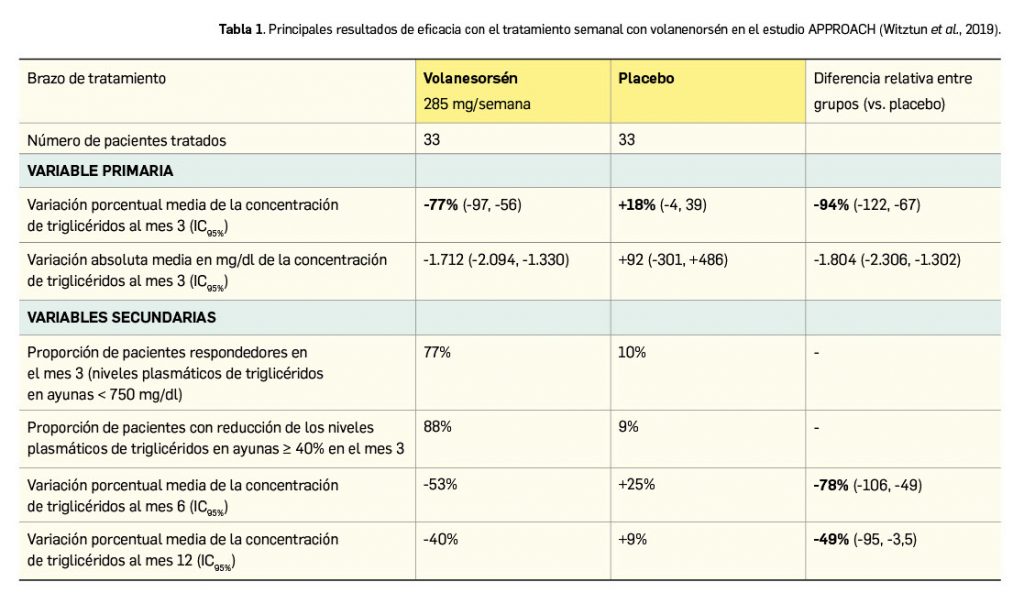
El tratamiento con volanesorsén (285 mg una vez a la semana), ajustable según la concentración de plaquetas, dio lugar a una significativa reducción de los niveles de triglicéridos en comparación con un placebo equivalente al mes 3 (Tabla 1). En el brazo experimental, 19 pacientes (58%) completaron los 12 meses de tratamiento del estudio; hubo pacientes que no recibieron todas las dosis, pero sí acudieron a las evaluaciones durante todo el estudio. Los resultados (Witztun et al., 2019) revelaron que el inicio del efecto fue rápido, observándose ya en la semana 4 una separación de la curva de niveles de triglicéridos frente al placebo, con una respuesta máxima a las 12 semanas que se fue atenuando con el tiempo; en todo caso, la diferencia entre ambos grupos fue estadísticamente significativa también a los 6 y a los 12 meses de tratamiento. La eficacia del fármaco fue consistente en los distintos subgrupos de pacientes, con independencia del tratamiento concurrente con ácidos grasos omega-3 o fibratos.
Un análisis a posteriori reveló que el tratamiento con volanesorsén redujo la incidencia de pancreatitis durante un periodo de tratamiento de 52 semanas (variable exploratoria): 4 eventos en el grupo control frente a 1 solo evento en el grupo experimental; la diferencia en el subgrupo de pacientes con antecedentes de crisis de pancreatitis recurrentes (≥ 2 eventos en los 5 años previos) alcanzó significación estadística a favor de volanersorsén. Sin embargo, la variación promedio de la intensidad máxima del dolor abdominal informado por el paciente durante el tratamiento no fue significativa.
Adicionalmente, los datos del ensayo pivotal se vieron respaldados y complementados por los del estudio abierto de extensión CS7, también de fase 3 y multicéntrico, que fue diseñado con el objetivo de evaluar el uso a largo plazo de volanesorsén en un solo brazo de pacientes con SQF. Se incluyeron un total de 67 pacientes, que procedían bien del brazo experimental del ensayo pivotal, bien del estudio de soporte COMPASS o bien eran participantes nuevos3. Todos ellos debían reducir la frecuencia de dosis (a 285 mg/2 semanas) tras 13 semanas. Los resultados disponibles de este estudio aún en marcha (50 pacientes siguen en tratamiento, de los cuales se ha suspendido y ajustado el tratamiento en 29) están en la misma línea que en el estudio APPROACH y confirman que el fármaco mantiene su eficacia durante al menos 18 meses (Tabla 2).
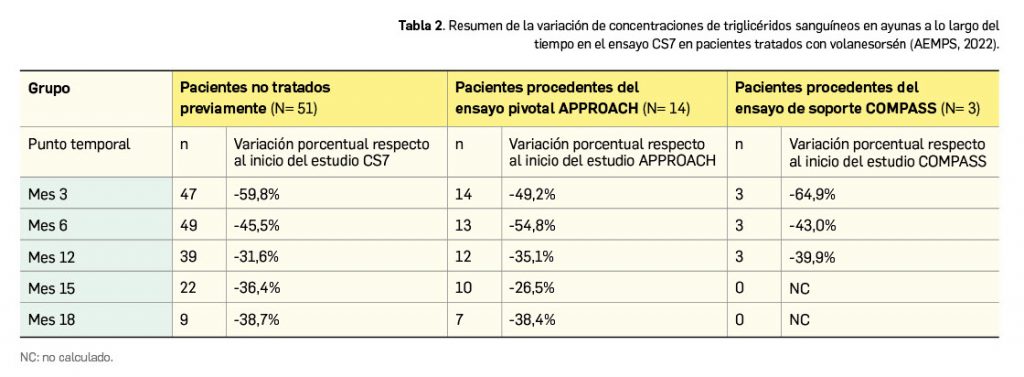
Así, para los pacientes procedentes de los estudios pivotal y de soporte, la reducción porcentual de la trigliceridemia en ayunas hasta el mes 3 desde el inicio de su estudio origen osciló entre el -49% y el -65%, respectivamente; de entre los que procedían del estudio pivotal, la reducción a los 6 meses fue del -55%, y a los 12 meses, del -35%. De modo interesante, entre los pacientes con SQF que no habían recibido tratamiento previo se verificó una reducción del -60% en los niveles de triglicéridos al mes 3 de tratamiento (media de 804 mg/dl al mes 3 vs. 2.341 mg/dl al inicio); si bien los niveles aumentaban progresivamente con el tiempo, la eficacia seguía en valores notables al mes 18, cuando se confirmó una reducción de -39% respecto al inicio (media de 1.139 mg/dl al mes 18 vs. 2.341 mg/dl al inicio).
Conviene aclarar que el estudio de soporte COMPASS fue un ensayo de fase 3, doble ciego y controlado por placebo, de 26 semanas de duración, que aleatorizó a una población distinta de pacientes con hipertrigliceridemia (N= 113; nivel basal medio de triglicéridos de 1.261 mg/dl). El tratamiento con volanesorsén (300 mg/semana hasta la semana 12, y posteriormente cada 2 semanas) indujo también una reducción notable de -72% en los niveles sanguíneos de triglicéridos al mes 3 (variable primaria), frente a solo un -2,9% con placebo, lo que suponía una diferencia estadísticamente significativa del -69%. El fármaco demostró eficacia significativa tanto en pacientes con hipertrigliceridemia severa como en aquellos con SQF; en este último subgrupo (solo 7 pacientes) las diferencias promedio fueron incluso mayores: reducción del nivel de triglicéridos de -73% desde el inicio en el brazo experimental frente a un aumento del 70% con placebo (Gouni-Berthold et al., 2021).
Por último, la seguridad de volanesorsén se ha analizado en base a los datos procedentes de 86 pacientes tratados con el fármaco en los estudios de fase 3 durante una media de 25 semanas, pudiéndose concluir que tiene un perfil toxicológico no desdeñable pero aceptable. Las reacciones adversas más incidentes con el nuevo tratamiento fueron las reacciones locales en la zona de inyección (82% vs. 0% con placebo) –incluidas eritema (78%), dolor (44%), prurito (26%) o hinchazón (29%)–, y trombocitopenia con niveles de plaquetas por debajo de 100.000/µl (40% vs. 0% con placebo). En su mayoría fueron leves y autolimitadas en el tiempo, y la trombocitopenia se manejó con éxito mediante ajustes posológicos (incluida la interrupción) y el uso de corticoides, no asociándose con una mayor incidencia de eventos hemorrágicos importantes (sí de sangrados en general: 36% vs. 14% con placebo). Otros efectos adversos notificados con frecuencia fueron: cefalea (21% vs. 15%), fatiga (16% vs. 10% con placebo), dolor abdominal (15% vs. 8%), diarrea (14% vs. 9%) y náuseas (13% vs. 4%). Se vio que los pacientes tratados con el fármaco tienen mayor probabilidad de interrumpir el tratamiento por eventos adversos (17% vs. 2% con placebo), principalmente por reacciones en el sitio de inyección o trombocitopenia.
La inmunogenicidad parece ser tiempo-dependiente: un 16% de los pacientes tratados con el fármaco presentaba anticuerpos anti-fármaco a los 6 meses y un 30% de los que lo recibieron durante 12 meses; si bien no parece que esto afecte al perfil beneficio-riesgo del fármaco, hay pocos datos aún a largo plazo y esto debe reevaluarse en un futuro. De igual modo, los escasos datos en pacientes de > 65 años de edad no permite concluir de forma sólida sobre la seguridad en mayores, aunque sugieren que puede haber una incidencia de eventos adversos comparable a la de adultos jóvenes.
Aspectos innovadores
Volanesorsén es un oligonucleótido antisentido diseñado específicamente para unirse al ARNm de la apolipoproteína C-III (apoC-III) e inhibir su traducción y la síntesis proteica. Habida cuenta del papel como inhibidor del metabolismo de los triglicéridos que tiene la apoC-III, el fármaco favorece el aclaramiento hepático de los quilomicrones y de otras lipoproteínas ricas en triglicéridos. El medicamento, designado como huérfano, ha recibido la autorización condicional como complemento a la dieta en pacientes adultos con síndrome de quilomicronemia familiar (SQF) confirmado genéticamente y con riesgo alto de pancreatitis, en quienes la respuesta a la dieta y al tratamiento de reducción de triglicéridos no ha sido suficiente. La única terapia hasta ahora viable a largo plazo frente al SQF era la precisamente la restricción de la ingesta total de grasas junto con fármacos hipolipemiantes (estatinas, fibratos y ácidos grasos omega-3), si bien han demostrado una eficacia limitada.
Su aprobación se ha sustentado fundamentalmente en los resultados del estudio pivotal de fase 3 APPROACH, en el que se verificó que un tratamiento semanal con el nuevo fármaco inducía tras 3 meses una reducción del -77% en los niveles de triglicéridos respecto al estado basal, lo que supone una disminución estadísticamente significativa de -94 puntos porcentuales respecto a placebo (variación de +18%). La práctica totalidad de pacientes responden al tratamiento y 3 de cada 4 alcanzan el objetivo de trigliceridemia de < 750 mg/dl (77% vs. 10% con placebo). Con un inicio rápido (apreciable desde la semana 4 y máximo a las 12 semanas), el efecto reductor de triglicéridos del fármaco se atenúa con el tiempo de tratamiento (diferencia de -53% a los 6 meses y -40% a los 12 meses), si bien dicha reducción puede explicarse al menos en parte por la mayor tasa de interrupciones (42% vs. 6% con placebo), bien voluntarias o ajustes posológicos por motivos de seguridad. De modo interesante, su eficacia se ha mostrado consistente en los distintos subgrupos de pacientes, con independencia del uso simultáneo con ácidos grasos omega-3 o fibratos. Las variables secundarias o los datos del estudio abierto de extensión respaldan la superioridad de volanesorsén respecto a placebo, también en tratamientos de más allá de 1 año. Por otra parte, el perfil toxicológico del fármaco parece adecuadamente caracterizado y manejable clínicamente. El principal problema de seguridad asociado es la trombocitopenia, que afecta a más de un tercio de los pacientes tratados y, si bien suele ser leve-moderada y tratable, con frecuencia determina la interrupción del tratamiento; en todo caso, no se asocia con una mayor incidencia de sangrados graves. Junto a la alta incidencia de reacciones locales en el punto de inyección (> 80%, incluyendo hemorragias leves), otros efectos adversos frecuentes con el uso de volanesorsén son de tipo inespecífico (cefalea o fatiga) o relacionados con el tracto gastrointestinal (dolor abdominal, diarrea o náuseas). Aún persisten incertidumbres sobre la relevancia de su inmunogenicidad y la seguridad –y eficacia– en mayores de 65 años.
Conviene subrayar, entre las limitaciones de la evidencia disponible, que la variable principal del ensayo pivotal es una variable bioquímica subrogada, por lo que el impacto clínico de la reducción de triglicéridos con volanesorsén es desconocido (los resultados en variables clínicas como la incidencia de pancreatitis4 o el dolor abdominal son muy limitados). Además, la muestra de pacientes no es completamente representativa de la población con SQF por haberse incluido una amplia proporción de pacientes sin antecedentes de pancreatitis (28%) y excluido aquellos con comorbilidades cardiacas o diabetes, lo cual puede limitar la validez externa de los estudios.
Volanesorsén inaugura una ruta farmacológica en su indicación, siendo el primer fármaco específicamente autorizado frente al síndrome de quilomicronemia familiar; continúa la idea terapéutica de los nucleótidos antisentido iniciada en 2018 por nusinersén (aprobado para el tratamiento de la atrofia muscular espinal), aunque con ligeras diferencias en su mecanismo de acción. El nuevo fármaco presenta un mejor perfil de seguridad de lo que sería esperable en este tipo de terapias génicas: no provoca toxicidad hepática o renal sustancial, ni gran incidencia de síntomas gripales.
En resumen, puede ser una opción de tratamiento eficaz como complemento a la dieta baja en grasas en pacientes con SQF e historia de pancreatitis recurrente que no alcanzan los niveles objetivo de triglicéridos con otros hipolipemiantes. No obstante, dado que parece que su efecto decae con el tiempo, que hay una alta proporción de interrupciones del tratamiento y que su perfil beneficio-riesgo a largo plazo no está suficientemente caracterizado (se debe reducir dosis a los 3 meses y revisar periódicamente los niveles de plaquetas y de triglicéridos), su utilidad real en práctica clínica en el uso crónico que requeriría el SQF puede verse seriamente comprometida, a falta de disponer de datos adicionales de efectividad y tolerabilidad (AEMPS, 2022).
Valoración