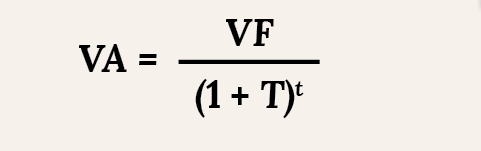La inversión en investigación y desarrollo (I+D) por parte de la industria de medicamentos y tecnologías sanitarias es cada vez mayor. Por este motivo, y debido a su importancia sanitaria, económica y social, muchos países han creado agencias de Evaluación de las Tecnologías Sanitarias (ETS) para informar y ayudar a la toma de decisiones en el ámbito del cuidado de la salud y para mejorar la asignación de fondos públicos para las intervenciones y tecnologías sanitarias, evaluando y recompensando su innovación.
El concepto de innovación en salud ha sido ampliamente descrito y discutido en la literatura. Sin embargo, pocas veces se ha revisado, en el marco de la actuación de las agencias de ETS, cómo los distintos países definen este concepto, cómo se mide y cómo se incorpora en sus guías metodológicas y en sus evaluaciones. La mayoría de las agencias de ETS examinan las características de la innovación desde la perspectiva de los pacientes, en función del beneficio terapéutico que aportan, las necesidades no cubiertas que pueden satisfacer, la seguridad aportada, el modo de administración y su impacto en el presupuesto actual; lo que se conoce como una “perspectiva estática”. Sin embargo, aunque con menos frecuencia, algunos sistemas de ETS adoptan una perspectiva más dinámica en la que contemplan, además, la aportación futura de la I+D de la nueva alternativa.
El estudio de Rejon-Parrilla y colaboradores, con el objetivo de establecer una definición amplia de innovación y un proceso para su adaptación en las agencias de ETS, ha evaluado el concepto y los criterios empleados: a) para medir la innovación en agencias nacionales de ETS de varios países (Francia, Italia, Inglaterra, España y Japón); y b) para estudiar cómo se considera este concepto en el proceso de evaluación y fijación de precio y reembolso (P&R). Además, se analizó el caso concreto de España para discutir cómo se debería fortalecer el grado de innovación en las decisiones de las agencias de ETS.
Tanto Francia como Inglaterra son sistemas centralizados que emplean altos estándares de transparencia y que integran el concepto de innovación de manera diferente. En el caso de Inglaterra se entiende como una característica independiente, mientras que en Francia este concepto se encuentra relacionado con otros criterios. Por otro lado, Japón presenta un sistema de ETS centralizado en el que se premia la innovación mediante la aplicación de un precio superior al precio del comparador. Italia, por su parte, posee un sistema más fragmentado a pesar de tener una agencia nacional, y al igual que Japón, premia la innovación con un precio superior al precio del comparador. Por último, España es el país con una mayor descentralización, con varias agencias de ETS regionales, además de las nacionales, pero con competencias paralelas, que incluye el grado de innovación entre los criterios para la inclusión de medicamentos y productos sanitaros en la financiación del Sistema Nacional de Salud.
Tras la búsqueda bibliográfica, se obtuvieron un total de 543 artículos que, tras revisar título y abstract, se redujeron a 73. Finalmente, para la realización del estudio se excluyeron 15 y se emplearon un total de 58 referencias. El término de innovación se clasificó mediante el empleo de 8 dimensiones (Tabla 1).
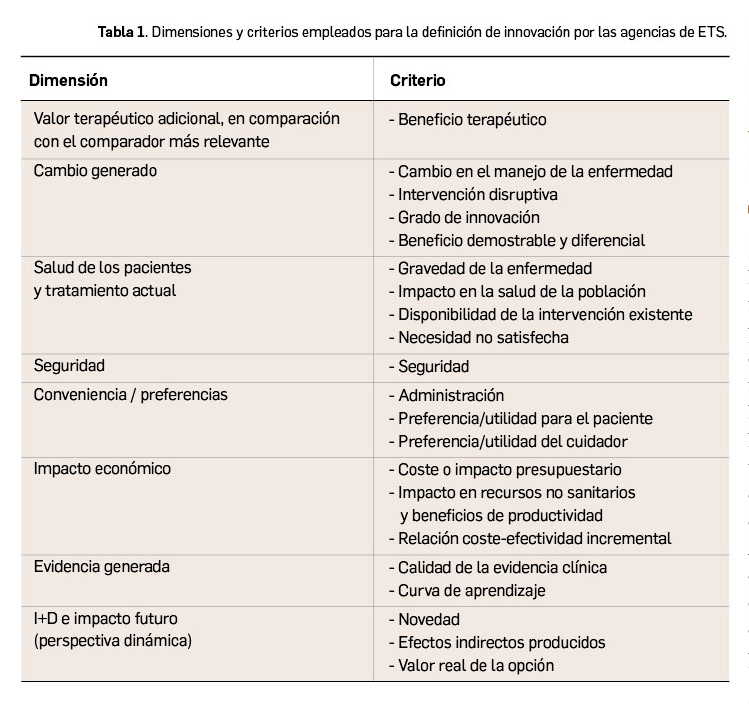
Los países analizados se dividieron en dos grandes grupos en función de su propia definición de innovación. Francia, Japón e Italia son países que emplean términos como la gravedad, la necesidad no satisfecha y el valor terapéutico adicional como indicadores del grado de innovación de una tecnología sanitaria, mientras que Inglaterra y España consideran el grado de innovación como un criterio independiente y adicional a los demás. Sin embargo, estos dos últimos países no aportan información metodológica para orientar sobre cómo los tomadores de decisiones deben medir esta innovación, dejando la determinación del grado de innovación en manos de los miembros de las agencias de ETS.
En conclusión, es necesario definir claramente el término innovación. Este concepto debe ser independiente de otras dimensiones de valor ya analizadas por los sistemas de ETS, con el fin de que el término sea operativo y ayude en la evaluación y la adopción de decisiones de precio y financiación de las tecnologías sanitarias.
Comentario
El artículo revisado abre el debate sobre la necesidad de establecer no solo los criterios, sino también una definición explícita sobre el concepto de innovación, que se pueda aplicar de forma rigurosa en las diferentes agencias de ETS de los países, con el fin de ayudar a la toma de decisiones sobre las tecnologías sanitarias.
Una de las principales limitaciones por las que, hasta el momento, no se ha consensuado una definición específica para tal término es que este criterio recae generalmente en los propios comités que evalúan a la tecnología sanitaria.
Además, la medición de los parámetros asociados al concepto de innovación no tiene que llevar implícito una medida cuantitativa, pero sí debe ser lo suficientemente rigurosa y reproducible para evitar sesgos o discrecionalidad en el proceso de financiación. Es decir, para mejorar la calidad de las evaluaciones de las agencias de ETS es recomendable que la determinación del grado de innovación de la tecnología incorpore la transparencia en su examen y brinde la oportunidad a las diferentes partes interesadas de ser partícipes en el proceso. En este sentido, sería recomendable conocer las preferencias de la sociedad.