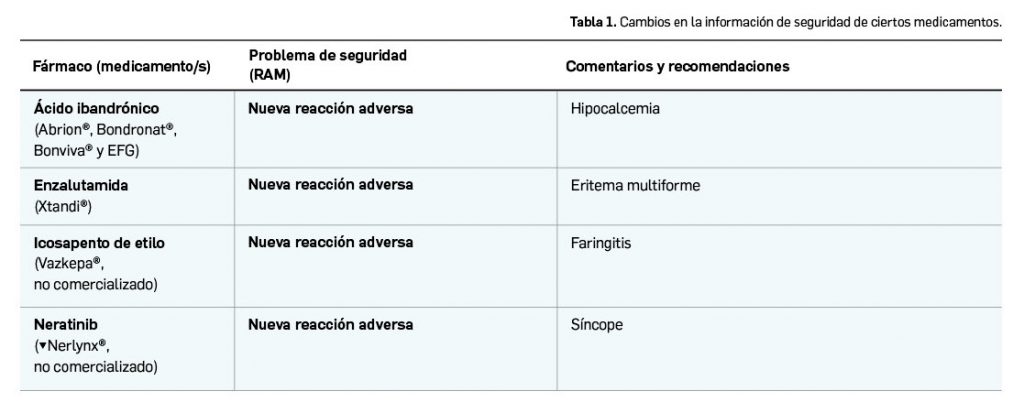
La Organización Mundial de la Salud (OMS) ha alertado del riesgo de error de medicación grave por la administración inadecuada de inyección de ácido tranexámico por vía intratecal en lugar de vía intravenosa, que puede resultar mortal. El motivo fue la confusión con la anestesia espinal obstétrica durante partos por cesárea.
La Organización Mundial de la Salud (OMS) ha informado sobre errores de medicación que se siguen repitiendo por confusión entre el aspecto físico de las ampollas de ácido tranexámico con otros medicamentos que se administran por vía intratecal.
En concreto, la OMS informa de que ha habido notificaciones de casos en los que el TXA se confundió con la anestesia espinal obstétrica (por ejemplo, con bupivacaína) utilizada en partos por cesárea, resultando en una administración intratecal inadecuada. Por vía intratecal, el ácido tranexámico (TXA) es tóxico es una neurotoxina potente y puede provocar lesiones graves, que ponen en peligro la vida, como convulsiones refractarias, arritmias cardiacas, paraplejía, lesiones neurológicas permanentes y la muerte en el 50% de los casos.
La profunda toxicidad del TXA intratecal se describió en 1980. Una revisión de 2019 identificó 21 casos notificados de inyección intratecal involuntaria de TXA desde 1988, de los cuales 20 pusieron en riesgo la vida y 10 fueron fatales. Dieciséis casos fueron reportados entre 2009 y 2018.
La OMS y otras agencias reguladoras recomiendan el uso temprano de TXA intravenoso dentro de las 3 horas posteriores al nacimiento, además de la atención habitual para mujeres con hemorragia posparto (HPP), clínicamente diagnosticada después de un parto vaginal o una cesárea. El TXA debe administrarse a una dosis fija de 1 g en 10 ml (100 mg/ml) por vía intravenosa a la velocidad lenta de 1 ml/min, con una segunda dosis también intravenosa de 1 g si el sangrado continúa después de 30 min.
De igual modo, la inyección del antifibrinolítico TXA se indica en pacientes con hemofilia para uso a corto plazo (2 a 8 días) con el objetivo de reducir o prevenir la hemorragia y reducir la necesidad de terapia de reemplazo durante y después de la extracción dental.
Los profesionales sanitarios deben administrar la inyección de TXA siempre por vía intravenosa. Se suministra en ampollas o viales de dosis únicas que contienen 100 mg de ácido tranexámico en 1 ml. En España está disponible en ampollas de 5 ml o de 10 ml, bien como medicamento genérico (EFG) o bien bajo el nombre comercial de Amchafibrin® ampollas de 5 ml (500 mg); recientemente se ha autorizado otro medicamento con TXA: Medsamic® solución inyectable de 100 mg/1 ml en ampollas de 5 y 10 ml.
El TXA se almacena con frecuencia muy cerca de otros medicamentos, incluidos los anestésicos locales inyectables indicados para la analgesia espinal (por ejemplo, para la cesárea). La inyección de TXA, la inyección de bupivacaína y otros productos utilizados en el entorno perioperatorio pueden tener una apariencia similar, como un color de tapa de vial o ampollas similares que pueden contribuir a las confusiones. La presentación de algunos de los anestésicos locales también es similar a la presentación de los medicamentos con TXA (ampolla transparente que contiene una solución transparente), el cual se puede administrar erróneamente en lugar del anestésico intratecal previsto, provocando los citados efectos adversos indeseables, potencialmente muy graves.
Diversos grupos de obstetras de varios países han informado en los últimos años de la administración inadvertida de TXA intratecal y de lesiones relacionadas neurológicas graves (Yamaura et al., 1980; Bishop et al., 2019; Patel et al., 2019).
En definitiva, el ácido tranexámico es un fármaco que salva vidas, pero todo el personal del quirófano debe considerar y abordar este posible riesgo clínico por la similar apariencia de sus medicamentos con otros. Se requiere la revisión de las prácticas existentes de manejo de medicamentos en el quirófano para disminuir este riesgo, como el almacenamiento de TXA lejos del carro de medicamentos anestésicos, preferiblemente fuera del quirófano.
Recomendaciones
El manejo cuidadoso de la inyección de ácido tranexámico es importante para evitar errores de medicación que podrían provocar lesiones graves o la muerte. Por este motivo, en línea con las propuestas de la FDA de EE.UU. sobre este asunto, se pueden hacer las siguientes recomendaciones:
- Almacenar los viales de inyección de ácido tranexámico por separado, lejos de otros medicamentos, de manera que las etiquetas sean visibles para evitar tener que identificar los medicamentos por el color de la tapa del vial.
- Añadir una etiqueta de advertencia auxiliar para señalar que el vial contiene ácido tranexámico.
- Revisar la etiqueta del envase para asegurarse de que se selecciona y administra el producto correcto.
- Utilizar el escaneo de códigos de barras cuando almacene gabinetes de medicamentos y prepare o administre el producto.
- Animar a los profesionales de la salud y a los pacientes a notificar los eventos adversos, errores de medicación y problemas de calidad experimentados con el uso de cualquier medicamento al Sistema Español de Farmacovigilancia Humana a través de formulario electrónico en www.notificaRAM.es, del programa de notificación de eventos adversos de la AEMPS.