El asma es una enfermedad heterogénea caracterizada por una inflamación crónica de las vías aéreas; presenta una gran prevalencia, habiéndose estimado que hasta 358 millones de personas presentan esta patología en todo el mundo. Un problema añadido es que la incidencia parece aumentar de forma progresiva, por lo que esta patología adquirirá una mayor relevancia clínica con el paso del tiempo. El asma eosinofílica (AE) –identificada mediante un recuento de eosinófilos de ≥ 150-300 células/μl– es un fenotipo de asma caracterizado por una inflamación eosinofílica, que afecta al 5% de los asmáticos y a hasta la mitad de los graves. La eosinofilia aumenta el riesgo de exacerbaciones, por lo que, además de incrementar el coste del manejo de esta enfermedad, ya de por sí elevado, las exacerbaciones secundarias a un control deficitario lo incrementan más aún. Asimismo, la calidad de vida sufre un deterioro importante.
El asma grave requiere de la administración de corticoides inhalados en adición a los β agonistas de acción larga (LABA) y otros fármacos; sin embargo, en ocasiones esto puede no ser suficiente. Los tratamientos con anticuerpos monoclonales específicamente dirigidos frente a la interleucina-5 (anti IL-5), como mepolizumab (MEP), benralizumab (BEN) o reslizumab (RES), que actúan como mediadores en la activación eosinofílica, pueden mejorar el control de aquellos pacientes; así, las guías españolas recomiendan los anti IL-5 en AE con recuentos de ≥ 500 eosinófilo/μl o en recuentos inferiores pero que hayan sufrido > 2 exacerbaciones en el último año. Por todo ello, los autores de un reciente estudio han realizado un análisis coste-efectividad para comparar MEP vs. BEN y MEP vs. RES como tratamientos adicionales al cuidado usual (CU), en pacientes con AE en un horizonte temporal de 5 años.
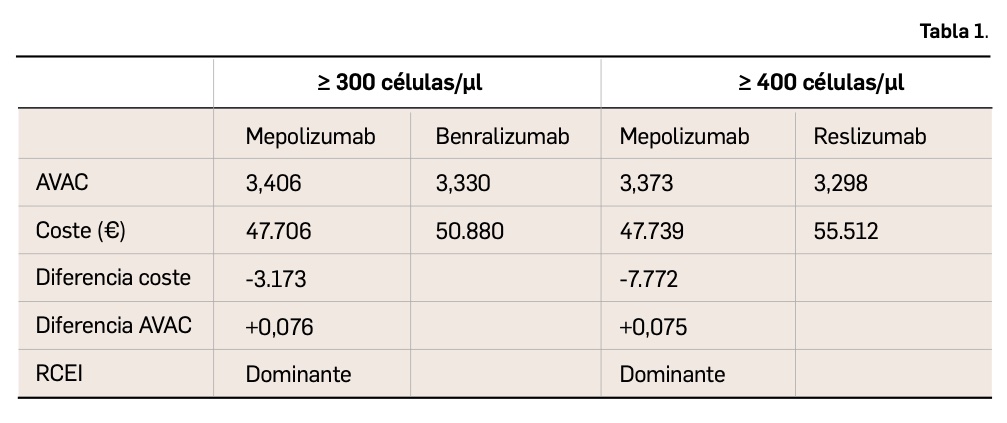
Para su ejecución, se diseñó un modelo de Markov que simulara la evolución de la enfermedad de una cohorte teórica de pacientes tratados solo con los cuidados estándar o adicionando los anti IL-5; los estados de salud incorporados en el modelo se correspondían con: respuesta clínica a los tratamientos, muerte secundaria al AE o por cualquier causa, y exacerbación (3 tipos en función de su gravedad). Asimismo, se diferenciaron 2 escenarios en función de las indicaciones autorizadas: pacientes con recuento ≥ 300 células/μl (MEP+CU vs. BEN+CU) y pacientes con recuento era superior a 400 células/μl (MEP+CU vs. RES+CU).
Los datos de transición entre estados se estimaron a partir de los ensayos pivotales, realizando un meta-análisis de los mismos. La variable principal fue la reducción de exacerbaciones clínicamente relevantes y el control de la patología (estimado éste mediante el Asthma Control Questionnaire –ACQ). Se consideraron también los efectos adversos asociados al tratamiento con corticoides. Los costes imputados se correspondían con los farmacológicos, los del manejo de los eventos y de los efectos adversos. Los valores de calidad de vida se estimaron mediante el St. George’s Respiratory Questionnaire, debidamente transformados a utilidades del EQ-5D. El resultado de la eficiencia se expresó como ratio coste-efectividad incremental (RCEI) en €/año de vida ajustado a calidad (€/AVAC).
Al cabo de 5 años, los resultados del modelo con pacientes cuyo recuento era de ≥ 300 células/μl revelan que MEP resultó dominante respecto a BEN, al presentar un coste inferior y un resultado superior; asimismo, el resultado mostró dominancia de MEP respecto a RES en pacientes con recuento de ≥ 400 células/μl (Tabla 1).
Los autores concluyen que los resultados obtenidos sugieren que la adición al cuidado usual del anti IL-5 mepolizumab es una alternativa eficiente respecto a la adición de otros anti IL-5, como benralizumab o reslizumab, en el tratamiento de pacientes con asma eosinofílica grave en España.