Archive
Revista PAM: 448
Número 448, Noviembre 2021
Variaciones en medicamentos previamente comercializados

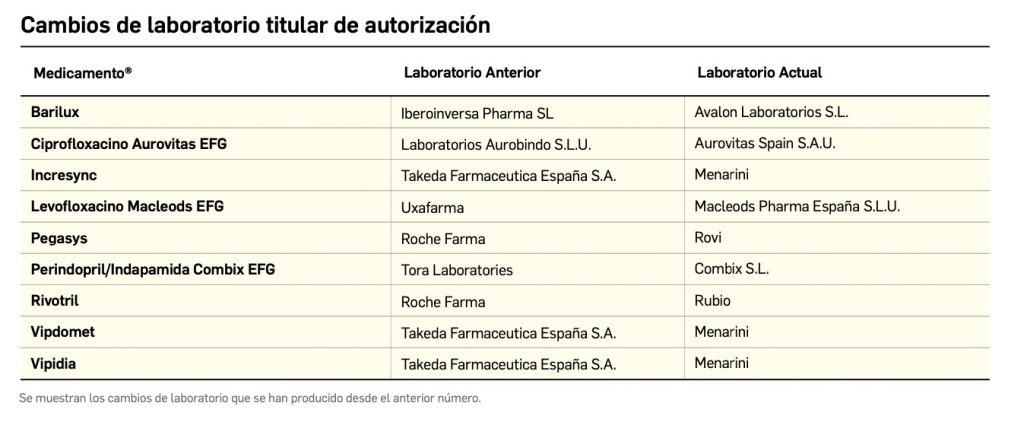
Cómo localizar cambios de nombre y de laboratorio con BOT PLUS
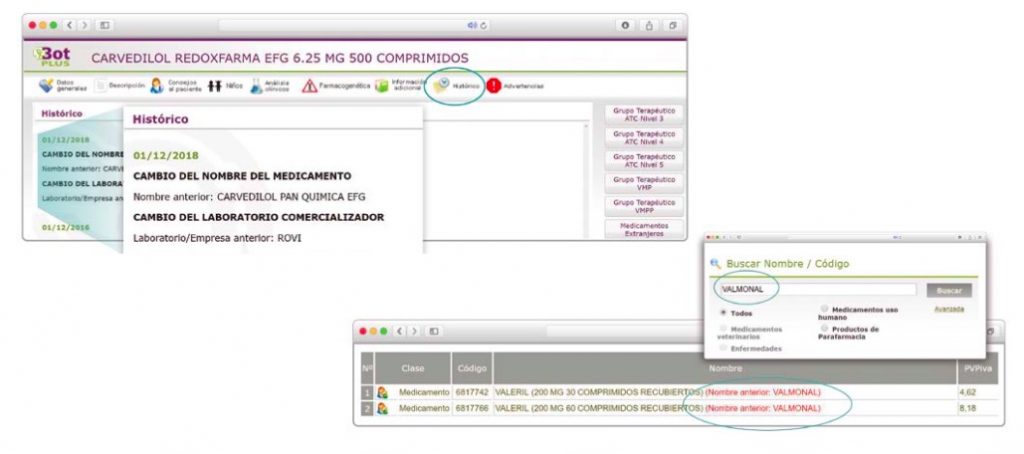
Además de la información que se incluye en los listados mensuales publicados en PAM, en BOT PLUS se incluye un apartado de Histórico, en las fichas de medicamentos, en el que se presenta información referente a cambios que haya sufrido anteriormente el medicamento o producto, entre otros, los cambios de nombre y los cambios de laboratorio. Esta información también está disponible para productos sanitarios financiados o dietoterápicos.
Se añade la posibilidad de visualización de las situaciones anteriores (o incluso futuras) relacionadas con un cambio de nombre.
Con automatismos que nos permiten localizar un medicamento que haya cambiado de nombre, independientemente de cuál usemos.
Posibilidad de generar listados por Histórico
Además de la información existente en Histórico, se permite la explotación de la información incluida en BOT PLUS en este apartado, mediante la integración de la información almacenada en Histórico en el apartado de Listados de BOT PLUS, que permite realizar consultas entre rangos de fechas y por un concepto en concreto de entre los almacenados en el apartado de Histórico. Entre ellos se incluyen, precisamente, los conceptos “Cambio del nombre del medicamento” y “Cambio del laboratorio comercializador”.
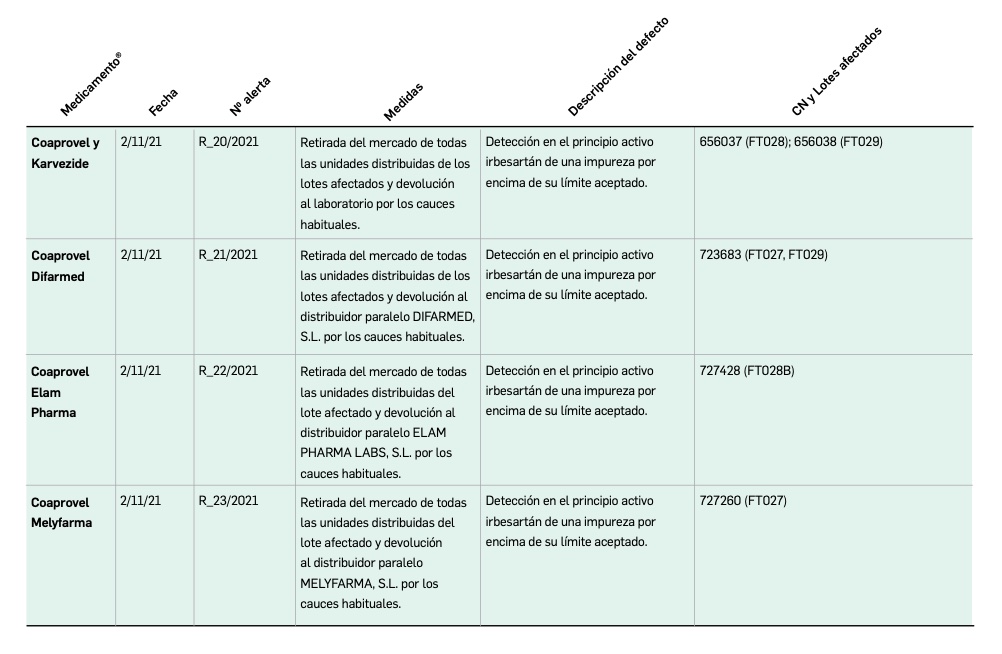
Alertas de seguridad
Alertas de calidad
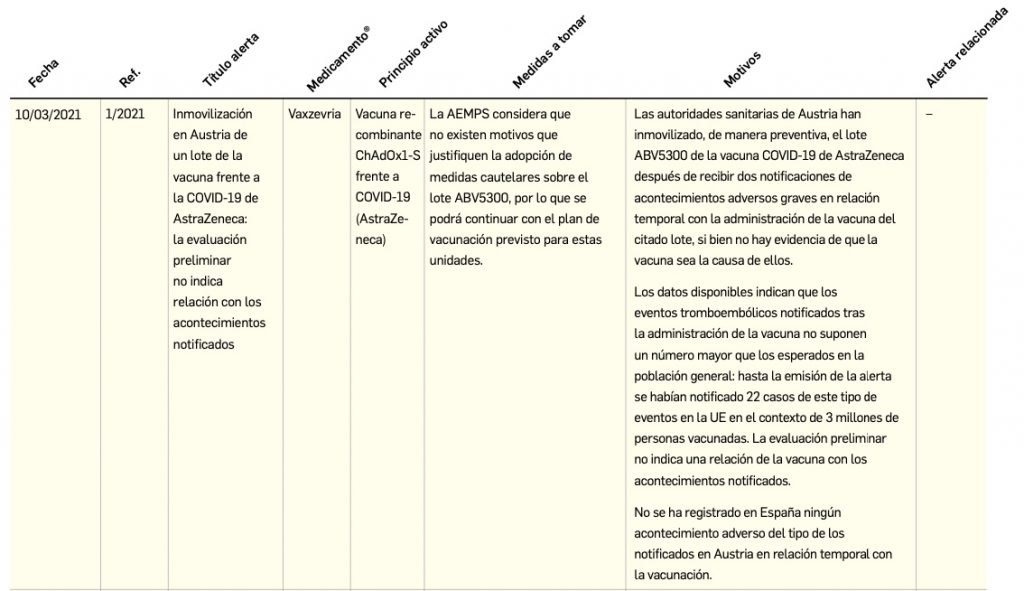
Alertas debidas a defectos de calidad observados en medicamentos de uso humano, publicadas por la AEMPS desde el anterior número y que suponen la retirada o inmovilización de ciertos lotes de medicamentos. En BOT PLUS puede encontrar más información detallada, con acceso al documento de la AEMPS.
Cómo localizar alertas de calidad con retiradas de lotes en BOT PLUS
Además de los listados mensuales que podemos consultar en PAM, en BOT PLUS se incorpora la información que publica la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) relativa a notificaciones sobre seguridad y/o calidad de los medicamentos. Mediante un pictograma específico se pueden visualizar de forma rápida medicamentos afectados por alguna alerta de seguridad o de defectos de calidad, con tan solo entrar en su ficha.
Al acceder a la ficha de un medicamento afectado por una retirada, se visualiza un mensaje con la advertencia “Medicamento con lotes retirados por Alerta AEMPS. Ver más información en “Alertas Calidad”.
Además, se incluye una pestaña específica en la que se pueden consultar los lotes concretos que han sido retirados, con sus respectivas fechas de caducidad, así como la descripción del defecto de calidad detectado y las medidas a adoptar. También se cuenta con acceso al documento publicado por la AEMPS.
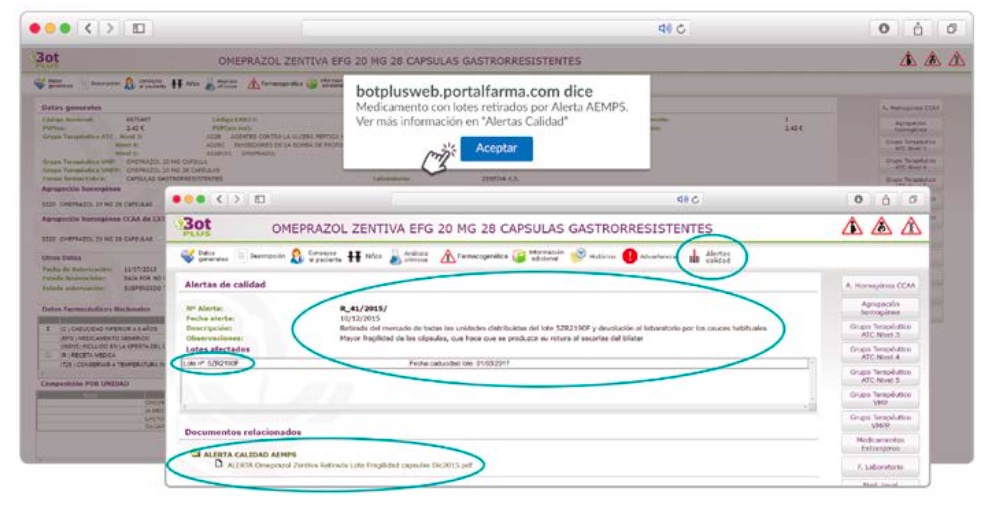
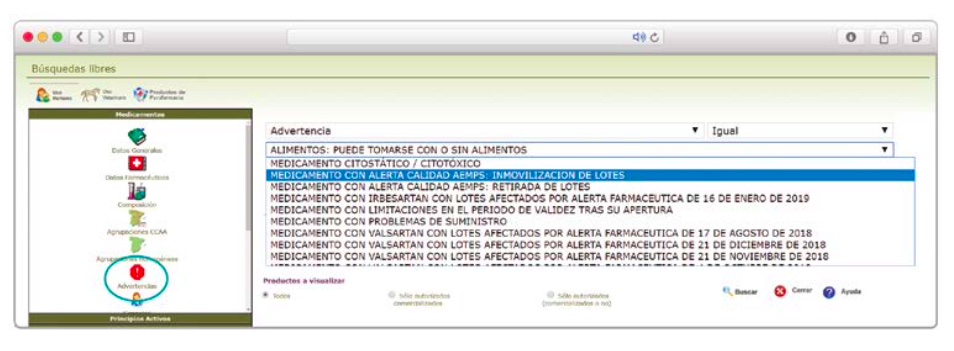
De forma interesante, dicha información se puede explotar a través de la Búsqueda Libre de BOT PLUS para obtener listados de todos los medicamentos afectados por alertas de calidad que implica la retirada (o también la inmovilización) de sus lotes en un momento dado.
Esta codificación de los lotes retirados es una información puesta a disposición de todos los usuarios, con el objetivo de ofrecer una nueva información capaz de integrarse con otros sistemas de información y mejorar la gestión e identificación de estos medicamentos, en los que la labor asistencial y de control del farmacéutico es fundamental.
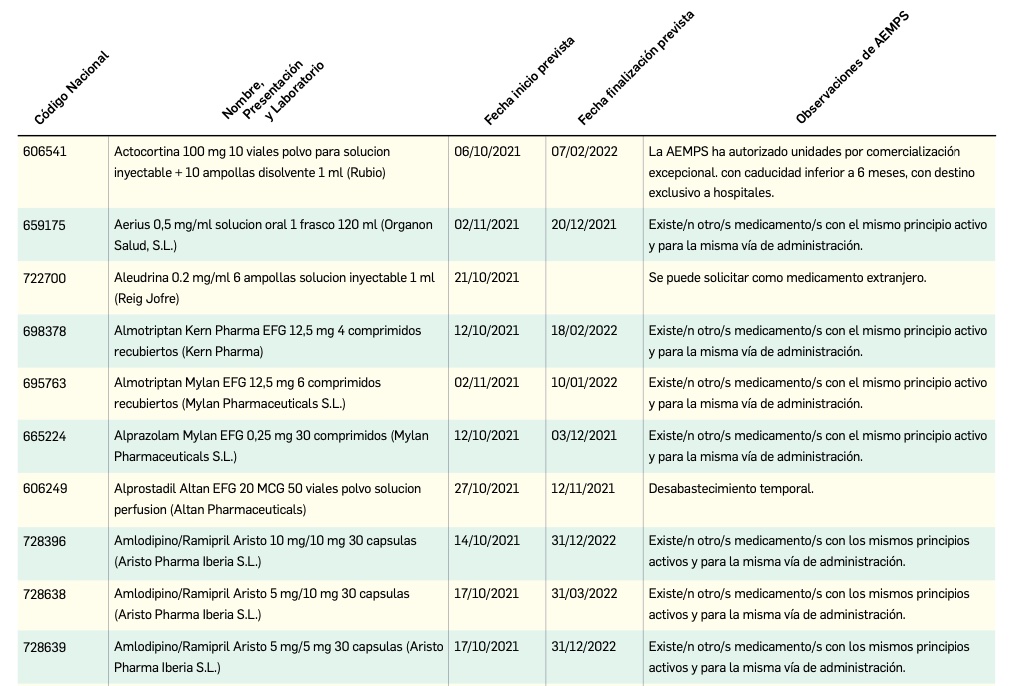
Problemas de suministro de medicamentos
Nuevos problemas de suministro
Listado de medicamentos con problemas de suministro publicado por la AEMPS, a fecha de cierre de este número. En BOT PLUS, se puede encontrar la información completamente actualizada, al tratarse de una información que varía de forma continua.
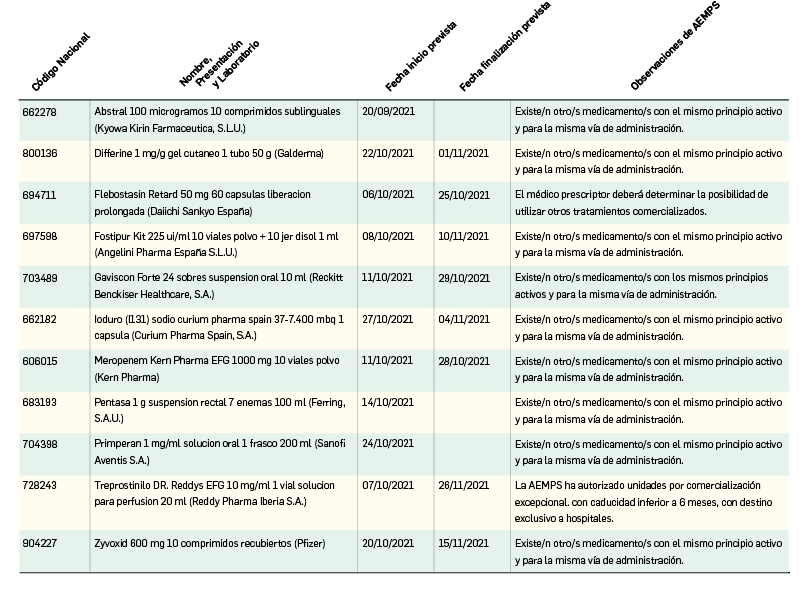
Problemas de suministro finalizados
Nuevos fármacos autorizados en la UE y EE. UU.
Nuevos medicamentos de terapias avanzadas
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
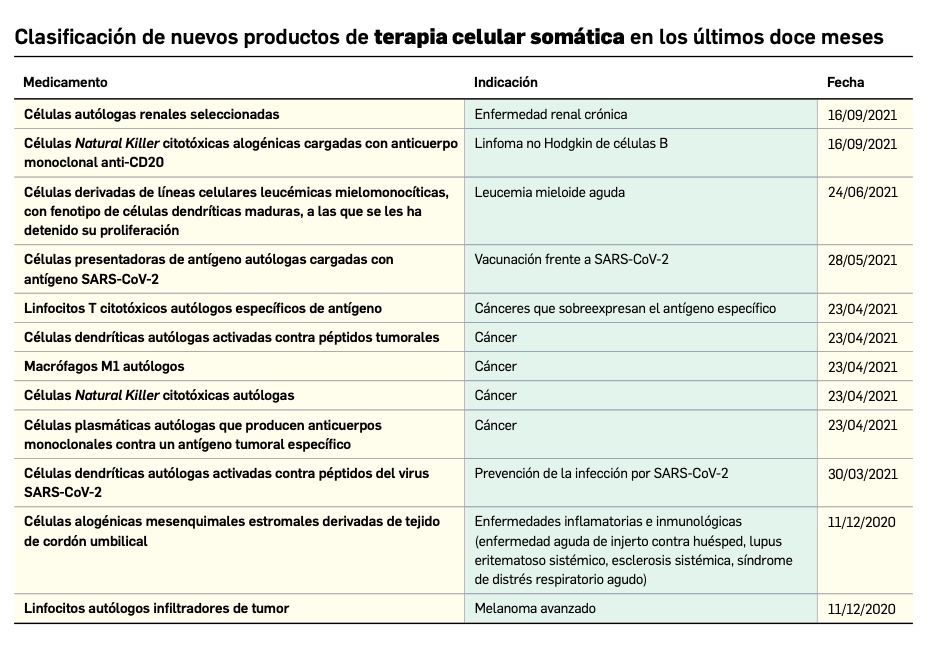

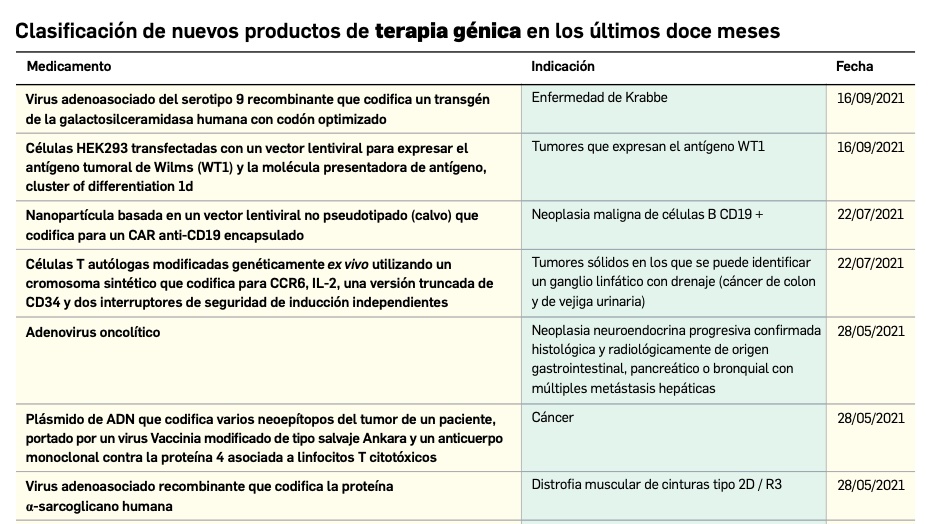
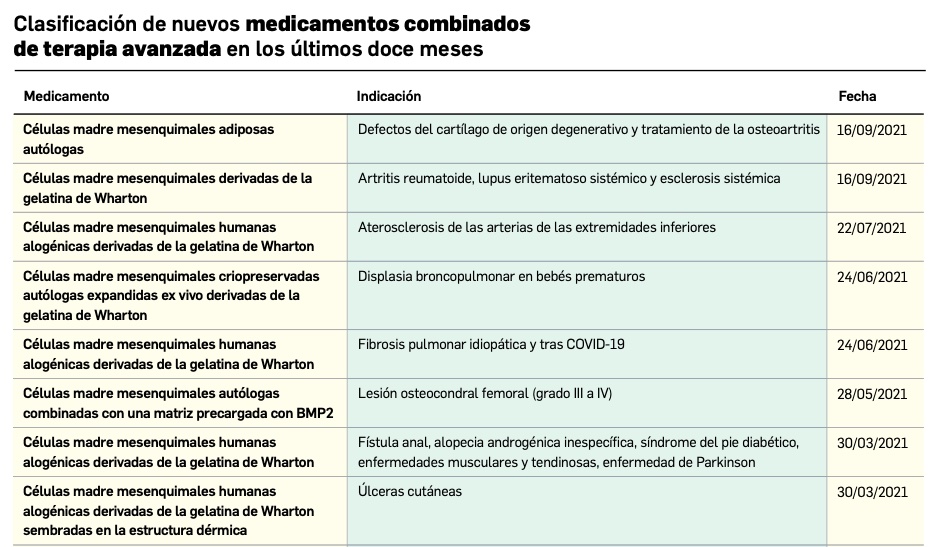
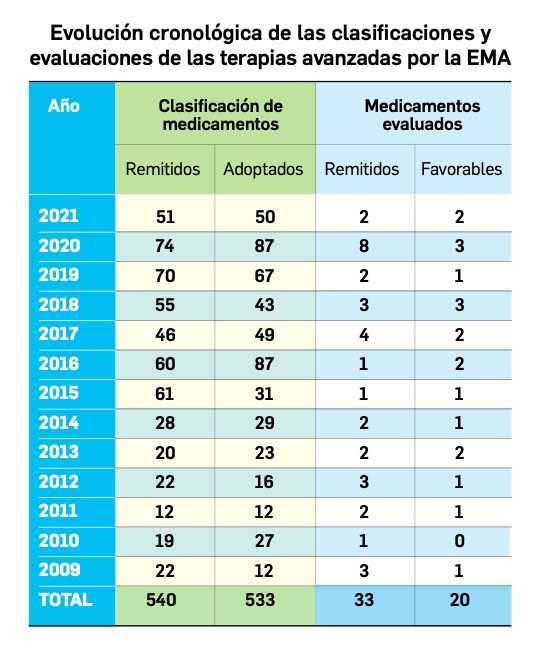
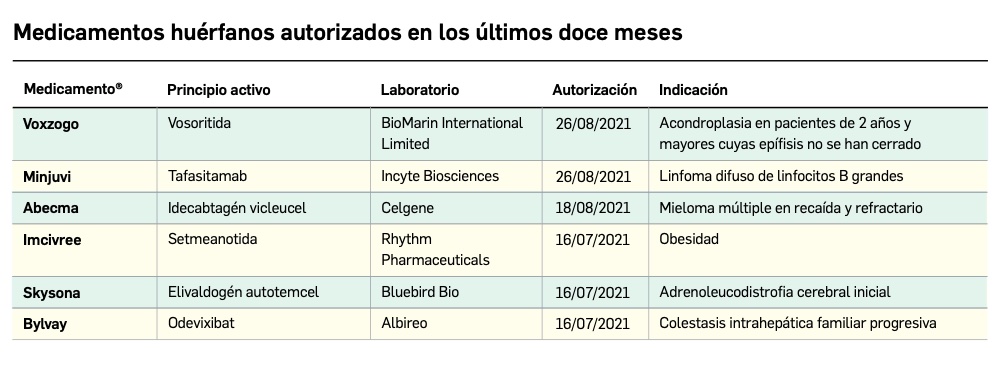
Nuevos medicamentos huérfanos
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas. La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios solo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
Instituciones y redes españolas
► Instituto de Salud Carlos III (Ministerio de Ciencia e Innovación):
Instituto de Investigación en Enfermedades Raras:
https://www.isciii.es/QuienesSomos/CentrosPropios/IIER/Paginas/default.aspx
CIBERER (Centro de Investigación Biomédica en Red de Enfermedades Raras): https://www.ciberer.es/
►Instituto de Mayores y Servicios Sociales (IMSERSO, Ministerio de Derechos Sociales y Agenda 2030):
http://www.imserso.es/imserso_01/index.htm
► Federación Española de Enfermedades Raras (FEDER): www.enfermedades-raras.org
► Asociaciones de pacientes en España: https://enfermedades-raras.org/index.php/asociaciones/nuestros-socios
Instituciones y redes europeas
►Agencia Europea de Medicamentos (EMA; Europea Medicines Agency). Apartado de Medicamentos Huérfanos
(inglés): https://www.ema.europa.eu/en/human-regulatory/overview/orphan-designation-overview
https://www.ema.europa.eu/en/committees/committee-orphan-medicinal-products-comp
►Comisión Europea: web oficial de la Comisión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://ec.europa.eu/health/rare_diseases/policy/index_es.htm
►Orphanet: Portal de información oficial de la Unión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://www.orpha.net/consor/cgi-bin/index.php?lng=ES
► Eurordis: Federación Europea de Asociaciones de Pacientes con Enfermedades Raras (español). http://www.eurordis.org/es
Otras instituciones y redes internacionales
►Food & Drug Administration (FDA, Estados Unidos). Apartado de Medicamentos Huérfanos (inglés):
http://www.fda.gov/ForIndustry/DevelopingProductsforRareDiseasesConditions/default.htm
►Pharmaceuticals & Medical Devices Agency. Agencia de Medicamentos y Dispositivos Médicos, de Japón (inglés):
http://www.pmda.go.jp/english/index.html
Ritodrina y magnesio sulfato en coadministración: riesgo incrementado de hiperpotasemia
La autoridad reguladora de Japón ha revisado los datos relativos a casos notificados de hiperpotasemia en pacientes tratados con ritodrina (Pre-par®) simultáneamente con sulfato de magnesio (Sulmetin® y EFG). Se incluirá la advertencia de este riesgo en la información del medicamento.
La autoridad reguladora de Japón (Pharmaceuticals and Medical Devices Agency, PMDA), junto con el ministerio competente (Ministry of Health, Labour and Welfare, MHLW) ha publicado (PMDA, 2021) las actualizaciones de la información del prospecto de ritodrina (Utemerin®, en Japón) y del magnesio sulfato (Magsent® y Magnesol®, en Japón) para incluir el riesgo de hiperpotasemia en bebés prematuros nacidos de madres que recibieron administración simultánea con ritodrina y sulfato de magnesio.
La ritodrina está indicada para la amenaza de aborto/parto prematuro, mientras que el sulfato de magnesio está indicado para la inhibición de contracciones uterinas y para profilaxis y tratamiento de eclampsia.
En Japón, se han notificado un total de ocho casos de hiperpotasemia neonatal en recién nacidos de mujeres tratadas con ritodrina y magnesio sulfato, en los últimos 3 años, incluidos 4 casos en los que se valoró como razonablemente posible una relación causal entre los fármacos y el evento posible. Hay un caso notificado con resultado mortal, pero la relación causal no ha podido ser establecida. Tanto el MHLW con la PMDA concluyeron que es necesaria la revisión del prospecto para incluir esta información.
Es preciso subrayar que en España existen medicamentos con ritodrina, como Pre-par® 50 mg/5 ml solución inyectable (caja de 3 ampollas de 5 ml), y con sulfato de magnesio heptahidratado, como Sulmetin Simple® 150 mg/ml solución inyectable y para perfusión (envase con 5 ampollas de 10 ml) y Sulfato de Magnesio Altan® 150 mg/ml solución inyectable y para perfusión EFG (envases de 10 y 100 ampollas de 10 ml).
Información de seguridad procedente de la evaluación periódica de los datos de farmacovigilancia que decide el PRAC
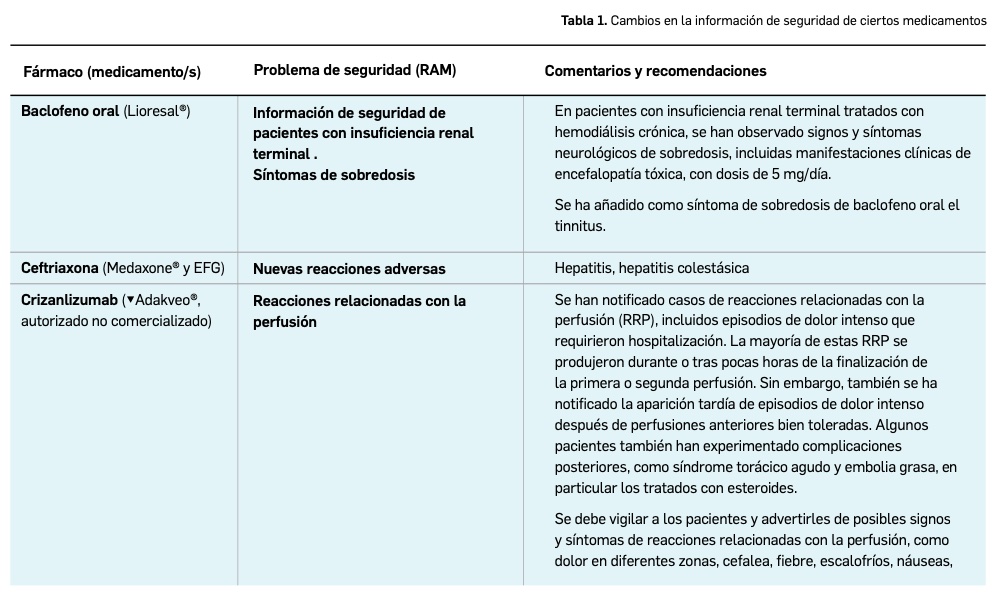
El Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha acordado cambios en la información autorizada de las fichas técnicas y de los prospectos de los medicamentos europeos por motivos de seguridad. Una vez que se revisan y evalúan los datos de los informes periódicos de seguridad (IPS; PSUR en inglés) de forma colaboradora entre las 27 agencias regulatorias nacionales, se presentan los cambios y se acuerdan en las reuniones mensuales del PRAC. A continuación, se muestran los últimos cambios de información de seguridad acordados recientemente.
El Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha acordado cambios en las fichas técnicas y los prospectos de los siguientes medicamentos, siendo los más importantes los que se describen en la Tabla 1, según informa la AEMPS en su Boletín de Seguridad de Medicamentos de Uso humano de junio de 2021 (AEMPS, 2021). Las fichas técnicas y prospectos de los medicamentos pueden consultarse en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos.