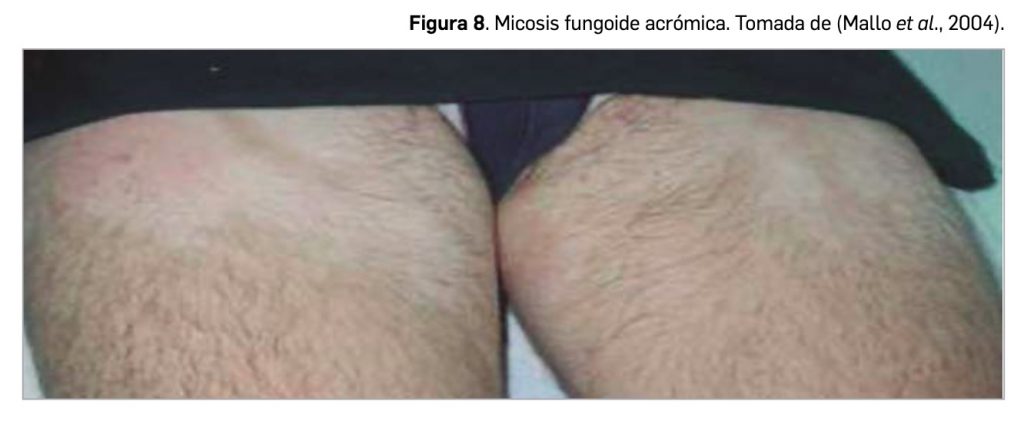
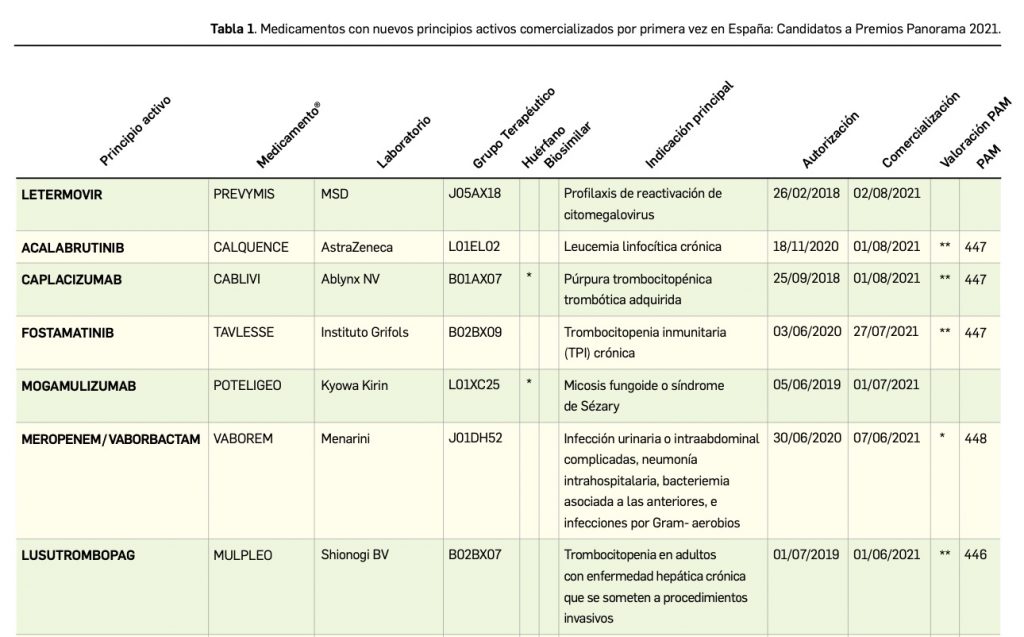
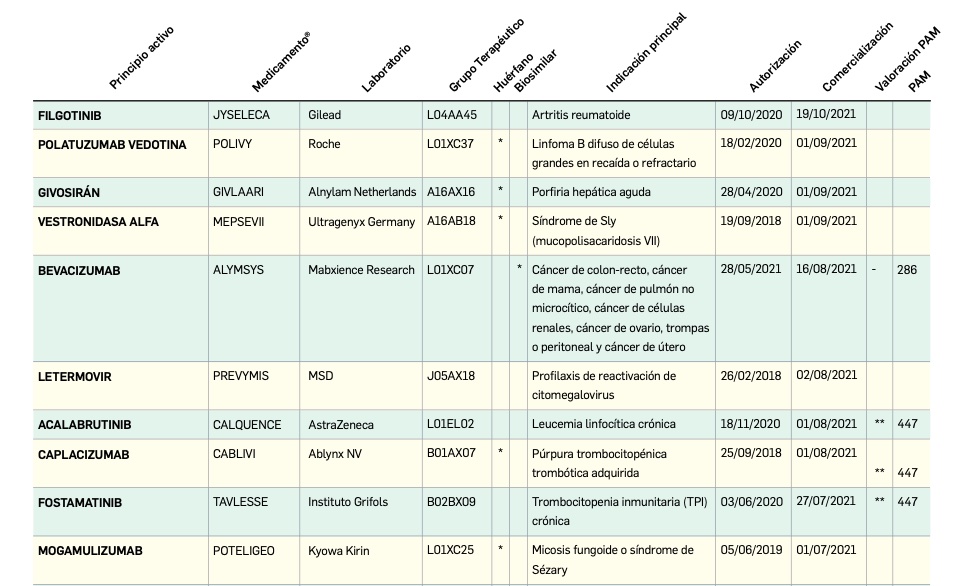
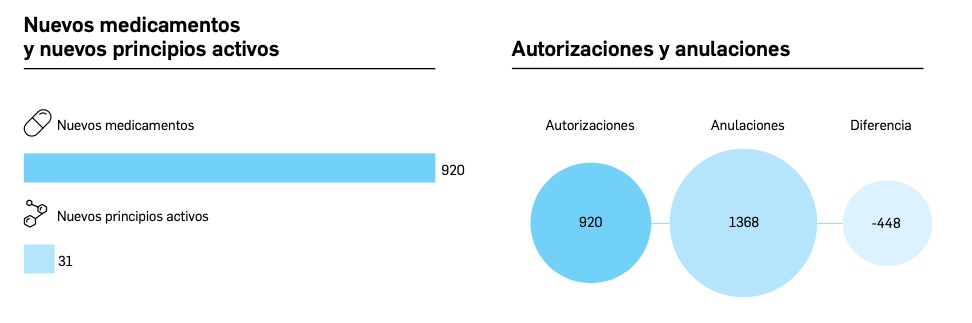
Resumen
El nuevo medicamento consiste en la asociación de meropenem, un antibiótico betalactámico previamente comercializado del grupo de los derivados del carbapenem (cuya acción bactericida se media por la inhibición de la síntesis de la pared celular de peptidoglicano), y vaborbactam, un nuevo principio activo inhibidor de betalactamasas que amplía el espectro y la potencia antibacteriana del primero. Vaborbactam carece de núcleo betalactámico e inhibe las betalactamasas de clases A y C –incluida la carbapenemasa de K. pneumoniae– mediante la formación de un aducto covalente con las mismas, diferenciándose en estructura y selectividad de los otros inhibidores de betalactamasas disponibles (ácido clavulánico, tazobactam y avibactam); no protege a meropenem de las betalactamasas de clase B y D ni restaura la sensibilidad al carbapenémico si la resistencia se debe a la impermeabilidad de la membrana externa o a una bomba de eflujo. El medicamento ha sido autorizado para su uso por vía intravenosa, siguiendo las directrices oficiales del uso apropiado de antibacterianos, para el tratamiento en pacientes adultos de infecciones urinarias complicadas (incluida la pielonefritis), infecciones intraabdominales complicadas, neumonías intrahospitalarias (incluida la asociada a ventilación mecánica), bacteriemias asociadas –o con sospecha de estar asociadas– a cualquiera de las infecciones anteriores e infecciones debidas a microorganismos gran negativos aerobios en adultos con opciones de tratamiento limitadas. Se ha probado su eficacia clínica frente a patógenos como Escherichia coli, Klebsiella pneumoniae y el complejo Enterobacter cloacae spp, pero no se ha confirmado aún su actividad frente a otras bacterias potencialmente implicadas en las indicaciones aprobadas.
Los datos clínicos procedentes de dos estudios clínicos de fase 3 han contrastado adecuadamente la eficacia de la combinación a las dosis autorizadas en su indicación en ITUc y pielonefritis. Los resultados revelaron su no inferioridad frente a piperacilina/tazobactam: en la visita de curación entre los días 15 y 23 de tratamiento, la tasa de erradicación microbiológica era del 67% en el brazo experimental frente al 58% en el brazo control (el beneficio fue mayor en pacientes con pielonefritis aguda que en ITU complicadas con fuente de infección removible). Pero es importante subrayar que por ahora no se dispone de datos definitivos de eficacia en el resto de las indicaciones (uno de los estudios solo incluyó un número muy limitado de pacientes con dichas infecciones), sino que la autorización se basa en la experiencia con la monoterapia con meropenem, datos de preclínica y análisis combinados de farmacocinética/farmacodinamia, aceptando que se pueden alcanzar concentraciones de vaborbactam en la cavidad abdominal y en el epitelio pulmonar suficientes para proteger a meropenem frente a carbapenemasas y betalactamasas. En términos de seguridad, el perfil toxicológico del medicamento se puede considerar similar al de los comparadores activos, esto es, un perfil relativamente benigno, manejable, y equiparable al de otros antibióticos betalactámicos. Las reacciones adversas más comunes durante el tratamiento son la cefalea (8%), la diarrea (5%), flebitis en el lugar de perfusión (2%) y las náuseas (2%). Ninguna de ellas fue considerada grave o motivo de interrupción del tratamiento (la tasa de discontinuación se mantuvo baja, en torno al 1%).
En resumen, es la primera combinación de un antibiótico carbapenémico con un inhibidor de betalactamasas, que puede jugar un papel importante en el abordaje de un grave problema de salud pública como son las infecciones causadas por enterobacterias (entre ellas, K. peumoniae) y Pseudomonas aeruginosa multirresistentes productoras de betalactamasas de espectro extendido o de carbapenemasas. Es decir, se trata de un buen antibiótico que amplía las opciones disponibles para varios tipos de infecciones complicadas, pero no aporta ningún elemento innovador farmacológico ni clínico respecto a otras opciones ya disponibles. El IPT lo posiciona como una alternativa en la terapéutica dirigida cuando se disponga del antibiograma, de utilidad también en el tratamiento empírico en casos de sospecha o alta prevalencia local de enterobacterias productoras de carbapenemasas A; pero no debe ser una opción preferente en el tratamiento empírico de infecciones por enterobacterias productoras de betalactamasas distintas, pues existen otras alternativas. Su elección se hará de forma individualizada, preferiblemente dentro de programas de optimización de uso de antibióticos.
Aspectos fisiopatológicos
Infecciones del tracto urinario (ITU)
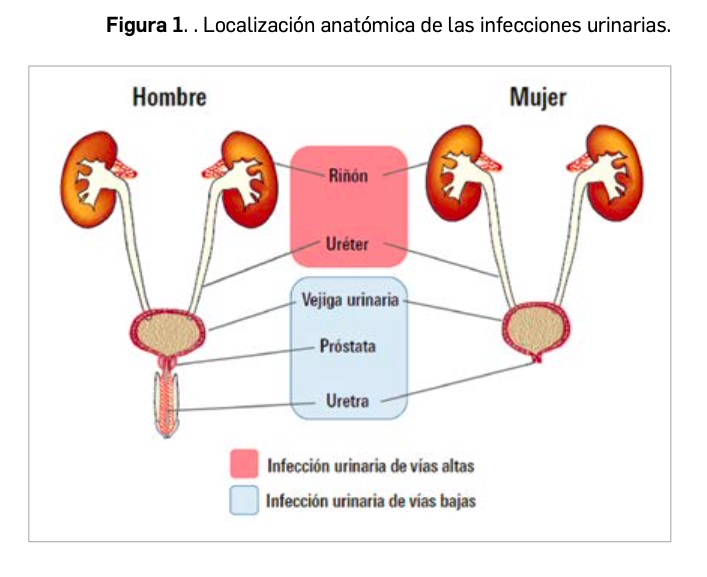
El término genérico de infección urinaria implica –con independencia de que existan síntomas o no– la presencia en orina de un elevado número de microorganismos, habitualmente bacterias, en un número que supera el considerado como límite inferior de 100.000 unidades formadoras de colonias (UFC) por ml; no obstante, recuentos inferiores son también indicativos de infección en determinadas circunstancias. Es común que este tipo de patología presente recaídas, en las que existe una recurrencia de la infección por el mismo agente infeccioso o por otros distintos (reinfecciones). Según criterios anatómicos (Figura 1), se denomina infección urinaria de las vías bajas aquella en la que involucran a vejiga, uretra y/o próstata (tales como uretritis, cistitis y prostatitis), e infección de las vías altas cuando la infección se localiza en riñón y uréteres (pielonefritis y absceso renal). Desde el punto de vista de la clínica, se considera infección no complicada la que se produce en individuos con un tracto urinario estructuralmente normal y cuyos mecanismos de defensa se encuentran intactos, e infección complicada cuando afecta a enfermos con anomalías anatómicas o funcionales del tracto urinario (que alteran el libre flujo de orina), diabetes mellitus, instrumentación de la vía urinaria, portadores de sonda vesical, insuficiencia renal crónica o inmunodeprimidos.
Específicamente, la pielonefritis es un cuadro infeccioso grave que afecta al parénquima renal y al sistema colector y constituye la forma más seria de infección del tracto urinario, pues aumenta hasta en un 30% el riesgo de que el paciente sufra una bacteriemia. Se manifiesta como un síndrome miccional que se acompaña de fiebre alta, escalofríos, taquicardia y vómitos, aunque pueden existir formas incompletas o subclínicas en las que no aparecen algunos de los datos clínicos o exploratorios característicos; en ancianos puede expresarse como un deterioro del estado general o incontinencia urinaria. Hasta en un 20% de los cultivos se pueden encontrar < 100.000 UFC/ml.
Se han descrito una serie de factores que predisponen a padecer ITUs, entre los que sobresalen:
- Embarazo: los estrógenos causan dilatación del uréter y reducen el flujo urinario, lo cual puede empeorar por el útero grávido;
- infancia: sobre todo, edad menor de 2 años, puesto que la contaminación de los genitales por las heces es común, especialmente si no se cambian los pañales con adecuada frecuencia;
- diabetes mellitus: la glucosuria favorece el crecimiento bacteriano;
- anomalías estructurales: que aumentan el riesgo de infección, impidiendo el aclaramiento fisiológico de determinadas áreas urológicas;
- lesiones medulares: las vejigas presentan un vaciamiento incompleto y estasis de orina; y
- cálculos renales: disminuyen el flujo de orina y, además, las bacterias invaden las grietas de los cálculos.
La calificación como ITU complicada (ITUc) hace precisamente referencia a la presencia de las anomalías estructurales o funcionales del aparato urinario que implican una diferente orientación terapéutica, dado el mayor espectro de gérmenes implicados y su frecuente carácter multirresistente. Por ello, se considera igualmente complicada cualquier infección urinaria que se produzca en una embarazada, en un paciente varón, en niños, en personas con inmunosupresión, en pacientes hospitalizados o personas institucionalizadas, en aquellas sometidas a manipulación urológica reciente, en quienes presenten síntomas de más > 1 semana de duración o tengan otras enfermedades subyacentes.
Es importante citar que la ITU evolucionada, por fracaso diagnóstico o terapéutico, puede conducir a la aparición de una pielonefritis crónica. Otro aspecto importante es que la infección urinaria constituye una de las mayores fuentes de sepsis que, todavía hoy, comportan una elevada mortalidad (no inferior al 15-20% de los afectados). Se trata de una de las infecciones hospitalarias más frecuentes, siendo las vías urinarias sondadas el punto de origen que se asocia con mayor frecuencia a bacteriemia por gram negativos en pacientes ingresados.
La etiología de la ITU está condicionada no solo por factores epidemiológicos del paciente (edad, sexo, embarazo, comorbilidades, etc.), sino también por otros como son el ámbito de adquisición de ésta, la existencia de tratamientos antimicrobianos previos o el propio tipo de infección. Los microorganismos que consiguen acceder al tracto urinario y que son capaces de provocar infección pueden tener un origen endógeno, en cuyo caso provienen mayoritariamente del colon, o exógeno, cuando son introducidos en la vía urinaria, al ser manipulada, o bien llegan al riñón previa diseminación hematógena (menos frecuente), en cuyo caso su procedencia dependerá del foco de la bacteriemia.
Más del 95% de las infecciones urinarias son monomicrobianas. Entre ellas, Escherichia coli es, con gran diferencia, el agente etiológico más frecuente en las ITU no complicadas y en la embarazada. En la ITU complicada, E. coli sigue aislándose de manera mayoritaria, pero el espectro se amplía y otros microorganismos –como Proteus spp., Enterococcus spp., Klebsiella spp., Pseudomonas aeruginosa, Serratia spp. y Providencia spp.– han ido adquiriendo progresivamente un mayor protagonismo. No obstante, cuando existen anomalías estructurales en la vía urinaria o manipulación de la misma (ITU complicada), es bastante común el aislamiento de múltiples microorganismos y que éstos, como consecuencia de tratamientos antimicrobianos previos, sean multirresistentes en mayor grado. Los microorganismos causales de ITU asociada a sondaje vesical proceden de la microbiota fecal del paciente, modificada por la presión selectiva antibiótica; así, en pacientes portadores de sonda urinaria no es infrecuente la presencia de <P. aeruginosa, E. faecalis y levaduras del género Candida.
El ámbito hospitalario también condiciona la etiología de los procesos, de modo que en las ITU en pacientes hospitalizados se aíslan con relativa frecuencia especies de Proteus, Klebsiella, Enterobacter, Pseudomonas, Enterococcus y Staphylococcus. Además, las infecciones cruzadas adquieren especial importancia, sobre todo las asociadas a catéteres. Se ha reconocido como patógeno urinario asociado a este ámbito al Corynebacterium urealyticum, una bacteria gram positiva de crecimiento lento, que, gracias a su potente ureasa, es capaz de producir la formación de cristales de estruvita; en pacientes inmunosuprimidos, especialmente en aquellos que han recibido un trasplante renal, esta bacteria puede ocasionar cistitis incrustante alcalina.
Cuando la clínica del paciente hace preciso el tratamiento empírico inmediato (sin dar tiempo al antibiograma), como en casos de pielonefritis o urosepsis, suelen emplearse antibióticos de amplio espectro, como piperacilina/tazobactam, cefalosporinas de 3ª o 4ª generación o carbapenemas, así como las fluoroquinolonas más modernas; recientemente, en esta indicación se han incorporado las combinaciones de ceftolozano/tazobactam y ceftazidima/avibactam. En cualquier caso, es imperativa la corrección de cualquier anomalía urológica reversible. La duración del tratamiento de una ITU complicada no está establecida, si bien generalmente se recomiendan 7-14 días.
La rapidez en la aparición y diseminación de resistencias a diversos fármacos de elección en la ITU ha sido especialmente frecuente entre las enterobacterias; esto tiene una gran repercusión clínica, pues estos microorganismos son causa frecuente de distintos tipos de infección, tanto comunitaria como nosocomial. La diseminación de resistencias a penicilinas, asociaciones de betalactámico con inhibidores de betalactamasas, cefalosporinas, quinolonas, aminoglucósidos y, últimamente, a carbapenemas, constituye un problema de salud pública de orden mundial (AEMPS, 2021).
Infecciones intraabdominales (IIA)
Las infecciones intraabdominales constituyen un grupo heterogéneo de cuadros clínicos, cuya etiología bacteriana es muy variada. Las IIA no complicadas se limitan a un órgano o tejido (apéndice, divertículos, colédoco, etc.), mientras que las complicadas implican la extensión a varios órganos, con afectación del peritoneo, dando lugar a peritonitis localizadas (abscesos intraabdominales) o generalizadas (difusas). Su origen suele estar en perforaciones o inflamaciones de la pared intestinal, lo que determina la pluralidad de la flora patógena causante del cuadro, predominando las bacterias anaerobias. Las IIA se consideran como la segunda causa más frecuente de sepsis grave tras las ITU, y resulta fundamental el diagnóstico microbiológico que evalúe la sensibilidad antimicrobiana, en especial de las infecciones abdominales nosocomiales o en pacientes de riesgo con sospecha de bacterias multirresistentes o Candida spp.
Las causas más comunes de peritonitis secundaria son: apendicitis perforada, perforación de úlcera gástrica o duodenal, perforación del colon por diverticulitis, vólvulos o cáncer, retención o aprisonamiento (o incarceración) del intestino delgado y perforación por trauma penetrante (arma de fuego o blanca). La pancreatitis necrotizante también puede estar asociada con peritonitis en caso de que ocurra la infección del tejido necrótico. Menos frecuentes son los casos de peritonitis ocasionados por patología biliar, enfermedad pélvica y procedimientos invasivos (poscirugía, posendoscopía). Los gérmenes más frecuentemente aislados son bacterias gram negativas (Escherichia coli en más de las dos terceras partes, seguido a mucha distancia de Klebsiella spp y Pseudomonas aeruginosa), gram positivas (Streptococcus spp 30-40%, Enterococcus spp 20-25%) y anaerobias (Bacteroides fragilis en > 70% de casos).
Los cocos gram positivos son frecuentemente hallados en cuadros de peritonitis, tanto en aquellas asociadas a síndrome nefrótico y lupus eritematoso –donde predomina Streptococcus pneumoniae– como en aquellas otras que complican la diálisis peritoneal, en las que prácticamente la mitad de los casos están provocados por Staphylococcus aureus, o en las peritonitis secundarias y en abscesos intraabdominales, donde se puede detectar frecuentemente Enterococcus faecalis, generalmente formando parte de una flora mixta aerobia/anaerobia. También los enterococos son el agente etiológico de algunos casos de colangitis y hasta un 20% de los casos de infecciones ascíticas en los pacientes con cirrosis se relacionan con cocos gram positivos.
La denominada peritonitis terciaria es la que persiste después de 48 h de un adecuado manejo de la peritonitis primaria o secundaria. Por lo general son pacientes posquirúrgicos que ya recibieron antibióticos, están inmunodeprimidos y reciben nutrición parenteral; también puede asociarse o producirse a causa de un absceso peritoneal y más del 90% presenta ascitis. Más del 50% de estos pacientes ingresan a UCI con sepsis grave y presentan una tasa de mortalidad elevada, que puede ser > 30%. Suelen estar provocadas por enterobacterias multirresistentes (con betalactamasas de espectro extendido), anaerobios, enterococos, P. aeruginosa1, S. aureus y Candida spp.
La colecistitis aguda se relaciona con la presencia de cálculos biliares en más del 90% de casos. El retardo del tratamiento adecuado puede llevar a complicaciones graves en la vesícula (gangrena, empiema o perforación), además de a colangitis, pancreatitis aguda, íleo y fístulas biliares. Por su parte, la colangitis aguda es una infección del árbol biliar que, por lo general, se presenta en un paciente que ya presenta una patología biliar previa, como litiasis o cáncer; el cuadro suele evolucionar rápidamente al estado de sepsis grave (disfunción orgánica, hipotensión) y tiene una alta mortalidad, principalmente en población anciana.
El tratamiento más común de este tipo de infecciones se basa en las cefalosporinas de 3ª generación en combinación con metronidazol, penicilinas de amplio espectro asociadas con un inhibidor de betalactamasas, y carbapenemas. Sin embargo, la difusión de resistencias microbianas a estos fármacos dificulta enormemente el tratamiento empírico –e incluso el dirigido– de las IIA complicadas: la incorporación de nuevos antibióticos susceptibles de actuar sobre cepas multirresistentes es una necesidad derivada de todo lo indicado anteriormente. En los últimos años, se han comercializado en España algunos antibióticos activos frente a algunas de esas bacterias, como los glucopéptidos teicoplanina y dalbavancina, las oxazolidinonas linezolid y tedizolid, y las combinaciones ceftolozano/tazobactam o ceftazidima/avibactam, que están ayudando a controlar terapéuticamente el creciente espectro de patógenos resistentes. También la tetraciclina tigeciclina ha obtenido en pacientes con infecciones graves intraabdominales tasas altas de respuesta clínica y microbiológica, equiparables a las obtenidas con los carbapenemas imipenem, meropenem y doripenem. Es habitual, por otro lado, la combinación con agentes específicos frente a anaerobios, particularmente metronidazol.
Neumonía adquirida en el hospital (NAH)
En líneas generales, se entiende por neumonía cualquier infección aguda –de gravedad variable– del parénquima pulmonar; se clasifica en 2 grandes grupos: neumonía adquirida en la comunidad (NAC) y neumonía adquirida en el hospital (NAH) o nosocomial. Esta última es la que se presenta a partir de las 48-72 h del ingreso hospitalario, una vez se ha excluido que la infección no estuviera presente o en periodo de incubación en el momento del ingreso. Es la segunda infección nosocomial más frecuente, después de la urinaria, y la que comporta mayor morbimortalidad y sobrecarga en el consumo de recursos sanitarios, erigiéndose como la principal complicación infecciosa en los pacientes sometidos a ventilación mecánica.
Se adquiere principalmente a través de 3 mecanismos: microaspiración de bacterias que colonizan la orofaringe y/o que están presentes en el estómago, inhalación de aerosoles y diseminación hematógena a partir de otro foco de sepsis. Los bacilos gram negativos (enterobacterias como K. pneumoniae, E. coli, Serratia marcescens, Enterobacter spp., y P. aeruginosa) constituyen la etiología más frecuente de la NAH (20-60%). En los enfermos sometidos a ventilación mecánica, S. aureus se sitúa en segundo lugar (10-30%), mientras que los microorganismos más prevalentes en la comunidad, como S. pneumoniae, H. influenzae o C. pneumoniae son infrecuentes. Además, la colonización de las aguas de la mayoría de los hospitales por Legionella spp. convierte a este microorganismo en una causa endémica y relativamente frecuente de neumonía nosocomial. Pero cada vez se describen con mayor frecuencia neumonías nosocomiales de etiología vírica, sobre todo por virus respiratorio sincitial, influenza y parainfluenza. Hay que tener en cuenta, no obstante, las diferencias que existen en los agentes etiológicos entre los pacientes ingresados en las áreas de hospitalización general y los enfermos ventilados de las UCI, por la disparidad epidemiológica en ambos grupos de enfermos.
Según se ha sugerido, la frecuencia de neumonías en los pacientes ventilados2 es muy superior a la del resto de los pacientes hospitalizados. La mortalidad relacionada con este tipo de NAH continúa siendo elevada, a pesar de los avances realizados en su diagnóstico y tratamiento, siendo uno de los principales factores de mal pronóstico la prescripción empírica inadecuada de antibióticos. La etiología de la neumonía adquirida en el hospital en pacientes con ventilación mecánica es polimicrobiana en el 25% de los casos. En las neumonías precoces (4-7 días de estancia en el hospital), la flora endógena primaria –formada por S. aureus, H. influenzae, S. pneumoniae y enterobacterias– es la principal responsable de la infección. Las neumonías tardías, en pacientes con enfermedades crónicas y que han recibido antibióticos para tratamiento o profilaxis, están producidas por flora endógena secundaria, en la que predominan P. aeruginosa, Acinetobacter baumannii y S. aureus. En general, en las neumonías tardías predominan los patógenos más prevalentes en el hospital.
La vía de infección más frecuente en los pacientes ventilados es la endógena, a través de la superficie externa del tubo traqueal que permite aspiraciones repetidas del exudado orofaríngeo. La vía exógena supone la colonización directa de las vías respiratorias bajas por el interior de la luz del tubo traqueal a partir de reservorios externos (respiradores, aerosoles, humidificadores), mani-pulaciones (aspiración de secreciones) y técnicas invasivas (broncoscopia, intubación); esta vía ha disminuido su importancia en las últimas décadas debido a la mejor utilización de los procedimientos de esterilización y desinfección de los aparatos mecánicos. Se consideran factores de riesgo para desarrollar una neumonía todas aquellas situaciones que favorecen la aspiración de secreciones en la vía aérea, aumentan la cantidad y patogenicidad de los microorganismos inoculados y disminuyen las defensas locales del tracto respiratorio y la inmunidad sistémica. Entre ellos, destacan: la duración de la ventilación mecánica, la enfermedad pulmonar crónica grave, la edad avanzada, la aspiración masiva de contenido gástrico, la reintubación o autoextubación, etc.
Actualmente, el abordaje más aceptado de las NAH es el de iniciar un tratamiento empírico lo antes posibles basado en factores como el riesgo de presencia de bacterias multirresistentes o BMR (en base al uso previo de antibióticos, shock séptico, prevalencia de patógenos multirresistentes en el hospital de > 25% u hospitalización reciente de > 5 días), la gravedad del paciente y el riesgo de mortalidad, habiendo tomado previamente las muestras para los estudios microbiológicos que guiarán el posterior tratamiento. En pacientes con bajo riesgo de BMR y de mortalidad, se recomienda monoterapia antibiótica con ertapenem, ceftriaxona, cefotaxima, moxifloxacino o levofloxacino, mientras que en pacientes con alto riesgo de BMR y/o de mortalidad, el tratamiento depende de la presencia de shock séptico (se recomienda una combinación de un betalactámico antipseudomonas con un aminoglucósido –amikacina– o una quinolona –cipro o levofloxacino–) o ausencia del mismo (monoterapia con un agente antipseudomonas –imipenem, meropenem, cefepima, piperacilina/tazobactam, levofloxacino o ceftazidima– con adición, si es necesario, de un fármaco con acción frente a S. aureus meticilin-resistente –vancomicina o linezolid–).
En resumen, la creciente prevalencia de microorganismos gram negativos multirresistentes, incluidas las enterobacterias y P. aeruginosa con betalactamasas de espectro extendido y carbapenemasas3, hace necesario disponer de nuevos antibióticos, como alternativa a las carbapenemas, que amplíen la actividad frente a esos microorganismos y sean útiles en el tratamiento de estas infecciones.
Acción y mecanismo
La combinación de meropenem/vaborbactam está formada por un antibiótico betalactámico del grupo de los derivados del carbapenem (meropenem), ya autorizado y comercializado previamente, y por un novedoso inhibidor de betalactamasas (vaborbactam); vaborbactam no tiene actividad antibacteriana, sino que busca ampliar el espectro y la potencia antibacteriana de meropenem. El medicamento ha sido autorizado para su uso, siguiendo las directrices oficiales del uso apropiado de antibacterianos, en el tratamiento en pacientes adultos de infecciones urinarias complicadas (incluida la pielonefritis), infecciones intraabdominales complicadas, neumonías intrahospitalarias (incluida la neumonía asociada a ventilación mecánica), bacteriemias asociadas –o con sospecha de estar asociadas– a cualquiera de las infecciones anteriores e infecciones debidas a microorganismos gran negativos aerobios en adultos con opciones de tratamiento limitadas.
Meropenem ejerce su acción bactericida mediante la inhibición de la síntesis de la pared celular bacteriana de peptidoglicano, tanto en bacterias gram positivas4 como en gram negativas, como resultado de la unión a proteínas fijadoras de penicilinas (PFP) esenciales y la inhibición de su actividad. Esto se traduce en que la célula bacteriana solo puede crecer en forma de filamento o esferoblasto, con el resultado de la lisis celular al no poder mantener la presión osmótica adecuada. La eficacia antibacteriana de meropenem, como para otros betalactámicos, se correlaciona con el tiempo en que sus concentraciones plasmáticas exceden la concentración inhibitoria mínima (CIM); en modelos preclínicos, demostró actividad cuando se superó la CIM de los agentes infectantes durante al menos el 40% del intervalo de dosis. En general, la resistencia a carbapenemas se mantiene en niveles relativamente bajos, si bien en los últimos años se ha observado un incremento de las mismas en algunos estados miembros de la UE (n= 7), siendo K. pneumoniae la especie productora de carbapenemasas más diseminada.
Por su parte, sin poseer actividad antibacteriana, vaborbactam es un nuevo inhibidor no betalactámico de serina betalactamasas de clases A y C de la clasificación de Ambler, incluida la carbapenemasa de Klebsiella pneumoniae (KPC), que ejerce su efecto mediante la formación de un aducto covalente con las betalactamasas. Además de ser estable a la hidrólisis mediada por betalactamasas, vaborbactam no inhibe las enzimas de clase B (metalo-β-lactamasas dependientes de zinc) ni las carbapenemasas de clase D. Tanto su estructura como su selectividad lo diferencian ligeramente de los otros inhibidores de betalactamasas disponibles, tales como:
- tazobactam: un fármaco betalactámico relacionado estructuralmente con las penicilinas que actúa como inhibidor de numerosas betalactamasas (especialmente de los grupos A, como SHV-1 y TEM) que con frecuencia producen resistencia a las penicilinas y a las cefalosporinas, pero no inhibe las enzimas AmpC o metalo-β-lactamasas;
- o, en menor medida, de avibactam: un inhibidor de diversos tipos de betalactamasas pertenecientes a los grupos A y C, así como algunas del grupo D, incluyendo algunas de amplio espectro o de espectro extendido y carbapenemasas, pero que carece de actividad sobre betalactamasas de la clase B.
Los mecanismos de resistencia en las bacterias gram negativas que se sabe que afectan a meropenem/vaborbactam incluyen microorganismos que producen metalo-β-lactamasas u oxacilinasas con actividad carbapenemasa. Los mecanismos de resistencia bacteriana que podrían disminuir la actividad antibacteriana de la combinación también incluyen las mutaciones de porinas que afectan a la permeabilidad de la membrana externa y la sobreexpresión de bombas de eflujo (casos en los que las bacterias pueden mostrar resistencia a más de una clase de antibacteriano), pero no se ha descrito ninguna resistencia cruzada basada en la diana entre meropenem y agentes de las clases quinolona, aminoglucósido, macrólido y tetraciclina. Además, algunos estudios in vitro han probado que no existe antagonismo entre meropenem/vaborbactam y levofloxacino, tigeciclina, polimixina, amikacina, vancomicina, azitromicina, daptomicina o linezolid (AEMPS, 2018; EMA, 2018).
En consecuencia, la combinación meropenem/vaborbactam tiene un espectro antibacteriano relativamente amplio, aunque con una acción más marcada sobre gram negativos; ha demostrado ser activa en clínica frente a los siguientes patógenos que mostraron sensibilidad in vitro: microorganismos gram negativos como Escherichia coli, Klebsiella pneumoniae y el complejo Enterobacter cloacae sp. En cambio, aunque los estudios preclínicos sugirieron sensibilidad a meropenem o a la combinación (en ausencia de mecanismos de resistencia adquiridos), no se ha establecido aún la eficacia clínica frente a los siguientes patógenos potencialmente implicados en las indicaciones aprobadas: bacterias gram negativas como Citrobacter freundii, C. koseri, Enterobacter aerogenes, Klebsiella oxytoca, Morganella morganii, Proteus mirabilis, Providencia spp., Pseudomonas aeruginosa y Serratia marcescens; bacterias gram positivas como Staphylococcus saprophyticus, S. aureus (sensibles a la meticilina), S. epidermidis (sensibles a la meticilina) o Streptococcus agalactiae; y bacterias anaerobias como Bacteroides fragilis, B. thetaiotaomicron, B. caccae, Clostridium perfringens, Peptoniphilus asaccharolyticus, Peptostreptococcus sp., Prevotella bivia y P. disiens.
Aspectos moleculares
En primer lugar, meropenem es un derivado carbapenémico estrechamente relacionado con imipenem y, especialmente, con doripenem y ertapenem (Figura 2). Su nombre químico es el de ácido (4R,5S,6S)-3-[[(3S,5S)-5-[(dimetillamino)carbonil] pirrolidin-3-il]sulfanil]-6-[(1R)-1-hidroxietil]-4-metil-7-oxo-1-azabiciclo[3.2.0]hept-2-ene-2-carboxílico trihidrato, que se corresponde con la fórmula molecular C17H25N3O5S · 3H2O y con un peso molecular relativo de 437,5 g/mol. Su estructura presenta 6 átomos de carbono asimétricos; de forma aislada, se presenta como un polvo cristalino de color blanco o ligeramente amarillo.
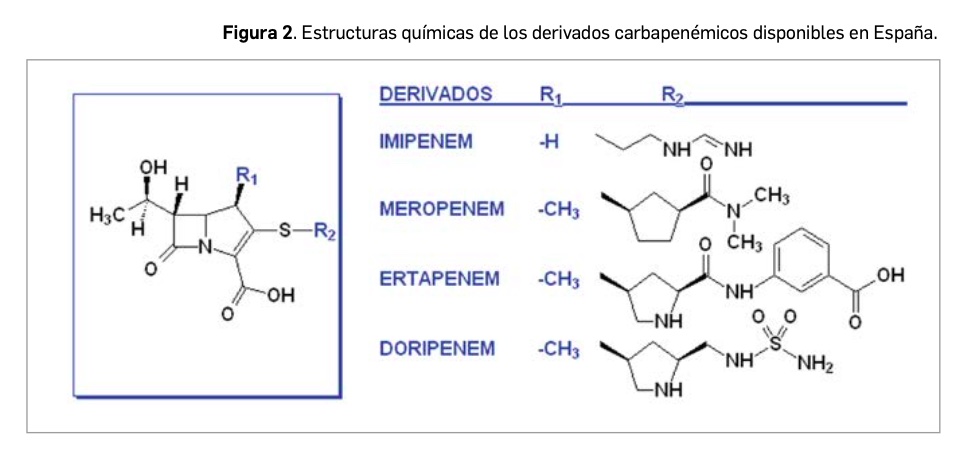
Las carbapanemas son una subfamilia de antibacterianos betalactámicos con actividad bactericida de amplio espectro y, concretamente, derivan de las penicilinas, en cuyo núcleo betalactámico se ha sustituido el átomo de azufre (S) de la fracción tiazolínica por otro de carbono (C), dando lugar a una estructura pirrolínica, característica de las carbapenemas. En casi todos los antibióticos betalactámicos la disposición espacial del núcleo betalactámico es de tipo CIS; es decir, con los dos átomos de hidrógeno (H) en el mismo lado del plano del núcleo. Sin embargo, la excepción la constituyen precisamente las carbapenemas, que tienen disposición TRANS. Esta diferencia parece ser la responsable principal de la elevada resistencia del grupo a la acción hidrolítica de buena parte de las betalactamasas. Además, la presencia del resto metilo (-CH3) en 1β del núcleo betalactámico (R1) le confiere resistencia frente a la acción degradativa de las dihidropeptidasas humanas (responsables de la inactivación renal del imipenem).
Por otra parte, vaborbactam tiene por nombre químico el de ácido (3R,6S)-2-hidroxi-3-[[2-(2-tienil)acetil]amino]-1,2-oxaborinano-6-acético, derivado de la fórmula molecular C12H16BNO5S, y presenta una masa molecular de 297,14 g/mol. Se presenta como polvo cristalino no higroscópico de color blanco-blanquecino, escasamente soluble en agua; presenta dos átomos de carbono asimétricos (3R, 6S) y dos grupos funcionales ionizables: un ácido carboxílico con un pKa= 1,9 y un ácido borónico con un pka= 8,2.
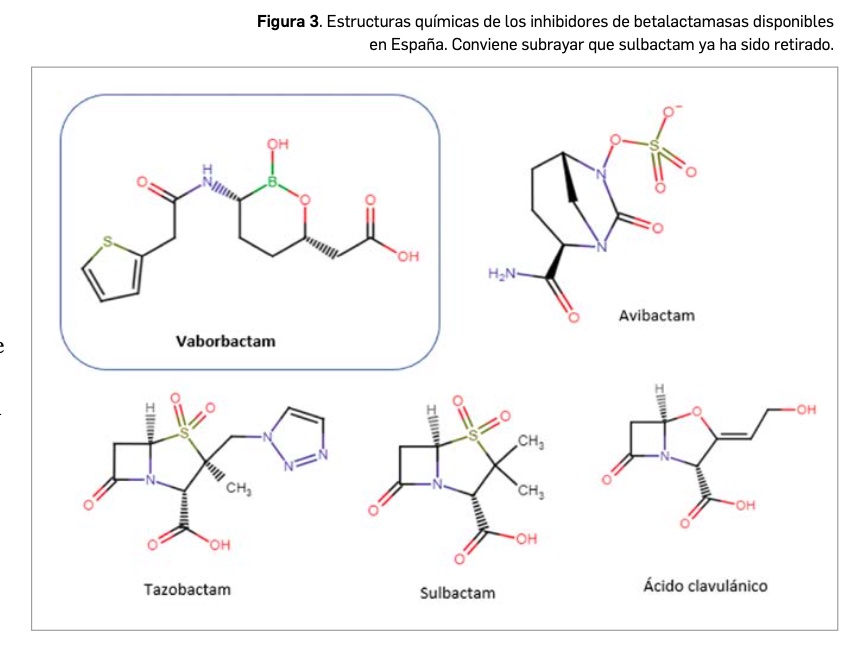
Hasta la autorización de avibactam en 2016, todos los inhibidores de betalactamasas utilizados en clínica –como el ácido clavulánico, sulbactam y tazobactam– eran análogos estructurales de las penicilinas, conteniendo un núcleo penámico. Continuando esa alternativa, vaborbactam se separa de esta característica estructural sin mantener la relativa proximidad química –por la característica presencia de un agrupamiento sulfónico (-SO2-)– que persistía en avibactam respecto a tazobactam y sulbactam (Figura 3). Quizás la principal característica estructural específica de vaborbactam es la presencia de un átomo de boro y la sustitución del grupo sulfonato por un tiofeno o tiol.
La combinación de ambos principios activos en el medicamento está en una proporción de 1:1 (1 g de meropenem y 1 g de vaborbactam).
Eficacia y seguridad clínicas
La eficacia y seguridad clínicas de meropenem/vaborbactam por vía intravenosa en adultos (≥ 18 años) han sido evaluadas en sus indicaciones aprobadas en dos estudios pivotales de fase 3 –el estudio 505 (TANGO I) y el estudio 506 (TANGO II)–, aleatorizados y multicéntricos.
_El primero de ellos –TANGO I– fue un amplio ensayo doble ciego y de doble simulación, de no-inferioridad, que evaluó la asociación de meropenem/vaborbactam (MERO/VABO) frente al control activo piperacilina/tazobactam (PIPE/TAZO) en el tratamiento de infecciones genitourinarias complicadas (ITUc), incluyendo pielonefritis aguda, que requerían ≥ 5 días de tratamiento antibiótico intravenoso. Se excluyeron pacientes con absceso renal o perinefrítico, enfermedad renal poliquística, reflujo vesicoureteral crónico, trasplante renal, cistectomía, prostatitis, orquitis, epididimitis, o cirugía reciente o planificada del tracto urinario, así como aquellos que recibieron tratamiento antibiótico 48 h antes de la aleatorización (excepto si el paciente fracasó o había recibido una única dosis). Estratificados en base al tipo de infección y región geográfica, se aleatorizaron (1:1) un total de 550 pacientes a recibir tratamiento en perfusión intravenosa de 3 h con MERO/VABO (2/2 g cada 8 h, 1/1 g en pacientes con insuficiencia renal moderada) o de 30 min con PIPE/TAZO (4/0,5 g cada 8 h); de ellos, 545 recibieron tratamiento al menos 1 día y el 89% completaron la duración del tratamiento por 5-14 días. Poco más de la mitad cambió a terapia oral con levofloxacino 500 mg/24 h (tras haber recibido al menos 15 dosis de terapia intravenosa).
Las características basales de los pacientes fueron similares entre los dos grupos de tratamiento: la edad promedio fue de 53 años (> 60% tenían < 65 años y solo un 15% eran mayores de 75), el IMC promedio fue de 26 kg/m2, > 90% eran de raza blanca (80% europeos), 66% mujeres; la mayoría de las pacientes (≈91%) tenían aislado un único microrganismo basal, destacando E. coli (77%), mientras que K. pneumoniae solo se aisló en el 11% de pacientes. Se observó una tasa notablemente mayor de resistencias a los tratamientos asignados en el brazo control. Aproximadamente el 60% de los pacientes tenían pielonefritis aguda y el 40% ITUc.
La variable primaria del ensayo fue la proporción de pacientes con respuesta o erradicación microbiológica (reducción en orina del recuento de microorganismos aislados al inicio a < 10³ UFC/ml) en la visita de curación (días 15 a 23). En la población por intención de tratar modificada microbiológicamente5 (ITTmm), dicha variable se verificó en el 66,7% (128/192) de los pacientes del brazo del tratamiento experimental, frente a un 57,7% (105/182) en el brazo control, lo que supone una diferencia absoluta de 9,0 puntos porcentuales. En la población microbiológicamente evaluable6(ME), los resultados fueron similares: 66,3% (118/178) con la nueva combinación vs. 60,4% (10/169) en el brazo control (diferencia de 5,9 puntos porcentuales). El beneficio microbiológico parece superior en la pielonefritis aguda (74,2% vs. 63,4% en la población ITTmm y 74,8% vs. 67,4% en la población ME) en comparación con la ITU complicada con fuente de infección removible (60,0% vs. 52,6% en la población ITTmm y 58,8% vs. 55,9% en la población ME). No se observó ninguna mejora microbiológica con el nuevo tratamiento en el caso de ITU complicada con fuente de infección no removible, con tasas de erradicación microbiológica que rondaban el 48% en ambos brazos.
El cambio de terapia a levofloxacino oral mostró tasas de erradicación en los días 15 a 23 más altas en comparación con el mantenimiento de la terapia intravenosa. Los resultados en los distintos subgrupos de pacientes fueron consistentes con los comentados –numéricamente mejores para la nueva combinación o similares entre ambos brazos–, a excepción de los pacientes con ITUc con infección asociada al dispositivo y que cambiaron a vía oral, donde el control activo mostró mejores resultados. De modo interesante, los tres patógenos aislados que inicialmente fueron resistentes a meropenem fueron erradicados con el tratamiento con la nueva asociación en la visita de curación, lo que evidencia cómo vaborbactam aumenta el espectro antimicrobiano del primero; también la nueva asociación se mostró más eficaz frente a los patógenos resistentes a piperacilina/tazobactam. Por último, las tasas de curación clínica en las poblaciones evaluadas fueron también numéricamente superiores en el grupo experimental frente al control en todos los tiempos considerados (de 3 a 30 días), sin diferencias reseñables entre los pacientes con pielonefritis o ITU.
_El segundo estudio –TANGO II– fue un ensayo abierto en el que se asignaron al azar (2:1) un total de 77 pacientes con infecciones bacterianas complicadas sospechosas o confirmadas de ser causadas por enterobacterias resistentes a carbapenémicos (28 con bacteriemia, 34 con ITU complicada, 8 con neumonía adquirida en el hospital y 7 con infección intraabdominal complicada) a recibir durante 7-14 días la combinación de MERO/VABO 2/2 g (N= 52) o bien, como control activo, el mejor tratamiento disponible elegido por el investigador (N= 25), que podía ser una combinación o monoterapia por vía intravenosa de alguno de los siguientes: meropenem, imipenem, ertapenem, tigeciclina, colistina, polimixina B, amikacina, gentamicina, tobramicina, o ceftazidima/avibactam. Se permitieron cambios en el fármaco dentro de las 72 h según los resultados de las pruebas de sensibilidad.
Estratificados también por indicación y región geográfica, los pacientes presentaban las siguientes características: en torno al 40% estaban inmunocomprometidos, la gran mayoría presentaba una importante carga de comorbilidades (79% tenía una puntuación en el índice de comorbilidad de Charlson7 ≥ 5); de los 54 pacientes que presentaron microorganismos gram negativos y conformaban la población ITTmm, en 47 se identificaron enterobacterias resistentes a carbapenemas (CRE), quienes formaron la población CRE-ITTmm. Las variables principales de eficacia difirieron según la indicación considerada: para ITU complicada o pielonefritis aguda se consideró la proporción de sujetos en la población CRE-ITTmm con erradicación microbiológica; para neumonía adquirida en hospital o bacteriemia se evaluó la mortalidad por cualquier causa en el día 28 en CRE-ITTmm; y en pacientes con infección intraabdominal complicada se estimó la proporción de pacientes en CRE-ITTmm con resultado clínico de curación en la visita de curación (días 15 a 23).
Los resultados revelan que para todas las indicaciones se obtuvieron datos microbiológicos, clínicos y de tasas de mortalidad mejores en pacientes que recibieron MERO/VABO en comparación con el mejor tratamiento disponible, tanto en las poblaciones de ITTmm como en CRE-ITTmm, con un beneficio consistente en todos los subtipos de pacientes considerados (adultos de > 65 y > 75 años, con alta carga de comorbilidades o con insuficiencia renal), aunque los resultados en sujetos con ITU complicada o pielonefritis son difíciles de interpretar. Así, en la visita de curación, las tasas de curación clínica y de erradicación microbiológica en la población CRE-ITTmm fueron, respectivamente, un 30,5% y 11,8% más altas en el grupo experimental respecto al grupo control para el conjunto de indicaciones. La tasa de mortalidad por cualquier causa al día 28 también se vio notablemente reducida a la mitad (15,6% vs. 33,3%). De modo interesante, los datos finales del estudio en pacientes con infección por enterobacterias productoras de carbapenemasas y con bacteriemia como única fuente microbiológica al inicio del estudio revelan que la mortalidad se reduce notablemente con MERO/VABO (28,6% vs. 37,5% con el tratamiento seleccionado), lo cual apoya el uso de la combinación en esos pacientes (AEMPS, 2021).
Por indicaciones, los resultados de las variables primarias fueron los siguientes:
- Para sujetos con ITU complicada o pielonefritis, la proporción de pacientes de la población CRE-ITTmm que mostraban erradicación microbiológica al final del tratamiento (de día 10 al 14) fue del 66,7% en el brazo experimental frente al 50% en el brazo control.
- En pacientes con neumonía adquirida en hospital o bacteriemia, la tasa de mortalidad por cualquier causa al día 28 en la población CRE-ITTmm se redujo a la mitad en el brazo experimental frente al control (22,2% vs. 44,4%).
- En sujetos con infección intraabdominal complicada, la tasa de curación clínica –resolución completa o mejora significativa de los signos y síntomas basales que permiten abandonar tratamiento– en la visita de curación en pacientes de la población CRE-ITTmm fue del 100% en el grupo tratado con la nueva combinación frente al 0% con el comparador activo.
Con respecto a la seguridad de meropenem/vaborbactam, conviene subrayar que la limitación en el número de pacientes que se han expuesto a la dosis clínica prevista (2g/2g en infusión cada 3 h), un total de 322 en los estudios clínicos de fase 3, no supone un impedimento importante para dilucidar su perfil toxicológico. La dosis de meropenem usada en la combinación es la más alta aprobada en la UE, para la cual se ha descrito adecuadamente su tolerabilidad.
En el estudio TANGO I, el más amplio de los realizados con MERO/VABO, la proporción de pacientes que notifica algún evento adverso relacionado con los fármacos en estudio se ha mostrado muy similar a la del comparador piperacilina/tazobactam (15,1% vs. 12,8%, graves en el 4% vs. 4,4%). Las reacciones adversas más frecuentes con la nueva combinación fueron: cefalea (8,1%), diarrea (4,7%), flebitis en el lugar de perfusión (2,2%) y náuseas (2,2%). Ninguna de ellas fue considerada grave o motivo de interrupción del tratamiento (la tasa de discontinuación se mantuvo baja, en torno al 1%); solo se observaron reacciones adversas graves en dos pacientes (0,6%): una asociada a la perfusión y un aumento de los niveles sanguíneos de fosfatasa alcalina (AEMPS, 2018). Las reacciones adversas en el lugar de la inyección fueron ligeramente más comunes con la nueva combinación que con los comparadores, si bien no parece que la tolerancia local sea un problema importante a nivel global. Ninguna de las muertes registradas durante el desarrollo clínico de la combinación se consideró relacionadas con el tratamiento. Se acepta que la tasa de eventos adversos es mayor en pacientes con insuficiencia renal (AEMPS, 2021).
Aspectos innovadores
El nuevo medicamento consiste en una combinación de meropenem, un antibiótico betalactámico previamente comercializado del grupo de los derivados del carbapenem (cuya acción bactericida se media por la inhibición de la síntesis de la pared celular de peptidoglicano), y vaborbactam, un novedoso inhibidor de betalactamasas que, si bien no tiene actividad antibacteriana, busca ampliar el espectro y la potencia antibacteriana de meropenem. El medicamento ha sido autorizado para su uso por vía intravenosa, siguiendo las directrices oficiales del uso apropiado de antibacterianos, para el tratamiento en pacientes adultos de infecciones urinarias complicadas (incluida la pielonefritis), infecciones intraabdominales complicadas, neumonías intrahospitalarias (incluida la asociada a ventilación mecánica), bacteriemias asociadas –o con sospecha de estar asociadas– a cualquiera de las infecciones anteriores e infecciones debidas a microorganismos gran negativos aerobios en adultos con opciones de tratamiento limitadas.
El nuevo principio activo vaborbactam carece de núcleo betalactámico y ejerce su acción inhibitoria de las betalactamasas de clases A y C –incluida la carbapenemasa de K. pneumoniae– mediante la formación de un aducto covalente con las mismas (pero no inhibe las enzimas de clase B ni las carbapenemasas de clase D), diferenciándose en estructura y selectividad de los otros inhibidores de betalactamasas disponibles (ácido clavulánico, tazobactam y avibactam). Aunque los derivados carbapenémicos tienen por sí mismos una resistencia intrínseca mayor frente a la acción hidrolítica de las betalactamasas en comparación con otros antibióticos betalactámicos, vaborbactam complementa esa resistencia para aportar al medicamento un espectro antibacteriano más amplio que el que presentaría meropenem en monoterapia. En consecuencia, el medicamento tiene una acción más marcada sobre gram negativos, habiéndose probado su eficacia clínica frente a patógenos como Escherichia coli, Klebsiella pneumoniae y el complejo Enterobacter cloacae spp. No obstante, no se ha confirmado aún su actividad frente a otras bacterias potencialmente implicadas en las indicaciones aprobadas. Tampoco vaborbactam puede proteger a meropenem de las betalactamasas de clase B y D ni restaurar la sensibilidad al carbapenémico si la resistencia se debe a la impermeabilidad de la membrana externa o a una bomba de eflujo.
Los datos clínicos procedentes de dos estudios clínicos de fase 3 han contrastado adecuadamente la eficacia clínica de la combinación a las dosis autorizadas en su indicación en ITUc y pielonefritis. Así, el ensayo TANGO I (N= 550) confirmó su no-inferioridad frente a piperacilina/tazobactam, dado que la diferencia en las tasas de erradicación microbiológica estaba dentro del -10% que establece la guía de la EMA: en la visita de curación entre los días 15 y 23 de tratamiento, era de 67% en el brazo experimental frente al 58% en el brazo control (población ITTmm). El beneficio microbiológico fue superior en pacientes con pielonefritis aguda (74% vs. 63% en la población ITTmm) en comparación con ITU complicadas con fuente de infección removible (60% vs. 53% en la población ITTmm). No obstante, el estudio incluyó muy pocos microorganismos resistentes a meropenem, por lo que el estudio no demuestra sólidamente que vaborbactam actúe como inhibidor de carbapenemasas tipo A, siendo más probable que las diferencias de eficacia observadas se deban al propio meropenem (el cual, en monoterapia, se ha probado más eficaz que piperacilina/tazobactam en infecciones complicadas). En general, la eficacia de la nueva combinación mostró superioridad numérica en todos los subgrupos diagnósticos, excepto en el de ITUc con foco de infección no asociada a dispositivo.
Es importante subrayar que por ahora no se dispone de datos definitivos de eficacia clínica en el resto de las indicaciones. De hecho, el estudio TANGO II solo incluyó un número muy limitado de pacientes con infecciones intraabdominales complicadas (n= 7), con neumonía nosocomial (n= 8) o con infecciones causadas por bacterias resistentes a los carbapenémicos y con opciones de tratamiento muy limitadas (n= 47), de modo que la autorización de la combinación en estas indicaciones se basa en la experiencia con la monoterapia con meropenem, datos de preclínica y análisis combinados de farmacocinética/farmacodinamia, aceptando que se pueden alcanzar concentraciones de vaborbactam en la cavidad abdominal y en el epitelio pulmonar suficientes para proteger a meropenem frente a carbapenemasas y betalactamasas. Dicho estudio también incluyó 24 pacientes con bacteriemia conjunta o asociada a las infecciones anteriores, concluyéndose que los datos sí son suficientes para avalar el uso de la combinación en estos pacientes.
Desde el punto de vista de la seguridad, el perfil toxicológico de la nueva combinación se puede considerar similar al de los comparadores usados en los diferentes estudios, esto es, un perfil relativamente benigno, manejable, y equiparable al de otros antibióticos betalactámicos (por ejemplo, con incidencia de eventos adversos parecida a la notificada con pireracilina/tazobactam). Las reacciones adversas más comunes durante el tratamiento son la cefalea (8%), la diarrea (5%), flebitis en el lugar de perfusión (2%) y las náuseas (2%). Ninguna de ellas fue considerada grave o motivo de interrupción del tratamiento (la tasa de discontinuación se mantuvo baja, en torno al 1%). Dado que la tasa de eventos adversos es mayor en pacientes con insuficiencia renal, en ellos es recomendable una estrecha vigilancia y ajustar la dosis según el aclaramiento de creatinina.
En resumen, se trata de la primera combinación de un antibiótico carbapenémico con un inhibidor de betalactamasas, que puede jugar un papel importante en el abordaje de un grave problema de salud pública como son las infecciones complicadas causadas por enterobacterias (entre ellas, K. peumoniae) y Pseudomonas aeruginosa multirresistentes productoras de betalactamasas de espectro extendido o de carbapenemasas; frente a ellas, los datos clínicos y experiencia de uso demuestran que las carbapenemas son en general eficaces y se consideran la opción más adecuada en caso de necesidad de uso empírico. Por su perfil, parece una opción más útil para enterobacterias que para P.aeruginosa, ya que esta última suele poseer mecanismos de resistencia no evitables con vaborbactam. Es decir, estamos ante un buen antibiótico que amplía las opciones disponibles en el ámbito de las infecciones complicadas del tracto urinario e intraabdominales, neumonías nosocomiales y septicemia, pero que no aporta ningún elemento innovador farmacológico ni clínico respecto a otras opciones ya disponibles.
El IPT considera, a la vista de las limitaciones de los ensayos clínicos, que meropenem/vaborbactam es una alternativa en la terapéutica dirigida cuando se disponga del antibiograma, siendo también de utilidad en el tratamiento empírico en casos de sospecha o alta prevalencia local de infección por enterobacterias productoras de carbapenemasas A (incluida la KPC8), pero no debe considerarse una opción preferente en el tratamiento empírico de infecciones por enterobacterias productoras de betalactamasas distintas a las carbapenemasas A, pues existen otras alternativas. Su elección se hará de forma individualizada, teniendo en cuenta la gravedad de la infección y las características del paciente, preferiblemente dentro de programas de optimización de uso de antibióticos, ya que su uso indiscriminado puede contribuir a la proliferación de microorganismos no sensibles, requiriendo la interrupción del tratamiento u otras medidas adecuadas (AEMPS, 2021).
Valoración
Fármacos relacionados registrados en España