Número 447, Octubre 2021

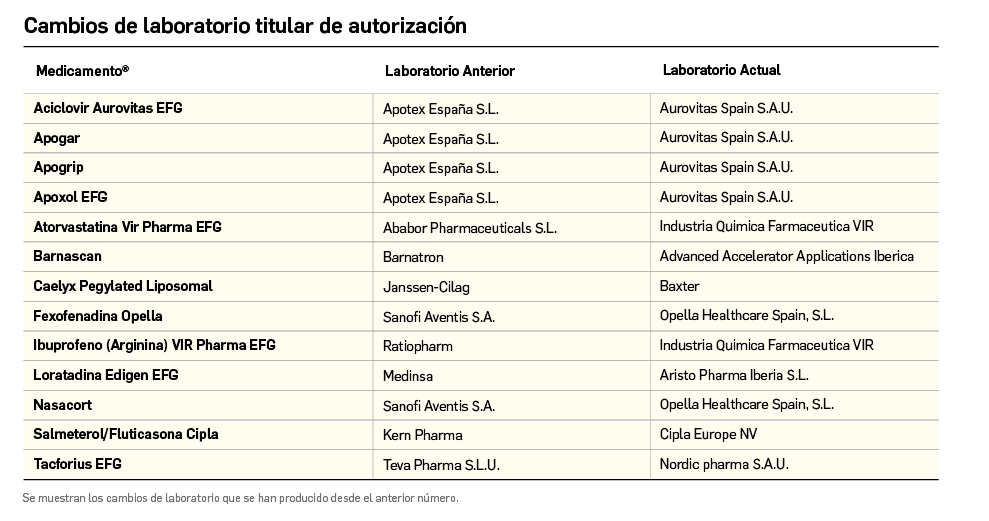
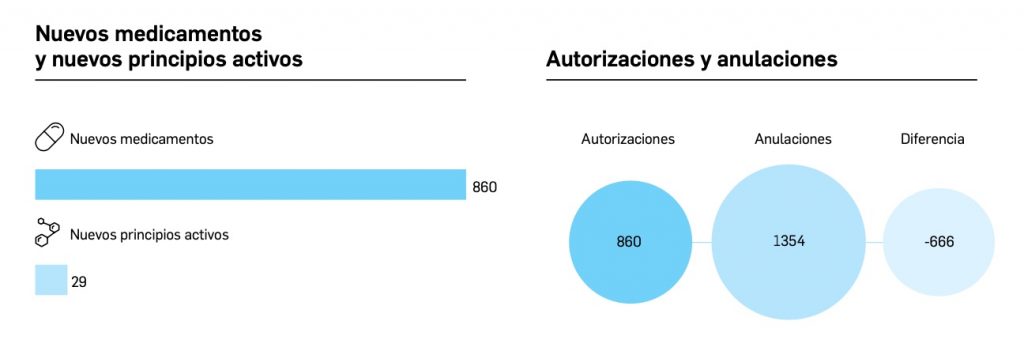
Además de la información que se incluye en los listados mensuales publicados en PAM, en BOT PLUS se incluye un apartado de Histórico, en las fichas de medicamentos, en el que se presenta información referente a cambios que haya sufrido anteriormente el medicamento o producto, entre otros, los cambios de nombre y los cambios de laboratorio. Esta información también está disponible para productos sanitarios financiados o dietoterápicos.
Se añade la posibilidad de visualización de las situaciones anteriores (o incluso futuras) relacionadas con un cambio de nombre.
Con automatismos que nos permiten localizar un medicamento que haya cambiado de nombre, independientemente de cuál usemos.
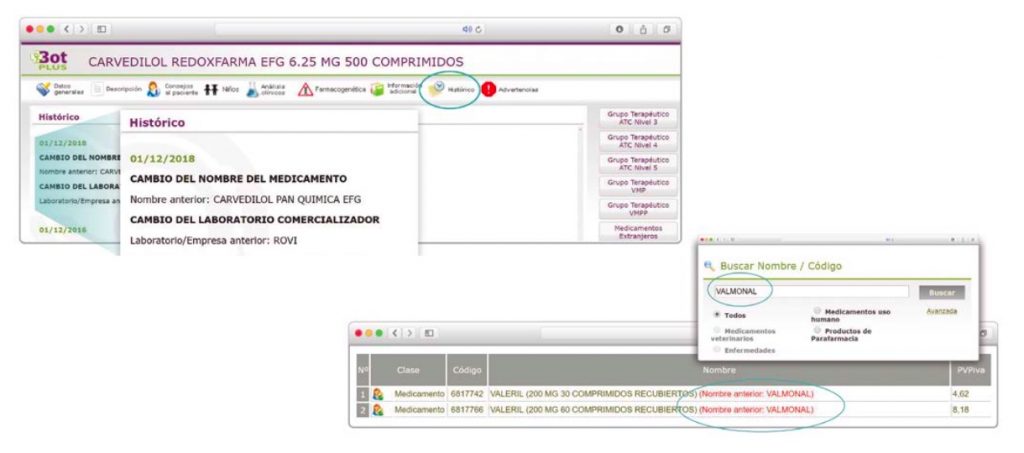
Además de la información existente en Histórico, se permite la explotación de la información incluida en BOT PLUS en este apartado, mediante la integración de la información almacenada en Histórico en el apartado de Listados de BOT PLUS, que permite realizar consultas entre rangos de fechas y por un concepto en concreto de entre los almacenados en el apartado de Histórico. Entre ellos se incluyen, precisamente, los conceptos “Cambio del nombre del medicamento” y “Cambio del laboratorio comercializador”.
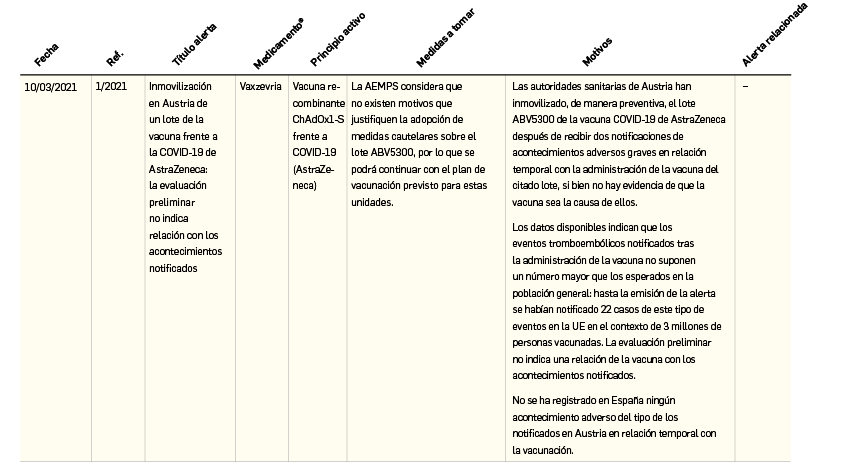
Resumen de las notas sobre seguridad y farmacovigilancia publicadas por la AEMPS desde principios del año 2021. Para información más ampliada y acceso al documento de la AEMPS, puede consultar BOT PLUS.
Continúa la tabla aquí
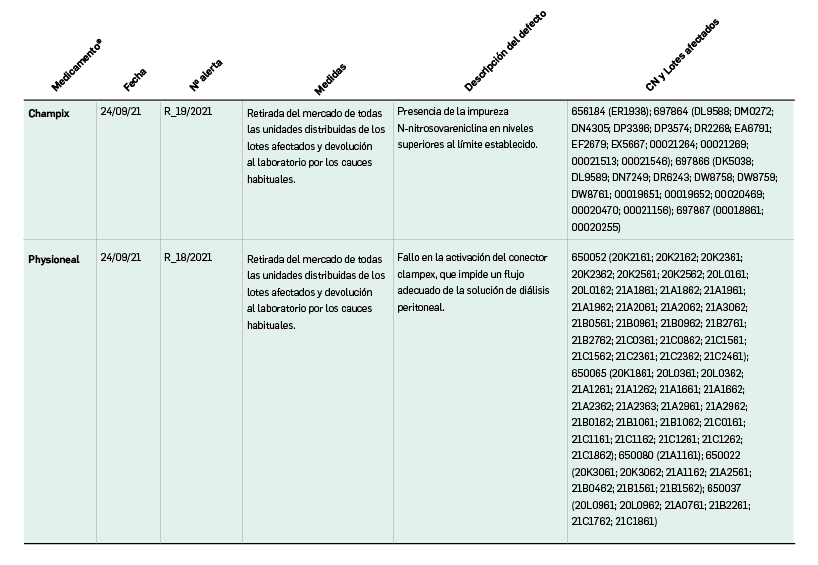
Alertas debidas a defectos de calidad observados en medicamentos de uso humano, publicadas por la AEMPS desde el anterior número y que suponen la retirada o inmovilización de ciertos lotes de medicamentos. En BOT PLUS puede encontrar más información detallada, con acceso al documento de la AEMPS.
Además de los listados mensuales que podemos consultar en PAM, en BOT PLUS se incorpora la información que publica la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) relativa a notificaciones sobre seguridad y/o calidad de los medicamentos. Mediante un pictograma específico se pueden visualizar de forma rápida medicamentos afectados por alguna alerta de seguridad o de defectos de calidad, con tan solo entrar en su ficha.
Al acceder a la ficha de un medicamento afectado por una retirada, se visualiza un mensaje con la advertencia “Medicamento con lotes retirados por Alerta AEMPS. Ver más información en “Alertas Calidad”.
Además, se incluye una pestaña específica en la que se pueden consultar los lotes concretos que han sido retirados, con sus respectivas fechas de caducidad, así como la descripción del defecto de calidad detectado y las medidas a adoptar. También se cuenta con acceso al documento publicado por la AEMPS.
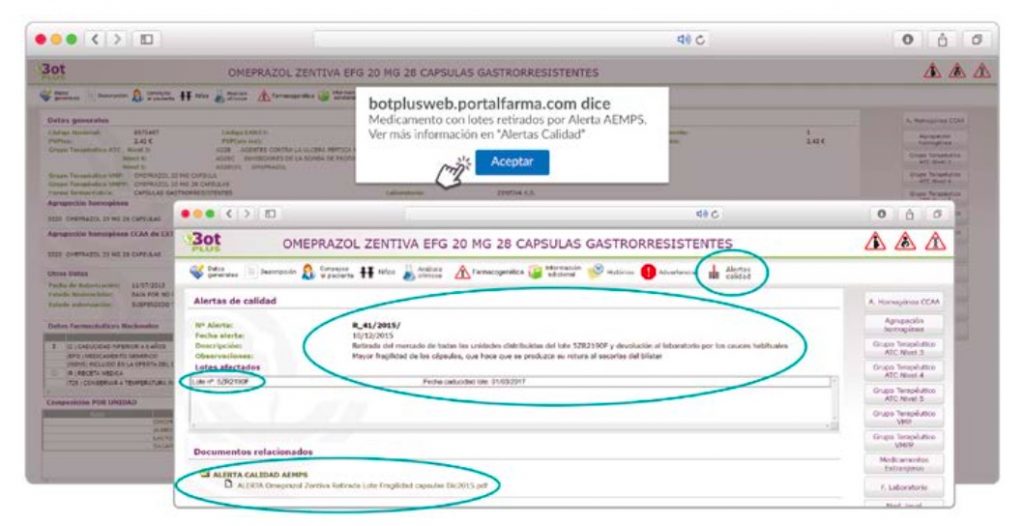
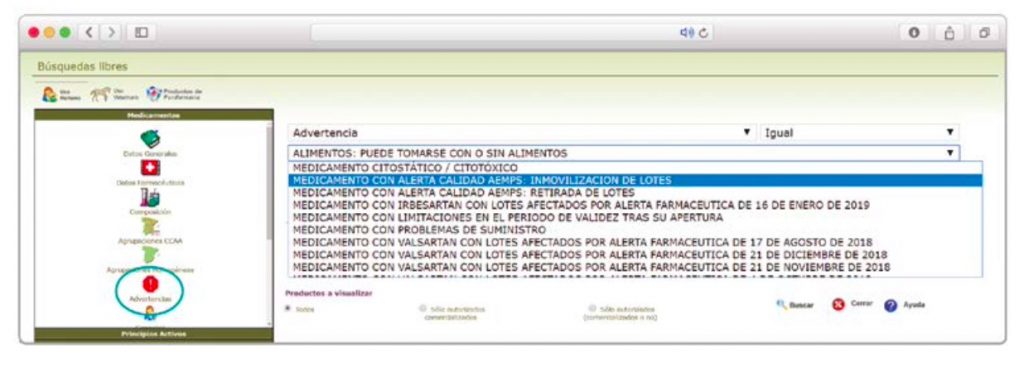
De forma interesante, dicha información se puede explotar a través de la Búsqueda Libre de BOT PLUS para obtener listados de todos los medicamentos afectados por alertas de calidad que implica la retirada (o también la inmovilización) de sus lotes en un momento dado.
Esta codificación de los lotes retirados es una información puesta a disposición de todos los usuarios, con el
objetivo de ofrecer una nueva información capaz de integrarse con otros sistemas de información y mejorar la gestión e identificación de estos medicamentos, en los que la labor asistencial y de control del farmacéutico es fundamental.
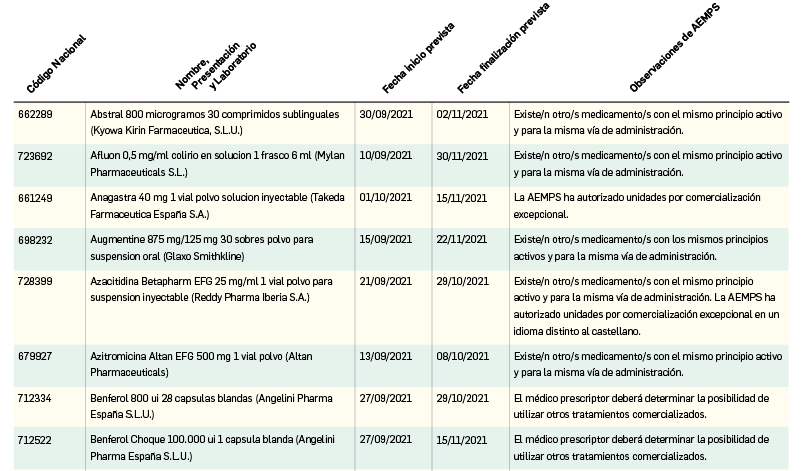
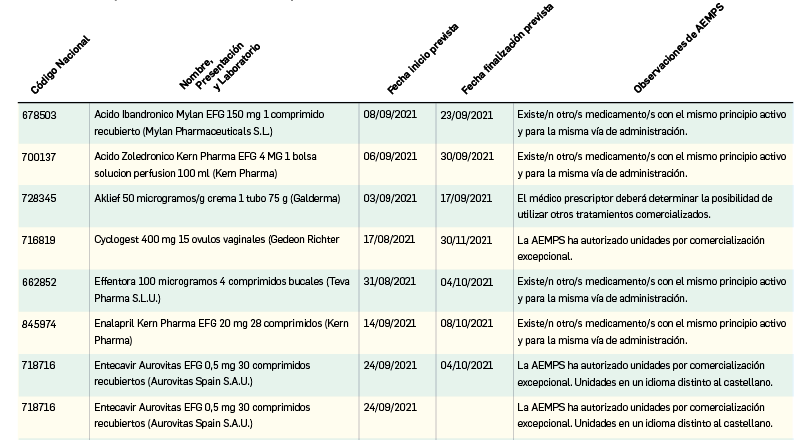
Listado de medicamentos con problemas de suministro publicado por la AEMPS, a fecha de cierre de este número. En BOT PLUS, se puede encontrar la información completamente actualizada, al tratarse de una información que varía de forma continua.
Continúa la tabla aquí
Continúa la tabla aquí
Medicamentos de uso humano autorizados en la Unión Europea (EMA) y Estado Unidos (FDA) durante los últimos 12 meses, con principios activos o biosimilares que aún no están comercializados en España.
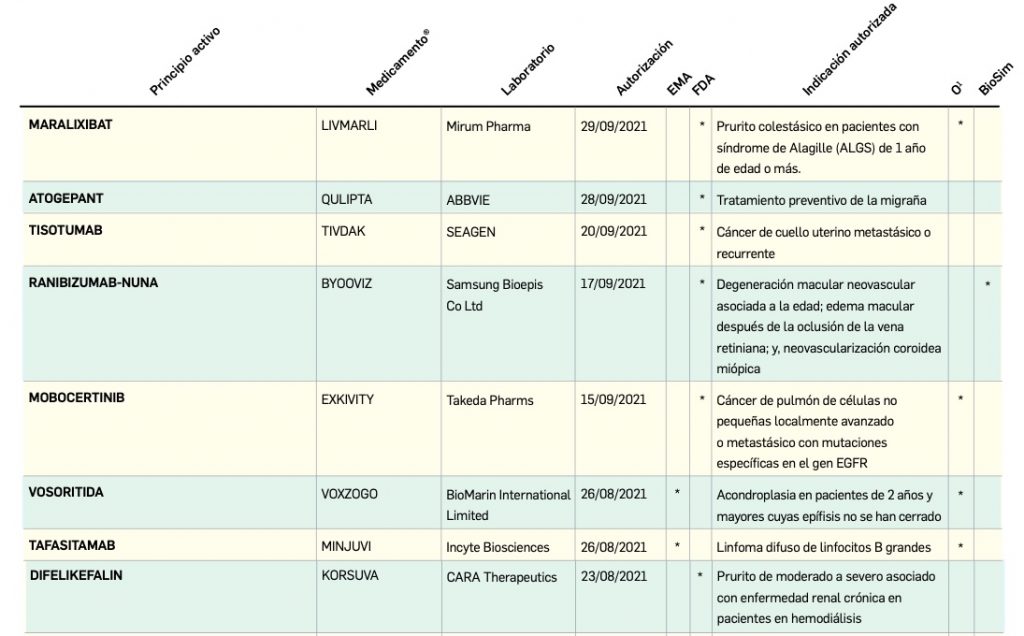
Continúa la tabla aquí
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
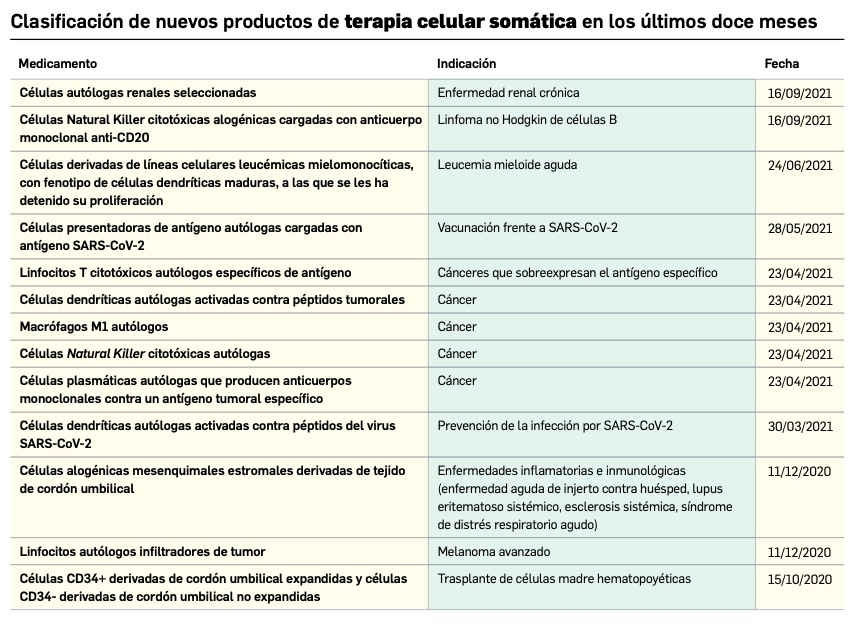
Continúa la tabla aquí
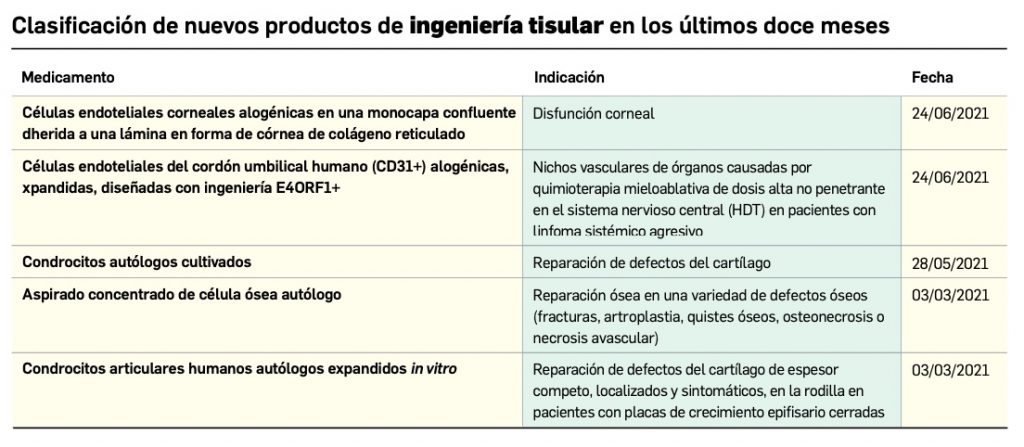
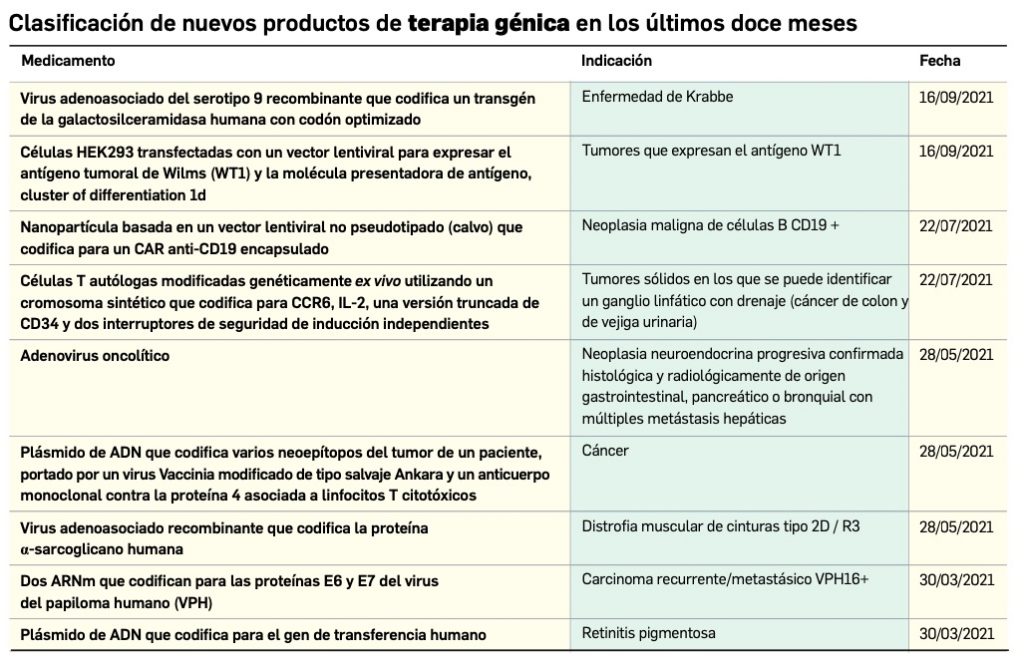
Continúa la tabla aquí
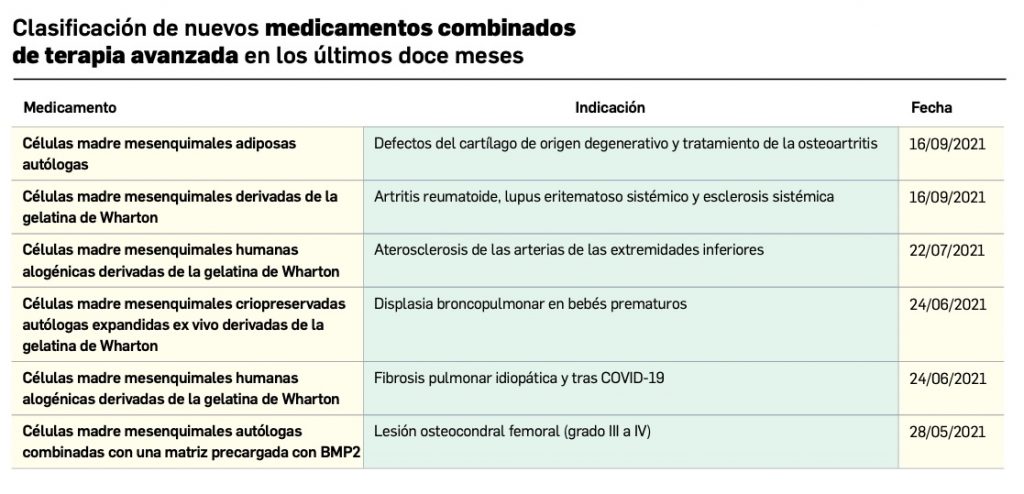
Continúa la tabla aquí
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas. La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios solo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
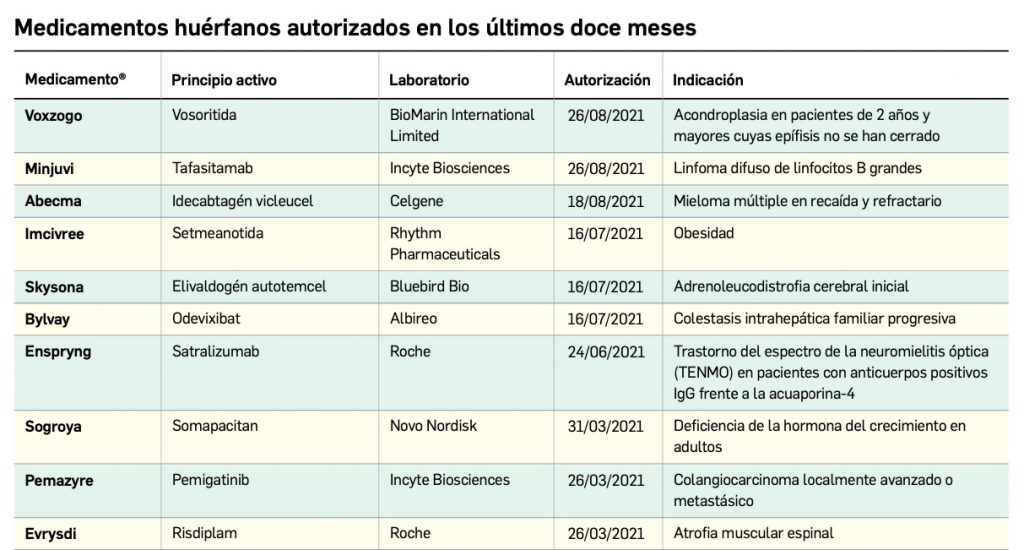
Continúa la tabla aquí
Instituciones y redes españolas
► Instituto de Salud Carlos III (Ministerio de Ciencia e Innovación):
Instituto de Investigación en Enfermedades Raras:
https://www.isciii.es/QuienesSomos/CentrosPropios/IIER/Paginas/default.aspx
CIBERER (Centro de Investigación Biomédica en Red de Enfermedades Raras): https://www.ciberer.es/
►Instituto de Mayores y Servicios Sociales (IMSERSO, Ministerio de Derechos Sociales y Agenda 2030):
http://www.imserso.es/imserso_01/index.htm
► Federación Española de Enfermedades Raras (FEDER): www.enfermedades-raras.org
► Asociaciones de pacientes en España: https://enfermedades-raras.org/index.php/asociaciones/nuestros-socios
Instituciones y redes europeas
►Agencia Europea de Medicamentos (EMA; Europea Medicines Agency). Apartado de Medicamentos Huérfanos
(inglés): https://www.ema.europa.eu/en/human-regulatory/overview/orphan-designation-overview
https://www.ema.europa.eu/en/committees/committee-orphan-medicinal-products-comp
►Comisión Europea: web oficial de la Comisión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://ec.europa.eu/health/rare_diseases/policy/index_es.htm
►Orphanet: Portal de información oficial de la Unión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://www.orpha.net/consor/cgi-bin/index.php?lng=ES
► Eurordis: Federación Europea de Asociaciones de Pacientes con Enfermedades Raras (español). http://www.eurordis.org/es
Otras instituciones y redes internacionales
►Food & Drug Administration (FDA, Estados Unidos). Apartado de Medicamentos Huérfanos (inglés):
http://www.fda.gov/ForIndustry/DevelopingProductsforRareDiseasesConditions/default.htm
►Pharmaceuticals & Medical Devices Agency. Agencia de Medicamentos y Dispositivos Médicos, de Japón (inglés):
http://www.pmda.go.jp/english/index.html
La Agencia Europea de Medicamentos (EMA) ha iniciado una revisión de los datos relativos a casos de meningiomas (tumor de las membranas que recubren el cerebro y la médula espinal) en mujeres tratadas con medicamentos con nomegestrol o con clormadinona, en diversos trastornos ginecológicos. El objetivo es confirmar este riesgo en ambos medicamentos, para armonizar, en su caso, la información relativa a este riesgo en todos los medicamentos con ambos principios activos.
La Agencia Europea de Medicamentos (EMA) ha iniciado una revisión de los medicamentos que contienen los principios activos nomegestrol y clormadinona (EMA, 2021). Estos medicamentos pueden usarse, solos o en combinación con otros principios activos (estradiol o etinilestradiol), para tratar trastornos ginecológicos como amenorrea (ausencia de períodos menstruales) y otros trastornos menstruales, sangrado uterino, endometriosis (una condición en la que tejido similar al revestimiento del útero crece en otras partes del cuerpo), sensibilidad en los senos y como terapia de reemplazo hormonal o como anticonceptivos.
La revisión fue solicitada por la agencia francesa de medicamentos (ANSM, Agence Nationale de Sécurité du Médicament et des Produits de Santé) a raíz de nuevos datos de dos estudios epidemiológicos llevados a cabo en Francia en mujeres que tomaban estos medicamentos, para investigar el riesgo de meningioma, un tumor de las membranas que recubren el cerebro y la médula espinal. Este tumor generalmente no es maligno y no se considera un cáncer, pero debido a su ubicación dentro y alrededor del cerebro y de la médula espinal, los meningiomas, en algunos casos, pueden causar problemas graves.
Se han notificado casos de meningioma en mujeres que toman medicamentos que contienen nomegestrol o clormadinona y ya se incluyen advertencias en la información de prescripción de algunos de los medicamentos, como en Zoely® (con nomegestrol y estradiol hemihidrato). Sin embargo, la información para prescriptores (fichas técnicas) y pacientes (prospectos) puede diferir entre los Estados miembros de la Unión Europea (UE).
Los datos de los dos estudios sugieren que el riesgo de meningioma aumenta con la dosis y la duración del tratamiento, y puede ser mayor en mujeres que toman nomegestrol o clormadinona durante varios años. Los estudios mostraron también que después de que las mujeres dejaron de tomar nomegestrol o clormadinona durante un año o más, el riesgo de desarrollar estos tumores se redujo, y fue comparable al riesgo en las personas que nunca usaron estos medicamentos.
Los medicamentos que contienen acetato de nomegestrol o acetato de clormadinona que se están revisando actualmente, están disponibles en forma de comprimidos que se administran por vía oral. Están disponibles solos o en combinación con estrógenos y se comercializan con varios nombres comerciales. En España están comercializados: con nomegestrol acetato, ▼Zoely® (en combinación con estradiol hemihidrato) como anticonceptivo hormonal combinado oral; y con clormadinona acetato (en combinación con etinilestradiol) ▼Balianca®, ▼Belara®, ▼Elynor® y varios medicamentos genéricos, EFG, de Aristo Pharma Iberia y Stada.
Con la excepción de ▼Zoely® (acetato de nomegestrol /estradiol hemihidrato), que está autorizado de forma centralizada, y ya incluye advertencias sobre meningiomas en la información de prescripción (ficha técnica), todos los demás medicamentos afectados por este procedimiento han sido autorizados mediante procedimientos nacionales.
A la luz de estos nuevos datos, el comité de seguridad de la EMA (PRAC, Pharmacovigilance Risk Assessment Committee) examinará la evidencia disponible y hará recomendaciones sobre si las autorizaciones de comercialización de los medicamentos que contienen nomegestrol y clormadinona deben modificarse en toda la UE. Todo ello siguiendo el procedimiento europeo de arbitraje (o referral, en inglés), de toma única de medidas para toda la UE y de obligado cumplimiento para los 27 estados miembros.