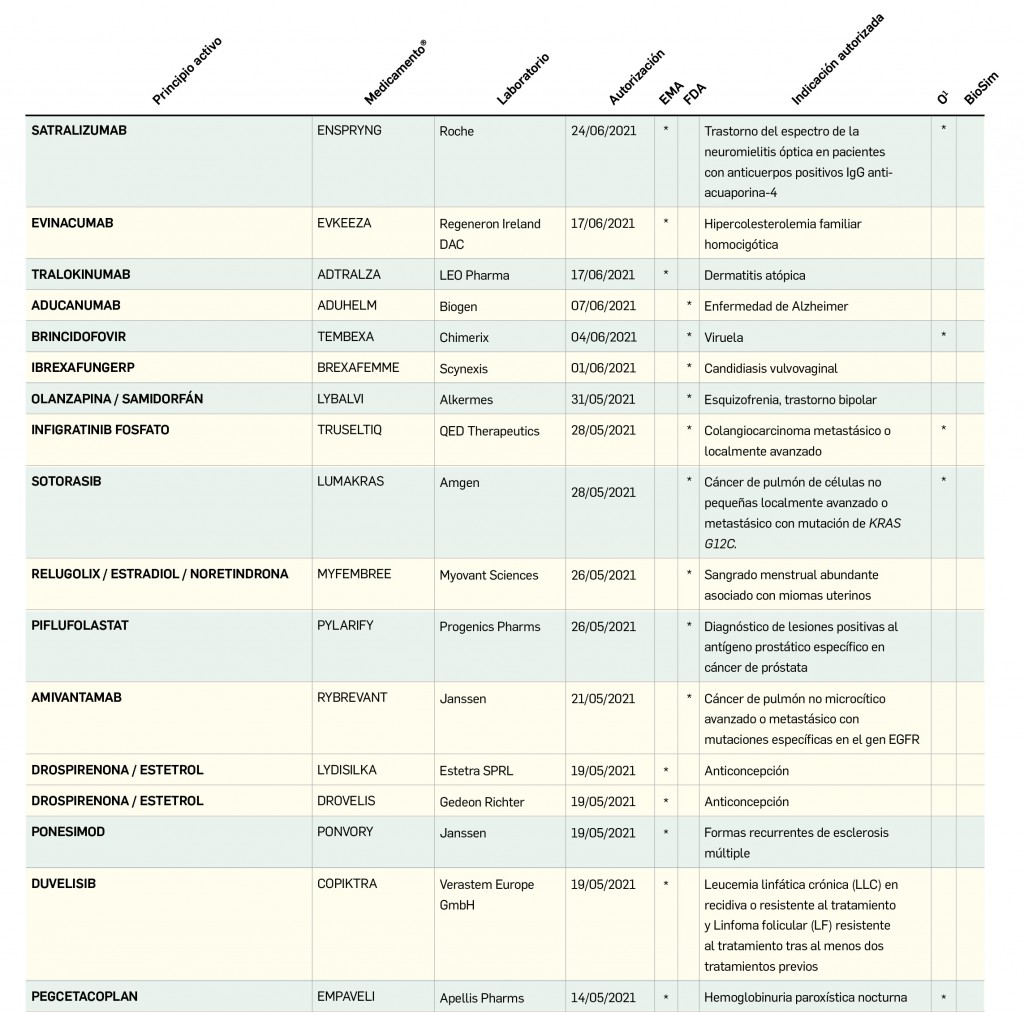
Medicamentos de uso humano autorizados en la Unión Europea (EMA) y Estado Unidos (FDA) durante los últimos 12 meses, con principios activos o biosimilares que aún no están comercializados en España.
Número 445, Julio – Agosto 2021
Medicamentos de uso humano autorizados en la Unión Europea (EMA) y Estado Unidos (FDA) durante los últimos 12 meses, con principios activos o biosimilares que aún no están comercializados en España.

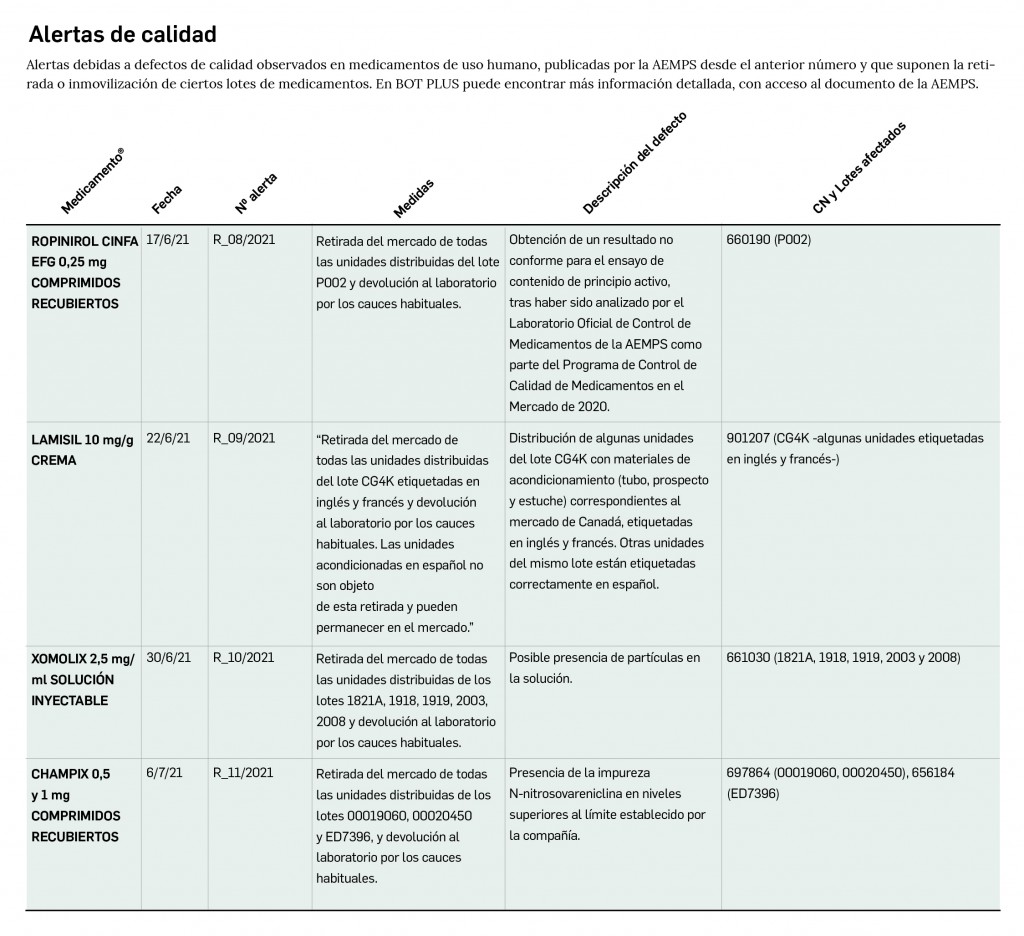
Alertas debidas a defectos de calidad observados en medicamentos de uso humano, publicadas por la AEMPS desde el anterior número y que suponen la retirada o inmovilización de ciertos lotes de medicamentos. En BOT PLUS puede encontrar más información detallada, con acceso al documento de la AEMPS.
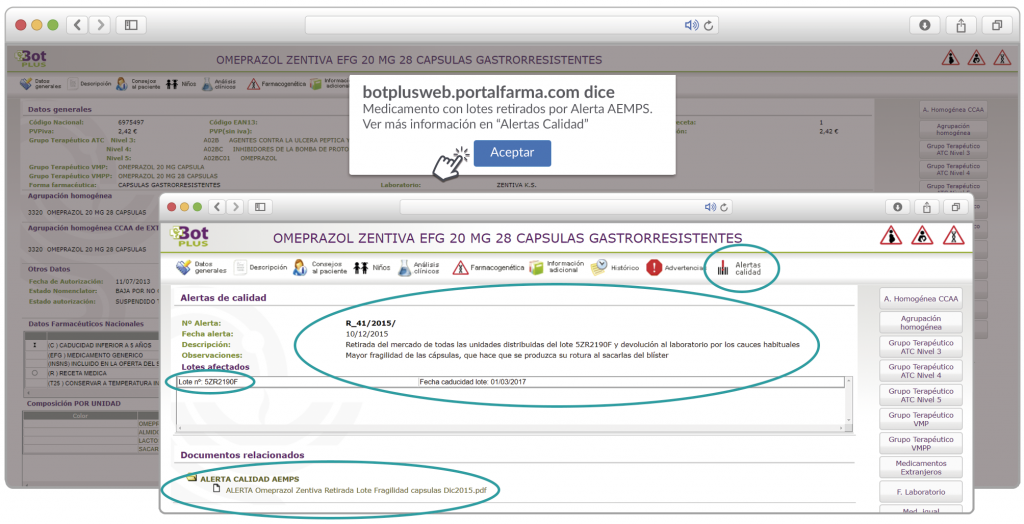
Además de los listados mensuales que podemos consultar en PAM, en BOT PLUS se incorpora la información que publica la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) relativa a notificaciones sobre seguridad y/o calidad de los medicamentos. Mediante un pictograma específico se pueden visualizar de forma rápida medicamentos afectados por alguna alerta de seguridad o de defectos de calidad, con tan solo entrar en su ficha.
Al acceder a la ficha de un medicamento afectado por una retirada, se visualiza un mensaje con la advertencia “Medicamento con lotes retirados por Alerta AEMPS. Ver más información en “Alertas Calidad”.
 Además, se incluye una pestaña específica en la que se pueden consultar los lotes concretos que han sido retirados, con sus respectivas fechas de caducidad, así como la descripción del defecto de calidad detectado y las medidas a adoptar. También se cuenta con acceso al documento publicado por la AEMPS.
Además, se incluye una pestaña específica en la que se pueden consultar los lotes concretos que han sido retirados, con sus respectivas fechas de caducidad, así como la descripción del defecto de calidad detectado y las medidas a adoptar. También se cuenta con acceso al documento publicado por la AEMPS.
![]()
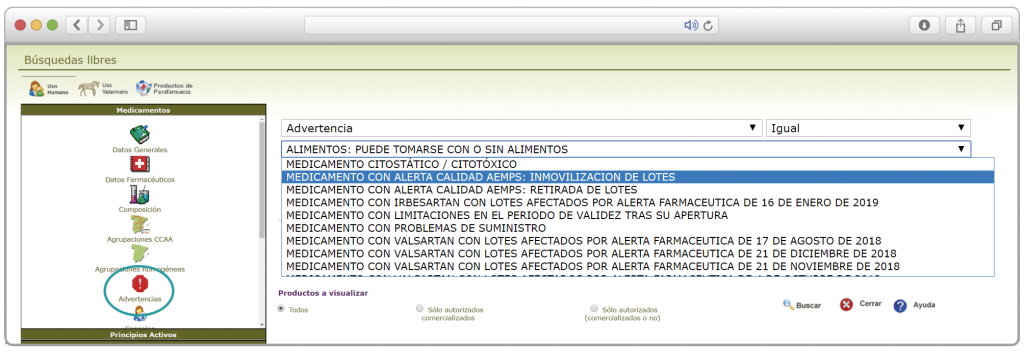
De forma interesante, dicha información se puede explotar a través de la Búsqueda Libre de BOT PLUS para obtener listados de todos los medicamentos afectados por alertas de calidad que implica la retirada (o también la inmovilización) de sus lotes en un momento dado.
Esta codificación de los lotes retirados es una información puesta a disposición de todos los usuarios, con el objetivo de ofrecer una nueva información capaz de integrarse con otros sistemas de información y mejorar la gestión e identificación de estos medicamentos, en los que la labor asistencial y de control del farmacéutico es fundamental.
La alergia se define como un conjunto de reacciones de hipersensibilidad del sistema inmunitario de algunas personas frente a determinadas sustancias (alérgenos) que normalmente son inocuas para el resto, tales como pólenes de diferentes especies vegetales, ciertos alimentos, pelo de algunos animales, veneno de insectos, ácaros, o determinados medicamentos, entre otros. El sistema inmunitario de la persona alérgica reconoce como extraño cualquiera de estos elementos y pone en marcha una reacción específica “exagerada” para identificar y destruir el alérgeno a través de un complejo proceso inflamatorio en el que participan distintos tipos de células y los mediadores bioquímicos producidos por ellas.
La relevancia epidemiológica de los procesos alérgicos se ilustra con la cifra estimada por la Organización Mundial de la Alergia: hasta el 20% de la población mundial sufre alguna enfermedad alérgica, que afectan frecuentemente a la población infantil y cuya variabilidad clínica puede afectar tanto al sistema digestivo, como al sistema respiratorio, a la piel o tener una presentación multiorgánica, con grandes diferencias entre pacientes. Esto es, más que una enfermedad en sí, la alergia puede manifestarse como diversas entidades patológicas, tales como rinitis y conjuntivitis alérgica, urticaria, asma alérgico, dermatitis atópica y anafilaxia. Diversos factores, entre los que se han postulado los mayores niveles de contaminación ambiental o los hábitos higiénicos, están haciendo que los casos de este tipo de patologías alérgicas sean cada vez más prevalentes en la sociedad actual, en mayor medida en los países desarrollados.
En líneas generales, la estrategia de tratamiento de las enfermedades alérgicas se basa fundamentalmente en la educación del paciente, las medidas de prevención de la exposición a alérgenos, la farmacoterapia y la inmunoterapia desensibilizante. El tratamiento farmacológico incluye el empleo de antihistamínicos H1, glucocorticoides, descongestivos nasales, adrenalina, antagonistas de los receptores de leucotrienos, anticuerpos monoclonales anti-IgE y anti-interleucinas e inhibidores de fosfodiesterasas. Este artículo revisa de forma resumida el conocimiento actual sobre la etiopatogenia, aspectos clínicos y epidemiológicos de los procesos alérgicos, centrando el foco especialmente sobre las distintas opciones farmacológicas disponibles para su tratamiento y prevención; se aborda, por último, el papel asistencial que el farmacéutico comunitario puede desarrollar para con los pacientes con alergias y la población general.
El término alergia procede de las palabras griegas allos –“otro”, “diferente”, “extraño”, o “estado de alteración”– y ergos –“reacción” o “reactividad”–, o sea, reacción diferente o extraña. Es un concepto, por tanto, que hace referencia al hecho de que las personas con alergia presentan reacciones diferentes a las personas sin alergia ante la misma sustancia, y se utilizó por primera vez para describir a los pacientes que presentaban reacciones secundarias al efecto de factores externos sobre su sistema inmunitario.
La definición original propuesta por el médico austriaco Clemens von Pirquet (1906), demasiado amplia (incluiría a todas las reacciones inmunitarias), era la de “una capacidad alterada del cuerpo para reaccionar frente a una sustancia extraña, cuyo origen no está en el agente que la produce, sino en el propio individuo”. Se ha definido posteriormente la alergia como una reacción exagerada –e inapropiada– del sistema inmunitario a sustancias que reconoce como externas o extrañas, pero que normalmente son inocuas para la mayoría de personas, llamadas alérgenos, que pueden ser de diversa tipología, desde polen de plantas a determinados fármacos. A grandes rasgos, las personas alérgicas intentan neutralizar específicamente esas sustancias por mecanismos inflamatorios que se vuelven nocivos contra el propio organismo, causando las manifestaciones alérgicas típicas. Pero la sensibilidad a un alérgeno con aparición de determinados síntomas solamente es alérgica si presenta un mecanismo identificable, distinción que es relevante para el establecimiento de diagnóstico y el tratamiento.
La alergia pertenece a las llamadas reacciones de hipersensibilidad, que son respuestas inmunitarias dañinas capaces de producir lesiones en los tejidos y que pueden provocar enfermedades graves. El término hipersensibilidad hace referencia precisamente a la excesiva respuesta frente a antígenos ambientales, habitualmente no patógenos, que causan inflamación tisular y malfuncionamiento orgánico, es decir, el mecanismo de respuesta inmunitaria que conduce a la reacción alérgica, por lo que ambos conceptos están muy relacionados, aunque no son lo mismo. Es preciso recordar que también se producen respuestas de hipersensibilidad frente a antígenos propios, como es el caso de las enfermedades autoinmunes, o frente a antígenos extraños en reacciones de rechazo a injertos por trasplante de órganos, y en la defensa frente a los tumores; no se consideran alergia.
Coombs y Gell (1963) describieron 4 tipos básicos de mecanismos inmunopatogénicos o reacciones de hipersensibilidad, en una clasificación que se sigue aceptando a día de hoy (Tabla 1). Estos mecanismos no suelen actuar de forma independiente para producir daño tisular, sino que es común que varios tipos de lesión estén implicados en un mismo proceso.
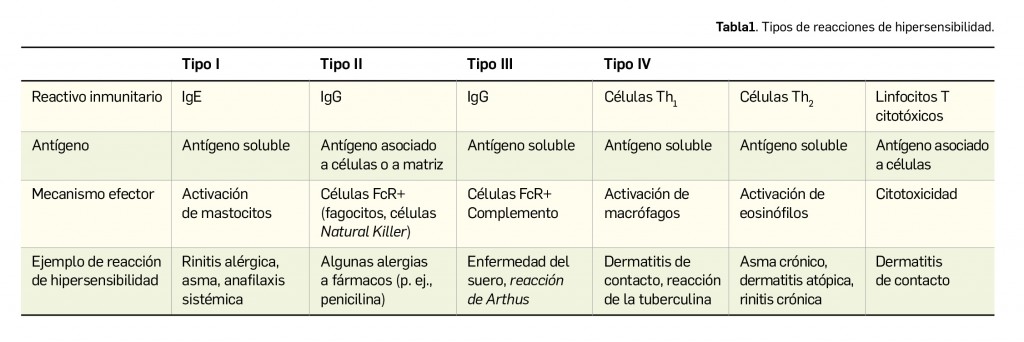
En cada tipo de reacción de hipersensibilidad participan de forma secuencial diferentes tipos de células y mediadores. Los tipos I a III están mediados por anticuerpos y se distinguen por los diferentes tipos de antígenos reconocidos y las diversas clases de anticuerpo que intervienen. Así, las enfermedades asociadas a hipersensibilidad inmediata (reacciones de hipersensibilidad tipo I) se deben a la liberación de mediadores, dependiente de IgE, provenientes de los basófilos sensibilizados y mastocitos que entran en contacto con los antígenos (alérgenos). Por su parte, las de tipo II y III están mediadas por IgG, que se pueden acoplar a mecanismos mediados por el receptor Fc y el complemento en diversos grados, dependiendo del tipo de IgG y de la naturaleza del antígeno implicado. Como se desarrollará a continuación, la mayor parte de las reacciones alérgicas inmediatas son reacciones de tipo I (Zaragozá et al., 2014).
Si se abordan en mayor detalle los distintos tipos de reacciones de hipersensibilidad, se puede empezar diciendo que las reacciones de tipo I generalmente se desencadenan cuando el antígeno une como un puente a dos moléculas de IgE que están, a su vez, sobre los receptores de las células efectoras, basófilos y mastocitos. La agregación de los receptores pone en marcha una cascada de señales intracelulares que conduce a la liberación de los mediadores y al consiguiente desencadenamiento de las manifestaciones características de la reacción alérgica que, según su localización, pueden tener forma clínica de rinitis alérgica, asma bronquial, síntomas digestivos o cutáneos, o anafilaxia generalizada. Se hablará, por tanto, de enfermedades alérgicas.
En las reacciones de tipo II, el antígeno no es soluble como en el caso anterior, sino que está asociado a las células del organismo; estas respuestas se dirigen contra la superficie celular o los antígenos de la matriz y el daño tisular se debe a las respuestas disparadas por los inmunocomplejos. En las reacciones de hipersensibilidad de tipo III se forman en la sangre complejos inmunes solubles, es decir, agregados de anticuerpos IgG e IgM, que son depositados en varios tejidos (piel, riñón y articulaciones), donde desencadenan una respuesta inmunitaria mediada mayoritariamente por la activación de la vía clásica de la cascada del complemento; puede tardar en desarrollarse desde varias horas hasta días. Finalmente, las reacciones de hipersensibilidad de tipo IV están mediadas por células T y pueden subdividirse en 3 grupos: en el primero de ellos, el daño tisular se produce por la activación de los macrófagos por células Th1, resultando en una respuesta inflamatoria; en el segundo, el daño se debe a la activación mediada por las células Th2 de las respuestas proinflamatorias de eosinófilos; y, en el tercer grupo, el daño está causado directamente por las células T citotóxicas (CTL, por sus siglas en inglés).
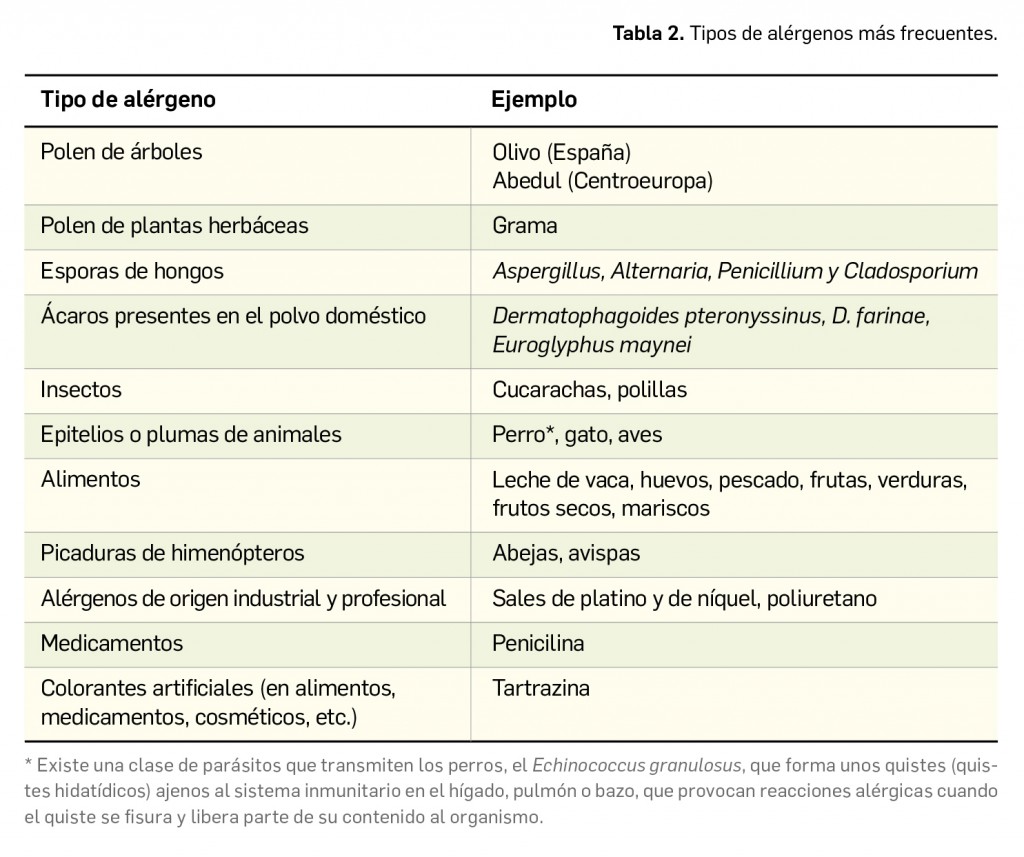
De forma general, la naturaleza y clínica de las reacciones de hipersensibilidad está supeditada a la índole del antígeno o alérgeno que inicia la reacción y al modo en que éste entra en contacto con el organismo. Puede tratarse de alérgenos frente a los que todas las personas están expuestas, por ejemplo, un agente inhalante transportado por el aire o un antígeno alimentario; también puede proceder de animales o del ambiente profesional u ocupacional (Tabla 2). Es decir, el alérgeno no es diferente del resto de los antígenos convencionales capaces de inducir cualquier otro tipo de reacción inmunitaria: a pesar de la exposición generalizada de la población, solo son patógenos para una parte, quienes ponen en marcha mecanismos de hipersensibilidad frente a dichos alérgenos. Se considera que la condición de ser alérgico no está en el alérgeno, sino que tiene un importante componente constitucional, es decir, depende de una predisposición genética individual a reaccionar con la síntesis de anticuerpos IgE tras el contacto repetido con el alérgeno, que frecuentemente es hereditaria.
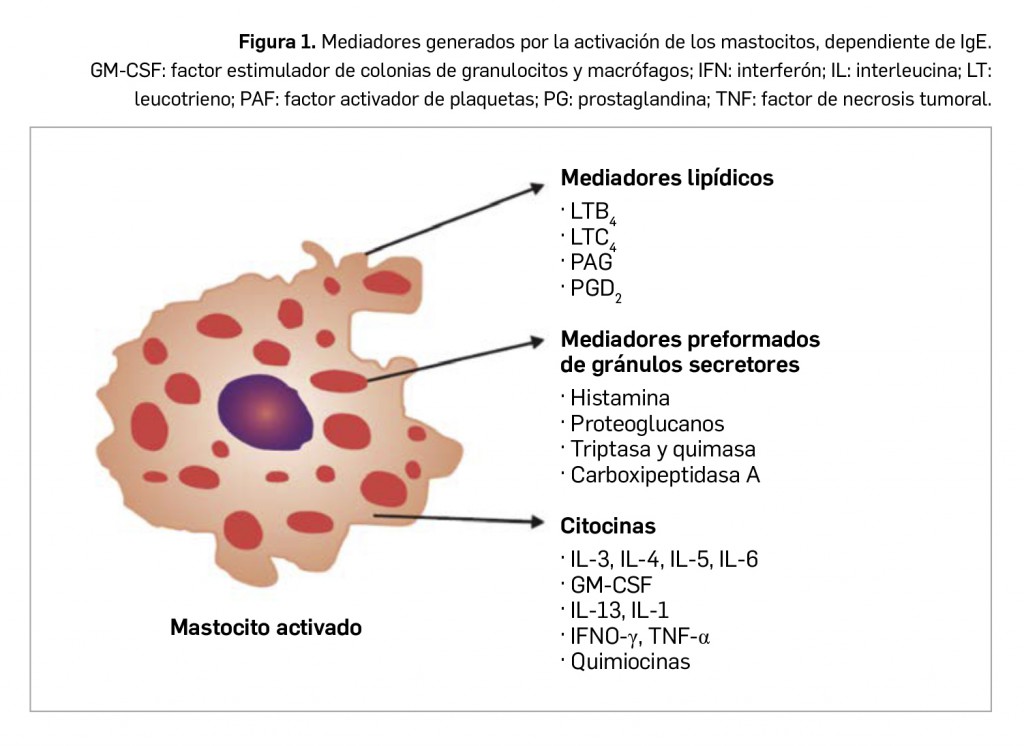
Para definir esa predisposición se emplea el término atopia, propuesto por el Dr. Arthur Fernández-Coca en 19221 y que literalmente significa “inhabitual” o “raro”. Se define como un estado de hipersensibilidad en personas con enfermedades tales como asma, rinitis, conjuntivitis y algunas dermatitis, motivo por el cual los términos alergia y atopia se utilizan indistintamente para designar globalmente estas enfermedades (SEAIC, 2019). Es una tendencia familiar y está restringida genéticamente en diversos grados de la respuesta. Los procesos atópicos están asociados con valores altos de IgE total y específica en el suero de los pacientes, y cursan fundamentalmente con una reacción inmediata al antígeno, seguida en muchas ocasiones por una reacción tardía (tras varias horas), inflamatoria, con infiltración de eosinófilos y linfocitos T; también participan mastocitos y basófilos. Se desarrollará este proceso más adelante.
La alergia se considera a menudo equivalente a la hipersensibilidad de tipo I, o sea, reacciones de hipersensibilidad de tipo inmediato mediadas por IgE. La IgE es producida por las células plasmáticas localizadas en los ganglios linfáticos que drenan al sitio de entrada del antígeno o, localmente (en los sitios de las reacciones alérgicas), por las células plasmáticas derivadas de los centros germinales en desarrollo en el tejido inflamado. La IgE difiere de otros isotipos de anticuerpo en que se localiza de forma predominante en los tejidos, donde se halla unida a los mastocitos por receptores de superficie de alta afinidad, denominados FcR1. La unión del antígeno a la IgE entrecruza estos receptores, lo que provoca la liberación de mediadores químicos proinflamatorios por parte de los mastocitos, que podrían conducir al desarrollo de una reacción alérgica.
Las sustancias desencadenantes, los alérgenos, suelen ser proteínas, a menudo glicoproteínas o lipoproteínas, aunque las características que hacen que una molécula sea alergénica no están muy bien definidas y no todas las proteínas tienen la capacidad de causar alergia; excepcionalmente, algunos hidratos de carbono también pueden generar anticuerpos, funcionar como alérgenos y provocar reacciones alérgicas. Por lo general, deben ser moléculas relativamente grandes para poder provocar alergia (pues, si contienen muchos epítopos, tienen más probabilidades de causar reacciones alérgicas), aunque en ocasiones algunas pequeñas (haptenos) también lo hacen, como es el caso de algunos fármacos.
El tamaño, la solubilidad, la similitud molecular a otros alérgenos y la estabilidad molecular contribuyen también a determinar su potencia alergénica. En especial, los dos primeros, tamaño y solubilidad, son factores cruciales para los alérgenos que acceden al organismo a través de las vías respiratorias2: como norma, deben ser proteínas de 10-60 kDa y solubles en agua, ya que así se facilita su liberación en la mucosa respiratoria. Algunos alérgenos, como los epitelios de perro y gato, son partículas pequeñas; sin embargo, los alérgenos de cucaracha y los ácaros del polvo son partículas de mayor tamaño. En el caso de los alimentos, su capacidad de resistir altas temperaturas y la digestión del jugo gástrico, es decir, su estabilidad, les ayuda a incrementar su potencia alergénica. Si bien a priori cualquier alimento puede provocar una reacción alérgica3, los más frecuentemente involucrados en una reacción de este tipo son el cacahuete y los mariscos. Es importante no olvidar que con los alimentos pueden ingerirse diversos aditivos, conservantes y colorantes, tanto naturales como sintéticos, que pueden también ser los responsables de la reacción alérgica. Es el caso, por ejemplo, de la tartrazina, un colorante azoico artificial ampliamente utilizado en la industria alimentaria, así como en la elaboración de medicamentos (antibióticos) y cosméticos.
Por otra parte, se han producido importantes avances en la investigación de los factores genéticos (Tabla 3) que determinan la aparición de la alergia en entidades como dermatitis atópica, rinitis o asma (la alergia a fármacos o la urticaria se comportan de modo distinto). La primera observación de que las enfermedades alérgicas tienen una agrupación familiar fue comunicada por Cooke y Van der Veer en 1916, al apreciar en un grupo de 504 sujetos alérgicos que prácticamente la mitad de ellos tenía antecedentes familiares de alergia (frente al 14% en un grupo control de 76 sujetos no alérgicos). Los estudios realizados posteriormente en hermanos gemelos han reafirmado el componente genético hereditario, habiéndose descrito una superior concordancia en gemelos monocigóticos (con idéntica carga genética) que en gemelos dicigóticos. No obstante, queda todavía mucho por descubrir, como predecir qué personas desarrollarán alergia y a cuáles habrá que exponer o no y a qué influencias ambientales para evitar que se manifieste la enfermedad.
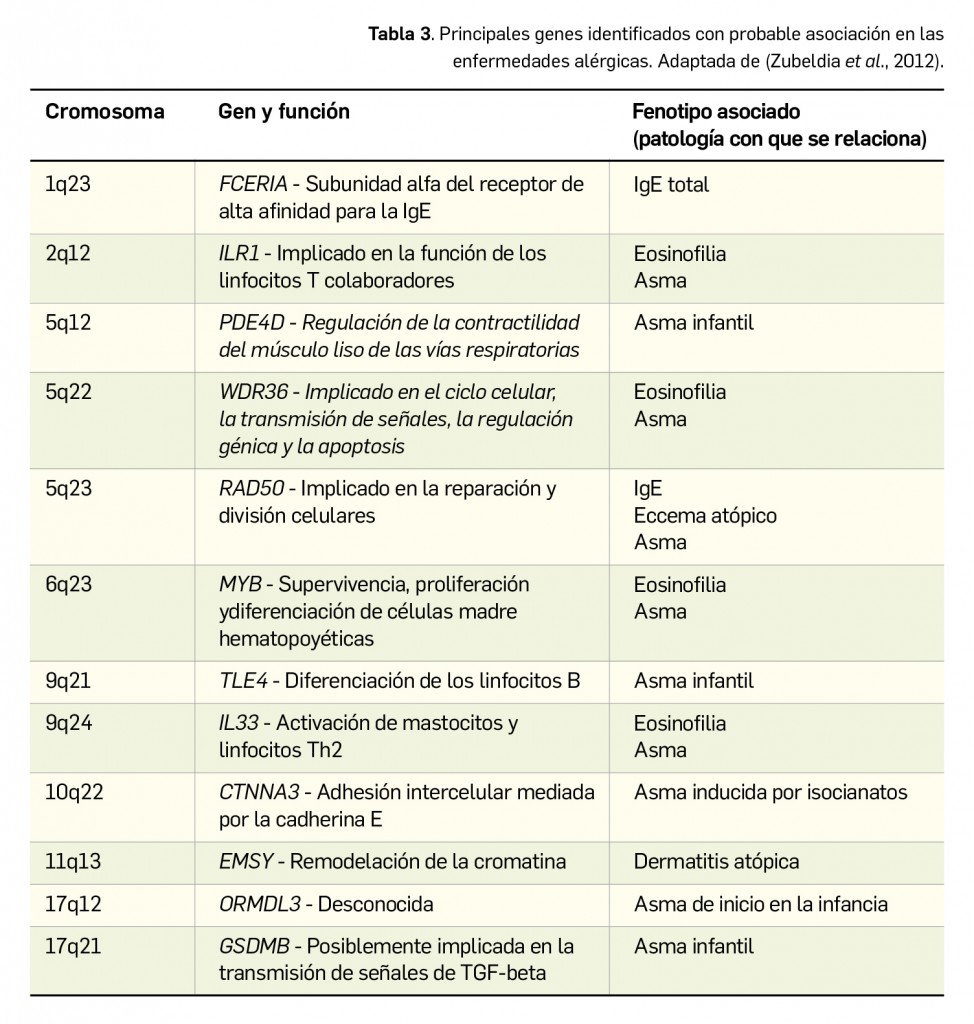
Se acepta que los trastornos alérgicos no se heredan como tal, aunque sí puede heredarse la predisposición a “hacerse alérgico”, esto es, la atopia. Se considera que los hijos de padres alérgicos tienen un mayor riesgo de sufrir una enfermedad alérgica a lo largo de la vida: partiendo de un riesgo del 10-15% en la población general, según la SEIAC, este riesgo asciende al 50% en caso de que uno de los progenitores sea alérgico e incluso hasta el 70% en caso de que lo sean ambos progenitores. En definitiva, el patrón de herencia de las enfermedades alérgicas es el de las patologías genéticas complejas: los factores genéticos y ambientales influyen no solamente en el desarrollo de la sensibilidad mediada por IgE, sino también en el desarrollo ulterior de síntomas clínicos en diferentes localizaciones del organismo (Zubeldia et al., 2012).
Sea como fuere, según se ha sugerido previamente, en el proceso de generación de la alergia se diferencian las siguientes etapas:
Este proceso, aplicable a la práctica totalidad de reacciones alérgicas, ha sido ampliamente descrito, por ejemplo, en el caso del asma alérgico (Figura 2).
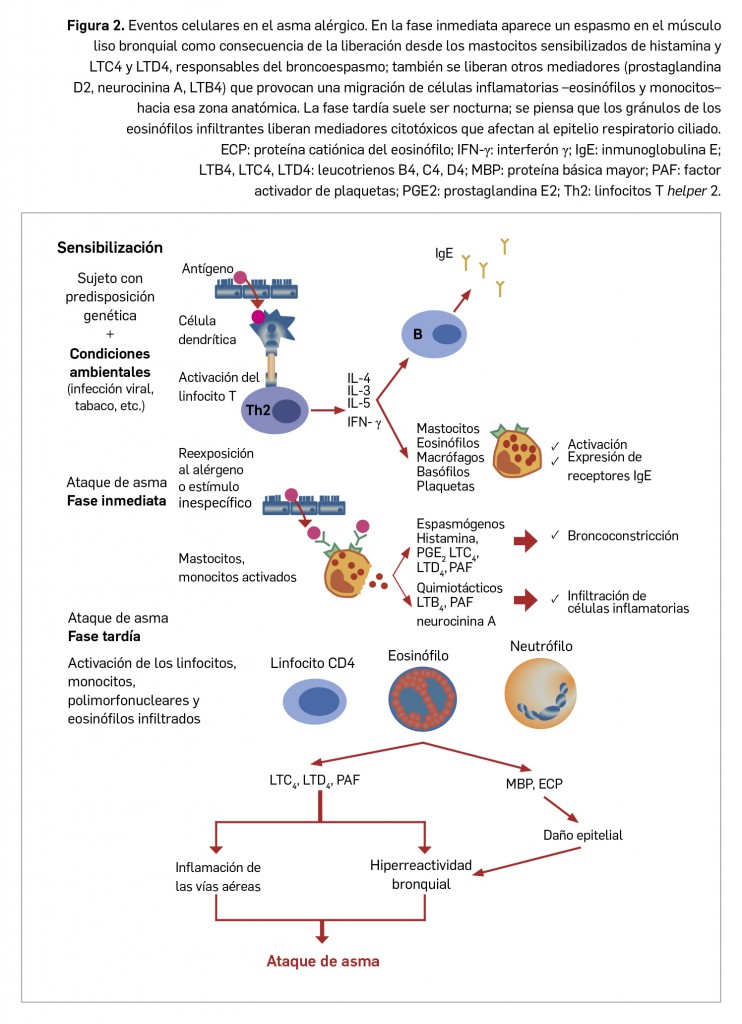
Grosso modo, las enfermedades alérgicas son procesos crónicos que afectan a la calidad de vida de los pacientes, tanto a nivel físico como psíquico, condicionando la actividad diaria. Las manifestaciones de las reacciones alérgicas varían según el sitio de activación de los mastocitos: cuando la reexposición al alérgeno dispara una reacción alérgica, los efectos se centran en el sitio en que se produce su desgranulación. En la respuesta inmediata, los mediadores preformados liberados son de vida breve y sus potentes efectos sobre los vasos sanguíneos y músculos lisos se centran en los lugares próximos a los mastocitos activados. Los efectos más sostenidos de la respuesta de fase tardía se centran también en el punto de activación inicial desencadenada por el alérgeno y la anatomía particular de dicho sitio puede determinar la rapidez con que puede resolverse la inflamación. En resumen, el síndrome clínico producido por una reacción alérgica depende de 3 variables: la cantidad de anticuerpo IgE específico del alérgeno, la vía por la cual es introducido dicho alérgeno y la dosis del mismo.
Así pues, la alergia puede afectar a diferentes partes del cuerpo. Por ejemplo, al aparato digestivo cuando la persona no tolera ciertos alimentos4 –cacahuete, soja, o incluso intolerancia a la leche o el huevo– o determinados fármacos. Otras manifestaciones pueden ser respiratorias cuando las sustancias a las que hay alergia ingresan al organismo por esta vía, como los ácaros o el polen. Frecuentemente, también hay manifestaciones en la piel como urticaria o enrojecimiento, con algunos alérgenos que pueden tener contacto directo (por ejemplo, detergentes, cremas o jabones), pero también con otros que no necesariamente están en contacto con la piel (por ejemplo, fármacos o alimentos). Es decir, las enfermedades alérgicas pueden provocar muchas y diversas manifestaciones, pero no en todas las personas se presentan de igual forma. Destacan sobre el resto las que se exponen a continuación. De no ser debidamente tratadas, pueden dar lugar a mayores complicaciones.
Rinitis alérgica (RA)
Es un estado inflamatorio de la mucosa nasal caracterizado por episodios repetidos de un conjunto variado de síntomas, tales como estornudos, rinorrea y obstrucción de las fosas nasales; puede asociarse a prurito conjuntival y faríngeo, lagrimeo y sinusitis. Es la manifestación alérgica más común en respuesta a alérgenos cuya vía de entrada al organismo es la inhalatoria, junto con la conjuntivitis alérgica (cuyo proceso es similar, pero con alérgenos depositados por vía aérea en la conjuntiva). Presenta una prevalencia en torno al 20-25% de la población en los países industrializados, con un pico en los últimos años de la infancia y la adolescencia (si bien puede debutar a los 3-5 años, e incluso ser causa de problemas de aprendizaje y trastornos del sueño en los niños). Es considerada con frecuencia un problema banal porque no pone en riesgo la vida de los pacientes, pero tiene una relevancia progresivamente creciente e interfiere de forma notable en la calidad de vida de los pacientes (especialmente en aquellos que padecen RA crónica).
Se identifican dos formas clínicas: a) RA estacional (≈75% de los casos), también llamada polinosis o fiebre del heno5, que tiene carácter periódico, coincidiendo sus fases de máxima incidencia con la época de polinización de las especies alergénicas (primavera), especialmente en las horas del día de mayor polinización (5:00-10:00 h y 19:00-22:00 h); y b) la RA perenne, que varía la gravedad de sus síntomas a lo largo del año, si bien la congestión nasal crónica es generalmente intensa y puede extenderse hacia el oído interno, provocar dolores de cabeza y, también, afectar el sueño, la concentración, el apetito y el crecimiento de los niños. Por último, se diferencia la rinitis ocupacional, en que la aparición de los síntomas está relacionada con alérgenos presentes en el lugar de trabajo, procedentes de productos tales como harinas, detergentes, ácaros, látex, maderas, animales de laboratorio, etc.
La RA supone el fracaso de los mecanismos defensivos de la mucosa para eliminar al antígeno. La reacción alérgica se desencadena con la liberación de mediadores químicos que determinan la activación de linfocitos B y maduración de linfocitos T. Así, la liberación de histamina en la mucosa nasal y en la conjuntiva –y su actuación sobre los receptores H1 y H2– da lugar a una vasodilatación de las vénulas poscapilares y edema, que originan los síntomas de obstrucción nasal, estimula los receptores irritativos (provocando prurito y estornudos), y la secreción de las células globulares y las glándulas submucosas. Por otro lado, diversas enzimas (por ejemplo, exoglucosidasas y proteasas neutras) facilitan la rotura de la membrana mucosa. Además, la prostaglandina D2 provoca un engrosamiento vascular de la mucosa, mientras que el leucotrieno C4 incrementa la permeabilidad vascular, provocando la formación de un exudado. La emigración quimiotáctica y la activación subsiguiente de eosinófilos, neutrófilos y basófilos hacia la zona en la que se ha producido la desgranulación mastocitaria provocan una mayor liberación de mediadores inflamatorios, que convierten la situación en un proceso autoperpetuante de hiperreactividad nasal crónica.
La RA tiene como comorbilidades típicas la sinusitis, la poliposis nasal, la conjuntivitis, las infecciones respiratorias de las vías aéreas superiores, etc., y es un factor de riesgo para el asma bronquial. De hecho, asma y RA son procesos que a menudo se solapan: involucran a los mismos tejidos y participan del mismo proceso inflamatorio. Hasta el 80% de las personas asmáticas tiene RA, y los asmáticos que padecen a la vez RA tienen peor evolución, con crisis más graves y mayor necesidad de medicación de rescate. Se ha observado que los pacientes con RA no tratada evolucionan a asma en mayor grado que quienes reciben tratamiento específico para los alérgenos a los que están sensibilizados.
Asma alérgico
Es una enfermedad producida por la inflamación crónica de las vías aéreas (con presencia continua de cantidades crecientes de linfocitos Th2, eosinófilos, neutrófilos y otros leucocitos) que se asocia con cambios estructurales variables, y afecta a niños y adultos de todas las edades. Cursa con una hiperreactividad bronquial y obstrucción al flujo de aire, a menudo reversible espontáneamente o con tratamiento. Se suele desencadenar por la activación –inducida por alérgeno– de los mastocitos submucosos en las vías aéreas bajas, que provoca una rápida broncoconstricción y secreción aumentada de fluido y moco, dificultando la respiración (el aire inhalado queda atrapado el aire en los pulmones. Los alérgenos más comúnmente implicados en su patogénesis son proteínas de los reinos animal y vegetal, procedentes de los ácaros (Derma-tophagoides pteronyssinus y D. farinae) –los más comunes en nuestro medio–, de pólenes (gramíneas), de árboles (Corylus avellana, Olea sp.), de hongos (Alternaria sp., Aspergillus sp.) o de animales (epitelios y fluidos de gato, perro, etc.).
Pero, aunque el asma alérgico constituya inicialmente una respuesta contra un alérgeno específico, la inflamación crónica posterior parece perpetuarse incluso en ausencia de una nueva exposición al mismo: las vías aéreas se vuelven hiperreactivas y otros factores diferentes a la exposición al antígeno pueden desencadenar los ataques de asma. Por ejemplo, las vías respiratorias de pacientes muestran una respuesta exagerada a agentes irritantes químicos ambientales, como el humo de los cigarrillos o el dióxido de sulfuro; las infecciones virales o bacterianas del tracto respiratorio pueden exacerbar la enfermedad al inducir una respuesta local dominada por células Th2. En ese estado de cronificación, puede considerarse como una reacción de hipersensibilidad de tipo IV.
Dermatitis atópica (DA)
En tanto que la expresión cutánea de la atopia, se trata de una de las patologías de la piel más comunes, caracterizada por un historial familiar en el 70% de los pacientes de asma bronquial, rinitis alérgica o dermatitis. La DA puede iniciarse y finalizar a cualquier edad, pudiendo los pacientes desarrollar –de forma continuada o intermitente– lesiones de los diversos estadios (depende de la edad), o bien desaparecer a partir de cualquiera de ellos.
La DA del lactante, la más frecuente, suele empezar hacia los 3-6 meses de vida. Algunos niños desarrollan lesiones de eccema seborreico, que de forma gradual va adquiriendo el aspecto de la dermatitis o eccema atópico, siendo su localización más habitual la cara, aunque también es frecuente en el cuero cabelludo, las orejas, el dorso de las manos y las zonas de extensión de las extremidades. La inflamación epidérmica propia de las dermatitis provoca una serie de lesiones que, progresivamente, según se agrava o se hace crónica, pasan sucesivamente por las fases de eritema, edema, vesiculación, exudación, costra, descamación y liquenificación. El prurito es un síntoma constante en todos los casos y las edades.
Cuando aparece en los lactantes, es relativamente frecuente su desaparición espontánea entre los 3 y los 5 años de edad, pero puede mantenerse como una condición crónica durante la edad adulta hasta para un 40% de pacientes. Por su parte, la DA que debuta en la infancia suele iniciarse hacia los 2 años y finalizar entre los 7 años y la pubertad. En ese caso, las lesiones características se observan sobre todo en las flexuras, en especial en los codos y las rodillas, pero pueden aparecer en otras zonas. A partir de la pubertad (menos común), las lesiones típicas son las placas de liquenificación o liquen simple crónico, consistentes en un engrosamiento de la piel, con aumento de su reticulado normal; son consecuencia del rascado crónico y es muy frecuente que sobre ellas aparezcan excoriaciones. Se producen mayoritariamente en la nuca, el dorso de las manos y los pies, la cara de flexión de las muñecas y las zonas de extensión de las piernas, coexistiendo a menudo con lesiones similares a las del periodo infantil (dermatitis flexural) o a las típicas de los lactantes.
Se estima que en torno al 60% de los pacientes adultos con DA padecen al menos un tipo de comorbilidad atópica, como asma o rinoconjuntivitis alérgica (las tres patologías constituyen la clásica triada de la atopia). También se ha descrito un mayor riesgo de comorbilidades no atópicas, como otros trastornos cutáneos, ciertas enfermedades cardiovasculares, trastornos inmunitarios sistémicos o cáncer. Además, la pérdida de la barrera protectora de la piel y la desregulación del sistema inmunitario aumentan el riesgo de infecciones cutáneas, que pueden ser potencialmente graves.
En su patogenia, determinada normalmente por una producción excesiva de IgE y la disminución de la inmunidad mediada por células, intervienen factores externos como la dieta, la existencia de aero-alérgenos, infecciones por microorganismos (estafilococos u hongos como Malassezia furfur) o incluso otros factores como sequedad ambiental, disminución de la temperatura, tejidos irritantes, etc., que podrían actuar como estímulos desencadenantes o agravantes de un episodio de DA. En las lesiones agudas de DA, no así en las crónicas, se observa un predominio de linfocitos T facilitadores CD4+ de tipo Th2, que son las responsables de la producción aumentada de IL-4 e IL-13 (estimuladoras de la producción de IgE e inductoras de la expresión de moléculas de adhesión involucradas en la migración de células inflamatorias en las zonas de inflamación tisular), IL-5 (responsable de la activación de los eosinófilos) e IL-10 (responsable de la disminución de la inmunidad celular); además, se ha descrito que la IL-4 podría inhibir la producción de IFN-γ y la diferenciación de las células T hacia Th1.
Por la relación existente entre el asma y la atopia, se ha descrito que hasta el 35% de las personas con asma grave sufren DA, y que hasta la mitad de los afectados de DA padecen asma. Ambas patologías se engloban dentro de las llamadas enfermedades mediadas por inflamación tipo 2.
Las respuestas inflamatorias tipo 2 en el asma –predominantes en la mayoría de casos– son iniciadas por citocinas como la IL-25 o IL-33, llamadas alarminas, secretadas a nivel del epitelio tras la exposición a contaminantes, infecciones o alérgenos, y que activan a las células presentadoras de antígenos (dendríticas y NK) para inducir la respuesta inmunitaria adaptativa Th2. Una vez activas, las células Th2 migran hacia el epitelio y la mucosa subepitelial de la vía aérea, donde secretan las citocinas tipo 2, IL-5 e IL-13, que ejercen un papel crucial en patogénesis y el desarrollo de muchas características de la enfermedad. Las alarminas también activan directamente a las células linfoides innatas pulmonares tipo 2 (CLI-2) para que secreten una gran cantidad de IL-5 e IL-13; una vez estimuladas, esas CLI-2 pulmonares también producen pequeñas cantidades de IL-4, aunque no está claro si esto representa una interacción entre los mecanismos inmunitarios innatos y adaptativos. En consecuencia, las citocinas tipo 2 promueven el reclutamiento de células efectoras (mastocitos, basófilos y eosinófilos) y median la producción de IgE por las células B, un aumento de los niveles de óxido nítrico (FeNO) en la fracción exhalada y un incremento de los niveles séricos de periostina. La inflamación eosinofílica en las vías aéreas y la síntesis de IgE son, pues, eventos centrales en el asma alérgico tipo 2 y en la patogénesis de las exacerbaciones (Robinson et al., 2017).
Urticaria y angioedema
La penetración de la piel por una inyección local de pequeñas cantidades de alérgeno en la epidermis y dermis, como el veneno de un insecto tras su picadura, causa por lo general una reacción alérgica localizada. Esta puede expresarse como urticaria, que es una de las dermatosis más frecuentes (prevalencia del 15-20%, mayor en mujeres y tras la adolescencia, con un pico de incidencia entre los 30 y 40 años) y se caracteriza por la aparición brusca de máculas o pápulas edematosas de tamaño variable, posiblemente agrupadas, con bordes serpiginosos elevados y centros pálidos, bien circunscritas, y con halo eritematoso; el síntoma principal es el prurito. La distribución de las lesiones urticantes es casi siempre diseminada, con más frecuencia en áreas cubiertas (tronco, nalgas o pecho), y suele resolverse espontáneamente en el curso de unas horas. Se definen con el nombre de “roncha” o “habón” y se deben a un edema localizado en la parte superficial de la dermis.
No obstante, cuando se afectan las capas profundas de la piel, incluyendo el tejido celular subcutáneo, se produce angioedema, también llamado edema angioneurótico o edema de Quincke, que se manifiesta como áreas de edema localizado, que no dejan fóvea, y sin prurito. Su localización más frecuente es en la cara, párpados, labios, mucosas, genitales y el dorso de manos y pies. El cuadro clínico puede ir acompañado de síntomas prodrómicos inespecíficos que pueden aparecer horas o días antes; durante el brote de urticaria o angioedema puede observarse también la aparición de fiebre, taquicardia, hipotensión, cefalea, náuseas, vértigo u otra sintomatología específica que podría orientar a un diagnóstico etiológico concreto.
La urticaria y el angioedema pueden aparecer juntos o por separado y, a pesar de que obedecen al mismo mecanismo, hasta el momento se desconoce el motivo por el que pueden o no coexistir en un mismo episodio (los factores etiológicos implicados son numerosos y difíciles de precisar, no siendo posible determinar de forma fehaciente la causa responsable en un gran porcentaje de enfermos). En general, se producen como consecuencia de un aumento de la permeabilidad capilar, que permite la extravasación de proteínas y líquidos plasmáticos, y la consiguiente aparición de edema masivo en la dermis (urticaria) y/o el tejido subcutáneo (angioedema), en un proceso mediado por numerosas sustancias químicas, de acción rápida y escaso efecto inflamatorio. La principal causante del eritema, el edema y el prurito de la urticaria es la histamina procedente de los gránulos de los mastocitos y/o basófilos; en la patogenia del eritema también está implicada la serotonina, que se encuentra en las plaquetas y es liberada por el factor activador de plaquetas (producido por el mastocito). Otras sustancias vasoactivas responsables de la vasodilatación son la bradicinina, la acetilcolina, los metabolitos del ácido araquidónico (prostaglandinas, tromboxanos y leucotrienos), y el sistema del complemento, que produce desgranulación de mastocitos y de linfocitos CD4 (en urticaria crónica).
Anafilaxia
Si un alérgeno se introduce directamente en el torrente sanguíneo o se absorbe rápidamente en el intestino pueden activarse los mastocitos del tejido conectivo que están asociados a los vasos sanguíneos. Esta activación provoca un síndrome muy peligroso denominado anafilaxis sistémica, que se trata de una reacción de hipersensibilidad sistémica que pone en peligro la vida y puede aparecer minutos después de la exposición a la sustancia nociva (instauración rápida). Las manifestaciones incluyen: dificultad respiratoria, prurito, urticaria, hinchazón de mucosas, trastornos digestivos (náuseas, vómitos, dolor y diarrea) y colapso vascular. En los casos potencialmente fatales, a este síndrome se le denomina shock anafiláctico.
En principio, casi cualquier alérgeno puede desencadenar una reacción anafiláctica. Así, es posible su desarrollo, por ejemplo, si se administran fármacos (por ejemplo, antibióticos betalactámicos, AINEs, o medios de contraste radiológico) a individuos que poseen IgE específicas frente a ellos, tras la picadura de un insecto en individuos alérgicos a su veneno o tras la ingestión de algunos alimentos6 en individuos susceptibles (los más comunes son huevos, leche, frutos secos, pescado y marisco). El síndrome puede ser letal con gran rapidez, pero suele poder controlarse mediante una inyección inmediata de adrenalina, que relaja el músculo liso e inhibe los efectos cardiovasculares de la anafilaxis.
Las pruebas alérgicas se usan para identificar las sustancias a las que una persona está sensibilizada, y constituyen un método diagnóstico sensible o seguro, que permite guiar al correcto tratamiento, no siendo útiles, en cambio, para predecir si una persona sana o sin antecedentes va a presentar reacciones alérgicas en un futuro. Están indicadas siempre que se sospeche de una patología alérgica, sobre todo si tiene carácter persistente o grave, pero deben realizarse con precaución en personas que pueden ser altamente sensibles. Según la patología y del tipo de reacción –inmediata o tardía– de que se sospeche, se seleccionarán distintos tipos de pruebas alérgicas, debiéndose usar extractos estandarizados con concentraciones de alérgenos conocidas (para evitar resultados falsos).
La más extendida en práctica clínica es indudablemente la llamada prick-test o prueba de punción, que se emplea para investigar la alergia mediada por la IgE (reacción de hipersensibilidad inmediata). Consiste en disponer una gota de extracto del alérgeno a evaluar en la cara anterior del antebrazo, y hacer una ligera punción con una lanceta a través de la gota del extracto y la capa más externa de la piel (epidermis). Así se permite que el extracto penetre y contacte directamente con los mastocitos, responsables de reacciones alérgicas: si el paciente está sensibilizado, estas células reaccionan, liberando mediadores proinflamatorios que provocarán la aparición de una roncha o habón, rodeada de eritema; la respuesta se inicia en pocos minutos y es máxima a los 15-20 min, para ir desapareciendo a lo largo de las horas. Siempre se elegirán aquellos alérgenos que estén en relación con los síntomas que presente el paciente y que se encuentren en su entorno. Por lo general, las pruebas prick son suficientes para detectar la mayoría de las reacciones de hipersensibilidad inmediata, pero es posible que para algunos alérgenos –por ejemplo, fármacos o veneno de himenópteros (abeja y avispa)– o en personas con una sensibilización débil, dichas pruebas sean insuficientes. En tales casos, se recomienda hacer pruebas intradérmicas, que se basan en una inyección directa de extracto en la dermis mediante una aguja extremadamente fina. La lectura es similar a lo comentado para las pruebas prick, siendo más sensibles que ellas, y con la ventaja adicional7 de su utilidad para investigar la hipersensibilidad de tipo tardío (con una nueva lectura a las 24, 48 e incluso 96 h).
También se realizan análisis de sangre o pruebas in vitro para el estudio complementario de las enfermedades alérgicas, a fin de confirmar la existencia de la reacción alérgica y la relación de causalidad con el alérgeno, de cuantificar los mediadores inflamatorios y de evaluar el tipo de anticuerpos; la técnica más frecuentemente utilizada es la determinación de IgE específica o total. Pero conviene subrayar que la positividad en estas pruebas frente a un alérgeno concreto –o a una de sus proteínas o componentes– indica la presencia de sensibilización a dicho alérgeno, es decir, una propensión, pero no obligación, a desarrollar una reacción alérgica. Igualmente, la negatividad de los análisis de sangre o pruebas de laboratorio frente a un alérgeno no excluye la existencia de una sensibilización a dicho alérgeno, por lo que resulta necesario complementar los análisis in vitro con las pruebas in vivo, relacionándolas siempre con los síntomas que presente el paciente.
Finalmente, las pruebas de provocación (administración bajo control médico de dosis progresivamente crecientes) con alimentos o fármacos “sospechosos” son necesarias en algunos pacientes para complementar los datos de la entrevista clínica y las pruebas alérgicas in vivo. Y, en las enfermedades alérgicas respiratorias como la rinitis o el asma, se puede evaluar el grado de afectación mediante técnicas como la espirometría, el nivel de óxido nítrico en aire exhalado y la rinometría acústica, que son seguras e indoloras. En cualquier caso, el papel del médico especialista en Alergología es fundamental para la indicación y evaluación correcta de todas las pruebas.
Si bien en el apartado anterior ya se han citado ciertos datos epidemiológicos de las principales enfermedades alérgicas, hay consenso en torno a la idea de que éstas constituyen una auténtica epidemia no infecciosa en los países desarrollados en el siglo XXI. En líneas generales, se trata de patologías que tienen un impacto muy significativo en la calidad de vida de los pacientes, en relación con el grado de severidad de sus manifestaciones: a mayor gravedad, pueden tener efectos psicológicos, provocar trastornos del sueño e interferir con las relaciones sociales y laborales, suponiendo una carga económica relevante no solo para el afectado, sino también para su familia y para la sociedad en general.
La alergia, en su conjunto de formas clínicas, es la enfermedad crónica más prevalente en Europa, y su incidencia ha ido en aumento durante las últimas décadas, admitiéndose que un 20-30% de la población presenta patología alérgica y un 20% es atópica. Es decir, 1 de cada 4 personas puede desarrollar a lo largo de su vida una enfermedad alérgica. El incremento de la prevalencia de las enfermedades alérgicas en los países industrializados durante las últimas décadas, demostrado mediante estudios epidemiológicos, se achaca fundamentalmente a la creciente influencia de factores externos ambientales. Según advierte la Sociedad Española de Alergología e Inmunología Clínica, las fuentes contaminantes con un mayor impacto son las actividades industriales y el tráfico urbano, capaces de generar diversos tipos de partículas que quedan suspendidas en el aire y pueden generar y amplificar los daños inflamatorios directos e indirectos en los tejidos, interactuando con el epitelio respiratorio y el sistema inmunitario; pueden, incluso interactuar con las partículas de polen, aglutinándolos o fraccionándolos en partículas más pequeñas y de fácil dispersión, aumentando así el riesgo de sensibilización alérgica. Esto, unido al hecho de que en las últimas 3 décadas el cambio climático ha exacerbado las temporadas de polen (al aumentar los niveles de CO2, crece la actividad fisiológica vegetal), con un alargamiento de las mismas y un aumento de las concentraciones, redunda en efectos negativos para la salud respiratoria.
Tomando como ejemplo la rinitis, como la manifestación alérgica más común, se ha estimado que su incidencia se sitúa en torno al 20-25% de la población en los países industrializados, siendo la enfermedad crónica respiratoria más frecuente. La prevalencia de la RA es de aproximadamente un 10-20% en niños en edad escolar y de un 15-30% en adolescentes. Se trata de una enfermedad que, a pesar de no poner en riesgo la vida de los pacientes, en sus formas crónica y grave entorpece la actividad diaria, impide el sueño, dificulta la concentración y disminuyendo la capacidad intelectual y física, lo que da como resultado una pérdida importante de productividad y absentismo laboral y escolar, que contribuyen a altos costes económicos y personales. Además, para valorar el auténtico impacto de la enfermedad, se debe considerar la asociación entre RA y otras patologías como asma alérgico, sinusitis, otitis media, poliposis nasal, infección de vías respiratorias bajas e, incluso, maloclusión dental.
Otro ejemplo ilustrativo de la relevancia epidemiológica de las enfermedades alérgicas es el de la dermatitis atópica. Se ha estimado que un 15-20% de los niños que acuden al dermatólogo en los países desarrollados padecen este tipo de afección, frente a menos del 1% en los países en vías de desarrollo; la prevalencia en adultos a nivel mundial se cree que oscila entre el 1-3%. Estos datos revelan cómo las patologías alérgicas están muy ligadas al nivel económico de los países, hasta el punto de que su prevalencia parece haberse triplicado en el último medio siglo en los países desarrollados. En España, se estima que la DA grave tiene una prevalencia del 0,08% de la población. Puede afectar a las personas de cualquier raza, es más frecuente en el sexo femenino (1,5:1) y se presenta más a menudo en las clases socioeconómicas altas, así como en las grandes ciudades, posiblemente por una mayor exposición a estímulos capaces de desencadenar el cuadro. La probabilidad de padecer la enfermedad es del 80% cuando ambos progenitores la sufrieron, del 55% cuando solo la padeció uno de ellos y del 60% cuando un progenitor presentaba dermatitis y el otro, atopia respiratoria (Montalvo-Calvo et al., 2019).
Por último, se han descrito una serie de factores pronóstico con capacidad de predecir el curso clínico e impacto epidemiológico de la enfermedad alérgica, toda vez que ésta se ha instaurado, de modo que su identificación es de gran interés para la prevención secundaria. Los principales se describen brevemente a continuación (Zaragozá et al., 2014).
—Las enfermedades alérgicas, constituyen una auténtica epidemia no infecciosa en el siglo XXI—
Además de la educación sanitaria del paciente alérgico, como parte fundamental del tratamiento integral, los pilares básicos del abordaje terapéutico de una patología alérgica se alinean con los objetivos clínicos, y pueden resumirse en tres:
Dentro de la farmacoterapia, se puede distinguir entre un tratamiento preventivo, que se ha de tomar a diario, y los tratamientos de rescate, que se utilizan en caso de la aparición de síntomas o crisis de las manifestaciones. Los principales grupos de fármacos usados en la práctica clínica, y sus características, se resumen a continuación. Pero la investigación en alergia e inmunología ha dado lugar a una gran variedad de nuevos enfoques terapéuticos considerados en fase de ensayos clínicos, tales como agonistas de los receptores de tipo toll (TLR, toll like receptors), moduladores de factores de transcripción Syk cinasa, del receptor PPARγ y del factor nuclear kappa B, todos ellos mediadores de las reacciones inmunitarias.
El comienzo de la utilización de este tipo de fármacos se remonta a la primera mitad del siglo XX. Tras el descubrimiento en el año 1910 de la histamina –y su identificación como principal responsable de la mayoría de las reacciones alérgicas y del enrojecimiento e hinchazón de la piel–, en estudios en animales sobre el cornezuelo de centeno desarrollados por el farmacólogo inglés Henry H. Dale en colaboración con sir Patrick P. Laidlaw, en 1933 el químico Ernest Fourneau descubrió en el Instituto Pasteur la existencia de sustancias capaces de antagonizar los efectos nocivos de la histamina en los tejidos del paciente alérgico: eran los primeros antihistamínicos. En 1944, Daniel Bovet y sus colaboradores obtuvieron el maleato de pirilamina, que fue el primer antihistamínico usado en humanos. Posteriormente (1947), los doctores Gay y Carliner, en un hospital de Baltimore (EE.UU.), usaron dimenhidrinato para tratar a una paciente con urticaria; otro antialérgico del que, posterior y azarosamente, se descubrió su potencial terapéutico frente al mareo y al vértigo (Pelta, 2012).
Como grupo, son sin duda los fármacos más empleados en patologías alérgicas, estando disponibles en España a día de hoy una gran diversidad de principios activos y medicamentos diferentes. Los antihistamínicos H1 se utilizan en el tratamiento sintomático de enfermedades alérgicas como rinitis y urticarias agudas o crónicas, y en el control del picor y del rascado de diversas causas, ya que muchos de los efectos de las reacciones alérgicas (picor de ojos, goteo de nariz, picor de piel) están causados por la acción de la histamina. Estos fármacos son capaces de impedir la acción de la histamina liberada durante la fase temprana de la reacción alérgica, permitiendo reducir el típico picor nasal, los estornudos, la rinorrea y la conjuntivitis, pero son poco eficaces en el control de la congestión nasal.
La primera generación de antihistamínicos se comercializó entre los años 1940 y 1960: difenhidramina, hidroxizina, clorfenamina, prometazina (compuesto tricíclico que comenzó a utilizarse como antihelmíntico y que constituyó la transición a los antipsicóticos fenotiazínicos) y triprolidina. Estructuralmente, casi todos conservaban el grupo etilamino (–CH2-CH2-N=) de la cadena lateral de la histamina (Figura 3) y tiene un grupo amino terciario unido por una cadena de 2 o 3 átomos a 2 sustituyentes aromáticos. Muestran una pobre selectividad sobre los receptores H1 y marcados efectos sedantes y anticolinérgicos y, en mayor o menor medida, bloquean también receptores α-adrenérgicos, serotoninérgicos y dopaminérgicos. No en balde, surgieron a partir de la clorpromazina, tras la apertura del anillo central de este derivado tricíclico. Prácticamente han caído en desuso en el tratamiento antialérgico.
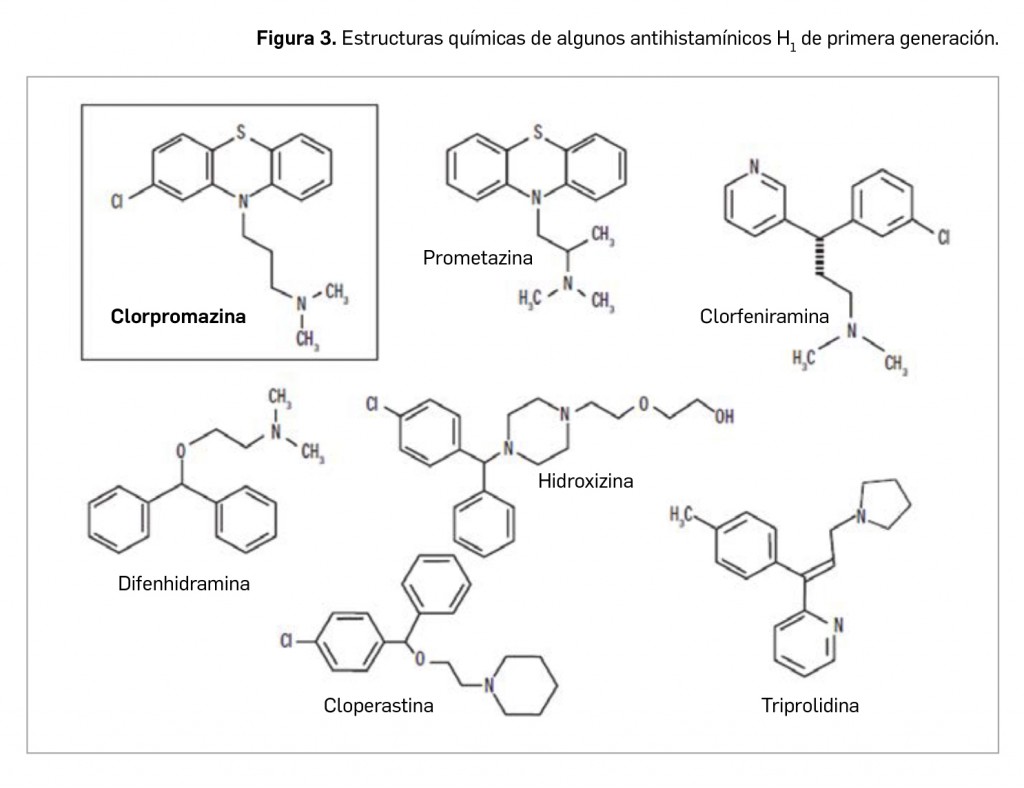
Los fármacos clásicos o de 1ª generación se absorben bien por vía oral, tienen un inicio de acción a los 15-30 min de la administración, alcanzan niveles plasmáticos máximos al cabo de 2-3 h y la duración de los efectos es de 4-6 h; se distribuyen ampliamente en el organismo, ocupando aproximadamente el 75% de los receptores H1 centrales. Estos fármacos contienen anillos aromáticos y sustituyentes alquilo, que los convierten en compuestos con una lipofilia moderada-alta, por lo que pueden atravesar fácilmente la barrera hematoencefálica (BHE) por difusión pasiva y presentan un efecto sedante. En general, sufren metabolización hepática y se eliminan por las heces con mayor rapidez en niños que en adultos, aunque algunos, como clorfenamina, se eliminan principalmente por vía renal.
Con el objetivo de modificar el anillo central de estos heterociclos, la investigación químico-farmacológica dio luz en la década de los 60 a fármacos interesantes, sobre todo en el ámbito del sistema nervioso central (SNC), como ciproheptadina8, un antihistamínico y antiserotoninérgico derivado de la piperidina, o ketotifeno, íntimamente relacionado con la ciproheptadina, que es un anti-H1 capaz de inhibir la desgranulación de los mastocitos, oponiéndose por tanto a la acción de la histamina por un doble mecanismo. Pero fue entre 1975 y 1980, y en adelante, cuando aparece la segunda generación de antihistamínicos H1, con poco o casi nulo efecto sedante y un inicio de acción rápido, inaugurada por terfenadina y astemizol (éste último anulado en 2003 por la aparición de arritmias ventriculares por prolongación del intervalo QT del electrocardiograma); ninguno de los dos está ahora comercializado en España. En general, los fármacos de este grupo son más selectivos, tienen una mayor potencia, mayor duración de acción y menor incidencia de efectos adversos.
A partir de los fármacos hasta aquí citados se fueron obteniendo el resto de antihistamínicos (Figura 4), como consecuencia de diferentes estrategias de obtención y motivado por la caducidad de patentes de la industria farmacéutica. A partir de terfenadina se obtuvo la fexofenadina (que no bloquea los canales de K+ que participan en la repolarización de la fibra cardiaca), la cetirizina,una mezcla racémica de la piperazina, y, a partir de ciproheptadina, se sintetizó la loratadina. Todos ellos representaron un avance en la terapéutica antialérgica por su escasa penetración en el SNC (al contrario que hidroxizina) y la ausencia de efectos cardiotóxicos.
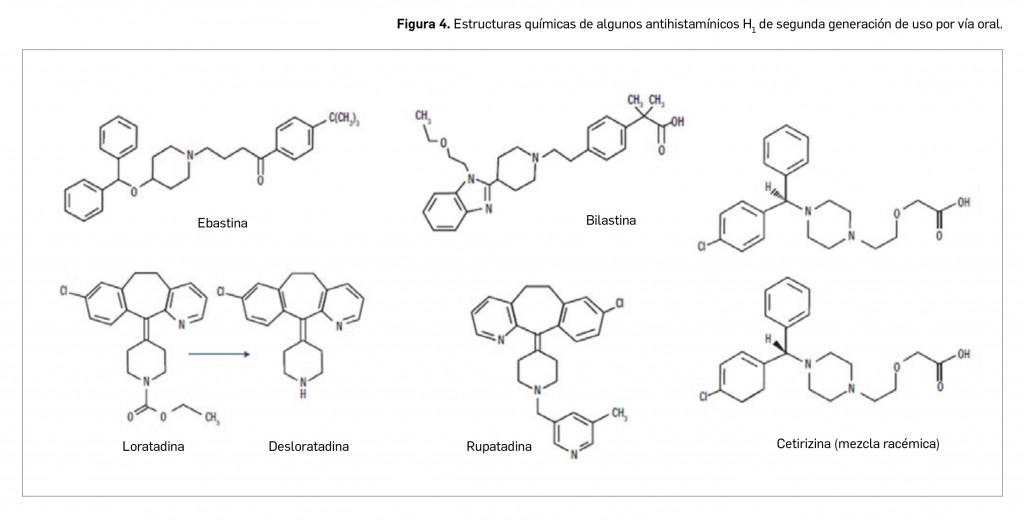
También aparecieron otros fármacos que, en realidad, son metabolitos activos y enantiómeros de algunos de los antihistamínicos de 2ª generación. Por ejemplo, levocetirizina es un metabolito activo (enantiómero R) de la cetirizina, y la desloratadina, un metabolito descarboxi-etoxilado de la loratadina, más potente que ella en el bloqueo de receptores H1 y con la ventaja de un menor riesgo de interacciones farmacológicas al no metabolizarse por la vía del CYP-450; ebastina se desarrolló a partir de terfenadina, siendo estructuralmente similar a dicha molécula, pero sin cardiotoxicidad (por bloquear más débilmente el canal rectificador de K+ en el miocardio). Otros antihistamínicos de 2ª generación con estructuras diversas son: mizolastina, un derivado piperidínico que no se utiliza mucho en la actualidad por el riesgo de prolongación del intervalo QT; rupatadina, el antihistamínico con que se iniciaron los primeros ensayos clínicos en niños menores de 6 años; y bilastina, el último en comercializarse tras casi una década sin nuevas moléculas.
A diferencia de los anteriores, que se emplean por vía oral, aparecieron también dos antihistamínicos de uso local en la mucosa nasal y/u oral, como fueron azelastina y levocabastina, y otros fármacos de uso restringido en forma de colirios para el tratamiento de los síntomas de la conjuntivitis alérgica: emedastina, epinastina, ácido espaglúmico, lodoxamida y olopatadina.
Las diferencias farmacocinéticas entre los dos grandes grupos de antihistamínicos H1 no son demasiado importantes en la práctica. No obstante, los antihistamínicos de 2ª generación son más selectivos por los receptores H1 periféricos y no atraviesan la BHE, ya que se han añadido o suprimido radicales en la estructura molecular para reducir su lipofilia. Esto se traduce en un perfil de efectos adversos diferente y en que producen menos sedación, sin efectos anticolinérgicos adicionales. Casi todos se administran en una sola toma diaria por vía oral y la acción dura unas 12-24 h. Cetirizina, loratadina, terfenadina, rupatadina o bilastina tienen un comienzo de acción rápido (Tmáx de 1 h) y son más útiles en casos agudos; a diferencia de los antihistamínicos orales, los nasales –azelastina y levocabastina– tienen un inicio de acción más rápido (< 15 min).
Con respecto a su mecanismo de acción, todos los fármacos de este grupo son antagonistas competitivos reversibles de los receptores histaminérgicos H1,9 que bloquean las acciones biológicas mediadas por la histamina a través de su unión a dicho receptor; actualmente se sabe que algunos de ellos son realmente agonistas inversos de dichos receptores (cetirizina, loratadina), ya que reducen la activación constitutiva del receptor, estabilizándolo en su conformación inactiva. Al bloquear los receptores H1 periféricos, reducen la permeabilidad vascular, el prurito, la contracción de la musculatura lisa intestinal y la broncoconstricción que provoca la liberación de histamina. Como se ha sugerido previamente, también producen efectos sobre el SNC, predominando la acción sedante e hipnótica, con diferencias importantes según el fármaco de que se trate y la susceptibilidad individual del paciente; este efecto puede ser una reacción adversa, pero también se puede aprovechar para obtener un beneficio terapéutico. Además, existe una cierta relación entre el efecto depresor del SNC y el componente de bloqueo colinérgico que la mayoría de estos fármacos presenta: de hecho, las acciones antieméticas y anticinetósicas de muchos de ellos (fenotiazinas, difenhidramina, dimenhidrinato) se deben en gran parte a sus propiedades sedantes y anticolinérgicas.
Adicionalmente, algunos antihistamínicos H1 presentan propiedades antiinflamatorias que no se explican exclusivamente por su antagonismo sobre receptores H1, habiéndose comprobado que inhiben la migración y la activación de células proinflamatorias, o sea, reducen la quimiotaxis de eosinófilos y monocitos. Algunos estudios con determinados fármacos (por ejemplo, desloratadina) han mostrado que son capaces de inhibir la generación de LTB4 y de anión superóxido, la liberación de factor de necrosis tumoral α (TNF-α) o la expresión de moléculas de adhesión, efectos que podrían tener repercusiones importantes en el control de la respuesta inflamatoria.
En la práctica clínica, todos los antihistamínicos H1 se emplean frecuentemente en el tratamiento de procesos alérgicos: son útiles en el tratamiento de la rinoconjuntivitis alérgica estacional y perenne, la urticaria, la dermatitis atópica y de contacto, picaduras de insectos, reacciones medicamentosas caracterizadas por picor o urticaria y en la enfermedad del suero, en la que responden bien a la urticaria y los edemas, pero no a la fiebre y las artralgias. En las rinitis y conjuntivitis alérgicas de carácter estacional, los anti-H1 alivian la rinorrea, el estornudo y el picor de ojos, nariz y garganta; a diferencia de los antihistamínicos orales, los nasales (azelastina, levocabastina) tienen cierta eficacia para mejorar la congestión nasal. Sin embargo, ningún fármaco del grupo aporta grandes beneficios en asma bronquial (solo ketotifeno se usa para la prevención del asma bronquial y de la bronquitis alérgica, combinado con otros antiasmáticos), cuadros sistémicos de anafilaxis, edema angioneurótico, alergias gastrointestinales y rinitis vasomotoras crónicas. En cualquier caso, su efecto antialérgico es paliativo, solo suprimen los síntomas derivados de la acción de la histamina liberada, pero no actúan sobre la reacción antígeno-anticuerpo, por lo que su efectividad dependerá del grado en que la histamina contribuya a la patogenia y la sintomatología. Es preciso recordar, además, que estos fármacos aparecen habitualmente en asociación con analgésicos y descongestionantes en medicamentos indicados en el tratamiento de la gripe y del resfriado.
Por otra parte, los anti-H1 clásicos también tienen utilidad en procesos no alérgicos:
Para ampliar la información sobre las distintas presentaciones comerciales de medicamentos antihistamínicos que están disponibles en el mercado farmacéutico, así como sus indicaciones autorizadas, se recomienda consultar la base de datos de medicamentos y productos sanitarios BOT PLUS o la página web de la Agencia Española de Medicamentos o Productos Sanitarios (AEMPS): https://cima.aemps.es/cima/publico/home.html.
Amén de su uso en la restauración hormonal en la enfermedad de Addison, el uso clínico de los glucocorticoides se fundamenta en sus propiedades inmunosupresoras y antiinflamatorias, con independencia de la causa que provoca la inflamación (infección, traumatismo, alergia, etc.), usándose en patologías de diversos ámbitos orgánicos, desde enfermedades reumáticas y autoinmunes, a la enfermedad inflamatoria intestinal o al edema cerebral. Su mecanismo de acción es complejo y múltiple: al penetrar en la célula se unen a un receptor citoplasmático y la interacción del complejo resultante con el ADN nuclear induce la activación o supresión de diversos genes, de modo que el inicio de su acción se demora unas horas y el efecto máximo se obtiene tras varios días o semanas de tratamiento. Sin embargo, también ejercen algunos efectos a través de una vía no genómica, de rápido inicio de acción, cuyos detalles no son tan bien conocidos (Toral et al., 2019).
Su principal indicación en patologías alérgicas es el asma bronquial, ya que su efecto antiinflamatorio en las vías respiratorias se manifiesta en la reducción de los síntomas y de la frecuencia y gravedad de las reagudizaciones. En este caso, la aplicación de corticoides (beclometasona, budesónida, fluticasona, ciclesonida, mometasona) por vía inhalatoria ha permitido reducir los efectos secundarios de estos medicamentos y extender su utilización. Cuando se administran a diario en largos periodos de tiempo, se consideran la opción de tratamiento más efectiva para el control del asma persistente, siendo la tendencia actual su introducción precoz en dosis altas, para alcanzar rápidamente el control y, posteriormente, reducir la dosis a la mínima que sea capaz de mantenerlo. Se incluyen en los distintos escalones de tratamiento recomendados en pacientes asmáticos (Fernández-Moriano, 2020).
Por otra parte, su uso por vía intranasal permite controlar las manifestaciones de los procesos alérgicos a ese nivel, siendo de elección en el tratamiento de adultos que padecen rinitis intermitente moderada-grave o rinitis persistente moderada-grave. Resultan eficaces, fundamentalmente, para reducir la congestión nasal, pero también para combatir el prurito nasal, los estornudos y la rinorrea. Sus efectos son lentos, pero más duraderos, e incluso pueden usarse en profilaxis en pacientes con historia de síntomas de RA estacional moderada a grave (en cuyo caso se recomiendan hasta 4 semanas antes del inicio de la estación polínica). En general, se prefiere esa administración tópica y su formulación acuosa por la menor incidencia de efectos secundarios locales con que se asocian. Incluso, esta vía de administración influye indirectamente, por distintos mecanismos, en la mejoría que también se obtiene de la otitis media y de los síntomas oculares que en ocasiones acompañan a la RA. En conjuntivitis alérgica se recurre a la utilización de corticoides –preferentemente en forma de colirio o pomada oftálmica– solo en casos extremos no controlados con los tratamientos habituales.
De igual modo, los corticoides ocupan un lugar importante en el abordaje de enfermedades dermatológicas de origen alérgico. Son de primera elección por vía tópica en el tratamiento de la dermatitis atópica, en un amplio rango de severidad, tanto en fases agudas como en crónicas, ya que reducen el prurito y la inflamación; en algunas reagudizaciones graves puede ser necesaria la administración de corticoides por vía oral. La elección de uno u otro fármaco (hidrocortisona, beclometasona, clobetasol, fluocinolona, metilprednisolona, mometasona, etc.) dependerá de la gravedad y distribución de las lesiones, debiéndose optar por el de menor potencia que sea eficaz. Se suelen emplear mayoritariamente en forma de cremas, pomadas o espumas. Su aplicación tópica también representa la base del tratamiento, junto con la evitación del agente causal, en la dermatitis de contacto, siendo posible recurrir a su administración por vía sistémica en casos graves o muy extensos. En la dermatoconjuntivitis de contacto se prescriben corticoides tópicos para las lesiones dérmicas de los párpados, siguiendo las mismas pautas que en la dermatitis de contacto de otras localizaciones, teniendo en cuenta la zona y procurando que el fármaco no penetre en el ojo.
Sin embargo, en los casos de urticaria aguda o crónica, el tratamiento de primera elección son los antihistamínicos por vía oral, pero se puede recurrir a los corticoides por vía sistémica (dexametasona, budesónida, hidrocortisona, metilprednisolona, fluticasona, etc.) en casos graves o resistentes, debiéndose usar en periodos cortos, con la dosis más baja posible y con una re-ducción progresiva de la misma previamente a su retirada. Igual que ocurría con los antihistamínicos H1, son muy numerosos y diversos –en principios activos, dosis y formas farmacéuticas– los medicamentos comercializados, y se recomienda consultar bases de datos específicas, como BOT PLUS, para ampliar la información.
En resumen, siempre que sea posible se prefiere la vía de administración tópica a la sistémica, utilizando la dosis mínima eficaz y durante el menor tiempo posible, pues se minimizan los riesgos de efectos secundarios de los glucocorticoides. Dentro de la administración sistémica, debe utilizarse siempre que sea posible la vía oral, y reservar la parenteral (intravenosa o intramuscular) para situaciones de emergencia o para la administración de preparados de acción prolongada (intramuscular). Los criterios de selección de un glucocorticoide concreto son, principalmente, la duración de acción y la actividad mi-neralocorticoide, prefiriéndose fármacos de acción corta o intermedia en tratamientos de urgencia o casos agudos; la potencia tiene menor influencia en la decisión, pues las dosis de los distintos fármacos se ajustan para compensar las diferencias de actividad.
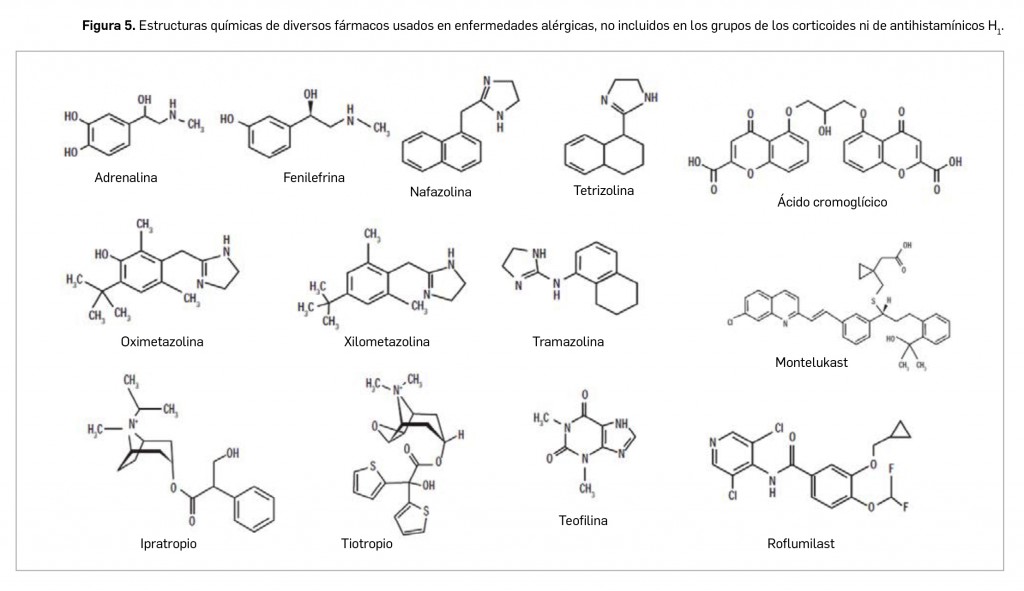
La adrenalina (Figura 5) es un potente simpaticomimético natural que tiene efectos adrenérgicos al estimular directamente los receptores α1, α2, β1 y β2, lo que produce vasoconstricción (incremento de la presión arterial) y broncodilatación. Es fundamental en el tratamiento de la anafilaxia, con alta eficacia también de las crisis agudas de asma en que está dificultada la inhalación de broncodilatadores. Tiene un rápido inicio de acción y combate el bajo gasto cardiaco y la hipotensión, y reduce eficazmente el angioedema y el edema de glotis, que es la complicación más grave de la alergia, ya que si no se trata a tiempo puede provocar asfixia por obstrucción mecánica de la vía aérea. Puede administrarse por vía subcutánea, intramuscular e intravenosa, de forma general a la dosis recomendada de 0,01 mg por kg de peso (0,01 ml de la solución 1/1.000 habitualmente comercializada) y existen dispositivos de autoadministración (jeringa o pluma precargada con dosis fija, variable según edad) para que el paciente pueda llevarlo consigo y usarlo, en caso necesario, fuera del ámbito sanitario (Altellus®, Anapen®, Emerade® y Jext®).
Los descongestivos nasales también tienen un amplio potencial de uso en pacientes alérgicos, por su efecto sobre la resistencia al flujo aéreo a través de la nariz, común en pacientes alérgicos con rinitis, y causa de la congestión o taponamiento nasal (frente a la cual también pueden usarse otros fármacos que actúan sobre la inflamación, como antihistamínicos o corticoides nasales). Habida cuenta de que el estado de los sinusoides nasales está regulado por receptores α-adrenérgicos, los fármacos descongestivos suelen ser agonistas adrenérgicos que actúan provocando una vasoconstricción local, lo que conduce a una redistribución del flujo sanguíneo en la mucosa nasal; esto se traduce en una reducción del edema y, por consiguiente, de la congestión nasal. Los descongestivos son también útiles para aliviar la conjuntivitis alérgica, al disminuir la vasodilatación de los vasos conjuntivales.
La forma de administración más común es la intranasal mediante aerosoles o gotas nasales, o por vía oftálmica en forma de colirios o gotas, por lo que su acción es local y rápida. La fenilefrina es un agonista α1-adrenérgico selectivo que fue obtenido a imagen y semejanza de la adrenalina y la noradrenalina, suprimiendo un grupo hidroxilo del anillo catecol. Posteriormente, surgieron los demás descongestivos imidazólicos, derivados a partir de la clonidina, que son agonistas α2 postsinápticos: nafazolina, oximetazolina, tramazolina, tetrizolina y xilometazolina. Todos ellos pueden utilizarse en la rinitis alérgica leve que no responde a otras medidas o, en casos moderados/graves, combinados con corticoides tópicos nasales. La asociación de estos vasoconstrictores con antihistamínicos ha demostrado mayor eficacia que el antihistamínico solo, pero hay que tener en cuenta que también aumentan los efectos adversos. En cualquier caso, se deben emplear por periodos cortos de tiempo para aliviar la congestión y permitir la acción de otros fármacos administrados por vía nasal. En pacientes pediátricos hay que tener una especial precaución por el riesgo de eventos adversos graves, estando contraindicado su uso en menores de 2 años (y escasamente recomendado en menores de 6).
Menos común en el tratamiento de la rinitis es el uso de fármacos descongestivos por vía oral. Por esta vía se dispone de pseudoefedrina, fenilefrina y fenilpropanolamina, que suelen asociase en un mismo medicamento con un antihistamínico H1. Son eficaces y no provocan efecto de rebote, pero tienen mayor riesgo de interacciones farmacológicas, efectos sistémicos (por ejemplo, taquicardia, agitación, insomnio y alucinaciones) y de tolerancia, especialmente en niños, no debiéndose usar durante más de 7-10 días.
Dentro del grupo de las cromonas, pasada la mitad del siglo XX se investigó clínicamente el cromoglicato sódico (ácido cromoglícico), un derivado del ácido cromon-2-carboxílico obtenido a partir de la kelina (una furanocromona presente en los frutos de la planta apiácea Ammi visnaga que demostró poseer propiedades broncodilatadoras), que fue posteriormente introducido en la terapéutica de la alergia. Más adelante se desarrolló y comercializó el nedocromilo sódico, el único actualmente disponible por vía inhalatoria en la profilaxis del asma. Existen preparados oftálmicos de ácido cromoglícico, espaglúmico y nedocromilo, indicados sobre todo en la conjuntivitis de origen alérgico. Estos fármacos actúan mediante la inhibición de la degranulación de los mastocitos y la liberación de mediadores de la inflamación, sin poseer actividad broncodilatadora intrínseca o actuar sobre receptores histaminérgicos, muscarínicos o serotoninérgicos. Su eficacia es menor que la de los corticoides inhalados (lo que les ha hecho caer en desuso en práctica clínica), pero están desprovistos casi por completo de efectos secundarios. Su principal inconveniente es el escaso cumplimiento, relacionado con su pauta posológica de varias administraciones al día por vía inhalatoria, junto con una eficacia limitada y condicionada por el tratamiento continuado.
Por otra parte, se dispone de fármacos anticolinérgicos que actúan a través del bloqueo de los receptores muscarínicos. Se incluyen en ese grupo dos fármacos: ipratropio y tiotropio. Ambos son compuestos de amonio cuaternario que se obtuvieron por procesos de semisíntesis a partir de noratropina (extraída de Datura metel), y que se administran en niños de > 6 años por vía inhalatoria10 mediante nebulización o en aerosol. Tienen gran selectividad por el receptor M3 del músculo liso bronquial, produciendo broncodilatación sin apenas presentar efectos sobre las secreciones bronquiales, aunque las disminuye ligeramente. Su eficacia en el asma (su empleo se recomienda solo en crisis moderadas o graves), donde suelen utilizarse asociados a β-miméticos, es moderada comparación con la que presentan en EPOC, ya que previenen los espasmos bron-quiales que se producen en esta última.
Los antileucotrienos o antagonistas selectivos de leucotrienos11 constituyen otra familia de fármacos que han demostrado su eficacia en el asma (bloquean los efectos asmógenos de los leucotrienos) y, en menor medida, en la rinitis alérgica; su utilidad en otras enfermedades alérgicas no está bien establecida. Son fármacos obtenidos mediante diseño molecular, entre los cuales a fecha de hoy solo está autorizado montelukast, indicado para el tratamiento de la RA estacional en pacientes asmáticos (en cualquier escalón terapéutico, en monoterapia o en asociación a otros fármacos) a partir de 2 años de edad. Con una estructura de amina heterocíclica indólica, es un antagonista reversible, competitivo y selectivo del receptor bronquial de cisteinil-leucotrienos LTD4 (CysLT1), que presenta una buena absorción oral, obteniéndose la Cmáx a las 3 h de su administración. Tiene la capacidad de inhibir la broncoconstricción inducida por leucotrienos, esfuerzo o alérgenos –incluido virus–, pudiendo mejorar el control de los síntomas y reducir el número de exacerbaciones asmáticas (con menor eficacia que los corticoides inhalados); además, parece reducir la producción mucosa y la permeabilidad vascular. Tanto en niños como en adultos se aconseja su administración por vía oral en dosis única diaria, preferentemente por la noche (una pauta favorable para su cumplimiento), siendo un fármaco bien tolerado del que no se ha descrito ninguna reacción adversa grave.
La teofilina es una metilxantina que actúa como un inhibidor no selectivo de las fosfodiesterasas (PDE), aunque su mecanismo de acción no ha sido completamente esclarecido. Fue uno de los fármacos más utilizados en el tratamiento del asma bronquial, especialmente en niños, pues relaja la musculatura bronquial, inhibe la inflamación y estimula la respiración. Pero, en la actualidad, su uso ha pasado a un segundo plano, en parte por su potencia broncodilatadora inferior a la de los agonistas β2 inhalados, su estrecho margen terapéutico asociado a efectos secundarios importantes, y a las amplias variaciones interindividuales en su metabolismo. Disponible en preparados comerciales para administración intravenosa y oral (jarabe, comprimidos o cápsulas), se emplea hoy en día como adyuvante en el tratamiento de la crisis asmática grave o en el tratamiento de fondo.
No obstante, ha aparecido un renovado interés en la farmacología y los efectos clínicos de las metilxantinas, basado fundamentalmente en el creciente conocimiento de las distintas isoenzimas de la PDE y el desarrollo de inhibidores selectivos de las mismas. En este sentido, la isoenzima más abundante en el músculo liso de las vías aéreas y células inflamatorias (neutrófilos, eosinófilos, basófilos y mastocitos) es la PDE-4, metabolizadora del adenosín monofosfato cíclico (AMPc). La pasada década se aprobó en la UE roflumilast, un inhibidor selectivo de la PDE-4 con estructura química derivada de benzamida, que no afecta a la actividad de otras isoenzimas, incluso a concentraciones elevadas. Su efecto farmacológico se traduce en una elevación de los niveles intracelulares de AMPc, reduciendo la contracción del músculo liso y la activación de células inflamatorias. Está autorizado para el tratamiento de mantenimiento de la EPOC crónica grave asociada a bronquitis adultos con historial de exacerbaciones frecuentes y como terapia adicional a un tratamiento broncodilatador.
Por último, y aunque su uso en enfermedades alérgicas es quizá menos relevante, merecen una mención aquí dos fármacos inmunomoduladores, tacrolimus y pimecrolimus, los cuales, por uso tópico (tienen escasa biodisponibilidad sistémica) han mostrado eficacia en el tratamiento de la dermatitis atópica moderada-grave: se usan en casos refractarios, en segunda línea, tras los corticoides tópicos. Ejercen su acción a través de la inhibición de la enzima calcineurina, de forma que inhiben la activación de los linfocitos T y la expresión de citocinas proinflamatorias. Con un perfil de seguridad en principio más benigno que los corticoides tópicos, persiste la incertidumbre de sus efectos a largo plazo, especialmente por su potencial carcinogénico, no confirmado aún.
Como complemento de lo anteriormente indicado, es preciso subrayar que en los últimos años se han incorporado al arsenal terapéutico antialérgico algunos fármacos biológicos obtenidos mediante tecnología de ADN recombinante y dirigidos a la inhibición de las citocinas Th2, con potencial efectividad en diversas patologías, si bien hasta ahora solo se han autorizado como tratamiento del asma, la dermatitis atópica, la urticaria y la rinosinusitis, especialmente cuando son graves y refractarias al tratamiento habitual de primera línea. Se recogen a continuación los fármacos autorizados en la UE, pero hay otros similares que han estado o están en distintas fases de la investigación preclínica y clínica, también dirigidos frente a interleucinas (IL-4, -5 y -13) o frente a las células CD4 implicadas en la inflamación alérgica (por ejemplo, ligelizumab, lebrikizumab o tralokinumab).
El primero en autorizarse fue omalizumab (Xolair®), por lo que es también el mejor estudiado. Se trata de un anticuerpo monoclonal IgG1 humanizado12 dirigido específicamente contra la IgE para inhibir la respuesta del sistema inmunitario a la exposición de alérgenos, bloqueando dichos anticuerpos y evitando su unión a receptores específicos de alta afinidad (FcεRI). Por tanto, el fármaco disminuye la cantidad de IgE circulante libre e impide la desgranulación de basófilos y mastocitos mediada por ésta y la consiguiente liberación de mediadores inflamatorios y broncoconstrictores: reduce la reacción de hipersensibilidad inmediata. Omalizumab está indicado actualmente en el tratamiento, por vía subcutánea tanto en niños de > 6 años como en adultos, del asma alérgico moderada-grave que no esté bien controlada con tratamientos convencionales, debiendo ser considerado únicamente cuando se demuestra de forma convincente que el asma está mediada por IgE. En muchas ocasiones, el uso de omalizumab no solo consigue la mejoría clínica del paciente y de su calidad de vida, sino que logra la reducción del uso de otros medicamentos (principalmente, de corticoides inhalados). También se ha mostrado útil y se indica para tratar la urticaria crónica y la rinosinusitis crónica con pólipos nasales, estando en investigación en otras patologías alérgicas. Se trata de un fármaco, en general, bien tolerado por la mayoría de los pacientes; aun así, se han descrito diversas reacciones adversas, tales como reacciones locales en el punto de inyección, exantemas cutáneos y, aunque infrecuentes, también reacciones anafilácticas (obligan a tomar precauciones referentes al tiempo de observación tras la inyección y a la educación para el reconocimiento y tratamiento de sus manifestaciones).
Otros biológicos persiguen el bloqueo de la producción o actividad de citocinas proinfla-matorias, concretamente de la IL-5, que juega un papel relevante en la inflamación de tipo 2 a través de la promoción del crecimiento, diferenciación y liberación de eosinófilos desde la médula ósea. Así, mepolizumab (Nucala®) y reslizumab (Cinqaero®) son dos inmunoglobulinas –IgG1 e IgG4, respectivamente– que se unen con alta afinidad y especificidad a la propia IL-5, mientras que benralizumab (Fasenra®) es una IgG1 que se une a la subunidad alfa del receptor de la IL-5 en basófilos y eosinófilos, bloqueando también las acciones biológicas de ésta. Por vía subcutánea (excepto reslizumab, que es de administración intravenosa), están autorizados como tratamiento adicional en pacientes adultos con asma grave eosinofílica no controlada adecuadamente con otros fármacos.
Finalmente, dupilumab (Dupixent®) ha sido el último biológico aprobado para su uso en patologías alérgicas, comercializado por primera vez en España en 2020. Se trata de un novedoso anticuerpo monoclonal anti-receptor α de la IL-4, que inhibe la señalización bioquímica tanto de IL-4 como de IL-13, los principales mediadores de la inflamación tipo 2. Inaugurando una vía farmacológica en sus indicaciones, está autorizado para su uso por vía subcutánea en pacientes adultos y niños de > 6 años con dermatitis atópica moderada-grave que precisan tratamientos sistémicos; para el tratamiento de mantenimiento adicional para el asma grave con inflamación de tipo 2 (elevación de eosinófilos en sangre y/o de FeNO en aire exhalado) en adultos y adolescentes que no están adecuadamente controlados con corticosteroides inhalados en dosis altas en combinación con otro medicamento; y para tratar adultos con rinosinusitis crónica con poliposis nasal grave y no controlada, adicionalmente a corticosteroides intranasales. La más relevante es quizás su indicación en dermatitis atópica, pues supone el primer avance terapéutico desde hace mucho tiempo (primer tratamiento biológico autorizado) y será una alternativa adecuada en pacientes sin respuesta o no candidatos a tratamiento con ciclosporina.
Dupilumab demostró en ensayos clínicos superioridad frente a placebo en el tratamiento de la DA tanto en pacientes que inician tratamiento sistémico tras fracaso del tratamiento tópico como en pacientes pre-tratados con ciclosporina: en monoterapia, el fármaco induce aumentos significativos en la proporción de pacientes respondedores con aclaramiento de la piel en comparación con placebo (+27-28% según escala IGA y +37-44% que alcanzan EASI-50), que también se verifican en combinación con un corticoide o inhibidor de calcineurina tópicos (+24-28% en IGA y +40-48% con EASI-50); un estudio en pacientes adolescentes confirmó resultados similares. En el tratamiento adicional del asma no controlada, evidenció una eficacia notable en pacientes con biomarcadores inflamatorios de tipo 2 elevados. Así, en presencia de altos niveles de eosinófilos en sangre y de FeNO en aire exhalado, reduce el riesgo de exacerbaciones en un 66-67% y mejora la funcionalidad pulmonar (duplicando el valor de VEF1 pre-broncodilatador) en comparación con placebo. Además, un estudio específico reveló que dupilumab permite reducir/suprimir la dosis de corticoides orales –y, con ello, su toxicidad– en un 70% de pacientes (vs. 42% con placebo). En ambas patologías, el efecto es de inicio rápido (2 semanas) y duradero, por periodos de más de 1 año, aportando beneficio en síntomas y calidad de vida reportados por los pacientes.
En términos de seguridad, dupilumab muestra una buena tolerabilidad a corto-medio plazo, con un perfil toxicológico aceptable y manejable, alineado con el de otras proteínas terapéuticas. Entre las reacciones adversas más frecuentes destacan las reacciones en el lugar de la inyección (eritema, edema y prurito) e infecciones (conjuntivitis, blefaritis, nasofaringitis, infecciones respiratorias del tracto superior, sinusitis y herpes oral), en su mayoría leves-moderadas. El riesgo de desarrollo de reacciones alérgicas e inmunogenicidad parece bajo, si bien se requieren aún datos de seguridad a largo plazo que permitan esclarecer los potenciales riesgos de desarrollo de neoplasias malignas.
Además de los fármacos citados en el apartado anterior, hay otros muchos principios activos pueden ser utilizados ocasionalmente en relación con las reacciones alérgicas. Entre ellos destacan los macrólidos (por su efecto antiinflamatorio y antibacteriano) y otros antibióticos. Los probióticos también han sido objeto de múltiples estudios como agentes preventivos y en el tratamiento de diversas patologías alérgicas, fundamentalmente en la prevención del eccema atópico, pero los resultados son contradictorios y no puede recomendarse su uso de modo rutinario.
Las principales guías de práctica clínica recogen que el tratamiento básico de la rinitis alérgica –sin cambios sustanciales en los últimos años– lo constituyen los antihistamínicos orales, que pueden resultar suficientes en la mayoría de los casos (Tabla 4). La elección del fármaco y la dosis debe ajustarse a cada paciente, pero hay que recordar que la eficacia antialérgica de todos los antihistamínicos H1 es similar y que la selección de uno de ellos se suele realizar en función de su perfil de seguridad y su posología. La regla general de selección es utilizar en primer lugar un fármaco de segunda generación, cambiando a otro antihistamínico (de un grupo químico diferente) si el primero resulta excesivamente molesto para el paciente. Las diferencias fundamentales entre los fármacos de ese subgrupo son de tipo farmacocinético, no demasiado importantes en la práctica: casi todos se administran en una sola toma diaria por vía oral, y la acción dura entre 12 y 24 h; cetirizina, loratadina, terfenadina o rupatadina tienen un inicio de acción rápido (Tmáx 1 h) y son más útiles en casos agudos que ebastina o azelastina (Tmáx 3 h). Es preciso recordar que los antihistamínicos no influyen en la reacción antígeno-anticuerpo, sino que únicamente bloquean la respuesta fisiológica a la histamina liberada, la acción terapéutica es meramente paliativa y limitada a la influencia de dicho mediador en la respuesta alérgica.
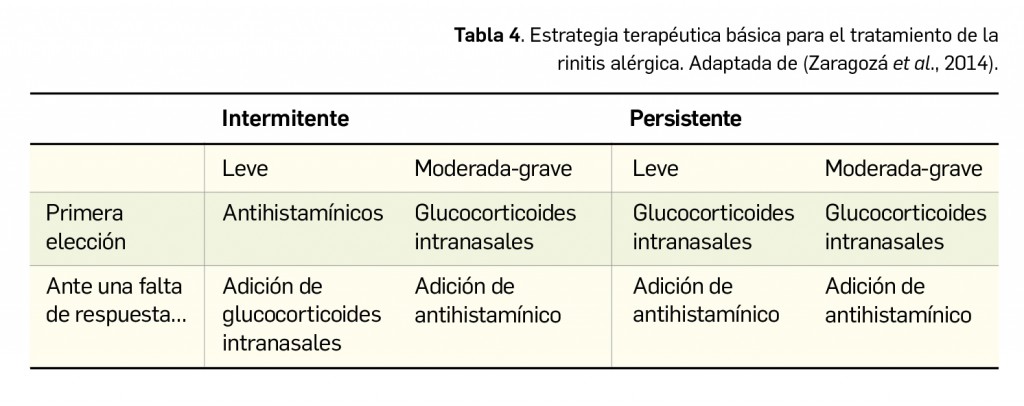
En la terapéutica de la rinitis, los anti-H1 de primera generación y de acción sedante son menos usados. En tal caso, se administran preferiblemente por la noche, evitando la ingestión concomitante de alcohol, ya que pueden potenciar el efecto depresor sobre el SNC. Los glucocorticoides se reservan para los casos graves o cuando los antihistamínicos no son suficien-tes para el control de los síntomas. Se suelen usar corticoides de acción intermedia, en pauta descendente y preferiblemente en dosis única matinal; son efectivos a la hora de controlar los síntomas, tanto si se administran previamente a la exposición al alérgeno (lo cual es preferible en RA estacionales) como si se administran con posterioridad a la presentación de los síntomas nasales. En cambio, el uso regular de descongestivos tópicos durante más de 2 o 3 días puede llevar a la pérdida de efectividad y producir síntomas de congestión de rebote, siendo preferible optar por descongestivos orales en tratamientos prolongados.
En los niños que sufran esta patología alérgica se recomienda el uso de soluciones salinas estériles para el lavado de las fosas nasales, que también es aconsejable en mujeres embarazadas y madres lactantes; estas no deben utilizar los descongestivos, pero sí pueden usar fármacos con estructura de cromonas. En pacientes con hipertensión, diabetes, hipertiroidismo, angina de pecho o glaucoma se debe recomendar únicamente el uso de soluciones salinas.
En relación con la conjuntivitis alérgica, si se presenta en forma leve, los antihistamínicos orales pueden ser suficientes, empleándose, si las molestias persisten, colirios antihistamínicos. Las presentaciones en monodosis tienen la ventaja de evitar la irritación ocular provocada por los conservantes. Además, no presentan el problema de caducidad de los envases de colirio, que una vez iniciados deben desecharse a las 4 semanas, como norma general.
En urticaria y angioedema son de utilidad los antihistamínicos H1 clásicos (clorfenamina, difenhidramina, hidroxizina) o los de segunda generación (loratadina, ebastina, fexofenadina, cetirizina). Los antihistamínicos H2, normalmente usados en patología gastro-duodenal –por ejemplo, ranitidina–, pueden conferir ventajas en caso de alergias con síntomas gastrointestinales. Los antagonistas del receptor de leucotrienos (montelukast) emergen como tratamiento complementario. En caso de urticaria con componente psíquico pueden ser de utilidad los antidepresivos tricíclicos, mientras que ketotifeno se emplea fundamentalmente en urticaria crónica de origen alimentario, por sustancias inhaladas y por frío, aunque su efecto es limitado por su baja absorción intestinal. En casos de obstrucción de la vía aérea con edema faríngeo o laríngeo, y en caso de reacción anafiláctica, se debe administrar adrenalina subcutánea, además de valorar otras de las medidas anteriores.
En dermatitis atópica es fundamental evitar sustancias irritantes, procurar la hidratación cutánea, administrar glucocorticoides tópicos y tratar las lesiones cutáneas infectadas (a menudo con Staphylococcus aureus). Los glucocorticoides sistémicos solo deben emplearse en caso de exacerbaciones graves que no responden al tratamiento tópico conservador, pudiendo recurrir al inmunosupresor ciclosporina o al anticuerpo dupilumab en casos refractarios.
Con respecto al tratamiento del asma alérgico, los glucocorticoides inhalados son los medicamentos más efectivos. A la hora de optar por un tratamiento biológico, es importante tener en cuenta que actúan sobre vías patogénicas específicas y tienen elevado coste económico, por lo que es fundamental determinar el perfil individual de alteraciones fi-siopatológicas predominante en cada paciente antes de indicarlo.
A pesar de todo lo anteriormente comentado, la única terapia que puede modificar el curso natural de los procesos alérgicos, evitando la evolución de la rinitis a asma bronquial o la aparición de las reacciones alérgicas generalizadas y/o sistémicas mediadas por IgE, es la administración de alérgenos desensibilizantes. Es decir, representa el único tratamiento profiláctico y curativo de ciertas alergias, que trata la causa y permite evitar el agravamiento de los síntomas.
Así, un tratamiento durante 3-5 años consistente en la administración, a dosis progresivamente crecientes y en intervalos regulares de tiempo, de un extracto del alérgeno –o mezcla de alérgenos– responsable de la enfermedad (identificado tras un diagnóstico adecuado) consigue por lo general inducir la tolerancia necesaria a los alérgenos implicados para controlar la respuesta inflamatoria alérgica: disminuye el nivel de sensibilización y consigue suprimir –al menos parcialmente– los síntomas que ésta causa. Además, evita que la persona afectada aumente su capacidad de respuesta alérgica, sensibilizándose a nuevos alérgenos o progresando a asma bronquial y otras complicaciones.
Por este motivo, el tratamiento debe comenzarse cuanto antes y sus resultados son más positivos en niños y jóvenes adolescentes. Está indicado en pacientes expuestos a alérgenos “no evitables” y con relevancia en la aparición de síntomas alérgicos (rinitis, conjuntivitis y/o asma), siendo necesario, antes de la administración, haber demostrado la sensibilización alérgica tanto por medio de pruebas cutáneas como mediante la determinación en el laboratorio de IgE específica para el alérgeno responsable en el suero del paciente. No obstante, es preciso subrayar que la administración de alérgenos desensibilizantes está contraindicada en algunas situaciones, tales como: enfermedades de origen neoplásico o inmunológico, enfermedades cardiovasculares graves, patologías que contraindiquen el uso de adrenalina (cardiopatía isquémica, hipertiroidismo o hipertensión arterial), tratamientos concomitantes con betabloqueantes (que dificultarían la recuperación en caso de anafilaxia), asma grave o mal controlada, causas que originen un mal cumplimiento terapéutico (trastornos psiquiátricos, dificultades económicas, problemas laborales o escolares, etc.), o en embarazo (contraindicación relativa).
En líneas generales, los extractos alergénicos son mezclas de proteínas que se preparan de forma individualizada, para cada paciente concreto según su alergia. Se obtienen incubando la materia prima natural (por ejemplo, ácaros del polvo doméstico, pólenes, hongos Alternaria y Cladosporium, epitelio de gato, etc.) en tampones acuosos, con el fin de reproducir las condiciones en que dicha materia prima interacciona con las mucosas del organismo. La mezcla se purifica mediante filtración y diálisis y posteriormente se comprueba la presencia de todos aquellos alérgenos que se consideran relevantes y que deben encontrarse en los diferentes extractos para que sean útiles en el diagnóstico y tratamiento de las enfermedades alérgicas. Este tratamiento es un complemento a las medidas de evitación del alérgeno y al tratamiento farmacológico.
Para este tipo de terapias se utilizan actualmente dos vías de administración, aunque los mecanismos inmunológicos que intervienen son similares en ambos casos; la elección dependerá de múltiples factores, como la eficacia para cada alérgeno, la duración prevista del tratamiento, etc. Por un lado, la administración subcutánea del extracto en dosis crecientes es la modalidad estándar, en una pauta preestablecida (fase de iniciación) –generalmente semanal– hasta llegar a la dosis máxima o de mantenimiento, que se repite de forma mensual (fase de mantenimiento); es la preferida para las conocidas como “vacunas individualizadas”. La vía subcutánea tiene como principales inconvenientes: las molestias locales originadas por la inyec-ción (prurito, eritema, edema), la incomodidad que supone acudir periódicamente a un centro médico para recibir el tratamiento, y el riesgo de reacciones adversas graves, tales como rinitis, asma, urticaria, y hasta de shock anafiláctico, que obligan a interrumpir el tratamiento.
Como solución a estos problemas se han desarrollado productos de administración por vía sublingual. En España están autorizados tres medicamentos: extractos estandarizado de varias plantas gramíneas (Oralair®) o de solo una de ellas –Phleum pratense– (Grazax®), indicados en el tratamiento de la rinitis y la conjuntivitis inducidas por polen de gramíneas en pacientes adultos con síntomas clínicamente relevantes y diagnosticados mediante prueba cutánea de prick positiva y/o test de IgE específica a polen de gramíneas; y otro más reciente, Acarizax®, un extracto estandarizado de los ácaros del polvo doméstico Dermatophagoides pteronyssinus y D. farinae, indicado en adultos diagnosticados por historia clínica y prueba positiva de sensibilización a los mismos, que presenten rinitis alérgica y/o asma alérgico. Por esta vía de administración pueden aparecer reacciones adversas locales (prurito bucal o bucolabial, sensación de ardor bucolabial, edema labial o sublingual y efectos gastrointestinales), pero suelen ser leves y autolimitadas, y no obligan a modificar la pauta de administración; las reacciones sistémicas son poco frecuentes y consisten en la reaparición de los síntomas del proceso alérgico o en urticaria (Mesa et al., 2021).
Cabe destacar la reciente comercialización en 2021 de dos nuevos medicamentos a base de extractos estandarizados de alérgenos de veneno de abeja (Alutard SQ Apis mellifera®) y veneno de avispa (Alutard SQ Vespula spp.®), como las primeras opciones de inmunoterapia desensibilizante para pacientes con alergia debidamente contrastada al veneno de abejas y avispa, respectivamente, que sufran reacciones sistémicas o generalizadas (se ha descrito una prevalencia de reacciones alérgicas al veneno de estos insectos en torno al 3% de la población en Europa). No se indican en pacientes con reacciones locales (la mayoría de las personas), aunque sean intensas, ni en reacciones no-mediadas por IgE.
La potencial amenaza vital que representan esas reacciones alérgicas y otros motivos éticos han impedido la realización de estudios específicos controlados por placebo. Su autorización se ha visto sustentada por la literatura científica derivada de estudios clínicos de hasta 5 años de duración, que, en tratamientos de hasta 1 año con el veneno de abeja y hasta 3 años con veneno de avispa, han permitido contrastar tasas de eficacia protectora consistentemente superiores al 80%; o sea, esa amplia proporción de pacientes no sufrió una reacción alérgica sistémica o generalizada como consecuencia de una picadura, bien fortuita en el medio natural o bien tras una prueba hospitalaria de re-picadura. Los medicamentos presentan, además, una relativa buena tolerabilidad, gracias sobre todo a la pauta de administración con dosis crecientes de alérgeno. El perfil toxicológico se caracteriza por eventos adversos asociados a la respuesta alérgica al veneno, que pueden manejarse con la administración de antihistamínicos. Aunque la incidencia de los eventos adversos locales es variable según los estudios (6-79% en la fase de inicio y 0-47% en mantenimiento), los mayoritarios son las reacciones inmediatas en el lugar de inyección (urticaria, dolor, eritema, hinchazón, prurito, etc.). Entre las reacciones adversas sistémicas se describen prurito ocular, rinitis, asma y tos, urticaria y angioedema; son menos frecuentes (0-25% en la fase de inicio y 0-16% en mantenimiento) y en su mayoría leves-moderadas, si bien por su severidad sobresale el riesgo de shock anafiláctico, que requeriría tratamiento inmediato con adrenalina. Por último, a pesar de que la ruta de administración subcutánea puede conllevar ciertos inconvenientes en términos de adherencia terapéutica (frente a la vía oral o sublingual), la formulación depot –adsorción en hidróxido de aluminio– de los dos medicamentos representa una ventaja potencial, al asociarse con una mejor tolerabilidad local que los extractos acuosos de veneno de himenópteros (Fernández-Moriano, 2021).
En relación a su mecanismo de acción, este tipo de medicamentos que actúan como anticuerpos anti-IgE pueden impedir la unión de la IgE a la superficie de las células cebadas, dando lugar a una disminución de la formación de complejos antígeno-IgE activados, con la consiguiente supresión de la liberación de mediadores alérgicos (responsables de la aparición de estornudos, sibilancias, prurito, tos y la broncoconstricción inmediata en la fase temprana). Por tanto, la administración de alérgenos desensibilizantes reduce los síntomas de la respuesta inmediata y de la respuesta tardía actuando sobre los mecanismos humorales y celulares involucrados en la inflamación alérgica, mediante tres tipos de cambios principales: a) modulación de la respuesta de anticuerpos alérgeno-específicos; b) disminución en el reclutamiento y activación de células proinflamatorias; y c) cambios en el patrón de respuesta de las células T alérgeno-específicas (hacia Th1).
Dada la dificultad de establecer una prevención primaria, por el desconocimiento sobre las causas que provocan el aumento de las tasas de sensibilización a alérgenos comunes en la población13 y los motivos concretos que hacen que un individuo sea alérgico (se ha llegado a plantear que el asma y las alergias pueden tener su origen a principios de la vida, incluso en el útero materno), las medidas profilácticas se orientan a la prevención secundaria, toda vez que el paciente ya ha sido diagnosticado de una patología alérgica, y a fin de evitar nuevos episodios o complicaciones clínicas. A caballo entre medidas terapéuticas y las orientadas a la prevención secundaria se podrían encuadrar la administración de inmunoterapia sensibilizante, que ya ha sido descrita en el apartad anterior.
Pero sin duda, las medidas de evitación del alérgeno responsable, o de reducción de la exposición, son esenciales y representan el primero de los “tratamientos preventivos” a instaurar. Aunque no siempre son posibles ni hacen desaparecer completamente los alérgenos, sí que pueden implementarse con éxito en muchos tipos de alergia (ácaros, animales, polen, medicamentos, etc.), aportando, a pesar de su sencillez, un rendimiento a medio plazo muy alto en el buen control de la enfermedad alérgica. Destacamos las siguientes:
En personas con alergia al polen, se recomienda cerrar las ventanas de la casa durante las horas de sol, abrirlas al atardecer (no por la noche, pues los pólenes son más abundantes de madrugada), cerrar las ventanillas cuando se viaja en coche, no tumbarse en el césped, utilizar gafas de sol para evitar el contacto del alérgeno con los ojos, reducir las actividades a primera hora de la mañana y a última hora de la tarde, utilizar y mantener en buen estado los filtros específicos en el coche y aire acondicionado, etc. Estas personas deberán evitar la práctica de ejercicios de alto impacto durante la época de polinización.
Con similares objetivos se recomiendan una serie de medidas extrafarmacológicas, relativas a los hábitos de vida, que ayudan a prevenir complicaciones, sobre todo, en el caso de rinitis alérgica:
En todo caso, es necesario para los pacientes alérgicos permanecer en control médico con un especialista en alergología, cumpliendo el tratamiento suministrado de acuerdo a cada caso.
Dadas las particularidades de las enfermedades alérgicas, caracterizadas por la diversidad y variabilidad de manifestaciones clínicas, la mayor parte de los pacientes van a estar en tratamiento prolongado o crónico en el ámbito ambulatorio, y en algunas ocasiones, van a ser tratados con más de un fármaco (polimedicados). En dicho tratamiento, la adherencia terapéutica y una serie de medidas no farmacológicas, relativas a hábitos de vida, constituyen dos pilares fundamentales para el control de estas enfermedades e influyen de un modo notable en los resultados en salud de los pacientes.
En ese sentido, y teniendo en cuenta que la mayoría de medicamentos autorizados para el tratamiento de las enfermedades alérgicas –que permiten tratar las manifestaciones y aliviar los síntomas producidos por la inflamación de los tejidos afectados, a fin de prevenir una reacción grave– han sido calificados para su dispensación y uso extrahospitalario, es decir, de dispensación en la farmacia comunitaria, destaca la influencia que en la optimización de resultados clínicos puede tener el farmacéutico ejerciente en este ámbito. De ahí que la red española de más de 22.000 farmacias, por su ubicuidad y accesibilidad, resulte especialmente interesante como centro de divulgación de información rigurosa, adecuado para formar a los pacientes, promover un mejor uso de los fármacos antialérgicos y prevenir los problemas relacionados con los mismos.
Por otro lado, el papel del farmacéutico especialista a nivel hospitalario tiene una indudable influencia en la consecución de los mejores resultados en salud de la farmacoterapia, orientada especialmente al tratamiento de pacientes con fármacos biológicos –como omalizumab, mepolizumab, reslizumab, benralizumab o dupilumab– o los más recientes medicamentos de antígenos desensibilizantes indicados en la alergia al veneno de insectos, que son de dispensación exclusiva (o casi) en hospital. Los farmacéuticos que ejercen como analistas clínicos también tienen un papel muy importante en el correcto diagnóstico de las patologías alérgicas.
En todo caso, a la vista del alto impacto socio-sanitario y económico que tienen estas enfermedades, con la integración efectiva del farmacéutico en los equipos multidisciplinares –que asegure la necesaria coordinación con otros profesionales sanitarios de atención primaria y especializada, en particular con el médico alergólogo– se pueden describir varias vías asistenciales de actuación enfocadas al abordaje y asesoramiento práctico a los pacientes o, en su caso, a los familiares.
La educación sanitaria en las enfermedades alérgicas, como en cualquier proceso crónico, es fundamental para un buen control de éstas y, hoy en día, es un pilar más del tratamiento de estas enfermedades, enfocado al mantenimiento de una buena calidad de vida para que el paciente pueda llevar a cabo con naturalidad sus actividades cotidianas, participando de forma proactiva en su estado de salud. Habida cuenta de que la farmacia y el farmacéutico son, en muchas ocasiones, el primer establecimiento y profesional sanitario con que entra en contacto un paciente (esto es, la puerta de entrada al sistema de salud), tienen una posición privilegiada en este abordaje educativo.
Se debe proporcionar al paciente, bien por medios orales o –preferentemente– por medios escritos, información científicamente rigurosa, pero accesible, clara y concisa, con sencillas pautas que garanticen su compresión y que faciliten la administración correcta del tratamiento. Con respecto a la información concreta que el paciente debe recibir se deben considerar de forma individualizada sus necesidades, sus conocimientos previos, sus creencias, su edad, la gravedad de la patología y el grado de implicación necesario en su manejo. Será de utilidad transmitir al paciente –y, en muchos casos, también a su familia– los conocimientos necesarios sobre su enfermedad y los cambios conductuales o dietéticos que precisen para ser capaces de controlar sus manifestaciones, sin olvidar la necesaria coordinación con el médico. A este respecto, se recuerda que la alergia se define como un conjunto de reacciones de hipersensibilidad del sistema inmunitario de algunas personas frente a determinadas sustancias (alérgenos) que normalmente son inocuas para el resto, como ciertos alimentos, pólenes de diferentes especies vegetales, epitelios de algunos animales, veneno de insectos o determinados fármacos, entre otros.
Algunos autores han estimado que, entre las reacciones adversas a medicamentos (que pueden afectar al 10% de la población mundial y hasta un 20% de todos los pacientes hospitalizados), más del 10% del total de casos se deben a reacciones impredecibles de hipersensibilidad a medicamentos, y los medicamentos pueden ser responsables de hasta el 20% de las muertes por anafilaxia, teniendo, por tanto, un importante impacto socioeconómico. En su prevención, la educación sanitaria y un correcto diagnóstico son fundamentales.
La reacción alérgica más frecuente a fármacos es la que se produce frente a la penicilina y los antibióticos derivados de ella, cuando son administrados por vía oral o parenteral. En personas con anticuerpos IgE anti-penicilina, su administración puede causar anafilaxis e incluso la muerte. Esto es debido a que la penicilina actúa como un hapteno: es una molécula pequeña con un anillo β-lactámico altamente reactivo que reacciona con grupos amino sobre las proteínas del huésped para formar conjugados covalentes. Los péptidos propios, al modificarse por el fármaco, pueden desencadenar una respuesta Th2 en algunos individuos, de modo que esas células Th2 activan a los linfocitos B, que se unen al fármaco para producir anticuerpos IgE contra el hapteno: la penicilina y sus derivados actúan como antígeno para las células T. Cuando se inyectan por vía intravenosa a un individuo alérgico, las proteínas modificadas por el fármaco pueden entrecruzarse con las IgE en los mastocitos y desencadenar anafilaxis. Otros fármacos generalmente implicados en reacciones de este tipo son los antibióticos con estructura de cefalosporina o de sulfamida, y los fármacos antinflamatorios no esteroides, como la aspirina (Pawankar et al., 2011).
En caso de aparición, la anafilaxia puede ser letal con gran rapidez, siendo esencial que el paciente conozca y reconozca sus signos de alerta (los más graves pueden ser el dolor u opresión en el pecho, dificultad para tragar o respirar, hinchazón de labios o lengua, pulso débil, mareos, desmayos o shock) y la posibilidad de controlar el proceso mediante una inyección inmediata de adrenalina, que relaja el músculo liso e inhibe los efectos cardiovasculares de la anafilaxis. En cualquier caso, deberá solicitar ayuda médica de emergencia, aun cuando parezca que los síntomas están remitiendo. Es aconsejable que el paciente se acueste con las piernas elevadas para así aumentar el flujo sanguíneo (las embarazadas deben acostarse del lado izquierdo para no oprimir la vena cava), si bien ante la presencia de vómitos o sensación de ahogo es preferible permanecer sentado. En esa posición se debe autoadministrar la inyección de adrenalina, con un ángulo recto en el muslo, manteniendo el inyector en esa posición durante unos segundos (aproximadamente 10 s); a continuación, se debe masajear la zona donde se ha aplicado la inyección otros 10 s. Es posible una segunda administración a los 5-15 min si los síntomas continúan, aunque mejor es preferible que se haga bajo supervisión médica.
La situación de pandemia por COVID-19 ha reforzado la posición del farmacéutico como punto de referencia en salud al que acuden un gran número de pacientes con o sin sintomatología de infección respiratoria para realizar consultas de diversa índole. Según la limitada evidencia disponible, los pacientes con patología respiratorias crónicas, como el asma alérgico, no tienen mayor riesgo de padecer la COVID-19 pero, tras el contagio por el SARS-CoV-2, sí presentan un mayor riesgo de sufrir complicaciones. Por ello cobra mayor relevancia aún el buen control de la enfermedad y la cumplimentación adecuada del tratamiento. En esa línea, la Organización Mundial de la Alergia estableció como lema para el Día Mundial del año 2020 “El cuidado de las alergias no se detiene con la COVID-19″, con el objetivo de concienciar a profesionales sanitarios y ciudadanos para que la pandemia no impacte en la calidad de vida de las personas con algún tipo de alergia.
Conviene subrayar, en términos de farmacoterapia, que no se ha descrito ninguna incompatibilidad entre los fármacos empleados habitualmente en las enfermedades alérgicas y los tratamientos autorizados o experimentales usados frente a la COVID-19. Asimismo, es importante recordar que las cuatro vacunas disponibles frente a la COVID-19 actualmente en España (Comirnaty®, Spikevax®, Vaxzevria®, COVID-19 Vaccine Janssen®) están contraindicada en personas que hayan presentado una reacción de hipersensibilidad al compuesto activo de las vacunas o a cualquiera de los excipientes, o bien una reacción anafiláctica a una dosis previa de vacuna frente a COVID-19 o a alguno de los componentes de la vacuna. En personas con alergias a otras vacunas o medicamentos con otros componentes diferentes no presentes en la vacuna COVID-19, la vacuna debe administrarse con precaución, extremando las precauciones mediante la observación en el lugar de vacunación de las personas durante 30 minutos tras la inyección. Sin embargo, la vacunación frente a COVID-19 no está contraindicada en personas con alergias alimentarias, a animales, insectos, alérgenos del ambiente, látex u otras alergias, en quienes es suficiente vigilar cualquier posible reacción durante al menos 15 minutos tras la administración de la vacuna, dejando claro que los beneficios de la vacunación superan a los posibles riesgos.
En el contexto actual, el Ministerio de Sanidad recomienda que los pacientes con enfermedades respiratorias crónicas con terapia inhalatoria, además de cumplir con los consejos generales de prevención (lavado frecuente de manos, uso de mascarillas, evitar tocarse ojos, nariz o boca, distanciamiento social, etc.), sigan estos consejos: pasar una toallita de papel seco por el inhalador tras su uso, limpiar las gafas nasales de oxigenoterapia con agua y jabón y secarlas bien, no cambiar las pautas habituales de oxigenoterapia sin indicación y realizar ejercicios de rehabilitación respiratoria básicos en su domicilio.
Por otro lado, en los niños que sufran rinitis alérgica se recomienda el uso de soluciones salinas estériles para el lavado de las fosas nasales, que también es aconsejable en mujeres embarazadas y madres lactantes. El farmacéutico puede educar al paciente sobre la técnica correcta de administración de estas soluciones: el paciente debe inclinarse sobre el lavabo con la cabeza baja, echar un poco de solución salina estéril en la palma de la mano e inhalarla por la nariz, por un orificio nasal cada vez; a continuación, el paciente debe expulsar la solución restante y “sonarse” con cuidado. La solución también puede ser insertada en la nariz mediante una jeringa de goma de las empleadas para el oído; en ese caso, inclinado sobre el lavabo, el paciente debe insertar solamente la punta de la jeringa en un orificio nasal y apretar el émbolo varias veces para lavar el tracto nasal, presionándolo con firmeza para que la solución pase a la boca. El proceso debe repetirse después en el otro orificio nasal, llevando a cabo este lavado varias veces al día.
Finalmente, el farmacéutico podrá informar a aquellos pacientes alérgicos que están en tratamiento, pero con la enfermedad no adecuadamente controlada (que afecta a su calidad de vida), de la posibilidad de acudir al alergólogo para que sea este el que valore la opción de la administración de inmunoterapia desensibilizante en las unidades de inmunoterapia en centros sanitarios. Según se ha avanzado, este tipo de terapia consiste en la administración de un extracto del alérgeno específico responsable de la enfermedad, mediante dosis progresivamente crecientes a intervalos regulares de tiempo, con la finalidad de inducir la tolerancia necesaria para controlar la respuesta alérgica, siendo el único tratamiento capaz de modificar el curso natural de la enfermedad alérgica. Conviene subrayar que, en el caso de mujeres embarazadas, puede continuarse la administración si se ha alcanzado el mantenimiento de la vacuna y se han tolerado las dosis iniciales, pero en caso de comenzar con una nueva vacuna es recomendable posponerla hasta después del parto.
Para una mayor información sobre preguntas frecuentes y dudas que pueden plantear los pacientes y ciudadanos en relación a las enfermedades alérgicas y su tratamiento, se recomienda consultar el espacio específico habilitado por la Sociedad Española de Alergología e Inmunología Clínica (SEIAC) en su página web: https://www.seaic.org/faqs/categoria-faqs/preguntas-sobre-alergia.
Como complemento del ineludible papel como educador sanitario, la detección por parte del farmacéutico de los casos de alergias leves en su interacción con el paciente puede basarse en la identificación de una demanda reiterada de medicamentos no sujetos a prescripción médica para el alivio de síntomas respiratorios (por ejemplo, antihistamínicos H1 por vía oral, o corticoides o descongestivos de uso intranasal). En esos casos, además de proponer las medidas no farmacológicas que ayuden a minimizar los síntomas, es conveniente una derivación al médico de atención primaria (o, en casos más graves, a la consulta de alergología) para realizar un correcto diagnóstico de la patología alérgica.
Una amplia mayoría de las manifestaciones alérgicas son leves-moderadas en severidad, y pueden circular por esa vía asistencial hacia el diagnóstico definitivo sin mayores complicaciones clínicas. No obstante, el farmacéutico deberá tener muy presente los signos de alarma que pueden sugerir la instauración de una reacción anafiláctica; estos ya se han descrito anteriormente en este artículo, y destacan: el dolor u opresión en el pecho, dificultad para tragar o respirar, hinchazón de labios o lengua, pulso débil, mareos o desmayos o shock. La anafilaxia supone una emergencia sanitaria por su potencial letalidad. Además, el farmacéutico puede jugar un especial papel como agente centinela frente a las reacciones de hipersensibilidad a medicamentos, como profesional experto en el mismo, habida cuenta de que tanto el infradiagnóstico como el sobrediagnóstico son comunes en relación a dichos eventos.
Por otra parte, ante un paciente con una patología alérgica ya diagnosticada, y que tiene prescrito una pauta duradera de determinado tratamiento farmacológico, el farmacéutico deberá estar alerta ante posibles signos o síntomas sugerentes de agravamiento en el estado de salud o agudización de la enfermedad por un posible fracaso terapéutico, lo cual debe activar de igual modo la derivación al médico para su reevaluación y, en su caso, modificación del tratamiento.
Una vez establecido el diagnóstico de una reacción o enfermedad alérgica, el farmacéutico, con independencia de su ámbito de actuación, puede y debe velar por el uso racional y seguro de los medicamentos para que los pacientes alcancen el máximo beneficio clínico, en tanto que conocerá toda la medicación de estos pacientes, no solo la prescrita frente a la alergia, sino también los tratamientos para enfermedades concomitantes, medicamentos que no necesitan prescripción, el uso de complementos alimenticios, etc. Para ello, los pacientes alérgicos deben conocer bien las características del medicamento o medicamentos prescritos por el médico, diferenciando adecuadamente entre el tratamiento antialérgico de base empleado a diario para minimizar los síntomas y el tratamiento de rescate ante crisis, empleado para relajar los músculos de las vías aéreas y conseguir un alivio rápido de la obstrucción bronquial en el caso, por ejemplo, del asma alérgico. Como en otras patologías crónicas, conviene tener claros los objetivos de la farmacoterapia, la importancia de cumplir el tratamiento y de usar de un modo correcto los inhaladores, soluciones salinas y la adrenalina autoinyectable. En líneas generales, las instrucciones dadas por el médico respecto a un tratamiento farmacológico prescrito deben ir siempre reforzadas con recomendaciones relativas a las medidas preventivas generales por parte del farmacéutico.
En el momento de la dispensación de cualquier medicamento, el farmacéutico comprobará que el paciente cuenta con toda la información necesaria para que su uso sea efectivo y seguro. Se debe averiguar si existe algún criterio que impida la dispensación, tal como: alergia a algún componente del medicamento, una contraindicación absoluta, interacciones con otros medicamentos (o alimentos), una duplicidad o una situación fisiológica especial (por ejemplo, embarazo o lactancia). Si es la primera vez que el paciente va a utilizar un medicamento, la labor del farmacéutico será asegurar que la persona sale de la farmacia conociendo para qué es ese medicamento y cuál es su correcto proceso de uso. Así, por ejemplo, en el caso de medicamentos por vía intranasal, se debe recomendar que, antes de su administración, el paciente se “suene” la nariz para limpiar los orificios nasales y agite el dispositivo suavemente antes de cada uso. Seguidamente, deberá inclinar la cabeza ligeramente hacia adelante; sujetar el pulverizador nasal en posición vertical y colocar con cuidado el aplicador en uno de los orificios nasales; orientar el aplicador hacia el exterior de la nariz, lejos del tabique nasal (esto favorece que el medicamento llegue a la parte adecuada de la nariz); apretar firmemente una única vez el botón dosificador para pulverizar el medicamento dentro de la nariz, mientras se coge aire por la misma; y sacar el aplicador y echar el aire por la boca.
Si se trata de una dispensación de continuación, el farmacéutico evaluará si el beneficio-riesgo del medicamento sigue siendo favorable en el paciente concreto, verificando si ha habido cambios en el tratamiento (dosis, pauta posológica, duración, adición de nuevos medicamentos, etc.) y si el paciente ha experimentado algún problema de seguridad que pudiera hacer sospechar de una reacción adversa, interacción, contraindicación, etc. Además de los medicamentos prescritos, en muchas ocasiones el propio paciente solicitará consejo al farmacéutico sobre los diferentes síntomas que van apareciendo. En las patologías alérgicas el farmacéutico comunitario puede recurrir al Servicio de Indicación para aconsejar el uso durante periodos de tiempo limitados a unos pocos días de algunos de los medicamentos sin receta disponibles, que pueden permitir el alivio de síntomas nasales y oculares leves de procesos alérgicos estacionales; es el caso, por ejemplo, de algunos fármacos antihistamínicos H1 (tópicos u orales), asociados o no a un descongestivo.
En cualquier caso, como en otras enfermedades que requieren tratamientos prolongados, la adherencia –tanto al tratamiento farmacológico como a las terapias no farmacológicas– ha sido descrita como uno de los factores de mayor influencia sobre los resultados de la terapéutica de las diferentes manifestaciones de la alergia. De nada sirve un diagnóstico preciso y la selección personalizada del fármaco y de la pauta posológica, si el paciente no concede la importancia requerida al estrecho cumplimiento de las indicaciones recibidas. Así pues, el refuerzo de la evaluación y promoción de la adherencia terapéutica, especialmente en pacientes con trastornos de mayor gravedad o en aquellos que se encuentren polimedicados, es uno de los pilares de la actuación del farmacéutico, para favorecer que el paciente se involucre decidida y voluntariamente en el correcto cumplimiento de su tratamiento. Se pueden desarrollar estrategias individualizadas con este fin, valorando las causas de la no adherencia (visión subjetiva de pobre eficacia, tolerabilidad, etc.) y fomentando la confianza en los fármacos administrados, que pueden incluir información verbal y escrita y recursos interactivos, con referencia a las posibles consecuencias de la escasa adherencia, que pueden ir desde un empeoramiento de la calidad de vida y una mayor probabilidad de complicaciones, hasta la aparición de efectos secundarios o comorbilidades; todo ello, además, puede supone ingresos hospitalarios adicionales y otras intervenciones sanitarias que implicarán ineficiencia del gasto farmacéutico y sanitario.
Por último, adquiere gran interés la realización del Servicio de Seguimiento Farmacoterapéutico, quizá el más relevante para optimizar la farmacoterapia del paciente alérgico. Ofrecido por el farmacéutico de forma rutinaria, sistematizada y registrada/documentada, con reuniones periódicas con el paciente, permitirá, en colaboración con el resto de profesionales sanitarios, detectar, atenuar y resolver problemas relacionados con el medicamento (PRM), resultados negativos asociados a la medicación (RNM) y aportar soluciones personalizadas para cada paciente. La farmacovigilancia (con la correspondiente notificación, en su caso, de sospechas de reacciones adversas al Sistema Nacional de Farmacovigilancia14) es otro aspecto que nunca puede ser relegado, puesto que de ello depende la seguridad no solo de un paciente en concreto, sino la de todos aquellos potenciales usuarios de un determinado medicamento. El farmacéutico debe estar alerta y ayudar a los pacientes a identificar los efectos adversos más relevantes de los medicamentos antialérgicos, con el fin de comunicárselo al médico responsable del tratamiento para que éste adopte las medidas oportunas.
Para todo ello, complementariamente a lo especificado en este artículo y a la recomendación de consultar las fichas técnicas de los medicamentos, si se tiene en consideración que la información científica se actualiza constantemente, cobran especial relevancia las bases de datos que contienen información farmacológica actualizada y pormenorizada. Es el caso, por ejemplo, de BOT PLUS, un aplicativo informático que permite, entre otras funcionalidades, la detección de interacciones farmacológicas entre múltiples medicamentos comerciales y/o principios activos, para su evaluación a la hora de optimizar tratamientos.
En última instancia, como complemento a lo expuesto en apartados anteriores, conviene recordar algunos conceptos sobre el perfil beneficio-riesgo de los diferentes grupos farmacológicos empleados en las enfermedades alérgicas, que se resumen a continuación:
Queridos lectores,
Os traemos este nuevo número de Panorama Actual del Medicamento con el mismo grado de ilusión de todos los meses. En unos primeros días de julio en que asistimos, no obstante, a una situación sanitaria que vuelve a ser preocupante. Los contagios de la infección por SARS-CoV-2 entre la población joven ascienden vertiginosamente, y, si bien se aprecia el notable efecto de la vacunación masiva sobre la gravedad y la mortalidad por COVID-19, se siguen viendo comportamientos sociales que no invitan al optimismo sobre la vuelta a la normalidad, algo que empezábamos a vislumbrar. Sería una pena tirar por la borda el camino recorrido y adentrarnos en una quinta ola que haga volver, como ya parece que empieza a ocurrir en algunas comunidades, a las restricciones horarias o de movilidad.
Por tanto, hacemos un llamamiento, desde la responsabilidad como actores implicados en la salud de la población, a extremar la prudencia en las conductas sociales, para impedir el avance o aparición de nuevas variantes del virus (como la variante delta que ahora parece empezar a predominar en nuestro país). Quizá la menor preocupación por la pandemia, conforme aumenta la confianza en las vacunas, tal y como revelaba recientemente el estudio Cosmo-Spain –impulsado por la Organización Mundial de la Salud–, subyace como causa de esta situación. Pero, lejos aún de erradicar la circulación del virus, debemos seguir teniendo presentes sus consecuencias, esto es, mantenernos siempre de guardia. Y es que numerosos profesionales sanitarios han dado su vida en la lucha por la salud global; su mérito se quiso conmemorar en la entrega de las Medallas del Consejo General de Farmacéuticos el pasado 22 de junio. Una mayor concienciación sanitaria debería servirnos para estar preparados a futuro frente a posibles emergencias de salud pública.
Entre los contenidos de este número, destacamos la revisión monográfica de apertura centrada en la farmacoterapia y otros aspectos generales de la alergia, un proceso fisiopatológico que se expresa clínicamente como distintas patologías muy prevalentes en la sociedad actual. También se incluye la evaluación de la innovación de tres fármacos de reciente comercialización: siponimod en esclerosis múltiple secundaria progresiva, brigatinib en cáncer de pulmón no microcítico ALK+ y ciclosilicato de sodio y zirconio en hiperpotasemia. Si bien ninguno de ellos representa una innovación disruptiva en sus indicaciones, contribuyen a aumentar el arsenal terapéutico disponible para los pacientes, lo cual, en última instancia, sustenta el avance progresivo de la farmacoterapia. Otros artículos en secciones como Actualidad Farmacoterapéutica, Farmacovigilancia o Farmacoeconomía (por ejemplo, la referencia al primer IPT que incorpora evaluación económica dentro del nuevo sistema REvalMed) complementan un abordaje integral de las novedades en el mundo del medicamento.
Os recordamos que PAM para en agosto. Volvemos en septiembre con las energías renovadas. Os deseamos un feliz descanso estival, junto a la esperanza de que todos preservemos una buena salud. Recibid un afectuoso saludo.
COMERCIALIZADOS EN ESPAÑA EN LOS ÚLTIMOS DOCE MESES
Valoración de la innovación terapéutica en PAM
Es importante indicar que se valora el grado de innovación. Todos los medicamentos, sean innovadores o no, tienen utilidad terapéutica, en tanto que su autorización por las autoridades sanitarias implica que han demostrado rigurosamente su eficacia, su seguridad, su calidad y las condiciones de uso (incluyendo la información contenida en la ficha técnica – sumario de características – y en el prospecto del medicamento). Por tanto, la valoración que se hace se refiere a la incorporación, en el grado que se determine, de algún elemento innovador con respecto a otros medicamentos autorizados previamente para iguales o similares indicaciones terapéuticas o, en su caso, cubriendo la ausencia de éstas.
Asimismo, debe considerarse que ésta es una evaluación que se practica coincidiendo con la comercialización inicial del medicamento. Se trata, por consiguiente, de una valoración provisional de la innovación realizada en función de la evidencia clínica disponible hasta el momento, lo que no prejuzga, en ningún caso, la disponibilidad posterior de nuevas evidencias científicas (de eficacia o de seguridad) en la indicación autorizada o el potencial desarrollo y autorización, en su caso, de nuevas indicaciones terapéuticas o la imposición de restricciones de uso en las anteriores.
Se consideran tres posibles niveles, adjudicados en función de la relevancia de la(s) innovación(es) presentes en el nuevo medicamento, siempre en relación al arsenal terapéutico disponible clínicamente en España en el momento de la comercialización:
Se distinguen dos niveles de evidencia científica para los aspectos innovadores de los nuevos medicamentos:
El rigor de los datos contrastados mediante ensayos clínicos controlados (evidencia clínica) es determinante en la valoración de la innovación, mientras que las potencialidades solo pueden ser valoradas accesoriamente, como aspectos complementarios de esta valoración. En ningún caso, un medicamento es valorado con un nivel de innovación importante en función de sus ventajas potenciales, si no aporta otras ventajas demostradas clínicamente. Se analizan cinco aspectos de la innovación: clínica, molecular, toxicológica, físico-química y económico-tecnológica. Como ya se ha indicado, la fundamental y determinante es la novedad clínica.