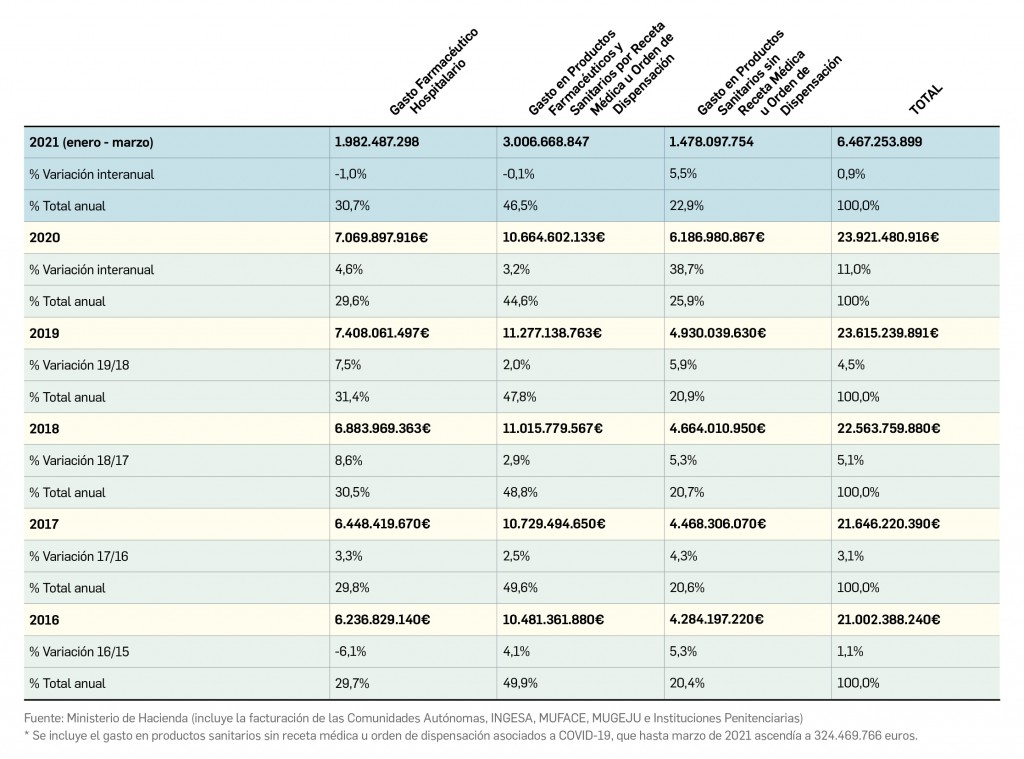
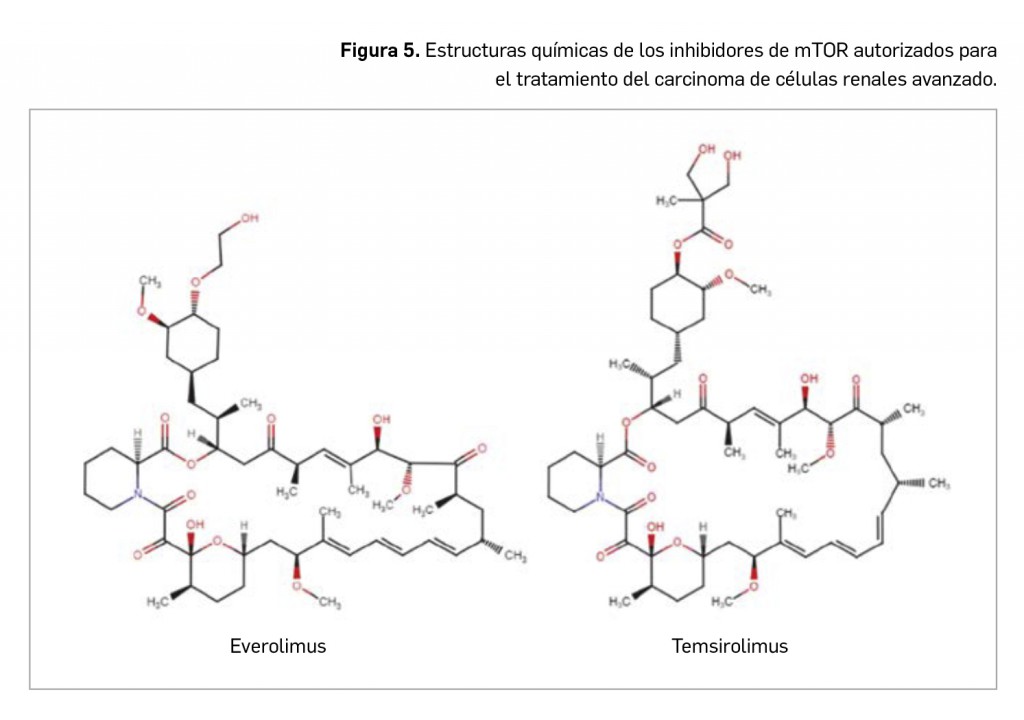
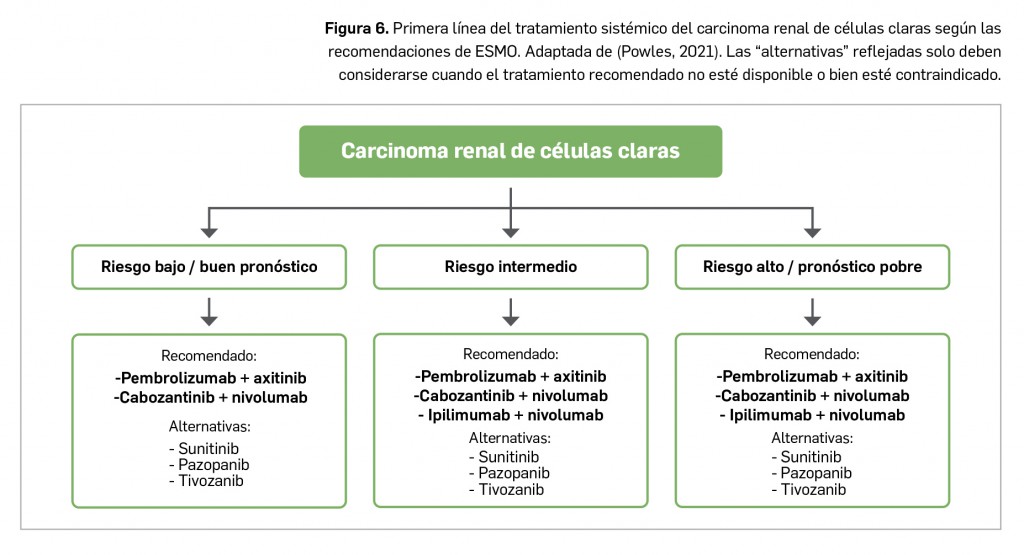
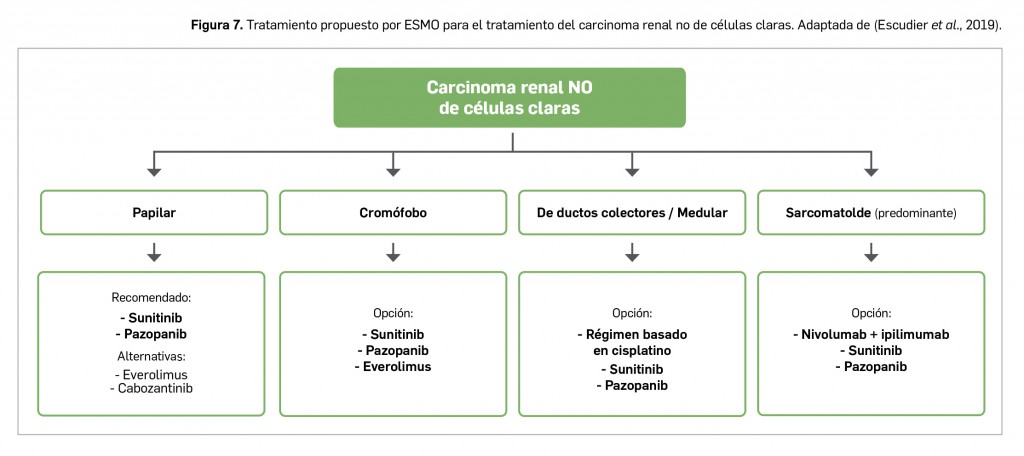
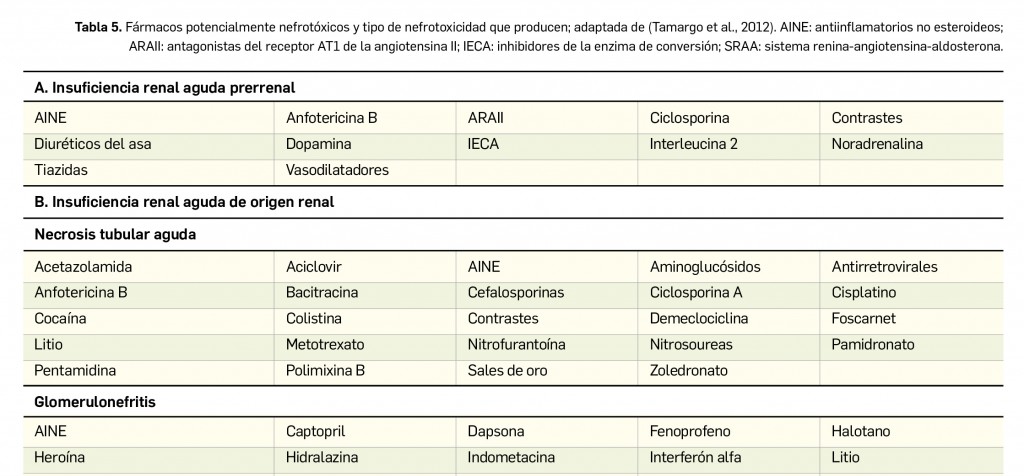
Los casos notificados de adenopatías axilares durante los ensayos clínicos y después de la comercialización de las vacunas frente a COVID-19 han motivado su estudio, evaluación y el establecimiento de recomendaciones para la interpretación de las imágenes correspondientes, que pueden inducir a errores en mujeres con sospecha de cáncer de mama.
Varias comisiones nacionales de mamografía, sociedades científicas y asociaciones vinculadas a radiología y diagnóstico por imagen están haciendo recomendaciones sobre consultas realizadas por pacientes con linfoadenopatías axilares o linfadenitis reactivas, que recientemente han recibido vacunas frente a COVID-19. De acuerdo con estas organizaciones, tras el inicio de las campañas de vacunación, se están presentando con mayor frecuencia cuadros de linfadenitis reactiva (ganglios axilares aumentados de tamaño) en mujeres vacunadas. Varios de los casos reciben recomendaciones de manejo que van desde biopsias a imagenología adicional.
Es preciso recordar que los resultados de estudios clínicos de varias de las vacunas aprobadas ya subrayaron la posibilidad de un aumento de tamaño de los ganglios axilares a la palpación, con una frecuencia variable dependiendo de la vacuna. Para el caso de la vacuna de Moderna, este efecto se ha visto en un 11% de los casos tras la primera dosis y en un 16% tras la segunda, siendo más frecuente en personas jóvenes y en la axila del lado donde se ha recibido la inoculación. Estos eventos son menos frecuentes con las vacunas de Pfizer (Comirnaty®) y la de AstraZeneca (Vaxzevria®). El Centro para la Prevención de Enfermedades (CDC) de EE.UU. ha indicado que el aumento de tamaño de los ganglios de la axila, detectable a la palpación en el lado de inyección de la vacuna, es el segundo efecto adverso local más frecuente. Generalmente, la hiperplasia de los ganglios comienza a partir del segundo día tras la vacunación, se mantiene por al menos 10 días y puede persistir en imágenes diagnósticas por varias semanas.
Recomendaciones
Ante la posibilidad de que ocurran estos eventos, especialmente en mujeres, se recomienda lo siguiente:
- Destacar que la hiperplasia de los ganglios linfáticos tras una vacuna es un evento esperado y no es exclusivo de las vacunas contra la COVID-19, ya que también se observa con otras vacunas como la de la gripe, el papiloma humano, sarampión, varicela o la BCG; es decir, con el uso de vacunas que inducen una respuesta inmunitaria fuerte.
- Evitar alarmarse si a los pocos días de la vacunación se notan bultos en las axilas o en el cuello, fundamentalmente en el lado en el que se ha vacunado.
- No se considera indicada ninguna consulta médica específica, ni ninguna imagen diagnóstica, a menos que el aumento de tamaño de los ganglios persista en el tiempo más de 6 semanas, sin observar disminución progresiva de los mismos.
- Para pacientes con antecedente personal de “cáncer de mama” se recomienda que la vacuna se administre en el lado opuesto a la mama intervenida.
- Para los programas de detección precoz de cáncer de mama se recomienda registrar la información detallada de antecedente de vacunación, tipo de vacuna, fecha de vacunación y lado del cuerpo donde se aplicó la vacuna.