La OMS, a través de su comité asesor de vacunas (GACVS), publicó sus conclusiones sobre las señales de seguridad de la vacuna de AstraZeneca, afirmando que los beneficios de vacunación superan los riesgos detectados, en esta situación pandémica, cuando ya se han alcanzado más de 120 millones de contagios identificados y más de 2 millones muertos a nivel global.
La Organización Mundial de la Salud (OMS), mediante el subcomité COVID-19 del Comité Asesor Mundial sobre Seguridad de las Vacunas (GACVS), también se ha declarado a favor de mantener la inmunización con la vacuna frente COVID-19 Vaxzevria®, de AstraZeneca, en esta situación pandémica. A fecha 17 de marzo de 2021, se habían reportado más de 120 millones de casos de infecciones por COVID-19, con más de 2 millones de muertes, a nivel mundial. La vacunación sigue siendo una herramienta fundamental para ayudar a prevenir más enfermedades y muertes, y para controlar la pandemia.
Hasta ahora, se han administrado más de 20 millones de dosis de la vacuna Vaxzevria® en Europa, y también se han administrado más de 27 millones de dosis de la vacuna Covishield® (vacuna de AstraZeneca en colaboración con el Serum Institute of India) en India.
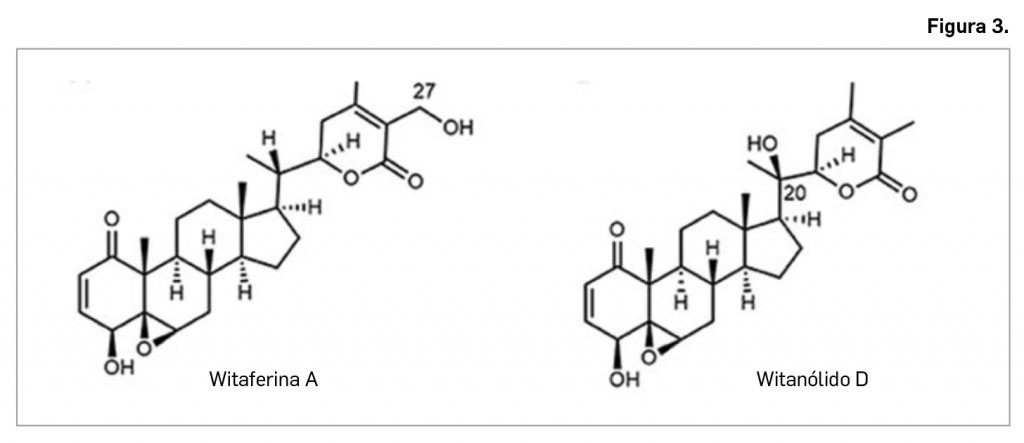
El subcomité COVID-19 del GACVS se reunió virtualmente los días 16 y 19 de marzo de 2021 para revisar la información y los datos disponibles sobre eventos tromboembólicos (coágulos de sangre) y trombocitopenia (plaquetas bajas) después de la vacunación con la vacuna Vaxzevria®. Revisó los datos e informes de ensayos clínicos basados en datos de seguridad de Europa, Reino Unido e India, y también la Vigibase, la base de datos mundial de la OMS de casos de sospechas de reacciones adversas o informes de seguridad de casos individuales (ICSR, por sus siglas en inglés).
En base a la detallada revisión científica de la información disponible, el subcomité llegó a las siguientes conclusiones y recomendaciones:
La vacuna de AstraZeneca (incluida la Covishield®) sigue teniendo un perfil beneficio-riesgo positivo, con un enorme potencial para prevenir infecciones y reducir las muertes en todo el mundo.
Los datos disponibles no sugieren ningún aumento general de las condiciones de coagulación, como trombosis venosa profunda o embolia pulmonar después de la administración de estas vacunas frente a COVID-19. Las tasas notificadas de eventos tromboembólicos después de la administración de las vacunas están en línea con el número esperado de diagnósticos de estas afecciones. Ambas condiciones ocurren naturalmente y no son infrecuentes. También ocurren como resultado de la propia patología COVID-19. Las tasas observadas han sido menores a las esperadas para tales eventos.
Si bien también se han notificado eventos tromboembólicos muy raros y únicos en combinación con trombocitopenia, como la trombosis del seno venoso cerebral (TSVC), después de la vacunación con la vacuna de AstraZeneca en Europa, no es seguro que hayan sido causados por la vacunación. El Comité de Evaluación de Riesgos en Farmacovigilancia (PRAC) de la Agencia Europea de Medicamentos ha revisado 18 casos de TSVC de un total de más de 20 millones de vacunas con la vacuna Vaxzevria® de AstraZeneca en Europa. En este momento no se ha establecido una relación causal entre estos eventos raros/infrecuentes.
Se debe ofrecer formación adecuada a los profesionales de la salud y a las personas que se vacunan para reconocer los signos y síntomas de todos los eventos adversos graves después de la vacunación con todas las vacunas frente a COVID-19, de modo que las personas puedan buscar y recibir atención y tratamiento médico oportuno y relevante.
El subcomité COVID-19 del GACVS recomienda que los países continúen monitorizando la seguridad de todas las vacunas frente a COVID-19 y promuevan la notificación de sospechas de eventos adversos (RAM o ESAVI). También está de acuerdo con los planes de la EMA de seguir investigando y monitorizando estos eventos.
El subcomité COVID-19 del GACVS continuará revisando los datos de seguridad de todas las vacunas frente a la COVID-19 y actualizará cualquier consejo según sea necesario. El “Manual de vigilancia de la seguridad de la vacuna COVID-19” de la OMS proporciona orientación a los países sobre el seguimiento de la seguridad y el intercambio de datos de eventos adversos para las nuevas vacunas frente a la COVID-19.

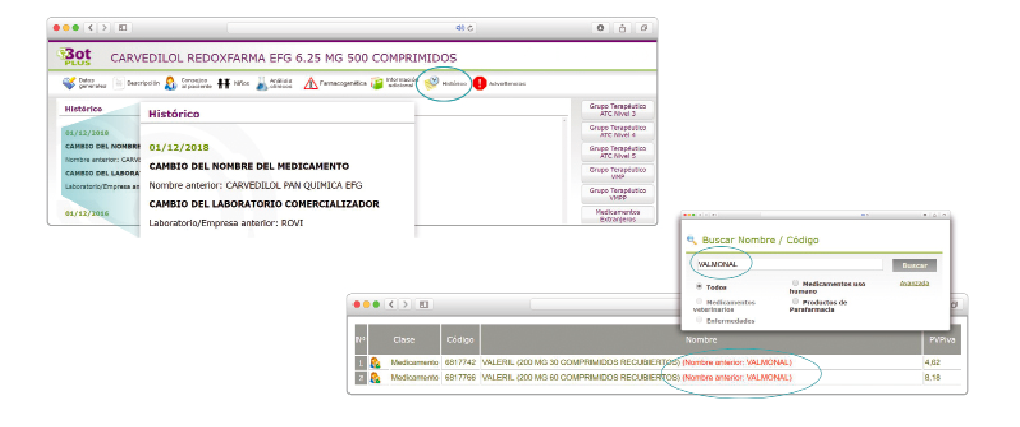
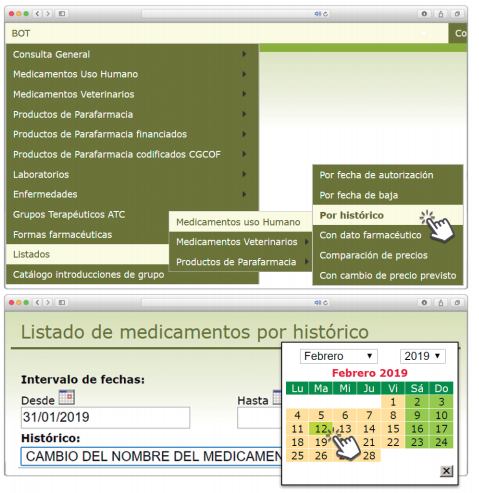
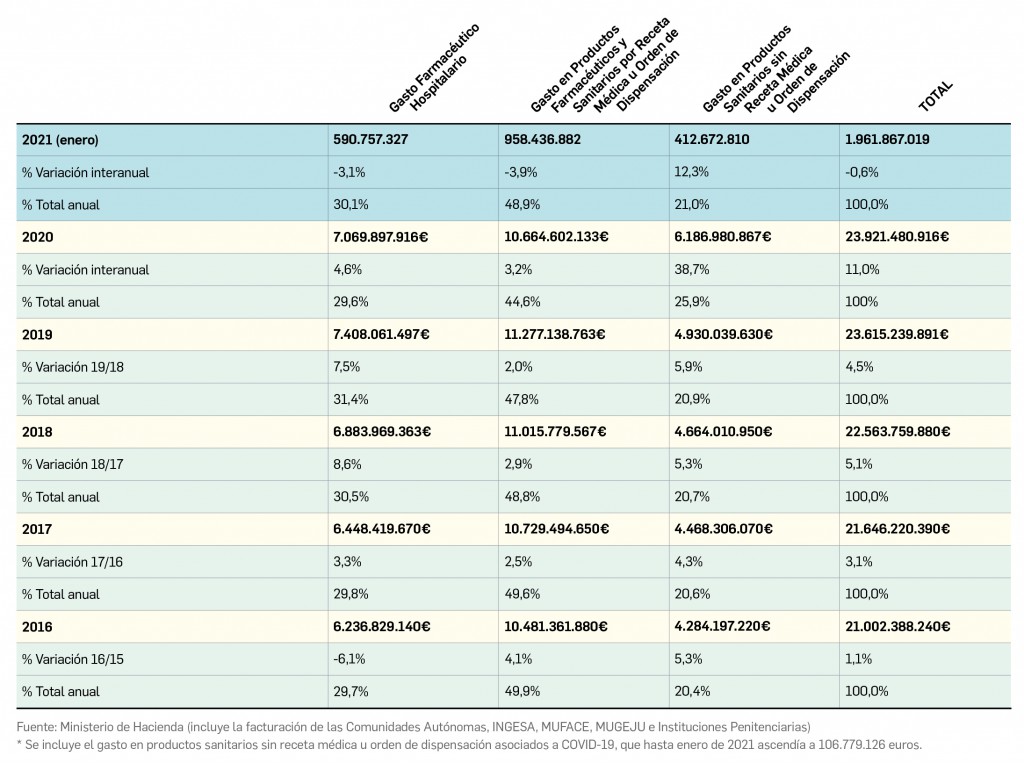
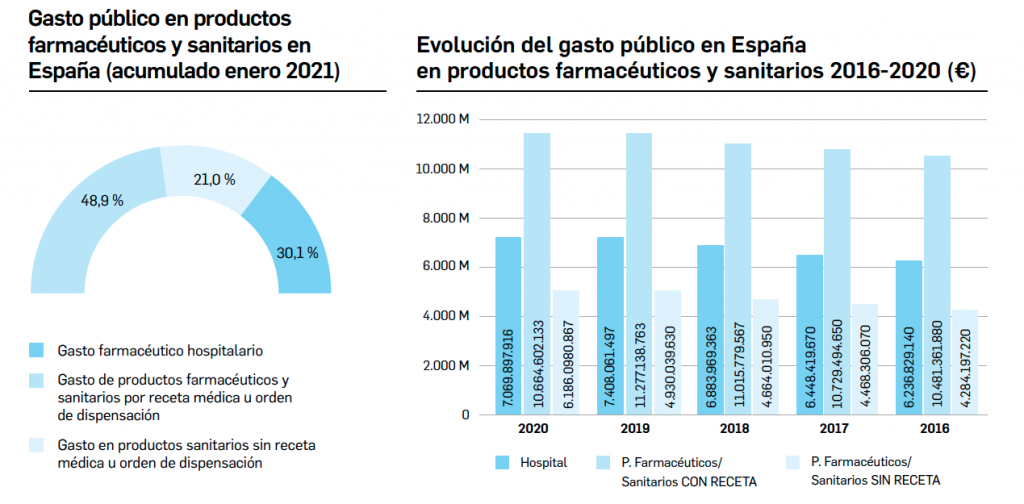
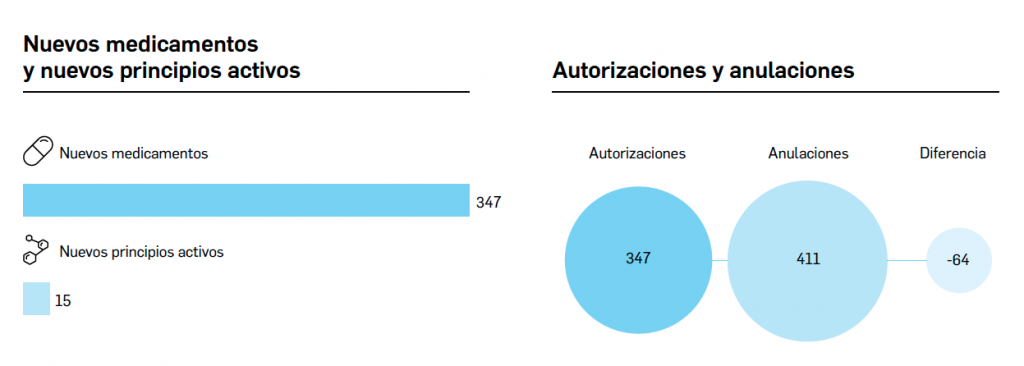
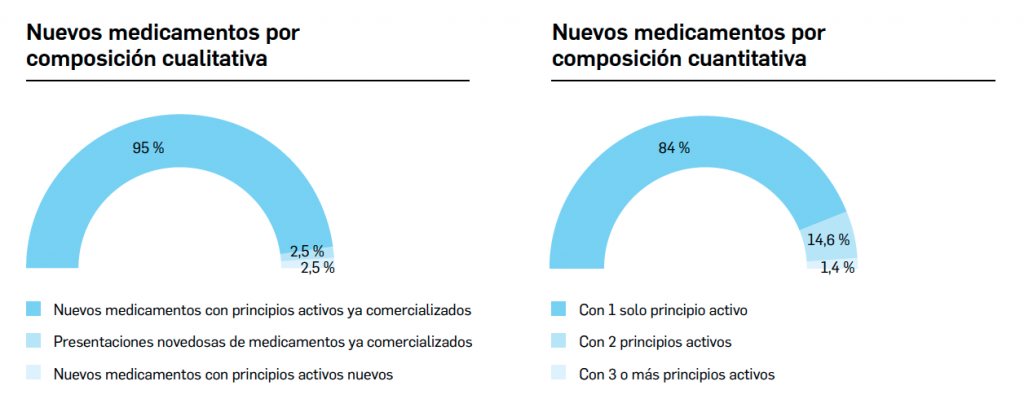
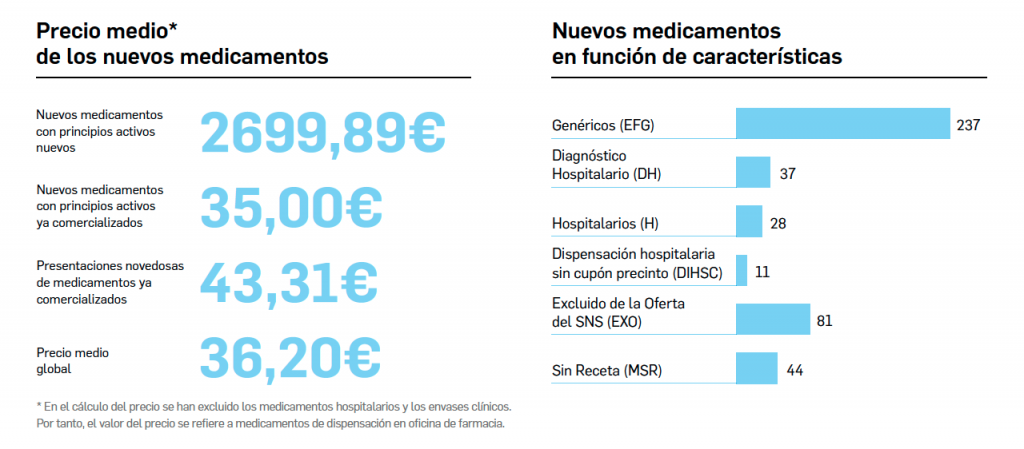
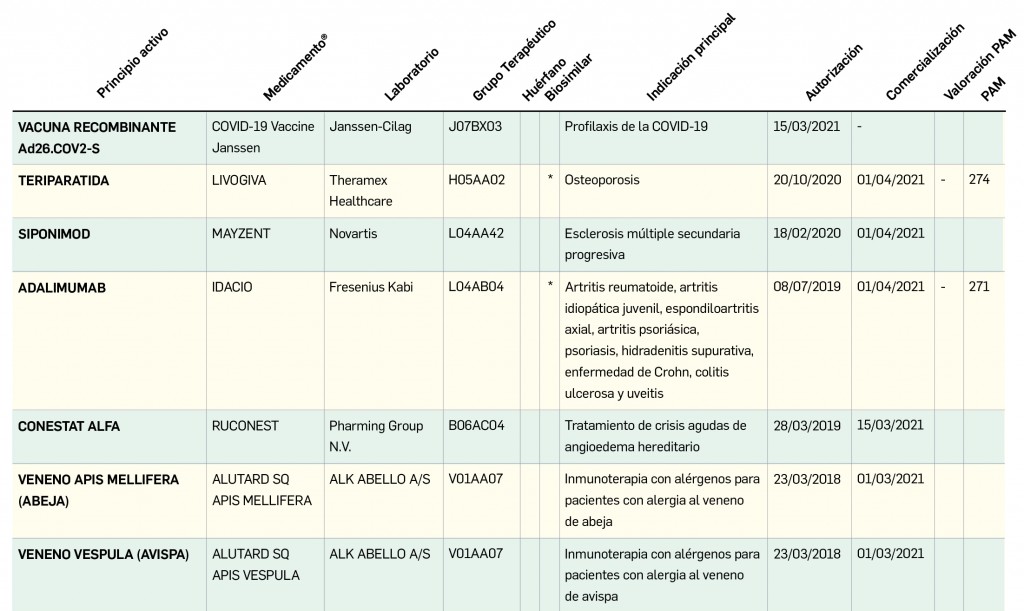
 desecadas de Withania somnifera”. No está incluida en la Farmacopea Europea.
desecadas de Withania somnifera”. No está incluida en la Farmacopea Europea.