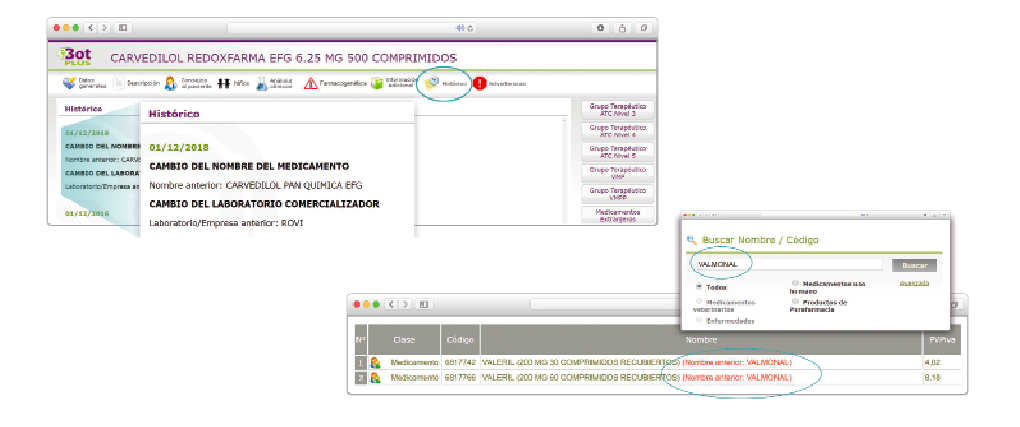
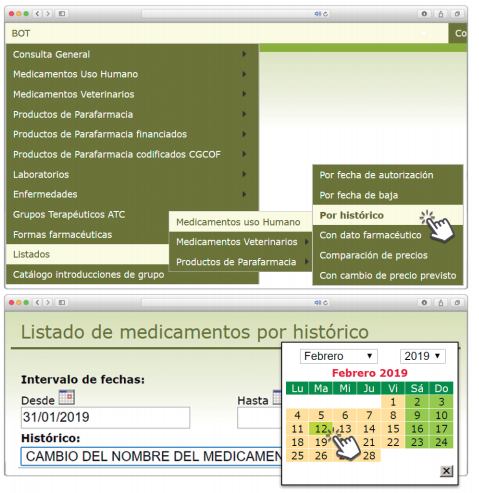
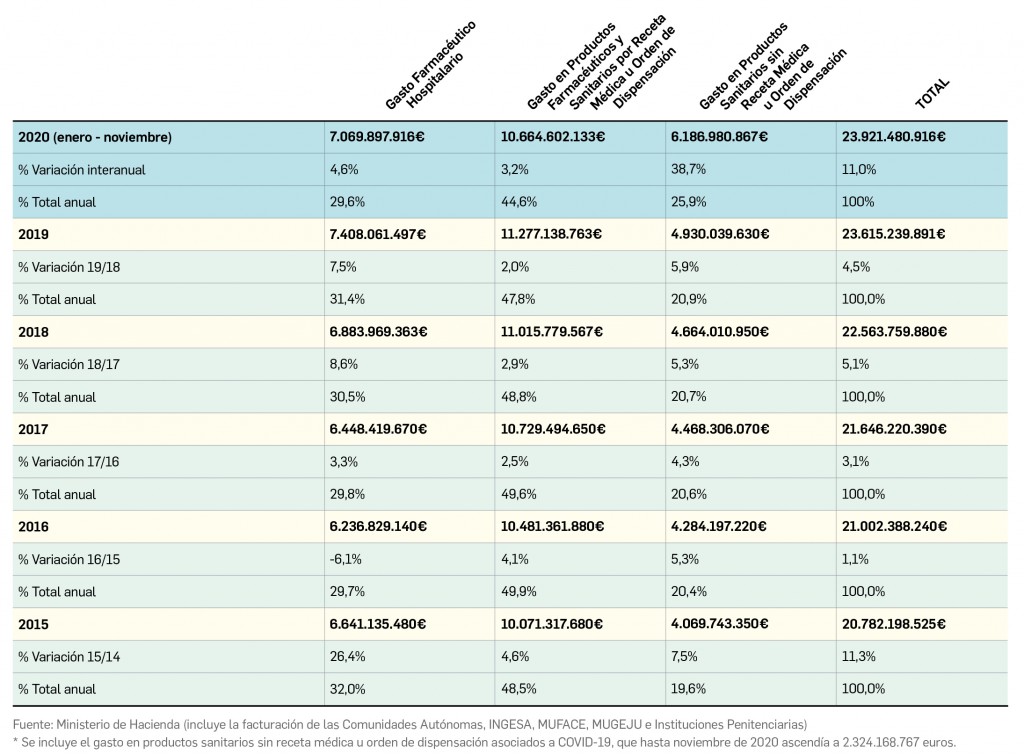
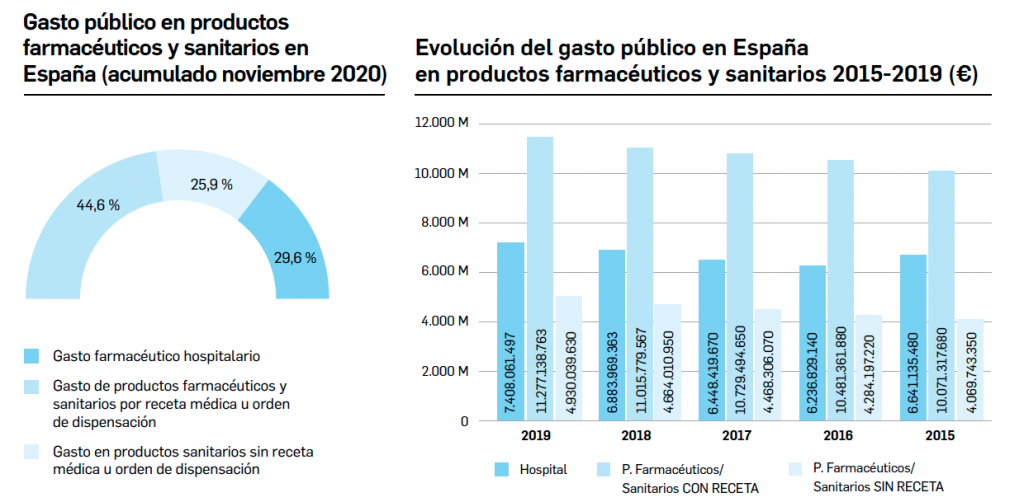
Queridos lectores,
Nos encontramos de nuevo en estas páginas en un momento –a las puertas de la Semana Santa– crucial para definir el futuro de la epidemia por COVID-19 en nuestro país. Habiendo recibido recientemente otra noticia positiva a este respecto, con la autorización de una cuarta vacuna frente a la enfermedad en la Unión Europea, vemos cómo avanzan los programas de vacunación masiva a nivel internacional. Los pasos que se van dando desde los entes regulatorios pueden permitir en un futuro próximo un crecimiento exponencial de la velocidad de vacunación, que por ahora discurre a un ritmo que no a todos satisface por igual. En ese mientras, es responsabilidad de quienes de un modo u otro formamos parte del sistema sanitario seguir removiendo la conciencia colectiva para que conjuntamente consigamos minimizar en lo posible el impacto de cifras de fallecimientos que nos bombardean día tras día, y que una sociedad como la nuestra no debe permitirse sin una honda reflexión.
El presente número de Panorama trae la evaluación de la vacuna ChAdOx1-S, de AstraZeneca, sobre la cual se ha debatido largo y tendido en diversos medios en las últimas semanas. Si bien ha habido controversias sobre su uso en población mayor de 55 años, debemos celebrar que ha permitido, por ejemplo, la vacunación de amplios colectivos de profesionales sanitarios que, aun estando en primera línea de la batalla frente al virus y el contacto con los pacientes, no fueron incluidos en los grupos iniciales de priorización de la vacunación.
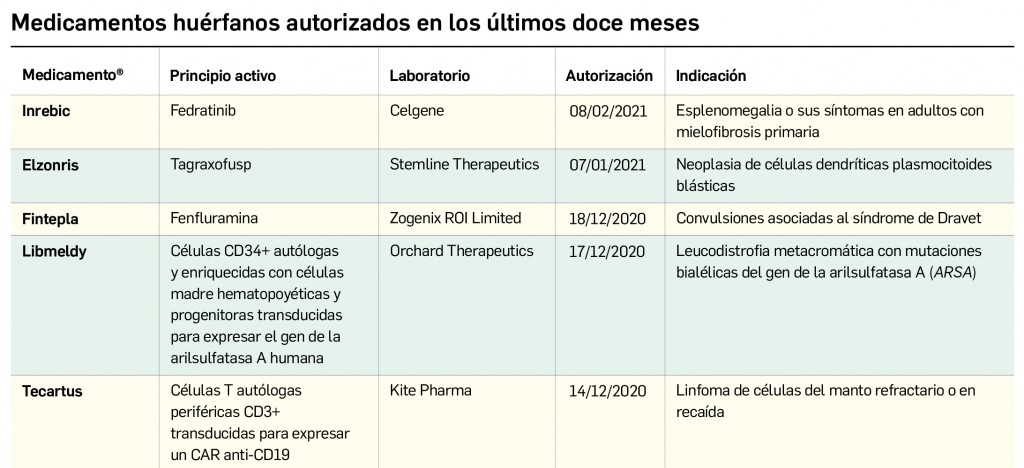
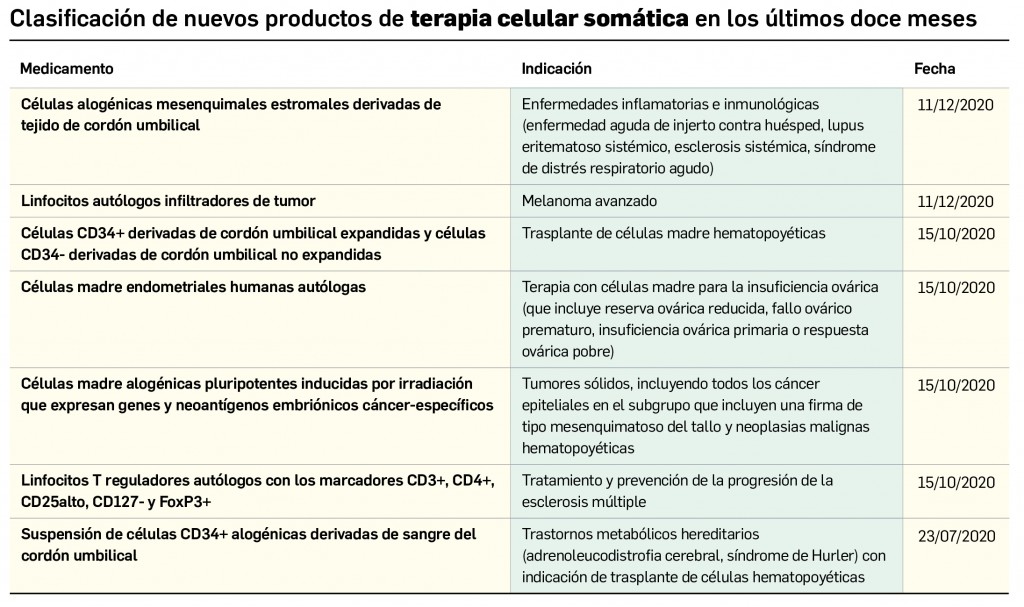
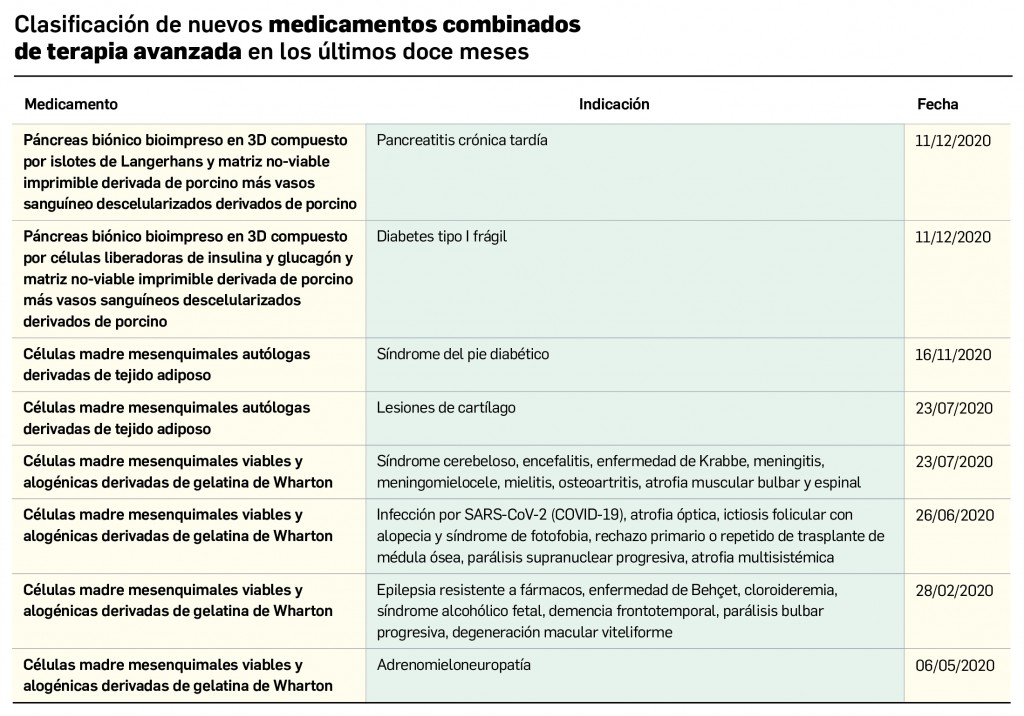
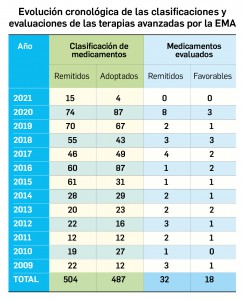
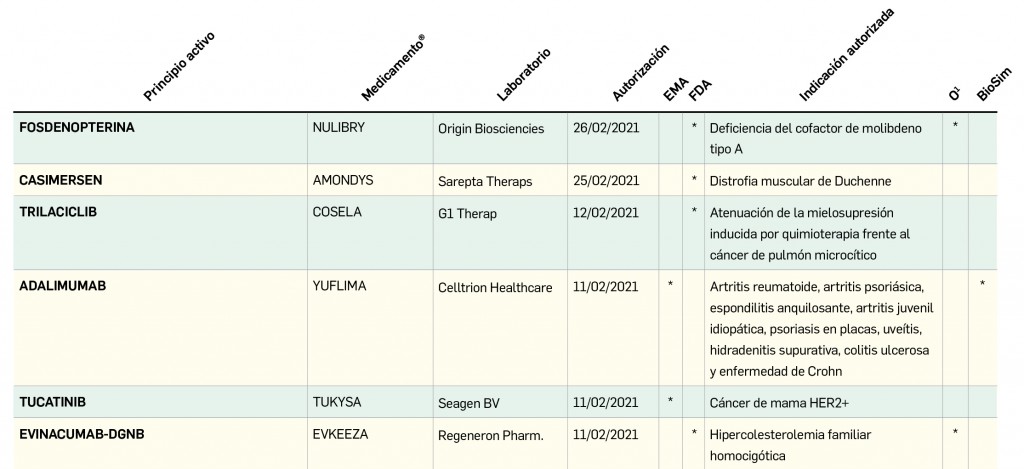
Pero no solo las novedades farmacoterapéuticas se limitan a la COVID-19. De hecho, lo que va de año 2021 está siendo un periodo muy prolífico desde el punto de vista de la innovación farmacológica, con la comercialización de hasta 11 principios activos nuevos solo en el primer trimestre. Entre ellos es destacable otro gran hito de la investigación en España, como ha sido la autorización de uso concedida en el mes de febrero por la AEMPS al hospital Clinic de Barcelona para la fabricación y administración del medicamento de terapia avanzada ARI-0001 en el tratamiento de la leucemia linfoblástica aguda en recaída o refractaria: se trata de la segunda autorización de este tipo concedida en nuestro país que profundiza en la evolución de los medicamentos CAR-T como un campo tremendamente prometedor de la medicina personalizada. De este medicamento se hablará detenidamente en el próximo número, pero por ahora se incluyen en éste la evaluación de otros tres principios activos antitumorales nuevos –apalutamida y darolutamida en cáncer de próstata y lorlatinib en cáncer de pulmón no microcítico– que, aunque comportan un menor grado de innovación, contribuyen a ampliar el arsenal terapéutico antineoplásico. Se siguen dando pequeños pasos en la progresión del abordaje del cáncer.
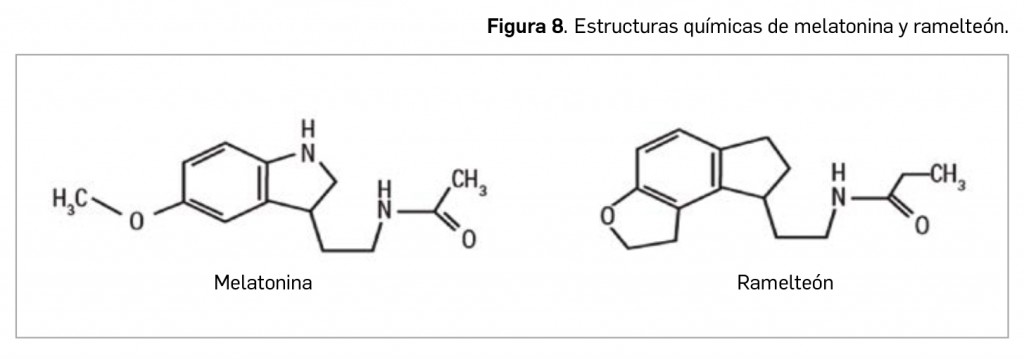
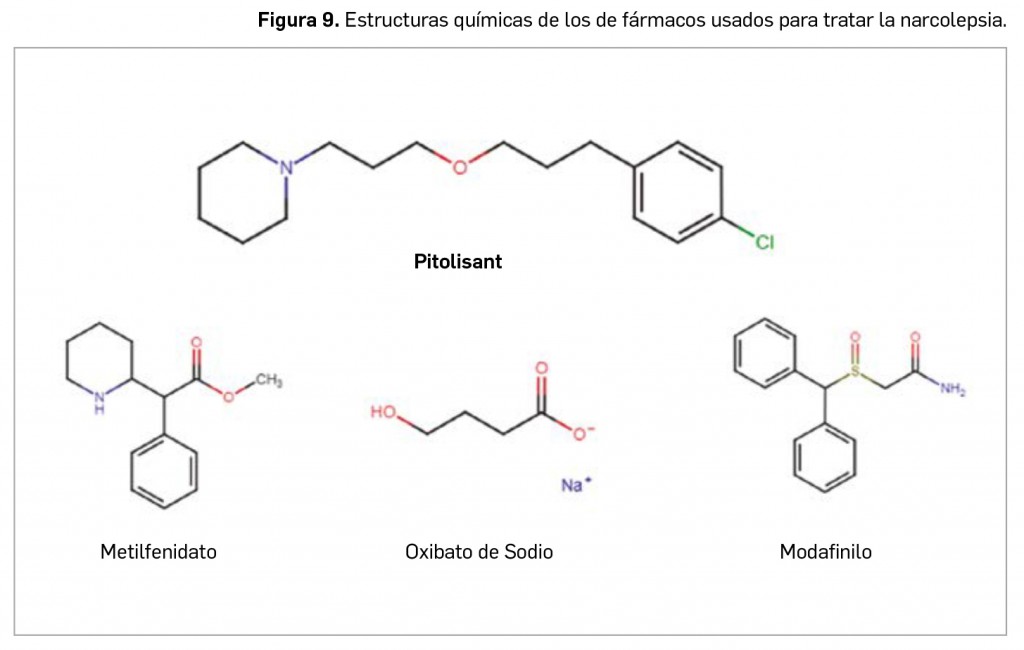
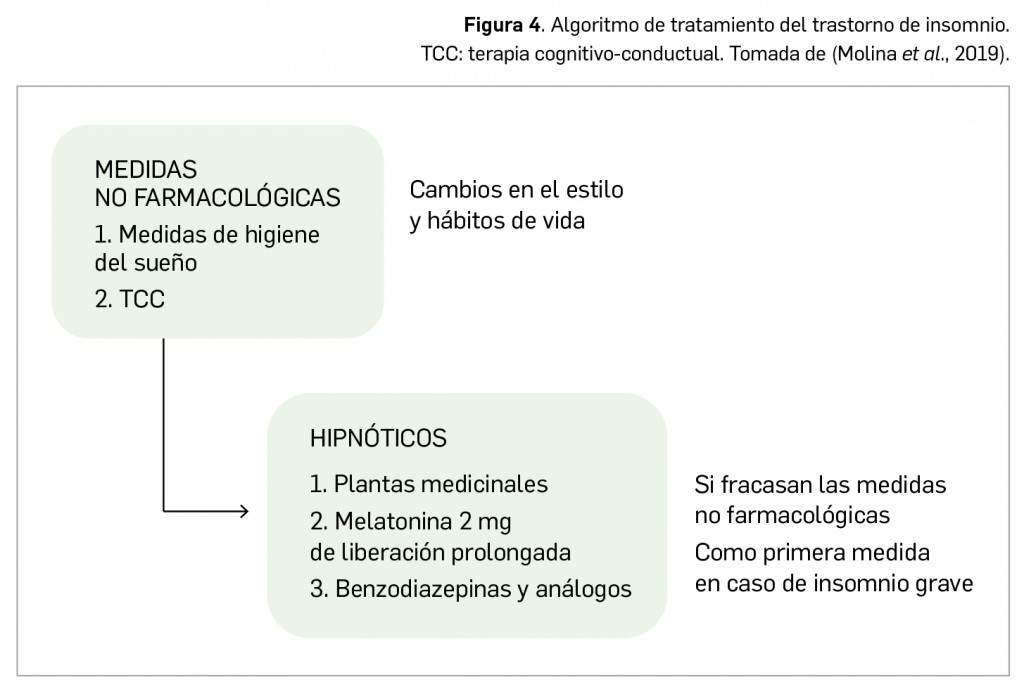
Otros contenidos de interés que pueden encontrar en estas páginas incluyen el artículo monográfico de apertura, que versa sobre dos de los trastornos del sueño más popularmente conocidos y de gran carga sociosanitaria, como el insomnio y la narcolepsia, revisando el arsenal terapéutico disponibles para su abordaje. Se complementa esa sección Revisión con un artículo que aborda, desde un prisma clínico de atención primaria, las patologías del nervio óptico.
Con el deseo de que pronto podamos escribir aquí que las vacunas han permitido alcanzar el tan ansiado objetivo de erradicación de la pandemia por COVID-19, os animamos a descubrir el resto de contenidos y os deseamos una agradable lectura. Un afectuoso saludo.



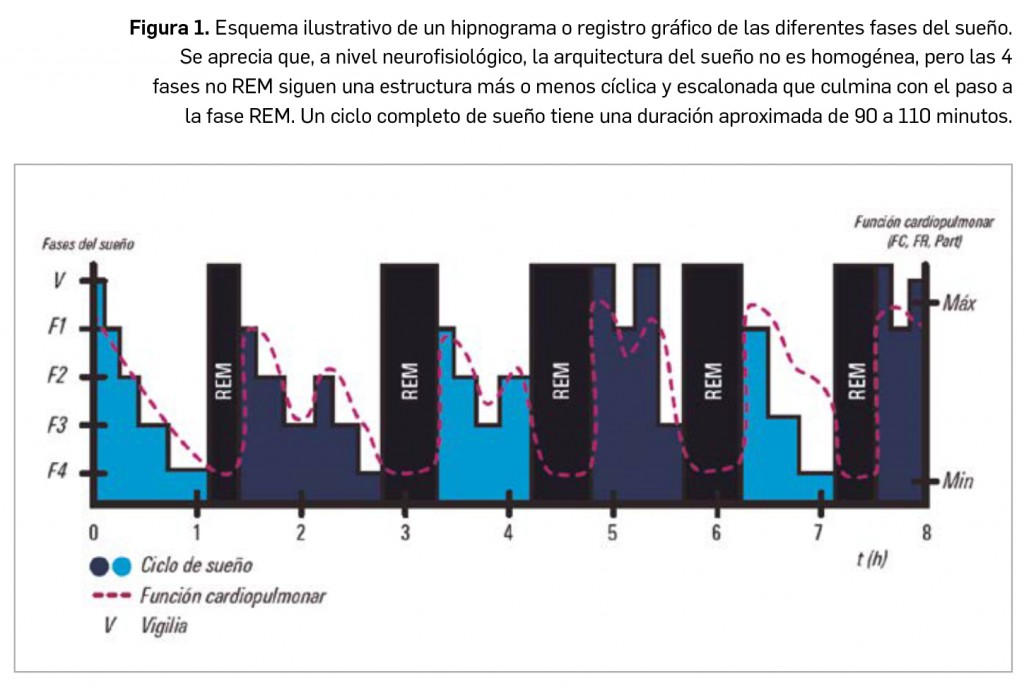
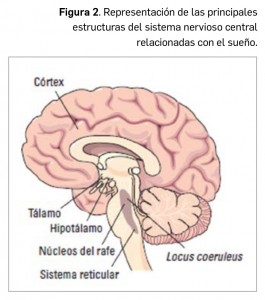 histaminérgica y colinérgica están aumentadas y disminuyen progresivamente durante la fase de sueño no REM. En cambio, durante el sueño REM las actividades noradrenérgica, histaminérgica y serotoninérgica se encuentran muy reducidas, mientras que el tono colinérgico se mantiene alto. Asimismo, las neuronas del área ventrolateral posterior del núcleo preóptico ejercen una acción inhibitoria mediada por el GABA y la galanina, ejerciendo como “activadoras del sueño”, y se proyectan a las regiones del hipotálamo posterior, como el núcleo tuberomamilar, activado por la histamina, el área perifornical, región responsable de la síntesis de hipocretinas u orexinas, y el tronco cerebral. Las hipocretinas son neuropéptidos de naturaleza excitatoria sintetizados por neuronas del hipotálamo lateral y posterior que presentan amplias proyecciones en el SNC (locus coeruleus, núcleos del rafe, área tegmental ventral, etc.) y actúan sobre receptores específicos –Hcrt-1 y Hcrt-2–; parecen cumplir un destacado papel en la etiopatogenia de ciertos trastornos del sueño, como la narcolepsia.
histaminérgica y colinérgica están aumentadas y disminuyen progresivamente durante la fase de sueño no REM. En cambio, durante el sueño REM las actividades noradrenérgica, histaminérgica y serotoninérgica se encuentran muy reducidas, mientras que el tono colinérgico se mantiene alto. Asimismo, las neuronas del área ventrolateral posterior del núcleo preóptico ejercen una acción inhibitoria mediada por el GABA y la galanina, ejerciendo como “activadoras del sueño”, y se proyectan a las regiones del hipotálamo posterior, como el núcleo tuberomamilar, activado por la histamina, el área perifornical, región responsable de la síntesis de hipocretinas u orexinas, y el tronco cerebral. Las hipocretinas son neuropéptidos de naturaleza excitatoria sintetizados por neuronas del hipotálamo lateral y posterior que presentan amplias proyecciones en el SNC (locus coeruleus, núcleos del rafe, área tegmental ventral, etc.) y actúan sobre receptores específicos –Hcrt-1 y Hcrt-2–; parecen cumplir un destacado papel en la etiopatogenia de ciertos trastornos del sueño, como la narcolepsia.

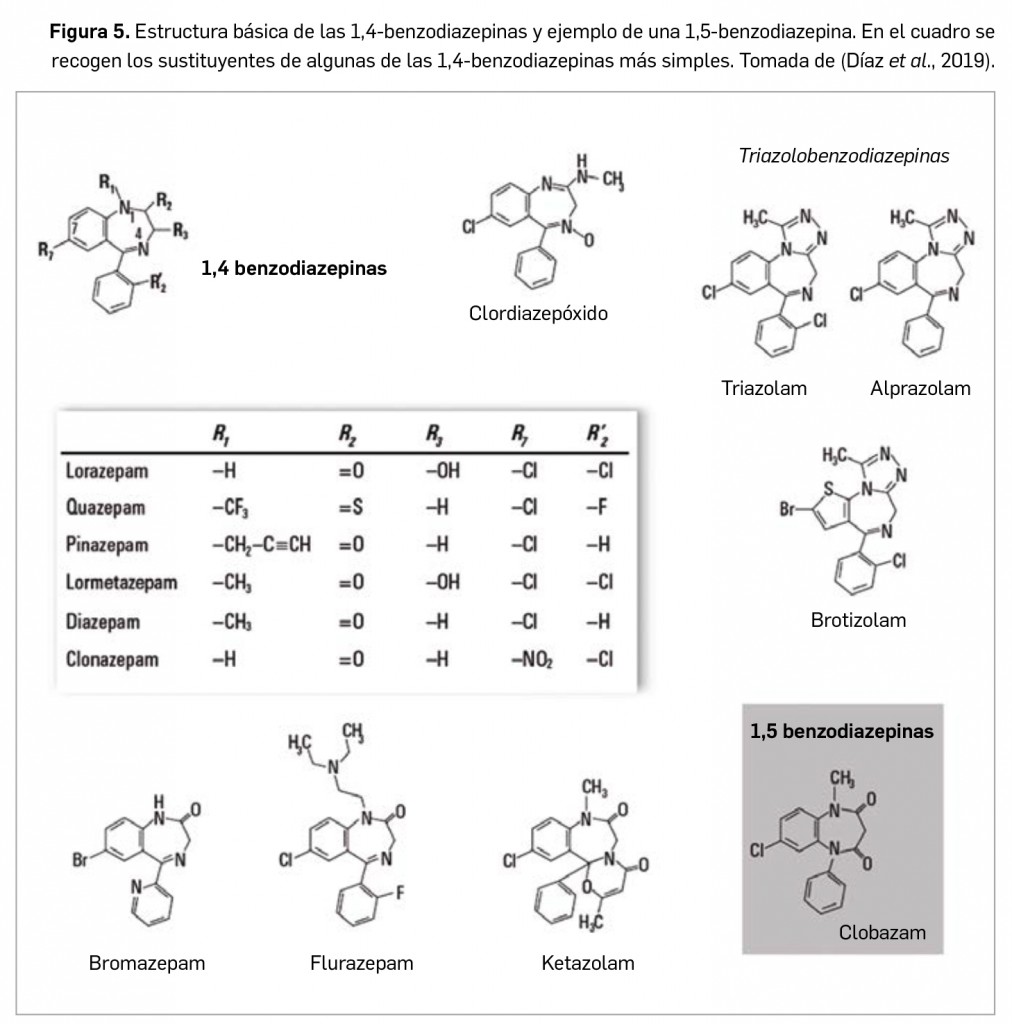
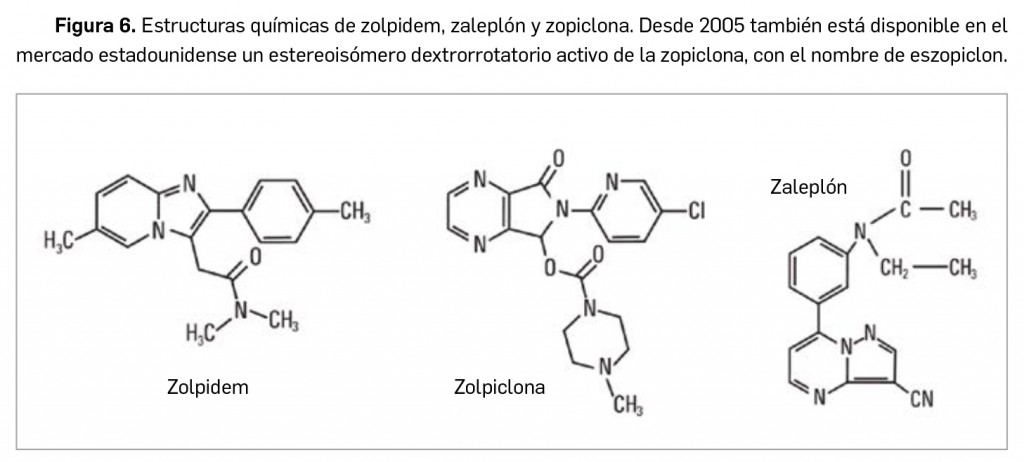
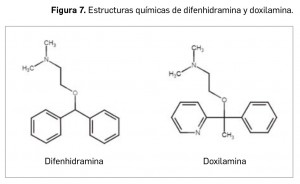 Conviene hacer una llamada de atención al curioso hecho que en la historia de la farmacología cuenta ya con varios ejemplos: un efecto adverso común –como es la somnolencia– de algunos fármacos utilizados originalmente para el tratamiento de otras patologías (las manifestaciones alérgicas en el caso de los antihistamínicos anti-H1) ha permitido reconducirlos hacia una indicación diferente. Es más, la identificación de esa reacción adversa estimuló el desarrollo de antihistamínicos incapaces de atravesar la barrera hematoencefálica a fin de evitarla en el tratamiento antialérgico.
Conviene hacer una llamada de atención al curioso hecho que en la historia de la farmacología cuenta ya con varios ejemplos: un efecto adverso común –como es la somnolencia– de algunos fármacos utilizados originalmente para el tratamiento de otras patologías (las manifestaciones alérgicas en el caso de los antihistamínicos anti-H1) ha permitido reconducirlos hacia una indicación diferente. Es más, la identificación de esa reacción adversa estimuló el desarrollo de antihistamínicos incapaces de atravesar la barrera hematoencefálica a fin de evitarla en el tratamiento antialérgico.