Archive
Revista PAM: 437
Número 437, Octubre 2020
Estadísticas de altas y bajas, composición, precio y características de medicamentos
Medicamentos con nuevos principios activos o biosimilares
COMERCIALIZADOS EN ESPAÑA EN LOS ÚLTIMOS DOCE MESES
_______________________________________________________________________________________________
Valoración de la innovación terapéutica en PAM
Es importante indicar que se valora el grado de innovación. Todos los medicamentos, sean innovadores o no, tienen utilidad terapéutica, en tanto que su autorización por las autoridades sanitarias implica que han demostrado rigurosamente su eficacia, su seguridad, su calidad y las condiciones de uso (incluyendo la información contenida en la ficha técnica – sumario de características – y en el prospecto del medicamento). Por tanto, la valoración que se hace se refiere a la incorporación, en el grado que se determine, de algún elemento innovador con respecto a otros medicamentos autorizados previamente para iguales o similares indicaciones terapéuticas o, en su caso, cubriendo la ausencia de éstas.
Asimismo, debe considerarse que ésta es una evaluación que se practica coincidiendo con la comercialización inicial del medicamento. Se trata, por consiguiente, de una valoración provisional de la innovación realizada en función de la evidencia clínica disponible hasta el momento, lo que no prejuzga, en ningún caso, la disponibilidad posterior de nuevas evidencias científicas (de eficacia o de seguridad) en la indicación autorizada o el potencial desarrollo y autorización, en su caso, de nuevas indicaciones terapéuticas o la imposición de restricciones de uso en las anteriores.
Se consideran tres posibles niveles, adjudicados en función de la relevancia de la(s) innovación(es) presentes en el nuevo medicamento, siempre en relación al arsenal terapéutico disponible clínicamente en España en el momento de la comercialización:
- SIN INNOVACIÓN (*). No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas.
- INNOVACIÓN MODERADA (**). Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar.
- INNOVACIÓN IMPORTANTE (***). Aportación sustancial a la terapéutica estándar.
Se distinguen dos niveles de evidencia científica para los aspectos innovadores de los nuevos medicamentos:
- Evidencia clínica: mediante estudios controlados, específicamente diseñados y desarrollados para demostrar la eficacia y la seguridad del nuevo medicamento, con demostración fehaciente de lo que puede ser un avance o mejora sobre la terapia estándar hasta ese momento, en el que caso de que exista.
- Plausibilidad científica (potencialidad): existencia de aspectos en el medicamento que teórica y racionalmente podrían mejorar la terapéutica actual, pero que no han sido adecuadamente demostrados mediante ensayos clínicos, bien por motivos éticos o bien por imposibilidad de realización en el momento de la comercialización del nuevo medicamento: perfil de interacciones, mecanismos nuevos que permiten nuevas vías terapéuticas, nuevos perfiles bioquímicos frente a mecanismos de resistencia microbiana, posibilidad de combinar con otros medicamentos para la misma indicación terapéutica, efectos sobre el cumplimiento terapéutico (por mejoras en la vía, número de administraciones diarias, etc.), mejora de la eficiencia económica, etc.
El rigor de los datos contrastados mediante ensayos clínicos controlados (evidencia clínica) es determinante en la valoración de la innovación, mientras que las potencialidades solo pueden ser valoradas accesoriamente, como aspectos complementarios de esta valoración. En ningún caso, un medicamento es valorado con un nivel de innovación importante en función de sus ventajas potenciales, si no aporta otras ventajas demostradas clínicamente. Se analizan cinco aspectos de la innovación: clínica, molecular, toxicológica, físico-química y económico-tecnológica. Como ya se ha indicado, la fundamental y determinante es la novedad clínica.
Doravirina (▼Pifeltro®) en infección por VIH
Resumen
Doravirina es un nuevo inhibidor de la enzima transcriptasa inversa del VIH-1 de tipo no nucleosídico (ITINN) que inhibe de forma potente la replicación del virus en la célula hospedadora. Se une específicamente a la enzima viral de forma no competitiva (en una zona cercana pero diferente del centro catalítico de la enzima, usado por los ITIAN) y sin incorporarse a la cadena de ADN viral en formación, pero no inhibe las ADN polimerasas celulares α, ß ni la ADN polimerasa γ mitocondrial del ser humano. En base a ello, el medicamento ha sido autorizado, en combinación con otros medicamentos antirretrovirales, para el tratamiento por vía oral de adultos infectados por el VIH-1 sin evidencia pasada o presente de resistencia a otros ITINN.
Su eficacia ha sido adecuadamente contrastada en pacientes sin tratamiento antirretroviral previo (naïve) mediante dos amplios estudios pivotales de fase 3, controlados y doblemente ciegos. En el primero de ellos, demostró una no inferioridad frente al IP darunavir (potenciado con ritonavir), ambos en combinación con 2 ITIAN, con tasas de pacientes respondedores (< 40 copias de ARN viral/ml) similares a la semana 48 (83% vs. 79%). El segundo estudio reveló que el tratamiento con doravirina/lamivudina/tenofovir ejerce una eficacia pareja a la de otro régimen a base de ITINN (efavirenz/emtricitabina/tenofovir): las tasas de respuesta a la semana 48 fueron, respectivamente, del 84% y 80%. En ambos estudios, el patrón de eficacia se mantuvo constante hasta la semana 96, y se mostró independiente de los parámetros basales típicamente considerados (viremia, recuento de células CD4+ o subtipo viral). Adicionalmente, un tercer ensayo pivotal demostró que la combinación a dosis fija de doravirina, lamivudina y tenofovir es también significativamente eficaz en pacientes virológicamente suprimidos y sin antecedentes de fracaso virológico ni de mutaciones de resistencia a dichos fármacos, con independencia del TAR previo; de manera interesante, ningún paciente desarrolló resistencias al régimen con doravirina.
Por otro lado, el perfil toxicológico de doravirina es aceptable, con buena tolerabilidad, y similar o mejor que el de darunavir potenciado y el de efavirenz, con una baja tasa de interrupción del tratamiento por eventos adversos (~3%, vs. 6% con regímenes con efavirenz). Entre las reacciones adversas relacionadas con doravirina, por lo general escasas y leves, sobresalen las náuseas (4%) y la cefalea (3%). Tiene un perfil lipídico neutro e insignificante efecto sobre los niveles de bilirrubina, asociándose con un menor riesgo de eventos neuropsiquiátricos y rash cutáneo que efavirenz, y con una menor tasa de eventos gastrointestinales que darunavir.
En definitiva, doravirina ha demostrado que, en combinación con 2 ITIAN, aporta un beneficio clínico relevante y similar al del IP darunavir y al del ITINN efavirenz en pacientes naïve sin antecedentes de resistencia viral a fármacos de su clase, presentando, además, una buena tolerabilidad que mejora el perfil de los antirretrovirales usados como comparadores activos. Por superar algunas limitaciones de los ITINN hasta ahora disponibles, puede ser el fármaco de elección dentro de su grupo, en caso de que se decida un TAR de inicio a base de 2 ITIANN más 1 ITINN. Sin embargo, parece que el beneficio clínico que pueda aportar la doravirina no supera, con la evidencia hasta ahora disponible (y a pesar de que no se han realizado comparaciones directas), al de los antirretrovirales preferidos en el TAR de inicio (los INI), ni supone ninguna innovación a nivel mecanístico. A expensas de las consideraciones del IPT de la AEMPS, se puede concluir que doravirina se posicionará en regímenes de TAR alternativos a los de primera línea, sin implicar una innovación sustancial frente a las opciones ya disponibles para pacientes con infección por VIH-1 sin tratamiento previo. No se empleará, por ahora, en regímenes de cambio de TAR tras un fracaso virológico ni en pacientes con virus resistentes a ITINN.
Aspectos fisiopatológicos
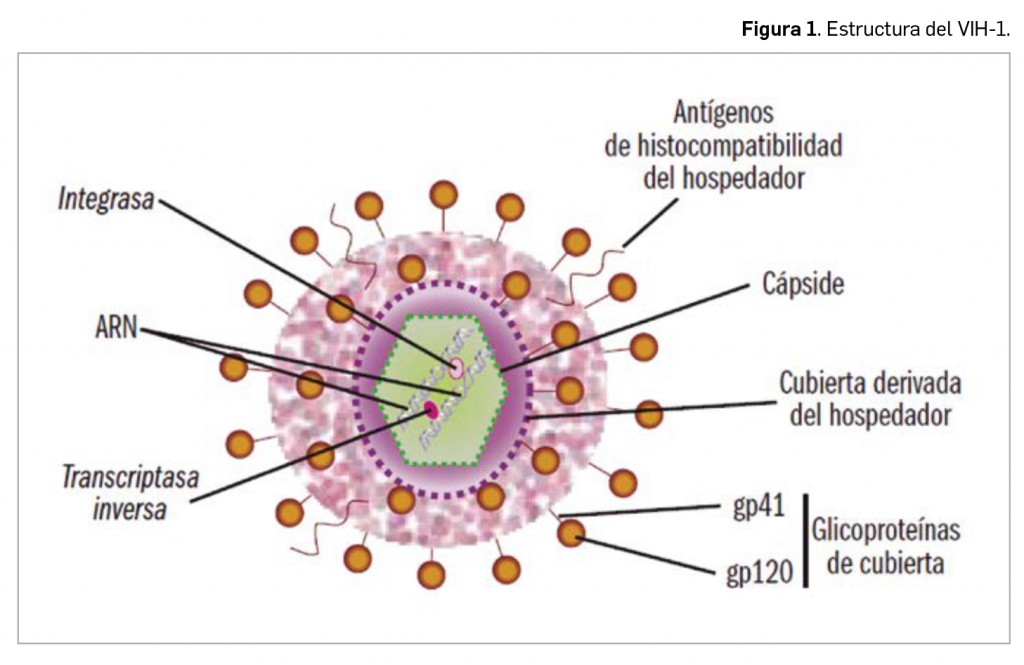
El virus de la inmunodeficiencia humana (VIH) es un retrovirus o virus de ARN monocatenario retrotranscrito (ssRNA-RT, single-stranded RNA virus reverse transcriptase) que forma parte de los lentivirus (familia Retroviridae, género Lentivirus), una subfamilia cuyo nombre alude a la forma insidiosa –lenta e inicialmente desapercibida– en que se desarrolla su infección; sin embargo, el VIH tiene una cinética de replicación muy agresiva, y muy diferente a la que suelen presentar los lentivirus. Su genoma se compone de dos copias idénticas de cadenas de ARN que dependen para su replicación en la célula huésped de una enzima denominada transcriptasa inversa o retrotranscriptasa, que da lugar mediante el proceso de retrotranscripción a un ADN provisional que a menudo se inserta en el genoma del hospedador por la acción de la integrasa viral, una ADN polimerasa dependiente de ARN.
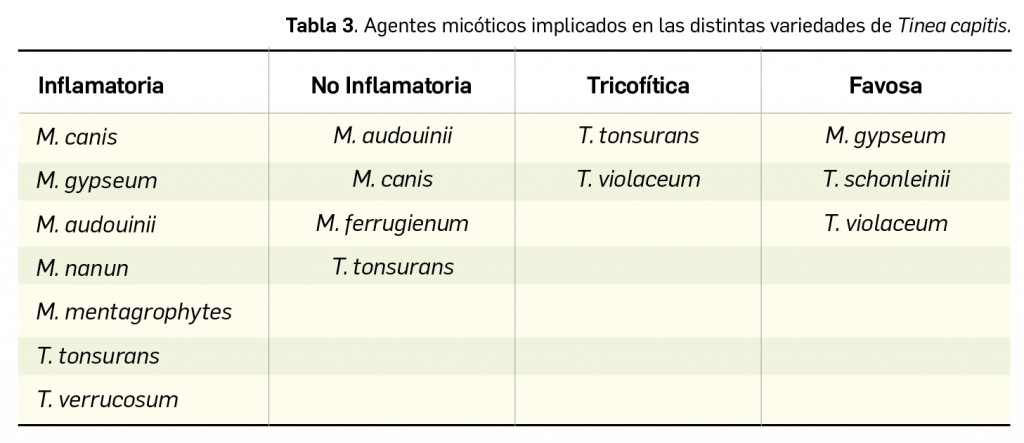
Los VIH son virus de geometría esférica, con un diámetro medio aproximado de 100 nm (Figura 1). La capa más externa o cubierta está formada por una membrana lipídica derivada de la célula hospedadora, con un alto contenido en lipoproteínas. En dicha membrana se insertan antígenos de histocompatibilidad (HLA) del hospedador, que le permitirán una primera unión a la célula hospedadora y multitud de complejos heterodiméricos de glucoproteínas, compuestos por trímeros de la glicoproteína de superficie gp120 y de la glicoproteína transmembrana gp41. Por debajo de la membrana lipídica se encuentra la matriz proteica, formada por la proteína p17, que recubre a la cápsula o cápside propiamente dicha, constituida por la proteína p24. En el interior de la cápside se encuentran el material genético –dos hebras idénticas de ARN monocatenario–, la nucleoproteína y algunas enzimas (entre otras, la transcriptasa inversa y la integrasa). El tamaño del genoma del VIH es inferior a 10.000 nucleótidos y contiene varios genes: 3 genes principales (gag, pol y env) que codifican, cada uno, varias proteínas (estructurales, enzimas y glicoproteínas de la cubierta viral, respectivamente) y varios genes que codifican proteínas reguladoras (tat, rev, vif, vpu, nef y vpx). Con la participación de todos esos elementos, el virus se apodera de la maquinaria celular y silencia la replicación de numerosos genes celulares en favor de la replicación de los propios.
Hasta ahora se han descrito 2 tipos de VIH: VIH-1, derivado del virus de la inmunodeficiencia de los simios de los chimpancés, y el VIH-2, que se originó a partir del retrovirus que infecta a los primates denominados mangabeys grises. La muestra de suero más antigua en la que se comprobó la presencia del VIH‐1 data de 1959, aunque el estudio de la evolución de la epidemia desde su introducción en Tailandia (1986‐1987) lleva a los investigadores a estimar que la infección en humanos se inició entre 1910 y 1950, probablemente alrededor de 1930. En 1983 se identificó el primer tipo de VIH (VIH‐1) y, en 1986, el segundo tipo (VIH‐2).
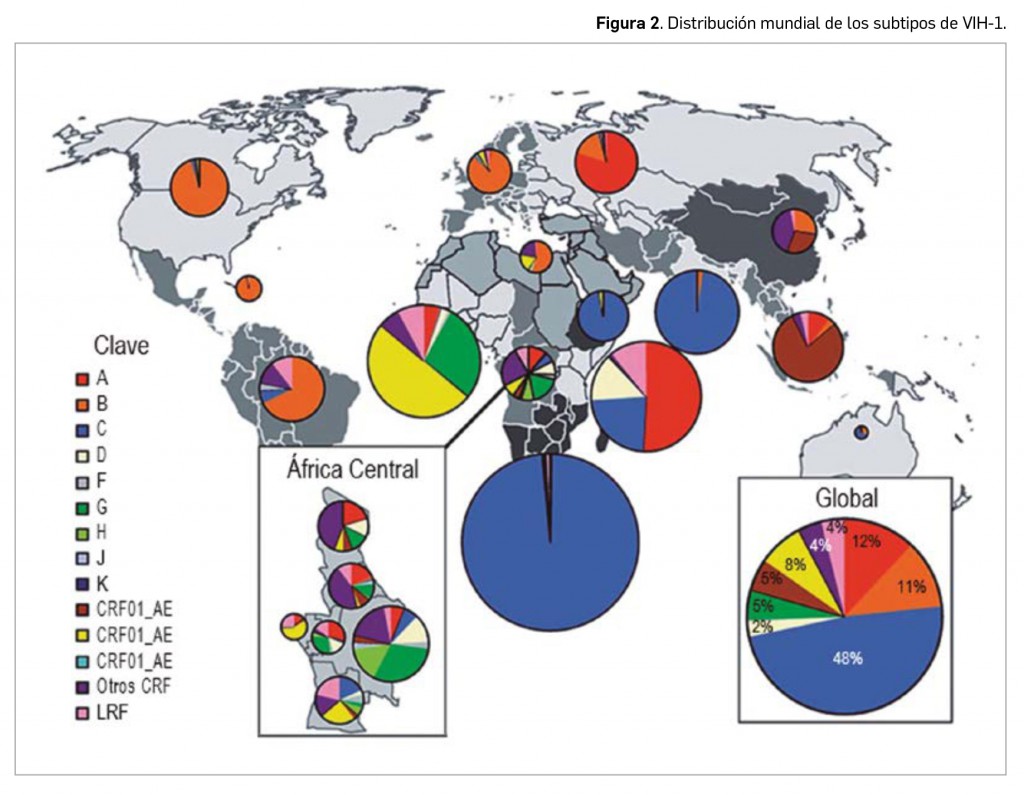
Los virus VIH se encuentran mayoritariamente localizados en individuos de diversos países de África Occidental, donde se distribuyen principalmente los primates portadores, y áreas con lazos históricos como Portugal y la India. Tanto el VIH-1, el más prevalente y distribuido a nivel mundial, como el VIH-2 son capaces de evolucionar a SIDA (síndrome de inmunodeficiencia adquirida) sin tratamiento. Dentro de cada uno de esos dos grandes grupos de VIH, se han descrito numerosos subtipos, algunos de los cuales han evolucionado mayoritariamente de forma pandémica (Figura 2). La gran variabilidad que presenta el virus VIH es uno de los mayores inconvenientes para conseguir un tratamiento eficaz.
De hecho, la tipificación del VIH resulta muy relevante en cuanto al pronóstico y al tratamiento de la infección, ya que los diferentes subtipos presentan características biológicas diferentes que pueden condicionar su patogenicidad, su capacidad de transmisión y su resistencia o sensibilidad a los antirretrovirales. Así, las cepas del grupo O del VIH-1 son naturalmente resistentes a inhibidores de la transcriptasa inversa no análogos de los nucleósidos; en los distintos subgrupos del grupo M, algunas cepas del subtipo G son menos sensibles in vitro a inhibidores de la proteasa; y algunas mutaciones que condicionan la resistencia a inhibidores de la transcriptasa inversa no nucleósidos son más frecuentes, por ejemplo, en el subgrupo C que en el B.
El VIH-2, por su parte, no es sensible a los inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITINN) y, para algunos subtipos, la determinación de carga viral (criterio fundamental en el manejo actual de la infección por el VIH) puede dar resultados falsamente negativos.
El VIH es un microorganismo extraordinariamente sensible al medio, no puede sobrevivir fuera del torrente sanguíneo o del tejido linfático y es muy sensible a las altas temperaturas y a la desecación (aunque el ARN es detectable en sangre seca durante 4-5 días, no es infeccioso), y a pH alcalinos o ácidos. Por ello, la transmisión del VIH entre personas ha de producirse a través de algún fluido biológico en el que pueda sobrevivir el VIH, fundamentalmente la sangre y algunas secreciones (vaginal, espermática, etc.), que entre en íntimo contacto con estructuras potencialmente receptoras, como los vasos sanguíneos, o pequeñas erosiones en la piel o las mucosas. Las principales vías de transmisión del VIH son la sexual, la parenteral y la vertical (madre-hijo), siendo la vía sexual la que origina más del 80% de los contagios a nivel mundial.
El VIH presenta tropismo por los macrófagos y los linfocitos T CD4+. Las células infectadas por el VIH pueden transferir el virus a las células del sistema inmune local, presentes en el epitelio vaginal o en la mucosa anorrectal. En el caso de las relaciones heterosexuales, el primer tejido en ser infectado es la mucosa cervical, donde pueden infectarse las células dendríticas y los linfocitos T CD4+. La proporción de linfocitos T CD4+ infectados en sangre periférica es mínima (1-10%), pero su capacidad de producir viriones es muy alta y, a partir de éstos, la infección puede difundirse hacia los nódulos linfáticos regionales y, posteriormente, ser distribuida por todo el organismo a través del torrente circulatorio. Una vez en los nódulos linfáticos se produce una intensa replicación del VIH, que en unos casos provoca la lisis de las células infectadas, pero en otros queda como una infección latente en los macrófagos y los linfocitos T en reposo. Estos últimos actúan como “reservorios naturales” del VIH y dificultan notablemente la respuesta inmunológica del organismo y, en la misma medida, la adopción de medidas terapéuticas eficaces desde el mismo inicio de la infección. Solo una pequeña proporción de los linfocitos infectados (1%) replica activamente el VIH en un determinado momento, permaneciendo latente en la inmensa mayoría de ellos. Aún no se conoce bien de qué forma estas células con infección latente pasan a la replicación activa, pero los factores implicados en este proceso podrían constituir nuevas dianas terapéuticas, ya que el virus latente carece de efectos patológicos.
La primoinfección por el VIH‐1 es sintomática en más de la mitad de los casos, pero generalmente puede pasar desapercibida ya que sus síntomas son los de una virosis común, como un resfriado o una gripe. Los síntomas y signos más comunes son fiebre, odinofagia, adenopatías de predominio laterocervical, mialgias, exantema, sudoración nocturna y artralgias; algunos pacientes pueden tener un cuadro similar al de la mononucleosis infecciosa. Apenas 10-12 días después del contagio ya se puede detectar el ARN viral en la sangre, lo que implica que el paciente está en condiciones de contagiar a otra persona. Tras la primera replicación después de la infección, la carga viral puede llegar a alcanzar valores de hasta 100 millones de copias por ml de sangre. Esta elevada viremia provoca una rápida reacción del sistema inmunitario.
La respuesta inmunitaria frente al VIH-1 se produce tanto en la vertiente humoral (con una intensa producción de anticuerpos contra las proteínas reguladoras y estructurales, así como producción de complemento e interferones) como en la celular (activación de poblaciones linfocitarias T colaboradoras, citotóxicas y de estirpe NK o natural killer). Inicialmente, se produce una intensa expansión clonal de linfocitos CD8+ con actividad citotóxica, dirigida frente a diversas proteínas del VIH-1, y que originan una cierta supresión de la replicación del VIH y una drástica disminución de la viremia, pudiendo incluso hacerse indetectable en la sangre (generalmente, < 50 copias de ARN/ml de sangre). Entre 3 y 5 semanas después de la infección (media de 28 días), aparecen anticuerpos, lo que determina la seroconversión, ya que a partir de ese momento el paciente se transforma en seropositivo. Aunque la potente respuesta antiviral llega a contener la replicación vírica, es incapaz de erradicar el virus del organismo.
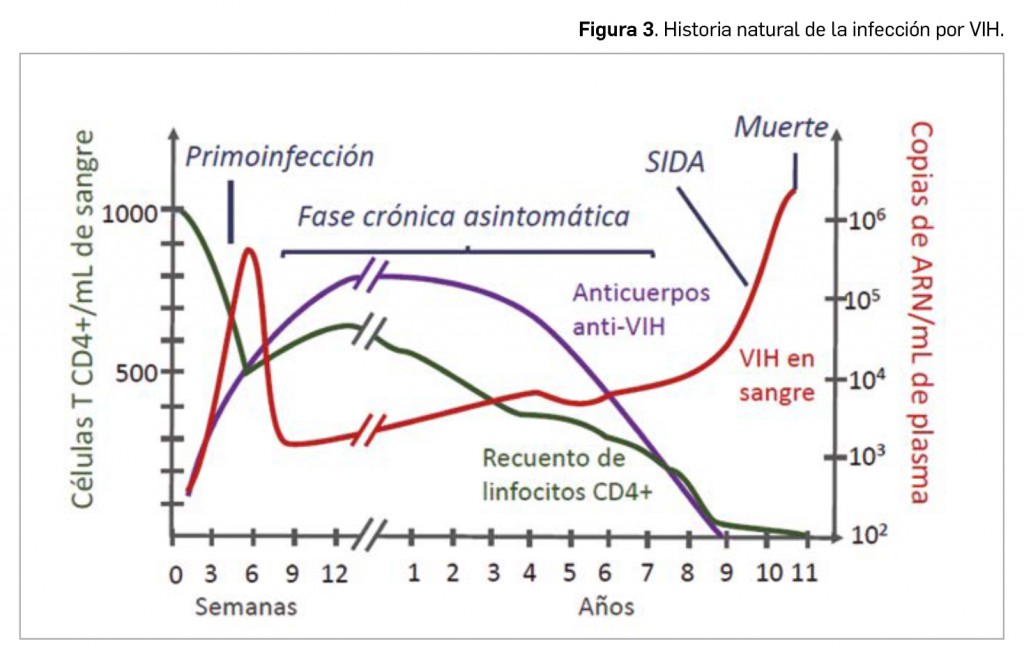
A la fase aguda de la infección le sigue una fase asintomática (fase crónica no SIDA) de duración variable pero raramente inferior a 18 meses, durante la que el virus continúa replicándose masivamente en diferentes compartimentos orgánicos, siendo solo parcialmente controlado por la activación constante de la respuesta inmunitaria natural del organismo; esto provoca un estado inflamatorio de carácter crónico que puede mantenerse por largos periodos de tiempo (Figura 3). El pronóstico y la evolución de la infección dependerán del equilibrio entre la virulencia del virus y la respuesta inmunológica del huésped.
En la gran mayoría de pacientes infectados1, a lo largo del periodo asintomático se produce un deterioro progresivo del tejido linfoide, con reducción del recuento de linfocitos T CD4+, fruto de la replicación viral y del estado inflamatorio crónico. Al ocupar un lugar preeminente en la organización y la activación del sistema inmunitario, la caída brusca de las células CD4+ origina un deterioro funcional de otras poblaciones celulares y se reduce la eficacia de dicho sistema: disminuyen los niveles de anticuerpos anti-VIH y se vuelve a elevar significativamente la carga viral, cuya difusión se generaliza por todo el organismo. En estos estadios finales de la enfermedad, la fase de SIDA propiamente dicha viene definida a partir de un contaje del número de linfocitos T CD4+ < 200 células/ml de sangre o por la asociación de cualquier manifestación grave independientemente del recuento celular.
En esta fase, se magnifica el riesgo de nuevas infecciones o la reactivación de infecciones latentes, siendo frecuentes las infecciones oportunistas y también ciertas patologías malignas, como ciertos tumores, asociados todos a la inmunodeficiencia provocada por el VIH. Los microorganismos oportunistas más frecuentemente causantes de infecciones son varias especies de Mycobacterium (M. tuberculosis, complejo avium-intracellulare, etc.), Pneumocystis jiroveci (antes P. carinii), Candida albicans, Herpes simple y zóster, Citomegalovirus, Criptosporidium, Giardia, Isospora, etc. A día de hoy, la tuberculosis continúa siendo la principal causa de muerte entre las personas que viven con el VIH (responsable de 1 de cada 3 muertes relacionadas con el SIDA), seguida de neumonía y candidiasis. En cuanto a las neoplasias emergentes como consecuencia del fracaso inmunológico, las más comunes son el sarcoma de Kaposi y ciertos linfomas. No es infrecuente el desarrollo de una encefalopatía progresiva inducida por el VIH, que consigue infectar células de la microglía.
La progresión de la infección a SIDA es más rápida en los pacientes inicialmente sintomáticos y se asocia a diversos factores, como la gravedad de la sintomatología en la infección aguda (mayor riesgo a mayor número de síntomas), grado del descenso inicial del número de linfocitos CD4+ (mayor riesgo si el contaje es < a 500 células/µl), nivel de la carga viral plasmática basal o a partir del 4º mes (mayor progresión si es > 100.000 copias/ml), la cuantía de ADN proviral inicial, la infección por más de un virus VIH‐1 y el perfil genético de los individuos infectados. En ausencia de tratamiento, se estima que la mediana de supervivencia de los pacientes con infección por VIH avanzada (recuento de linfocitos CD4+ < 50 células/µl) es de 12 a 18 meses, y el tiempo medio de evolución natural transcurrido entre la primoinfección y la muerte del paciente se sitúa sobre los 11 años.
Epidemiología
Según los datos publicados por la OMS en 2018, referentes a las cifras epidemiológicas del año 2017, en todo el mundo viven infectadas con el virus VIH un total de 36,9 millones de personas de todos los rangos de edades (incluyendo 1,8 millones de niños menores de 15 años). De todos ellos, casi tres cuartas partes de los casos se ubican en el continente africano (25,7 millones), especialmente en África Subsahariana, región en que la tasa media de prevalencia del VIH se aproxima al 4,7% y alcanza el 25% en algunos países, mientras que en Europa viven “solo” 2,3 millones de infectados, lo que evidencia la desigualdad en la prevalencia de la infección por zonas geográficas. El Caribe tiene la segunda tasa de prevalencia de VIH más alta del mundo, donde más del 50% de población infectada se encuentra en Haití. La prevalencia general en Asia es baja (con una tasa cercana al 0,6%), aunque en el Sudeste Asiático se estiman unos 3,5 millones de personas infectadas, de los que más de la mitad de casos (2,1 millones) se localizan en la India. El total de personas en el mundo que han contraído el virus desde el inicio de la epidemia se sitúa en 77,3 millones.
Sin embargo, la epidemia se ha estabilizado o está mostrando signos de recesión. Así, la incidencia de la infección continúa en descenso, habiéndose reportado un significativo descenso desde los 3,4 millones de nuevos casos a nivel global en 1996 hasta las 1,8 millones de nuevas infecciones en 2017. La mayoría de nuevos casos se concentraron en las poblaciones de riesgo, esto es, mujeres en el continente africano, hombres homosexuales, prostitutas o drogadictos. Es también importante destacar que el número de muertes anuales debidas a enfermedades relacionadas con el SIDA en personas infectadas también se ha reducido en más de la mitad, desde el pico de 1,9 millones en 2004 hasta las 940.000 defunciones en 2017. En el registro histórico, este dato eleva a 35,4 millones las muertes producidas por enfermedades relacionadas con el SIDA desde el comienzo de la epidemia.
El informe de Vigilancia Epidemiológica del VIH y SIDA publicado en 20192 (referente a datos epidemiológicos correspondientes al año 2018) indica que, en España, viven entre 140/145.000 personas con VIH, de las cuales alrededor del 18% desconocen que están infectadas por el virus. En 2018, se diagnosticaron 3.244 nuevos casos (tasa final de 8,65 por 100.000 habitantes); el 37,6% de los nuevos diagnósticos se realizó en personas nacidas fuera de España. De los nuevos casos, el 85,3% de nuevos casos eran hombres y la mediana de edad fue de 36 años, el 47,6% presentaba diagnóstico tardío (que se considera cuando hay presencia de una cifra < 350 células CD4+/μl); la vía de transmisión más frecuente fue la sexual en hombres homosexuales. Desde el inicio de la epidemia en España en 1981, se han notificado un total de 88.135 casos de SIDA. Tras alcanzar su cénit a mediados de la década de los 90, el número de casos notificados ha experimentado un progresivo declive desde 1996 hasta 2018, por la generalización de la terapia antirretroviral. Sin embargo, la proporción de casos de SIDA en personas cuyo país de origen no es España ha ido subiendo progresivamente, afectando principalmente a personas originarias de Latinoamérica y África Subsahariana.
Tratamiento antirretroviral (TAR)
Mientras no se disponga de fármacos con capacidad para erradicar definitivamente el VIH (como ha ocurrido ya con el virus de la hepatitis C), el objetivo fundamental del TAR es suprimir la replicación del VIH para mantener la carga viral plasmática (CVP) en niveles indetectables –el estándar terapéutico es una CVP < 50 copias de ARN por mililitro de sangre– durante el máximo tiempo posible. Esto persigue restaurar la función inmunitaria y limitar el desarrollo de resistencias virales, que revierta en la reducción de la morbi-mortalidad asociada, mejorando la calidad de vida del paciente para que su esperanza de vida se aproxime a la de la población general (lo cual actualmente se consigue), así como en la prevención de la transmisión del VIH.
La última versión del Documento de Consenso GeSIDA/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (Martínez et al., 2019) establece, en base a diversos estudios observacionales y a dos grandes ensayos clínicos, que el TAR debe iniciarse en todos los pacientes con infección por VIH-1 confirmada, con o sin sintomatología, independientemente del número de linfocitos T CD4+ y del valor de la CVP, si bien estos parámetros sí deben determinarse previamente. El inicio precoz del TAR se relaciona con una menor frecuencia de transmisión del VIH y de nuevas infecciones, y con una menor incidencia de manifestaciones clínicas debidas a infecciones o procesos tumorales. Es fundamental recordar que, una vez iniciado, el TAR debe administrarse por tiempo indefinido, reevaluando periódicamente (dependiendo de comorbilidades, riesgo de interacciones y resistencias, mala adherencia, etc.) la pauta farmacológica administrada a partir de los 6 meses, cuando la infección pasa a ser crónica.
Los fármacos antirretrovirales disponibles actualmente se enmarcan en 5 clases:
1. Inhibidores de la transcriptasa inversa
a. Inhibidores de la transcriptasa inversa análogos de nucleósidos o de nucleótidos (ITIAN): fue el primer grupo disponible de fármacos activos contra VIH. Los primeros eran análogos de los nucleótidos naturales (ITIAN, inhibidores de la transcriptasa inversa análogos de nucléosidos o nucleótidos), con capacidad de impedir la síntesis de ADN viral a partir de la cadena de ARN infectante. Actúan como finalizadores de cadena: la transcriptasa inversa los incorpora como eslabones en la cadena de ADN en formación, pero es incapaz de unir a ellos el eslabón siguiente. Obstaculizan así la incorporación del ADN viral a la dotación genética de la célula infectada. La zidovudina fue el primer medicamento antirretroviral, es el más experimentado y se considera la base del tratamiento. Como consideración muy general, hay dos perfiles distintos de efectos adversos dentro del grupo: a) la zidovudina y (con menor intensidad) la lamivudina tienen toxicidad hematológica (anemia y neutropenia) y gastrointestinal (náuseas); la emtricitabina presenta un marcado parecido con la lamivudina, estructural, farmacológico y clínico; b) por su parte, didanosina y estavudina presentan, en grados diferentes, riesgo de neuropatía periférica y pancreatitis. Además, abacavir produce reacciones hipersensibilidad potencialmente fatales en un 3% de los pacientes, asociados con la presencia del alelo HLA-B*5701. El tenofovir fue el primero de una subclase de los ITIAN, los derivados nucleotídicos (a diferencia de los nucleosídicos), que presenta la peculiaridad de acortar el proceso bioquímico intracelular de fosforilación (un paso imprescindible para la activación farmacológica de estos principios activos), además de facilitar su paso a través de las membranas celulares. Tenofovir está comercializado en 2 formulaciones diferentes: tenofovir disoproxilo y tenofovir alafenamida.
b. Inhibidores de la transcriptasa inversa no nucleósidos (ITINN): Su estructura química está muy alejada a la de los ITIAN. Los fármacos de este grupo que están actualmente disponibles son nevirapina, efavirenz, etravirina y rilpivirina. No parecen presentar resistencia cruzada con los derivados nucleosídicos (zidovudina, especialmente), aunque la resistencia frente a la nevirapina aparece de forma relativamente rápida, salvo que se utilice asociada con otros antirretrovirales (2 es el número mínimo recomendado). Los ITINN se unen al enzima en una zona relacionada aunque diferente de la utilizada por los ITIAN, por lo que son capaces de evitar la aparición de resistencias asociadas a mutaciones de esa zona de fijación.
2. Inhibidores de la proteasa (IP): interfieren en una etapa vital en el ensamblaje de nuevos viriones y la diseminación del virus. Al inhibir la aspartil proteasa viral, impiden su acción catalítica sobre las cadenas precursoras de muchas proteínas esenciales para el VIH (incluyendo la transcriptasa inversa, la propia proteasa y varias proteínas estructurales), de manera que el virus no es capaz de producir las proteínas funcionales y se liberarán partículas víricas no infectantes. Los inhibidores de la proteasa imitan la estructura química de los puntos de la cadena peptídica donde el enzima produce los cortes, bloqueando así su acción. Su potencia antiviral es, grosso modo, superior a la de los inhibidores de la transcriptasa inversa, siendo también muy susceptibles a las resistencias debidas a mutaciones, pero con las ventajas de no precisar activación del fármaco en el interior de la célula infectada y de presentar actividad frente a la mayoría de cepas de VIH-1 y también de VIH-2. A día de hoy, están disponibles en España: atazanavir, darunavir, indinavir, lopinavir, fosamprenavir, ritonavir, saquinavir y tipranavir. Salvo indinavir (prácticamente en desuso) y ritonavir, todos ellos se emplean en clínica potenciados con ritonavir o cobicistat.
3. Inhibidores de la integrasa (INI): la integrasa es un enzima codificado por el virus que facilita la integración del genoma del VIH en el genoma de la célula huésped (linfocitos T), en un proceso que es indispensable para la replicación viral: una vez integrado el ADN viral, la maquinaria celular llevará a cabo la duplicación del ADN. Estos fármacos inhiben el tercero de los cuatro pasos del proceso de integración catalizados por el enzima (la transferencia de hebras). Hasta hace poco, los INI comercializados en España eran 3: raltegravir, elvitegravir y dolutegravir. En julio de 2018, tras completar los ensayos confirmatorios, se ha autorizó el bictegravir en formulación conjunta con emtricitabina y tenofovir alafenamida, de muy reciente comercialización. Todos ellos presentan una estructura pseudo-peptídica que emula químicamente una fracción proteica y así son capaces de actuar de señuelo bioquímico para bloquear la integrasa del VIH.
4. Inhibidores de la fusión (IF). La enfuvirtida es el único fármaco autorizado de este grupo, y actúa inhibiendo el proceso en que la cubierta viral se funde con la membrana de los linfocitos, bloqueando así la penetración del VIH-1 en los linfocitos T CD4+. El mecanismo específico transcurre a través de la asociación con la subunidad glicoprotéica gp41 del VIH-1, de forma que impide el cambio conformacional requerido en ésta para fusionarse con la membrana de los linfocitos. Como consecuencia de su mecanismo de acción, enfuvirtida no es activa frente al VIH-2. Su relativamente frecuente toxicidad (evidenciada, sobre todo, por pérdida de peso y neuropatía periférica) y su complejidad de administración –al tratarse de un péptido, no es absorbible por vía oral y debe administrarse por vía subcutánea– restringen su empleo al TAR de rescate avanzado a pacientes sin otras posibilidades terapéuticas.
5. Inhibidores del co-receptor CCR5. Maraviroc es el único fármaco comercializado en España que actúa inhibiendo el co-receptor humano de quimiocinas CCR5, impidiendo con ello la penetración del VIH con tropismo CCR5 (virus R5). Maraviroc carece de actividad frente a VIH con tropismo CXCR4 (virus X4) o con tropismo dual CCR5/CXCR4. Estos co-receptores son requeridos, junto con el CD4, para facilitar la unión de la membrana celular con la cápside del VIH y, en consecuencia, la penetración del contenido del virus en el citoplasma de la célula infectada.
Las cepas que infectan a monocitos y macrófagos, que son las primeras seleccionadas por el VIH, son R5 o monocitotropas; después el virus evoluciona cambiando su tropismo hacia un tropismo CXC4 (X4), que son las que infectan preferentemente a los linfocitos. Maraviroc se une a la región proteica del co-receptor CCR5 exterior a la membrana, provocando un cambio estable de su conformación y haciéndola inasequible para las quimiocinas del VIH: se trata de una forma de inhibición alostérica no competitiva. Así, el VIH con tropismo CCR5 no es capaz de actuar sobre tal co-receptor, impidiendo la unión del VIH a la célula y, consecuentemente, la infección por el virus. Su principal ventaja es que no presenta resistencia cruzada con otros antirretrovirales, por lo que se recomienda limitar la administración maraviroc exclusivamente en TAR de rescate en pacientes con cepas multirresistentes de VIH-1 que sean R5-trópicas.
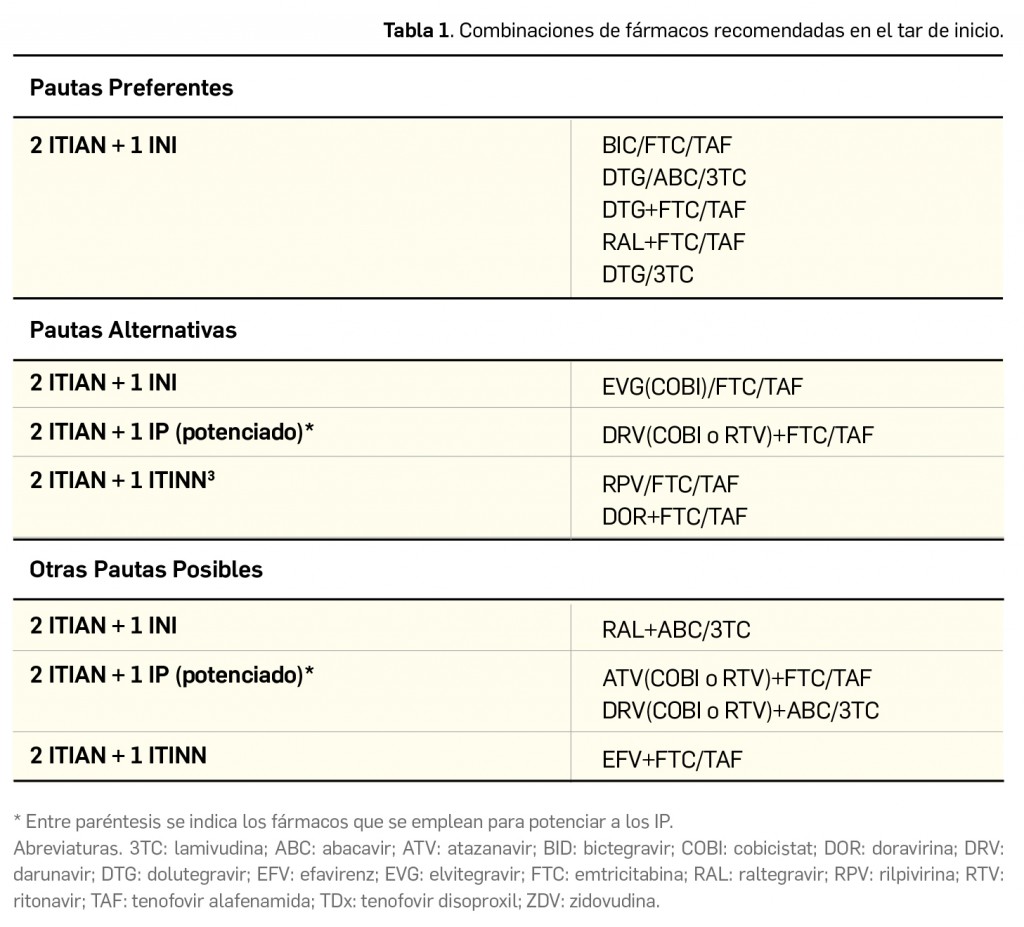
A día de hoy, la elección preferente para el TAR de inicio se basa en combinaciones de, al menos, 3 fármacos (Tabla 1). El uso combinado de fármacos limita la supervivencia de cepas resistente, pero su uso inadecuado puede limitar el uso de algunas alternativas. Aunque se han estudiado combinaciones eficaces con menor número de fármacos, las autoridades sanitarias no las han autorizado aún como TAR de inicio.
Para seleccionar una u otra familia de fármacos se valorarán las ventajas que aportan: el potencial de interacciones farmacológicas (menor en los INI, seguido de ITINN y mayor en los IP), la mayor barrera genética frente a resistencias (en los IP), y el menor coste (de los ITINN). Una pauta con dos ITIAN (preferentemente tenofovir/emtricitabina) y un INI (raltegravir) puede tener la ventaja de una mayor concentración en las secreciones genitales para reducir más rápidamente la CVP durante las primeras 4‐8 semanas en comparación con los IP o ITINN, facilitando la reducción de los contagios por vía sexual. Si no se dispone del resultado del estudio de mutaciones de resistencia es preferible comenzar con una pauta basada en un IP potenciado (que presentan actividad frente a la mayoría de cepas VIH-1) hasta tener los resultados. No se recomiendan como tratamientos de inicio pautas libres de ITIAN ni monoterapia con IP potenciados.
Las combinaciones de tres fármacos (2 ITIAN + 1 INI o 1 ITINN o 1 IP potenciado) previamente indicadas constituyen también el tratamiento de inicio de elección de la infección crónica por VIH, referida al periodo de más de 6 meses tras la primoinfección. En este periodo de la infección, rige igualmente la recomendación principal de iniciar el tratamiento en todos los pacientes diagnosticados de VIH-1, presenten o no sintomatología, e independientemente del recuento de linfocitos T CD4+ y la determinación de CVP.
Debe tenerse presente que la aparición de resistencias es un fenómeno inevitable y su detección por métodos genotípicos es muy útil en casos de fracaso virológico, orientando a la prescripción de terapias de rescate. Diversas circunstancias, incluyendo el fracaso virológico (motivado en muchos casos por la acumulación de resistencias virales), obligan a un cambio proactivo del TAR, si bien no se recomienda suspender el TAR en pacientes con fracaso virológico avanzado y sin opciones terapéuticas de rescate (Fernández-Moriano, 2018).
Acción y mecanismo
Doravirina es un potente inhibidor de la transcriptasa inversa del VIH-1 de tipo no nucleosídico (ITINN) que inhibe la replicación del virus en la célula hospedadora. Se unirá a la enzima en una zona relacionada pero diferente de las usadas por los ITIAN, actuando por unión no competitiva en un lugar cercano al centro catalítico de la enzima, pero sin incorporarse a la cadena de ADN viral en formación (a partir del ARN infectante) y sin necesidad de ser fosforilado para su activación. En cambio, no inhibe las ADN polimerasas celulares α, ß ni la ADN polimerasa γ mitocondrial del ser humano. En base a ello, el medicamento ha sido autorizado, en combinación con otros medicamentos antirretrovirales, para el tratamiento de adultos infectados por el VIH-1 sin evidencia pasada o presente de resistencia a otros ITINN.
En los ensayos preclínicos, el fármaco ha mostrado un valor de CE50 (concentración eficaz que inhibe la replicación viral en un 50%) de 12,0 ± 4,4 nM frente a cepas de laboratorio naturales (o wild type) del VIH 1, exhibiendo una menor actividad inhibitoria frente a cepas mutantes del virus (CE50 en el rango de 21-55 nM para mutantes como K103N, Y181C, G190A, y K103N/Y181C). En otros cultivos celulares, se ha mostrado activo frente a una amplia variedad de subtipos virales (A, A1, AE, AG, B, BF, C, D, G, H) con valores de CE50 comprendidos entre 1,2 y 10,0 nM, siendo además esta actividad sinérgica –o, al menos, no antagonista– en combinación con los demás ITINN (efavirenz, etravirina, nevirapina o rilpivirina), los ITIAN (abacavir, didanosina, emtricitabina, lamivudina, estavudina, tenofovir disoproxilo o zidovudina), los IP darunavir o indinavir, el inhibidor de la fusión enfuvirtida, el antagonista del correceptor CCR5 maraviroc o el INI raltegravir.
No obstante, se identificaron algunas de las cepas de VIH-1 resistentes –in vitro– a doravirina, las cuales pertenecen a distintos subtipos y tienen mutaciones en la transcriptasa inversa parcialmente diferentes a las observadas en el fracaso virológico a otros ITINN. Las mutaciones emergentes relacionadas con la resistencia al efecto del nuevo fármaco implicaban sustituciones aminoacídicas en posición 106 (V106A, V106M, V106I) –siendo éstas las que más frecuentemente aparecían como mutaciones iniciales–, en posición 227 (F227L, F227C, F227V) y en otras posiciones (V108I, H221Y, M230I, L234I, P236L e Y318F); sin embargo, no se seleccionaron otras mutaciones de resistencia a ITINN frecuentes (K103N, Y181C), lo que indica que la reducción de la susceptibilidad de la enzima no es muy pronunciada con esas mutaciones.
Hay que subrayar que la eficacia clínica de doravirina en pacientes naïve (no tratados previamente) solo se ha evaluado en ausencia de resistencias a otros ITINN, habida cuenta de que pacientes cuyo VIH presentaba una mutación de las incluidas en el listado oficial de la IAS (International Antiviral Society) estadounidense eran excluidos. Por ello, no se ha establecido definitivamente una resistencia cruzada a doravirina que se asocie con una menor eficacia clínica, si bien se han identificado cepas clínicas del VIH-1 con una disminución notable de la sensibilidad a doravirina de > 100 veces, específicamente las que contenían la sustitución Y188L o sustituciones de V106 en combinación con A98G, H221Y, P225H, F227C o Y318F. Las evidencias clínicas sugieren, además, que las sustituciones emergentes relacionadas con resistencia a doravirina pueden conferir resistencia cruzada a efavirenz, rilpivirina, nevirapina y etravirina.
Aspectos moleculares
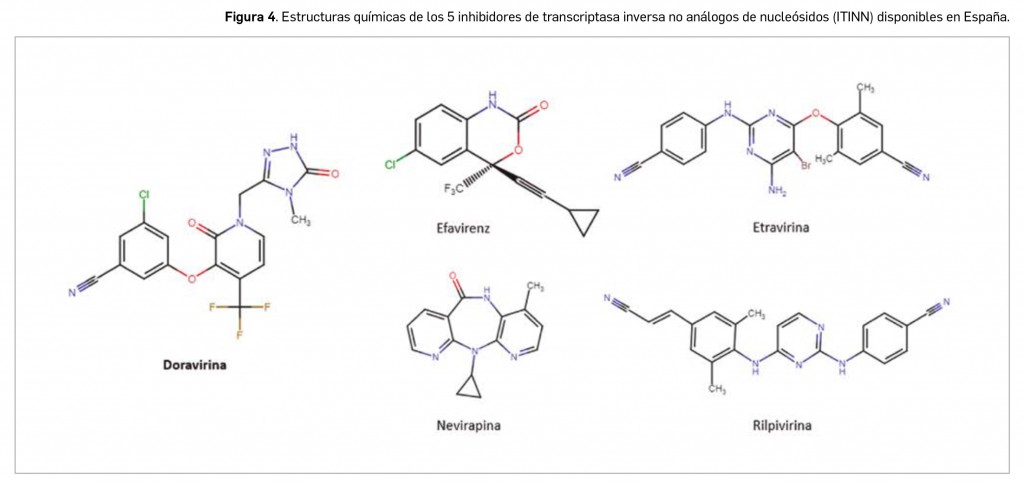
Doravirina es un nuevo inhibidor de la transcriptasa inversa del VIH-1 de tipo no nucleosídico (ITINN). Con una estructura química muy alejada de la de los ITIAN, pero también distante del resto de ITINN comercializados (Figura 4), es un derivado de la piridona con el nombre químico 3-cloro-5-({1-[(4-metil-5-oxo-4,5-dihidro-1H-1,2,4-triazol-3-il)metil]-2-oxo-4-(trifluorometil)-1,2-dihidropiridin-3-il}oxi)benzonitrilo, que se corresponde con una fórmula molecular de C17H11ClF3N5O3 y una masa molecular relativa de 425,75 g/mol. Este compuesto no quiral se presenta como un polvo blanco o blanquecino, no higroscópico y cristalino, prácticamente insoluble en agua.
La compañía que ha desarrollado clínicamente la doravirina también desarrolla en paralelo un medicamento multicomponente, en que doravirina se asocia a dosis fija con tenofovir disoproxilo y lamivudina (Deltrigo®), que aún no está disponible en España.
Eficacia y seguridad clínicas
La eficacia y la seguridad clínicas de doravirina en la indicación autorizada han sido adecuadamente contrastadas mediante tres ensayos clínicos pivotales de fase 3, dos de ellos controlados con comparadores activos realizados en pacientes con infección por VIH-1 no tratados previamente (naïve) y otro abierto llevado a cabo en pacientes virológicamente suprimidos y sin antecedentes de fracaso al tratamiento.
Pacientes naïve
Los dos ensayos pivotales realizados en pacientes sin tratamiento antirretroviral previo fueron controlados, multicéntricos y multinacionales, aleatorizados (1:1) y doblemente ciegos. Ambos evaluaron la eficacia y seguridad de doravirina en combinación con dos ITIAN, y compartieron criterios de inclusión y exclusión de pacientes, a excepción de la lista de mutaciones4 usadas como criterio de exclusión (dependiente de los fármacos incluidos en los brazos de estudio). Así, los pacientes debían de tener una carga viral de ≥ 1.000 copias de ARN/ml y un aclaramiento de creatinina de ≥ 50 ml/min, sin restricciones según el recuento de células CD4+.
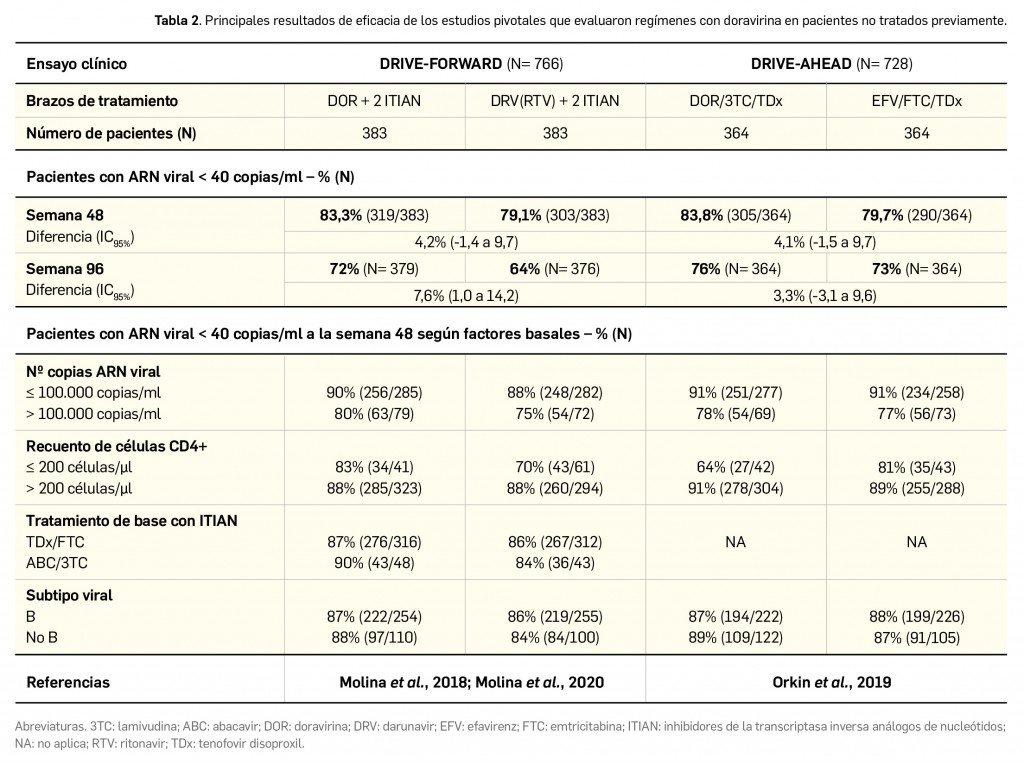
El ensayo DRIVE-FORWARD aleatorizó un total de 766 pacientes, quienes recibieron al menos una dosis de un régimen compuesto por doravirina (100 mg/día) o el comparador activo darunavir/ritonavir (800/100 mg/día), siempre en combinación con 2 ITIAN a elección del investigador, esto es, emtricitabina/tenofovir disoproxilo (lo recibieron el 87% de los pacientes) o abacavir/lamivudina (en el 13% de pacientes). Las características basales de los pacientes estaban bien balanceadas entre los brazos de estudio, destacando que la mediana de edad era de 33 años, una mayoría (84%) eran varones, de raza blanca (73%), un 86% tenía un recuento de linfocitos T CD4+ > 200 células/mm3, un 20% presentaba > 100.000 copias ARN/ml, un 4% tenía coinfección por los virus de la hepatitis B o C y el 10% tenían antecedentes de SIDA. La variable primaria del estudio fue el porcentaje de pacientes que cumplían una carga viral de < 40 copias de ARN/ml a la semana 48.
Por su parte, en el ensayo DRIVE-AHEAD, 728 pacientes fueron asignados al azar a recibir al menos una dosis del régimen experimental doravirina/lamivudina/tenofovir disoproxilo (100/300/245 mg/día) o bien del comparador activo compuesto por efavirenz/emtricitabina/tenofovir disoproxilo. En este caso, con las características también equilibradas entre los grupos de tratamiento (y similares a las de la población del estudio DRIVE-FORWARD), la mediana de edad de los pacientes en el momento basal fue de 31 años, el 85% eran varones, el 48% de raza blanca, el 3% estaba coinfectado con virus de hepatitis B o C, el 14% tenía antecedentes de SIDA, un 21% tenía una carga viral de > 100.000 copias de ARN/ml y el 88% un recuento de linfocitos T CD4+ < 200 células/mm3. Como variable principal se evaluó la seguridad, en términos comparativos con los eventos adversos típicamente derivados de efavirenz (mareo, trastornos del sueño y sensibilidad alterada).
En la siguiente Tabla 2 se muestra un resumen de los principales resultados de eficacia reportados para la población total de los dos estudios citados, tanto a la semana 48 como a la semana 96 (en este punto temporal, algunos pacientes sin datos de viremia fueron excluidos). La eficacia de las pautas a base de doravirina se muestra uniforme entre todas las características demográficas e independiente de los factores pronósticos basales. En esa línea, el EPAR de la EMA (EMA, 2018) refleja que la eficacia de los tratamientos comparados en los estudios era similar entre los distintos subtipos virales y no difería notablemente entre los distintos brazos. Habida cuenta de que el tratamiento antirretroviral es crónico, se ha planificado una extensión de otras 96 semanas para ambos estudios, que aportará datos más sólidos a largo plazo de la eficacia y de la seguridad de los regímenes que contienen doravirina.
Adicionalmente, se realizó un estudio de fase 2b (de hallazgo de dosis óptima), doble ciego y aleatorizado (estudio P007), en pacientes adultos infectados por el VIH-1 y sin tratamiento antirretroviral previo (N= 340). En la primera de sus dos partes, el estudio (N= 210) comparó el tratamiento con doravirina en dosis crecientes de 25-50-100 mg/día con efavirenz de 200 o 600 mg/día, ambos combinados con tenofovir y emtricitabina (estos administrados en tratamiento abierto). Los resultados divulgados (Gatell et al., 2019) demuestran que a la semana 24, la proporción de pacientes con < 40 copias de ARN viral/ml fue del 72,9% con doravirina 100 mg y de 73,1% con efavirenz, lo que prueba la no inferioridad de doravirina en pacientes naïve. Con la incorporación de 132 más pacientes a una segunda fase del estudio (en la que todos recibieron doravirina a la dosis seleccionada de 100 mg/día o efavirenz 600 mg/día), las tasas de pacientes respondedores a la semana 48 eran similares entre ambos grupos de tratamiento (78 vs. 79%); ese patrón se mantenía a la semana 96, aunque con tasas de respondedores más bajas en ambos brazos debido a un mayor número de discontinuaciones.
Pacientes virológicamente suprimidos
La eficacia de TAR con doravirina en pacientes ya tratados eficazmente (con carga viral de < 40 copias de ARN/ml) durante al menos 6 meses con un régimen a base de 2 ITIAN (combinados bien con un IP potenciado, con el INI elvitegravir potenciado o bien con un ITINN) ha sido evaluada en el ensayo DRIVE-SHIFT, un estudio de no-inferioridad de fase 3, abierto y controlado con comparador activo. Dicho estudio aleatorizó un total de 673 pacientes (edad media de 43 años, 84% hombres y 76% de raza blanca) –sin antecedentes de fracaso virológico ni documentación genotípica previa de mutaciones de resistencia5 a doravirina, lamivudina y tenofovir– a cambiar el tratamiento a doravirina/lamivudina/tenofovir disoproxilo al inicio del ensayo (N=447, grupo A) o mantener su pauta inicial hasta la semana 24 y cambiar entonces a dicha pauta con doravirina (N=223, grupo B).
Los resultados del estudio (Johnson et al., 2019) demuestran que un cambio inmediato a doravirina/lamivudina/tenofovir disoproxilo mostraba no-inferioridad en la semana 48 en comparación con la continuación de la pauta posológica inicial hasta la semana 24: en el grupo A, un 90% de pacientes tenía < 40 copias de ARN viral/ml, en comparación con el 93% en el grupo B (diferencia de -3,6%; IC95% -8,0 a 0,9); los resultados fueron muy parecidos (todos en el rango de 89-95% de tasa de respuesta media) con independencia del régimen de TAR recibido previamente por los pacientes, y se observaron resultados coherentes para la comparación en la semana 24 del estudio en cada grupo de tratamiento. La eficacia evidenciada en ambos brazos –en términos de niveles de < 40 copias de ARN viral/ml– fue superior entre pacientes con un mayor recuento basal de linfocitos T CD4+ (≥ 200 células/mm3: 90% en el grupo A y 94% en el grupo B) en comparación con los que presentaban un recuento menor (< 200 células/mm3: 77% en el grupo A y 75% en el grupo B).
Cabe destacar, además, que ningún paciente desarrolló resistencia genotípica o fenotípica al régimen con doravirina en las primeras 48 semanas del estudio, bien cambiaran al inicio o a la semana 24. Asimismo, ninguno de los 24 pacientes incluidos con mutaciones de ITINN iniciales (K103N, G190A o Y181C) experimentó fallo virológico hasta la semana 48 o hasta el momento de la interrupción del tratamiento.
Finalmente, la seguridad clínica de doravirina parece bien definida en base a datos procedentes de 1.657 pacientes con infección por VIH-1 (747 pacientes en los estudios de fase 3) que recibieron al menos una dosis durante su desarrollo clínico, bien del fármaco solo o en asociación con otros antirretrovirales; un total de 667 pacientes han estado expuestos a la dosis autorizada de doravirina durante más de 48 semanas. En base a los datos de los estudios pivotales en pacientes naïve, la EMA considera que el perfil toxicológico de doravirina (con o sin tenofovir/lamivudina) es favorable, y tiene una tolerabilidad comparable o mejor que darunavir (potenciado con ritonavir) y que efavirenz, con mayores tiempos hasta la discontinuación del tratamiento. Así, en un análisis agrupado que combinó los datos de los dos ensayos pivotales, la proporción de pacientes que abandonó el tratamiento por un evento adverso hasta la semana 48 fue significativamente menor en el grupo de tratamiento con doravirina (2,8 %) que en el grupo de tratamiento combinado con efavirenz (6,1 %).
En general, las reacciones adversas posible o probablemente relacionadas con doravirina son escasas y leves, siendo las notificadas con más frecuencia: náuseas (4%) y cefalea (3%); de hecho, el fármaco no se asoció en estudios preclínicos con toxicidad órgano-específica de ningún tipo. En comparación con el TAR a base de efavirenz, que también pertenece al grupo de los ITINN, la doravirina se asoció con una menor tasa de eventos neuropsiquiátricos (23,6% vs. 56,9%, relacionados o no con el tratamiento), un menor riesgo de rash cutáneo (4,7% vs. 12,1%) y un perfil lipídico más favorable (0-0,3% vs. 1,1-1,4% de hipercolesterolemia o hipertrigliceridemia). En la comparación con darunavir (potenciado con ritonavir), doravirina mostró un mejor perfil lipídico (0,3% vs. 1,8% de hipercolesterolemia) y menos eventos adversos gastrointestinales (35,8% vs. 42,3%, relacionados o no con el tratamiento). No obstante, en los brazos de tratamiento con doravirina se notificaron elevaciones ligeras de los niveles de bilirrubina –signo de posible toxicidad hepática– con mayor frecuencia que en los controles (~6% vs. 1,5% con darunavir potenciado y 0% con efavirenz), si bien esto se ha explicado por la muy baja frecuencia de tales eventos con los comparadores (que incluso han mostrado efectos reductores), considerando que el efecto doravirina está en línea con otros antirretrovirales que se asocian con efectos nulos sobre el aclaramiento de bilirrubina (EMA, 2018).
Aspectos innovadores
Doravirina es un nuevo inhibidor de la enzima transcriptasa inversa del VIH-1 de tipo no nucleosídico (ITINN) que inhibe de forma potente la replicación del virus en la célula hospedadora. Se une específicamente a la enzima viral de forma no competitiva (en una zona cercana pero diferente del centro catalítico de la enzima, usado por los ITIAN) y sin incorporarse a la cadena de ADN viral en formación, pero no inhibe las ADN polimerasas celulares α, ß ni la ADN polimerasa γ mitocondrial del ser humano. En base a ello, el medicamento ha sido autorizado, en combinación con otros medicamentos antirretrovirales, para el tratamiento de adultos infectados por el VIH-1 sin evidencia pasada o presente de resistencia a otros ITINN.
La eficacia y seguridad clínicas de doravirina por vía oral han sido sólidamente contrastadas en pacientes sin tratamiento antirretroviral previo (naïve) mediante dos amplios estudios pivotales de fase 3, aleatorizados, controlados y doblemente ciegos, que incluyeron una población de pacientes representativa de la población diana, y con características demográficas y de la enfermedad similares. En el primero de ellos (N= 766), doravirina se comparó frente al inhibidor de la proteasa darunavir (potenciado con ritonavir), ambos en combinación con 2 ITIAN, y demostró una eficacia similar y no inferior al comparador: a la semana 48, la proporción de pacientes con < 40 copias de ARN viral/ml fue del 83% y 79%, respectivamente; esa tendencia se mantuvo a la semana 96 (72% vs. 64%) y fue independiente de la combinación de ITIAN usados de base. El segundo estudio (N= 728) demostró que la combinación de doravirina/lamivudina/tenofovir tampoco es inferior en términos de eficacia a otra combinación de 1 ITINN con 2 ITIANN (efavirenz/emtricitabina/tenofovir): las tasas de pacientes respondedores (< 40 copias de ARN viral/ml) a la semana 48 fueron, respectivamente, del 84% y 80%; de nuevo, ese patrón se mantuvo hasta la semana 96 (76% y 73%). Un ensayo de fase 2b aportó datos adicionales de soporte que respaldan la no inferioridad de doravirina frente a efavirenz, en ese caso comparados de forma directa (ambos coadministrados con los mismos ITIAN de base): a la semana 24, los pacientes de ambos brazos respondieron en igual grado (73%), con una eficacia consistente hasta la semana 96.
Por otra parte, un tercer ensayo pivotal (N= 673), aleatorizado, controlado y abierto, demostró que la combinación a dosis fija de doravirina, lamivudina y tenofovir en régimen de pastilla única es también significativamente eficaz en pacientes virológicamente suprimidos con un régimen de 2 ITIAN más un tercer fármaco y sin antecedentes de fracaso virológico ni de mutaciones de resistencia a doravirina, lamivudina y tenofovir. Así, a la semana 48, el cambio al régimen experimental en el inicio se mostró no inferior respecto al cambio en la semana 24 (90% vs. 94% de pacientes con < 40 copias de ARN viral/ml en ambos brazos), con independencia del TAR previo. De manera interesante, ningún paciente desarrolló resistencias al régimen con doravirina.
Los resultados de los dos estudios en pacientes naïve indican que la no inferioridad de doravirina frente a sus comparadores es independiente de la viremia basal, del recuento de células CD4+ y del subtipo viral. Hay que subrayar que los comparadores empleados son actualmente considerados por la guía de la Sociedad Clínica Europea del SIDA6 (EACS) como opciones recomendadas de TAR de inicio (darunavir/ritonavir) o como regímenes alternativos (efavirenz), de manera que se consideran adecuados por la EMA. El límite de no inferioridad, establecido en el 10%, también se consideró adecuado. La principal limitación de estos ensayos radica en que todas las mutaciones de resistencia frente a ITINN fueron consideradas criterios de exclusión, de manera que la autorización de doravirina se limita a su uso en pacientes sin antecedentes de mutaciones de resistencia a ITINN. De igual modo, no ha sido estudiado en pacientes insatisfactoriamente tratados, por lo que por ahora no se plantea como alternativa ante un fracaso del TAR de inicio.
Con respecto a la seguridad, el perfil toxicológico de doravirina parece aceptable, con buena tolerabilidad, comparable a la de otros antirretrovirales de uso común; es un perfil similar o mejor que el de darunavir potenciado y que el de efavirenz, con una baja tasa de interrupción del tratamiento por eventos adversos (en torno al 3%, vs. 6% con regímenes con efavirenz). Entre las reacciones adversas relacionadas con doravirina, por lo general escasas y leves, sobresalen las náuseas (4%) y la cefalea (3%). Con un perfil lipídico neutro e insignificante efecto sobre los niveles de bilirrubina, se asocia con un menor riesgo de eventos neuropsiquiátricos y rash cutáneo que efavirenz, y con una menor tasa de eventos gastrointestinales que darunavir.
Para posicionar a doravirina en el vasto arsenal terapéutico antirretroviral, conviene recordar antes, según sugería un amplio meta-análisis (Messiaen et al., 2013) y así se recoge en las recomendaciones del documento de consenso de GeSIDA (Martínez et al., 2020), que la adición –a los ITIAN– de un fármaco de la clase de los inhibidores de la integrasa (INI) como tratamiento de primera línea de la infección por VIH da lugar a mejores resultados clínicos que otros grupos como los inhibidores de la proteasa (IP); en especial, si el INI es dolutegravir o bictegravir, ambos de elevada barrera frente a las mutaciones del VIH. Por tanto, se acepta que el llamado standard of care del TAR de inicio está constituido por 2 ITIAN (tenofovir/emtricitabina o abacavir/lamivudina) más un INI (dolutegravir, raltegravir o bictegravir).
Sin haber sido comparado frente a esos INI considerados como opción preferente, doravirina se encuadra en el grupo de los ITINN, cuyo uso actualmente se incluye en las principales guías clínicas como parte de los regímenes alternativos, fundamentalmente por desventajas en términos de tolerabilidad (efectos adversos sobre el sistema nervioso de efavirenz, toxicidad hepática y rash debidos a nevirapina) o eficacia (rilpivirina no se indica en pacientes con alta carga viral ni en coadministración con inhibidores de la bomba de protones, y etravirina requiere dos tomas diarias). Además, en algunas regiones geográficas, las resistencias virales a ITINN han crecido tanto que hacen conveniente la incorporación de nuevos agentes que carezcan de la necesidad de screening de resistencias previo al inicio del TAR.
Doravirina fue desarrollado con el objetivo de superar esas limitaciones de los ITINN ya comercializados. La evidencia disponible apunta a que podría tener una barrera genética en parte superior a efavirenz, lo cual podría favorecerse por sus propiedades farmacocinéticas, entre las que destaca una vida media (~15 h) considerablemente más corta que la de efavirenz o rilpivirina (~40-45 h), que puede contribuir a reducir el riesgo de desarrollo de resistencias en caso de que se detenga el tratamiento (problema a menudo considerado entre los fármacos del grupo). Pero para sacar conclusiones sólidas al respecto, la relevancia clínica de la barrera genética de doravirina aún debe investigarse detalladamente (especialmente en pacientes con antecedentes de resistencia a algún ITINN y en pacientes ineficazmente tratados). Otra relativa ventaja del fármaco es que no requiere potenciador farmacocinético y tiene un reducido riesgo de interacciones farmacológicas, las cuales no parecen ser importantes clínicamente. Por último, la combinación de doravirina con lamivudina y tenofovir en un único medicamento (Delstrigo®) –aún no comercializado en España – puede aportar una mejora en términos de adherencia (considerada la primera causa de fracaso terapéutico del TAR) en comparación con el medicamento monocomponente, al reducir el número de medicamentos que el paciente debe tomar diariamente.
En resumen, doravirina ha demostrado que, en combinación con 2 ITIAN, aporta un beneficio clínico relevante y similar al del IP darunavir (potenciado con ritonavir) y al del ITINN efavirenz en pacientes naïve sin antecedentes de resistencia viral a fármacos de su clase, con una eficacia independiente de los parámetros basales típicamente considerados. Además, presenta una buena tolerabilidad, que mejora el perfil de los antirretrovirales usados como comparadores activos. Por todo ello, puede ser el ITINN de elección en caso de que se decida un TAR de inicio a base de 2 ITIANN más 1 ITINN. Sin embargo, parece que el beneficio clínico que pueda aportar la doravirina no supera, con la evidencia hasta ahora disponible, al de los antirretrovirales preferidos en el TAR de inicio (los INI), ni supone ninguna innovación a nivel mecanístico. A expensas aún de las consideraciones del IPT de la AEMPS, se puede concluir que doravirina se posicionará en regímenes de TAR alternativos a los de primera línea, sin implicar una innovación sustancial frente a las opciones ya disponibles para pacientes con infección por VIH-1 sin tratamiento previo. No se empleará, por ahora, en regímenes de cambio de TAR tras un fracaso virológico.
Valoración
Fármacos relacionados registrados en España
Deontología de los profesionales farmacéuticos en casos de epidemias como la COVID-19
Resumen
El Juramento Hipocrático, dictado por Hipócrates de Cos en el siglo V a.C., sigue vigente a día de hoy en cuanto a lo fundamental de sus preceptos, concerniendo actualmente de forma específica a las profesiones sanitarias –entre ellas, a la profesión farmacéutica–, que los incluyen en sus códigos deontológicos y éticos. Si bien no hace referencia a los deberes de los profesionales de la salud ante casos de catástrofes sanitarias, como la pandemia por COVID-19, los preceptos básicos generales de la deontología han sido suficientes en el contexto actual para que el comportamiento de todos los profesionales sanitarios –y, específicamente, de los farmacéuticos– haya sido en su inmensa mayoría ejemplar y abnegadamente altruista.
El presente artículo revisa los orígenes e implicaciones del Juramento Hipocrático, así como las interpretaciones filosóficas y éticas realizadas por diversos autores, principalmente a lo largo del siglo XX, al respecto de la deontología de los profesionales sanitarios.
Introducción
La COVID-19 es una grave catástrofe, no solo sanitaria sino también económica, de desempleo y de inseguridad respecto a cómo será el futuro una vez la situación sanitaria se haya normalizado o esté estabilizada. Además, ha llegado en pleno cambio de era, determinado por la emergencia de la sociedad digital, la globalización y grandes desajustes culturales, económicos, sociopolíticos y religiosos, ya que para una gran parte de la población las promesas del progreso no se cumplen, al tiempo que hay mucha desorientación moral y sobre el sentido de la existencia.
Todo trabajo es necesario para ganar los medios para vivir, y para realizarse uno mismo. Pero, sin negar que cualquier trabajo como profesión confiere a quien lo realiza la máxima dignidad si se realiza honradamente, hay diferencias fundamentales entre lo que es un trabajo y lo que es una profesión.
Profesión etimológicamente significa declaración de compromiso e históricamente se daba ese calificativo, de “profesionales”, exclusivamente a los médicos, juristas, y a los que “profesaban” en religión y órdenes religiosas. Así, las profesiones sanitarias tienen unas características particulares que desde Hipócrates de Cos, en el siglo V antes de Cristo, con su Juramento, se han ido normalizando y codificando.
En este artículo se demuestra lo siguiente:
- que el Juramento Hipocrático en cuanto a sus preceptos sigue hoy en día, en lo fundamental, totalmente vigente;
- que este Juramento concierne actualmente específicamente a todas las profesiones sanitarias, que lo tienen explícita o implícitamente en la base de sus Códigos de Deontología y Ética; y, por lo tanto, también a la profesión farmacéutica; y
- que la fuerza de los principios de la Deontología sanitaria que se derivan del Juramento Hipocrático es tal que, aún sin estar actualmente codificados los deberes de los profesionales de la salud en casos de catástrofes o de pandemia en los Códigos Deontológicos españoles, los preceptos básicos generales de la deontología sanitaria, y específicamente de la farmacéutica, han sido suficientes en la actual situación de pandemia para que el comportamiento de todos los profesionales sanitarios y, específicamente de los farmacéuticos, que son a los que se refiere este trabajo, haya sido en su inmensa mayoría ejemplar y abnegadamente altruista.
Y es que, como Pellegrino y Thomasma señalan, el “acto profesional” es “una voluntad consciente de decidir asumir las obligaciones necesarias para hacer la declaración auténtica” (Pellegrino et al., 1981), debiéndose recordar que la “Declaración” se refiere a los deberes profesionales.
Motivos por los que los profesionales sanitarios tienen obligaciones deontológicas muy superiores a las de las demás profesiones y trabajos existentes
Como escriben Edmundo Pellegrino (1920-2013) y David C. Thomasma (1939-2002), en “Las virtudes cristianas en la práctica médica” (Pellegrino et al., 2008), toda relación laboral y comercial se puede asimilar a un contrato entre el profesional y quien requiere los servicios de éste. Ahora bien, esta relación, contractual o no, requiere que las partes actúen con autonomía personal, conocimiento, o al menos capacidad de informarse, y libertad de decisión. Pues bien, esto no se da en las profesiones sanitarias ya que lo típico de ellas es que quien pide asistencia lo haga por enfermedad o trastorno que, cuanto más grave, dolorosa e incapacitante, más priva al paciente de su claridad de juicio y libertad de decisión y, aún más, le sume en la ansiedad y angustia. Así, el dolor, la enfermedad y la incapacidad desequilibran la relación entre el médico (farmacéutico/enfermera) y el enfermo. Es más, dado que la confianza en los profesionales sanitarios tiene por sí mismo virtudes tranquilizadoras y terapéuticas, es obvio que el paciente o ciudadano ha de tener fe en ellos.
Hipócrates fue contemporáneo de Sócrates, y en más de uno de los “Diálogos” de Platón se le menciona. Así, en “Fedro”, Sócrates afirma que “después de haber consultado a Hipócrates, es preciso consultar a la razón y ver si ésta está de acuerdo con ella”. También Aristóteles, en “La Política” (capítulo IV, libro séptimo), afirma que “Hipócrates es el más grande”. Hipócrates es el padre de la Medicina científica; de una Medicina que ya se basa en la historia clínica, en la observación y exploración del paciente, y en el estudio de sus signos y síntomas –tales como la fiebre, los derivados del examen de la orina y las heces, y del estudio del ambiente, así como de la investigación de la etiología–, y en el establecimiento del pronóstico. Trata las fracturas, las heridas, las luxaciones, las hemorroides y las fístulas, y amplía recetas de pociones, ungüentos, lavados, cataplasmas y otros, de origen vegetal, mineral y animal. Hipócrates, en el primero de sus “aforismos”, reconoce que “corta es la vida, el arte (médico) extenso, la oportunidad fugaz, las observaciones inciertas, el juicio difícil (…)”.
Hipócrates se enfrenta a una tradición que en gran medida apoyaba la curación en la invocación a “los dioses”, en la oración y en los sacrificios. Además, se enfrenta también a los charlatanes y embaucadores que utilizan fórmulas y remedios secretos, y que afirman que “los demonios” son los causantes de las enfermedades. Es evidente que no es contrario a la religión, pues la impiedad era un delito en su sociedad (por el que Sócrates será condenado a muerte). El propio “Juramento” comienza invocando a los dioses, pero considera que las enfermedades tienen causas, mecanismos y explicaciones naturales, que el médico ha de investigar, desentrañar y procurar corregir.
En lo que se refiere a la “religión” Hipócrates reconoce la relación “cuerpo-alma”, y utiliza, entre otros medios, la técnica del diagnóstico por la “incubación”, que permite el estudio de las sensaciones del enfermo y de sus sueños, que ya se consideraba que eran el lenguaje por el que el cuerpo se comunica con el alma. En el “Régimen”, Hipócrates expone que durante el día el alma está al servicio del cuerpo pero que durante la noche ella se atiende a sí misma y a reparar el funcionamiento del cuerpo. Dice también que “rezar es algo bueno, pero, sin perjuicio de invocar a los dioses, hay que ayudarse a uno mismo”.
Así pues, Hipócrates está decidido a sustituir la medicina religiosa y especulativa por un ejercicio médico rigurosamente basado en la ciencia médica y en la experiencia clínica. Es consciente no solo de sus limitaciones, sino de la relación que los médicos tienen obligatoriamente que respetar entre el progreso científico y la calidad de la relación “espiritual” entre el médico y el enfermo. Incluso compartiría seguramente las palabras de Esquilo en “Agamenón”, que se representó por primera vez en el 458 antes de Cristo, es decir, cuando Hipócrates tenía dos años de edad: “la justicia da el saber a aquellos que han sufrido”.
El juramento hipocrático
El Juramento Hipocrático desde un punto de vista ontológico se mantiene en sus principios rectores plenamente vigente en la actualidad, y por ello, es el primer texto que figura en Código de Deontología Médica del Consejo General de Colegios Oficiales de Médicos de España. Así, por ejemplo, en “El médico interactivo” de 26 de agosto de 2011, se informa de la sesión de la Real Academia de Medicina de Cataluña en la que el académico Josep M. Mascaró resalta la validez actual del Juramento Hipocrático y la similitud que tiene con la “Declaración de Ginebra” de la Asociación Médica Mundial de 1948.
El Juramento Hipocrático desde un punto de vista ontológico
Un juramento es una solemne declaración de compromiso que pone a Dios por testigo del cumplimiento de su contenido. El Juramento es una invocación a los dioses del Olimpo más relacionados con el origen natural de la Medicina, Apolo y Esculapio, así como a Higea (o Hygia) y Panacea, diosas, respectivamente, de la higiene y medicina preventiva, y de la medicina curativa y de los medicamentos. Así, para el médico hipocrático la religión no es meramente “mitología” sino además “metafísica”, por el desentrañamiento progresivo e incesante de un universo estructurado que se puede ir descubriendo con ayuda del trabajo, la investigación, la razón y el amor por los enfermos y por la ciencia. Así, aunque los dioses del Olimpo se toman como testigos su carácter religioso, no es meramente ritual sino de reconocimiento de los misterios de la relación entre lo sagrado y lo profano en relación con la salud, la enfermedad y la muerte.
Juramento hipocrático (500 a.C.)
Juro por Apolo médico, por Esculapio, Hygia y Panacea, juro por todos los dioses y todas las diosas, tomándolos como testigos, cumplir fielmente, según mi leal saber y entender, este juramento y compromiso:
Venerar como a mi padre a quien me enseñó este arte, compartir con él mis bienes y asistirle en sus necesidades; considerar a sus hijos como hermanos míos, enseñarles este arte gratuitamente si quieren aprenderlo; comunicar los preceptos vulgares y las enseñanzas secretas y todo lo demás de la doctrina a mis hijos, y a los hijos de mi maestro y a todos los alumnos comprometidos y que han prestado juramento según costumbre, pero a nadie más.
En cuanto pueda y sepa, usaré de las reglas dietéticas en provecho de los enfermos y apartaré de ellos todo daño e injusticia.
Jamás daré a nadie medicamento mortal, por mucho que me soliciten, ni tomaré iniciativa alguna de este tipo; tampoco administraré abortivo a mujer alguna. Por el contrario, viviré y practicaré mi arte de forma santa y pura.
No tallaré cálculos, sino que dejaré esto a los cirujanos especialistas.
En cualquier casa que entre, lo haré para bien de los enfermos, apartándome de toda injusticia voluntaria y de toda corrupción, y principalmente de toda relación vergonzosa con mujeres y muchachos, ya sean libres o esclavos.
Todo lo que vea y oiga en el ejercicio de mi profesión, y todo lo que supiere acerca de la vida de alguien, si es cosa que no debe ser divulgada, lo callaré y lo guardaré como secreto inviolable.
Si este juramento cumpliere íntegro, viva yo feliz y recoja los frutos de mi arte y sea honrado por todos los hombres y por la más remota posteridad. Pero si soy transgresor y perjuro, avéngame lo contrario.
El Juramento Hipocrático es normativo, es decir, prescribe las principales acciones que el médico ha de hacer, o ha de evitar, en su trato con los enfermos. Pero las obligaciones del Juramento no dependen de ningún derecho específico de los pacientes como tales, o por su capacidad económica u otras circunstancias, sino de obligaciones que los médicos se autoimponen por el hecho de tener que situar los intereses de los pacientes por encima de los propios. Esto se amplía siglos más tarde a todos los sanitarios, farmacéuticos y enfermeras, constituyendo estos preceptos un bloque, y obligan colectivamente a todos los miembros de las profesiones sanitarias.
Ya señala en varios preceptos que el médico actuará en provecho y beneficio de los enfermos, que evitará toda corrupción e injusticia, así como cualquier relación vergonzosa con cualquiera (no solo con pacientes), ya sean libres o esclavos. Y esta obligación hacia los esclavos, dado que estos no gozaban de derechos legales, solo puede proceder de un derecho inherente y previo a su reconocimiento legal –es decir, natural–, o de ser considerados hijos de Dios, que es lo que actualmente se conceptúa como “dignidad” humana. También se insiste en la protección de la vida y en “no matar”, “por mucho que me lo soliciten”, y en la no administración de abortivos. En relación con el secreto profesional y con la confidencialidad, el médico está obligado a no violar el secreto, no solo de lo que se le confió, sino de todo lo que vea, escuche o supiere de la vida de alguien.
Son muy numerosas las Facultades de Medicina del mundo en los que en la ceremonia de graduación de los nuevos médicos éstos juran cumplir el Juramento Hipocrático. En el análisis de sus preceptos se observa que son ontológicamente inherentes a la Medicina y, por extensión, a la Farmacia y a las profesiones sanitarias. Su objetividad corresponde a lo que Immanuel Levinas (1906-1995) define como ontología primera, que nos impone responsabilidad hacia “el Otro”. Levinas sostiene que la responsabilidad hacia “el Otro” tiene sus raíces en nuestra propia estructura, subjetiva; de tal modo que hacer mal al otro es hacérnoslo a nosotros mismos.
Esto para el psicólogo y filósofo alemán Philip Lersch (1898-1972), tiene que ver con los sentimientos normativos del deber y de la justicia, con las vivencias de relación como el ser “con otro” y el ser “para otro”, y con el impulso transcendente, religioso o de espiritualidad. Este impulso se experimenta en la conciencia moral, que enlaza con los sentimientos del “yo”, con los de la comprensión del sentido del mundo y de la vida (Lersch, 1962).
José Luis Iglesias Benavides escribe que “El juramento hipocrático fue bien recibido por las autoridades de la Iglesia Católica, pues contenía muchos conceptos éticos universales útiles”; y que el hecho de que el juramento original se hiciese por Apolo, médico, y otros dioses del Olimpo, se subsana más tarde haciendo que el voto vaya “dirigido a Dios Todopoderoso, a Jesucristo y a la Divina Providencia”, cuestión que no afecta en modo alguno a las obligaciones del Juramento (Iglesias, 2007).
Sin embargo, como escriben los bioeticistas canadienses Roy (1937-2015) y Wachter, actualmente “las bases de la ética contemporánea se han hundido. Nos es difícil, a veces imposible, distinguir el bien del mal (…). El significado de la autoridad está en continua modificación (…). Los rápidos y profundos acontecimientos en la medicina y ciencia de la vida han sumido a la antropología y deontología médicas en un estado de crisis (…), manifestadas por la desintegración gradual (…) del consenso moral existente (…)” (Roy et al., 1985).
Aunque no se comparta esta opinión, no deja de ser cierto que las bases tradicionalmente admitidas de la ética y la moral se encuentran contestadas por muchas personas e ideologías. También es cierto que con la modernidad y la globalización se impone el que la ética y la religión en muchos aspectos se hayan visto reducidas a la esfera privada, con el argumento de que hay que respetar a los que no piensan igual que nosotros. Ahora bien, este respeto a los demás no implica la admisibilidad de cualquier opción o conducta, por aberrante que esta resulte.
Patrick Devlin (1905-1992) señala que “la libertad de pensamiento, de ideología, de religión y de fundamentación de nuestros juicios morales, no implica que se pueda vivir sin respetar principios éticos. Así, aunque con fundamentos religiosos, ideológicos o filosóficos distintos se llega al consenso en el respeto de los derechos humanos fundamentales” (Devlin, 1970).
Si revisamos los principios que ha de respetar en el paciente el médico hipocrático, vemos que corresponden a los derechos humanos que, como escribe Benito de Castro Cid, son “aquellas exigencias o expectativas existenciales del hombre en cuanto tal, que se imponen a la razón como atribuciones que no pueden faltar en ningún ordenamiento jurídico”. En todo caso, son indispensables axiomas que, con carácter de evidencias, hagan posible la discusión, “creencias en sentido orteguiano”, es decir, “ideas en las que nosotros estamos porque son el continente o universo en el que está nuestra vida” (De Castro, 1983).
Precisamente porque los derechos humanos fundamentales se imponen con carácter general, absoluto y universal a toda la Humanidad, son exigibles sin necesidad de que su promulgación en leyes sea, o no, conocida. Así, la Declaración Universal de los Derechos Humanos, aprobada por la Asamblea General de las Naciones Unidas el 10 de diciembre de 1948, es reconocida por los representantes de todos los estados, con independencia de sus culturas, religiones e ideologías políticas; y con independencia de que algunos estados no tuvieran entonces o tengan hoy la menor intención de cumplirlos.
Ahora bien, donde la exigencia de racionalidad de la posibilidad de universalización diverge, es en el contexto del fundamento de la racionalidad ética, religiosa o filosófica en el que se explican, definen y relacionan los derechos humanos.
Así, Karl-Otto Apel (1922-2017) habla de una “comunidad ideal de comunicación”, y del consenso como forma de resolver problemas, aunque no pueda ser universal porque algunas soluciones implican a generaciones futuras. El filósofo y sociólogo Jürgen Habermas (1929) habla de “una situación ideal de diálogo”, y John Rawls (1921-2002) de la justicia como “la primera virtud de las instituciones sociales”, de tal modo que “cada persona debe tener en cuenta la posible situación de cualquier otra; y, en tanto está obligado a considerar todas las posibles situaciones como potencialmente propias, su elección será racional y justa”.
Por su parte, Hans Jonas (1903-1993), insistiendo en la obligación de la responsabilidad de nuestras acciones en una era de continuos, exponencialmente crecientes y abrumadores descubrimientos científicos y grandes catástrofes, afirma que “la tecnología gana sin cesar terreno; que la vocación del ser humano y el dominio de su destino se perciben cada vez más como la capacidad de lograr un dominio máximo de las cosas y de sí mismo” (Jonas, 1974).
También Samuel Fleischacker, nacido en 1961, y citando a Hannah Arendt (1906-1975), destaca que “Arendt dice que la verdadera autoridad implica la ausencia de fuerza y de persuasión (…), y que la quintaesencia de la relación de autoridad es la que existe entre el maestro y el estudiante, el padre y el hijo, el sacerdote y el creyente (…), que tiene lugar en una relación en la que estatus e intereses no cuentan”. Añade que “esta relación de autoridad verdadera es la que se da en la relación médico-paciente”, y que “solo es posible gracias a la garantía deontológica que es inherente a las profesiones sanitarias” (Fleischacker, 1994).
En nuestro caso hemos demostrado aquí que esa relación profesional asistencial incluye la del “farmacéutico-paciente”. Ahora bien, aquí estamos confrontados a una doble concepción de la Medicina-Farmacia que tiene dos grandes facetas:
1. La Medicina como “profesión” centrada en el paciente concreto; que es al mismo tiempo un arte que tiene como fin el bien del enfermo, y la ciencia del conocimiento de su patología y de cómo conservar o mejorar su salud a través de las terapias y los medicamentos. Las organizaciones profesionales sanitarias, como los Colegios de médicos, los de farmacéuticos y los de otros profesionales sanitarios, tienen como guías de conducta profesional la deontología derivada del Juramento Hipocrático; y
2. La Medicina y las ciencias biológicas, biomédicas y farmacéuticas orientadas al progreso de la investigación; porque estas disciplinas no están orientadas solo al servicio de los enfermos, sino que crean enormes centros de proyectos de investigación que están orientados al dominio de la naturaleza por el ser humano. Estos proyectos conciernen a la Industria Farmacéutica, a la de las tecnologías biomédicas, al conocimiento y dominio del cerebro humano y al cambio y la transformación de la Medicina, convertida ya en telemedicina, y en una robotización que puede acabar transformando el mundo que conocimos en nuestra juventud. Esto no ignora la ética, pero, al margen de que sus profesionales puedan estar colegiados, está regulado por Comisiones de ética asistencial y por Comisiones de ética de la investigación en los distintos centros, hospitales e instituciones en cuestión, ya sean públicas o privadas, por la sujeción a principios de la legislación general, y a Códigos de ética particulares, por ejemplo, el Código Ético de Farmaindustria, la patronal del sector de las industrias farmacéuticas en España, o el Código ético particular de cada una de las grandes empresas farmacéuticas.
Los fundamentos naturales de la ética y la deontología
Henry Bergson (1859-1941) muestra de qué manera la aparición del cristianismo y su consolidación en el mundo occidental supone un progreso o salto evolutivo espiritual y social (Bergson, 1932). José Manuel Santiago señala que “Bergson destaca el valor filosófico e inspirador de la mística cristiana como cumbre de la vivencia religiosa”. Aunque también señala que “puede resultar muy sugerente e impulsor hacia el progreso moral pero las experiencias místicas cristianas, al igual que los misticismos orientales, no resultan universalizables, ya que exigen una actitud de apertura y entrega incondicionada” (Santiago, 2016).
En “Los hermanos Kamarazov” de Fiódor Dostoyevski (1821-1881), Iván Kamarazov exclama: “si Dios no existe, todo está permitido”. Esta frase, condicional e hipotética, expresa la rebeldía de quien la pronuncia frente al “silencio de Dios”, que deja a los agnósticos ante la duda de que el universo, el mundo y la vida (con sus esfuerzos, el dolor y la felicidad, el bien y el mal humanos) tengan sentido, ontológicamente hablando.
Friedrich Nietzsche (1844-1900) concluye que “Dios ha muerto”, por lo que debe ser sustituido por el “superhombre”. Hitler (1889-1945) regalará a Mussolini (1883-1945) las obras completas de Nietzsche en una evidente alusión a que ellos se consideraban ese “superhombre”, lo que es evidentemente monstruoso y, finalmente, catastrófico y suicida.
El problema epistemológico reside en el círculo vicioso de afirmar que la idea de Dios es la que justifica la veracidad de todas las ideas claras, al mismo tiempo que se sostiene que la idea de Dios es una idea clara. Se incurre así en un círculo “in probando”, es decir, en una petición de principio (que diría el filósofo, sacerdote y matemático Pierre Gassendi, 1592-1655). De “razonar” así, el desprecio de “la idea de Dios” actuaría como una barrera; en cambio, si somos capaces de reconocer que el sentido del universo y de nuestra propia vida se puede captar “místicamente”, como expresión del amor de Dios, entonces Dios se abre a nuestra inteligencia y a nuestra fe, que es nuestra fidelidad, a pesar de todos nuestros fallos y defectos. Así, Emmanuel Kant (1724-1804) nos dice que no podemos exigir el premio de nuestras obras, sino que “debemos obrar no para ser premiados por Dios sino para merecer ser premiados por El”.
Bachelard (1884-1962) es un filósofo que ha analizado los distintos tipos de obstáculos que los seres humanos encontramos para comprender los problemas científicos. Estos obstáculos, que actúan desorientando nuestra recta comprensión, son lo que él llama obstáculos epistemológicos; y son nuestras propias emociones y experiencias, nuestro propio entorno, nuestros seres queridos que nos merecen credibilidad, nuestros intereses y las trampas e insuficiencias lógicas y del lenguaje.
Hannah Arendt dice que “queda un problema fundamental (…) la naturaleza y función del juicio humano (…), de personas cuyos principios pueden hallarse en total oposición con la opinión (…) de cuantos les rodeaban” (Arendt, 2004). En esa posibilidad apuntada por Arendt reside una de las bases de la deontología sanitaria. Esta no es una expresión del poder de una profesión sanitaria, sino de la capacidad de distinguir entre el bien y el mal, que a esos profesionales les otorga su función, sus conocimientos y su necesidad de ser sinceramente solidarios con los pacientes.
Heidegger (1889-1976) y Gadamer (1900-2002), siguiendo a San Agustín (354-430), dicen que toda interpretación metafísica y teológica que requiera la comprensión debe haber entendido previamente lo que se pretende interpretar (Dreyfus, 1991). Sin embargo, cuando ese requisito no se da es preciso no desanimarse ya que, como decía San Agustín, “cuando dudes actúa y pide ayuda a Dios como si tuvieses fe y trata de acercarte a Dios y la fe te será concedida”.
En conclusión, quien se acerque a la religión como un científico que quiera analizar “materialmente” la existencia de Dios y, por lo tanto, el fundamento de la ética, por lo general fracasará en su intento, salvo que esté iluminado a pesar de su escepticismo.
Conclusión
Se puede concluir que para obrar con arreglo a las normas generales de la moral y la ley natural no hace falta el conocimiento explícito o la representación de Dios, aunque sí es necesario que nos interroguemos sobre el sentido de la existencia personal, del amor y de la solidaridad; y que los seres humanos tenemos por nuestra conciencia racional la intuición de lo que está bien y de lo que está mal.
Sin pretender penetrar en los fundamentos metafísicos del orden del universo y de sus leyes, del problema de la libertad humana y del sentido de la existencia, se puede afirmar que también existe una relación clara entre la ética humana y la etología animal. Lo que las diferencia es que los seres humanos, aunque tenemos la percepción intuitiva del bien y del mal, también tenemos voluntad y libertad, al menos de desear. Sin embargo, la etología de cada especie animal tiene aspectos orientados hacia la conservación de la especie más fácilmente analizables que la conducta humana. Y esta relación entre ética y etología es una prueba, por extensión, de que la ética humana, que tiene aspectos culturales, tiene raíces naturales. La cuestión reside en saber si los seres humanos tenemos que regirnos por leyes universales naturales, o no. Leyes que han sido reveladas o transmitidas por las distintas religiones y tradiciones, y por las distintas antropologías filosóficas y morales, y por los principios de los derechos humanos.
La deontología de las profesiones sanitarias ¿tiene principios fundamentales absolutos o sus fundamentos son culturales y sometidos a posibles cambios?
El principio que guía el presente artículo es exponer que el Juramento Hipocrático ha resistido el paso de 25 siglos y tiene plena vigencia en el siglo XXI. Para los griegos de tiempos de Pericles (469-429 a.C.), el Juramento Hipocrático era el ejemplo más acabado y selecto de su educación, que trataba de formar a las personas según las leyes universales de la naturaleza humana, que incluían la oratoria, el teatro, la filosofía, la música, el deporte y la legislación.
Un reducto deontológico universal inquebrantable ha existido y, como afirman Pellegrino y Thomasma, permanecerá en la ética y deontología sanitarias, y ello por la sencilla razón de que, ante la enfermedad, el dolor, el miedo a la muerte, el recurso a las ciencias médico-sanitarias presenta perspectivas que son humanitarias, solidarias, altruistas y realistas, que son las que desde el Juramento Hipocrático han inspirado a las deontologías sanitarias. Es más, el que el derecho positivo de muchos países permita prácticas como el aborto o la eutanasia, que son contrarias al Juramento Hipocrático, solo supone que estas prácticas son legales, pudiéndose explicar esa consideración por situaciones de conflicto; pero no respalda que sean ética o deontológicamente legítimas.
La crisis actual, que es de civilización y se ve actualmente muy agudizada por la COVID-19, deriva de la combinación de la catástrofe que supone la pandemia, en una situación en la que impera el “multiculturalismo” del “melting pot” –o la “olla”– donde están mezcladas todas las culturas y tendencias políticas dominantes, con la realidad del rápido progreso y cambio tecnológico y cultural, que están poniendo en cuestión la estabilidad mental de muchas personas y los principios morales y religiosos sobre los que se fundamenta la cultura occidental. Esta pandemia ha trastornado todo el mundo, y en España particularmente, la crisis económica, social y de expectativas de futuro es tan enorme que no es fácil saber cómo se irá superando. Decía Javier Zubiri (1898-1983) que “conocer es actualizar lo real de modo fundamental” (Fernández, 1987) pero todavía no podemos conocer el mundo y España después de la COVID-19, y es responsabilidad de todos el trabajar para que sea lo mejor posible.
En este trabajo se ha puesto en relieve que los profesionales sanitarios, y en concreto la profesión farmacéutica, gracias a su ética y deontología, que son consustanciales con ellos, han respondido eficazmente, generosamente y, en bastantes casos, heroicamente y al precio de su salud y de su vida, a las necesidades asistenciales de la población.
Novedades en la normativa de ensayos clínicos con medicamentos con organismos modificados genéticamente
Resumen
Desde la Unión Europea, a través del Reglamento (UE) 2020/1043, de 15 de julio de 2020, se han acordado unas excepciones transitorias al cumplimiento de la normativa reguladora de los ensayos clínicos con medicamentos que contienen organismos modificados genéticamente con objeto de incentivar el desarrollo de medicamentos destinados al tratamiento o prevención de la infección por SARS-CoV-2, como una herramienta para mermar las consecuencias derivadas de la pandemia ocasionada por la COVID-19. Así las cosas, podrá autorizarse el empleo de estos medicamentos con fines de investigación en los seres humanos sin necesidad de una evaluación previa del riesgo medioambiental derivado de la liberación de los mismos. No obstante, las autoridades regulatorias seguirán requiriendo la observación de la autorización de fabricación por parte de los laboratorios solicitantes.
El presente artículo revisa los principales contenidos y novedades de la citada norma, de relevancia fundamental en la investigación clínica de candidatos a vacuna y medicamentos de terapia avanzada frente a la COVID-19, y pretende aportar una visión global de la legislación sobre ensayos clínicos en Europa.
Introducción
La crisis sanitaria ocasionada en 2020 como consecuencia de la infección provocada por el coronavirus SARS-CoV-2, es decir, la enfermedad coronavírica (COVID-19), ha forzado a los diferentes Estados miembros de la Unión Europea, así como al Parlamento Europeo y al Consejo de la Unión Europea a adoptar diversas medidas urgentes en relación con la protección de la salud pública. El presente análisis se centrará en las medidas acordadas por el Reglamento (UE) 2020/1043, de 15 de julio de 2020, relativo a la realización de ensayos clínicos y al suministro de medicamentos para uso humano que contengan organismos modificados genéticamente (en adelante, OMG) o estén compuestos por estos organismos, destinados a tratar o prevenir la COVID-19, publicado en el Diario Oficial de la Unión Europea, serie L, número (núm.) 231, de 17 de julio de 2020.
Al ser una disposición normativa de carácter de Reglamento, resulta de obligado cumplimiento en todos sus elementos y de aplicación directa en los veintisiete Estados miembros de la Unión (cf. artículo 288, párrafo 2.º del Tratado de Funcionamiento de la Unión Europea).
Análisis del reglamento (UE) 2020/1043
La norma contiene veintiséis considerandos, y cinco artículos, que se resumen a continuación.
Considerandos
- Considerando núm. 1. El 30 de enero del presente año, el brote de la enfermedad coronavírica adquirió la categoría de emergencia de salud pública de importancia internacional, y el 11 de marzo de 2020 fue calificada de pandemia.
- Considerando núm. 2. Los medicamentos requieren una autorización por parte de una autoridad competente previa a su puesta en el mercado. En la solicitud de autorización de comercialización debe constar un expediente en el que deben figurar, entre otras informaciones, los datos clínicos de eficacia y de seguridad.
- Considerando núm. 3. El inicio de ensayos clínicos con medicamentos también requiere la autorización por parte de las autoridades competentes de cada uno de los Estados miembros donde se realicen.
- Considerando núm. 5. La liberación intencional en el medio ambiente de OMG con cualquier propósito distinto de su comercialización –por ejemplo, la realización de ensayos clínicos– requiere notificación y autorización en cada estado miembro. Las autoridades competentes examinarán, para ello, el pertinente expediente de evaluación del riesgo medioambiental.
- Considerando núm. 6. Se requiere una evaluación individualizada de los riesgos para la salud humana y el medio ambiente vinculados al empleo confinado de microorganismos modificados genéticamente.
- Considerando núm. 8. La experiencia adquirida en los ensayos clínicos con medicamentos en cuya composición se incluyen OMG ha demostrado la complejidad de la evaluación del riesgo medioambiental, lo que justifica los dilatados plazos de las necesarias autorizaciones nacionales.
- Considerandos núm. 9 y 10. La falta de armonización a nivel comunitario sobre los requisitos necesarios para la autorización de la investigación clínica con productos de elevado interés sanitario torna aún más compleja la realización de ensayos clínicos en varios Estados miembros (ensayos clínicos multicéntricos).
- Considerandos núm. 13, 14, 15, 16, 17, 20. Habida cuenta de la declaración de la enfermedad coronavírica como una pandemia por las autoridades competentes internacionales, no cabe ninguna duda de la necesidad del desarrollo de medicamentos con adecuadas garantías sanitarias destinados al tratamiento o la prevención de ésta en la Unión Europea –sin perjuicio de la evaluación del impacto medioambiental de éstos–, de ahí la urgente necesidad del inicio de la ejecución de ensayos clínicos multicéntricos en la población europea.
- Es por ello por lo que se requiere la simplificación de los trámites establecidos en la normativa comunitaria, concretamente en la Directiva 2001/18/CE del Parlamento Europeo y del Consejo, de 12 de marzo de 2001, sobre la liberación intencional en el medio ambiente de OMG, y en la Directiva 2009/41/CE del Parlamento Europeo y del Consejo, de 6 de mayo de 2009, relativa a la utilización confinada de microorganismos modificados genéticamente.
- Considerando núm. 19. Por lo tanto, los laboratorios farmacéuticos que soliciten una autorización para la comercialización de medicamentos que contengan OMG –o estén compuestos por éstos– destinados a tratar o prevenir la COVID-19 no requerirán la presentación de una autorización para la liberación intencional en el medio ambiente de OMG con fines de investigación y desarrollo (cf. artículo 2.3).
- Considerando núm. 18. Sin embargo, no puede obviarse la autorización de fabricación de ningún tipo de medicamento que contengan OMG con potencial terapéutico o preventivo frente a la COVID-19 (cf. artículo 2.1). Asimismo, los promotores deben velar por la adopción de medidas de minimización del impacto medioambiental negativos que puedan derivarse como consecuencia de la liberación de estos productos (cf. artículo 2.2).
- Considerando núm. 21. También se mantiene la exigencia de la concesión de una autorización en cada Estado miembro para la realización de ensayos clínicos con estos medicamentos, así como el seguimiento de las Buenas Prácticas Clínicas durante su realización.
Artículos
- Artículo 1. La norma reitera algunas definiciones establecidas previamente a nivel comunitario. Por una parte, en el artículo 2 de la Directiva 2001/20/CE del Parlamento Europeo y del Consejo, de 4 de abril de 2001, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros sobre la aplicación de buenas prácticas clínicas en la realización de ensayos clínicos de medicamentos de uso humano, se establecen las definiciones de ensayo clínico –letra a)–, de medicamento en investigación –letra d)–, y de promotor –letra e)–. Por otra parte, la definición de medicamento se establece en el Código comunitario de medicamentos de uso humano, aprobado por la Directiva 2001/83/CE –artículo 2.1–.
- De conformidad con la normativa europea, un OMG es cualquier entidad biológica –exceptuando al ser humano– capaz de reproducirse o de transferir material genético, y cuyo material genético haya sido modificado de una manera que no se produce naturalmente en el apareamiento ni en la recombinación natural (cf. artículo 2.2, de la Directiva 2001/18/CE; y artículo 1.5 del Reglamento 2020/1043).
- Artículo 2. En su apartado primero se excepciona a cualquier operación vinculada a la realización de ensayos clínicos –envasado, etiquetado, almacenamiento, destrucción, transporte, administración, etc.– con los medicamentos incluidos en el ámbito de aplicación del Reglamento, a la realización de la autorización previa del riesgo medioambiental ni a la obtención de una autorización de liberación intencional de los mismos. Sin embargo, esta exención no resulta de aplicación a la fabricación de los medicamentos en investigación.
- En el apartado segundo, como se ha anticipado aquí, se dispone que los promotores emplearán cuantas medidas sean necesarias para minimizar las consecuencias negativas que puedan preverse de la liberación de estos medicamentos al medio ambiente.
- El apartado tercero exceptúa, de forma transitoria, al cumplimiento de las exigencias establecidas en el Reglamento (CE) núm. 726/2004 del Parlamento Europeo y del Consejo, de 31 de marzo de 2004, por el que se establecen procedimientos comunitarios para la autorización y el control de los medicamentos de uso humano y veterinario y por el que se crea la Agencia Europea de Medicamentos –artículo 6, apartado 2, letra a)– y en la Directiva 2001/83/CE –parte I, punto 1.6, párrafo cuarto, segundo guión del anexo I–. En otras palabras, en la solicitud de una autorización de comercialización de estos medicamentos no se demanda la presentación de una autorización para la liberación intencional en el medio ambiente de OMG con fines de investigación y desarrollo.
- Artículo 3. En el apartado primero se establece que las exenciones establecidas en el apartado primero del artículo 2 también resultan de aplicación a los medicamentos empleados en dos situaciones concretas: el uso compasivo y el uso de medicamentos como respuesta a una propagación de un agente patógeno capaz de causar daños. El apartado segundo dispone que, a nivel nacional, se deberán adoptar medidas para la reducción del perjudicial impacto medioambiental previsible que se derive de la liberación –intencionada o no intencionada– de los medicamentos que contengan OMG destinados al tratamiento o prevención de la COVID-19.
- Artículo 4. El apartado primero indica que el Reglamento estará en vigor en tanto que la enfermedad coronavírica tenga la consideración de pandemia por parte de la Organización Mundial de la Salud, o bien durante el periodo en el que la Comisión considere que se mantenga una situación de emergencia de salud pública debido a la COVID-19. El apartado segundo explicita que una vez superada la crisis sanitaria producida por la COVID-19, se publicará un anuncio en el Diario Oficial de la Unión Europea, con la finalidad de indicar el fin de las medidas adoptadas a través de esta norma. Finalmente, en el apartado tercero se acuerda la validez de los ensayos clínicos realizados al amparo de este Reglamento comunitario, de tal suerte que los datos obtenidos en los mismos serán válidos para sustentar una autorización de comercialización de medicamentos compuestos por OMG destinados al tratamiento o prevención de la COVID-19.
- Artículo 5. La fecha de entrada en vigor del mismo se inició el 18 de julio de 2020, un día después de su publicación en el Diario Oficial, debido a la premura de las medidas adoptadas por el legislador comunitario.
Conclusiones
El legislador comunitario ha acordado una serie de medidas transitorias con objeto de incentivar el desarrollo clínico de medicamentos destinados al tratamiento o prevención de la enfermedad coronavírica en el ámbito de la Unión, lo que pone de manifiesto su compromiso en la lucha frente a la COVID-19.
Concretamente, se establecen determinadas exenciones en cuanto a la evaluación del riesgo medioambiental derivado de la liberación de estos medicamentos, habida cuenta de la dilatación en el tiempo de este proceso de evaluación por parte de las Administraciones competentes a nivel nacional. Aunque podría resultar paradójico que en esta situación de emergencia sanitaria se hayan establecido de forma temporal estas excepciones establecidas en el ordenamiento jurídico comunitario, ciertamente el objetivo de estas medidas es lograr la protección de la salud pública, a través de la obtención de medicamentos que sean capaces de controlar la pandemia actual.
Además, hay que tener en cuenta dos circunstancias. Por una parte, estas medidas no son de aplicación para todos los medicamentos en investigación en la Unión, sino solamente para aquellos que tengan un potencial uso frente a la COVID-19. Por otro lado, la propia norma establece que las Agencias regulatorias del medicamento deberán mantener la evaluación medioambiental de cara a la otorgación de una autorización de comercialización, al tiempo que exige a los promotores de los ensayos clínicos y a los propios Estados miembros la adopción de medidas de minimización del riesgo medioambiental derivado de la liberación de los medicamentos con OMG.
En definitiva, consideramos que las medidas adoptadas por el legislador comunitario tienen un impacto verdaderamente positivo para la salud colectiva, en tanto que agilizarán la obtención de medicamentos con potencial terapéutico o preventivo frente a la COVID-19, permitiendo de esta manera reducir las elevadas tasas de morbilidad y mortalidad acontecidas en los últimos meses.
Infecciones micóticas de la piel
Resumen
Muy diversas especies de hongos existen normalmente como saprófitos en el cuerpo humano, aunque en ciertas situaciones, como la existencia de un cuadro de inmunodepresión o consumo de corticoides, pueden actuar como patógenos oportunistas ocasionando patologías infecciosas de elevada relevancia clínica en algunos casos.
Se denomina micosis superficiales a las que afectan a piel, pelo y uñas, las cuales representan un motivo de consulta frecuente en Atención Primaria, en pediatría y dermatología. Dentro de este grupo se diferencia entre 3 grandes subgrupos: dermatofitosis, candidiasis mucocutáneas y pitiriasis versicolor. Su diagnóstico es eminentemente clínico y el abordaje terapéutico suele ser sencillo, con aplicación tópica, o administración sistémica en los casos más graves, de fármacos antifúngicos. El presente artículo revisa las diferentes formas mayoritarias de presentación clínica de las micosis superficiales, centrando el foco en su diagnóstico diferencial y su tratamiento.
Introducción
Se entiende por micosis superficiales aquellas infecciones por hongos patógenos para el ser humano que se limitan a piel, pelo, uñas y mucosas, mientras que el término micosis profundas se emplea cuando se produce –en el lugar de inoculación– una respuesta granulomatosa de la piel y tejido subcutáneo, y el de infecciones micóticas sistémicas cuando afectan órganos y mucosas internas y posteriormente se manifiestan en la piel. Las micosis superficiales son un motivo de consulta frecuente en la consulta del médico de familia, pediatra y dermatólogo; pueden estar producidas por distintos grupos de hongos que invaden las estructuras queratinizadas, o sea, el estrato córneo, pelo, uñas y mucosas.
A modo de recordatorio, los hongos son un grupo independiente de organismos enmarcados en un reino fuera del reino animal, distribuidos ampliamente en la naturaleza, y que pueden vivir en el organismo humano como saprófitos o parásitos. El empleo relativamente común en la actualidad de fármacos inmunosupresores hace que estos hongos se comporten en muchas ocasiones como patógenos oportunistas. Sus características epidemiológicas –antropófilos, zoófilos o geófilos– delimitarán actitudes concretas para evitar contagios. Las de origen zoófilo, con manifestaciones muy inflamatorias pueden resolverse espontáneamente, mientras que las antropófilas pueden persistir de manera indefinida.
Por otra parte, existen factores predisponentes exógenos que favorecen el desarrollo de las infecciones micóticas, como pueden ser la presencia de clima húmedo, condiciones de hacinamiento, calzado poco transpirante, falta de higiene, y factores endógenos, como enfermedades e incluso el uso de fármacos que condicionan una situación de inmunodepresión.
Tipos de micosis superficiales
Las micosis superficiales cutáneas constituyen un grupo de entidades que comprenden: tiñas o dermatofitosis (tinea capitis, tinea barbae, tinea facie, tinea corporis, tinea cruris, tinea manuum, tinea pedis y tinea unguim), candidiasis cutáneo-mucosas, pitiriasis versicolor y otras (piedra blanca, piedra negra, tinea nigra palmaris, infecciones por hongos oportunistas) (Tabla 1).
1. Dermatofitosis
Las dermatofitosis o tiñas (Tinea) son infecciones superficiales de la piel causadas por hongos queratinofílicos o dermatofitos que afectan a estructuras que contienen queratina.
Los dermatofitos son un grupo extenso y homogéneo de hongos con características similares, distinguiéndose entre sí por sus características macroscópicas y microscópicas, así como sus propiedades enzimáticas y nutricionales. Se clasifican en tres géneros: Trichophyton, Microsporum y Epidermophyton, se han llegado a reconocer más de cuarenta especies de dermatofitos aunque no todos son patógenas para el ser humano (Tabla 2).
La forma de transmisión de las dermatofitosis puede ir asociada al contacto con animales y, por tanto, se deben diferenciar las fuentes de contagio entre la población rural en contacto con animales y la población urbana, más frecuentemente usuaria de centros deportivos y en contacto con animales de compañía (gato, conejo, cobaya, etc.). Clínicamente, las dermatofitosis se clasifican según la región del cuerpo afectada.
1.1. Tiña del cuero cabelludo o tinea capitis
Predomina en la edad infantil, entre los 5 y 8 años de edad, más habitual en el sexo femenino. El agente causal más frecuentemente implicado es Microsporum canis (Tabla 3), relacionándose la mayoría de los casos con el contacto con gatos, especialmente en el Sur de Europa. La transmisibilidad aumenta en casos de falta de higiene, hacinamiento y bajo nivel socioeconómico.
Es posible aislar hongos viables a partir de peines, lendreras, fundas de almohada, reposacabezas y juguetes. La forma clínica varía según si las artroconidias afectan a la vaina externa del pelo (ectotrix) o se introducen en el interior de la misma (endotrix), produciendo en este último caso la rotura del cabello y la conocida tiña de los puntos negros. La tinea capitis puede presentarse como una de las siguientes manifestaciones:
Forma inflamatoria o Querión: inicialmente se presenta como una o varias placas eritemato-escamosas, con caída o no del pelo, que en el plazo de días evolucionan hacia una placa prominente y engrosada, bien delimitada, dolorosa a la palpación, con superficie alopécica pero con cabellos adheridos y llena de folículos abiertos y pústulas. Los pelos que persisten se pueden desprender con facilidad y suele estar acompañada por adenopatías cervicales (Figura 1A).
Formas no inflamatorias o tonsurantes. Clásicamente se acostumbran a subdividir en:
- Variedad microspórica o, más frecuente, placa alopécica: con pelos rotos a pocos milímetros del orificio y recubierta de escamas grises (Figura 1B). Puede ser levemente pruriginosa y se localizan, preferentemente en vértex y occipucio.
- Variedad tricofítica o de los puntos negros: presenta múltiples lesiones de pequeño tamaño, dando lugar a una alopecia irregular porque no afecta a todos los pelos, los cuales se rompen a la salida del folículo piloso (Figura 1C).
- Favus: forma crónica poco frecuente en nuestro medio, causada por Trichophyton schoenleinii. Se inicia durante la infancia y persiste hasta la edad adulta. Las lesiones comienzan con una descamación difusa y evolucionan a pústulas aisladas, que forman pequeñas placas costrosas crateriformes, creando masas densas amarillentas llamada escudete o cazoleta fávica. Se caracterizan por un “olor a roedor” y cubren la piel húmeda y enrojecida, pudiendo dar lugar a cicatrices y alopecia permanente (Figura 1D).
1.2. Tiña del cuerpo o tinea corporis
La tiña del cuerpo es la infección superficial por dermatofitos de la piel lampiña, tórax, abdomen y miembros, excepto ingles, palmas y plantas. Puede presentarse a cualquier edad, aunque es más frecuente en niños y adolescentes1, relacionada con el contacto con los animales domésticos. Causada tanto por hongos zoofílicos, antropofílicos como geofílicos, se caracteriza por presentar una evolución e imagen característica. Las lesiones son autocontagiosas y pruriginosas. Todas las especies de dermatofitos pertenecientes a los géneros Trichophyton, Microspurum y Epidermophyton son capaces de provocar tiña corporis, si bien los agentes causales más comúnmente implicados en nuestro medio son T. mentagrophytes, M. canis, T. rubrum y M. auduinii.
La tiña del cuerpo es la variedad topográfica más frecuente de todas las tiñas. Se observa más en climas húmedos y calurosos, aunque tiene una distribución cosmopolita. Los agentes micóticos causantes de la tinea corporis, en general residen en el estrato córneo, que, por sus características de calor y humedad, proporciona el ambiente propicio para la proliferación del hongo, el cual activa y libera enzimas y queratinasas para invadir la capa córnea. Tras un periodo que oscila entre 1 y 3 semanas se produce la diseminación periférica de la infección cutánea.
Entre sus formas clínicas sobresalen las siguientes:
- Herpes circinado: lesión de tipo anular o policíclica con un borde activo de crecimiento centrífugo eritematoso y, a veces, pápulo-vesiculoso, con un centro de color más claro, descamativo (Figura 2A) y con tendencia a la mejoría clínica espontánea. Suele presentar una distribución asimétrica, pudiendo ofrecer variaciones en el tamaño y en el número de placas. En ocasiones, dichas placas confluyen y adoptan formas policíclicas. En las formas zoófilas suelen observarse varias lesiones. Se caracterizan por acompañarse de prurito leve o moderado.
- Granuloma de Majochi o tricofítico: se manifiesta como una perifoliculitis, con nódulos granulomatosos que se produce por afectación profunda de los folículos pilosos (Figura 2B). Ocurre con más frecuencia en personas que se afeitan las piernas.
- Tiña incógnito: son micosis que previamente fueron tratadas con corticosteroides o inmunomoduladores tópicos. Se caracterizan por su duración en el tiempo y evolución tórpida, presentado un aspecto irregular en su contorno, poco definido y con posibles elementos microvesiculosos aislados en su parte central (Figura 2C). Son de difícil diagnóstico, ofreciendo una lesión más característica cuando se suprime el tratamiento corticoideo.
- Tinea cruris, de grandes pliegues o eccema marginado de Hebra: se distribuye desde el fondo del pliegue inguinal hacia la cara interna del muslo, con borde sobreelevado y presencia de descamación, pústulas o vesículas acompañadas de prurito. Caracterizada por un tono rojo-marronáceo con la parte central más clara (Figura 2D). Suele aparecer en la adolescencia y en la edad adulta. Los agentes causantes más habituales en nuestras latitudes suelen ser T. Rubrum y E. Floccosum.
- Tiña de pequeños pliegues o pie de atleta: su presentación típica es a partir de la preadolescencia, aunque con el uso de calzado deportivo de forma habitual aparece cada vez en edades más tempranas. Suele afectar habitualmente al 4° espacio interdigital con lesiones descamativas, fisuradas y maceración (Figura 2E). Además, existen formas plantares con descamación e incluso pequeñas vesículas, y las llamadas formas “en mocasín”, que abarcan la parte lateral del pie.
- Tiña de las uñas: se inicia en el borde distal o lateral de la uña, apareciendo un cambio en la coloración, engrosamiento, fragmentación de las láminas (“pitting”), elevaciones, e incluso desprendimiento de la lámina ungueal (Figura 2F). Las formas clínicas de presentación más comunes son la distal subungueal, la proximal subungueal y la superficial blanca, siendo más frecuente la afectación de las uñas de los pies que de las manos. Su distribución es universal, ya que pueden estar producidas por dermatofitos, cándidas, hongos filamentosos y mohos.
- Lesiones estériles o dermatofítides: se trata de reacciones de hipersensibilidad que ocurren coincidiendo con la fase inicial de las lesiones. De características muy variadas, mejoran al hacerlo la lesión fúngica. No precisan tratamiento específico.
Diagnóstico
El diagnóstico de las dermatofitosis suele ser clínico-epidemiológico, siendo imprescindible realizar un estudio etiológico ante la sospecha de tiña incógnito, aquellas que se acompañan de dermatofítides, las de las uñas y ante pequeñas epidemias escolares o familiares.
Las técnicas más comúnmente empleadas para tal fin son:
- Examen microscópico directo (con tinción o no del material) con aplicación previa de hidróxido potásico o azul de lactofenol para visualizar hifas o artosporas.
- Cultivo en medios adecuados durante 2 semanas. Es la técnica gold standard, ya que permite el estudio etiológico y de sensibilidad a antifúngicos. El agar Saboureaud es el medio más empleado.
- La lámpara de luz ultravioleta o de Wood puede ser una ayuda diagnóstica, puesto que determinados hongos pueden emitir fluorescencia.
Además, en ciertos casos es fundamental establecer un diagnóstico diferencial:
- En el caso de la tinea capitis, el diagnóstico debe diferenciar de lesiones que produzcan alopecia y descamación, como pueden ser: alopecia areata, falsa tiña amiantácea, dermatitis seborreica del cuero cabelludo, psoriasis, alopecia postraumática, lupus eritematoso y abscesos o forúnculos en los casos de la tiña inflamatoria.
- El diagnóstico diferencial de la tinea corporis se debe realizar con: granuloma anular, pitiriasis rosada, eczema numular, psoriasis e impétigo.
- La tiña crural se debe diferenciar del eritrasma (positivo a la luz de Wood), con el intértrigo candidiásico o con la psoriasis invertida.
- El pie de atleta se puede confundir con: intertrigo candidiásico, psoriasis, dermatitis plantar juvenil.
- La tiña ungueal resulta más difícil de diferenciar clínicamente, debiendo establecerse un diagnóstico diferencial con: candidiasis ungueal, leuconiquia congénita, pitting psoriásico y la exostosis ungueal.
Tratamiento
El tratamiento no farmacológico de las dermatofitosis consiste en medidas higiénicas adecuadas, aireación, evitar la autocontaminación y la humedad.
Por otra parte, las medidas farmacológicas incluyen el uso de antifúngicos tópicos y de antifúngicos sistémicos. Los antifúngicos tópicos pueden ser inespecíficos (han quedado obsoletos hoy en día), como la tintura de yodo, o específicos, clasificándose estos últimos en: alilaminas, azoles, morfolinas y polienos (Tabla 4). Entre los antifúngicos sistémicos para el tratamiento de las tiñas superficiales, destacan fundamentalmente terbinafina y griseofulvina, cuyas características farmacológicas se resulmen en la Tabla 5, aunque también pueden emplearse algunos azoles (fluconazol e itraconazol).
- Tratamiento de tiñas de la cabeza:
Se empleará terbinafina, de 2 a 4 semanas, según sean formas no inflamatorias o inflamatorias, teniendo en cuenta que existe una menor respuesta de M. canis a este fármaco. En las formas inflamatorias se pueden asociar corticoides orales (prednisona) a dosis bajas. En pediatría, el tratamiento de la tinea capitis de elección es la griseofulvina a dosis altas (20 mg/kg/día) repartidas en 2 tomas durante 6 a 8 semanas.
- Tratamiento de tiñas del cuerpo:
En formas extensas o inflamatorias, se recomienda utilizar los mismos fármacos que para la tiña de la cabeza. En formas localizadas, se recomienda tratamiento tópico con imidazoles, terbinafina o ciclopiroxolamina durante 2 a 4 semanas.
- Tratamiento de tiña de los pequeños pliegues:
El tratamiento inicial es tópico y el sistémico se reserva para formas extensas.
- Tratamiento de tiñas de las uñas:
Se recomienda un tratamiento con antifúngicos tópicos en forma de laca (amorolfina 5%, ciclopirox 8%) cuando la afectación de la uña sea distal, en niños y cuando haya menos de 4 o 5 uñas afectadas, o bien en pacientes en los que el tratamiento sistémico esté contraindicado. En casos más avanzados, puede ser necesario indicar tratamientos orales con itraconazol, terbinafina o fluconazol. Dado que los tratamientos son largos, son aconsejables pautas pulsátiles: itraconazol 200 mg/12 h, 1 semana al mes durante 2-3 meses (si están afectadas las uñas de las manos) o durante 3-4 meses (para uñas de los pies); o fluconazol 150 mg/semana durante el mismo periodo de tiempo.
La terbinafina se utiliza en pauta diaria de 250 mg/día durante 6 (manos) o 12 semanas (pies). Una de sus principales ventajas es que no inhibe la vía del citocromo p-450 hepático, a tener en cuenta en pacientes polimedicados.
2. Candidiasis cutáneo-mucosas
Son infecciones producidas por hongos levaduriformes dimórficos del género Candida, saprofitos y gram negativos, que alcanzan la piel, uñas y mucosas. Solo se ha encontrado afectación del folículo del cuero cabelludo en pacientes portadores de VIH. Se conocen más de un centenar de especies de las que solo una docena se consideran patógenas para el ser humano: C. albicans, C. krusei, C. glabatra, C. parapsilosis, C. tropicalis, C. guillermondii, C. kefir, C. rugosa, C. lusitaniae, C. famata y C. dubliniensis (oportunista en pacientes VIH). Todas las especies de cándida se caracterizan por formar colonias levaduriformes de color blanquecino en los medios de aislamiento rutinarios.
Candida albicans es el más frecuente. No es un saprófito habitual de la piel, pero existe en la microflora oral, gastrointestinal o genital y se convierte en patógena cuando hay alteraciones inmunitarias del huésped u otros factores que favorecen la candidiasis, tales como embarazo, periodo premenstrual, diabetes, hipotiroidismo, obesidad, déficit de hierro, otras infecciones, leucemias, anticoncepción hormonal, antibióticos, corticoides, etc-
Clínicamente, se distinguen formas localizadas y difusas de candidiasis mucocutáneas.
Las candidiasis difusas son menos frecuentes, se aprecian en la edad neonatal y se caracterizan por la formación de múltiples elementos eritematosos de pequeño tamaño, que evolucionan con rapidez a vesícula, ampolla o pústula. Otra forma difusa aparece en adictos a drogas por vía paranteral manifestándose en forma de lesiones nodulares o foliculares.
En cuanto a las formas localizadas, distinguimos siete posibles manifestaciones:
- Intértrigo candidiásico: aparición inicial de lesiones a modo de pápulas y vesículas que terminan confluyendo en placas eritematosas, observándose una zona limítrofe descamativa y la presencia de lesiones satélites (Figura 3A). Las localizaciones más frecuentes suelen ser axilar, inguinal, candidiasis del pañal, región interglutea y submamaria.
- Muguet: formado por pequeñas manchas rojas que se convierten poco a poco en placas blanquecinas de aspecto cremoso que se retiran con facilidad pero dejan una base eritematosa (Figura 3B).
- Forma miliar: colonización de lesiones de sudamina o miliaria (Figura 3C). Se suele ver en pediatría y en pacientes institucionalizados que usan pañal.
- Interdigital: localizado habitualmente entre tercer y cuarto espacio interdigital, quedando la lesión delimitada por un collarete descamativo.
- Paroniquia-onicomicosis: a diferencia de las tiñas, las infecciones por Candida spp sí producen afectación del pliegue periungueal, apareciendo hinchado, con eritema y exudación (Figura 3D).
- Queilitis candidiásica: fisuración dolorosa de la comisura labial (Figura 3E), de etiología multifactorial, que se clasifica en 4 grados según la zona afectada y la extensión: la de primer tipo es una mínima lesión en la piel, la de segundo tipo recibe el nombre de rágades, la de tercer tipo forma largas fisuras y la de cuarto tipo se extiende al borde de los labios.
- Candidiasis genital: ocurre en la mucosa no queratinizada genital, como las de la vulva, glande y vagina. Generalmente, se debe a un sobrecrecimiento de flora endógena, aunque en la balanitis candidiásica –en el varón adolescente y adulto– suele haber antecedentes de contacto con pareja infectada.
El diagnóstico de la candidiasis suele ser clínico, siendo necesario en formas difusas, lesiones inflamatorias o en las formas de paroniquia llegar al diagnóstico etiológico, que se realizará mediante el examen microscópico directo tras tinción para demostrar la existencia de levaduras con pseudofilamentos, al tiempo que se procede al cultivo de las muestras. El diagnóstico diferencial se realizará en el caso del intértrigo candidiásico, en cuyo caso conviene distinguir respecto a los de origen dermatofítico o bacteriano, el eritrasma, psoriasis invertida y eczema seborreico (Figura 4). También en el caso de muguet, hay que diferenciarlo de la estomatitis en general, y la perioniquia, de los panadizos ungueales y las tiñas de la uña.
El tratamiento es básicamente tópico. Se pueden utilizar: nistatina, imidazoles, ciclopiroxolamina o terbinafina durante 5-7 días (de 3 a 4 meses en la paroniquia). Al tratarse de infecciones oportunistas es importante eliminar los factores que las favorecen, como es una mala higiene, humedad y otras infecciones.
La siguiente Tabla 6 resume los esquemas terapéuticos que pueden establecerse para el tratamiento de las candidiasis mucocutáneas.
3. Pitiriasis versicolor
Se trata de una infección superficial de la piel, crónica y habitualmente asintomática, producida por una levadura del género Malassezia, el cual se divide, actualmente, en especies lipófilas (M. furfur, M. sympodialis, M. globosa, M. slooffiae, M. restricta y M. obtusa) y no lipófilas (M. pachydermatis). Se trata de comensales habituales de la flora cutánea (en especial, a partir de la pubertad), que residen en el estrato córneo y en los folículos pilosos; alguna teoría señala la posible interferencia de la levadura en la producción de melanina.
Entre los factores favorecedores de la también llamada tiña versicolor se han descrito: el calor, la humedad, la sudoración, la piel grasa y el empleo de aceites corporales. No se ha asociado, en cambio, con una mala higiene ni se han hallado diferencias epidemiológicas en función del sexo ni del fototipo.
Topográficamente, se localiza de forma preferente en parte superior del tórax, espalda (con extensión hacia la raíz de miembros superiores) y cuello. En lactantes, es poco frecuente y se puede encontrar en cara y cuello. La principal manifestación son pequeñas manchas uniformes, planas, ovaladas, escamosas y confluentes (Figura 5A). La coloración varía según la constitución del paciente y la exposición al sol, entre el amarillo parduzco y el marrón en las formas hipocrómicas. Su raspado da lugar al desprendimiento de finas escamas (signo de la uñada) con visualización de epidermis sonrosada (Figura 5B). Además, puede ser discretamente pruriginosa.
El diagnóstico es, de nuevo, eminentemente clínico. La luz de Wood muestra fluorescencia del amarillo al anaranjado. El examen directo de las muestras con aplicación de hidróxido de potasio permite apreciar la característica imagen en espagueti y albóndigas que corresponden a las hifas y esporas de la levadura, respectivamente (Figura 6). El diagnóstico diferencial se debe hacer con la pitiriasis rosada, el vitíligo, las leucodermias posinflamatorias y los eccematides acromiantes.
Por último, el tratamiento consiste en sulfuro de selenio al 2,5% y ketoconazol en champú durante 7 días, pudiéndose aplicar también naftifina o imidazólicos en solución o spray durante 2 semanas. Se reservará ketoconazol o itraconazol por vía oral durante 7 días para los casos rebeldes.
Psoriasis
Resumen
La psoriasis es una enfermedad crónica de origen autoinmune, no trasmisible y con un importante componente de inflamación sistémica, que afecta fundamentalmente a la piel, donde se ha postulado que células dendríticas, linfocitos T, macrófagos y neutrófilos inducen hiperproliferaciones locales de queratinocitos que, en última instancia, son las responsables de las placas o lesiones típicas de la patología en sus diferentes formas clínicas. También puede manifestarse en las uñas, las articulaciones (artritis psoriásica) y, menos frecuentemente, en las mucosas (por ejemplo, con afectación ocular). Aunque presenta una amplia variedad de manifestaciones interindividuales, en la mayoría de pacientes (> 60%) es una enfermedad leve con aparición de posibles brotes en su evolución. En los casos moderados-graves, se asocia con un impacto emocional y psicológico significativamente negativo, y con un mayor riesgo de aparición de ciertas comorbilidades (por ejemplo, obesidad, diabetes, depresión, etc.). No se conoce por completo la o las causas que la originan, pero se cree que influye en gran medida una conjunción de factores genéticos predisponentes y ciertos factores ambientales desencadenantes, tales como el uso de determinados fármacos (litio, betabloqueantes, etc.), el estrés o el clima, entre otros.
En términos epidemiológicos, la psoriasis es la más común de las enfermedades cutáneas crónicas humanas, con una prevalencia –en tendencia creciente– estimada de alrededor del 2% en la población mundial, afectando en torno a 125 millones de personas. Si bien presenta una distribución global, su aparición varía según la edad y la región geográfica, siendo por lo general más prevalente en los países más distantes desde el ecuador y con mayor incidencia en la segunda década de la vida y entre los 55-60 años. En España, la prevalencia se estima cercana al 2,3% de la población (más de 1,2 millones de pacientes, de los cuales unos 200.000 presentan artritis psoriásica), habiendo crecido desde el 1,4% en 1998. Si se considera que en muchos casos limita notablemente la calidad de vida, se entiende que implique un importante impacto socio-económico.
Desde el prisma de la terapéutica, el tratamiento de los casos leves de psoriasis se realiza eminentemente por vía tópica. Se emplean para ello fármacos inmunomoduladores como los corticoides, los análogos de vitamina D y los retinoides. Un segundo escalón de tratamiento lo constituye el tratamiento sistémico corticoideo o con FAMEs (metotrexato o ciclosporina, principalmente), y la fototerapia. Pero ha sido en el tratamiento de las formas más graves o refractarias donde se ha experimentado el mayor progreso en las últimas dos décadas, con la incorporación de los fármacos biológicos. En la mayoría de pacientes, la elección del régimen terapéutico adecuado permitirá el control efectivo de las manifestaciones, aunque no están exentos de eventos adversos.
El presente artículo revisa ampliamente el conocimiento actual sobre la etiopatogenia, la epidemiología, las manifestaciones y el diagnóstico de la psoriasis, centrando el foco en su tratamiento específico en los diversos supuestos clínicos. Se pone en valor, finalmente, el importante papel asistencial que el profesional farmacéutico puede ejercer para con los pacientes con psoriasis, especialmente en términos de educación sanitaria y optimización de la farmacoterapia.
Introducción
La psoriasis es una patología que se enmarca dentro del conjunto de enfermedades autoinmunes. Estas se pueden definir, de forma general, como trastornos caracterizados por la producción de anticuerpos o de células efectoras que reaccionan contra los propios tejidos, de uno o de varios órganos. Es decir, ocurre que el sistema inmunitario ataca a sus propias estructuras celulares sanas a las que paradójicamente tiene como misión proteger de cualquier invasión externa (fundamentalmente microorganismos) e interna (eliminando las células anómalas propias susceptibles de invadir y lesionar órganos, como las tumorales). Para poder calificar una enfermedad como autoinmune, el paciente debe presentar autoanticuerpos reactivos en suero o fijados sobre las células o tejidos diana, e infiltrados inflamatorios en los tejidos lesionados; pero, además, es preciso comprobar empíricamente el efecto patogénico de esos autoanticuerpos y la especificidad de los linfocitos por el antígeno diana, así como la disponibilidad de modelos experimentales de la enfermedad autoinmune. La simple presencia aislada de autoanticuerpos no define por sí sola una enfermedad autoinmune.
A modo de recordatorio, se debe subrayar que, para llevar a cabo su cometido, el sistema inmunitario es capaz de distinguir las células propias sanas de las células anómalas o agentes extraños. Sin embargo, en determinadas ocasiones, algunos linfocitos reaccionan consigo mismos (autorreactividad), provocando una reacción autoinmune y activando mecanismos para inducir la apoptosis. Normalmente, la mayoría de estos linfocitos son suprimidos mediante mecanismos que reciben globalmente el nombre de autotolerancia y que permiten la destrucción de las células del sistema inmunitario que no cumplan su función esencial: proteger las estructuras orgánicas propias. Esta autotolerancia permite controlar los procesos de autoinmunidad que ocurren, en cierto grado, de forma natural en todas las personas, evitando con ello que lleguen a provocar enfermedades.
La tolerancia a componentes propios del organismo se establece tanto en fases del desarrollo del sistema inmunitario (tolerancia central) como, posteriormente, en la vida adulta (tolerancia periférica), y actúa eliminando o inactivando funcionalmente las poblaciones de linfocitos autorreactivos (Figura 1). Así, cuando un elemento es reconocido como propio, se desarrollará un mecanismo activo de no respuesta, denominado tolerancia inmunológica. En cambio, si es reconocido como elemento extraño, se activará la respuesta inmunológica encaminada a destruir dicho antígeno.
Las enfermedades autoinmunes constituyen un variado grupo de más de un centenar de enfermedades crónicas, de las que todavía hoy se sigue ignorando el desencadenante, si bien se han postulado varios mecanismos que, solos o en combinación, pueden conducir a la pérdida de la tolerancia fisiológica a los antígenos propios, desencadenando una respuesta inflamatoria que puede inducir daño estructural o funcional del tejido afectado. Entre ellos, se pueden mencionar:
- Presencia de algunos tipos de antígenos: ya sean determinantes propios crípticos u ocultos (que no presentan concentraciones o afinidad suficiente como para inducir la selección negativa de la población linfocitaria reactiva frente a los mismos) o antígenos bacterianos o virales que se mimetizan con los del huésped para pasar desapercibidos (mimetismo molecular), pueden desencadenar una respuesta inmunitaria y favorecer fenómenos de autoinmunidad.
- Alteraciones en el procesamiento y presentación del antígeno: por amplificación de determinantes antigénicos, expresión impropia del antígeno de histocompatibilidad1(HLA) de clase II o alteraciones en su estructura que desencadenen la actividad de los linfocitos T citotóxicos.
- Alteración de los mecanismos de generación o mantenimiento de la tolerancia.
- Alteraciones en la regulación de la respuesta inmunitaria: los defectos en la regulación pueden favorecer la autoinmunidad.
Asimismo, cada vez es mayor la acumulación de pruebas que avalan la participación de factores ambientales y, sobre todo, de la propia herencia genética (también considerada como factor predisponente) en la etiopatogenia de las enfermedades autoinmunes. La predisposición genética vendría determinada no por un único gen anómalo o mutado, al estilo de lo que se observa en determinadas metabolopatías monogénicas, sino por un gran número de genes polimorficos que a título individual tendrían poca influencia, pero cuya acción combinada podría reducir el umbral de respuesta inmunitaria, con mayor o menor selectividad hacia determinadas patologías.
En líneas generales, las patologías autoinmunes suelen cursar clínicamente en brotes, con periodos de recidiva y remisión, atendiendo al equilibrio entre la presencia constate del estímulo y la existencia de mecanismos antiinflamatorios que intentan controlar el proceso. Hasta ahora, las estrategias con que se ha obtenido más éxito en su abordaje terapéutico han sido las que de uno u otro modo producen un bloqueo del sistema inmunitario en general, que por otra parte presentan importantes efectos adversos derivados de la inmunodepresión, como son la posible reactivación de infecciones latentes o el riesgo de desarrollar cáncer ante la falta de respuesta del organismo frente a las células transformadas. Así pues, el desarrollo de tratamientos enfocados a bloquear la respuesta inmune antígeno-específica constituye la meta para el tratamiento de estas enfermedades y se dispone ya, por ejemplo, de anticuerpos monoclonales anti-CD20, CD22, CD19 y CD40, y contra el ligando de CD40 (CD154) en patologías como la esclerosis múltiple, la artritis reumatoide y el lupus eritematoso sistémico (Fernández del Pozo et al., 2018a).
Etiopatogenia
La psoriasis es una enfermedad inflamatoria no contagiosa de la piel, de carácter crónico aunque fluctuante, que puede afectar, además de a la piel, a uñas, articulaciones (artritis psoriásica) y, menos frecuentemente, a las mucosas. Según se ha avanzado, se desconoce la causa exacta de la psoriasis, pero se considera que es el resultado de la exposición a factores ambientales en individuos genéticamente predispuestos, en cuyo caso se puede desencadenar un brote y empeorar la situación clínica.
La influencia significativa de algunos factores genéticos se refleja en la marcada agregación familiar, así como la concordancia en gemelos. Aunque la mayoría de autores la consideran no hereditaria, otros optan por definirla como una patología de herencia poligénica, habiéndose descrito distintas regiones de sensibilidad (PSORS), como algunas asociadas al CMH-II (es más frecuente en presencia del alelo HLA-Cw6, y en pacientes con HLA-B27 debuta más precozmente y la evolución es más grave).
Entre los factores ambientales con posible implicación en la aparición de la psoriasis, o en el desencadenamiento de los brotes, sobresalen los siguientes:
- Infecciones por bacterias, levaduras o virus;
- fármacos, como litio, betabloqueantes, antipalúdicos, antiinflamatorios no esteroideos o corticosteroides;
- traumatismos;
- obesidad, tabaco y estrés;
- y clima (mejora en climas cálidos con alta exposición solar y empeora con el frío) y estacionalidad (empeora en invierno y mejora durante el verano y con la exposición solar).
También se ha relacionado con factores metabólicos (hipocalcemia, alcoholismo, diálisis, etc.) y factores endocrinos (mayor incidencia en la pubertad y la menopausia, mejora en el embarazo). No obstante, a pesar de que no se conocen con exactitud sus causas, sí se han identificado diversos eventos bioquímicos y celulares que subyacen tras las manifestaciones clínicas de la enfermedad (Figura 2).
Se sabe que las alteraciones autoinmunes de la psoriasis conducen a una hiperplasia epidérmica, esto es, la diferenciación anormal y una maduración incompleta de los queratinocitos –cuyo ciclo vital es mucho más rápido de lo normal (7-10 días, frente a los 50-75 días de un ciclo normal)– con hiperproliferación local de los mismos, que resulta en un engrosamiento de la epidermis y una capa granular reducida o ausente (paraqueratosis), con persistencia de los núcleos celulares de los queratinocitos. Se observa, además, la infiltración local epidérmica y dérmica de células del sistema inmunitario (linfocitos T y células dendríticas CD11+ en la dermis, y células CD8+ y neutrófilos), un aumento de la angiogénesis (formación de nuevos vasos sanguíneos) e inflamación de la piel; todo ello indicativo de la participación decisiva del sistema inmunitario en un trastorno que antiguamente se consideró como una simple hiperproliferación de queratinocitos que era responsable de las lesiones en la piel. Estas alteraciones de la respuesta inmunitaria pueden ser desencadenadas por los factores ambientales descritos.
Por otra parte, se ha postulado que las células presentadoras de antígeno (CPA) –elementos clave del sistema inmunitario, implicadas en la captación, procesamiento y presentación de moléculas de carácter antigénico sobre la membrana– procesan el auto antígeno e interactúan con las células T en la llamada sinapsis inmunológica, iniciando la cadena de respuestas antígeno-específicas. Para ello, liberan diversas citocinas que van a favorecer la activación, maduración y diferenciación de los linfocitos T en células efectoras específicas (linfocitos T facilitadores o helper, particularmente las Th1, Th2 y Th17) que secretan a su vez diferentes citocinas, para algunas de las cuales se ha demostrado una participación directa en la hiperproliferación de los queratinocitos en la psoriasis.
Una de estas citocinas es el factor de necrosis tumoral alfa (TNF-α, por sus siglas en inglés), que activa el desarrollo de las lesiones mediante el aumento del número de moléculas que participan en la respuesta inflamatoria. Los queratinocitos activados producen citocinas y quimiocinas, que atraen a los linfocitos al sitio de la inflamación y que potencian su proliferación. De hecho, no es difícil encontrar subpoblaciones de linfocitos Th1 y Th17 en las lesiones psoriásicas de la piel, además de queratinocitos, células dendríticas y células de Langerhans y, como consecuencia de todo ello, un aumento de la concentración de TNF-α en las zonas de la piel afectadas. Es más, se ha observado que una disminución del TNF-α, tanto en suero como en las lesiones, se relaciona con una mejora clínica, lo que sugiere un importante rol en la enfermedad.
Asimismo, se ha observado que las interleucinas (IL) IL-12 e IL-23 pueden tener también un importante papel patogénico en la psoriasis2y se ha observado mayor eficacia clínica al bloquear la subunidad p40 (ustekinumab) compartida por ambas. La IL-12, producida por las CPA, es capaz de inducir la producción de nuevas poblaciones de linfocitos T e incrementar las respuestas de los linfocitos Th1, sobre todo en la producción de interferón (IFN); estas células también parecen estimular la inmunidad mediada por células y la síntesis de anticuerpos fijadores del complemento. Por su parte, la IL-23 facilita la adquisición de memoria inmunológica por los linfocitos T, en especial de las subpoblaciones de linfocitos Th17, y parece tener un papel crítico en la patogénesis de la psoriasis: datos procedentes de modelos inflamatorios de la piel sugieren que los linfocitos Th17, que producen a su vez IL-17 e IL-22, podrían ser los inductores principales de la hiperplasia epidérmica, modificando la diferenciación epidérmica en la psoriasis.
También parece que las interacciones entre el antígeno asociado a la función leucocitaria de tipo 1 (LFA-1) y las moléculas de adhesión intercelular facilitan la patogenia de la psoriasis. En concreto, favorecen la migración de los linfocitos T desde la circulación sistémica a los tejidos de la dermis y de la epidermis, y su consiguiente reactivación. Todo ello conduce a una infiltración de las células T activadas en el tejido y a una proliferación anormal de los queratinocitos. Por su parte, la alta producción de factor de crecimiento endotelial vascular (vascular endothelial growth factor, VEGF) en los queratinocitos psoriásicos promueve la angiogénesis, lo que provoca un aumento de la vascularización y la inflamación local. Los neutrófilos se encuentran en grandes cantidades en las lesiones psoriásicas; de hecho, se ha demostrado que algunas citocinas, tales como la IL-8, causan la acumulación de neutrófilos en la piel. Sin embargo, a pesar de todos los mecanismos bioquímicos mencionados, el origen especifico de la enfermedad sigue siendo desconocido (Rendon et al., 2019; Fernández-Moriano, 2020).
Epidemiología
La psoriasis es la más común de las enfermedades cutáneas crónicas humanas, con una prevalencia estimada de alrededor del 2% en la población mundial, afectando en torno a 125 millones de personas (Parisi et al., 2013). La OMS habla de una prevalencia global con una tendencia creciente y situada entre el 1,5% y el 5% en la mayoría de países desarrollados (OMS, 2016). Algunos autores apuntan a una prevalencia del 1,5-3% en Europa. En España, la prevalencia de la patología se estima cercana al 2,3% de la población3(más de 1,2 millones de pacientes), habiendo crecido desde el 1,4% en 1998; del total de pacientes, un 20% presenta psoriasis moderada-grave, y unas 200.000 personas tienen artritis psoriásica (Ferrándiz et al., 2014).
El Atlas Global de la Psoriasis4–una colaboración de la International Federation of Psoriasis Associations (IFPA), International League of Dermatological Societies (ILDS) y el International Psoriasis Council (IPC)– publicó en 2019 los hallazgos de un estudio epidemiológico internacional con datos del 17% de los países, que recoge cifras de prevalencia menores a las reportadas por otras fuentes, según las cuales unos 60 millones de personas padecerían psoriasis en todo el mundo. Indica, por ejemplo, que la prevalencia en niños es menor del 1% en todos los países y que en adultos oscila entre el 0,17% y el 2,5%. En España, la prevalencia global sería del 1,11% (2,03% en adultos y 0,15% en niños).
Por tanto, los datos epidemiológicos sugieren que, a pesar de su distribución universal (Figura 3), la aparición de la psoriasis varía según la edad y la región geográfica, siendo en general más prevalente en los países más distantes desde el ecuador (posiblemente debido a un menor nivel de exposición a la radiación ultravioleta procedente del sol), como es el caso de los países nórdicos donde puede llegar hasta 11,4%. Así, la prevalencia oscila, por ejemplo, en niños desde el 0% en Taiwán al 2,1% en Italia, y en los adultos desde el 2,7% de Estados Unidos al 8,5% de Noruega.
La incidencia de nuevos casos varía también, como se observa por la diferencia entre las 78,9/100.000 personas-año en Estados Unidos y las 230/100.000 personas-año en Italia. Pero estos datos no son del todo fiables, ya que el registro de los casos de psoriasis no es obligatorio. En España, se ha estimado una incidencia del 1,4%, esto es, se producen 14 casos nuevos al año por cada 10.000 habitantes; además, se ha observado un incremento notable en los últimos años.
Si bien algunos estudios han sugerido que es más común en hombres, la psoriasis puede afectar a ambos sexos en igual proporción y debutar a cualquier edad, pero es rara en menores de 9-10 años (0,7% de los casos). Presenta dos picos de máxima incidencia: la segunda década (se observa con mayor frecuencia entre los 15 y los 25 años, de origen generalmente familiar) y entre los 55-60 años. Aproximadamente un tercio de los afectados cuenta con familiares directos con psoriasis. La artritis psoriásica, por su parte, se desarrolla típicamente 10 años o más después de la diagnosis del psoriasis, en un 10-30% de los pacientes, y mayoritariamente entre las edades de 30 y 50 años.
En la mayoría de casos (>70%), la psoriasis presenta un curso crónico con actividad inflamatoria que evoluciona con remisiones y recaídas espontáneas, y puede persistir toda la vida o durar solo unos meses. Si bien raramente llega a poner en peligro la vida del paciente, puede ser muy discapacitante, limitando considerablemente la calidad de vida e implicando un importante impacto socio-económico. Tal es así, que el Global Burden of Disease Study estimó en 2010 que la carga sociosanitaria de la enfermedad es muy elevada, suponiendo de media más de un millón (1.050.660) de años de vida ajustados a discapacidad (AVAC) a nivel mundial, esto es, años perdidos de vida con buena salud (IHME, 2012), que es el doble del impacto, por ejemplo, de la hepatitis C aguda. Esos AVAC se concentraban de forma mayoritaria (> 30 AVAC por 100.000 habitantes) en los grupos etarios de 50-69 años y > 70 años.
El impacto económico –nada desdeñable– de la psoriasis, tanto para pacientes como para la sociedad (mayor cuanto más severa es la patología), viene motivado tanto por los costes indirectos asociados a los tratamientos médicos como por los costes indirectos derivados de una reducción importante de la productividad laboral de los pacientes. A modo de ejemplo, en el año 2016 en Reino Unido se estimó un coste total asociado al absentismo y a la menor productividad laboral de los pacientes con psoriasis de 1,07 billones de libras; de forma similar, en EE.UU. en 2013, se estimó un coste total de entre 112 y 135 billones de dólares.
Aspectos clínicos
Manifestaciones
La aceleración del proceso de recambio celular de la capa más superficial de la piel o epidermis (algunos autores hablan de unos 4 días, frente a los 30 días de duración normal), motivada por el estímulo de las citocinas proinflamatorias, determina la acumulación de células en la capa córnea de la piel. Por ello, las lesiones cutáneas características de la psoriasis son placas de tamaño y grosor variable, de color rojo5 oscuro (por el mayor flujo sanguíneo debido a la inflamación), recubiertas de escamas –formadas por los queratinocitos epidérmicos acumulados– no adherentes de un peculiar tono blanco-nacaradas y con borde bien delimitado. Estas lesiones pueden picar, doler, agrietarse e incluso sangrar, siendo sus localizaciones más frecuentes las superficies de extensión articular (codos y rodillas), la zona sacra y el cuero cabelludo (Figura 4), aunque puede afectar a cualquier otra parte del cuerpo.
En todo caso, la psoriasis se manifiesta con una gran variabilidad clínica entre distintos pacientes y a lo largo del tiempo para un mismo paciente, pudiendo coexistir en un momento dado distintas formas clínicas, que se definen a continuación (Figura 5):
- La psoriasis en placas o psoriasis vulgar constituye la forma clínica más frecuente (80-90% de los casos), y su nombre hace referencia precisamente a las citadas formaciones escamosas. Se trata de placas bien delimitadas con una distribución bilateral y simétrica en la mayoría de los casos, aunque pueden confluir y formar figuras policíclicas. El porcentaje del cuerpo afectado por las placas psoriásicas puede variar desde una forma leve (< 3% de la superficie corporal afectada) hasta las formas más graves (> 10%), pasando por la forma moderada (3-10%). La gran mayoría de pacientes suele presentar formas leves, pero los casos moderados-graves pueden llegar a representar hasta uno de cada tres casos totales y pueden provocar un importante deterioro de la calidad de vida, con altos niveles de discapacidad física, psicológica o sociolaboral. Se considera como una enfermedad crónica de curso variable, con periodos de brotes y remisiones alternantes, y que suele manifestarse por vez primera en dos grupos de edad: 16-22 y 57-60 años.
- La denominada psoriasis en gotas (o psoriasis guttata) es un cuadro agudo que suele cursar con numerosas lesiones puntiformes y pequeñas (pápulas < 1 cm), sobre todo en el tronco. Es más común en niños y adolescentes, siendo típica su erupción de forma secundaria tras 10-14 días de una infección estreptocócica, habitualmente de garganta, y que desaparece espontáneamente en 2-3 meses, aunque un tercio de los pacientes puede llegar a desarrollar psoriasis en placas.
- La psoriasis pustulosa es una forma aguda y poco frecuente. Puede ser generalizada (tipo von Zumbusch), como la forma de comienzo de una psoriasis en placas, o aparecer en el curso de una psoriasis crónica. Cursa con una fiebre elevada y brusca, malestar general, eritema con pequeñas pústulas estériles en pocas horas, piel de color rojo escarlata, seca y no descamativa, inflamada y dolorida. Sin tratamiento, puede ser mortal. Puede desencadenarse tras una infección, pero también por la suspensión brusca de corticoides sistémicos. Un subtipo de ésta es la forma localizada de psoriasis palmoplantar, que cursa con brotes repetidos de pequeñas pústulas estériles sobre una base eritematosa en las palmas y las plantas, simétricas, y que suelen secarse, dejando escamas y costras marrones; el 25% de estos pacientes padece además psoriasis en placas.
- Otra forma minoritaria es la psoriasis invertida, en la que las lesiones son de color rojo intenso brillante y sin escamas. Aparecen en los pliegues cutáneos: ingles, axilas, entre las nalgas y en las mujeres debajo de los pechos.
- Finalmente, la psoriasis eritrodérmica consiste en una forma generalizada y grave. Se instaura normalmente sobre cuadros de psoriasis crónica –no bien tratados o tras la suspensión brusca del tratamiento– y se presenta como una eritrodermia exfoliativa seca, que afecta todo el tegumento, incluyendo el pelo y, sobre todo, las uñas.
A grandes rasgos, los síntomas relacionados con la psoriasis y que se reportan con mayor frecuencia son: descamación de la piel (92%) –tanto en el cuero cabelludo (62%) como en otras áreas (89%)–, picor (72-87%), eritema (69%), fatiga (27%), inflamación o hinchazón (23%), quemazón en la piel (20%) y hemorragias debidas al rascado (20%) (Boehncke et al., 2015). También se ha reportado una alta prevalencia de dolor en la piel (62%), brotes (49%), artralgias (42%), agrietamiento de la piel (39%) y sequedad cutánea (34%) (Pariser et al., 2016).
La afectación ocular suele implicar especialmente a los párpados, pero también a la conjuntiva y, en menor medida, a la córnea. La formación de placas psoriásicas y edema en los párpados favorecen la aparición de ectropión cicatricial y triquiasis. Es frecuente la hiperemia conjuntival y
el lagrimeo.
En más del 50% de los pacientes se observa afectación ungueal, y en éstos es más frecuente la artritis psoriásica, que representa una de las complicaciones más importantes de la psoriasis, apareciendo en torno al 20% de pacientes con psoriasis (raramente ocurre en ausencia de lesiones cutáneas), usualmente entre 7 y 12 años tras el inicio de la enfermedad cutánea, y hasta en un 40% de aquellos con la forma más grave (> 10% de superficie corporal afectada), si bien la gravedad de la artritis no guarda relación con la extensión de la psoriasis en la piel. Por lo general, cursa con inflamación, dolor, rigidez e hinchazón en una o más articulaciones, mayoritariamente las de los dedos de manos y pies, la columna lumbar y sacra, las muñecas y las rodillas; también cursa con espondilitis y entesitis.
Dentro de la afectación articular, la forma más común (50-70%) es la oligoarticular asimétrica seronegativa6, que afecta de forma característica a las articulaciones interfalángicas distales de algunos dedos de las manos, que aparecen inflamados (originando dactilitis o “dedos en salchicha”) (Figura 6). La artritis psoriásica tiene una evolución habitualmente progresiva y un tercio de los pacientes llega a tener un grado importante de dolor crónico, deformación de las articulaciones afectadas y hasta limitación de la movilidad (por ejemplo, de las manos). Las formas poliarticulares y algunas axiales (que cursan, por ejemplo, con dolor inflamatorio en la espalda) son las de peor pronóstico. Aunque la artritis psoriásica no se cura, se puede controlar bien con tratamiento analgésico y antiinflamatorio, y modificador de la progresión del daño en la articulación afectada.
Por otra parte, la psoriasis puede complicarse con infecciones, favorecidas por el rascado y la farmacoterapia inmunosupresora. E incluso algunos autores la asocian con un aumento del riesgo de desarrollar algunos tipos de cáncer, como linfoma y cáncer de piel (razón de probabilidad u odds ratio de 2,95) (Gelfand et al., 2003), estando el riesgo de este último también incrementado por algunos de los medicamentos o procedimientos empleados en su tratamiento. En definitiva, si no se trata o se demora el tratamiento, la psoriasis en general, y la artritis psoriásica en particular, puede causar discapacidad funcional importante y tener un impacto muy negativo en la calidad de vida de los pacientes, incluso con una afectación de la superficie corporal relativamente limitada, por lo que es muy importante su diagnóstico precoz (Augustin et al., 2014).
Adicionalmente, debe considerarse, como con otras enfermedades de la piel, el alto impacto psicosocial –asociado, sobre todo, al componente estético y al miedo a sufrir estigmatización o rechazo–, que puede afectar a muchas áreas de la vida de una persona, incluyendo su familia, las relaciones sociales, ámbito laboral, ocio, estilo de vida, comportamiento y humor. De hecho, una creciente evidencia respalda la asociación de la psoriasis con una frecuencia mayor de lo normal de depresión (en hasta el 60% de pacientes) y ansiedad; diversos trabajos reportan también una autoestima baja que conduce al aislamiento social, e incluso a disfunción sexual e ideaciones suicidas.
Conviene subrayar, por último, que la complejidad de la etiopatogenia de la psoriasis hace que se relacione con diversas comorbilidades, de las que se conoce en detalle su efecto y gravedad, pero no tanto su interconexión con la psoriasis. Entre ellas, destaca el riesgo elevado de padecer diabetes mellitus tipo 2 y síndrome metabólico (odds ratio de 3,58) (Gelfand et al., 2012), y, como ocurre con otras enfermedades autoinmunes, la inflamación a nivel vascular incrementa el riesgo de aterosclerosis y de enfermedad cardiovascular de estos pacientes, que determina mayores tasas de morbilidad y mortalidad. Por todo ello, se recomienda iniciar el tratamiento lo antes posible.
En vista de todo lo anterior, se ha replanteado la definición de psoriasis (Figura 7), que puede considerarse de forma más precisa como una dermatosis inflamatoria crónica, recidivante e inmunológicamente mediada, que tiene una participación multiorgánica con afectación del aparato locomotor, un significativo efecto negativo sobre el bienestar físico, emocional y psicológico de los pacientes, y una asociación a diversas patologías concomitantes.
Diagnóstico
El diagnóstico de la psoriasis es eminentemente clínico, en base a los signos y síntomas previamente comentados, y en muy escasas ocasiones es necesario recurrir a una biopsia para confirmarlo. Suele ser suficiente con una exploración física del paciente, de la piel sin ropa, pues a veces las lesiones pueden aparecer en lugares poco visibles como genitales, pliegos axilares, ingles o pliego interglúteo, plantas de los pies o cuero cabelludo. Además, en caso de que el paciente presente dolores articulares, es necesaria una exploración articular completa por un reumatólogo. No hay ninguna analítica sanguínea que permita el diagnóstico de psoriasis, aunque puede ser útil para comprobar la ausencia de contraindicaciones cuando se plantea un tratamiento sistémico, o para investigar eventos adversos relacionados con el mismo.
El diagnóstico diferencial se ha de realizar con otras dermatosis como el eccema numular, dermatofitosis, pitiriasis rosada o rubra, liquen plano, dermatitis atópica o seborreica o de contacto, intértrigo candidiósico, sífilis secundaria, liquen plano, pénfigo benigno familiar, u otras afecciones de la piel menos comunes (dermatosis pustulosa subcórnea, eccema dishidrótico, lupus eritematoso discoide crónico o linfoma cutáneo de células T). Hay que subrayar también que la artritis psoriásica es una complicación a menudo infradiagnosticada, en hasta un 30% de pacientes con diagnóstico de psoriasis, debiéndose sospechar su presencia en pacientes con factores de riesgo reconocidos, tales como afectación ungueal o en el espacio interglúteo o perianal.
Ante cualquier sospecha, adquiere gran relevancia en el diagnóstico la evaluación de la morfología de las lesiones y de su distribución, que determinarán el tipo (psoriasis en placas, psoriasis guttata, psoriasis eritrodérmica, o psoriasis pustulosa) y la gravedad de la enfermedad (Kim et al., 2017). Existen diversas escalas de valoración para evaluar –de la forma más objetiva posible– la severidad de la psoriasis, que permitirán tomar decisiones terapéuticas estandarizadas, inicialmente y a lo largo del proceso terapéutico tras la evaluación de la respuesta al tratamiento. Las más empleadas tanto en ensayos clínicos como en la práctica clínica habitual se resumen en la Tabla 1.
Quizá la combinación de parámetros más empleada en el diagnóstico, por su mayor utilidad (en base a la información que aportan), es la de datos de BSA con el índice PASI. Por ejemplo, si el paciente presenta un BSA del 15% y un PASI < 10, puede decirse que padece una forma extensa de enfermedad con eritema, descamación e infiltración discretos. La valoración del índice PASI ofrece, además de la valoración del paciente en un momento dado, considerar índices de eficacia de un tratamiento: PASI-50 es el valor PASI que supone una reducción del 50% del valor del PASI basal de un paciente al inicio de un tratamiento concreto; PASI-75 es el valor de PASI que supone una disminución del 75% del PASI basal (ha sido clásicamente considerado como indicativo de adecuada respuesta clínica); y PASI-90 implica que el PASI actual es el 10% del inicial y se considera hoy en día como el paradigma de eficacia en los estudios que evalúan los nuevos fármacos biológicos (Boehncke et al., 2015; Greb et al., 2016).
Tratamiento
La psoriasis ha recibido atención terapéutica especial desde los tiempos de los egipcios, por la visibilidad y cronicidad de sus manifestaciones, y ha sido durante siglos objeto de diversos tipos de curas milagrosas, utilizadas con poco éxito. Fue a partir de la segunda mitad del siglo XX cuando se inició una nueva era, de lenta pero progresiva evolución, desde la aparición y desarrollo de la fototerapia, el metotrexato, los retinoides y la ciclosporina. Esos tratamientos, ya considerados “clásicos” (aunque siguen siendo piedra angular en el manejo de muchos pacientes), permitieron pasar del uso exclusivo de cremas al tratamiento sistémico, asumiendo por primera vez que la psoriasis era algo más que una afección cutánea. Pero ha sido a partir de los primeros años del siglo XXI cuando la investigación farmacológica en psoriasis y artritis psoriásica ha vivido una auténtica revolución, gracias a un progresivo conocimiento de la fisiopatología de las enfermedades autoinmunes en general, que ha permitido abrir nuevas líneas terapéuticas con fármacos selectivos, los llamados “biológicos”, obtenidos por técnicas de ingeniería genética. Los nuevos tratamientos han superado la eficacia y han reducido en muchos casos la toxicidad que presentaban los tratamientos más clásicos, ofreciendo alternativas en casos que no las tenían.
Grosso modo, dado que no existe un tratamiento curativo, el objetivo del tratamiento de la psoriasis será el de mantener la piel libre de lesiones durante el máximo tiempo posible o conseguir que remitan, ejerciendo también un control sobre la inflamación sistémica, para prevenir la aparición y progresión de comorbilidades. La selección del mismo dependerá del área afectada, la presencia o ausencia de artritis, el espesor de las placas y escamas y el impacto en la calidad de vida. No será un tratamiento exclusivamente farmacológico de la patología cutánea y/o articular, sino que el abordaje óptimo del paciente debe ser integral y multidisciplinar, incluyendo tratamientos adyuvantes no farmacológicos que minimicen la afectación psicológica y social. La calificación de los resultados terapéuticos depende en buena medida de la aceptación de los pacientes, sus criterios estéticos y su propia personalidad.
Se ha demostrado que, cuanto antes se instaure el tratamiento y se detenga el proceso inflamatorio, más probable es que el pronóstico –y el daño radiológico en artritis psoriásica– a largo plazo mejore, conservando el paciente un mayor grado de funcionalidad. Se describen a continuación los principales tratamientos actualmente disponibles, muchos de los cuales son efectivos no solo para la patología cutánea, sino también para el tratamiento de la artropatía.
1. Tratamiento farmacológico
En líneas generales, la mayoría de fármacos indicados en psoriasis se dirigen a bloquear o suprimir la respuesta (auto)inmunitaria que subyace en la patogénesis de esta enfermedad, lo cual suele traducirse inevitablemente en importantes efectos adversos, incluyendo la reactivación de infecciones latentes, así como una reducción de los mecanismos de inmunovigilancia frente a células tumorales, entre otros.
Hay cierto consenso en la comunidad científica internacional en las estrategias terapéuticas a desarrollar ante un caso de psoriasis de nuevo diagnóstico (Figura 8), como reflejan las guías de práctica clínicas específicas a nivel internacional, siendo una de las más relevantes la del NICE británico (National Institute for Health and Care Excellence), revisada por última vez en 2017 (NICE, 2017). Así, la primera línea de tratamiento en la psoriasis vulgar serían los tratamientos tópicos tradicionales (corticosteroides, vitamina D y análogos, y la brea de hulla o coaltar). La segunda línea incluye la fototerapia, bien a base de luz ultravioleta B de banda ancha o estrecha o de la combinación de luz ultravioleta A con psoralenos (terapia PUVA), y la administración sistémica de fármacos “clásicos” no biológicos, como ciclosporina, metotrexato y retinoides. La tercera línea, indicada en psoriasis moderada a grave, incluye el uso de una de las terapias biológicas sistémicas disponibles; una minoría de pacientes, con una pobre o nula respuesta al tratamiento biológico, exigirá la adición de un segundo fármaco biológico.
1.1. Tratamiento tópico
La farmacoterapia por vía tópica se indica en los casos de psoriasis en placas leve a moderada y como tratamiento adyuvante en situaciones más graves. Por sí sola puede no conseguir el control de la enfermedad (especialmente en casos extensos) y tiene el inconveniente de que la adherencia al mismo es muy baja. En su selección deben tenerse en cuenta las preferencias del paciente, la aceptabilidad cosmética y el lugar y la extensión a tratar: en áreas extensas se aplicarán cremas, lociones o geles; en el cráneo y zonas pilosas, lociones, soluciones o geles; y ungüentos en zonas con escamas muy adherentes. El tratamiento tópico debe continuarse hasta alcanzar los resultados deseados o durante el tiempo máximo en que pueda aplicarse (si se usan corticosteroides). Tras un tratamiento inicial que se muestra eficaz, se puede retomar el tratamiento siempre que sea necesario, a sabiendas de que las recaídas son frecuentes al suspenderlo.
Se valoran las siguientes opciones de tratamiento tópico:
- Los agentes queratolíticos reducen el espesor de las placas y facilitan el acceso de otros fármacos a la piel, empleándose como adyuvantes a otros tratamientos, a fin de hidratar, evitar la aparición de fisuras y eliminar las escamas (sobre todo a nivel de cuero cabelludo; no deben aplicarse en pliegues). Entre ellos, el ácido salicílico no es demasiado eficaz, pero es barato y bien aceptado por los pacientes; se dispone, por ejemplo, de asociaciones de corticosteroides con ácido salicílico (Diprosalic®, Elocom PLUS®, Ionil champu®) que persiguen una mayor eficacia y mejorar la adherencia al tratamiento corticoideo.
- La brea de hulla o coaltar es una mezcla compleja de hidrocarburos, con propiedades queratoplásticas (estimula la renovación celular epidérmica), astringentes, vasoconstrictoras, antipruriginosas y antisépticas. Con una mayor potencia que el anterior, reduce el número y el tamaño de las células epidérmicas: si bien sus efectos queratolíticos son lentos, produce remisiones generalmente prolongadas en los pacientes sensibles al tratamiento. Su mecanismo de acción exacto se desconoce, pero se ha sugerido que algunas de las sustancias polifenólicas que la integran –como el ditranol (o antralina)– puedan reaccionar con los grupos sulfhidrilo de los queratinocitos produciendo un efecto similar a la luz solar; otras sustancias captan el oxígeno favoreciendo un efecto antimitótico. Se emplea tanto en la psoriasis como en otras condiciones descamativas (por ejemplo, dermatitis seborreica o caspa), aunque presenta el inconveniente de su olor desagradable; además, puede provocar eventualmente irritación, alergia de contacto y foliculitis. Por su carácter fotosensibilizante, se administra por la noche y debe lavarse por la mañana para evitar la exposición solar; por ese mismo motivo, no debe administrarse con otros medicamentos fotosensibilizantes. Está disponible en solución para pulverizacion (Alfitar®) y en champú (Piroxgel®, Tarmed®), formulaciones con mayor aceptabilidad –pero menor eficacia– que la brea de hulla pura.
- Corticosteroides tópicos: están fundamentalmente indicados en la psoriasis en placas, y su selección dependerá de la localización y la gravedad de las lesiones y de la edad del paciente (Tabla 2). Producen efectos rápidos y potentes, pero la duración de las remisiones es más bien corta, debiendo ser administrados en ciclos de corta duración de forma intermitente. El empleo de corticoides muy potentes (por ejemplo, clobetasol dipropionato) debe evitarse en niños y jóvenes, así como en casos de lesiones faciales o intertriginosas, y en adultos deben reservarse para el tratamiento de placas crónicas resistentes: se pueden considerar de primera elección en la psoriasis leve que no responde a otros tratamientos tópicos y en determinadas localizaciones como la cara, el cuero cabelludo, los pliegues o los genitales (localizaciones que no toleran otros tratamientos tópicos). Cuando se empleen fármacos potentes o muy potentes se recomienda interrumpir la administración durante 4 semanas sustituyéndolos por un análogo de vitamina D o brea de hulla. Todos los fármacos de este grupo presentan el inconveniente de que, tras la suspensión del tratamiento, la enfermedad puede reactivarse.
- Entre los análogos hormonales de la vitamina D, se dispone –en formas de pomadas, espumas o geles cutáneos– de calcitriol (Silkis®), calcipotriol (Daivonex®) y tacalcitol (Bonalfa®), que ejercen un efecto modulador de la respuesta inmunitaria. Estas sustancias se emplean en la mayor parte de los tipos de psoriasis (en psoriasis vulgar solo si es leve-moderada con < 35% de BSA) y son la opción preferida como tratamiento de mantenimiento, por su capacidad de inducir la diferenciación de los queratinocitos e inhibir su proliferación. Su eficacia es similar a la de los corticoides (con mayor incidencia de eventos adversos locales) e incluso inducen periodos de remisión algo más largos que aquellos; también suelen producir mejores resultados que la brea de hulla. Su absorción sistémica es de aproximadamente un 10% de la dosis administrada para el calcitriol, un 1-5% para el calcipotriol y del 0,5% para el tacalcitol, motivo por el cual estos dos últimos son los más empleados. Calcipotriol puede producir irritación local, por lo que no debe aplicarse sobre la cara, las flexuras o el área genital; en estas será preferible tacalcitol, que es menos irritante. En la formulación de estos medicamentos se emplean excipientes grasos que aportan también un efecto beneficioso, aunque pueden reducir su aceptabilidad por algunos pacientes.
- Cabe destacar que, en pacientes con psoriasis en el cuerpo y el cuero cabelludo, la terapia combinada con análogos de vitamina D y corticosteroides funciona mejor que cualquiera de estos solos, y actualmente es la opción preferente de tratamiento. Así, existen formulaciones que asocian calcipotriol y corticoides como betametasona (Daivobet®, Enstilar®, Prenamid®), permitiendo reducir discretamente los efectos adversos cutáneos de los corticoides; son los medicamentos más prescritos de este grupo.
- Una última opción de tratamiento tópico serían los retinoides, análogos estructurales de carácter aromático de la vitamina A o ácido retinoico, que actúan –a través de la activación de receptores nucleares específicos del ácido retinoico (RAR)– sobre diversas actividades biológicas en la piel, entre ellas, la proliferación y diferenciación celular, la función inmunológica, la inflamación y la producción de sebo. Administrados por vía tópica, tienen una eficacia similar a los corticosteroides tópicos en pacientes con psoriasis vulgar, en lo que se refiere a la elevación de las placas psoriásicas (revierten los cambios hiperqueratósicos), pero su efecto es algo menor en cuanto a la reducción del eritema. Actualmente se dispone únicamente de tazaroteno formulado en gel (Zorac®), que se indicado en psoriasis leve a moderada que no afecte a más de un 10% de la superficie corporal. Por su potencial teratógeno, su uso debe ser estrictamente vigilado en mujeres en edad fértil, estando contraindicado en embarazo o en su planificación. La combinación de tazaroteno y corticosteroides produce mejores resultados que el tazaroteno solo.
En resumen, la Figura 9 recoge el algoritmo de tratamiento tópico de la psoriasis en adultos propuesto en la Guía clínica sobre valoración y manejo de la psoriasis del NICE británico (NICE, 2017). La Figura 10 muestra las estructuras químicas de los principales fármacos usados por vía tópica para el tratamiento de la psoriasis.
1.2. Fototerapia
A medio camino hacia el tratamiento sistémico, la fototerapia es el tratamiento de elección en aquellos casos diseminados o refractarios al tratamiento tópico, pero que no se consideran lo suficientemente graves para el uso de terapia sistémica. La fototerapia con el uso de lámparas de radiación ultravioleta (UV) constituye, pues, otro de los puntales del manejo de la psoriasis en placas, siendo ineficaz en el resto de formas clínicas.
Según la longitud de onda, se distinguen dos tipos básicos de radiación que pueden usarse con tal fin. La de longitud de onda más larga (UV-A) tiene una menor capacidad de penetración en la piel, por lo cual requiere la administración previa de sustancias que sensibilicen la piel, generalmente psoralenos; esta forma de tratamiento es lo que se conoce como terapia PUVA (psoralenos + UVA) o fotoquimioterapia. Es el tratamiento más eficaz disponible para la psoriasis en placas: su acción es lenta, pero produce periodos prolongados de remisión. No obstante, por considerarse un factor de riesgo para determinados tipos de cáncer, debe evitarse en pacientes con fototipos claros y en aquellos que tengan otros factores de riesgo de desarrollo de cáncer. Dado que dicho riesgo se incrementa con el número de exposiciones7, tampoco es recomendable en niños o jóvenes: en la práctica, la terapia PUVA se restringe a casos graves refractarios en pacientes de edad media. Por otro lado, también se puede emplear la radiación de longitud de onda más corta (rayos UV-B, preferiblemente de banda estrecha), que tiene una mayor capacidad de penetración y no requiere ninguna sustancia sensibilizante, si bien se suele emplear brea de hulla de forma previa; este método es conocido como fototerapia.
1.3. Tratamiento sistémico
A base de fármacos con efectos antiproliferativos, va a ser la última opción de tratamiento, aunque relativamente frecuente en casos de psoriasis vulgar moderada-grave y extensa que no responde a otros tratamientos, formas eritrodérmicas y pustulosas y formas incapacitantes (artritis psoriásica). La elección del medicamento debe individualizarse en cada paciente teniendo en cuenta su edad, el fenotipo de la enfermedad y su patrón de actividad, comorbilidades y posibles planes de concepción, así como los tratamientos previos.
a) Fármacos antiinflamatorios
En pacientes que padecen artropatía psoriásica es conveniente coordinar el tratamiento con el reumatólogo. El objetivo terapéutico será controlar el dolor, reducir la inflamación articular y detener la evolución de la enfermedad. La farmacoterapia de la artritis psoriásica suele iniciarse –en los casos más leves– con antiinflamatorios no esteroideos (AINE), que suelen mejorar la inflamación articular, pero podrían empeorar la psoriasis a nivel cutáneo.
En caso de no mejorar, puede entonces recurrirse a pequeñas dosis de corticoides sistémicos, especialmente en aquellas artritis leves-moderadas que afectan a las articulaciones de las manos. En muchos casos, es preferible la aplicación de los mismos en forma de infiltraciones intraarticulares, sobre todo cuando una articulación o la vaina de un tendón están muy inflamadas.
Los corticosteroides por vía sistémica constituyen igualmente una opción para el tratamiento de la psoriasis pustulosa en el embarazo (generalmente ocurre en el 1er trimestre) y en situaciones agudas, mientras hacen efecto otros medicamentos, o si ésos están contraindicados. Su uso sistémico debe hacerse con precaución para evitar sus efectos adversos sobre la piel (atrofia dérmica, estrías, etc.) y sobre el eje hipotálamo-hipófisis-adrenal. Se emplean, por vía oral o intravenosa, los siguientes fármacos: deflazacort (Dezacor®, Zamen® y EFG), dexametasona (EFG), hidrocortisona (Hidroalterona®), metilprednisolona (Solu-moderin®, Urbason® y EFG), prednisona (varios medicamentos), prednisolona (Estilsona®) y triamcinolona acetónido (Trigon Depot®).
b) Fármacos antirreumáticos modificadores de la enfermedad (FAME)
Si la artritis psoriásica no es controlada con antiinflamatorios se recurre a los llamados FAME, con los que un porcentaje significativo de pacientes presenta una importante mejoría de la enfermedad, reduciéndose también las lesiones cutáneas. Son potentes inmunosupresores clásicos ampliamente utilizados como primera opción en el tratamiento de las formas activas moderadas o graves de psoriasis. Es importante resaltar que estos fármacos actúan lentamente y, en ocasiones, su eficacia no es evidente hasta 3-4 meses después de iniciado el tratamiento, siendo habitual su administración conjunta con antiinflamatorios.
El más el más utilizado es, sin duda, el metotrexato (Bertanel®, Imeth®, Metoject®, Metoject Pen®, Metotrexato Wyeth®, Nordimet®, Quinux® y EFG), un antagonista del ácido fólico perteneciente a la clase de fármacos citotóxicos conocidos como antimetabolitos, que actúa por inhibición competitiva de la enzima dihidrofolato reductasa, bloqueando así la síntesis normal del ADN. Aunque no se ha esclarecido por completo si su eficacia en esta patología se debe a su efecto dual antiproliferativo y antiinflamatorio, se considera como una primera elección en las formas graves de psoriasis en placas refractarios a las terapias tópicas, la psoriasis pustulosa y la psoriasis eritrodérmica, y se administra con ácido folínico para prevenir su hepatotoxicidad. Produce una mejoría en 7-14 días y su respuesta es máxima en 4-8 semanas. Se administra –por vía oral o parenteral– de forma incremental hasta un máximo de 25 mg/semana, ajustando así la mínima dosis terapéutica para mantener la remisión. La leflunomida (Arava® y EFG) supone una alternativa a metotrexato en la artritis psoriásica.
Si la respuesta al tratamiento no es la adecuada, se puede recurrir a la ciclosporina (Sandimmun®, Sandimmun Neoral® y EFG), un agente inmunosupresor que actúa mediante la inhibición de la calcineurina en las células T, bloqueando especialmente la producción de anticuerpos dependientes de células T colaboradoras (Th), aunque también inhibe la producción y liberación de citocinas (sobre todo, de IL-2). Tiene una eficacia clínica similar –aunque una respuesta terapéutica algo más lenta– a la del metotrexato en la psoriasis en placas y en la psoriasis pustulosa, pero algo menor en la psoriasis eritrodérmica y en la artritis psoriásica. Pese a que se utiliza en dosis muy inferiores a las empleadas en la prevención del rechazo en el trasplante de órganos, su nefrotoxicidad constituye uno de los factores limitantes para su empleo.
En general, el metotrexato, la ciclosporina, los UV-B y los PUVA se consideran las formas más eficaces de tratamiento sistémico de los casos graves o moderadamente graves de psoriasis, facilitando la desaparición prácticamente completa de las manifestaciones clínicas en gran parte de los pacientes. Una vez alcanzado este objetivo, el tratamiento puede ser reducido o incluso suspendido, al menos hasta que se produzca una eventual recidiva.
Dentro de este grupo de fármacos sistémicos no biológicos (Figura 11), pero no considerados FAMEs como tal, también se dispone del retinoide acitretina (Neotigason® y EFG). Está indicada en psoriasis extensa grave que no responde a otros tratamientos y psoriasis palmoplantar pustular, además de la ictiosis. Constituye una alternativa en pacientes inmunodeprimidos que no pueden ser tratados con otros inmunosupresores potentes. Debe advertirse su contraindicación, por su efecto teratógeno, si la paciente planea un embarazo o está ya embarazada, debiéndose contemplar una anticoncepción eficaz hasta 2 años después del tratamiento. Tanto acitretina como ciclosporina y metotrexato se asocian a toxicidad significativa sobre diversos órganos y tienen limitaciones en los tratamientos a largo plazo de formas crónicas de psoriasis.
Por su parte, apremilast (Otezla®) es un inhibidor oral selectivo de la fosfodiesterasa de tipo 4 (PDE4) indicado, solo o en combinación con otros FAME, en el tratamiento de la artritis psoriásica activa en adultos refractarios o intolerantes al tratamiento previo con un FAME, y en el tratamiento de la psoriasis en placas crónica moderada-grave en adultos que no han respondido, tienen contraindicado o no toleran otro tratamiento sistémico, incluyendo ciclosporina, metotrexato o terapia PUVA. Al inhibir a la enzima PDE4, implicada en el metabolismo de AMPc, incrementa los niveles intracelulares de éste y facilita la reducción de la expresión de citocinas proinflamatorias, fundamentalmente TNF-α e IL-12; asimismo, parece modular los niveles de otras citocinas, en este caso de carácter antiinflamatorio, como la IL-10.
También tienen indicación en el tratamiento sistémico de la enfermedad, aunque se emplean en menor medida, los siguientes fármacos:
- Dimetilfumarato (Skilarence®, comprimidos): junto a su metabolito monometilfumarato, ejerce efectos antiinflamatorios e inmunomoduladores que, aunque no se han esclarecido completamente, se ha postulado que se deben principalmente a la interacción con el glutatión reducido intracelular de las células implicadas directamente en la patogenia de la psoriasis; dicha interacción provoca la inhibición de la translocación al núcleo y de la actividad transcripcional del factor nuclear potenciador de las cadenas ligeras κ de los linfocitos B activados (NF-κB). Se cree que la actividad inmunomoduladora del fármaco provoca una conversión de los linfocitos T colaboradores del perfil Th1 y Th17 a un fenotipo Th2, de manera que se reduce la producción de citocinas inflamatorias con inducción de eventos proapoptóticos, inhibición de la proliferación de queratinocitos, expresión reducida de moléculas de adhesión y disminución de los infiltrados inflamatorios en las placas psoriásicas. Se recomienda iniciar el tratamiento de formas moderadas-graves de psoriasis con dosis bajas (30 mg/día) para ir aumentando semanalmente, hasta un máximo permitido de 720 mg/día. Con una toxicidad principalmente a nivel gastrointestinal, está contraindicado en pacientes con trastornos gastrointestinales graves, insuficiencia renal o hepática grave, y en embarazadas o lactantes.
- Tofacitinib (Xeljanz®, comprimidos): se indica, en combinación con metotrexato y a la dosis de 5 mg/2 veces al día, para el tratamiento de pacientes adultos con artritis psoriásica activa refractarios o intolerantes a un FAME previo. Se trata de un inhibidor potente y selectivo de enzimas cinasas de la familia de las JAK: inhibe preferentemente las señales de transducción activadas por receptores de citocinas heterodiméricos que se unen a JAK3 y/o a JAK1, con mayor selectividad que aquellos que actúan a través de JAK2. De esa forma, atenúa las señales de transducción activadas por las interleucinas (IL-2, -4, -6, -7, -9, -15 y -21) y los interferones de tipo I y II, modulando así la respuesta inmunitaria e inflamatoria.
c) Fármacos biológicos
En los últimos 10-15 años se han incorporado al arsenal terapéutico diversos agentes biológicos obtenidos mediante tecnología de ADN recombinante que actúan sobre distintas dianas terapéuticas implicadas en la patogénesis de la psoriasis (TNF-α, interleucinas, etc.) y otras muchas enfermedades autoinmunes (por ejemplo, artritis reumatoide o espondilitis anquilosante), por lo que comparten diversas indicaciones. En general, se recurrirá a este tipo de tratamientos cuando el paciente requiera tratamiento sistémico y no responda o tolere otros medicamentos y su enfermedad tenga un impacto negativo sobre su estado funcional y psicosocial.
El tratamiento con estos fármacos debe iniciarse bajo la supervisión de un especialista, consensuando con el paciente su administración y el seguimiento que se haga del tratamiento, y de acuerdo con otros especialistas cuando la situación del paciente exija un abordaje multidisciplinar (en caso de comorbilidades importantes). Hay que recordar que, al cambiar de un FAME a un medicamento biológico, con la excepción del metotrexato, o si la enfermedad es inestable, el biológico debe iniciarse pasado 1 mes tras la última dosis del inmunosupresor. De igual modo, en el cambio de un fármaco biológico a otro debe plantearse una estrategia de transición, teniendo en cuenta la farmacología de los principios activos en cuestión, la situación del paciente y su perspectiva de los beneficios y riesgos de este cambio.
Teniendo en consideración la relevancia del TNF-α en el desarrollo de la inflamación asociada a la psoriasis, la terapia biológica anti-TNF-α fue la primera en incorporarse al tratamiento de formas graves de psoriasis vulgar, refractarias a los tratamientos previamente citados. Fue desarrollada precisamente para bloquear esta citocina e impedir o limitar su actividad y, en consecuencia, reducir las interacciones entre las células inmunitarias y los queratinocitos. La neutralización del TNF-α impide su interacción con sus receptores (TNFR1) y, con ello, la subsiguiente cascada bioquímica que, entre otros efectos, desembocaría en la activación del NF-κB, un complejo proteico presente en la mayoría de tipos de células animales e implicado en la respuesta celular frente a estímulos como el estrés, las citocinas, la radiación UV y antígenos diversos; NF-κB juega un papel clave en la regulación de la respuesta inmunitaria, dado que las cadenas ligeras kappa son componentes básicos de las inmunoglobulinas. Otras consecuencias del bloqueo del TNF-α son el cambio en los niveles de las moléculas de adhesión responsables de la migración leucocitaria (ELAM-1, VCAM-1 e ICAM-1) y la disminución de los niveles de metaloproteinasas matriciales (MMP-1 y MMP-3), responsables de la remodelación tisular (Figura 12).
Por orden de antigüedad en su comercialización en España, los fármacos anti-TNF-α aprobados para tratar la psoriasis y actualmente disponibles son infliximab (1999), adalimumab (2003), etanercept (2006) y certolizumab pegol (2009). Todos ellos tienen autorización adicional, bien en monoterapia o en combinación con FAMEs, para su uso en el tratamiento de la artritis psoriásica activa en adultos, cuando la respuesta previa al tratamiento con FAMEs haya sido inadecuada. Otro agente anti-TNFα disponible en nuestro país, el golimumab (2009), que no se usa para tratar la psoriasis en placas, está indicado en artritis psoriásica, artritis reumatoide, colitis ulcerosa y espondilitis anquilosante.
- Infliximab: es un anticuerpo monoclonal quimérico humano de origen murino (ratón) que se une con alta afinidad tanto a la forma soluble como a la transmembrana del TNF-α, pero no a la linfotoxina α (TNFβ). El medicamento original es Remicade®, aunque se han comercializado en España 3 biosimilares: Flixabi®, Inflectra® y Remsima®; todos ellos son de administración intravenosa. Los eventos adversos más frecuentemente descritos (> 10%) con infliximab son infecciones del tracto respiratorio superior (gripe, sinusitis, etc.), herpes, cefalea, dolor abdominal, náuseas y dolor y otras reacciones locales en el punto de inyección. Entre las más graves, sobresale la reactivación de infecciones producidas por virus de la hepatitis B (VHB), insuficiencia cardiaca congestiva, infecciones como septicemia, infecciones oportunistas y tuberculosis, reacciones de hipersensibilidad retardada, reacciones hematológicas, síndrome pseudolúpico, enfermedades desmielinizantes, y el riesgo de aparición de neoplasias malignas (linfomas, leucemia, melanoma, etc.).
- Adalimumab: es un anticuerpo monoclonal que, a diferencia de infliximab, es completamente humanizado, si bien los efectos farmacodinámicos principales son superponibles. El medicamento original es Humira®, y se han comercializado en España 5 biosimilares: Amgevita®, Hulio®, Hyrimoz®, Idacio® e Imraldi®. De administración subcutánea, se usa en artritis psoriásica a la dosis de 40 mg/2 semanas, con una dosis inicial de 80 mg. Los eventos adversos más frecuentemente descritos (> 10%) con adalimumab son infecciones del tracto respiratorio inferior y superior (neumonía, sinusitis, faringitis, nasofaringitis y neumonía por herpesvirus), leucopenia (incluyendo neutropenia y agranulocitosis) y anemia, hiperlipemia, cefalea, trastornos gastrointestinales (dolor abdominal, náuseas y vómitos), aumento los niveles de enzimas hepáticas, erupciones exantemáticas y exfoliativas, dolor musculoesquelético y reacciones –dolor y exantema– en el punto de inyección. Se han notificado reacciones adversas graves que afectan al sistema inmunitario, susceptibles de reducir la defensa del cuerpo contra infecciones y cáncer: infecciones mortales o que amenazan la vida del paciente (incluyendo sepsis, infecciones oportunistas y tuberculosis), reactivación del VHB y varios tipos de tumores.
- Etanercept (Enbrel® es el original; Benepali® y Erelzi®, los biosimilares): es una proteína de fusión formada por dos moléculas de receptor p75 soluble (sTNFR2), ligadas entre sí por una fracción Fc de IgG1 humana. Actúa inhibiendo de forma competitiva la unión del TNF a los receptores de membrana, impidiendo las respuestas celulares e inactivando biológicamente al TNF. Así, modula las respuestas biológicas inducidas por el TNF, entre las que cabe incluir a las moléculas de adhesión, otras citocinas séricas y las metaloproteinasas matriciales. Los receptores solubles de tipo dímero, como es el caso del etanercept, tienen una mayor afinidad hacia el TNF que los receptores monoméricos, y una potencia notablemente mayor de inhibición competitiva de la unión del TNF a los receptores de membrana. Además, la utilización de la fracción Fc como elemento de fusión del dímero en etanercept permite una mayor semivida de eliminación y, con ello, un efecto bloqueante más prolongado. Su posología por vía subcutánea es de 25 mg 2 veces por semana o de 50 mg 1 vez por semana. Los eventos adversos más frecuentemente descritos (> 10%) con etanercept son infecciones (incluyendo infecciones del tracto respiratorio alto, bronquitis, cistitis, infecciones cutáneas) y reacciones en la zona de inyección (hemorragia, hematomas, eritema, picor, dolor e hinchazón). Se han notificado también reacciones adversas graves que afectan al sistema inmunitario, y su utilización puede afectar a las defensas del organismo frente a infecciones y cáncer, como otros agentes anti-TNF. En concreto, si bien las infecciones graves afectan a < 1 de cada 100 pacientes tratados con etanercept, se han notificado casos de infecciones mortales y potencialmente mortales y sepsis. También se han notificado varias neoplasias –incluyendo cánceres de mama, pulmón, piel y ganglios linfáticos (linfoma)–, reacciones hematológicas, neurológicas y autoinmunes graves –incluyendo casos raros de pancitopenia y muy raros de anemia aplásica, casos raros o muy raros de desmielinización central y periférica–, y algunas notificaciones de enfermedades relacionadas con lupus y vasculitis.
- Certolizumab pegol (Cimzia®): es un fragmento de anticuerpo monoclonal anti-TNF-α que forma complejos estables con las dos formas bioactivas del TNF-α, la soluble (circulante) y la transmembranal, impidiendo su unión a sus receptores fisiológicos y, con ello, la inflamación y el resto de manifestaciones ligadas a la liberación de TNF-α. Certolizumab está unido a una cadena polimérica de poletilenglicol (pegol) con el fin de prolongar su presencia en el organismo: esta combinación disminuye el aclaramiento renal de la molécula, la proteólisis y la inmunogenicidad, prolongando la semivida de eliminación plasmática hasta valores equiparables (~14 días) con el del propio anticuerpo monoclonal completo, del que certolizumab es una fracción. Se recomienda una dosis inicial en adultos de 400 mg en 2 inyecciones subcutáneas de 200 mg en las semanas 0, 2 y 4; la dosis de mantenimiento es de 200 mg/2 semanas o 400 mg/mes. En cuanto a los aspectos toxicológicos, la incidencia de eventos adversos en los ensayos controlados con placebo en combinación con metotrexato fue de aproximadamente 67-68% (vs. 62% con placebo), con tasas de suspensión del tratamiento del 5% (vs. 2,5% con placebo). El evento adverso más común fueron las infecciones (15,5% vs. 7,6% con placebo); otros eventos adversos frecuentes (1-10%) fueron eosinofilia, leucopenia, cefalea, parestesia, hipertensión, aumento de los valores de enzimas hepáticas, exantema, fiebre, astenia, prurito y reacciones locales (dolor y/o induración) en el punto de inyección.
- Golimumab (Simponi®): es un anticuerpo monoclonal humano anti-TNF-α que también forma complejos estables con las dos formas bioactivas del TNF-α, con un grado de afinidad frente a ambas formas 2,4 veces mayor que el infliximab y 1,8 mayor que adalimumab, pero 2,7 veces menos que etanercept. Sin autorización en psoriasis en placas, se administra para el tratamiento de la artritis psoriásica en forma de inyecciones subcutáneas de 50 mg/mes (dosis máxima de 100 mg/mes en pacientes de > 100 kg de peso). Los datos clínicos indican, respecto a su toxicidad, que se asocia con frecuencia a eventos adversos con un perfil similar al de otros agentes anti-TNF-α. La reacción adversa más frecuentemente notificada en los ensayos controlados fue la infección del tracto respiratorio superior –nasofaringitis, faringitis, laringitis y rinitis– (12,6% vs. 11,0% en el grupo control). Con una frecuencia del 1-10% se notificaron: celulitis, gripe, anemia, broncoespasmo, reacciones de hipersensibilidad, urticaria, depresión, insomnio, mareo, parestesias, cefalea, hipertensión, estreñimiento, dispepsia, dolor abdominal, incremento de los valores de transaminasas, alopecia, dermatitis, prurito, fiebre, astenia y dolor/induración en la zona de inyección. Las reacciones adversas más graves relacionadas con el fármaco son infecciones graves (como sepsis, neumonía, tuberculosis, infecciones fúngicas invasivas e infecciones oportunistas), trastornos desmielinizantes, la reactivación del VHB, procesos autoinmunes (síndrome tipo lupus), reacciones hematológicas, hipersensibilidad sistémica grave (incluyendo reacción anafiláctica), vasculitis, linfoma y leucemia.
Con un mecanismo de acción diferente al de todos los fármacos anteriores, se dispone en España de abatacept (Orencia®), un agente biológico autorizado exclusivamente para el tratamiento de la artritis psoriásica activa, solo o en combinación con metotrexato, en adultos refractarios a un tratamiento previo con FAMEs (incluyendo metotrexato), y que no requieran tratamiento sistémico adicional para las lesiones cutáneas psoriásicas. Se trata de una proteína de fusión formada por el dominio extracelular del antígeno 4 asociado al linfocito T citotóxico humano (CTLA-4) unido a un fragmento modificado Fc de la IgG1. Abatacept modula selectivamente una señal coestimuladora clave que es necesaria para la activación completa de los linfocitos T que expresan CD28, la cual requiere dos señales proporcionadas por las CPAs: el reconocimiento de un antígeno específico por un receptor del linfocito T y una segunda señal coestimuladora. Una vía de coestimulación mayor implica la unión de las moléculas CD80 y CD86 sobre la superficie de la CPA al receptor de CD28 en los linfocitos T. Abatacept se une específicamente a CD80 y CD86 e inhibe selectivamente esta vía de coestimulación. Diversos estudios muestran que abatacept modula las respuestas a anticuerpos dependientes de linfocitos T y la inflamación, afectando más a las respuestas de los linfocitos T vírgenes que a las respuestas de los linfocitos T de memoria; además, reduce la producción de TNF-α específico de antígeno, IFN-γ e IL-2 por los linfocitos T.
El otro gran grupo de fármacos biológicos anti-psoriásicos lo constituyen los fármacos activos sobre interleucinas, mediadoras bioquímicas esenciales en la comunicación intercelular para la respuesta inflamatoria.
Entre los agentes neutralizantes de la interleucina 17A8sobresalen secukinumab e ixekizumab, que son dos anticuerpos que se unen y neutralizan a la IL-17A, considerada como uno de los principales inductores de la hiperplasia y diferenciación epidérmica observada en la psoriasis, a través de la formación de NF-κB. Un tanto innovador es el mecanismo del brodalumab, que se une al receptor de la IL-17A (IL-17AR), bloqueando la actividad de la IL-17A, pero también de la IL-17F y del heterodímero IL-17A/F. Estos tres fármacos han sido autorizados para el tratamiento de la psoriasis en placas de moderada a grave en adultos candidatos a tratamientos sistémicos.
- Secukinumab (Consetyx®, comercializado en 2015): es un anticuerpo monoclonal humano de tipo IgG1/κ frente a IL-17A, cuyas cadenas pesadas se encuentran glucosiladas, con restos glucídicos de tipo oligosacárido ligados a la posición Asn307 y constituidos por estructuras complejas sin galactosa o con uno o dos residuos de ésta. Está autorizado también, solo o en asociación con metotrexato, para el tratamiento de la artritis psoriásica activa en adultos refractarios a tratamientos previos con FAME. Se recomienda su administración por vía subcutánea a la dosis de 300 mg/1 vez por semana durante las primeras 4 semanas, seguido de 300 mg/1 vez al mes. Entre sus reacciones adversas, la más frecuentemente notificada en los ensayos clínicos controlados fue la infección del tracto respiratorio superior –nasofaringitis, faringitis, laringitis y rinitis– (29% vs. 19% con placebo). Con una frecuencia del 1-10% también se notificaron herpes oral, rinorrea y diarrea.
- Ixekizumab (Taltz®, comercializado en 2016): es un anticuerpo monoclonal humanizado de tipo IgG4 frente a IL-17A formado por dos cadenas peptídicas ligeras (L) tipo κ idénticas entre sí y otras dos pesadas (H), igualmente idénticas entre sí. Las cadenas H presentan una sustitución en la posición 227 de serina a prolina (S227P), que reduce la capacidad del ixekizumab para inducir la formación de auto-anticuerpos u otras combinaciones de anticuerpos heterólogos, que en ocasiones se observa con las moléculas de IgG4. Asimismo, las cadenas pesadas carecen del aminoácido terminal (eliminación de la lisina de la posición 447). Igual que secukinumab, está autorizado para el tratamiento, solo o en asociación con metotrexato, de la artritis psoriásica activa en adultos refractarios a tratamientos previos con FAME. Se administra en forma de inyecciones subcutáneas a dosis de 160 mg/2 semanas durante las primeras 12 semanas, seguido de 80 mg/1 vez al mes. Desde el punto de vista de la seguridad, ixekizumab presenta un perfil toxicológico relativamente benigno, equiparable al del secukinumab, destacando las infecciones de tracto respiratorio superior (13-14% vs. 13% con placebo) y las reacciones locales en el punto de inyección (13-17% vs. 3%). Con menor frecuencia, se describieron náuseas, infección dérmica por tiña y dolor orofaríngeo. Los porcentajes de pacientes que suspendieron el tratamiento por este motivo fueron similares –o muy ligeramente superiores– a los observados con placebo. Entre un 9% y un 17% de los pacientes tratados con ixekizumab desarrollaron anticuerpos frente a éste, aunque solo en un 1% se asociaron a niveles bajos del fármaco y una pobre respuesta terapéutica.
- Brodalumab (Kyntheum®, comercializado en 2018): es un anticuerpo monoclonal humano de tipo IgG2 que se une con elevada afinidad al receptor A de la interleucina 17 (IL-17RA), y bloquea las actividades biológicas de las citocinas proinflamatorias IL-17A, IL-17F e IL-17A/F; ello se traduce en la inhibición de la inflamación y de los síntomas clínicos de la psoriasis. A pesar de que su mecanismo de acción podría sugerir una eficacia superior, los datos clínicos indican que, en comparación con secukinumab e ixekizumab, logra resultados similares de aclaramiento de la piel a las 12 semanas de tratamiento (si bien no se dispone de estudios directamente comparativos y esas conclusiones derivadas de comparaciones indirectas deben valorarse con prudencia). El perfil toxicológico del brodalumab es benigno, siendo los eventos adversos más comunes registrados: nasofaringitis, dolor de cabeza, infección del tracto respiratorio superior y artralgia; la mayoría fueron leves o moderados en gravedad. Menos del 2% de los pacientes experimentó neutropenia o infección –leve a moderada– por Candida9 , siendo la neutropenia transitoria y no asociada a infecciones. No se aprecian diferencias sustanciales en el perfil de seguridad en comparación con secukinumab e ixekizumab (Cuéllar, 2018).
Por su parte, ustekinumab (Stelara®, comercializado en 2009) es un anticuerpo monoclonal humano con estructura IgG1κ frente a IL-12 e IL-2310, autorizado para el tratamiento de la psoriasis en placas moderada o grave en adultos candidatos a tratamiento sistémico que no responden, tienen contraindicada o no toleran otras terapias sistémicas, incluyendo metotrexato, ciclosporina o PUVA. La IL-12 y la IL-23 contribuyen a la activación de los linfocitos natural killer (NK) y a la activación y diferenciación de los linfocitos CD4+, y su regulación parece estar alterada en pacientes con psoriasis y otras patologías autoinmunes. De ahí se comprende que la formación del complejo de ustekinumab con dichas interleucinas, a través de su unión específica a la subunidad proteica p40 que comparten ambas, impida la activación del receptor celular de éstas (IL-12Rβ1), tanto solo como formando parte de receptores complejos duales (IL-12Rβ 1/β2 e IL-12Rβ1/23R); en consecuencia, el fármaco interrumpe la señalización bioquímica mediada por dichos receptores, que desembocaría en la secreción de citocinas inflamatorias pro-psoriásicas por parte de determinadas poblaciones de linfocitos. No obstante, ustekinumab no puede unirse ni a la IL-12 ni a la IL-23 que ya estén previamente unidas a los receptores IL-12R en la superficie de células inmunitarias, por lo que no parece que contribuya a la citotoxicidad mediada por el complemento o por anticuerpos (Fernández del Pozo et al., 2018a).
La dosificación de ustekinumab en psoriasis y artritis psoriásica es de 45 mg por vía subcutánea en las semanas 1 y 4 y, posteriormente, 45 mg/12 semanas; en pacientes de > 100 kg de peso, la dosis debe doblarse (90 mg), mientras que en niños es de 0,75 mg/kg. Las reacciones adversas descritas con una frecuencia del 1-10% son infecciones de las vías respiratorias, nasofaringitis, mareo, cefalea, dolor orofaríngeo, diarrea, náuseas, vómitos, dolor de espalda, mialgia, artralgia, reacción en el punto de inyección y astenia. Se han notificado, en raras ocasiones (≥ 1/10.000 a < 1/1.000 pacientes), casos de dermatitis exfoliativa en pacientes con psoriasis que habían sido tratados con ustekinumab; en algunos de estos casos, el cuadro se produjo pocos días después de que los pacientes hubieran recibido el tratamiento, lo que sugiere una posible relación con ustekinumab; algunos casos fueron graves y requirieron hospitalización. También se han notificado casos poco frecuentes (≥ 1/1.000 a < 1/100) de exfoliación de la piel sin otros síntomas de dermatitis exfoliativa.
Por otra parte, los más recientes guselkumab (Tremfya®) y tildrakizumab (Ilumetri®), comercializados ambos en 2019, son dos anticuerpos monoclonales (guselkumab de tipo IgG1λ y tildrakizumab, IgG1κ) de administración subcutánea que se unen con elevada afinidad y especificidad a la subunidad p19 de la proteína IL-2311, sin afectar a la IL-12 (lo que los diferencia de ustekinumab). Bloquean, por tanto, la interacción de la IL-23 con su receptor específico en la superficie celular (IL-23R) y contrarrestan sus efectos proinflamatorios: inhiben la diferenciación de linfocitos Th17 y la secreción de la IL-17 y otras citocinas efectoras (como IL-22), minimizando la respuesta inmunitaria responsable de las manifestaciones de la psoriasis.
Comparten la indicación con ustekinumab en psoriasis en placas moderada-grave pero no están autorizados a día de hoy para su uso en artritis psoriásica. Brodalumab se recomienda a una dosis de 210 mg en las semanas 0, 1 y 2, seguidos de 210 mg/2 semanas, mientras que la pauta recomendada de tildrakizumab es de 100 mg en las semanas 0 y 4 y, en adelante, cada 12 semanas, por lo que este último tiene un régimen posológico, en principio, de más fácil cumplimiento para los pacientes. En términos de seguridad, la incidencia de eventos adversos –en su mayoría leves o moderados– relacionados con ambos fármacos es baja (en torno al 15%) y comparable a placebo. Así, si bien su perfil toxicológico parece relativamente benigno y favorable a corto y medio plazo, la ausencia de datos sobre su uso a largo plazo (> 1-2 años) impide evaluar por el momento el efecto de este tipo de terapias inmunológicas sobre la incidencia de reacciones de hipersensibilidad generalizadas o tumores malignos (Fernández-Moriano, 2019a; Fernández-Moriano, 2019b).
El último fármaco biológico en incorporarse al tratamiento de la psoriasis en placas moderada-grave en adultos candidatos a tratamiento sistémico ha sido risankizumab (Skyrizi®, comercializado en 2020), otro anticuerpo monoclonal de tipo IgG1 que comparte mecanismo de acción con los dos fármacos anteriores: al unirse con elevada afinidad y especificidad a la subunidad p19 de la proteína interleucina 23 (IL-23), bloquea las acciones biológicas mediadas por la interacción de esta citocina proinflamatoria con su receptor específico en la superficie celular (por ejemplo, la cascada de señalización que implica la fosforilación de la proteína STAT3 o la liberación de más citocinas proinflamatorias), lo que se traduce en la inhibición de la inflamación y de los síntomas clínicos de la psoriasis.
Con una pauta posológica similar a tildrakizumab (150 mg en inyección subcutánea en la semana 0 y 4 y, a partir de entonces, cada 12 semanas), el perfil toxicológico de risankizumab parece bien definido y está dentro de lo esperable a la vista de la seguridad de otros agentes anti-interleucinas usados en psoriasis, con una adecuada tolerabilidad a corto y medio plazo. La incidencia de eventos adversos relacionados con el nuevo fármaco –leves en su práctica totalidad– fue baja (12%), ligeramente superior a placebo (10%) e inferior a ustekinumab (15%) y adalimumab (20%), manteniéndose consistente en plazos de hasta 1 año; por ello, la tasa de interrupción del tratamiento fue aceptable (< 2%). Las reacciones adversas más frecuentes asociadas al tratamiento fueron las infecciones del tracto respiratorio (13%, incluidas infecciones víricas), la artralgia y la cefalea, si bien presentó menor riesgo de eventos en el lugar de administración que los comparadores. Entre los eventos adversos graves destacan la insuficiencia cardiaca congestiva, eventos isquémicos, hepatotoxicidad, carcinomas, sepsis, celulitis y neumonía. Como otras proteínas terapéuticas, risankizumab tiene cierto potencial de inmunogenicidad, pero parece que los anticuerpos anti-fármaco (desarrollados en hasta el 24% de pacientes tras 1 año) no afectarían a su perfil beneficio-riesgo (Fernández-Moriano, 2020).
Debido a que por el momento no se dispone de estudios comparativos directos entre todas las opciones de tratamiento biológico de la psoriasis grave-moderada, diversas revisiones sistemáticas y meta-análisis han tratado recientemente de realizar comparaciones indirectas de los datos clínicos –derivados mayoritariamente de estudios pivotales– entre los diversos fármacos, teniendo éstas siempre una robustez limitada por las diferencias en las poblaciones de pacientes incluidas en los ensayos, en las variables analizadas, etc. Además, no aportan resultados claramente concluyentes.
Uno de los más recientes, y quizá el más amplio, fue el realizado por Sawyer y colaboradores (Sawyer et al., 2019a), quienes sugirieron, mediante una comparativa indirecta de la eficacia a corto plazo con datos clínicos de 77 estudios y casi 35.000 pacientes, que los inhibidores de IL-17 (secukinumab, brodalumab e ixekizumab), guselkumab y risankizumab son más eficaces que tildrakizumab, ustekinumab, los anti-TNF-α y otros tratamientos sistémicos no biológicos en todos los niveles de respuesta PASI; en concreto, brodalumab, ixekizumab, risankizumab y guselkumab mostraron los niveles más altos de eficacia a corto plazo. Otro meta-análisis de 13 ensayos clínicos (Xu et al., 2019) comparó indirectamente la eficacia y seguridad de los tres inhibidores de la subunidad p29 de IL-23 (guselkumab, tildrakizumab y risankizumab) en psoriasis: además de confirmar su superior eficacia y similar perfil toxicológico respecto a placebo, concluye que son más eficaces que adalimumab o ustekinumab y, de entre ellos, guselkumab es el fármaco más potente y risankizumab el mejor tolerado. En un meta-análisis de 28 ensayos clínicos, Bai y colaboradores (Bai et al., 2020) apuntaron también a esa mejor tolerabilidad de risankizumab, si bien determinaron que, a pesar de un perfil toxicológico más pobre, los anti-IL-17 (secukinumab, ixekizumab o brodalumab) mostrarían una eficacia superior a corto plazo (12-16 semanas de tratamiento).
En cuanto a la eficacia a largo plazo (52 semanas), un meta-análisis de 4 estudios controlados sugirió que brodalumab era significativamente más eficaz que secukinumab, ustekinumab y etanercept, asociándose, en ese orden, con una mayor probabilidad de una respuesta PASI sostenida, incluyendo el aclaramiento completo de la piel. Etanercept y apremilast mostraron las menores expectativas de eficacia a largo plazo (Sawyer et al., 2019b). No obstante, los autores de este último trabajo aluden a la necesidad de disponer de un mayor número de estudios controlados con comparador activo para esclarecer la eficacia comparativa a largo plazo de cualquiera de estos fármacos antipsoriásicos, teniendo en cuenta de que se trata de una patología crónica que en muchos casos requiere tratamientos muy prolongados. Así pues, en base a la evidencia actualmente disponible, se consideran todos los biológicos previamente citados como alternativas de tratamiento en primera línea de pacientes que no respondan bien o tengan contraindicación o intolerancia a otros tratamientos sistémicos convencionales (metotrexato, ciclosporina, acitretina) o PUVA.
Las principales guías clínicas recomiendan que la elección de un determinado fármaco biológico para el tratamiento de pacientes adultos con psoriasis moderada-grave candidatos a dicho tratamiento se haga de forma individualizada, considerando los objetivos terapéuticos, el perfil beneficio-riesgo de los fármacos, el fenotipo y el patrón de actividad de la enfermedad, su gravedad e impacto en la funcionalidad del sujeto, la presencia de artritis, el resultado de tratamientos previos, la edad del paciente, las comorbilidades, el peso, los planes de concepción y las preferencias del paciente en cuanto a vía de administración y adherencia.
Recientemente, la Asociación Británica de Dermatólogos ha aceptado el uso posible de cualquiera de los fármacos aprobados en primera línea (según los criterios recogidos en la Tabla 3), pudiendo cambiar a cualquier otro fármaco de entre ellos cuando la enfermedad no responda a una primera elección. Subraya, no obstante, que se debe considerar etanercept para su uso en pacientes candidatos a tratamiento con anti-TNF-α en los que los fármacos de otros grupos estén contraindicados o hayan fracasado, o si especialmente se busca una vida media corta del fármaco. Recomienda, además, reservar infliximab para pacientes con enfermedad muy grave, para los que no hay otra alternativa disponible o en aquellos donde la dosificación en función del peso es una prioridad (Smith et al., 2020). Por su parte, la Academia Americana de Dermatología y la Fundación Nacional de Psoriasis de EE.UU. indican conjuntamente en su guía clínica que etanercept y ustekinumab deberían ser, por su eficacia y seguridad, los fármacos de elección en la primera línea de tratamiento sistémico de psoriasis moderada-severa en pacientes pediátricos y adolescentes (Aslam et al., 2020).
Por último, hay que mencionar que los datos publicados de varios ensayos clínicos que han evaluado la adición de terapias tópicas a los fármacos biológicos con la intención de mantener las respuestas iniciales, aunque limitados, sugieren que tal combinación es una estrategia eficaz y bien tolerada para controlar la psoriasis y mejorar la calidad de vida de los pacientes (permitiendo rotar entre ellos para evitar periodos de tratamiento largos que impliquen toxicidad acumulativa). De igual modo, una publicación reciente revisó la evidencia disponible sobre la combinación de fármacos biológicos y de fototerapia para la psoriasis moderada a grave y concluyó que 9 de cada 10 estudios publicados demostraban eficacia y seguridad favorables para la combinación de ambos tratamientos (EMA, 2019).
En resumen, las guías de práctica clínica vigentes recomiendan –en base a aspectos clínicos y farmacoeconómicos– el uso de fármacos biológicos solo como segunda línea dentro del tratamiento sistémico, es decir, en pacientes que no tengan una respuesta adecuada (o ésta se reduzca con el tiempo), no toleren o cumplan alguna contraindicación a una primera línea de tratamiento sistémico convencional, incluyendo PUVA. Esto está justificado por el hecho de que en la mayoría de pacientes la psoriasis es una enfermedad relativamente benigna y el retraso en la implementación de un tratamiento efectivo, generalmente, no conlleva consecuencias graves para el paciente. En la práctica, suele ser una pequeña proporción de pacientes los que finalmente requieren terapia biológica. No obstante, entre pacientes con casos moderados-graves, incluso con un tratamiento acorde a las recomendaciones e incluyendo las novedades terapéuticas, una mayoría no alcanza un control suficiente para un completo aclaramiento de la piel: sigue existiendo una necesidad de nuevos fármacos y mecanismos que aporten mejores resultados clínicos, teniendo siempre en consideración que la psoriasis en una enfermedad crónica en la que una apropiada adherencia al tratamiento es crucial y suele representar uno de los principales problemas terapéuticos.
2. Terapia no farmacológica
De forma general, en el tratamiento de la psoriasis, y con especial relevancia en casos graves, es conveniente que un dermatólogo y un psicólogo participen conjuntamente en el abordaje del paciente, para tratar no solo los aspectos físicos de la patología, sino mitigar el impacto psicológico y afectivo mediante una adecuada terapia psicológica. En este sentido, habida cuenta de que el estrés es un importante factor de riesgo de la psoriasis y sus brotes, las técnicas de control de estrés contribuyen a minimizar su impacto.
Otras medidas no farmacológicas incluyen las intervenciones quirúrgicas, que pueden hacerse necesarias en algunos casos de afectaciones oculares (triquiasis, ectropión cicatricial y alteraciones corneales). En la artritis psoriásica debe también contemplarse, como en otros tipos de artritis, el tratamiento rehabilitador: la fisioterapia y la recuperación funcional serán imprescindibles para lograr la mejoría clínica del paciente. En aquellos casos de artritis psoriásica que no mejoran por otros medios, puede optarse también por el tratamiento quirúrgico, reemplazando la articulación afectada. Las articulaciones que habitualmente se recambian son la cadera y la rodilla, menos frecuentemente las de los dedos de las manos y los hombros, y, en alguna ocasión extraordinaria, la de los tobillos.
Además, hay una serie de medidas higiénicas y de estilo de vida que pueden contribuir al eficaz tratamiento de la psoriasis y a la prevención secundaria de brotes. Entre ellas, se recomienda lo siguiente:
- La exposición solar y los baños en agua de mar mejoran la sintomatología, en algunos casos de forma significativa.
- También resulta eficaz el mantenimiento de una buena hidratación con el uso de emolientes libres de parabenos, cremas o baños de avena; tienen el inconveniente de que su efecto es pasajero y deben aplicarse frecuentemente.
- Resulta conveniente suprimir el alcohol y el tabaco y evitar otros factores desencadenantes y favorecedores conocidos: infecciones, golpes o estrés.
- Realizar una adecuada limpieza de la piel usando geles, jabones o champús que no agredan la piel. El agua de la ducha o baño debe estar preferiblemente templada (20°C), pudiéndose añadir aceite o avena.
- Usar ropa holgada y de tejidos de algodón o lino, evitando la lana y los tejidos sintéticos.
- Evitar ambientes cálidos.
- Para combatir el picor, aplicar frío (compresas empapadas en infusión de manzanilla fría, o crema hidratante mantenida en nevera). El gel de Aloe vera12también ayuda a calmar el picor y reduce la inflamación. Las cremas anestésicas pueden ser útiles para el alivio puntual.
- Llevar las uñas cortas y limpias, evitando el rascado con ellas; ante un prurito intenso, se recomienda frotar la piel suavemente con los dedos o la palma de la mano para no empeorar las manifestaciones cutáneas.
- La dieta, en líneas generales, no influye mucho en la evolución de la psoriasis, pero sí la obesidad, que puede contribuir al desarrollo de comorbilidades cardiovasculares que empeoren el estado de salud. Por ello, siempre será conveniente seguir una dieta variada y saludable que permita mantener un peso adecuado.
El papel asistencial del farmacéutico
Todos los profesionales farmacéuticos, desde sus diversos ámbitos profesionales y de competencias, pueden contribuir al adecuado asesoramiento y asistencia sanitaria a los ciudadanos y pacientes con psoriasis. Teniendo en cuenta las particularidades de la enfermedad comentadas en la presente revisión, se puede asumir que la práctica totalidad de pacientes van a estar en tratamiento crónico ambulatorio, si bien requerirán visitas periódicas al dermatólogo para evaluar la progresión de la enfermedad, la gravedad de posibles brotes y los resultados del tratamiento instaurado. Recibirán, por tanto, uno o más medicamentos de dispensación a nivel de oficina de farmacia13, donde la figura del farmacéutico comunitario cobra especial relevancia en la consecución de los objetivos del proceso terapéutico y en la educación sanitaria de la población.
Atendiendo al hecho de que cada día más de 2,3 millones de pacientes y usuarios acuden a las más de 22.000 farmacias españolas, y que en ellas se ofrecen al año más de 182 millones de consejos sanitarios, parece evidente el enorme potencial divulgador del farmacéutico como profesional sanitario, así como su incuestionable papel para canalizar hacia el médico a personas con problemas relevantes de salud, para un estudio clínico detallado. La oficina de farmacia constituye, pues, un establecimiento sanitario accesible (con amplitud de horarios y sin necesidad de cita previa) y ubicuo capaz de suministrar una información rigurosa, de ofrecer un servicio proactivo de máximas garantías sanitarias con la debida confidencialidad, y de promover un mejor uso de los medicamentos a fin de prevenir los problemas relacionados con los mismos. Facilita, además, la disponibilidad de los medicamentos usados en el tratamiento de la psoriasis y la artritis psoriásica (así como de las principales comorbilidades asociadas a éstas), con claras implicaciones en la sostenibilidad del Sistema Nacional de Salud.
No obstante, en la nueva era de los biológicos iniciada en el tratamiento de la psoriasis, el farmacéutico hospitalario es también una figura fundamental para optimizar los regímenes terapéuticos que se instauren con estos fármacos en pacientes con psoriasis grave, ya que la mayoría de los nuevos medicamentos biológicos se financian en su dispensación por los servicios de farmacia hospitalaria. Así pues, con la integración efectiva del farmacéutico en los equipos multidisciplinares de atención primaria y hospitalaria, se pueden identificar varias vías de actuación para con los pacientes con psoriasis a través de los Servicios Profesionales Farmacéuticos Asistenciales.
1. Educación sanitaria orientada a la prevención
Indudablemente, una de las medidas globales más eficaz y eficiente desde la perspectiva de salud pública en el ámbito de cualquier enfermedad dermatológica es la educación sanitaria de la población, dirigida a minimizar el impacto de factores externos agresivos sobre la piel y a instaurar adecuados hábitos higiénico-sanitarios que aseguren el bienestar cutáneo. Como se ha indicado previamente, la psoriasis es una enfermedad de la que no se conocen con exactitud las causas, en muchos casos con un componente genético relevante. Por tanto, al no poder ejercer una prevención primaria que sí es eficaz en otras patologías, la educación proporcionada a los pacientes se orienta a una prevención secundaria, con el propósito de evitar el desencadenamiento de brotes y mantener el mejor estado posible de la piel.
A este respecto, el farmacéutico comunitario está en una posición privilegiada para transmitir a pacientes y ciudadanos una información veraz –con rigor científico, pero en un lenguaje adaptado al nivel sociocultural del receptor– sobre la naturaleza de la patología psoriásica, y consejos sobre las distintas medidas profilácticas y modificaciones favorables de los hábitos higiénicos y de estilo de vida. Entre ellas, cabe destacar y recordar las recogidas en la infografía publicada por el Consejo General de Farmacéuticos con motivo de la celebración del Día Mundial de la Psoriasis en 2017 (Figura 13). Es crucial explicar el porqué de cada medida de ayuda para que los pacientes la acepten y la apliquen racionalmente.
Conviene dejar claro –con una sensibilidad adecuada, pero en todos los casos– que se trata de una enfermedad no contagiosa de carácter crónico, de forma que las expectativas del tratamiento sean realistas: la enfermedad no se cura, pero si se asegura una estrecha adherencia al tratamiento, vital en esta patología, se podrá llegar a un buen control de la misma, con un blanqueamiento completo o casi completo de las lesiones, y a una calidad de vida adecuada. Además, se deben combatir algunos tópicos. Por ejemplo, muchas personas pueden creer erróneamente que la psoriasis se limita a la apariencia externa, al problema cutáneo, cuando se trata, en realidad, de una patología autoinmune con un importante componente inflamatorio y afectación multisistémica, que aumenta el riesgo de desarrollar otras enfermedades, como depresión, enfermedad de Crohn y diabetes, entre otras.
El farmacéutico puede y debe aportar a los pacientes información relevante sobre: a) los medicamentos usados en el tratamiento antipsoriásico (antiinflamatorios, inmunosupresores tipo FAME o biológicos) y en el control de posibles comorbilidades: especial hincapié sobre su objetivo y mecanismo, las peculiaridades de conservación (si las hubiera), el momento óptimo de administración, la posibilidad e importancia de interacciones con otros medicamentos (incluidos los de automedicación), etc.; y b) su pauta de administración: se puede aconsejar la adaptación de la toma o inyección coincidiendo con eventos cotidianos, o aportar diagramas que ayuden a relacionar la medicación con hábitos de vida. Esta información es de enorme interés en mujeres embarazadas o que planean estarlo, incidiendo en la necesidad de que lo adviertan a su médico, quien adecuará su tratamiento con fármacos seguros en el embarazo (fórmulas emolientes y corticosteroides).
Además, conviene transmitir a los pacientes otros aspectos importantes relacionados con su patología, de vertiente más social. Se les puede animar a que se enrolen en asociaciones de pacientes a nivel nacional, como es el caso de Acción Psoriasis (https://www.accionpsoriasis.org/) o Psoriasis en Red (http://psoriasisenred.org/), donde podrán acceder a recursos informativos y orientación sobre tratamientos, y recibirán apoyo sociopsicológico dirigido a mejorar el bienestar de los pacientes.
La adecuada información y educación sanitaria de los pacientes cobra, si cabe, mayor relevancia en la situación actual de pandemia por COVID-19. En este sentido, según informa la Federación Internacional de Asociaciones de Psoriasis14, no hay evidencia de que los pacientes con psoriasis o artritis psoriásica tengan un mayor –ni menor– riesgo de contagiarse por el SARS-CoV-2 ni de desarrollar formas más severas de la infección, siendo perfectamente aplicables a esta población las recomendaciones generales de prevención del contagio. Los pacientes deberán consultar al dermatólogo solo cuando sea necesario (brotes, problemas de control de la enfermedad o con el tratamiento, etc.), priorizando los medios de telemedicina cuando estos sean factibles. No obstante, algunos organismos y asociaciones enfocadas a la psoriasis sí reconocen que los pacientes de más de 60 años y que padecen comorbilidades crónicas asociadas (obesidad, diabetes, hipertensión, enfermedades cardiovasculares o respiratorias, hepatitis B, patología renal o cáncer) presentan una mayor probabilidad de complicaciones. Por tanto, sobre todo en esos pacientes, el cumplimiento de las medidas profilácticas frente a la COVID-19 es crucial.
2. Detección precoz
Según se ha sugerido previamente, la demora el tratamiento de la psoriasis, y de la artritis psoriásica en particular, puede causar discapacidad funcional importante y limitar la calidad de vida de los pacientes, incluso a pesar de una afectación cutánea relativamente reducida, por lo que es muy importante su diagnóstico temprano. El farmacéutico comunitario se encuentra en una posición privilegiada para actuar como primera barrera de la atención primaria y derivar a la ruta asistencial especializada a pacientes que puedan mostrar signos o síntomas de psoriasis o artritis psoriásica.
Las manifestaciones cutáneas suelen ser más sencillas de identificar y hacen que los pacientes consulten con mayor premura a su médico (por el componente estético). Por ello, especialmente ante pacientes que en los últimos meses hayan experimentado manifestaciones de rigidez, inflamación o dolor en una o más articulaciones, o incluso rubefacción o hipertermia en las zonas afectadas, sugerentes todas ellas de artritis, se debe subrayar la conveniencia de ser evaluados por un reumatólogo a la mayor brevedad posible. De igual modo, la psoriasis ungueal debe ser un signo de alerta, por considerarse una señal temprana de la artritis psoriásica.
3. Optimización de la terapia farmacológica
Una vez establecido el diagnóstico de psoriasis o artritis psoriásica y el tratamiento pertinente por el dermatólogo y/o reumatólogo, el farmacéutico, como profesional sanitario experto en la materia, debe velar por el uso seguro y eficaz de los medicamentos para que los pacientes alcancen el máximo beneficio clínico. Esto es aplicable tanto en el entorno hospitalario, donde se dispensarán mayoritariamente los fármacos biológicos, como, con igual o mayor relevancia, en el ámbito comunitario para pacientes con formas leves-moderadas de la enfermedad, que recibirán tratamientos tópicos o FAMEs sistémicos. Hay que recordar que el farmacéutico comunitario conoce toda la medicación que utiliza un paciente ambulatorio, no solo la medicación prescrita frente a la psoriasis, sino también los tratamientos para enfermedades concomitantes, medicamentos que no necesitan prescripción, el uso de complementos alimenticios, etc.
En el momento de la dispensación de cualquier medicamento, el farmacéutico comprobará que el paciente cuente con toda la información necesaria para que el uso del mismo sea efectivo y seguro. Se debe averiguar si existe algún criterio que impida la dispensación, tal como: alergia a algún componente del medicamento, una contraindicación absoluta, interacciones con otros medicamentos (o alimentos), una duplicidad o una situación fisiológica especial (por ejemplo, embarazo o lactancia). Si es la primera vez que el paciente va a utilizar un medicamento, la labor del farmacéutico será asegurar que la persona sale de la farmacia conociendo para qué es ese medicamento y cuál es su correcto proceso de uso. Si se trata de una dispensación de continuación, el farmacéutico evaluará si dicho medicamento está siendo eficaz y seguro, verificando si ha habido cambios en el tratamiento (dosis, pauta posológica, duración, adición de nuevos medicamentos, etc.) y si el paciente ha experimentado algún problema de seguridad que pudiera hacer sospechar de una reacción adversa, interacción, contraindicación, etc. Además de los medicamentos prescritos, en muchas ocasiones el propio paciente solicitará consejo al farmacéutico sobre los diferentes síntomas que van apareciendo.
En este punto, se debe tener presente que existen diversos fármacos que pueden agravar la psoriasis o la artritis psoriásica en mayor o menor grado, o desencadenar un brote15, por lo que, siempre que sea posible, deben evitarse. Entre ellos, se encuentran fármacos tan comunes como: ácido acetilsalicílico y otros AINE (ibuprofeno, diclofenaco, indometacina, etc.), antihipertensivos (bisoprolol, metoprolol, propranolol, captopril, diltiazem, etc.), antipsicóticos (risperidona o sales de litio), antibióticos (claritromicina, amoxicilina, cotrimoxazol, doxiciclina, etc.), antipalúdicos (cloroquina, mefloquina, primaquina, etc.) o antidepresivos (fluoxetina, trazodona, etc.). En caso de que el paciente esté en tratamiento con alguno de ellos, o les sean prescritos durante el curso de la psoriasis, es imprescindible consultar al médico.
Como en tantas enfermedades que requieren tratamiento crónico, la adherencia terapéutica ha sido descrita como uno de los factores de mayor influencia sobre los resultados de la farmacoterapia de la psoriasis, y uno de los principales problemas para el éxito terapéutico, sobre todo en el tratamiento tópico de formas leves16. Así, por ejemplo, se han descrito tasas de adherencia muy bajas, que en periodos de seguimiento de 1 año son próximas al 40% incluso con el tratamiento con fármacos biológicos (Doshi et al., 2016), los cuales suelen asociarse a un mayor cumplimiento terapéutico (en las formas moderadas-graves de la patología los pacientes están más concienciados sobre la severidad de su enfermedad y la importancia de la adherencia).
Es por ello que la promoción de la adherencia a los tratamientos antipsoriásicos de base es uno de los principales campos de actuación del farmacéutico. Hay evidencia de que intervenciones basadas en una adecuada educación sanitaria pueden incrementar notablemente la proporción de pacientes adherentes (hasta niveles superiores al 80%) en comparación con la no intervención (Wang et al., 2019). Por ello, parece necesario que se desarrollen estrategias para asegurar que el paciente se involucra voluntariamente en su tratamiento; estas deben definirse de forma personalizada, con el paciente y la familia, valorando las causas de la no adherencia (dificultad de aplicación, aceptabilidad cosmética, tolerabilidad, etc.) y fomentando su confianza en los fármacos administrados. Pueden incluir información verbal y escrita y recursos interactivos, debiendo siempre recordarse que las consecuencias de la falta de adherencia pueden ir desde un empeoramiento de la calidad de vida, una falta de control de la enfermedad y una mayor probabilidad de complicaciones, hasta la aparición de efectos secundarios o comorbilidades. Todo ello, además, puede suponer ingresos hospitalarios adicionales y otras intervenciones sanitarias que impliquen ineficiencia del gasto farmacéutico y sanitario.
Por otra parte, especialmente en los tratamientos prolongados, un adecuado seguimiento farmacoterapéutico (ofrecido por el farmacéutico de forma rutinaria, sistematizada y registrada/documentada, con reuniones periódicas con el paciente) permitirá detectar, atenuar y resolver la posible aparición de resultados negativos y problemas relacionados con la medicación. La farmacovigilancia ante posibles reacciones adversas (con su correspondiente notificación, en su caso, al Sistema Nacional de Farmacovigilancia), y la identificación y prevención de interacciones farmacológicas y contraindicaciones de los tratamientos anitinflamatorios e inmunosupresores revertirá en una mejor calidad de vida de los pacientes con psoriasis o artritis psoriásica. Además, una actitud vigilante desde farmacia comunitaria, enfocada a la detección precoz de los signos y síntomas sugerentes de una posible refractariedad a una línea de tratamiento (empeoramiento de lesiones cutáneas, mayor extensión de piel afectada, dolor articular, etc.) también puede contribuir a activar la ruta asistencial que asegure un cambio de tratamiento temprano.
Para todo ello, además de lo especificado en este artículo y de la recomendación de consultar las fichas técnicas de los medicamentos, si se tiene en consideración que la información científica se actualiza constantemente, cobran especial relevancia las bases de datos que contienen información actualizada y pormenorizada sobre aspectos farmacológicos. Es el caso, por ejemplo, de la base de datos BOT PLUS, que permite, entre otras funcionalidades, la detección de interacciones farmacológicas entre múltiples medicamentos comerciales y/o principios activos, para su evaluación a la hora de optimizar los tratamientos.
Un apropiado seguimiento farmacoterapéutico requiere tener presente algunos conceptos sobre el perfil beneficio-riesgo de los tratamientos más comúnmente empleados en psoriasis, entre los que podemos destacar los siguientes:
- El uso de corticoides de forma continuada incrementa el riesgo de efectos adversos, que pueden llegar a ser sistémicos si las zonas con lesiones a tratar son extensas. En cuanto a los efectos locales, pueden producir atrofia cutánea irreversible, hacer inestable la patología (con exacerbaciones de intensidad variable si se interrumpen de forma brusca), o inducir la aparición de estrías, telangiectasias o foliculitis. Se debe recomendar una revisión al menos anual del tratamiento corticoideo.
- Los análogos de vitamina D y el retinoide tazaroteno se asocian con irritación cutánea en la zona lesionada y su periferia, pudiendo también los primeros provocar fotosensibilidad.
- Los FAMEs metotrexato y calcineurina tienen riesgo de toxicidad órgano-específica: metotrexato se relaciona con hepatotoxicidad, toxicidad hematológica y efectos gastrointestinales, mientras que la calcineurina puede dar lugar a nefrotoxicidad e hipertensión arterial.
- El conjunto de fármacos biológicos se asocia a un riesgo incrementado de infecciones, fundamentalmente leves; la mayoría de estas suelen afectar al tracto respiratorio superior (sobre todo, nasofaringitis). Además, son comunes las reacciones –dolor, irritación o prurito– en el punto de inyección, dada su administración por vía subcutánea (salvo infliximab, de administración intravenosa), así como otras reacciones adversas inespecíficas (cefalea, náuseas o rash cutáneo).
- En línea con lo anterior, los fármacos anti-TNF-α (etanercept, adalimumab, infliximab, golimumab, certolizumab) están contraindicados en pacientes con infecciones graves. De hecho, aumentan significativamente el riesgo de padecer tuberculosis.
- Igualmente, es bien conocido el riesgo de reactivación de la infección por virus de la hepatitis B (VHB) asociada a la administración de terapia inmunosupresora, debido a un aumento de la replicación del virus en pacientes portadores inactivos o con infecciones pasadas de VHB. Aunque puede ocurrir al inicio y en cualquier momento del tratamiento, es frecuente que suceda al final de éste, por el fenómeno de reconstitución inmunológica. Puede cursar desde una forma asintomática hasta una hepatitis fulminante, por lo que se deben extremar las precauciones en pacientes con antecedentes. Este riesgo es compartido por todos los agentes anti-TNF y otros monoclonales anti-interleucinas con efectos inmunosupresores, y también por corticoides.
Un uso regular de IBPs podría incrementar el riesgo de padecer diabetes
Los inhibidores de la bomba de protones (IBP) o prazoles –omeprazol, pantoprazol, lansoprazol, esomeprazol y rabeprazol– son un grupo de fármacos bien conocidos y muy ampliamente utilizados a día de hoy para el tratamiento de la úlcera péptica, la enfermedad por reflujo gastroesofágico o como profilaxis de úlcera en pacientes que requieren un tratamiento continuado con antiinflamatorios no esteroideos. Tienen, pues, un rol muy importante en la práctica clínica, pero su uso a largo plazo se ha relacionado con problemas de salud como fracturas óseas e infecciones entéricas.
Además, su impacto sobre la microbiota intestinal ha planteado su posible asociación con metabolopatías como la diabetes mellitus. A este respecto la evidencia epidemiológica era escasa, pero se divulgan ahora los resultados de un reciente y amplio análisis prospectivo de los datos de 204.689 participantes sin diabetes de 25 a 75 años, tomados de los Estudios sobre la Salud de las Enfermeras de EE.UU. y del Estudio de Seguimiento de los Profesionales de la Salud (iniciados entre 1975 y 1990); ambos estudios de cohortes están aún en marcha. En el momento de enrolarse en el estudio, y posteriormente cada 2 años, los participantes reportaban información relevante sobre su estado de salud, historia médica y enfermedades diagnosticadas. La diabetes tipo 2 se confirmó siguiendo los criterios de la Asociación Americana de Diabetes. Los autores calcularon las razones de riesgo o hazard ratios (HR) tras un ajuste por factores demográficos, hábitos de vida, comorbilidades, uso de otros fármacos e indicaciones clínicas de los IBPs.
Los resultados ponen de manifiesto que, tras un total de 2.127.471 personas-año de seguimiento, se han documentado 10.105 casos nuevos de diabetes. Así, los pacientes con uso regular de IBPs presentaban un riesgo un 24% mayor de diabetes en comparación con quienes no recibían ese tratamiento (HR: 1,24; IC95% 1,17-1,31). De modo interesante, los autores concluyen que el riesgo de diabetes aumenta con la duración del tiempo de uso de los IBPs: en pacientes con tratamientos de 0 a 2 años de duración, el riesgo era menor (de solo el 5% adicional – HR: 1,05; IC95% 0,93-1,19) que en pacientes tratados durante más de 2 años (del 26% adicional – HR: 1,26; IC95% 1,18-1,35).
A la vista de estos hallazgos, parece prudente que se extremen las precauciones a la hora de prescribir prazoles para un uso a largo plazo. Igualmente, cuando se superen los 2 años de uso de los mismos, puede ser conveniente que los pacientes (sobre todo, aquellos con alto riesgo cardiovascular) se sometan a controles regulares de glucemia para prevenir o detectar precozmente la diabetes, una enfermedad con una prevalencia mundial superior al 8,5% y en tendencia creciente.
- Yuan J, He Q, Nguyen LH, Wong MC, Huang J, Yu Y et al. Regular use of proton pump inhibitors and risk of type 2 diabetes: results from three prospective cohort studies. Gut. 2020. DOI: 10.1136/ gutjnl-2020-322557
El interferón y su relevancia en la protección frente a la COVID-19
Un trabajo colaborativo desarrollado a nivel internacional por investigadores de diversos países y centros (Consorcio Covid Human Effort) ha puesto de manifiesto que hay una serie de defectos genéticos que determinan un mayor riesgo innato de padecer formas clínicas más graves de la infección por SARS-CoV-2. Los autores han analizado muestras de 659 pacientes con neumonía severa por COVID-19 con compromiso vital y las han comparado con las de 534 sujetos con infección asintomática o benigna; cabe destacar que, del total de participantes en el estudio, más de 300 han sido evaluados en España. Los resultados divulgados revelan que en los pacientes con formas graves de la enfermedad hay una mayor frecuencia de variantes genéticas raras de pérdida de función en los 13 loci humanos (8 genes) que se sabe que están implicados y regulan la inmunidad mediada por interferón (IFN) dependiente de los factores TLR3 (receptor tipo toll 3) e IRF7 (factor regulador del interferón 7). Concretamente, identificaron variantes de pérdida de función, relacionadas con deficiencias autosómicas recesivas o dominantes, en 23 pacientes de 17-77 años, que representan un 3,5% del total. Demostraron, además, que los fibroblastos humanos portadores de mutaciones que afectan a la vía del interferón son más vulnerables al SARS-CoV-2, todo lo cual apunta a que esas deficiencias genéticas pueden subyacer al agravamiento de la neumonía por COVID-19. Los investigadores han planteado la hipótesis de que dicha susceptibilidad genética solo ocurre con la infección por SARS-CoV-2, no habiéndose observado con otros virus como el de la gripe.
Otro reciente artículo de la citada colaboración internacional ha apuntado a que más del 10% de los pacientes (1011de los 987 investigados, con edades de entre 25 y 87 años) con neumonía severa por COVID-19 con compromiso vital presentaban en su sangre autoanticuerpos –IgG– capaces de neutralizar el IFN-ω (13 pacientes), los 13 tipos de IFN-α (36), o ambos (52), al inicio de enfermedad crítica; algunos pacientes también generaban autoanticuerpos contra los otros tres subtipos de IFN tipo 1. La presencia de esos autoanticuerpos, que se cree que habían sido producidos de forma previa a la infección en los pacientes, se traducía en la inhibición de la capacidad de los IFN tipo 1 para bloquear la infección por SARS-CoV-2 in vitro. Además, no fueron encontrados en las muestras sanguíneas de ninguno de los 663 individuos con COVID-19 asintomática o leve y solo en una muy escasa proporción de individuos sanos (4/1.227).
En definitiva, considerando los hallazgos de los dos trabajos, parece que hasta el 15% de las formas graves de COVID-19 podrían asociarse con alteraciones genéticas o inmunitarias que afectan a la funcionalidad del interferón, la primera defensa antiviral de nuestro organismo. Se podría quizá explicar con ello por qué hay pacientes jóvenes, previamente sanos, que ingresan en UCI con patología severa. También se esbozan ciertas implicaciones clínicas orientadas a la individualización de la terapéutica anti-COVID: surge la posibilidad de identificar a los pacientes con mayor riesgo de un peor funcionamiento de la vía del IFN (y de gravedad de la neumonía), en quienes el tratamiento precoz con interferón se postula como una posibilidad interesante, que será tenida en cuenta en futuros ensayos clínicos. O, incluso, si se sabe que un determinado paciente produce autoanticuerpos frente al interferón-α, ¿podría ser tratado con interferón-β? La plasmaféresis para eliminar los autoanticuerpos podría ser otra posibilidad.
-
Zhang Q, Bastard P, Liu Z, Le Pen J, Moncada-Velez M, Chen J et al. Inborn errors of type I IFN immunity in patients with life-threatening COVID-19. Science. 2020; eabd4570. DOI: 10.1126/science.abd4570.
- Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann HH, Zhang Y J et al. Auto-antibodies against type I IFNs in patients with life-threatening COVID-19. Science. 2020; eabd4585. DOI: 10.1126/science.abd4585.