Servicio de Dispensación
> Primer Accésit, 8ª Edición Premios FORO de Atención Farmacéutica en Farmacia Comunitaria.
Perfil del paciente
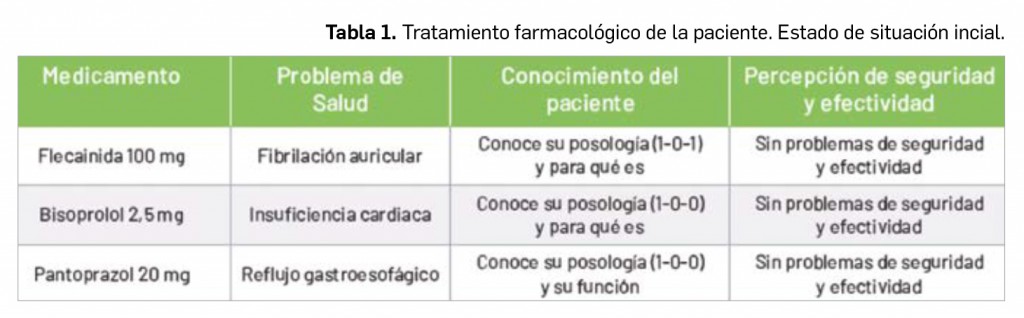
Se trata una mujer de 59 años, con un índice de masa corporal (IMC) de 28,60 kg/m2, sin alergias medicamentosas conocidas, habitual de la farmacia. Desde hace 5 años está siendo tratada con flecainida 100 mg (1-0-1) para controlar una fibrilación auricular paroxística. Recientemente le han detectado una insuficiencia cardiaca leve para la que se le ha prescrito bisoprolol 2,5 mg (1-0-0), y una enfermedad por reflujo gastroesofágico para la que toma pantoprazol 20 mg (1-0-0). Estos tres medicamentos están siendo utilizados por la paciente sin problemas de seguridad y efectividad. Además, conoce perfectamente la posología y para qué sirve cada uno de ellos (Tabla 1).
Descripción del caso y actuación realizada
La paciente ha sido intervenida de varices en el miembro inferior derecho por el procedimiento de flebectomía ambulatoria y acude a la farmacia para retirar la prescripción recomendada por el cirujano vascular. Ésta consiste en enoxaparina 60 mg inyectable (1 inyección/24 h durante 5 días), levofloxacino 500 mg oral (1 dosis/24h durante 5 días) y analgesia con paracetamol 1 g oral (1 dosis/8 h) o metamizol 575 mg oral (1 dosis/8 h) en caso de dolor más intenso.
Se muestra muy preocupada porque teme que el nuevo tratamiento pueda alterar la arritmia que padece. Desde la farmacia, se intenta tranquilizarla, derivándola a la Zona de Atención Personalizada (ZAP) y proponiéndola una revisión completa de su tratamiento farmacológico, a lo que la paciente accede.
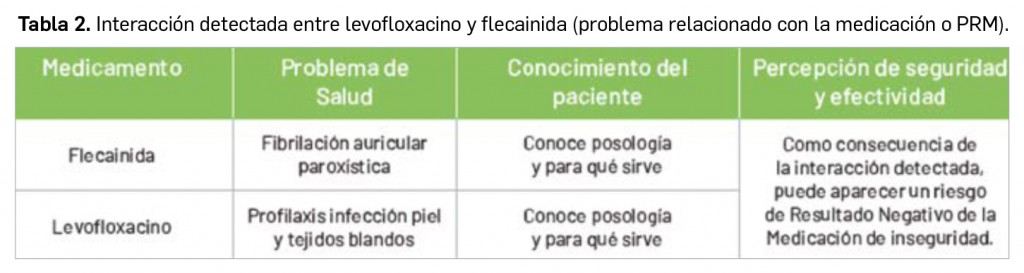
Tras la correspondiente consulta bibliográfica, detectamos una potencial interacción entre levofloxacino y flecainida (Tabla 2).
Evaluación e intervención
La administración conjunta de quinolonas con fármacos susceptibles de prolongar el intervalo QT puede aumentar el riesgo de aparición de arritmias cardiacas graves, tipo torsade de pointes, potencialmente fatales en pacientes con antecedentes de prolongación de intervalos de la conducción cardiaca (particularmente, del intervalo QT), con trastornos electrolíticos significativos o con enfermedades cardiacas graves como insuficiencia cardiaca congestiva.
La prolongación del intervalo QT parece ser un efecto de clase de las fluoroquinolonas, aunque es más acentuado con moxifloxacino y levofloxacino. El mecanismo de aparición es una posible adición de los efectos sobre el intervalo QT por bloqueo concomitante de canales de potasio a nivel cardiaco.
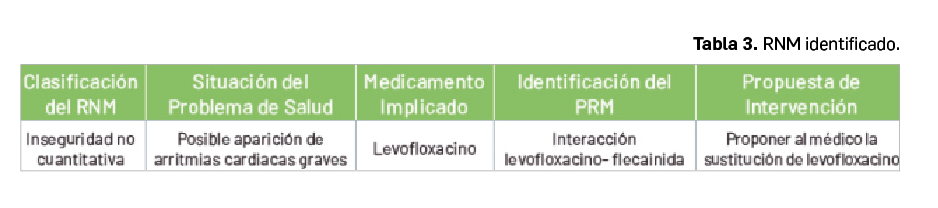
En el caso que aquí se presenta, se identifica un riesgo de Resultado Negativo de la Medicación (RNM) de inseguridad no cuantitativo cuya causa es un Problema Relacionado con la Medicación (PRM) de interacción entre levofloxacino y flecainida (Tabla 3).
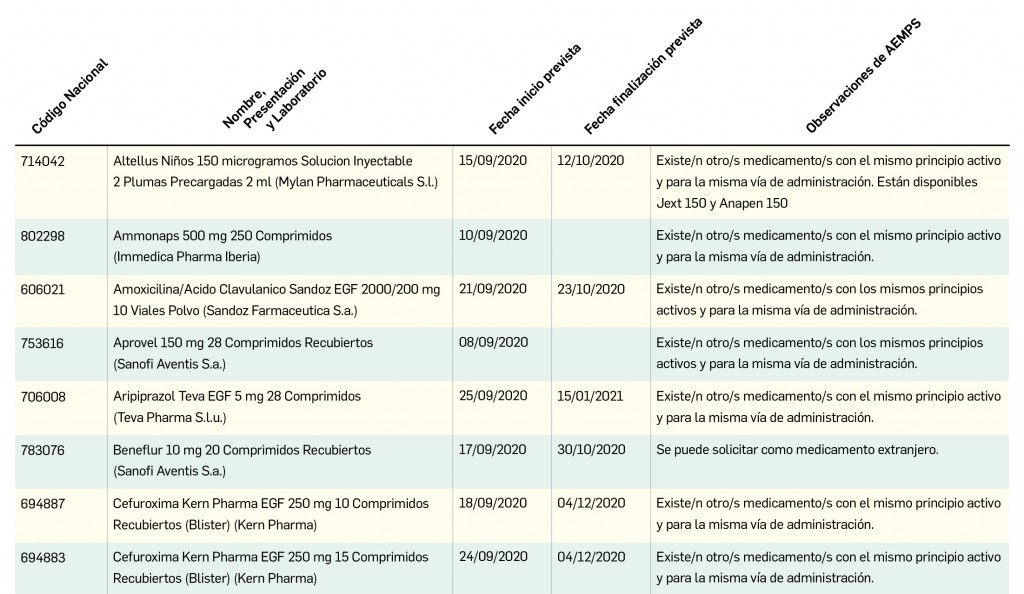
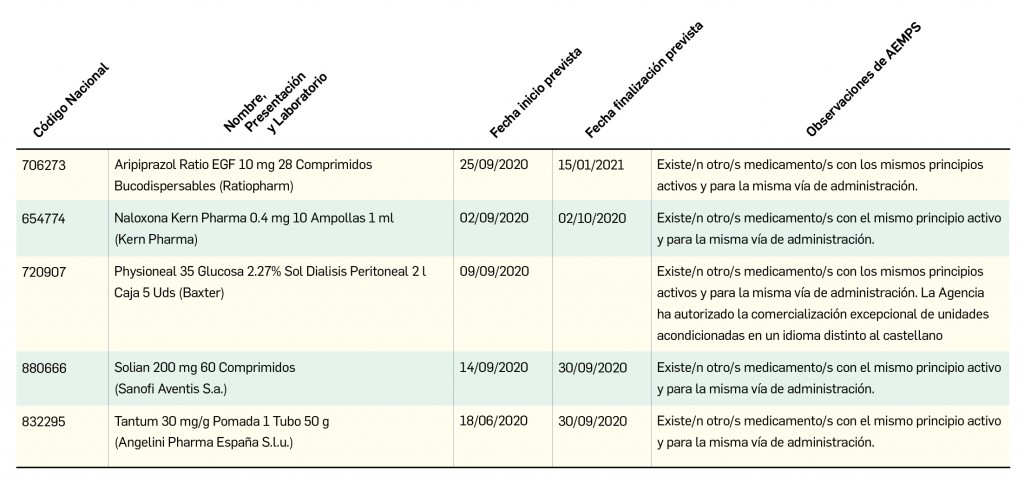
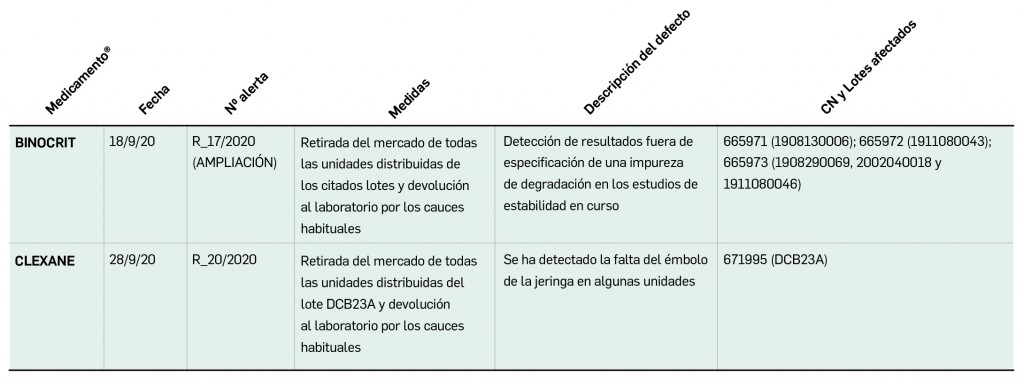
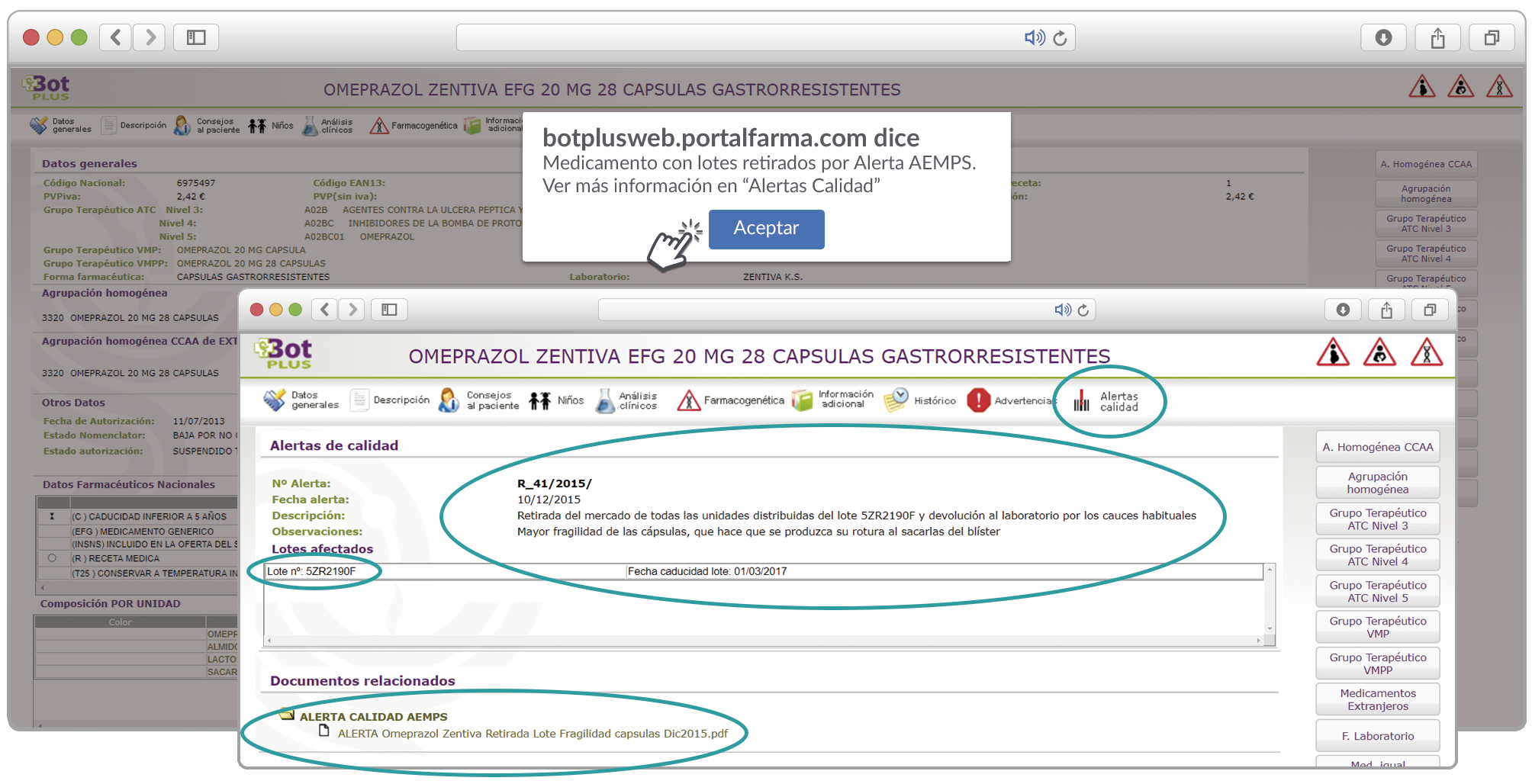
Se le explica a la paciente los resultados obtenidos y se acuerda elaborar un informe para proponer al médico la posible sustitución de levofloxacino por otra quinolona que presente un riesgo relativo menor (ciprofloxacino), o bien por otra alternativa como penicilinas o cefalosporinas (Figura 1).
Resultados
El médico decide cambiar la terapia antibiótica prescribiendo amoxicilina 875 mg/ácido clavulánico 125 mg (1 comprimido/8 horas durante 10 días). Con la dispensación del nuevo medicamento, la paciente refiere sentirse aliviada y agradece la intervención farmacéutica.
Comentarios
Durante el Servicio de Dispensación, el farmacéutico comunitario debe asegurar que el paciente conoce los medicamentos, cómo, cuándo y durante cuánto tiempo debe tomarlos y, al mismo tiempo, vigilar la posible aparición de PRM como son las interacciones. Es importante la comunicación farmacéutico-paciente para evitar RNM. Además, la colaboración con otros profesionales sanitarios se traduce en un mejor control de los problemas de salud de los pacientes y una mejora de su calidad de vida.
Casos ganadores y finalista 8ª edición Premios FORO AF-FC
El objetivo de la edición anual de Premios FORO de Atención Farmacéutica en Farmacia Comunitaria (Foro AF-FC) es reconocer el compromiso asistencial de los farmacéuticos que ofrecen a la población Servicios Profesionales Asistenciales de acuerdo a los procedimientos consensuados1, contando con la colaboración de laboratorios Cinfa. La convocatoria de la 8ª edición se realizó entre los meses de marzo a julio de 2019, periodo tras el cual el jurado, compuesto por seis representantes de las instituciones que forman Foro AF-FC, evaluó los 30 casos recibidos de acuerdo a los modelos editados en las webs de todas las instituciones para la descarga, cumplimentación y remisión on line, por parte de farmacéuticos voluntariamente interesados.
Se mantuvo un modelo abierto para aquellos casos que no se correspondieran con los Servicios descritos. Como novedad, en esta edición se posibilitó una categoría específica para casos de alumnos y tutores en prácticas tuteladas o máster. Los casos recibidos se clasificaron en: 8 casos del Servicio de Dispensación, 1 del Servicio de Indicación Farmacéutica, 3 del Servicio de SFT, 15 de modelo abierto y 4 de alumnos. El jurado valoró en cada caso once apartados relacionados con la adecuación de la terminología y metodología de Foro AF-FC, la existencia de práctica colaborativa, la utilización de herramientas informáticas, el interés clínico y el profesional del caso en la Farmacia Comunitaria, entre otros.
Los casos ganadores y finalistas de la citada edición se irán presentando periódicamente en esta sección de PAM. No obstante, puede acceder a la publicación íntegra de todos los casos a través del siguiente enlace al espacio de los Premios de FORO AF-FC:
Foro de Atención Farmacéutica en Farmacia Comunitaria (Foro AF-FC) es un grupo de trabajo y debate constructivo creado en 2009. Actualmente está constituido por farmacéuticos representantes de las siguientes instituciones:
- Consejo General de Colegios Oficiales de Farmacéuticos (CGCOF).
- Conferencia Nacional de Decanos.
- Fundación Pharmaceutical Care España.
- Grupo de Investigación en Atención Farmacéutica de la Universidad de Granada.
- Sociedad Española de Farmacia Familiar y Comunitaria (SEFAC).
La principal función de Foro AF-FC es contribuir a la implantación de los Servicios Profesionales Farmacéuticos
Asistenciales (SPFA) en la farmacia comunitaria, para lo cual:
- Mantiene el consenso adoptado y la homogeneidad de los procedimientos de Foro AF 2008 en los proyectos, conjunta o individualmente; de esta manera, se consigue un objetivo común transmitiendo el mismo mensaje con una terminología consensuada.
- Apoya la máxima difusión de los SPFA para alcanzar su implantación en la Farmacia Comunitaria.
- Incrementa la colaboración entre las organizaciones del Grupo.
- Constituye un agente de referencia en SPFA coordinado por el Consejo General.
Principales actividades:
- Elaboración de documentos consensuados; definición y procedimientación de Servicios Profesionales Farmacéuticos
- Asistenciales.
- Definición y clasificación de SPFA abordando tanto los relacionados con el medicamento (AF) como con los relacionados con la Salud Comunitaria.
- Edición de la actualización de la Guía practica de SPFA
- Edición anual de Premios a los mejores casos de farmacéuticos implicados en SPFA y participación en eventos/congresos para su divulgacion.
Más información en: http://www.portalfarma.com/inicio/serviciosprofesionales/forofarmaciacomunitaria/Paginas/default.aspx