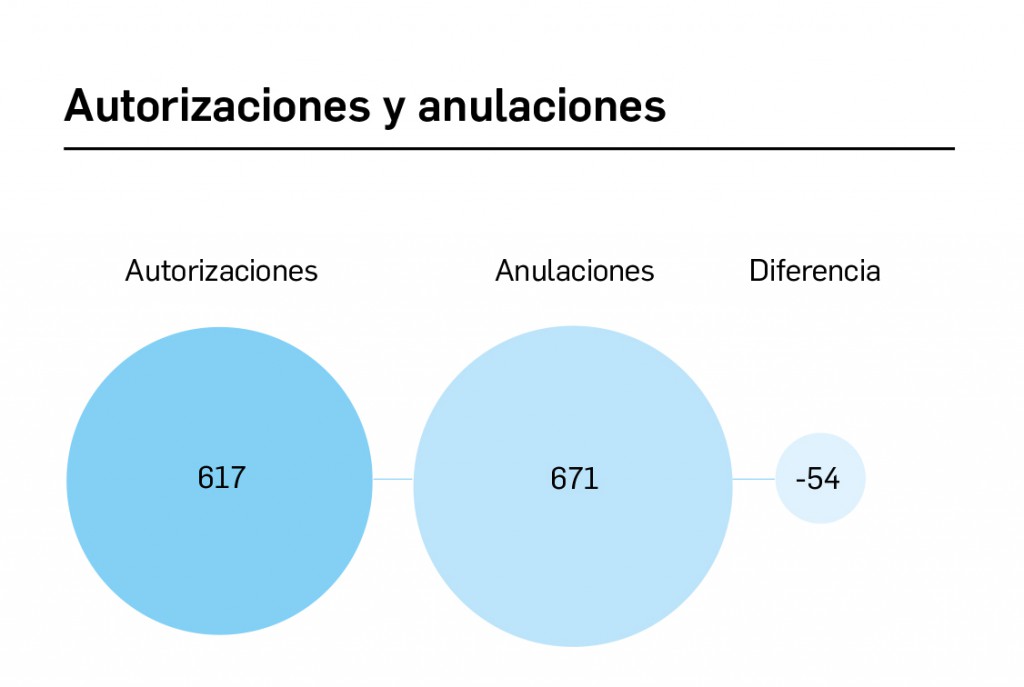
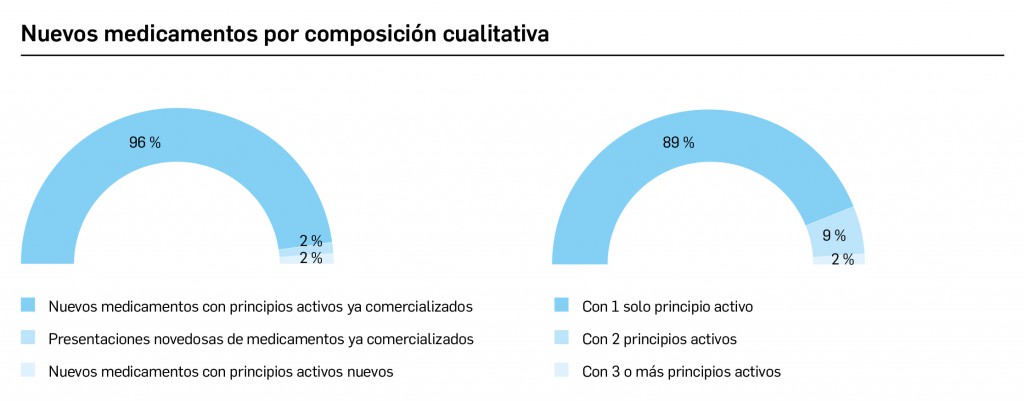
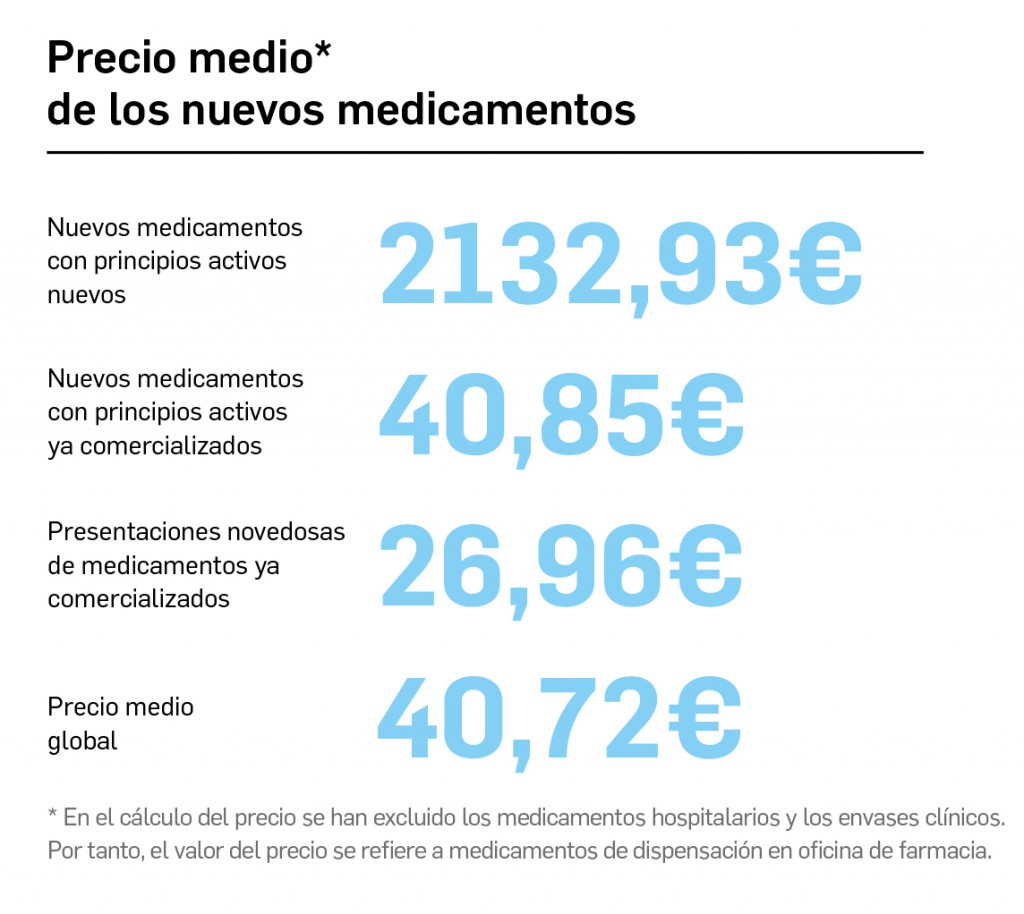
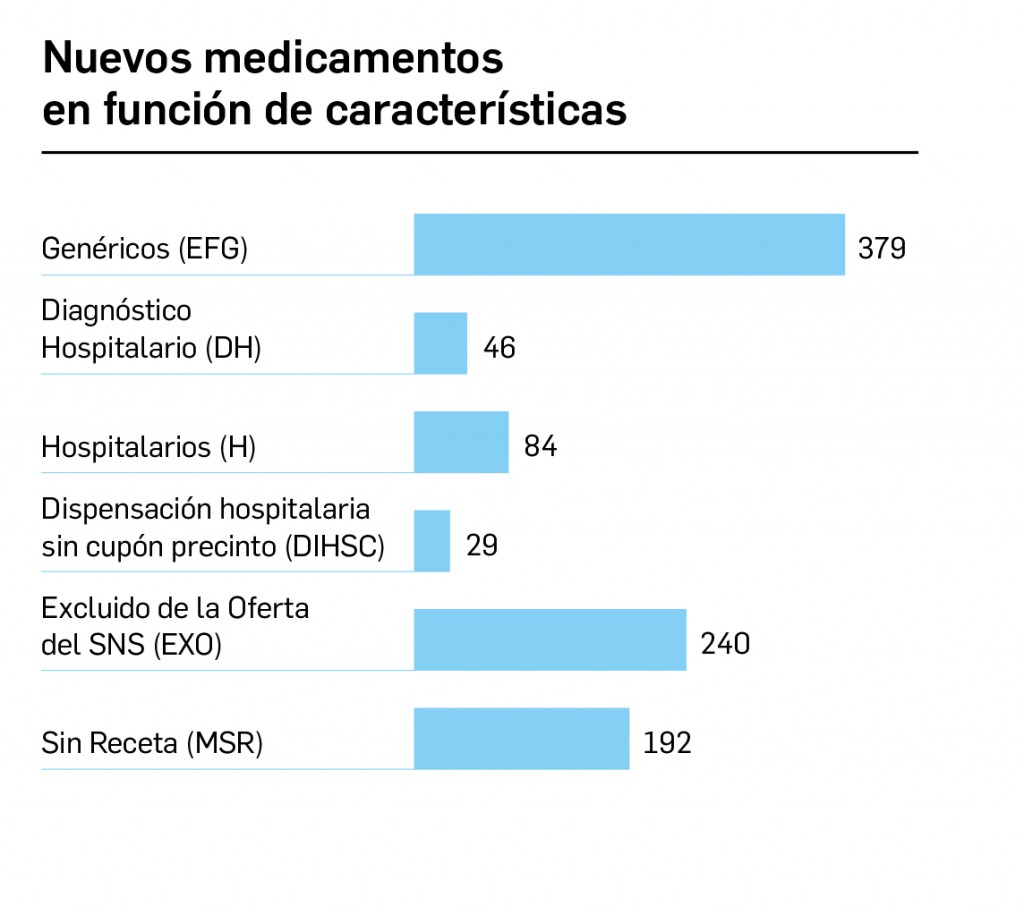
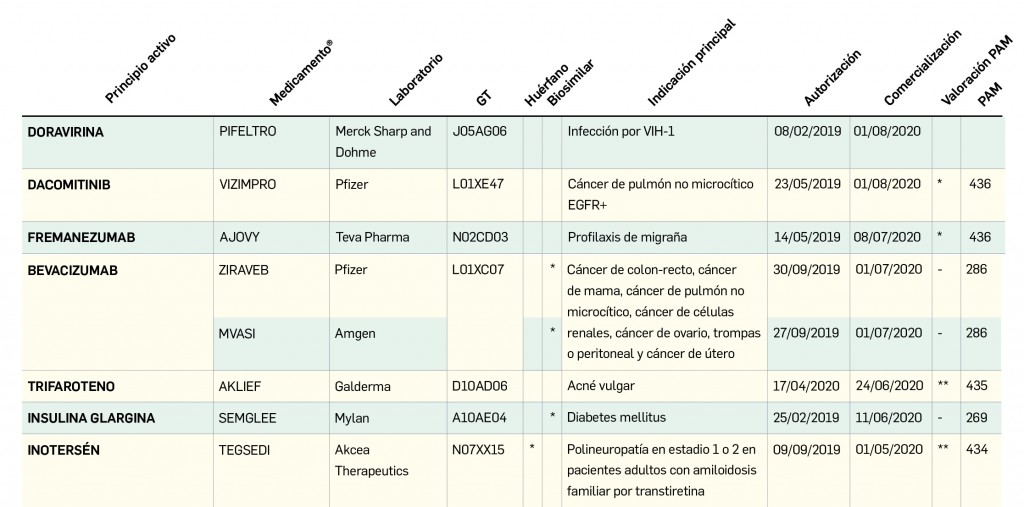
Archive
Revista PAM: 436
Número 436, Septiembre 2020
Estadísticas de altas y bajas, composición, precio y características de medicamentos
Medicamentos con nuevos principios activos o biosimilares
COMERCIALIZADOS EN ESPAÑA EN LOS ÚLTIMOS DOCE MESES
_______________________________________________________________________________________________
Valoración de la innovación terapéutica en PAM
Es importante indicar que se valora el grado de innovación. Todos los medicamentos, sean innovadores o no, tienen utilidad terapéutica, en tanto que su autorización por las autoridades sanitarias implica que han demostrado rigurosamente su eficacia, su seguridad, su calidad y las condiciones de uso (incluyendo la información contenida en la ficha técnica – sumario de características – y en el prospecto del medicamento). Por tanto, la valoración que se hace se refiere a la incorporación, en el grado que se determine, de algún elemento innovador con respecto a otros medicamentos autorizados previamente para iguales o similares indicaciones terapéuticas o, en su caso, cubriendo la ausencia de éstas.
Asimismo, debe considerarse que ésta es una evaluación que se practica coincidiendo con la comercialización inicial del medicamento. Se trata, por consiguiente, de una valoración provisional de la innovación realizada en función de la evidencia clínica disponible hasta el momento, lo que no prejuzga, en ningún caso, la disponibilidad posterior de nuevas evidencias científicas (de eficacia o de seguridad) en la indicación autorizada o el potencial desarrollo y autorización, en su caso, de nuevas indicaciones terapéuticas o la imposición de restricciones de uso en las anteriores.
Se consideran tres posibles niveles, adjudicados en función de la relevancia de la(s) innovación(es) presentes en el nuevo medicamento, siempre en relación al arsenal terapéutico disponible clínicamente en España en el momento de la comercialización:
- SIN INNOVACIÓN (*). No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas.
- INNOVACIÓN MODERADA (**). Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar.
- INNOVACIÓN IMPORTANTE (***). Aportación sustancial a la terapéutica estándar.
Se distinguen dos niveles de evidencia científica para los aspectos innovadores de los nuevos medicamentos:
- Evidencia clínica: mediante estudios controlados, específicamente diseñados y desarrollados para demostrar la eficacia y la seguridad del nuevo medicamento, con demostración fehaciente de lo que puede ser un avance o mejora sobre la terapia estándar hasta ese momento, en el que caso de que exista.
- Plausibilidad científica (potencialidad): existencia de aspectos en el medicamento que teórica y racionalmente podrían mejorar la terapéutica actual, pero que no han sido adecuadamente demostrados mediante ensayos clínicos, bien por motivos éticos o bien por imposibilidad de realización en el momento de la comercialización del nuevo medicamento: perfil de interacciones, mecanismos nuevos que permiten nuevas vías terapéuticas, nuevos perfiles bioquímicos frente a mecanismos de resistencia microbiana, posibilidad de combinar con otros medicamentos para la misma indicación terapéutica, efectos sobre el cumplimiento terapéutico (por mejoras en la vía, número de administraciones diarias, etc.), mejora de la eficiencia económica, etc.
El rigor de los datos contrastados mediante ensayos clínicos controlados (evidencia clínica) es determinante en la valoración de la innovación, mientras que las potencialidades solo pueden ser valoradas accesoriamente, como aspectos complementarios de esta valoración. En ningún caso, un medicamento es valorado con un nivel de innovación importante en función de sus ventajas potenciales, si no aporta otras ventajas demostradas clínicamente. Se analizan cinco aspectos de la innovación: clínica, molecular, toxicológica, físico-química y económico-tecnológica. Como ya se ha indicado, la fundamental y determinante es la novedad clínica.
Fremanezumab (▼Ajovy®) en profilaxis de migraña
Resumen
Fremanezumab es un nuevo anticuerpo monoclonal con actividad antimigrañosa por su capacidad de inhibir las acciones del neuropéptido CGRP (péptido relacionado con el gen de la calcitonina). Comparte mecanismo de acción con el previamente comercializado galcanezumab: se une con alta especificidad y afinidad al péptido CGRP (en sus dos isoformas, α y β) y evita los efectos biológicos –fundamentalmente, vasodilatación y modulación de señales nociceptivas– mediados por su unión al receptor en áreas cerebrales relevantes en la patogénesis de la migraña, como el ganglio del trigémino. Pese a que se desconoce el mecanismo exacto por el que previene las crisis migrañosas, el medicamento ha sido oficialmente autorizado para la profilaxis de la migraña en adultos con al menos 4 días de migraña al mes.
Dicha autorización se basó en los datos derivados de dos amplios ensayos pivotales de fase 3, doblemente ciegos y controlados por placebo de 12 semanas de duración; uno de ellos en pacientes con migraña crónica (N= 1.130) y el otro en pacientes con migraña episódica (N= 875) con medias de 21 y 9 días con migraña al mes, respectivamente. En los primeros, las dos pautas evaluadas de fremanezumab –mensual y trimestral– demostraron la capacidad de reducir significativamente el número de días mensuales con cefalea al menos moderada (unos 2 días adicionales respecto a placebo), con tasas de respuesta del 50% del doble que placebo (38-41% vs. 18%). En pacientes con migraña episódica, la reducción del número de días mensuales con migraña fue de 1,5 días adicionales, siendo las tasas de respuesta también mayores que con placebo (44-48% vs. 28%). La superioridad del fármaco se verificó desde el primer mes, y se mantuvo constante durante el periodo de tratamiento y consistente en todos los subgrupos evaluados, aunque el beneficio parece limitado: es necesario tratar al menos a 4-5 pacientes con migraña crónica o 5-6 con migraña episódica para conseguir una profilaxis eficaz en uno de ellos. Un ensayo de fase 3 a largo plazo no controlado permitió confirmar que la eficacia de fremanezumab perdura al menos por periodos superiores a 1 año, con tasa de respuesta del 50% en > 60% de los pacientes.
En relación a la seguridad, fremanezumab parece un fármaco bien tolerado, con una incidencia de eventos adversos sin grandes diferencias frente a placebo y un perfil toxicológico similar al descrito para galcanezumab. A grandes rasgos, las reacciones adversas relacionadas con el tratamiento (47-51% vs. 37-42% con placebo) fueron leves-moderadas y transitorias, asociándose a bajas tasas de abandono (< 3%). Destacan por su frecuencia las reacciones en el lugar de inyección (43-45% vs. 38% con placebo) y, entre ellas, principalmente dolor (26-30% vs. 26-28%), induración (20-25% vs. 15-18%) y eritema (18-20% vs. 14-16%). La limitación de la evidencia a largo plazo plantea aún incertidumbres sobre los riesgos potenciales derivados de la inhibición crónica de la acción vasodilatadora del CRPG, en especial los efectos cardiovasculares.
No se dispone de comparaciones directas de fremanezumab frente al resto de alternativas terapéuticas, pero las comparaciones indirectas podrían sugerir una similar eficacia a la del resto de opciones tanto en migraña episódica como crónica (incluyendo erenumab y galcanezumab), y no se puede aún concluir sobre su posible superioridad. En resumen, sin aportar novedad en términos mecanísticos, fremanezumab ha demostrado una eficacia significativa y temprana frente a placebo en la disminución de la frecuencia de crisis de migraña y sobre la calidad de vida de los pacientes, tanto naïve como pre-tratados sin éxito con una opción terapéutica. Si bien la magnitud del beneficio clínico es modesta, fremanezumab se incorpora al grupo de antagonistas del CGRP como una alternativa a los ya disponibles erenumab y galcanezumab en pacientes refractarios o intolerantes a otras opciones de profilaxis antimigrañosa. Su uso en primera línea se ve aún limitado por la falta de datos de eficacia y seguridad a largo plazo.
Aspectos fisiopatológicos
El término cefalea hace referencia al dolor localizado en la cabeza, incluida la cara. La cefalea es un síntoma que la mayoría de las personas ha experimentado en alguna ocasión. En España, se ha estimado que un 74% de la población general (79% en mujeres) ha padecido dolores de cabeza a lo largo de su vida. Sobre todo cuando es frecuente e intensa, impide el desarrollo de las actividades profesionales, sociales y familiares, reduce enormemente la calidad de vida y tiene un elevado coste para el sistema sanitario y la sociedad. Así, las pérdidas derivadas del absentismo laboral y los gastos médicos ocasionados por cefalea en Europa se calculan en más de 170.000 millones de euros anuales; la causa fundamental de este enorme coste se debe a la disminución de la productividad laboral, puesto que la mayoría de las cefaleas primarias (no causadas por lesiones del sistema nervioso) producen más síntomas durante la vida productiva de las personas, es decir, entre los 25 y los 55 años.
La migraña es el tipo de cefalea primaria más frecuente en la práctica clínica habitual –supone algo más del 50% de los casos consultados en unidades especializadas en cefalea– y mejor estudiado. Se define como un trastorno paroxístico con gran carga genética y se caracteriza por la aparición de crisis de dolor de cabeza recurrente e intenso que suelen durar entre 4 y 72 horas si no se tratan o se tratan sin éxito. Las crisis de migraña se producen en personas constitucionalmente predispuestas, de forma recurrente, y se desencadenan en el hipotálamo (parte del cerebro responsable de la regulación hormonal, los ciclos de sueño, el hambre y la temperatura corporal), favorecidas o no por factores desencadenantes. Se define como estatus migrañoso a una crisis característica de migraña con duración superior a las 72 horas, que a menudo se relaciona con el abuso de fármacos.
El dolor asociado a esta enfermedad neurológica suele ser, de forma característica, unilateral (localizado habitualmente en un lado o mitad de la cabeza), aunque a veces tiene localización bilateral, de intensidad moderada-grave, de carácter pulsátil (“latido dentro de la cabeza”), que empeora con el esfuerzo físico, se asocia a náuseas y vómitos, y se acompaña de fotofobia y fonofobia (hipersensibilidad a la luz y al ruido, respectivamente); de forma más infrecuente también puede aparecer dolor cervical, intolerancia a los olores y dificultad para pensar con claridad.
La migraña induce una incapacidad moderada o grave en prácticamente un 50% de las personas que la padecen y ocasiona un alto porcentaje de absentismo y pérdida de productividad laboral. Las comorbilidades que en mayor medida se asocian a cefalea migrañosa son: epilepsia, accidente cerebrovascular, ansiedad, insomnio, depresión, infarto de miocardio, fenómeno de Raynaud, síndrome de intestino irritable y trastornos del dolor como fibromialgia; la menstruación y la ovulación (con alteración de niveles hormonales) pueden aumentar también la frecuencia de las cefaleas.
Desde el punto de vista de su epidemiología, la migraña tiene una prevalencia aproximada del 12% en la población general, siendo del 17% en mujeres y del 6,5% en hombres; la prevalencia suele ser máxima entre los 30 y los 50 años de edad. En España, se ha descrito específicamente una prevalencia que oscila entre un 7% para los varones y un 16% para las mujeres, y las cifras se mantienen estables desde hace décadas. No obstante, algunos datos apuntan a que esta patología está altamente infradiagnosticada (solo un 30-40% de pacientes recibe la atención médica necesaria) y puede afectar a más de 5 millones de personas en España (casi 1 millón en su forma crónica).
En cualquier caso, la migraña ocupa el sexto lugar entre las enfermedades más discapacitantes a nivel mundial, de acuerdo con datos de la Organización Mundial de la Salud (OMS). En términos de años de vida vividos con discapacidad ocupa el segundo lugar, suponiendo una especial carga para las mujeres jóvenes y adultas. En España, se calcula que los pacientes migrañosos pierden una media de 7,6 días de trabajo al año (9,4 días al año para las mujeres) como consecuencia de su cefalea (Irimia et al., 2012).
Se distinguen 2 subtipos fundamentales de migraña: migraña con aura (20% de las migrañas) y migraña sin aura (80%). El aura se caracteriza por una serie de síntomas que se originan en el cerebro, duran entre unos pocos minutos y una hora, se resuelven espontáneamente y generalmente preceden a la crisis de dolor. Los síntomas de aura más frecuentes (>90% de casos) son los trastornos visuales, como visión borrosa y la aparición de luces o líneas brillantes en el campo visual, pero también algunos pacientes experimentan dificultades para hablar, confusión u hormigueos en diferentes partes del cuerpo.
En cuanto a la frecuencia de los episodios de cefalea, la migraña se ha clasificado tradicionalmente en episódica, caracterizada por menos de 15 días de cefalea al mes (la migraña episódica con presencia de aura es la que se considera migraña clásica), o crónica, cuando se reportan 15 días o más de cefalea al mes con al menos 8 días de migraña –con o sin aura– durante más de 3 meses. En torno al 2,5% de pacientes con enfermedad episódica progresa a migraña crónica en el curso de 1 año, y la patología crónica en ocasiones remite a episódica (tasa de transición superior al 50% a los 3 años).
El abuso de fármacos, la elevada frecuencia de crisis, la predisposición genética, la alteración de neurorreceptores nociceptivos, factores psicopatológicos y mecanismos de sensibilización central y periférica se han identificado entre los mecanismos de cronificación, que puede suceder en meses o años. No obstante, el pronóstico a largo plazo de la migraña es ampliamente variable, pudiendo reducirse los síntomas gradualmente con el paso de los años o incluso desaparecer completamente, mientas que en otros pacientes pueden continuar con la misma frecuencia y severidad o incluso empeorar y volverse más frecuentes.
El dolor asociado con la migraña aparece cuando se estimulan las aferencias trigeminales de la duramadre; se inicia con perturbaciones en la frecuencia de descarga de las neuronas del tronco cerebral, específicamente en los núcleos del rafe y locus coeruleus. La perturbación de sus neurotransmisores (serotonina y noradrenalina) ocasiona una oleada de oligohemia a nivel cortical que se relaciona con la sintomatología de la migraña: el aura se asocia con la depresión inicial de potenciales corticales, y la inflamación vascular neurogénica, asociada a la estimulación anormal de receptores 5-HT1B y 5-HT1D, ocasiona la sensación dolorosa. Otros síntomas, como las náuseas, se deben a la alteración sobre el centro del vómito, y la fotofobia y la fonofobia a la estimulación anormal de receptores de serotonina corticales.
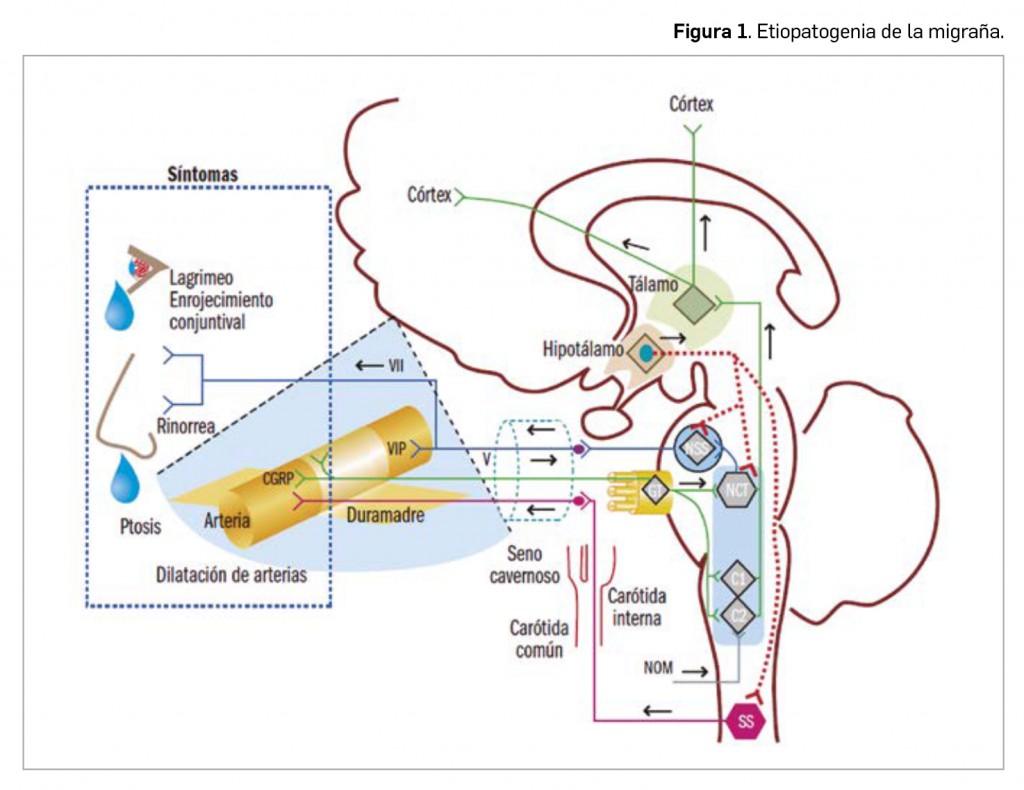
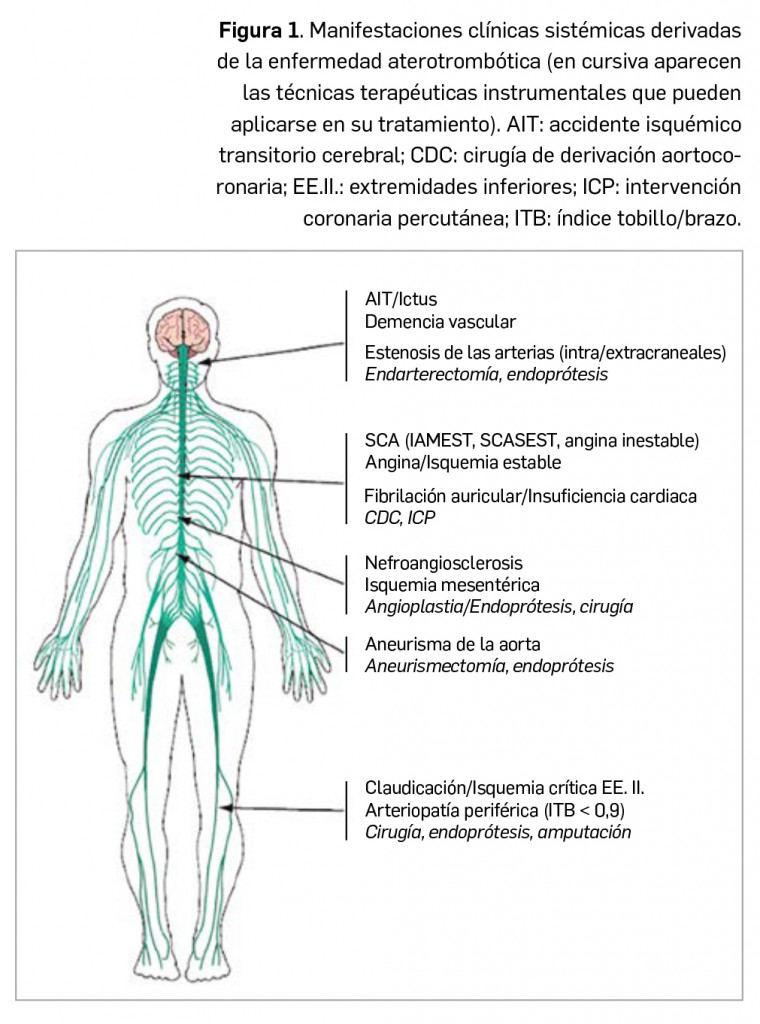
Paradójicamente, y aunque las molestias parecen originarse en el cerebro, conviene recordar que el propio tejido cerebral carece de receptores del dolor. Por el contrario, las estructuras extracraneales (piel, mucosas, músculos, arterias, venas y periostio) e intracraneales (duramadre y vasos sanguíneos intracraneales) sí son sensibles al dolor, recibiendo inervación del nervio trigémino y de fibras procedentes de las dos primeras ramas cervicales (Figura 1). Además, las fibras parasimpáticas y simpáticas también contribuyen a la inervación de las estructuras intracraneales. El estímulo doloroso se transmite hacia el núcleo espinal del trigémino a nivel del tronco del encéfalo y, posteriormente, hacia el tálamo y el córtex cerebral.
El nervio trigémino (V) transmite las sensaciones dolorosas de la piel, la duramadre y los vasos sanguíneos. Después de hacer sinapsis en el ganglio trigeminal (GT), conecta con el núcleo caudal del trigémino (NCT). Las aferencias perivasculares del trigémino pueden activarse de forma antidrómica y liberar péptido relacionado con el gen de la calcitonina (CGRP, por sus siglas en inglés), lo que provoca vasodilatación, pues las fibras nociceptivas trigeminales positivas para CGRP forman un rico plexo en los vasos sanguíneos intracraneales. El NCT y los segmentos medulares C1-C2 conforman el complejo trigémino cervical que tiene conexiones con el nervio occipital mayor (NOM), el hipotálamo y el núcleo salivar superior (NSS). La conexión entre el sistema trigeminal y el parasimpático facial (VII) se produce al nivel del NSS y constituye el denominado reflejo trigémino autonómico. Las fibras parasimpáticas del facial (VII) alcanzan los vasos sanguíneos, donde liberan péptido intestinal vasoactivo (VIP) de efecto vasodilatador y causan la sintomatología autonómica parasimpática (enrojecimiento conjuntival, lagrimeo, rinorrea). Las fibras simpáticas (SS) abandonan la médula espinal a nivel T1 y también modulan el dolor. En el seno cavernoso confluyen el trigémino y las fibras simpáticas y parasimpáticas. El hipotálamo tiene proyecciones hacia el NCT, NSS y las fibras simpáticas.
Aunque no se conocen en detalle las causas de la migraña o de la susceptibilidad a presentar episodios migrañosos, aproximadamente un 70% de las personas que la sufren tiene antecedentes familiares, lo que sugiere una causa genética del trastorno que posiblemente implica numerosos genes, haciendo que las manifestaciones sean muy variables. Además, se han identificado una serie de mutaciones genéticas responsables de cefaleas migrañosas poco frecuentes, como la migraña hemipléjica familiar (en la que se sabe que existe una mutación en el cromosoma 19 –19p13– de herencia autosómica dominante) o el síndrome MELAS (miopatía mitocondrial, encefalopatía, acidosis láctica y accidentes cerebrovasculares por afectación del ADN mitocondrial), y se han identificado varios genes en las formas habituales de migraña.
Según se ha sugerido previamente, existen una serie de desencadenantes del dolor que provocan alteraciones en el hipotálamo y, desde allí, se envían señales hacia el tronco cerebral, donde se localiza el denominado generador de la migraña (núcleos del rafe y locus coeruleus). Este centro generador pone en marcha los mecanismos responsables del dolor: actúa a través de las fibras nerviosas del nervio trigémino y produce la dilatación e inflamación de los vasos sanguíneos del cerebro (fundamentalmente como efecto de los mediadores vasodilatadores CGRP y VIP) y las estructuras que lo recubren (duramadre), provocando el dolor. Precisamente, por ese motivo, los fármacos vasoconstrictores alivian la migraña. Una parte importante de las citadas actividades biológicas está mediada por el neurotransmisor serotonina (5-hidroxitriptamina; 5-HT), que ejerce efectos mayoritariamente vasodilatadores al actuar sobre receptores de tipo 5-HT1B y 5-HT7 (Cuéllar et al., 2018).
Tratamiento y profilaxis
El objetivo del tratamiento de la migraña es conseguir la eliminación del dolor y del resto de síntomas asociados, y que el paciente pueda continuar sus actividades con normalidad, recuperando así su calidad de vida. Se basa en los siguientes pilares fundamentales: a) identificación y, si es posible, supresión o limitación de los factores modificables de riesgo (o desencadenantes); b) control rápido de los síntomas y de la discapacidad, reduciendo la intensidad y acortando la duración de las crisis; c) prevención de la recurrencia de las crisis; y d) evitación o limitación de la incidencia de efectos adversos del tratamiento.
El tratamiento sintomático de las crisis de migraña debe realizarse en todos los pacientes, y tiene como objetivo la supresión rápida y de forma completa del dolor y la sintomatología acompañante. Puede realizarse con fármacos no específicos (paracetamol, antiinflamatorios no esteroideos, opiáceos), fármacos específicos (triptanes, derivados ergóticos) y fármacos coadyuvantes (como los antieméticos y los procinéticos). Las principales guías clínicas (por ejemplo, de Sociedades Europeas, de la American Academy of Neurology y del Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología) recomiendan en primera línea el uso de triptanes –agonistas selectivos de los receptores de serotonina 5-HT1 (sobre todo, de los subtipos B y D, que participan en la vasoconstricción de vasos sanguíneos cerebrales)– en pacientes con crisis de migraña moderadas o graves y también en las crisis leves que no responden a fármacos no específicos, siempre que no exista contraindicación para su uso. En la actualidad, los derivados ergóticos, como la ergotamina, no se recomiendan en los pacientes migrañosos de novo, fundamentalmente por la menor eficacia respecto a los triptanes y por su perfil de efectos adversos (Díaz et al., 2019a).
En pacientes con más de 3 episodios de migraña al mes1 está indicado el tratamiento preventivo, a fin de reducir la cronicidad (reducir la frecuencia de los días de migraña) y mejorar la calidad de vida del paciente, reduciendo el impacto de la migraña en su funcionalidad; se considera una profilaxis eficaz si a los 3 meses de tratamiento se ha alcanzado una reducción al menos del 50% de los ataques mensuales. No obstante, la profilaxis farmacológica debe ser parte de un paradigma de tratamiento multimodal, incorporando también aspectos no farmacológicos como la nutrición, el ejercicio físico o las intervenciones psicológicas, que han demostrado ser beneficiosos para los pacientes con migraña. Si bien muchos pacientes pueden manejarse suficientemente bien con intervenciones no farmacológicas, otros requieren profilaxis con fármacos por la alta gravedad de la enfermedad caracterizada por ataques frecuentes y/o impacto funcional severo. Se calcula que alrededor del 25% de pacientes con migraña necesitan tratamiento preventivo, pero solo el 5% lo reciben.
El estándar de atención en la profilaxis de la migraña es similar para la migraña episódica y para la crónica, pero es bastante heterogéneo en todos los países europeos, con gran variedad de recomendaciones en las pautas nacionales de tratamiento. Los fármacos más comúnmente empleados en la UE y recomendados en las guías clínicas son: antiepilépticos (topiramato o valproato), betabloqueantes (propranolol, metoprolol), antidepresivos (amitriptilina), calcioantagonistas (flunarizina) y, por último, la toxina botulínica tipo A2 en casos refractarios o con contraindicación de betabloqueantes y topiramato. Otros fármacos también han mostrado cierto grado de eficacia en la profilaxis de la migraña, pero no están aprobados para este uso en la mayoría de países, como, por ejemplo, venlafaxina, lisinopril o candesartán.
La selección de la opción idónea se hará en función de las características del paciente, teniendo en cuenta que, en el caso de la migraña crónica, la necesidad del tratamiento está determinada por la frecuencia de las crisis (especialmente si hay cefalea >15 días/mes) y el consumo de medicación sintomática (un alto consumo es un factor de cronificación de la migraña). En todo caso, las evidencias clínicas disponibles son limitadas –muchas derivadas de estudios realizados hace décadas (en base a estándares de calidad diferentes)– y los tratamientos aprobados, que no se desarrollaron originalmente para la profilaxis de la migraña y no se dirigen a la fisiopatología subyacente del trastorno, se asocian frecuentemente con eficacia variable e inconsistente (en casos de migraña episódica vs. crónica) y deficiente seguridad y tolerabilidad3, lo que conduce a bajas tasas de persistencia y adherencia, tanto en estudios clínicos como en la práctica clínica real (EMA, 2019). Como resultado, muchos pacientes con migraña cambian entre terapias y las tasas de interrupción aumentan aún más a medida que los pacientes pasan por varias terapias, con tasas de adherencia tan bajas como el 20% tras un año desde el inicio.
En definitiva, existe –o hasta hace poco ha existido– una necesidad médica no cubierta de nuevos agentes profilácticos eficaces, seguros y bien tolerados para mejorar los resultados a largo plazo de la profilaxis de migraña (Díaz et al., 2019b).
La investigación clínica en torno al CGRP se centró inicialmente en pequeñas moléculas antagonistas del receptor de CGRP que, sin embargo, mostraron una notable hepatotoxicidad en diversos estudios, por lo que su desarrollo fue interrumpido y los trabajos se reorientaron al desarrollo de anticuerpos monoclonales dirigidos específicamente contra el propio CGRP o su receptor, que en principio presentarían mayor vida media y ausencia de metabolismo hepático, con menor riesgo de elevación de enzimas hepáticas. Estos novedosos anticuerpos se han mostrado más eficaces que los tratamientos “clásicos” y han abierto nuevos horizontes en la profilaxis de migraña. Así, en 2019 se incorporaron al mercado farmacéutico español erenumab y galcanezumab, dos nuevos anticuerpos monoclonales que muestran actividad antimigrañosa por su capacidad de inhibir los efectos biológicos del neuropéptido CGRP. Mientras que erenumab se une al dominio extracelular del receptor de CGRP, galcanezumab se une específicamente al propio CGRP, pero ambos fármacos previenen, en última instancia, los efectos vasodilatadores y de modulación de las señales nociceptivas mediados por la unión del CGRP a su receptor, fundamentalmente en áreas cerebrales relevantes en la patogénesis de la migraña, como el ganglio del trigémino. En base a ello, ambos medicamentos (Aimovig® y Emgality®), administrados por vía subcutánea una vez al mes, han sido aprobados para la profilaxis de la migraña en adultos con al menos 4 días de migraña al mes.
Tras 6 meses de tratamiento, erenumab demostró la capacidad de reducir 2,5 y 1,8 días de migraña mensuales frente a placebo en pacientes con migraña crónica y migraña episódica, respectivamente; el beneficio en términos de porcentaje de respuesta se produjo en 1 de cada 4-6 pacientes con migraña episódica y en 1 de cada 6 con migraña crónica. Por su parte, en periodos de tratamiento similares, galcanezumab aportó reducciones de la frecuencia de migraña de 2 días adicionales sobre placebo en ambos tipos de migraña; el beneficio se produjo en 1 de cada 4-5 pacientes con migraña episódica y en 1 de cada 8 con migraña crónica. Los análisis por subgrupos sugirieron que la eficacia de ambos fármacos es significativamente superior en pacientes que han fallado a ≥1 tratamiento preventivo previo frente a pacientes naïve, y algunos estudios con periodos de tratamiento más prolongados apuntan a que la eficacia de estos fármacos perdura en periodos de al menos 1 año.
Además, se trata de fármacos bien tolerados, que se asocian a reacciones adversas leves-moderadas y transitorias (con una incidencia de eventos adversos sin grandes diferencias frente a placebo) y a bajas tasas de abandono. En global, destacan por su frecuencia: reacciones en el lugar de inyección, reacciones de hipersensibilidad (prurito o eritema), infecciones del tracto respiratorio, estreñimiento, vértigo o fatiga. Aunque parece que la seguridad puede ser similar a la de otros fármacos profilácticos, no se dispone de datos a largo plazo y se plantea la incertidumbre de los riesgos potenciales derivados de la inhibición crónica de la acción vasodilatadora del CRPG, en especial los efectos cardiovasculares y sobre el embarazo (Fernández-Moriano et al., 2019).
Acción y mecanismo
Fremanezumab es un anticuerpo monoclonal IgG2Δa/kappa humanizado (derivado de un precursor murino), que se une directamente al ligando CGRP con una alta afinidad y alta especificidad y bloquea la unión de sus dos isoformas (α-CGRP y β-CGRP) a sus receptores, previniendo las actividades biológicas desencadenadas por esa unión. Aunque se desconoce el mecanismo de acción exacto por el que fremanezumab previene las crisis migrañosas, se cree que la prevención de la migraña se consigue gracias a su efecto modulador del sistema trigeminal. En base a ello, el medicamento ha sido oficialmente autorizado para la profilaxis de la migraña en adultos con al menos 4 días de migraña al mes.
Como se ha indicado anteriormente, el CGRP (péptido relacionado con el gen de la calcitonina) es un neuropéptido que modula las señales nociceptivas y tiene efectos vasodilatadores, de forma que se han identificado concentraciones sanguíneas elevadas de CGRP (sobre todo, en sangre venosa yugular externa ipsilateral al dolor) en los ataques de migraña con o sin aura, y se han asociado a la fisiopatología de la enfermedad; los niveles de CGRP en suero y saliva también se elevan durante los ataques de migraña espontánea o en la migraña crónica. Se ha demostrado que los niveles plasmáticos de CGRP se normalizan con el alivio de la cefalea y, al contrario, la infusión intravenosa de CGRP desencadena una cefalea de tipo migrañoso en una alta proporción de pacientes (~60%).
El CGRP se libera en alto grado en las neuronas trigeminales (especialmente en fibras C no mielinizadas y pequeñas fibras Ad mielinizadas), a menudo junto con otros neuropéptidos como la sustancia P; las fibras nociceptivas trigeminales positivas para CGRP forman un rico plexo en los vasos sanguíneos intracraneales. Al liberarse periféricamente de las terminaciones nociceptivas trigeminales activadas, este neuropéptido induce edema, aumenta el flujo sanguíneo y recluta células inflamatorias, promoviendo la inflamación neurogénica y provocando el dolor típico de la migraña. En las sinapsis del complejo trigeminocervical, CGRP transmite señales nociceptivas a través del tronco encefálico, al tálamo y la corteza somatosensorial, generando hiperalgesia. Durante la migraña, CGRP podría también sensibilizar los circuitos neuronales disminuyendo el umbral de aferencias sensoriales, conduciendo no solo a dolor sino también a alodinia (percepción anormal del dolor), náuseas, fotofobia y fonofobia.
Se entiende, por tanto, que la inhibición por fremanezumab de los efectos biológicos mediados por la unión de CGRP a su receptor atenuará los efectos vasodilatadores y sobre la nocicepción de CGRP y permitirá prevenir los ataques de migraña. Este anticuerpo podrá actuar fundamentalmente sobre las células del músculo liso en los vasos sanguíneos y las neuronas y las células gliales ubicadas fuera de la barrera hematoencefálica, probablemente en el ganglio trigémino y las estructuras paraventiculares del tronco encefálico. Los estudios in vitro e in vivo han demostrado que fremanezumab se une a α-CGRP con alta afinidad y especificidad, pero que no se une a otros miembros de su familia estrechamente relacionados (por ejemplo, amilina, calcitonina, intermedina y adrenomedulina).
Habida cuenta de que CGRP tiene efectos pleiotrópicos, una serie de mecanismos biológicos podrían verse afectados por este nuevo anticuerpo monoclonal, conduciendo a efectos adversos. Sin embargo, los datos de la literatura científica y aquellos de seguridad en animales (sobre todo, en monos) sugieren que CGRP no juega un papel importante en la homeostasis en situaciones normales, si bien no puede excluirse categóricamente que la inhibición de sus acciones pueda conducir a eventos adversos en combinación con comorbilidades o factores de riesgo. De hecho, se planteó que la inhibición de los efectos del CGRP podría teóricamente atenuar la vasodilatación compensatoria en condiciones relacionadas con una isquemia, pero las evidencias clínicas de la administración de este tipo de anticuerpos anti-CGRP en pacientes con angina de pecho estable sugieren que éstos soportan el ejercicio físico con una duración similar respecto a la administración de placebo, sin agravarse la isquemia miocárdica (EMA, 2019).
Aspectos moleculares
Fremanezumab es un anticuerpo monoclonal completamente humanizado de tipo IgG2 Δa/kappa producido por técnicas de ingeniería genética en células de ovario de hámster chino (CHO). Consta de dos cadenas ligeras idénticas entre sí y otras dos cadenas pesadas idénticas entre sí. Cada cadena ligera está formada por 214 residuos aminoacídicos, y se predice que cada cadena pesada contiene 448 aminoácidos4. El peso molecular de fremanezumab es de 148 kDa.
La molécula, glicosilada en el residuo de asparagina en posición 298 de las cadenas pesadas, contiene un total de 36 residuos de cisteína con capacidad de formar puentes disulfuro inter e intracatenarios. Cabe destacar que la introducción de 2 mutaciones en la región constante (Fc) de las cadenas pesadas de fremanezumab limita sus funciones efectoras, evitando una estimulación de la citotoxicidad celular dependiente de anticuerpos o la lisis mediada por el complemento.
Habida cuenta de que CGRP tiene efectos pleiotrópicos, una serie de mecanismos biológicos podrían verse afectados por este nuevo anticuerpo monoclonal, conduciendo a efectos adversos. Sin embargo, los datos de la literatura científica y aquellos de seguridad en animales (sobre todo, en monos) sugieren que CGRP no juega un papel importante en la homeostasis en situaciones normales, si bien no puede excluirse categóricamente que la inhibición de sus acciones pueda conducir a eventos adversos en combinación con comorbilidades o factores de riesgo. De hecho, se planteó que la inhibición de los efectos del CGRP podría teóricamente atenuar la vasodilatación compensatoria en condiciones relacionadas con una isquemia, pero las evidencias clínicas de la administración de este tipo de anticuerpos anti-CGRP en pacientes con angina de pecho estable sugieren que éstos soportan el ejercicio físico con una duración similar respecto a la administración de placebo, sin agravarse la isquemia miocárdica (EMA, 2019).
Eficacia y seguridad clínicas
La eficacia y seguridad clínicas de fremanezumab por vía subcutánea han sido adecuadamente contrastadas en la indicación y dosis autorizadas fundamentalmente mediante 3 ensayos pivotales de fase 3, incluyendo un estudio a largo plazo.
Dos de ellos tuvieron un diseño muy similar: aleatorizados, multicéntricos y multinacionales, doblemente ciegos, de grupos paralelos y controlados por placebo, de 12 semanas de duración. Incluyeron pacientes con migraña de tipo crónico (≥15 días de cefalea al mes con ≥8 días de migraña al mes) o tipo episódico (<15 días de migraña al mes), que debían tener antecedentes de migraña con o sin aura de ≥12 meses (según los criterios diagnósticos de la ICHD-3)5, pero excluyeron pacientes con edad >70 años, con uso excesivo (>4 días/mes) de opioides o barbitúricos, antecedentes de problemas cardiovasculares (infarto de miocardio, accidente cerebrovascular o tromboembolismo) y pacientes que habían fracasado al tratamiento con fármacos preventivos de al menos dos grupos distintos. Se permitió a los pacientes incluidos usar tratamientos sintomáticos contra la cefalea aguda durante los estudios y, además, a un subgrupo (21% en ambos estudios) también se les permitió usar de manera profiláctica algún otro fármaco de los comúnmente usados (betabloqueantes, calcioantagonistas, antidepresivos, antiepilépticos).
El estudio realizado en pacientes con migraña crónica (TV48125-CNS-30049) aleatorizó 1.130 pacientes en uno de los 3 grupos de tratamiento: i) dosis inicial de 675 mg de fremanezumab seguida de 225 mg una vez al mes; ii) una dosis 675 mg de fremanezumab cada 3 meses, seguida de 1 inyección subcutánea mensual de placebo; o iii) una inyección mensual de placebo. Las características demográficas y de la enfermedad estaban bien equilibradas entre grupos, destacando que, en global, los pacientes tenían una mediana de edad de 41 años, el 88% eran mujeres y el 79% de raza blanca, la frecuencia media de cefaleas al inicio era de unos 21 días al mes (unos 13 días de intensidad moderada o grave), y una proporción importante había usado previamente topiramato (30%) u onabotulinumtoxina A (15%).
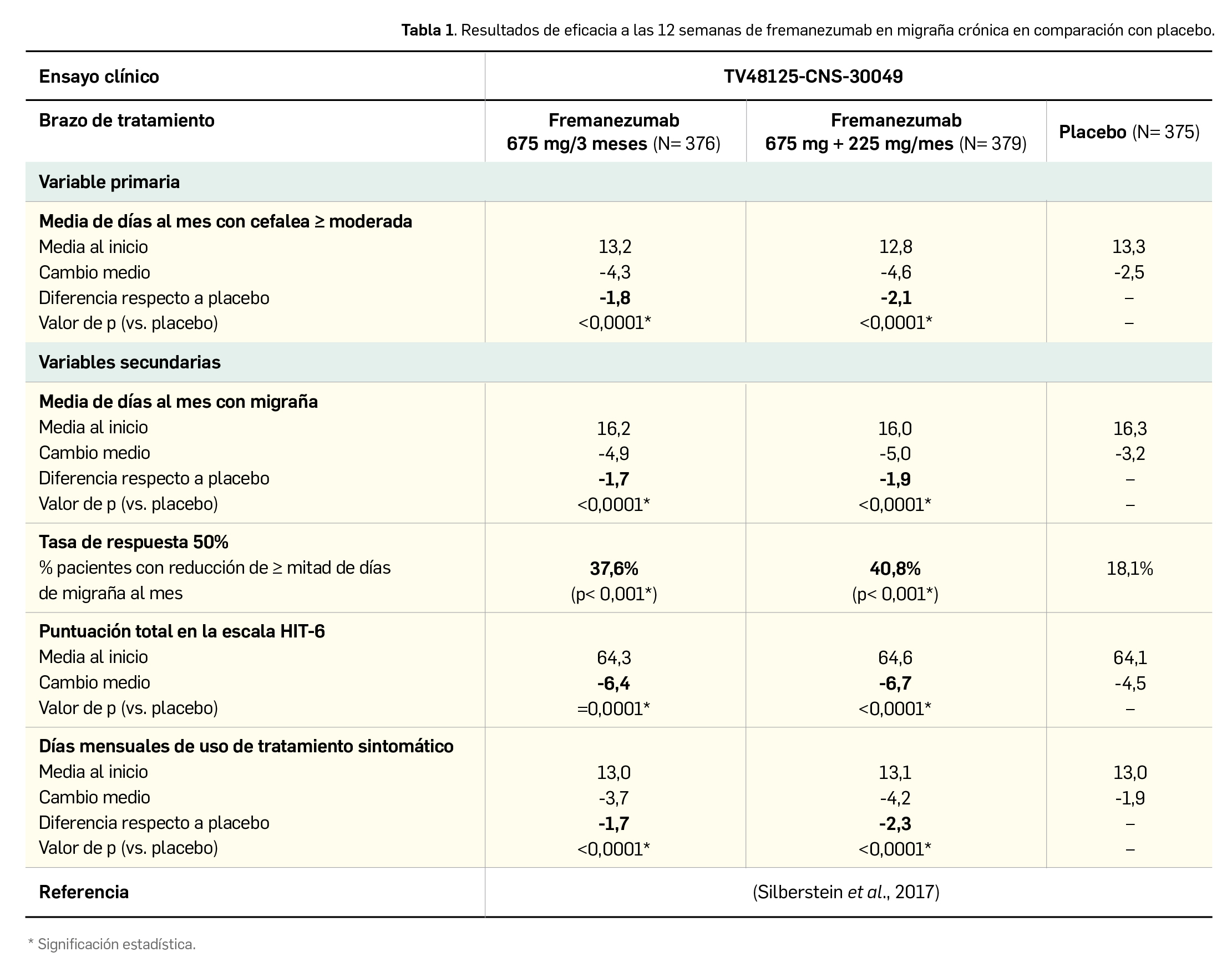
Un total de 1.034 pacientes completaron la fase de tratamiento de 12 semanas, periodo durante el cual se determinó como variable principal de eficacia la variación media –con respecto al inicio– en el promedio de días al mes con cefalea de intensidad al menos moderada. Entre las variables secundarias, se consideraron la tasa de respuesta del 50%, la variación media en la puntuación de la escala HIT-6 (prueba del impacto de la cefalea, por sus siglas en inglés) comunicada por el paciente y la variación en la media de días al mes de uso de medicamentos para la cefalea aguda. Los resultados divulgados, recogidos en la Tabla 1, demuestran que la pauta mensual y la trimestral de fremanezumab inducen una mejoría clínicamente superior a placebo, evidenciándose un efecto estadísticamente significativo ya desde el primer mes, que se mantuvo durante el periodo de tratamiento.
De manera interesante, el análisis por subgrupos reveló que, en pacientes que recibían a la vez otro fármaco para la profilaxis de migraña, la magnitud del beneficio clínico era similar con las pautas trimestral y mensual de fremanezumab, con reducciones respecto a placebo de -1,3 y -2,0 días mensuales con cefalea al menos moderada, respectivamente. Esa misma diferencia para ambos grupos se observó en pacientes tratados previamente con onabotulinumtoxina A, mientras que la eficacia en pacientes que habían usado previamente topiramato parece superior: la diferencia con respecto a placebo para la reducción del número de días mensuales con cefalea al menos moderada fue de -2,7 días para la pauta trimestral de fremanezumab y de -2,9 días para la pauta mensual. La mayoría (52%) de pacientes que tenían un uso excesivo de medicación para la cefalea aguda se benefició en términos similares, verificándose diferencias de -2,2 y -2,7 días respecto a placebo para ambos brazos de tratamiento.
El estudio de fremanezumab en el contexto de migraña episódica (TV48125-CNS-30050) aleatorizó un total de 875 pacientes en tres grupos de tratamiento iguales que en el estudio anterior, con la salvedad de que la pauta de fremanezumab mensual no incluía dosis de carga de 675 mg; 791 pacientes completaron el tratamiento de 12 semanas. Las características de los pacientes también estaban bien balanceadas entre grupos: mediana de edad de 42 años, 85% mujeres, 80% de raza blanca, frecuencia media de migrañas al inicio de 9 días al mes y el 19% de los pacientes había usado previamente topiramato.
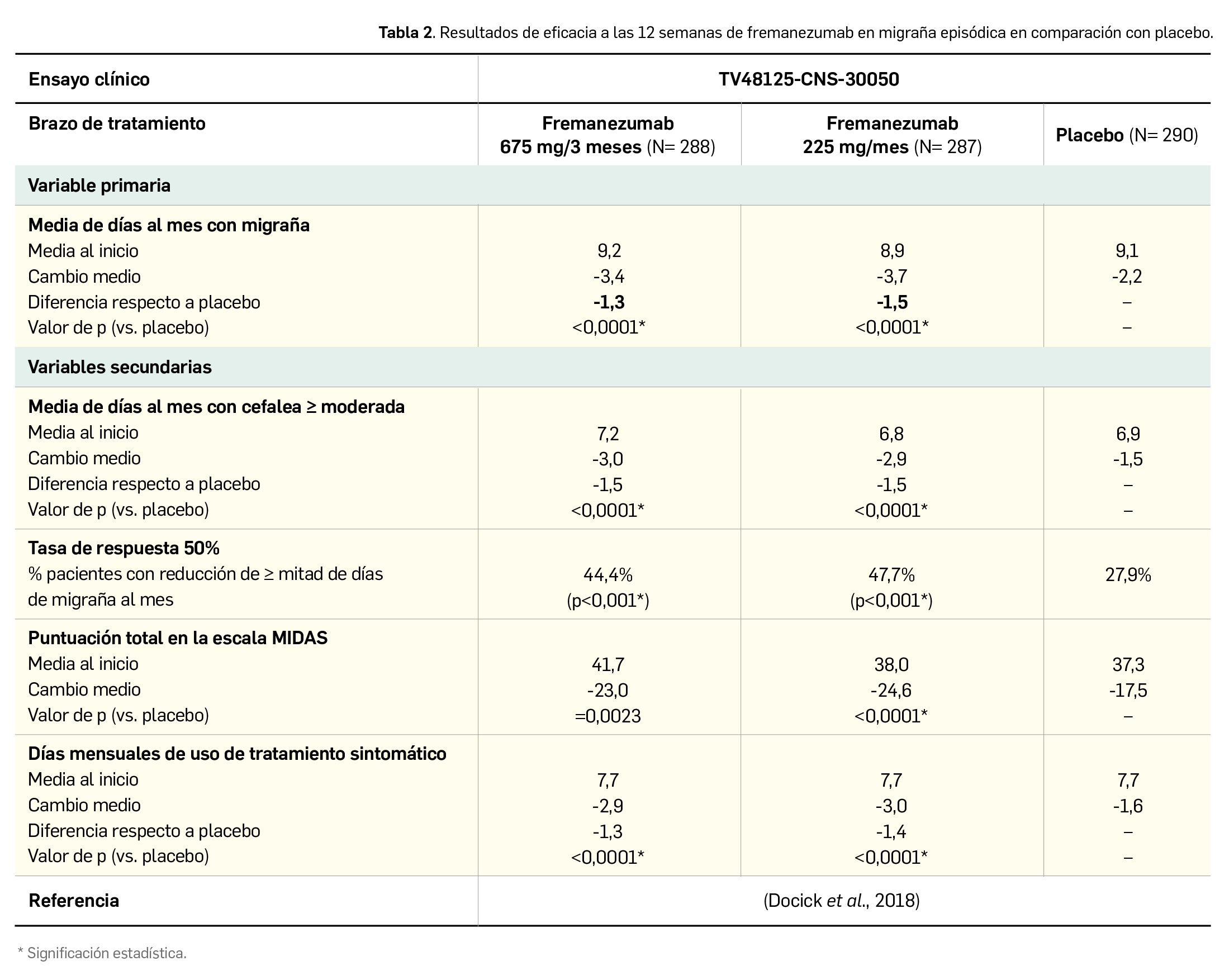
Se determinó como variable principal de eficacia el cambio medio con respecto al inicio en el promedio de días mensuales con migraña al mes. Las variables secundarias fueron similares a las comentadas en el estudio de migraña crónica, si bien para evaluar el impacto de la migraña sobre la calidad de vida comunicada por los pacientes se usó la puntuación de la escala MIDAS (del inglés, Migraine Disability Assessment). De nuevo, en comparación con placebo, las dos pautas posológicas de fremanezumab indujeron una mejoría clínicamente significativa respecto al inicio, con una eficacia constatada desde el primer mes y constante durante todo el estudio. Los resultados se recogen en la Tabla 2.
En aquellos pacientes que recibían a la vez otro fármaco para la profilaxis de la migraña, la mejoría frente a placebo fue ligeramente superior, con una reducción media de -1,8 y -2,0 días de migraña al mes con la pauta trimestral y la pauta mensual de fremanezumab, respectivamente. Asimismo, entre quienes habían sido tratados previamente con topiramato, la diferencia entre tratamientos se alcanzó los -2,3 y -2,4 días con migraña al mes para las pautas trimestral y mensual, respectivamente.
Por último, se han divulgado los resultados preliminares de un ensayo a largo plazo aún en marcha (estudio HALO), que presenta un diseño aleatorizado, multicéntrico y multinacional, completamente ciego y de fase 3, en el que se han enrolado los pacientes que habían completado los dos estudios previamente comentados y nuevos pacientes con migraña crónica o episódica, hasta un total de 1.890 pacientes asignados en dos brazos de tratamiento (675 mg de fremanezumab cada 3 meses o bien 225 mg/mes) durante un periodo de 12 meses adicionales.
Los datos sugieren que la eficacia de fremanezumab se mantiene en el tiempo. A los 6 meses se observó una reducción promedio –respecto al inicio– de -4,9 y -5,0 días de migraña al mes en pacientes con migraña episódica para las pautas mensual y trimestral, respectivamente, y de -7,9 y -6,5 días mensuales de migraña en pacientes con migraña crónica; la tasa de respuesta 50% respecto a los días mensuales con cefalea al menos moderada se verificó en el 61 y 65% de pacientes con migraña episódica y en el 56 y 51% de pacientes con migraña crónica. De forma interesante, combinando los datos de las dos pautas posológicas, después de 12 meses de tratamiento en este estudio (total de 15 meses) se observó una reducción de -6,6 días mensuales de migraña en comparación con el valor basal de los estudios de 12 semanas, que se asociaba con una tasa de respuesta del 50% en un 61% de los pacientes.
En lo referente a la seguridad, los datos derivan de más de 2.500 pacientes tratados con fremanezumab en los estudios de registro, de los cuales más de 1.400 recibieron el tratamiento durante al menos 12 meses. La incidencia de eventos adversos reportados fue similar para las dos pautas evaluadas de fremanezumab (una dosis trimestral o una dosis mensual) y sin diferencias reseñables en comparación con placebo, de forma que aproximadamente el 66-75% del conjunto de pacientes en los estudios de 12 semanas y el de largo plazo experimentaron algún evento adverso. No obstante, una amplia mayoría fueron leves-moderados, autolimitados y tendieron a reducir su frecuencia con el tiempo de uso, por lo que las tasas de abandono del tratamiento experimental por problemas de seguridad fueron bajas (<3%).
Los eventos adversos se relacionaron con el tratamiento en el 47-51% de los pacientes tratados con fremanezumab (vs. 37-42% con placebo). En los primeros tres meses, las reacciones adversas descritas con mayor frecuencia tanto en pacientes con migraña crónica como episódica fueron las reacciones en el lugar de inyección (43-45% vs. 38% con placebo), destacando: dolor (26-30% vs. 26-28%), induración (20-25% vs. 15-18%), eritema (18-20% vs. 14-16%) y prurito (2%). El tratamiento a largo plazo (> 1 año) no parece revelar aspectos nuevos de seguridad.
Ante el riesgo teórico de que la acción inhibitoria de fremanezumab sobre la vasodilatación (al inhibir las acciones de CGRP) pueda empeorar los acontecimientos isquémicos (ictus, accidente isquémico transitorio, infarto de miocardio), hay que mencionar que la incidencia de eventos cardio y cerebrovasculares en los estudios clínicos controlados fue baja y similar entre placebo y erenumab (hipertensión ~2%, sofocos < 1% y palpitaciones < 1%), en la mayoría de casos con una improbable relación causal con el fármaco. Sin embargo, la baja proporción de pacientes de > 65 años evaluados (quienes tendrían un riesgo cardiovascular incrementado) determina que este potencial riesgo aún no pueda ser descartado. Con respecto a la inmunogenicidad, no se identificaron diferencias remarcables de seguridad ni de eficacia en aquellos pocos pacientes con positividad de anticuerpos (incidencia de anticuerpos anti-fármaco no neutralizantes del 2,3% a los 12 meses y de neutralizantes de <1%).
Aspectos innovadores
Fremanezumab es un nuevo anticuerpo monoclonal que muestra actividad antimigrañosa por su capacidad de inhibir las acciones del neuropéptido CGRP (péptido relacionado con el gen de la calcitonina). Comparte mecanismo de acción con el previamente comercializado galcanezumab: se une con alta especificidad y afinidad al péptido CGRP (en sus dos isoformas, α y β) y evita los efectos biológicos –fundamentalmente, vasodilatación y modulación de señales nociceptivas– mediados por su unión al receptor en áreas cerebrales relevantes en la patogénesis de la migraña, como el ganglio del trigémino. Pese a que se desconoce el mecanismo de acción exacto por el que fremanezumab previene las crisis migrañosas, el medicamento ha sido oficialmente autorizado para la profilaxis de la migraña en adultos con al menos 4 días de migraña al mes.
Los datos clínicos que respaldan su autorización por vía subcutánea derivan fundamentalmente de 2 amplios ensayos pivotales de fase 3, doblemente ciegos y controlados por placebo, de 12 semanas de duración. El primero de ellos se realizó sobre un total de 1.130 pacientes con migraña crónica con o sin aura y con una media de 21 días al mes con cefalea (13 días de intensidad moderada o grave); en torno a la mitad de pacientes habían fallado previamente a un tratamiento profiláctico (topiramato u onabotulinumtoxina A). Las dos pautas del fármaco (675 mg/3 meses y 225 mg/mes con dosis de carga de 675 mg) indujeron una reducción estadísticamente significativa del número de días con cefalea al menos moderada, con diferencias frente a placebo próximas a 2 días mensuales (-4,3/-4,6 vs. -2,5 días con placebo; p<0,0001). Además, se verificó que casi el doble de pacientes tratados con el fármaco respondía con reducción de al menos un 50%6 del número de días con migraña al mes –requisito para considerar eficaz la profilaxis– en comparación con el grupo placebo (38-41% vs. 18%), lo cual se relacionaba con unos 2 días mensuales menos de uso de tratamiento sintomático.
El segundo estudio incluyó 875 pacientes con migraña episódica con una frecuencia media de 9 días de migraña al mes, en este caso con una menor proporción de pre-tratados (~19% con topiramato). A las 12 semanas, las dos pautas de fremanezumab también demostraron superioridad frente a placebo, con reducciones adicionales de -1,3 a -1,5 días mensuales con migraña (-3,4/-3,7 vs. -2,2 días; p<0,0001) y de -1,5 días mensuales con cefalea al menos moderada (-3,0/-2,9 vs. -1,5 días; p<0,0001). De nuevo, la tasa de respuesta 50%7 aumentaba hasta el 44-48% de los pacientes (vs. 28% con placebo) y el número de días mensuales con tratamiento sintomático se reducía en 1,4 días frente a placebo. A pesar de que en ambos estudios se observa cierta superioridad numérica en la pauta mensual de fremanezumab, la diferencia respecto a la pauta trimestral es mínima como para considerar que representa un beneficio.
Cabe destacar que la eficacia del fármaco se constató desde el primer mes y fue constante durante el periodo de tratamiento en ambos estudios, mejorando los resultados percibidos por los pacientes en las escalas de calidad de vida (sugerente de una reducción del impacto de la migraña en actividades de la vida diaria). Además, los análisis por subgrupos confirmaron la consistencia de dicha eficacia con independencia de factores como la edad, el sexo, la raza, el uso concomitante o pasado de fármacos preventivos y el uso excesivo de medicación para la cefalea aguda. Los datos apuntan, incluso, a que los pacientes pre-tratados con topiramato podrían beneficiarse en mayor medida del tratamiento (en comparación con pacientes naïve a la profilaxis), al observarse reducciones de casi 3 días mensuales con cefalea al menos moderada en pacientes con migraña crónica y de casi 2 días y medio con migraña al mes en aquellos con migraña episódica.
De manera interesante, un tercer estudio no controlado a largo plazo, de fase 3, aleatorizado, ciego y de grupos paralelos, que incluyó hasta un total de casi 1.900 pacientes (muchos de ellos procedentes de los estudios de 12 semanas) demostró que la eficacia de fremanezumab se mantiene en el tiempo en periodos de 1 año de tratamiento. La combinación de los datos de las dos pautas posológicas –mensual y trimestral– demuestra que tras 12 meses de tratamiento en ese estudio (total de 15 meses en la mayoría de pacientes) se verificaba una reducción de -6,6 días mensuales de migraña en comparación con el valor basal antes de los estudios de 12 semanas, asociada con una tasa de respuesta del 50% en un 61% de los pacientes.
Por otra parte, el perfil toxicológico de fremanezumab parece bien definido y relativamente benigno, con una incidencia global de eventos adversos (66-75%) sin diferencias notables entre las dos pautas de tratamiento y en comparación con placebo, ni en función del tipo de migraña; la práctica totalidad de los mismos fueron leves-moderados y autolimitados, lo cual se traduce en bajas tasas de abandono del tratamiento experimental (< 3%). Los eventos adversos relacionados con el tratamiento fueron ligeramente más frecuentes con fremanezumab que con placebo (47-51% vs. 37-42%), desatacando, por su frecuencia, las reacciones en el lugar de inyección (43-45% vs. 38% con placebo), principalmente dolor (26-30% vs. 26-28%), induración (20-25% vs. 15-18%), eritema (18-20% vs. 14-16%) y prurito (2%). Por la limitación de la evidencia, se plantea aún la incertidumbre de los riesgos potenciales derivados de la inhibición crónica de la acción vasodilatadora del CRPG, en especial los efectos cardiovasculares y en mayores de 65 años.
El adecuado diseño de los estudios realizados permite, por tanto, confirmar la superioridad clínica de fremanezumab frente a placebo (quizá ligeramente más eficaz en casos de migraña crónica). Sin embargo, la falta de comparación directa del nuevo fármaco con otros anticuerpos monoclonales anti-CGRP –erenumab o galcanezumab– o con el resto de alternativas terapéuticas disponibles para la profilaxis de migraña crónica o episódica –topiramato, toxina botulínica, betabloqueantes, flunarizina o amitriptilina– dificultan su correcto posicionamiento. Como ya indicábamos (Fernández-Moriano, 2019), las comparaciones indirectas, con grandes limitaciones intrínsecas –por diferencias en el perfil de los pacientes incluidos en ensayos clínicos, periodos de tratamiento, variables, etc.– son escasas en este campo y, en todo caso, con el resto de opciones profilácticas apuntarían a reducciones de entre -0,5 y -2,4 días con migraña al mes más que placebo.
Así pues, los resultados comentados para fremanezumab sugieren que ejerce una eficacia dentro de ese rango; en una comparación indirecta no ajustada también sería similar a la demostrada a los 3-6 meses por erenumab (reducción de 2,5 y 1,8 días mensuales de migraña en pacientes con migraña crónica y episódica, respectivamente) y por galcanezumab (reducción de 2 días mensuales en ambos tipos de migraña), sin que por ahora se pueda establecer la superioridad de uno u otro fármaco. El perfil de seguridad de fremanezumab coincide especialmente con el de galcanezumab, con el que comparte mecanismo de acción, y puede superar la principal limitación de toxicidad asociada a los fármacos clásicamente empleados en la profilaxis de migraña, para los que se han reportado elevadas tasas de abandono (por ejemplo, a los 6 meses, de hasta el 45% con topiramato). No obstante, se debe esperar a futuros estudios con mayor seguimiento para esclarecer los riesgos de seguridad a largo plazo de estos anticuerpos anti-CGRP, ya que son tratamientos que, a priori, pueden prolongarse en el tiempo.
En resumen, fremanezumab no aporta ninguna innovación en términos mecanísticos respecto al ya comercializado galcanezumab. Ha demostrado eficacia significativa en comparación con placebo desde la primera administración en la reducción de la frecuencia de crisis de migraña y sobre la funcionalidad de los pacientes, tanto naïve como pre-tratados sin éxito con una opción terapéutica, si bien la magnitud del beneficio clínico parece modesta y no hay evidencias de su efecto sobre la intensidad y la duración de las crisis de migraña. El IPT de la AEMPS considera que fremanezumab se incorpora al grupo de antagonistas del CGRP y, ante la ausencia de evidencias de un beneficio clínico añadido, puede ser una alternativa a erenumab y galcanezumab8 en pacientes en los que no exista mejoría o que presenten intolerancia a las otras opciones de profilaxis antimigrañosa. Su uso en primera línea se ve aún limitado por la falta de datos de eficacia y seguridad a largo plazo, teniendo en cuenta, además, que ha sido financiado en una indicación más restringida (profilaxis de migraña en pacientes con ≥ 8 días de migraña al mes y ≥ 3 fracasos de tratamientos previos –incluyendo la toxina botulínica– durante 3 meses), lo cual limitará su uso en la práctica clínica a las últimas líneas de tratamiento.
Valoración
Fármacos relacionados registrados en España
Dacomitinib (▼Vizimpro®) en cáncer de pulmón no microcítico
Resumen
Dacomitinib es un nuevo antineoplásico que actúa como inhibidor universal, selectivo, irreversible y competitivo con el ATP, del dominio tirosina cinasa del receptor del factor de crecimiento epidérmico humano (EGFR/HER1, pero también de HER2 y HER4), con actividad contra el EGFR mutado con deleciones en el exón 19 o la sustitución L858R en el exón 21. En base a ello, atenúa los procesos de crecimiento celular neoplásico (incluyendo, entre otros, la proliferación celular incontrolada, la migración celular, la invasión del estroma, la angiogénesis y la resistencia a la apoptosis), por lo que el medicamento ha sido autorizado, en monoterapia, para el tratamiento por vía oral de primera línea de pacientes adultos con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras del EGFR.
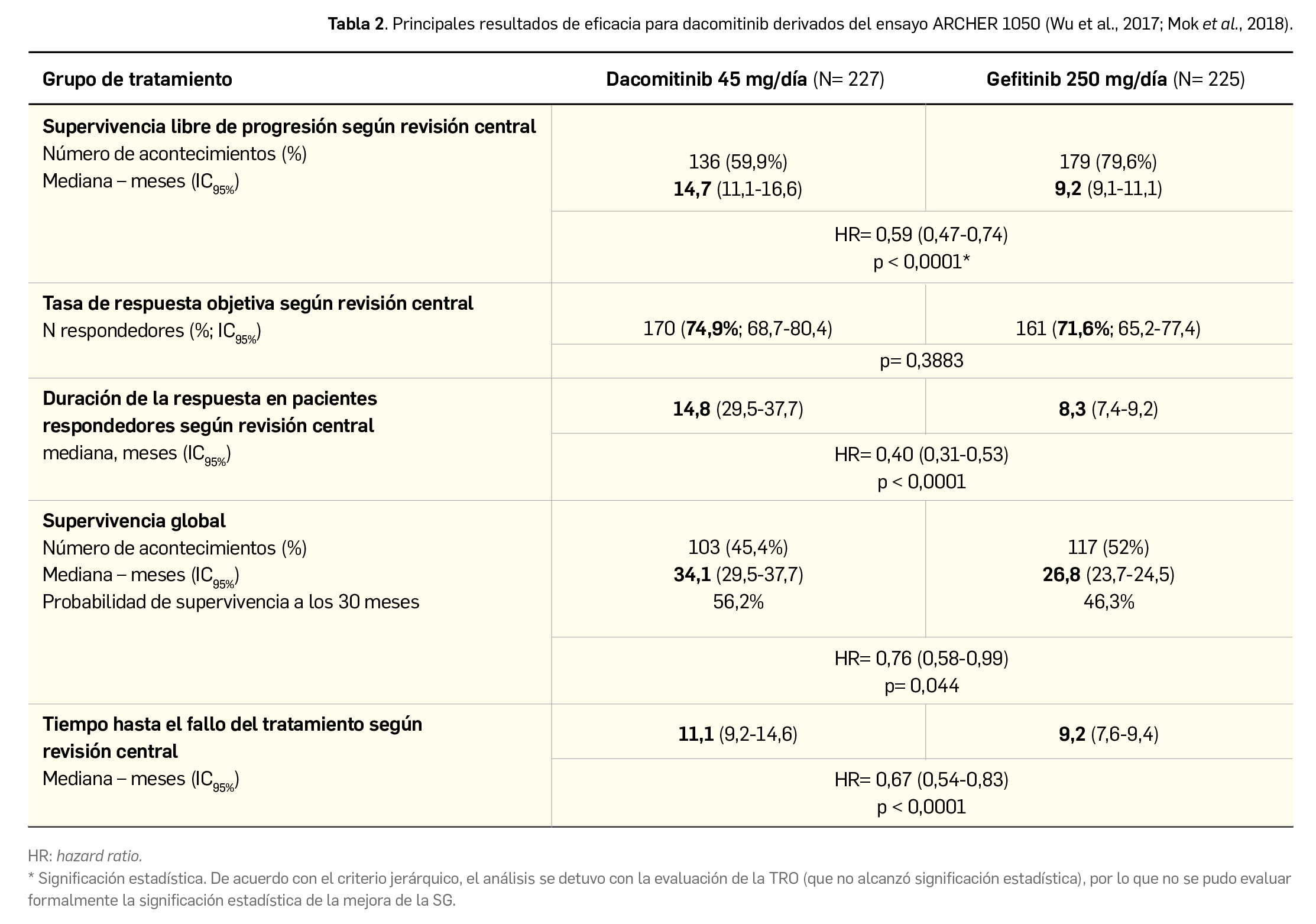
En el ensayo pivotal de fase 3 y multicéntrico (ARCHER 1050; N= 452), el tratamiento con dacomitinib (45 mg/día) ha demostrado su capacidad de prolongar en 5,5 meses la mediana de la supervivencia libre de progresión frente al comparador activo gefitinib (14,7 vs. 9,2 meses; p < 0,0001). Sin diferencias destacables en la tasa de respuesta, el nuevo fármaco también aporta mejoras en la mediana de duración de la respuesta (14,8 vs. 8,3 meses) y en el tiempo hasta el fallo del tratamiento (11,1 vs. 9,2 meses), lo cual se traduce en un aumento de la supervivencia global con una prolongación de la mediana de 7,3 meses (34,1 vs. 26,8 meses con gefditinib; p < 0,05), si bien estos resultados se consideran exploratorios. Su eficacia se mostró consistente en todos los subgrupos de pacientes con independencia de factores como la edad (salvo > 75 años), el género, el hábito tabáquico, el tipo de mutación de EGFR o el estado funcional; la excepción de los pacientes de raza no asiática, en que no se verificó mejora de SLP, es considerado por la EMA como un hallazgo debido al azar. Además, un estudio de soporte de un solo brazo también apunta a interesantes resultados de eficacia con dacomitinib (mediana de SLP de 18,2 meses y de SG de 42,3 meses) en pacientes con mutación activadora de EGFR.
Por otra parte, el perfil toxicológico de dacomitinib es importante y desfavorable en comparación con gefitinib (aumento de la diarrea y de toxicidades cutáneas), pero clínicamente manejable y en línea con lo esperado por los resultados de seguridad de afatinib, el otro EGFR-TKI de 2ª generación disponible. Casi todos los pacientes reportan algún evento adverso durante el tratamiento (de grado 3-4 en más de la mitad), destacando por su frecuencia las reacciones adversas del tracto gastrointestinal (diarrea y estomatitis), de la piel (dermatitis, sequedad, rash o prurito), de las uñas (paroniquia) y una reducción del apetito. La tasa de eventos adversos graves relacionados con dacomitinib alcanzó el 7% (sobre todo, diarrea, enfermedad pulmonar intersticial, dermatitis cutánea y reducción del apetito), lo cual se asocia con una tasa de discontinuación permanente por toxicidad del fármaco a tener en cuenta (9,7%); también notable es la proporción de pacientes que requiere reducciones de dosis (52%).
En resumen, el retraso en la progresión del tumor que aporta dacomitinib se considera clínicamente relevante, especialmente por demostrarlo frente a gefitinib, un fármaco comúnmente empleado en la práctica clínica en primera línea de CPNM avanzado o metastásico con mutaciones de EGFR. A pesar de un peor perfil de seguridad, éste se considera manejable, y los aspectos de eficacia pueden convertirlo en una alternativa interesante para el tratamiento de pacientes no pre-tratados. Sin embargo, no implica novedad mecanística alguna ni es una opción curativa, y los más favorables resultados clínicos divulgados para otros inhibidores de tirosina cinasa de EGFR, especialmente osimertinib, sugieren que dacomitinib no sería la opción preferente en la mayoría de pacientes, por lo que no parece aportar una innovación clínica sustancial.
Aspectos fisiopatológicos
El término cáncer de pulmón (o carcinoma broncogénico) hace referencia a aquél provocado por células malignas derivadas de las vías respiratorias o del parénquima pulmonar. Estos tumores se dividen en distintos tipos en función del tamaño y la apariencia histopatológica de las células malignas. En global, el cáncer de pulmón es actualmente el tumor más incidente –supone el 13% de todos los nuevos casos de cáncer– y letal en el mundo –responsable del 19% de todas las muertes por cáncer–; provoca más muertes que los cánceres de mama, colon y próstata juntos. Según cifras de GLOBOCAN, en 2018 se confirmaron casi 2,1 millones de casos (el 11,6% del total de cánceres) y casi 1,8 millones de muertes a nivel mundial; fue el cuarto tipo tumoral más prevalente tras el de mama, próstata y colon, con una prevalencia a 5 años de 2,1 millones de pacientes de todas las edades (OMS, 2018).
En España, su incidencia (~77 nuevos casos por cada 100.000 habitantes) es mayor que en el conjunto de la Unión Europea (~66 casos por 100.000 habitantes, unos 470.000 casos anuales), donde su incidencia ha experimentado un descenso de casi el 11% desde 2012; en mujeres, en cambio, la mortalidad ha aumentado un 5%. Para el año 2020, la Sociedad Española de Oncología Médica (SEOM) estima que se diagnosticarán 29.638 nuevos casos de cáncer de pulmón en nuestro país, que afectarán mayoritariamente a hombres (con casi 22.000 nuevos casos); el cáncer de pulmón se situará, así, como el cuarto tipo de cáncer más incidente, solo por detrás del cáncer colorrectal, el de próstata y el de mama.
Además, hay que subrayar que la supervivencia del cáncer de pulmón es muy baja y su letalidad es muy elevada: la supervivencia global a los 5 años es del 16%, tanto en Europa como en Estados Unidos (Cerezo et al., 2017). Por ello, en España su prevalencia en ambos sexos a 5 años era de solo el 3,4% del total de tumores en 2018, cuando vivían en nuestro país 28.833 personas con cáncer de pulmón. Ese año se produjeron 22.133 defunciones confirmadas por cáncer de pulmón (casi 17.200 en hombres), situándose como la principal causa de muerte por cáncer en nuestro país, por encima del colorrectal (11.265), páncreas (7.132), mama (6.621) y próstata (5.841).
En líneas generales, la causa predominante del cáncer de pulmón es la exposición al humo del tabaco (90%), en la mayor parte de los casos por tabaquismo activo, aunque también puede contribuir el tabaquismo pasivo. Adicionalmente, se han identificado otros factores que pueden actuar sinérgicamente con el humo del cigarrillo y modificar la prevalencia del cáncer de pulmón, como son los siguientes:
- la dieta: las frutas y verduras con elevado contenido en antioxidantes son factores protectores para el desarrollo de cáncer de pulmón;
- la actividad física: los individuos con mayor actividad tienen un riesgo más bajo de desarrollo de cáncer de pulmón que quienes son sedentarios;
- la exposición ocupacional, ya sea ambiental en el ámbito doméstico o industrial, como es el caso del radón, asbesto, humo de chimeneas y cocinas;
- la radiación: por ejemplo, la exposición continua a las radiaciones ionizantes;
- la polución ambiental, sobre todo en las zonas urbanas con un mayor grado de contaminación ambiental;
- factores relacionados con el huésped, como la susceptibilidad genética, pues no todos los individuos fumadores y/o expuestos a agentes carcinógenos desarrollan este tipo de neoplasia, existiendo cierto grado de agregación familiar para el desarrollo de cáncer de pulmón;
- o la existencia de una neumopatía adquirida como la enfermedad pulmonar obstructiva crónica (EPOC) y los procesos fibróticos; conviene tener en cuenta que la EPOC es un factor de riesgo independiente para el desarrollo de cáncer de pulmón, siendo el fenotipo enfisematoso el que se asocia con una incidencia más alta de cáncer de pulmón.
Aunque existen otros tipos de cáncer de pulmón (sarcomas, carcinoides, etc.), la inmensa mayoría de los casos de cáncer de pulmón corresponden a carcinomas, es decir, tumores malignos que nacen de células epiteliales. Tradicionalmente, la gran mayoría de carcinomas de pulmón se divide en dos tipos principales, en función de la estirpe celular de donde provengan. Si se originan en las células del sistema neuroendocrino se llama carcinoma indiferenciado o cáncer de pulmón de células pequeñas o también llamado microcítico (CPM), que es minoritario y suele representar <20% de todos los casos de cáncer de pulmón. Si el origen es el epitelio bronquial, bronquiolar o traqueal, conduce al cáncer de pulmón de células no pequeñas o no microcítico (CPNM), que supone más del 80-85% de los casos. En raras ocasiones los cánceres de pulmón tienen características de los dos tipos celulares; estos cánceres se conocen como cánceres mixtos de células pequeñas/grandes.
Tal distinción responde no solo a criterios histológicos sino a un comportamiento clínico sustancialmente diferente entre ambas entidades. El CPM es el tumor pulmonar de crecimiento más rápido y de aparición de metástasis más precoces. Por su parte, dentro del CPNM se pueden definir 3 grandes variantes que acumulan ese alto número de cánceres pulmonares (>80%):
- Carcinoma epidermoide o de células escamosas: es el más frecuente (alrededor del 25-35% de todos los cánceres de pulmón) y se localiza preferentemente en los bronquios principales, segmentarios o subsegmentarios, comenzando cerca de un bronquio central. Es el más claramente relacionado con el consumo de tabaco. Comúnmente se ve necrosis y cavitación en el centro del tumor. Aquellos tumores de células escamosas bien diferenciadas a menudo crecen más lentamente que los otros tipos de cáncer.
- Adenocarcinoma o carcinoma no escamoso: representa también cerca del 35-40% de todos los carcinomas de pulmón y es característica la presencia de mucosustancias. Se suele originar en el tejido pulmonar periférico y, aunque la mayoría de los casos de adenocarcinomas de pulmón están asociados al hábito de fumar cigarrillos, también es la forma más frecuente de cáncer de pulmón entre aquellos que nunca han fumado o dejaron de fumar hace varias décadas. Uno de sus subtipos, el carcinoma bronquioloalveolar (3%), se ve con más frecuencia entre mujeres que nunca han fumado y generalmente muestra grandes diferencias interindividuales en las respuestas a los tratamientos.
- Carcinoma de células grandes: representa un 10-15% de todas las formas de cáncer de pulmón y son tumores que crecen con rapidez cerca de la superficie del pulmón. A menudo son células pobremente diferenciadas y tienden a metastatizar pronto.
- Carcinoma de células gigantes y estrelladas: supone menos del 1% de todas las formas de cáncer de pulmón.
El diagnóstico del cáncer de pulmón incluye un estudio morfológico, histológico y molecular; el desarrollo actual de las técnicas genéticas permite identificar mutaciones oncogénicas de gran relevancia. La mayoría de los pacientes con cáncer de pulmón –con independencia del tipo– presenta síntomas en el momento del diagnóstico, debido a que el tumor se encuentra por lo general en un estadio avanzado de la enfermedad. Solo un 5-10% de ellos está asintomático en el momento del diagnóstico, efectuándose éste de forma casual al realizarse una radiografía de tórax por otro motivo o por un chequeo rutinario.
Los factores pronósticos más importante en el CPNM son el estadio de extensión y el tipo histológico: la afectación linfática y la escasa diferenciación de las células tumorales determinan un peor pronóstico. La supervivencia disminuye progresiva y significativamente con la evolución del tumor, desde una mediana de supervivencia de 59 meses (unos 5 años) para los pacientes diagnosticados en estadio IA (tasa de supervivencia a los 5 años del 49%) hasta solo 4 meses en los pacientes en estadio IV (tasa de supervivencia a los 5 años del 1%). Globalmente, en torno al 15-20% de los pacientes con CPNM siguen vivos a los 5 años del diagnóstico. Además, el mal estado general y la pérdida de peso se han asociado a una supervivencia más corta, y algunos estudios sugieren que los individuos afroamericanos tienen un peor pronóstico.
En los últimos años han adquirido también significado pronóstico otros factores, fundamentalmente biológicos, llegando a constituir una medida indirecta de la agresividad de la neoplasia. Actualmente se conocen varias alteraciones moleculares con implicación clínica y pronóstica, puesto que se dispone de fármacos específicos para realizar un tratamiento individualizado. Por ejemplo, se han descrito marcadores de respuesta al tratamiento específico frente a una diana con inhibidores de tirosina cinasas (TKI, tirosine kinases inhibitors).
Entre ellos, el más importante y frecuente es la mutación activadora del gen que codifica para el receptor del factor de crecimiento epidérmico (EGFR), presente en el 10-20% de los casos de CPNM en pacientes de raza blanca (en asiáticos, esa prevalencia asciende hasta el 30-50%), seguido por las translocaciones y reordenamientos del gen que codifica la cinasa del linfoma anaplásico (ALK), identificados en el 2-7% de pacientes. Los pacientes con mutación del gen EGFR, más común en aquellos tumores de histología no escamosa, presentan un pronóstico significativamente mejor que los que no la tienen. De hecho, las deleciones en el exón 19 y las mutaciones puntuales en el exón 20 han demostrado valor predictivo de respuesta (elevados niveles de apoptosis ante el tratamiento con TKI), aunque la mutación T790M1 en el exón 20 –y, en menor medida, las mutaciones L861Q y G719X– es importante porque está asociada a resistencia a los TKI (hasta el 65% de los casos resistentes presentan dicha mutación).
Otros genes mutados con menor frecuencia en el CPNM son los siguientes: KRAS, ROS1, BRAF, HER2 o MEK1; las mutaciones del gen del KRAS (sarcoma viral de rata Kristen) se asocian a una menor supervivencia. Además, la expresión de PD-L1 (el ligando de la proteína de muerte celular programada) en el tumor también se asocia con una reducida supervivencia y un peor pronóstico, de manera que la inhibición del eje PD-L1/PD-1 ha demostrado actividad antitumoral en varios estudios preclínicos. La probabilidad de encontrar mutaciones es mayor en los pacientes con adenocarcinoma (el 60% tiene una mutación oncogénica), en los no fumadores (excepto las del gen KRAS, que se asocian fuertemente con historia de tabaquismo), en las mujeres y en los individuos de raza asiática, aunque no son exclusivas. Por ello, se recomienda su detección en todos los pacientes con CPNM en estadio IV de estirpe no escamosa y en los casos seleccionados de histología escamosa en sujetos no fumadores o exfumadores de menos de 15 paquetes-año.
Entre las manifestaciones clínicas iniciales debidas al crecimiento tumoral, la tos –que puede ser seca, aumentar en frecuencia respecto a la situación basal o presentar un cambio en sus características– es el síntoma inicial más frecuente (30-55%); no obstante, hasta en cerca de un tercio de los casos la hemoptisis (expectoración de sangre) es el único síntoma de presentación (15-30%), siendo su presencia rara en los pacientes con metástasis pulmonares de neoplasias extratorácicas. La dificultad respiratoria –disnea– aparece en el 10-30% de los casos y puede deberse a la compresión extrínseca o a la obstrucción tumoral de un bronquio principal o de la tráquea.
Entre las manifestaciones debidas a la diseminación intra-torácica del cáncer de pulmón (cáncer localmente avanzado) destaca el dolor torácico por invasión de las estructuras de la pared torácica (presente al diagnóstico en alrededor del 20% de los pacientes con cáncer de pulmón, si bien > 50% de pacientes lo refiere en algún momento de la evolución), y el derrame pleural (8-15% de los casos), generalmente por la extensión pleural directa del tumor, aunque también puede ser secundario a la obstrucción del drenaje linfático por afectación ganglionar mediastínica.
Adicionalmente, se han descrito –con menor frecuencia– los siguientes signos clínicos: a) ronquera, indicativa de la invasión del nervio laríngeo izquierdo recurrente, que discurre por la parte inferior del arco aórtico; b) parálisis del nervio frénico, que recorre el pericardio y provoca la elevación del hemidiafragma, sobre todo en el lado izquierdo; c) disfagia, por compresión del esófago; d) estridor, debido a un estrechamiento de la tráquea, ya sea por invasión tumoral directa o por parálisis de ambas cuerdas vocales; e) derrame pericárdico (5-10%); f) síndrome de vena cava superior, que se produce por compresión de la misma por adenopatías paratraqueales derechas o invasión directa por el propio tumor; g) síndrome de Pancoast, que provoca dolor en el hombro y en la pared torácica superior, como consecuencia de un tumor localizado en el ápex pulmonar que invade estructuras adyacentes; y h) síndrome de Horner (que se caracteriza por la tríada de ptosis, miosis y anhidrosis) por afectación del ganglio superior cervical.
Los síntomas procedentes de las metástasis a distancia son menos frecuentes como forma de presentación del cáncer de pulmón (30%). Las localizaciones más comunes de las metástasis –más frecuentes en el tipo microcítico– son el cerebro, los huesos, el hígado y las glándulas suprarrenales. De hecho, el cáncer de pulmón es la primera causa de metástasis en el sistema nervioso central (SNC), que afectan al 10% de los pacientes en el momento del diagnóstico y hasta el 50% de ellos las desarrolla en el transcurso de la enfermedad. Las metástasis óseas ocurren en el 25% de los pacientes con cáncer de pulmón (especialmente la columna vertebral, la pelvis, las costillas y los fémures), mientras que la afectación hepática (10-25%) suele ser silente hasta fases muy avanzadas de la enfermedad. Las metástasis suprarrenales también son frecuentes (25-45%) aunque también suelen ser clínicamente silentes (Cerezo et al., 2017).
Tratamiento
Grosso modo, el tratamiento indicado en los estadios precoces (estadios I y II) del CPNM es la resección quirúrgica, sin haberse demostrado ningún beneficio significativo con el tratamiento quimioterápico adyuvante. Sin embargo, en el momento del diagnóstico, la mayoría de pacientes (> 65%) se encuentran en un estadio avanzado2 (IIIB y IV) y no pueden someterse a cirugía, único tratamiento potencialmente curativo. En esos casos el pronóstico continúa siendo deficiente (las tasas de supervivencia a largo plazo son bajas y casi ningún paciente llega a curarse) y la citología y el perfil molecular del tumor son importantes para decidir el tratamiento –quimio y radioterapéutico– de elección. Los tumores en estadios IIIA, caracterizados por presentar afectación ganglionar mediastínica limitada, son en ciertos casos susceptibles de cirugía tras la administración de un tratamiento previo adyuvante de quimioterapia (y radioterapia), con lo que se ha mejorado la supervivencia de la resección aislada.
Por tanto, el CPNM localmente avanzado en estadio III (que representa al menos un 20-30% de todos los nuevos diagnósticos) consiste en una población heterogénea con dos subconjuntos: estadios IIIA y IIIB. En torno a un tercio de los pacientes con enfermedad en estadio IIIA se consideran operables, pero la mayoría de los pacientes con estadio IIIA/B tienen una enfermedad inoperable quirúrgicamente (no resecable), aunque sí son susceptibles de recibir un tratamiento de quimiorradiación de intención curativa.
Los objetivos del abordaje terapéutico del CPNM avanzado son: el incremento de la supervivencia global (SG), el incremento de la supervivencia libre de progresión (SLP) tumoral, el manejo de síntomas y la mejora de la calidad de vida. En la elección del tratamiento individualizado se deben tener en cuenta factores como la histología y el tamaño del tumor primario, las características moleculares (posible presencia de marcadores tumorales para terapias dirigidas), la edad, el estado funcional, el peso, las comorbilidades y las preferencias del paciente. Además, es frecuente que el paciente se vea afectado emocionalmente (miedo, ira, dolor, ansiedad, depresión, soledad, etc.) y requiera atención psicológica.
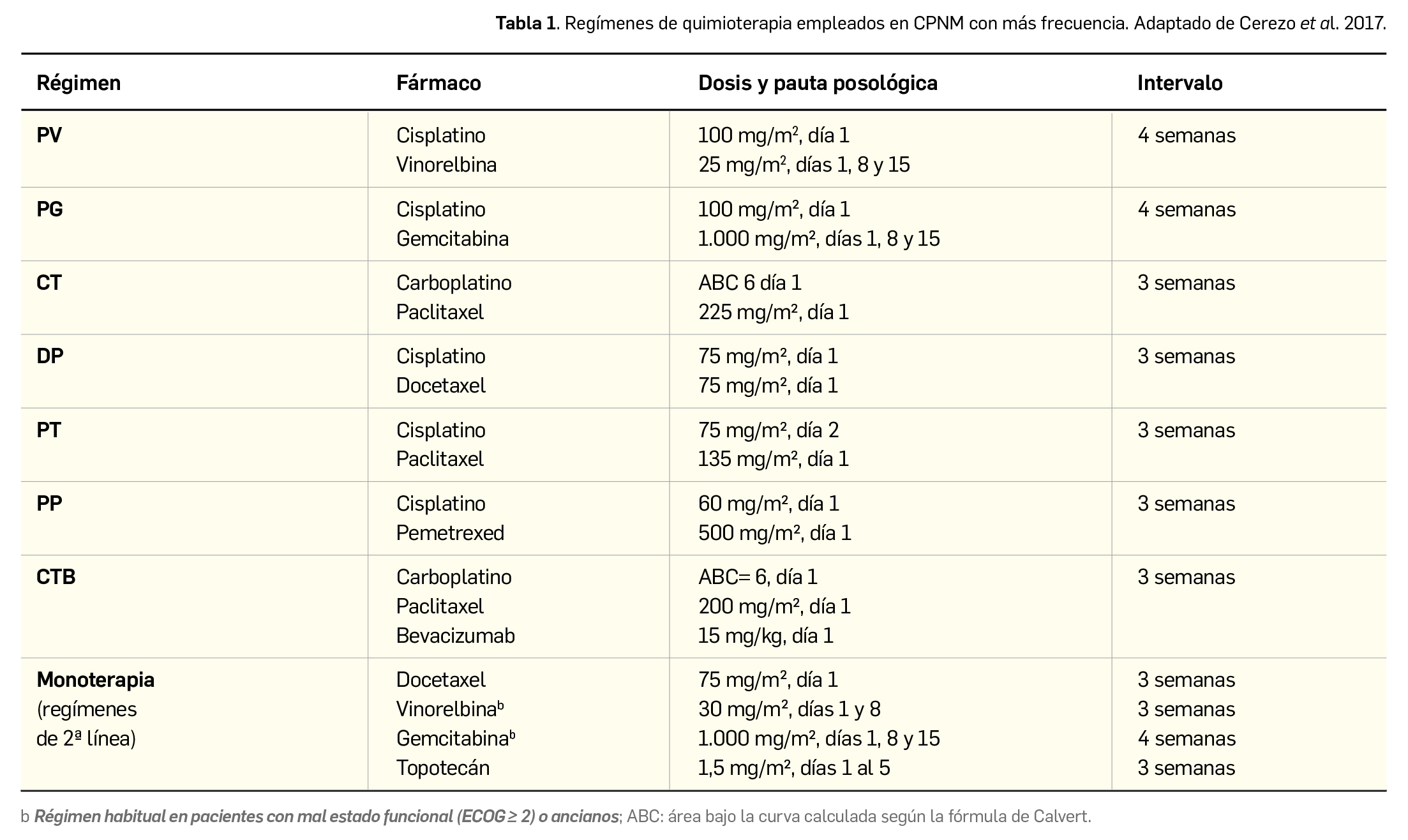
El tratamiento estándar de primera línea para el CPNM localmente avanzado y no operable es la quimiorradiación concurrente con intención curativa. La opción inicial general suele consistir en un esquema de quimioterapia basada en 2-4 ciclos de doblete a base de complejos con platino3 (fundamentalmente cisplatino, carboplatino y oxaliplatino) (Tabla 1) y radioterapia con 60 Gy de dosis total de radiación administrada en fracciones de 1,8-2 Gy/diario distribuida en 30-33 sesiones; tal régimen se ha mantenido sin cambios durante las últimas 2 décadas. Cuando la quimiorradiación concurrente no es posible, la quimioterapia secuencial seguida de radioterapia definitiva puede ser una alternativa válida. Se ha demostrado clínicamente que otras opciones, como la quimioterapia neoadyuvante de inducción adicional o de consolidación posterior a la quimiorradiación, no mejoran los resultados de SG.
Estas estrategias pueden lograr el control inicial de la enfermedad y, posteriormente, debe hacerse un seguimiento activo para controlar la progresión tumoral. No obstante, una gran mayoría (> 50%) de los pacientes progresan y desarrollan metástasis a distancia, con frecuencia cerebrales, y hasta el 40% puede experimentar una recurrencia local. La mediana de SLP en pacientes que han recibido quimiorradioterapia es de aproximadamente 8 meses y la tasa de supervivencia a 5 años está en torno al 15%. En caso de progresión, la 2ª línea estándar de quimioterapia del CPNM avanzado puede consistir en monoterapia con taxanos como el paclitaxel y el docetaxel, o con pemetrexed (que aporta TRO < 10% y medianas de 3 meses para la SLP y de 8 meses para la SG). Otros fármacos antineoplásicos utilizados en 2ª línea son la gemcitabina y la vinorelbina. En general, la asociación de 2, 3 o 4 fármacos quimioterápicos ha demostrado tener una eficacia superior a la monoterapia. En las pautas con 3 fármacos se recomienda que, además de contener platino, se incluya paclitaxel.
No obstante, en aquellos pacientes en que se identifican –por técnicas genéticas– mutaciones activadoras de EGFR o ALK, la terapia de primera línea recomendada por las principales guías de práctica clínica (Majem et al., 2019) son los inhibidores específicos para cada tipo de tirosina cinasa.
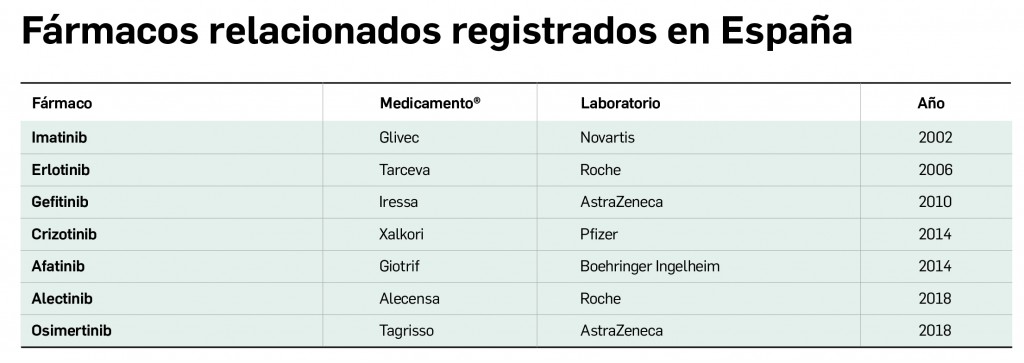
Hasta ahora hay varios inhibidores de tirosina cinasas (TKI) autorizados en España para tratar el CPNM, concretamente cuatro inhibidores de EGFR (EGFR-TKI: afatinib, erlotinib, gefitinib y osimertinib) y otros tres dirigidos específicamente a formas mutantes de ALK (alectinib, ceritinib y crizotinib). También tienen indicación en CPNM la combinación de trametinib/dabrafenib (inhibidores de MEK y BRAF, respectivamente) y el nindetanib (inhibidor de múltiples tirosina cinasas).
En particular, los EGFR-TKI han demostrado un beneficio clínico superior a los regímenes basados en platino en la subpoblación de pacientes con mutaciones activadorasa de EFGR. La eficacia de los mismos en términos de tasa de respuesta objetiva (TRO), SLP y SG ha ido mejorando, en comparación con los EGFR-TKI de primera generación (gefitinib y erlotinib), con la progresiva aparición de fármacos inhibidores irreversibles de segunda generación (afatinib), que previenen la homodimerización y heterodimerización de los receptores de la familia HER y bloquean las cascadas de señalización que involucran a las cinasas RAS, RAF, MEK y MAPK, bloqueando así la proliferación celular, la invasión y metástasis del tumor. Un nuevo avance fue la más reciente comercialización de osimertinib (EGFR-TKI de tercera generación), dirigido específicamente a la mutación de resistencia más común en el exón 20 (T790M).
En pacientes sin selección de mutaciones oncogénicas se han descrito TRO bastante discretas para estos fármacos (TRO < 10% y medianas de poco más de 2 meses para SLP y de 7 meses para la SG). Pero cuando se emplean como 1ª línea en pacientes con mutación sensibilizadora en el dominio de la tirosina cinasa del EGFR y con la ausencia de mutaciones K-RAS, se han conseguido TRO de > 50% y una mediana de SLP de 9-13 meses. Así pues, la determinación de la mutación oncogénica es determinante para optimizar la respuesta terapéutica a los EGFR-TKI en pacientes con CPNM. En comparación con la quimioterapia estándar, afatinib, por ejemplo, es capaz de retrasar globalmente la progresión tumoral en estos pacientes en una mediana de 5,5 meses adicionales; los pacientes con genotipo tumoral Del-19 (deleciones en el exón 19) responden mejor que aquellos con mutación L858R –sustitución de leucina por arginina en posición 858– en el exón 21 (diferencia de 8 meses y 3,3 meses, respectivamente), aunque en el caso de otras mutaciones las diferencias son menos consistentes.
En pacientes con mutación T790M, osimertinib permite alcantar TRO del 77% (vs. 39% para platino y prametexed) y una mediana de SLP de 8,2 meses (vs. 4,2 meses para platino y prametexed), habiendo demostrado superioridad sobre los TKI de primera generación en esa subpoblación. Posteriormente, osimertinib también ha mostrado superioridad a gefitinib y erlotinib en pacientes con deleciones en el exón 19 o con la mutación L858 del exón 21, aportando una mejora de la mediana de la SLP de 8,7 meses (18,9 meses vs. 10,2 meses con los TKI de 1ª generación; HR= 0,80; p < 0,0001) y de 6,8 meses en la SG (38,6 vs. 31,8; HR= 0,46; p < 0,05) (EMA, 2019).
En todo caso, a pesar de estos avances terapéuticos, los pacientes con CPNM y mutaciones activadoras de EGFR suelen progresar en un periodo medio de 8-19 meses tras una primera línea con los EGFR-TKI específicos, bien sean de 1ª, 2ª o 3ª generación. Por tanto, sigue existiendo una laguna terapéutica y una necesidad de nuevos fármacos que mejoren los resultados clínicos.
Acción y mecanismo
Dacomitinib es un inhibidor universal del receptor del factor de crecimiento epidérmico humano (EGFR/HER1, HER2 y HER4), con actividad contra el EGFR mutado con deleciones en el exón 19 o la sustitución L858R en el exón 21. En base a ello, el medicamento ha sido autorizado, en monoterapia, para el tratamiento de primera línea de pacientes adultos con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras del EGFR.
El EGFR, también llamado HER-1 o erbB1 k, forma parte de una familia bioquímica de receptores de membrana denominada erbB4, que está formada por 4 receptores –EGFR o HER-1 (erbB1), HER-2 (erbB2/neu), HER-3 (erbB3) y HER-4 (erbB4)– que en condiciones normales se encuentran en la membrana de la célula en diversos tejidos. Sus ligandos específicos son el propio factor de crecimiento epidérmico (EGF) –proteína enzimática que actúa como reguladora de diversas funciones celulares especialmente implicadas en el crecimiento neoplásico (proliferación, supervivencia, reparación, adhesión, migración, etc.)– y otros péptidos relacionados con éste, entre los que cabe incluir el factor de crecimiento transformante alfa (TGFα) y la anfiregulina. Tanto el EGF como el TGFα son capaces de desencadenar, tras su acción sobre el EGFR, una serie de eventos bioquímicos necesarios para continuar con el ciclo de división celular. Las anomalías de la vía de señalización de EGFR, desencadenadas por mutaciones activadoras del receptor o amplificación/sobreexpresión de sus ligandos, están involucradas en el proceso de carcinogénesis (que incluye la proliferación celular incontrolada, la migración celular, la invasión del estroma, la angiogénesis y la resistencia a la apoptosis, entre otros procesos) y dan lugar a diferentes subtipos moleculares de cáncer.
Dacomitinib se une de forma selectiva, irreversible (inhibición duradera) y competitiva con el ATP, a sus dianas de la familia HER y sus variantes oncogénicas, lo que produce una inhibición prolongada: se entiende, por tanto, que se inhiban los procesos de crecimiento celular tumoral. Los estudios bioquímicos demostraron que la inhibición por dacomitinib de los dominios catalíticos de las formas humanas de HER-1, HER-2 y HER-4 (HER-3 no se evaluó por la ausencia de actividad cinasa intrínseca) se asocia con valores de IC50 de 6,0 nM, 45,7 nM y 73,7 nM, respectivamente. Su afinidad para la inhibición de variantes de EGFR con deleciones en el exón 19 es potente, con cifras de Ki que oscilan de 0,4 a 3,8 nM, y muy superior a su afinidad por receptores EGFR con mutación T790M (Ki= 17 nM). Su selectividad hacia las cinasas de EGFR se demostró también muy elevada, siendo hasta 100 veces superior a la exhibida frente a la práctica totalidad de cinasas estudiadas. Se ha identificado un metabolito activo O-desmetilado de dacomitinib (PF-05199265), que es también un potente inhibidor in vitro de la familia de cinasas de EGFR, aunque se cree que su relevancia clínica es despreciable.
En otros estudios in vitro con líneas celulares de CPNM, dacomitinib exhibió una mayor potencia que gefitinib en la inhibición de su crecimiento –en términos de IC50–, demostrando también eficacia notable en la inhibición del crecimiento tumoral en modelos animales con xenoinjertos tumorales que sobreexpresan una desregulación genética de receptores HER. En los modelos in vivo, dacomitinib presentaba una inhibición dosis-dependiente de la fosforilación de los receptores de tirosina cinasa (EMA, 2019).
Aspectos moleculares
Dacomitinib está relacionado estructural y farmacológicamente con otros miembros de la serie de inhibidores de proteína cinasas en la que se encuadran un gran número de principios activos comercializados en España. Como otros miembros de la serie, es el resultado de la optimización funcional mediante modelización molecular a partir de una serie de 2-fenilaminopirimidinas, de donde surgió el imatinib, cabeza de serie del grupo. Aunque se aprecia una diversidad estructural importante en dicho grupo, todos ellos presentan heterociclos derivados azólicos y guardan –en mayor o menor grado– una familiaridad química con la molécula de ATP, con la cual algunos de los principios activos compiten para provocar el bloqueo de la cinasa correspondiente. Se han desarrollado modelos moleculares de relación estructura-actividad para este grupo de sustancias y, en todos los casos, las interacciones estéricas y electrostáticas han demostrado ser determinantes para el efecto inhibitorio sobre la tirosina cinasa.
Dacomitinib presenta una especial similitud estructural con otros EGFR-TKI usados en CPNM, tales como gefitinib y afatinib (Figura 1), con los que comparte un núcleo heteroclíclico nitrogenado de tipo quinazolínico, lo que sugiere que el mecanismo de bloqueo inhibitorio de las enzimas diana es similar, si bien las diferencias en el resto de la molécula pueden determinar la afinidad y especificidad por el sustrato, así como la irreversibilidad de la inhibición. Se considera, como afatinib, un EGFR-TKI de segunda generación.
El fármaco, presente en el medicamento como monohidrato, tiene como nombre químico el (2E)-N-{4-[(3-cloro-4-fluorofenil)amino]-7-metoxiquinazolin-6-il}-4-(piperidin-1-il)but-2-enamida, que se corresponde con la fórmula molecular C24H25ClFN5O2 y un peso molecular de 487,95 Daltons. Se trata de un fármco no higroscópico que se presenta como un polvo de color amarillo pálido; es insoluble en agua, ligeramente soluble en acetona y acetonitrilo, y escasamente soluble en ácido acético. La molécula no exhibe quiralidad, presentándose el doble enlace en disposición trans. En cambio, sí muestra polimorfismo, con tres formas principales (A, B y C), de las cuales la forma A es el polimorfo predominante en estado sólido.
Eficacia y seguridad clínicas
La eficacia y seguridad de dacomitinib por vía oral han sido adecuadamente contrastadas en la indicación y dosis autorizadas fundamentalmente por los datos clínicos derivados de un estudio confirmatorio aleatorizado (1:1) de fase 3 (estudio ARCHER 1050), multinacional y multicéntrico (52 centros en 6 países), con diseño abierto, controlado con comparador activo y de grupos paralelos. Dicho ensayo pivotal evaluó, frente a gefitinib, el tratamiento diario con el nuevo fármaco como terapia de primera línea de un total 452 pacientes adultos con CPNM localmente avanzado, no susceptible de cirugía o radioterapia curativa, o metastásico con mutaciones activadoras del EGFR. El tratamiento experimental se mantuvo hasta progresión de la enfermedad, toxicidad inaceptable, inicio de un nuevo tratamiento, retirada del consentimiento, muerte o decisión del investigador.
Los pacientes incluidos, en quienes se debía confirmar previamente el estado de la mutación de EGFR, presentaron unas características demográficas y de la enfermedad bien balanceadas entre los brazos del estudio. En conjunto, un 60% de pacientes eran mujeres, un 23% de raza blanca y un 77% de raza asiática, la edad media en el momento del reclutamiento era de 62 años (con un 11% de pacientes con ≥ 75 años), presentaban un buen estado funcional general (ECOG 0 en el 30% y ECOG 1 en el 70%), el 59% tenía una deleción del exón 19 y el 41% tenía una mutación L858R en el exón 21. Se excluyeron del estudio pacientes con otro tipo de mutaciones de EGFR, presencia o antecedentes de metástasis cerebrales, comorbilidades agudas o crónicas severas o con un estado ECOG ≥ 2.
La variable primaria de eficacia fue la supervivencia libre de progresión (SLP) tras revisión radiológica ciega por un comité central independiente, mientras que entre las variables secundarias principales se valoraron la tasa de respuesta objetiva (TRO), la duración de la respuesta (DR), la supervivencia global (SG) y el tiempo hasta el fallo del tratamiento (TFT). La Tabla 2 resume los principales resultados de eficacia divulgados del estudio pivotal, correspondientes al análisis por intención de tratar tras una mediana de seguimiento de los pacientes de 22,1 meses para la SLP (Wu et al., 2017) y de 31,3 meses para la SG (Mok et al., 2018).
Los análisis de subgrupos según la revisión por comité central independiente confirman la mejoría estadísticamente significativa en SLP del análisis primario, verificándose una eficacia consistente con independencia de la edad (hasta 75 años), el género, el estatus de hábito tabáquico, el tipo de mutación de EGFR o el estado funcional ECOG. La única diferencia se verificó en relación a la raza: los HR de la SLP según la revisión central independiente en pacientes asiáticos y no asiáticos fueron de 0,51 (IC95% 0,39-0,66) y 0,89 (IC95% 0,57-1,39), respectivamente; así, en pacientes asiáticos, la mediana de SLP fue de 16,5 meses en el grupo de dacomitinib y de 9,3 meses en el grupo de gefitinib, mientras que en pacientes no asiáticos la mediana de la SLP fue de 9,3 meses y 9,2 meses, respectivamente, sin beneficio significativo para dacomitinib en estos pacientes. No obstante, los posteriores datos de SG para pacientes no asiáticos muestran una mejora similar en términos numéricos al de la población general: mediana de 29,5 meses para dacomitinib y de 20,6 meses para gefitinib (HR= 0,72; p= 0,2073).
Adicionalmente, un ensayo de soporte de un solo brazo y de fase 2 (estudio A7471017), también multinacional y multicéntrico, respaldó la eficacia de dacomitinib (en dos dosis: 30 o 45 mg una vez al día) como 1ª línea en pacientes con CPNM localmente avanzado o metastásico no pretratados. La cohorte A de dicho estudio incluyó un total de 89 pacientes adultos con la máxima probabilidad de tener una mutación activadora de EGFR (la mitad de ellos con confirmación de deleción en el exón 19 o mutación L858R en el exón 21), en su mayoría mujeres (67%), de menos de 65 años (57%), de raza asiática (55%) y no fumadores (79%). Los criterios de exclusión eran similares a los del estudio pivotal, permitiéndose que los pacientes hubieran recibido previamente quimioterapia adyuvante en estadios más precoces del tumor, siempre que se hubiera finalizado al menos 1 año antes del inicio del estudio.
Los principales resultados (Jänne et al., 2014) apuntan a que, con una mediana de duración del tratamiento de 40 semanas, la mediana de la SLP en la población por intención de tratar fue de 11,5 meses, con una SLP a los 4 meses fue del 77% de los pacientes. En la subpoblación de pacientes con confirmación de mutaciones activadoras de EGFR (N= 45), la mediana de SLP alcanzó los 18,2 meses, y la mediana de la SG fue de 42,3 meses (con una probabilidad de supervivencia al año de tratamiento del 95,6%); además, la TRO fue del 75,6%, siendo todas ellas respuestas parciales, y la DR presentó una mediana de 17,2 meses. Estos resultados son ligeramente más favorables que los del estudio pivotal y confirman la eficacia de dacomitinib.
Desde el punto de vista de la seguridad, dacomitinib presenta un perfil toxicológico importante, pero clínicamente manejable por lo general. Ha sido adecuadamente definido en base a los datos agrupados de unos 1.600 pacientes que recibieron la dosis autorizada durante su desarrollo clínico (con independencia de la presencia de mutaciones activadoras de EGFR y de la línea de tratamiento), incluyendo los pacientes del estudio pivotal. Con una mediana de exposición de 66,7 semanas, la práctica totalidad de pacientes tratados con dacomitinib reportó algún evento adverso durante el tratamiento, graves en hasta 53%. Por su frecuencia y relación con el tratamiento, destacaron las siguientes: diarrea (87% vs. 56% con gefitinib), trastornos de las uñas –paroniquia– (62% vs. 20%), erupción/dermatitis (49% vs. 29%), estomatitis (44% vs. 18%), reducción del apetito (31% vs. 25%), sequedad de piel (28% vs. 17%), bajo peso (26% vs. 17%), alopecia (23% vs. 13%), prurito (22%), elevación de transaminasas hepáticas (22%) y náuseas (20%); todas ellas, salvo la alteración en los niveles de transaminasas y las náuseas, tuvieron una mayor incidencia que en los pacientes tratados con gefitinib.
Los eventos adversos graves relacionados con el tratamiento se notificaron en un 7% de los pacientes que recibieron dacomitinib, sobresaliendo entre ellos la diarrea (2%), la enfermedad pulmonar intersticial (1,2%), la erupción (1,2%) y la reducción del apetito (1,2%). Aunque la tasa de discontinuación permanente como consecuencia de las mismas no fue excesivamente alta (9,7% vs. 6,7% con gefitinib), hasta un 52% de pacientes tuvo que reducir la dosis del fármaco, destacando entre sus causas la erupción (32%), los trastornos de las uñas (16%) y la diarrea (8%). En el estudio pivotal, solo 2 muertes se relacionaron con la seguridad del tratamiento con dacomitinib (una por diarrea y otra por afectación hepática) y 1 con gefitinib (por diverticulitis del colon complicada por neumonía).
Aspectos innovadores
Dacomitinib es un nuevo antineoplásico que actúa como inhibidor universal, selectivo, irreversible y competitivo con el ATP, del dominio tirosina cinasa del receptor del factor de crecimiento epidérmico humano (EGFR/HER1, pero también de HER2 y HER4), con actividad contra el EGFR mutado con deleciones en el exón 19 o la sustitución L858R en el exón 21. En base a ello, atenúa los procesos de crecimiento celular neoplásico (incluyendo, entre otros, la proliferación celular incontrolada, la migración celular, la invasión del estroma, la angiogénesis y la resistencia a la apoptosis), por lo que el medicamento ha sido autorizado, en monoterapia, para el tratamiento por vía oral de primera línea de pacientes adultos con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras del EGFR.
Los datos clínicos conducentes a su aprobación por la EMA provienen fundamentalmente de un ensayo pivotal de fase 3 (ARCHER 1050), multicéntrico y multinacional, controlado por gefitinib. Sobre pacientes naïve (N= 452) con CPNM localmente avanzado (estadio IIIB) o metastásico (estadio IV), no operable y con mutaciones activadoras del gen EGFR, dacomitinib demostró una mejora estadística y clínicamente significativa en la supervivencia libre de progresión tumoral (variable primaria) según un comité de evaluación independiente, aumentando en una mediana de 5,5 meses los registros obtenidos con gefitinib (14,7 vs. 9,2 meses; p < 0,0001), uno de los EGFR-TKI usados como tratamiento estándar en 1ª línea. Aunque la tasa de respuesta objetiva no difirió de forma destacada (74,9% vs. 71,6% con gefitinib), los resultados del resto de variables secundarias parecen apoyar consistentemente la eficacia de dacomitinib, con aumentos en la mediana de duración de la respuesta (14,8 vs. 8,3 meses) y en el tiempo hasta el fallo del tratamiento (11,1 vs. 9,2 meses). La confirmación de su superioridad clínica parecía deberse a los resultados de supervivencia global (la variable de eficacia más robusta y relevante que hay en oncología): con un periodo de seguimiento de más de 2 años y medio, la mediana de SG se prolongó en 7,3 meses en comparación con el tratamiento con gefitinib (34,1 vs. 26,8 meses; p < 0,05). No obstante, de acuerdo con el criterio jerárquico, el análisis se detuvo con la evaluación de la TRO, por lo que los resultados de SG se consideran exploratorios y no se pudo evaluar formalmente su significación estadística.
Cabe destacar que la eficacia en términos de SLP fue consistente en todos los subgrupos de pacientes, con independencia de factores como el género, el hábito tabáquico, el tipo de mutación de EGFR o el estado funcional, a excepción de la edad de > 75 años y de la raza no asiática; sin embargo, el EPAR de la EMA sugiere que ese hallazgo de eficacia diferencial en base a la raza puede deberse al azar, sin existir datos de farmacocinética o farmacodinamia que lo justifiquen. En todo caso, un estudio de soporte de un solo brazo contribuyó a confirmar el beneficio con dacomitinib en 1ª línea del CPNM, reportando medianas de SLP de 18,2 meses y de SG de 42,3 meses en pacientes con mutación activadora de EGFR.
Entre las principales limitaciones de la evidencia disponible hay que subrayar que el ensayo pivotal no incluyó pacientes con metástasis del sistema nervioso central, debiendo tenerse presente que hasta el 10% de los pacientes con cáncer de pulmón tiene metástasis cerebrales en el momento del diagnóstico y hasta el 50% de ellos las desarrolla en el transcurso de la enfermedad. Además, tampoco se presentan datos de pacientes tratados con dacomitinib tras una progresión posquimioterapia, que suele ocurrir en hasta un 60% de los pacientes; muchos de ellos presentan la mutación T790M en el exón 20 del gen EGFR, no habiéndose estudiado esta subpoblación –ni con otro tipo de mutaciones diferentes a las que afectan al exón 19 o 21– en los ensayos con dacominitib.
Por otro lado, el perfil toxicológico del nuevo fármaco ha sido adecuadamente caracterizado y, aunque importante y desfavorable en comparación con gefitinib, es clínicamente manejable y está en línea con lo esperado a la vista de la seguridad de afatinib, el otro EGFR-TKI de 2ª generación disponible (EMA, 2019). Casi todos los pacientes sufrieron algún evento adverso durante el tratamiento (de grado 3-4 en más de la mitad), destacando por su frecuencia las reacciones adversas del tracto gastrointestinal (diarrea y estomatitis), de la piel (dermatitis, sequedad de piel, rash o prurito), de las uñas (paroniquia) y una reducción del apetito. La tasa de eventos adversos graves relacionados con dacomitinib alcanzó el 7% (sobre todo, diarrea, enfermedad pulmonar intersticial, dermatitis cutánea y reducción del apetito), lo cual se asocia con una tasa de discontinuación permanente por toxicidad del fármaco a tener en cuenta (9,7% vs. 6,7% con gefitinib), siendo también notable la proporción de pacientes que requiere reducciones de dosis (52%); no obstante, solo dos muertes se relacionaron con el tratamiento.
Conviene recordar que, de los cerca de 2 millones de casos de CPNM que se diagnostican anualmente en todo el mundo, las mutaciones activadoras de EGFR acontecen en aproximadamente el 10-20% de los pacientes con CPNM de raza blanca y en el 30-50% de los de raza asiática, siendo más frecuentes en tumores de histología no escamosa, en mujeres y en no fumadores. Los pacientes con mutación activadora de EGFR presentan un pronóstico significativamente mejor que los que no la tienen, por la posibilidad de ser tratados en primera línea con inhibidores de tirosina cinasa específicos de EGFR (EGFR-TKI: gefitinib, erlotinib, afatinib y osimertinib), que aportan un mayor beneficio clínico que la quimioterapia basada en platino, con tasas de respuesta del 56-80% y una SLP de 8 a 19 meses.
Los resultados comentados para dacomitinib son los primeros que demuestran una mejora en supervivencia global para un EGFR-TKI de 2ª generación en primera línea del CPNM con mutaciones activadoras de EGFR, de especial relevancia al compararse con uno de los fármacos clásicamente considerados como tratamiento estándar (el EGFR-TKI de 1ª generación gefitinib). En ausencia de comparaciones directas con el resto de EGFR-TKI usados en primera línea (erlotinib, afatinib y osimertinib), y a la espera de conocer las consideraciones del IPT de la AEMPS, para el posicionamiento de dacomitinib en su indicación se puede aludir a distintos meta-análisis que han realizado comparaciones indirectas (de robustez limitada) de los resultados de eficacia y seguridad de dichos fármacos.
Así, por ejemplo, se ha planteado que en la población de pacientes con mutaciones activadoras de EGFR, dacomitinib tiene una eficacia comparable a erlotinib en el retraso de la progresión tumoral (que puede ser superior en el subgrupo de pacientes con deleciones en el exón 19) y en SG (Ramalingam et al., 2016). Otro trabajo (Franek et al., 2019), en cambio, confirma que dacomitinib y osimertinib exhiben una mayor eficacia clínica en comparación con gefitinib, erlotinib y afatinib, y sugiere que deben ser considerados como opciones preferenciales en 1ª línea. Un meta-análisis en red (Zhao et al., 2019), que incluyó los datos clínicos del ensayo pivotal de dacomitinib, concluyó que osimertinib y la combinación de gefitinib con quimioterapia a base de pemetrexed se asocian con los mejores registros de SLP y SG en pacientes con deleciones en el exón 19 y la mutación L858R en el exón 21. En esa línea, el meta-análisis más amplio y reciente (Li et al., 2020), con datos de más de 4.000 pacientes tratados en ensayos clínicos con EGFR-TKI, también apunta a que la monoterapia con osimertinib es la mejor opción para la 1ª línea del tratamiento en términos de SLP, SG y de seguridad. Además, si consideramos que osimertinib también cubriría la población de pacientes que desarrollen la mutación T760M, parece claramente la opción preferente y con un mayor potencial.
En resumen, el retraso en la progresión del tumor que aporta dacomitinib se considera clínicamente relevante, especialmente por demostrarlo frente a gefitinib, comúnmente empleado en la práctica clínica en 1ª línea del CPNM avanzado o metastásico con mutaciones de EGFR. A pesar de un peor perfil de seguridad (sobre todo, aumento de la diarrea y toxicidades cutáneas), se considera manejable, y los aspectos de eficacia –en supervivencia global– pueden convertirlo en una alternativa interesante para el tratamiento de pacientes no pre-tratados. Sin embargo, no implica novedad mecanística alguna ni es una opción curativa, y los favorables resultados clínicos divulgados para otros inhibidores de tirosina cinasa de EGFR, especialmente osimertinib, sugieren que dacomitinib podría no ser la opción preferente en la mayoría de pacientes, por lo que no parece aportar una innovación clínica sustancial.
Valoración
Fármacos relacionados registrado en España
Informe anual de la AEMPS 2019
Hiperparatiroidismo
Resumen
El hiperparatiroidismo, entendido como un síndrome que se produce por una secreción excesiva de hormona paratiroidea, es una patología de baja prevalencia, pero que, debido a la mejora en los métodos diagnósticos y en los controles médicos rutinarios de los pacientes, está adquiriendo una importancia clínica creciente. De hecho, el hiperparatiroidismo primario suele identificarse en etapa asintomática en la mayoría de pacientes del mundo occidental. En líneas generales, las manifestaciones relacionadas con el aumento de los niveles y actividad de la hormona paratiroidea derivan de la afectación renal y la enfermedad ósea, que se combinan normalmente con diversos síntomas atribuibles a la típica hipercalcemia. En términos de su tratamiento, la paratiroidectomía quirúrgica es siempre una opción valiosa y apropiada, si bien la farmacoterapia con fármacos antiresortivos también es adecuada para determinados pacientes que no reúnen las recomendaciones para la cirugía.
El presente artículo revisa las principales características clínicas del hiperparatiroidismo, considerando su etiología y aportando una visión global para el diagnóstico diferencial.
Introducción
El hiperparatiroidismo es un síndrome que se produce por una secreción excesiva de hormona paratiroidea (PTH), producida en las glándulas paratiroides. Suele tener una prevalencia baja, si bien la mayor conciencia de la enfermedad, acompañada de los avances en bioquímica, fisiología y fisiopatología tanto en el estudio de la PTH como del metabolismo fosfocálcico, ha conducido a la observación de un aumento en la incidencia del hiperparatiroidismo en los últimos años, y a conseguir realizar un diagnóstico más precoz.
Clásicamente, dentro del hiperparatiroidismo han distinguido 3 formas clínicas: el hiperparatiroidismo primario (HPP 1º), el hiperparatiroidismo secundario (HPP 2º), y el hiperparatiroidismo terciario (HPP 3º).
En el hiperparatiroidismo primario, el problema radica en las propias glándulas paratiroides, de manera que se produce una secreción excesiva y autónoma de hormona paratiroidea a partir de las mismas. Su prevalencia se encuentra entre el 1 y el 3 por 1.000 de la población general, afectando principalmente a la población adulta. El 85% de los pacientes son mayores de 30 años, encontrándose por encima de 60 años su frecuencia más alta. Con respecto a la distribución por sexos, el HPP 1º es más frecuente en el sexo femenino que en el masculino, en una relación de 2:1. Así pues, podríamos decir que las mujeres posmenopáusicas constituyen el grupo de riesgo más elevado para presentar un HPP 1º, con una frecuencia de aparición 5 veces superior a la población general. En la edad pediátrica, a diferencia de los adultos, el HPP 1º afecta sobre todo a los varones, a excepción de los neonatos en los que no existen diferencias entre ambos sexos. La mayoría de los casos se producen en niños mayores de 10 años, sobre todo en edad peripuberal, y únicamente el 5% del total de los hiperparatiroidismos en la infancia se diagnostican entre los 3 meses y los 10 años. También hay que tener en cuenta, que cuando el HPP 1º se presenta en los niños, generalmente lo hace asociado a síndromes de neoplasia endocrina múltiple (MEN).
En el hiperparatiroidismo secundario, el mecanismo de producción está relacionado con la presencia de cambios adaptativos de las glándulas paratiroides ante hipocalcemias producidas por otras enfermedades. Así, en esta forma clínica, el origen del trastorno es ajeno a las propias glándulas. Su prevalencia dependerá de la enfermedad que esté provocando dicha alteración, siendo la principal responsable de este cuadro la hipocalcemia derivada de la insuficiencia renal crónica. En líneas generales, se estima que el 10-20% de los pacientes con insuficiencia renal crónica presenta HPP 2º, y el 5% en una forma severa.
Finalmente, el hiperparatiroidismo terciario se produce por la pérdida de autorregulación del HPP 2º, de manera que las glándulas paratiroides se hacen autónomas, lo que provoca hipercalcemias de muy difícil manejo.
Etiología
Hiperparatiroidismo primario
Dentro de las múltiples causas que lo pueden producir, el adenoma único de paratiroides constituye la causa más frecuente, representando el 80-85% de los casos. Le sigue en frecuencia la hiperplasia de paratiroides con un 12-16% de incidencia, de la que existen dos variantes histológicas: hiperplasia de células principales e hiperplasia de células claras. La tercera causa más frecuente de HPP 1º se debe a los adenomas múltiples o dobles adenomas (2-5%) o incluso por un carcinoma paratiroideo (0,5-2% de los casos).
A su vez, el HPP 1º puede presentarse asociado a otras patologías, formando parte del síndrome de neoplasia endocrina múltiple (MEN) tipo I o síndrome de Wermer, que se asocia a tumores de hipófisis y de las células de los islotes pancreáticos, o en el MEN tipo IIa o síndrome de Sipple, asociado a feocromocitoma y a carcinoma medular de tiroides. Ambos son heredados de forma autosómica dominante. En el tipo I la frecuencia de aparición del HPP es del 90%, y se manifiesta entre los 20 y los 40 años. En el tipo IIa, sin embargo, la incidencia de patología paratiroidea es menor del 40%, y suele ser un hallazgo durante la cirugía del carcinoma medular de tiroides. En ambos casos la etiología más frecuente es la hiperplasia de las glándulas paratiroides.
Hiperparatiroidismo secundario
A diferencia del HPP 1º, la causa más frecuente de hiperparatiroidismo secundario es la hiperplasia de todas las glándulas paratiroides. Según se ha indicado, la patología que con mayor frecuencia provoca la aparición de estos cambios es la hipocalcemia de la insuficiencia renal crónica. Otras causas que con menor frecuencia pueden producir hipocalcemia crónica con estimulación prolongada de PTH son: el déficit de vitamina D, la osteomalacia, el pseudohipoparatiroidismo, la ingestión de fosfatos inorgánicos y la hipomagnesemia severa.
Manifestaciones clínicas
Hiperparatiroidismo primario
La presentación clínica del HPP 1º ha cambiado notablemente en las últimas décadas. En el pasado, constituía una enfermedad que cursaba con grave afectación ósea y renal, sin embargo, hoy en día ambas complicaciones no parecen estar presentes en más del 10% de los pacientes diagnosticados de hiperparatiroidismo. Actualmente, la forma de presentación en el 80% de los casos es asintomática o como síntomas vagos de enfermedad, descubriéndose el hiperparatiroidismo en análisis sistemáticos del calcio sérico, sobre todo en ancianos. En aquellos casos de HPP 1º sintomático, las manifestaciones clínicas asociadas pueden ser múltiples, desconociéndose si los síntomas se deben a la elevación de la calcemia en sí o directamente a la acción de la PTH. En la mayoría de los casos es posible que estén implicados ambos factores.
En líneas generales, podríamos decir que las anormalidades directamente relacionadas con el aumento de la PTH son la afectación renal y la enfermedad ósea, mientras que los síntomas atribuibles a la hipercalcemia incluirían síntomas inespecíficos como la debilidad, fatiga, depresión, anorexia, náuseas, estreñimiento, etc., siendo éstos tanto más severos cuanto más rápida sea la instauración del cuadro.
Manifestaciones renales
Las principales manifestaciones renales del HPP 1º son la nefrolitiasis cálcica recurrente y la nefrocalcinosis, ambas secundarias a la precipitación de oxalato y fosfato cálcico en el epitelio tubular y en el intersticio renal. Se estima que los cálculos renales se presentan en solo el 10-20% de los pacientes con HPP 1º y en la mitad de los casos no dan síntomas. No obstante, se ha observado que en aproximadamente un tercio de los pacientes con enfermedad asintomática se pueden encontrar algunos grados de disfunción renal, tales como: a) incapacidad para la concentración de la orina (poliuria-polidipsia) debido al bloqueo de la acción de la ADH sobre los túbulos renales causado por el calcio; y b) acidosis hiperclorémica, por la incapacidad renal de excretar ácidos; y c) una reducción en el aclaramiento de creatinina, que puede desembocar en una insuficiencia renal crónica favorecida por los continuos episodios de sobreinfección. Por último, es importante señalar que alrededor del 3-5% de los pacientes con litiasis cálcica presentan hiperparatiroidismo, si bien suelen transcurrir más de 3 años –como término medio– antes de establecerse este diagnóstico.
Manifestaciones óseas
La forma clásica de afectación ósea en el HPP 1º es la osteítis fibrosa quística, que se manifiesta clínicamente como lesiones quísticas óseas, deformidades esqueléticas y dolores óseos, por lo que no es infrecuente que en un principio pueda ser diagnosticada erróneamente como “reumatismo”, gota o incluso “ciática”. Radiológicamente, la osteitis fibrosa quística se caracteriza por la presencia de desmineralización, erosión de la cortical ósea externa e interna, fracturas patológicas y lesiones quísticas. La desmineralización suele presentar un aspecto moteado característico en “sal y pimienta”, y se localiza típicamente a nivel del cráneo (Figura 1).
Con respecto a las lesiones quísticas óseas, éstas pueden ser de dos tipos: quistes óseos verdaderos y tumores pardos (Figura 2), pudiendo provocar los primeros grandes deformidades óseas típicamente a nivel mandibular. Ambos se comportan de forma idéntica desde el punto de vista radiológico, por lo que su diferenciación será eminentemente histológica. Por otro lado, es importante tener en cuenta, en relación a este tipo de lesiones, que mientras los tumores pardos se resuelven al corregir el HPP 1º, los quistes óseos verdaderos suelen permanecer de forma indefinida.
En la actualidad, el cuadro clásico descrito de osteitis fibrosa quística es poco frecuente, observándose en menos del 10% de los pacientes, y siendo evidente solo en las formas severas de HPP 1º. Hoy en día la manifestación ósea más frecuente es la osteopenia difusa, evidenciable radiológicamente como osteoporosis, pero clínicamente silente, aunque con un riesgo aumentado de sufrir fracturas patológicas. De hecho, se ha comprobado con técnicas densitométricas, que más del 30% de los pacientes diagnosticados de HPP 1º, tienen pérdida mineral incluso en las formas asintomáticas, por lo que la osteopenia puede considerarse como una manifestación subclínica de la enfermedad.
Manifestaciones debidas a la hipercalcemia
Con frecuencia los pacientes refieren manifestaciones inespecíficas y anodinas, secundarias a la afectación por la hipercalcemia de un gran número de sistemas.
- Trastornos neuromusculares. La astenia y la fatigabilidad son una de las manifestaciones clínicas más frecuentes del HPP 1º, presentándose en el 70-80% de los casos. Otra manifestación neuromuscular menos frecuente es la miopatía proximal de las extremidades inferiores, siendo característica a la exploración la presencia de hipotonía proximal simétrica, atrofia muscular, hiperreflexia y fasciculaciones.
- Trastornos psiquiátricos. Pueden abarcar un amplio espectro sintomático, desde confusión o irritabilidad emocional hasta depresión o fallos en la memoria, e incluso en ocasiones cuadros de psicosis, estupor y coma.
- Trastornos gastrointestinales. Las manifestaciones gastrointestinales del HPP 1º pueden ser sutiles, siendo los síntomas más frecuentes la anorexia, las náuseas y los vómitos; en los pacientes con hiperparatiroidismo de larga evolución puede haber también estreñimiento y, a veces, atonía gástrica. El 10-15% de los pacientes con HPP 1º presentan úlcera péptica, debido a que la hipercalcemia mantenida estimula la secreción de gastrina y ácido gástrico, siendo la prevalencia de la misma, en estos pacientes, mayor que en la población general (5-10%). A su vez, hasta el 25-38% de los pacientes presentan cálculos biliares radiopacos. Por último, el HPP 1º puede asociarse a pancreatitis, cuyo origen no está claro, pero podría deberse a una obstrucción de los conductos pancreáticos secundaria al depósito cálcico o bien a un incremento en la conversión de tripsinógeno a tripsina y al desarrollo de fenómenos inflamatorios, sin poder descartarse que la PTH tenga un efecto directo inflamatorio sobre el parénquima pancreático.
- Trastornos cardiovasculares. Se ha observado que en los pacientes diagnosticados de HPP 1º, la prevalencia de hipertensión arterial (HTA) es superior a la del resto de la población, apareciendo hasta en el 50% de los casos, si bien existe controversia acerca del mecanismo mediante el cual se establece esta relación causal. En cuanto a la asociación entre hiperparatiroidismo y enfermedad vascular, es posible que el hiperparatiroidismo predisponga a la formación de ateromas, así como a un aumento de mortalidad cardiovascular.
- Trastornos articulares. En el HPP 1º las lesiones articulares y periarticulares son relativamente frecuentes. Entre el 7-18% de los pacientes presentan condrocalcinosis o seudogota, siendo la rodilla la articulación más afectada. Además, se han descrito fracturas subcondrales paraarticulares, sinovitis atraumáticas y periartritis calcificante, así como calcificaciones ectópicas en tejidos blandos que favorecen las avulsiones de los tendones, sobre todo a nivel del cuádriceps.
- Otras manifestaciones. El HPP 1º puede cursar con la queratopatía en banda, que se caracteriza por la precipitación de cristales de calcio y fosfato en la córnea. Asimismo, se debe subrayar el elevado riesgo que presentan estos pacientes de desarrollar intolerancia a la glucosa (40-80% de los casos), o incluso una auténtica diabetes mellitus (7-16% de los casos) debida a un estado de hiperinsulinismo e insensibilidad periférica a la insulina, situación que ha sido atribuida tanto a la hipercalcemia como al aumento de los niveles de PTH, a través de la estimulación directa de las células ß pancreáticas.
Variantes clínicas especiales
- Hiperparatiroidismo primario neonatal. Es una forma rara de hiperparatiroidismo que cursa con hipercalcemia debida a una hiperplasia de las glándulas paratiroides. Los síntomas aparecen poco después del nacimiento, presentando el enfermo anorexia, irritabilidad, letargo, estreñimiento y fallo de medro. Los trastornos renales son inconstantes, pudiendo aparecer poliuria, polidipsia, deshidratación, litiasis renal y nefrocalcinosis. Las radiografías muestran resorción subperióstica de hueso, osteoporosis y fracturas patológicas. Todos estos síntomas pueden ser leves y desaparecer sin intervención terapéutica o, por el contrario, presentar una evolución rápidamente mortal si se retrasa el diagnóstico y el tratamiento.
- Hiperparatiroidismo primario en la infancia. El hiperparatiroidismo infantil es raro y resulta excepcional en menores de 10 años, si bien su incidencia no está claramente definida ya que no se suelen realizar análisis sistemáticos de calcemia en los niños. En la mayoría de los casos se debe a un adenoma único. A diferencia de los adultos, el HPP 1º infantil suele presentar una hipercalcemia intensa dominando las manifestaciones óseas y articulares; pero no son infrecuentes las manifestaciones clínicas inespecíficas (tipo fatiga y letargia), dolor abdominal, náuseas, vómitos, cefaleas o poliuria-polidipsia. Según diversos autores, ante un niño con esta sintomatología se debería solicitar un screening paratiroideo con la determinación de los niveles de calcio y de PTH.
- Hiperparatiroidismo primario en el embarazo. La presencia de hiperparatiroidismo primario durante la gestación se asocia a un alto índice de pérdidas fetales y muerte neonatal. Si el embarazo llega a término, la hipocalcemia en el recién nacido es frecuente y probablemente secundaria a la supresión de las glándulas paratiroides por los elevados niveles de calcio materno. Debido a la mortalidad fetal y al mayor riesgo de nefrolitiasis para la madre, se aconseja tratar el hiperparatiroidismo primario en el embarazo, excepto en aquellos casos con niveles de calcio poco elevados.
- Hiperparatiroidismo primario del anciano. Clínicamente, no difiere sustancialmente del que aparece en adultos. Predominan las manifestaciones neurológicas como la letargia y el deterioro mental, así como la deshidratación y la crisis paratiroidea.
- Por último, la crisis paratiroidea (o hiperparatiroidismo agudo) es una situación de emergencia caracterizada por hipercalcemia, a menudo > 16 mg/dl, asociada a fiebre, astenia rápidamente progresiva, anorexia, náuseas, vómitos, dolores abdominales, hipertensión arterial, trastornos de comportamiento, a veces convulsiones, delirio e incluso coma con deshidratación. Es la manifestación clínica más grave e impone un tratamiento de urgencia ya que puede complicarse con insuficiencia renal aguda y trastornos del ritmo cardiaco.
Hiperparatiroidismo secundario
El HPP 2º se manifiesta clínicamente mediante una serie de síntomas esqueléticos y extraesqueléticos. Aunque casi todos los signos y síntomas de la insuficiencia renal crónica (IRC) se han asociado de un modo u otro a la acción de la PTH, se destacan a continuación los más relevantes por su mayor repercusión clínica.
Los pacientes con HPP 2º pueden experimentar dolores óseos, calcificaciones ectópicas y prurito. La osteopatía de los pacientes con HPP 2º e insuficiencia renal se denomina osteodistrofia renal y se caracteriza por la destrucción progresiva de las trabéculas óseas, debido a la estimulación de los osteoclastos por la PTH. Las lesiones radiográficas típicas de esta patología son similares a las descritas para el HPP 1º: resorción subperióstica, hueso difuminado con las corticales óseas adelgazadas, cráneo en “sal y pimienta” y las características estrías de Looser-Milkman. Generalmente, este fenómeno se acompaña de una fibrosis de la médula ósea que a su vez produce una disminución de la formación de elementos formes de la sangre, responsable de la anemia del paciente renal. Al mismo tiempo puede haber osteomalacia (por déficit de calcio y vitamina D) u osteítis fibrosa quística (por acción excesiva de la PTH sobre el hueso).
Otras manifestaciones frecuentes del HPP 2º son la asociación con hipertensión arterial y la aparición de depósitos extraóseos de cristales de hidroxiapatita a nivel de partes blandas, de diversos órganos y de estructuras vasculares, lo que con el tiempo va dando lugar a una verdadera osificación activa vascular. Cuando estos fenómenos tienen lugar en pequeños vasos de las extremidades pueden provocar la aparición de calcifilaxis y, si lo hacen a nivel de las arterias coronarias, pueden dar lugar a fenómenos isquémicos cardiacos. Así pues, ambos eventos contribuyen a aumentar la mortalidad cardiovascular que es la principal causa de muerte en el paciente en diálisis.
Diagnóstico
Valoración de laboratorio
El diagnóstico del hiperparatiroidismo se establece fundamentalmente en base a los estudios de laboratorio. Actualmente, las mejores técnicas para el diagnóstico de HPP son la determinación de hormona paratiroidea, el calcio sérico total, el fósforo sérico y el calcio urinario. En líneas generales, se puede considerar que el aumento de los niveles de PTH y calcio asociado a hipofosfatemia configuran el diagnóstico de HPP 1º, mientras que niveles elevados de PTH, calcio y fósforo deberían hacernos sospechar un HPP 2º.
Determinación de calcio y fósforo séricos
Para la determinación de las cifras de calcemia se dispone de dos pruebas de laboratorio: la medición del calcio sérico total y la medición del calcio iónico. La primera constituye el medio más fácilmente disponible y menos costoso, y para su cálculo es necesaria la valoración conjunta del mismo con las proteínas totales o la albúmina: se considera hipercalcemia cifras mantenidas de calcio superiores a 10,3 mg/dl. Por su parte, la medición de calcio sérico ionizado es más exacta que la anterior, considerándose una concentración media normal alrededor de 4,7 mg/dl, siendo necesaria para su cálculo la corrección del pH a 7,4 (debido a la acidosis hiperclorémica que asocia el HPP); sin embargo, a pesar de la mayor fiabilidad, para su medición son necesarias una serie de condiciones específicas que en ocasiones resultan difíciles de cumplir en la práctica diaria.
Con respecto a la determinación del fósforo sérico, una fosforemia inferior a 2,5-2,7 mg/dl en un paciente con función renal normal sería indicativa de un incremento en la secreción de PTH. Por el contrario, en el HPP 2º las cifras de fósforo son superiores a la normalidad.
Hormona paratiroidea
La cuantificación directa de la concentración de PTH mediante métodos inmunorradiométricos (IRMA) es la mejor prueba para valorar el funcionamiento de las glándulas paratiroides. Sus cifras estándar oscilan entre 30-60 picogramos/ml y es importante su valoración conjunta con los niveles de calcio sérico. Así, una alta concentración de PTH en presencia de hipercalcemia confirmaría el diagnóstico de hiperparatiroidismo. Una concentración en los límites de la normalidad de PTH asociada a hipercalcemia sugeriría también dicho diagnóstico, mientras que una hipercalcemia con niveles de PTH indetectables o bajos debería hacer sospechar de un proceso fisiopatológico ajeno a estas glándulas. En pacientes con insuficiencia renal crónica se habla de hiperparatiroidismo cuando la cifra de PTH es superior a 150 picogramos/ml, es decir, cuando nos encontramos ante una cifra el triple de la habitual.
—Las manifestaciones clínicas más frecuentes son la afectación renal, la enfermedad ósea y síntomas inespecíficos relacionados con la hipercalcemia—
Diagnóstico por imagen
La importancia de la utilización de técnicas de imagen de localización paratiroidea no se basa en su utilidad para el diagnóstico de hiperparatiroidismo (que se realiza en base a criterios clínicos y bioquímicos), ni siquiera en la diferenciación entre adenoma e hiperplasia, sino en permitir la localización de las glándulas patológicas para facilitar la tarea del cirujano. No obstante, existe cierta controversia sobre la utilidad real de las técnicas de imagen para la localización preoperatoria de las glándulas paratiroides, ya que los cirujanos expertos pueden identificar los adenomas paratiroideos durante el acto quirúrgico en el 95% de los casos. A pesar de ello, el pequeño tamaño de las glándulas, su número inconstante y la diversidad en su localización, hacen que la correcta localización de las glándulas paratiroides durante la cirugía (sobre todo en los casos de patología hiperplásica o si ha existido cirugía previa del cuello) siga siendo hoy en día un reto incluso para el cirujano más experimentado. De cualquier manera, la introducción de nuevas técnicas de cirugía mínimamente invasiva en el tratamiento del HPP hacen que la localización preoperatoria de las glándulas paratiroides sea un factor clave: una localización preoperatoria exitosa disminuiría el tiempo quirúrgico y aumentaría el porcentaje de éxitos de la cirugía.
Entre los procedimientos de localización no invasivos que pueden emplearse se encuentran la ecografía, la tomografía computerizada, la resonancia magnética y la gammagrafía con Tc99m-SESTAMIBI. La elección de uno u otro método estará fundamentalmente condicionada por su disponibilidad, fiabilidad, precio y grado de experiencia del explorador. Es necesario puntualizar, que todas estas pruebas son bastante exactas en la localización de aquellos casos en los que el origen de la patología sea un adenoma paratiroideo, no siendo tan eficaces en los casos de hiperplasia, por lo que el diagnóstico definitivo se basará en el estudio anatomopatológico de las glándulas. Actualmente, el gold standard de las pruebas de localización preoperatoria de las glándulas paratiroides es la asociación de la gammagrafía Tc99m-SESTAMIBI y de la ecografía de alta resolución, con una sensibilidad de localización de hasta del 96%.
—El diagnóstico se establece fundamentalmente por los niveles séricos de PTH, de calcio sérico y urinario, y de fósforo sérico—
Ecografía de alta resolución
Se trata de una técnica no invasiva, de fácil disponibilidad, sencilla de realizar y de bajo coste, bastante eficaz para la evaluación de las glándulas paratiroides. Una de sus principales ventajas es que permite un análisis morfológico tanto de las glándulas paratiroides como del tejido tiroideo adyacente, por lo que está indicada como primera exploración ante la sospecha de cualquier caso de HPP. Las paratiroides normales generalmente no se visualizarán ecográficamente debido a su pequeño tamaño y a su estrecha relación con la glándula tiroides, mientras que las glándulas patológicas aparecerán como una lesión nodular de márgenes bien definidos y una ecogenicidad menor a la del tejido tiroideo adyacente.
No obstante, el estudio ecográfico del cuello en la patología paratiroidea presenta una serie de limitaciones, tales como: dificultad para identificar glándulas hiperplásicas de < 5 mm de diámetro, uso en pacientes con patología tiroidea asociada, o para la identificación de glándulas ectópicas situadas a nivel retroesofágico, retrotraqueal o mediastínico (áreas de sombra acústica no accesibles al transductor).
Una modalidad recientemente introducida en el estudio ecográfico de las glándulas paratiroides, concretamente de los adenomas paratiroideos, es la ecografía Doppler-color. Se basa en la observación de que las glándulas paratiroides patológicas presentan un patrón característico de vascularización, que consiste en la presencia de una arteria extratiroidea dilatada, de distribución polar; ésta, conforme penetra en la glándula patológica, se ramifica periféricamente conformando un anillo vascular bien definido alrededor de la glándula.
Gammagrafía con Tc99m-SESTAMIBI
Son muchos los estudios que han demostrado el valor de esta técnica como test preoperatorio, estableciéndose su superioridad frente al resto de técnicas de imagen no invasivas, especialmente en los adenomas solitarios, con una sensibilidad media del 87%. Para su realización se precisa la utilización de un radiofármaco, el Tc99m-SESTAMIBI. Tras la administración del mismo, se procede a la obtención de una imagen precoz (5-10 min tras la inyección del radiofármaco) y otra tardía (2-3 horas posinyección), de manera que pueda apreciarse un diferente “lavado” del Tc99m-MIBI desde la glándula tiroides y desde las lesiones de las glándulas paratiroides, siendo dicho lavado más rápido en el caso del tejido tiroideo. Las principales limitaciones que presenta esta técnica se refieren a la presencia de las glándulas hiperplásicas y de patología tiroidea asociada.
En la actualidad, la gammagrafía con Tc99m-SESTAMIBI se utiliza de manera conjunta con la ecografía de alta resolución. Esta combinación mejora de manera sustancial los parámetros evaluados (sensibilidad, especificidad y valores predictivos), pues la gammagrafía está basada en la actividad funcional de las glándulas paratiroides mientras que la ecografía proporciona una imagen de alta resolución con una precisa descripción de la localización anatómica.
Tomografía computerizada
La tomografía computerizada (TC) debe realizarse siempre tras inyección de contraste intravenoso. Aunque es capaz de detectar glándulas patológicas situadas en lugares ectópicos (retroesofágicas, retrotraqueales, retroclaviculares o mediastínicas), su eficacia disminuye debido a la presencia de artefactos, su resolución espacial y una menor nitidez de imagen. A su vez, la presencia de vasos tortuosos, masas tiroideas o nódulos linfáticos pueden confundirse con glándulas paratiroides patológicas. Otra desventaja adicional de esta técnica es que todos estos tejidos blandos cambian de posición y configuración según la posición del cuello en el momento de realizarse la exploración, así como con la deglución. Así pues, la TC resulta obsoleta actualmente como herramienta en la primera aproximación al diagnóstico de localización de las glándulas paratiroides.
Resonancia magnética
Las indicaciones para la realización de una RM en la patología paratiroidea son muy similares a las de la TC. Por tanto, debido a su elevado coste y su baja sensibilidad en cuello en comparación con la ecografía, la RM quedaría reservada para aquellos casos de localización ectópica de las glándulas paratiroides, las cuales, cuando son patológicas, muestran una señal intermedia similar a la del músculo en T1 y brillante en T2.
Otras técnicas
- Tomografía computerizada de 4-dimensiones (TC 4D). La TC 4D es una modalidad de imagen similar a la angiografía. Su nombre deriva del escáner de tres dimensiones con una dimensión sobreañadida derivada de los cambios de perfusión de contraste a lo largo del tiempo. Este tipo de técnica genera imágenes multiplanares detalladas del cuello y permite una visualización de las diferencias en la perfusión de contraste características de las glándulas paratiroides hiperfuncionales. De esta forma, la TC 4D proporciona, en una única prueba de imagen (que el cirujano puede interpretar fácilmente), no solo información referente a la anatomía y localización de las glándulas paratiroides (lado del cuello y cuadrante concreto), sino también referente a la funcionalidad de las mismas, con una sensibilidad, según los estudios realizados, de alrededor del 70%.
- Cateterismo venoso con detección selectiva PTH. La detección venosa selectiva de PTH es un método invasivo de localización preoperatoria de las glándulas paratiroides, que se basa en la determinación comparativa de los valores de PTH a nivel de las venas cervicales (tronco braquiocefálico, vena yugular interna y venas tiroideas inferior, superior y media) y a nivel de una vena periférica del antebrazo del mismo lado. Para su consecución será necesaria una punción de la vena femoral con posterior control fluoroscópico de las venas cervicales, considerándose sugestivo de la presencia de una glándula paratiroidea hiperfuncional un valor a nivel de las venas cervicales 2 veces superior en relación al obtenido en la vena periférica del antebrazo. Actualmente, debido a su carácter invasivo, a su elevado coste, a la posibilidad de complicaciones derivadas de esta técnica y, sobre todo, debido a que para su correcta realización es necesaria una amplia experiencia del explorador, el uso de esta prueba queda relegado a aquellos casos en los que la ecografía o la gammagrafía MIBI presentan resultados indeterminados o en pacientes con HPP recurrente o persistente.
- Tomografía computerizada por emisión de positrones (SPECT). Esta moderna técnica de localización preoperatoria, actualmente en estudio, parece tener utilidad en la localización ectópica de las glándulas paratiroides, concretamente si nos encontramos ante adenomas de localización mediastínica.
Tratamiento
Tratamiento quirúrgico del hiperparatiroidismo primario
Según las recomendaciones de consenso, la paratiroidectomía es siempre el tratamiento definitivo en el caso de la existencia de un hiperparatiroidismo sintomático en el paciente sin contraindicaciones para la cirugía. Es siempre una opción valiosa en el paciente con HPP 1º porque normaliza la calcemia y la PTH. Los estudios de cohortes han demostrado que también disminuye el riesgo de fracturas en pacientes asintomáticos. En todo caso, en las personas con enfermedad asintomática que no desean o no pueden someterse a cirugía, el control médico con intervención dirigida es una opción atractiva.
Los criterios recomendados para la realización de paratiroidectomía en pacientes con hiperparatiroidismo primario asintomático son:
- calcemia > 0,25ml/l sobre los límites superiores de la normalidad;
- aclaramiento de creatinina < 60 ml/min;
- densidad ósea con una puntuación T ≤ -0,25 en cualquier lugar o fractura anterior, o ambos;
- y edad < 50 años.
Según estudios prospectivos y retrospectivos de pacientes con HPP 1º leve, en manos expertas la paratiroidectomía normaliza la calcemia y la PTH, disminuye el riesgo de fracturas óseas y puede mejorar algo la disfunción neurocognitiva en casos de HPP 1º leve. Estudios no muy amplios de cohortes y retrospectivos sugieren que la paratiroidectomía reduce la incidencia de cálculos renales. Pero cabe destacar que ningún estudio aleatorizado ha evaluado los efectos de la paratiroidectomía sobre el riesgo de fracturas. Tampoco es clara la asociación entre cardiopatías e hiperparatiroidismo leve.
Tratamiento médico del hiperparatiroidismo primario
El tratamiento médico (farmacoterapia) es una opción adecuada para los pacientes que no reúnen las recomendaciones para la cirugía, así como para aquéllos que no desean someterse a un acto quirúrgico. Se deben controlar la calcemia anualmente y la creatininemia y la densidad ósea cada 1-2 años.
Si bien se ha evaluado la eficacia de los antiresortivos –estrógenos, bisfosfonatos, raloxifeno y cinacalcet– para personas con hiperparatiroidismo primario leve, todos los estudios son relativamente pequeños y no fueron diseñados para evaluar los efectos sobre el riesgo de fracturas. En dos estudios aleatorizados con 26 y 44 pacientes con HPP 1º, respectivamente, el tratamiento con alendronato durante 2 años aumentó significativamente la densidad ósea de la columna lumbar, la cadera y todo el cuerpo, siendo indetectables los marcadores de recambio óseo, como la desoxipiridinolina urinaria; en el segundo estudio también se observó la disminución de los marcadores de recambio óseo (N-telopéptido urinario y fosfatasa alcalina específica del hueso).
El tratamiento con estrógenos se ha mostrado eficaz para la osteoporosis posmenopáusica. En un estudio aleatorizado controlado con 42 mujeres con HPP 1º, el uso de estrógenos aumentó significativamente la densidad ósea de la columna lumbar y el cuello femoral. Los marcadores de recambio óseo, como la fosfatasa alcalina, la hidroxiprolina urinaria y el N-telopéptido urinario disminuyeron, aunque no sucedió lo mismo con la calcemia. Otro estudio controlado frente a placebo que incluyó a 18 mujeres posmenopáusicas con HPP 1º asintomático puso de manifiesto que el modulador selectivo de estrógeno, raloxifeno, en dosis de 60 mg/día durante 2 meses, disminuyó los marcadores de recambio óseo. Se necesitan más investigaciones para determinar si el raloxifeno protege el esqueleto en esta patología.
Por último, el calciomimético cinacalcet ha demostrado capacidad para disminuir la calcemia y la PTH en pacientes con HPP 1º, aunque en un estudio aleatorizado de 52 semanas con 78 pacientes no tuvo efectos significativos sobre la densidad ósea. Se considera, pues, eficaz para disminuir la calcemia y la HPT en pacientes con carcinoma paratiroideo y en el HPP 1º intratable. Sus efectos sobre la protección esquelética exigen más estudios.
Salud cardiaca: cardiopatía isquémica
Resumen
El término cardiopatía isquémica –o arteriopatía coronaria– designa a una variedad de patologías cardiovasculares que afectan a la estructura y función del corazón y que acontecen cuando hay un desequilibrio entre la oferta y la demanda de O2 en el miocardio, por la incapacidad de las arterias coronarias para suministrar suficiente sangre enriquecida en O2. La causa que subyace en la estenosis u oclusión de una o más arterias coronarias epicárdicas en la mayoría de casos es la aterosclerosis, una enfermedad sistémica caracterizada por la formación de placas de ateroma en los vasos sanguíneos y que se ve influenciada por diversos factores de riesgo, destacando, entre ellos, la hipertensión arterial, la hiperlipidemia (hipercolesterolemia), el tabaquismo, la obesidad o la diabetes. Desde el punto de vista epidemiológico, la cardiopatía isquémica representa la principal causa de muerte a nivel mundial, provocando cada año unos 7,4 millones de defunciones (el 13% del total). En España, fue responsable de 31.152 fallecimientos (18.423 hombres y 12.729 mujeres) en el año 2018, si bien su mortalidad se redujo un 3,7% respecto al año anterior. Entre los síndromes que se identifican como subtipos de la cardiopatía isquémica, destaca sobremanera el infarto agudo de miocardio como causa más frecuente de muerte. En definitiva, la prevalencia de la cardiopatía isquémica crónica y la incidencia de complicaciones agudas hacen de esta enfermedad uno de los principales retos sanitarios de nuestro país.
A grandes rasgos, la prevención de la evolución de la aterosclerosis de base y el tratamiento de las complicaciones agudas (síndromes coronarios agudos) y de los síntomas crónicos de estos pacientes se basa en modificaciones terapéuticas del estilo de vida y de los factores de riesgo, en determinados procedimientos invasivos de revascularización y en la administración de diversos grupos de principios activos. El objetivo de la farmacoterapia será el de disminuir la demanda miocárdica de O2 (a través de la reducción de la frecuencia cardiaca, presión arterial o contractilidad miocárdica) o aumentar el aporte al miocardio (mediante la vasodilatación coronaria). Destaca el papel de los fármacos antiagregantes plaquetarios, los antianginosos, los anticoagulantes, las estatinas o los fibrinolíticos; algunos de ellos se inician en la fase aguda y se continuarán indefinidamente.
El presente artículo revisa ampliamente el conocimiento actual sobre la etiopatogenia, la epidemiología, las manifestaciones clínicas y el diagnóstico de la cardiopatía isquémica, centrando el foco en su tratamiento específico en las diversas situaciones posibles. Se pone en valor, finalmente, el importante papel asistencial que el profesional farmacéutico, especialmente desde la farmacia comunitaria, puede ejercer en la prevención de la morbimortalidad de las enfermedades cardiovasculares, en términos de educación sanitaria, detección precoz y optimización de la farmacoterapia.
Introducción y enfoque
Las enfermedades cardiovasculares (ECV) son un grupo de enfermedades no transmisibles que afectan al corazón y a los vasos sanguíneos y, en su conjunto, representan, según la Organización Mundial de la Salud (OMS), la principal causa de muerte y de discapacidad en todo el mundo, siendo responsables de casi un tercio de todos los fallecimientos y de casi la mitad de los debidos a enfermedades no transmisibles. Tienen, pues, un gran impacto socio-sanitario a nivel global, especialmente elevado en países de ingresos bajos y medios, en los que sus habitantes no se benefician de un acceso equitativo a programas adecuados de atención primaria y asistencia sanitaria, lo cual determina una menor esperanza de vida.
En muchos casos se designan indistintamente bajo el término “enfermedad cardiaca” y engloban a todas aquellas enfermedades que implican un estrechamiento o bloqueo de los vasos sanguíneos o bien afectan al músculo (miocardio), las válvulas o el ritmo cardiacos. Entre las principales ECV se incluyen:
- la cardiopatía coronaria isquémica: enfermedad de los vasos sanguíneos que irrigan el músculo cardiaco;
- la insuficiencia cardíaca: rigidez o debilidad del miocardio que no puede bombear suficiente sangre oxigenada a todo el organismo;
- las enfermedades cerebrovasculares (por ejemplo, el ictus): por afectación de los vasos sanguíneos que irrigan el cerebro;
- la cardiopatía reumática: lesiones del músculo y las válvulas cardiacas debidas a la fiebre reumática (enfermedad infecciosa causada por estreptococos);
- las cardiopatías congénitas: malformaciones del corazón presentes desde el nacimiento, muchas de las cuales afectan a las válvulas del corazón;
- las arritmias o alteraciones del ritmo normal de contracción del corazón;
- las arteriopatías periféricas: afectan a los vasos sanguíneos que irrigan los miembros superiores e inferiores; y
- las trombosis venosas profundas y embolias pulmonares: coágulos de sangre o trombos en las venas de las piernas, que pueden desprenderse y alojarse en los vasos del corazón y los pulmones.
Afortunadamente, muchas de estas ECV pueden prevenirse actuando sobre los factores de riesgo ligados a estilo de vida y hábitos de consumo, como el de tabaco, las dietas insanas, la obesidad, la inactividad física o el consumo excesivo de alcohol. Así pues, para las personas con ECV o para personas sanas pero con un alto riesgo cardiovascular debido a la presencia de uno o más factores de riesgo (por ejemplo, la hipertensión arterial, la diabetes o la hiperlipidemia, entre otros), son fundamentales la detección precoz y el tratamiento temprano, por medio de servicios de orientación o a través de la administración de fármacos, según corresponda. Algunos autores sugieren que el control eficaz de los principales factores de riesgo podría reducir en hasta un 80% las muertes debidas a ECV.
En este sentido, en 2013, todos los Estados Miembros de la OMS acordaron una serie de mecanismos mundiales para reducir la carga evitable de las enfermedades no transmisibles (Plan de Acción Mundial para la Prevención y el Control de las Enfermedades No Transmisibles 2013-2020), cuyo principal objetivo era –y aún es– el de reducir para el año 2025 el número de muertes prematuras asociadas a esas enfermedades en un 25%, mediante la consecución de 9 metas mundiales de aplicación voluntaria, la mayoría de las cuales –si no todas– se enfocaban a minimizar la influencia de los factores de riesgo cardiovascular y reducir la mortalidad por ECV (OMS, 2017). De igual modo, la Agenda 2030 para el Desarrollo Sostenible reconoce que las enfermedades no transmisibles son un importante obstáculo, haciendo hincapié en la necesidad de reducir en un 33% para 2030 las muertes prematuras que generan, mediante la prevención y el tratamiento de todas ellas, con especial relevancia de las ECV (Cuéllar, 2016b).
Se estima que el 60% de la mortalidad total por causas cardiovasculares deriva de la cardiopatía isquémica y de la enfermedad cerebrovascular o ictus, siendo ambas las dos patologías cardiovasculares más relevantes desde el punto de vista de la salud pública. Habiéndose tratado en profundidad los aspectos epidemiológicos, clínicos y terapéuticos del ictus en números anteriores de PAM (Cuéllar, 2016a), nos centraremos en el presente artículo en las características y tratamiento de la cardiopatía isquémica y, en particular, del infarto agudo de miocardio, como uno de los principales –quizá el más importante– problemas de salud cardiaca. Para asegurar una mesurada extensión del artículo, se deja de lado en esta ocasión cualquier referencia a otras ECV de interés desde el punto de vista farmacoterapéutico, como las arritmias, las afecciones del pericardio y el endocardio, o las enfermedades que afectan a los vasos sanguíneos fuera del corazón.
Definiciones
La cardiopatía isquémica, también conocida como enfermedad arterial/arteriopatía coronaria, o solo enfermedad coronaria, es el tipo más común de ECV. Se trata de un término general que designa una variedad de condiciones que afectan la estructura y función del corazón y que acontecen cuando las arterias del corazón –o coronarias– no pueden suministrar suficiente sangre enriquecida en oxígeno a todas las células del músculo cardiaco (miocardio) para asegurar el correcto funcionamiento contráctil del corazón, originando la situación de isquemia (NIH, 2019). A pesar de los avances sustanciales acontecidos en las últimas décadas, tanto en el control de los factores de riesgo como en las intervenciones farmacológicas y no farmacológicas, la cardiopatía isquémica desemboca en muchas ocasiones en insuficiencia cardiaca1, lo cual puede agravar su carga social y su tasa de mortalidad.
Desde el punto de vista fisiopatológico y clínico, se diferencian dos formas básicas de presentación de la cardiopatía isquémica (determinan una terapéutica diferencial), fundamentalmente en base al momento de aparición, duración e intensidad de las manifestaciones:
- Cardiopatía isquémica estable (CIE) o síndrome coronario crónico (SCC): cuando los síntomas (sobre todo, dolor torácico), habitualmente en forma de angina de pecho, se reproducen regularmente con el ejercicio y no progresan, indicativo de que los pacientes están estables. Se debe a un estrechamiento –estenosis– luminal progresivo y gradual de las arterias coronarias. En esta entidad crónica podrían incluirse los pacientes revascularizados (sometidos a cirugía de derivación aortocoronaria –bypass– o a una angioplastia –intervención coronaria percutánea–). La definición más aceptada de angina de pecho estable implica la ausencia de cambios en su forma de presentación clínica en el último mes y la no previsible aparición de complicaciones de forma inminente o evolución desfavorable en un futuro inmediato.
- Cardiopatía isquémica aguda (CIA) o síndrome coronario agudo (SCA): se caracteriza por una aparición súbita de los síntomas, que progresan aumentando su frecuencia o su gravedad, o aparecen en reposo, asociados a una oclusión brusca del flujo sanguíneo coronario –por la formación de un trombo– y la consecuente isquemia miocárdica, rápida y muy marcada. Este SCA agrupa a una serie de entidades clínicas de mecanismo fisiopatológico similar, entre las que destacan la angina inestable y el infarto agudo de miocardio (IAM).
Una mención especial merece el IAM, que se define como la situación en la que existe necrosis –y evidencia serológica de la misma– de las células del miocardio como consecuencia de una isquemia prolongada (mientras que en la angina inestable no se obstruye la arteria de forma completa y no hay necrosis). En su definición actual (Thygesen et al., 2019) incluye diferentes criterios clínicos, electrocardiográficos (ECG), bioquímicos y patológicos, que permiten distinguir entre el síndrome coronario agudo con elevación del segmento ST del electrocardiograma (SCACEST o IAMCEST) y sin elevación del ST (SCASEST o IAMSEST)2, relacionados con una oclusión coronaria completa o parcial, respectivamente. En algún caso concreto, con una buena circulación colateral a la zona dependiente de la arteria obstruida, puede producirse una oclusión trombótica total de la arteria responsable sin que se produzca un SCACEST (o IAMCEST), sino un SCASEST.
Etiopatogenia
Como ya se ha avanzado, la cardiopatía isquémica se produce como consecuencia de una limitación en el aporte de la sangre con O2 y metabolitos que requiere el corazón en cada momento; en otras palabras, resulta de un desequilibrio entre la oferta y la demanda de oxígeno del miocardio. A grandes rasgos, el consumo metabólico de O2 por parte del miocardio varía ampliamente entre la situación contráctil y la no contráctil (siendo en esta segunda situación aproximadamente un 10-20% de la primera), y depende básicamente de factores como la tensión de la pared ventricular y la frecuencia cardíaca. Por ello, situaciones que aumentan los requerimientos energéticos del corazón –como el ejercicio físico– pueden precipitar situaciones de isquemia.
La causa que subyace en la estenosis u oclusión de una o más arterias coronarias epicárdicas en la mayoría de casos de cardiopatía isquémica es la aterosclerosis. Se trata ésta de una enfermedad sistémica que afecta a todas las arterias del organismo en mayor o menor grado (Figura 1), pero cuya manifestación más frecuente es precisamente la afectación de las arterias coronarias.
Conviene recordar de forma resumida el proceso de formación de la placa de ateroma, que comienza cuando la función endotelial de la pared arterial se deteriora y las lipoproteínas que circulan en el torrente sanguíneo se acumulan en la capa íntima de los vasos. Cuando las lipoproteínas de baja densidad (LDL) están en altas concentraciones son capaces de permear a través del endotelio dañado y oxidarse, tras lo cual atraen a los leucocitos a la capa íntima, donde pueden ser captados por macrófagos y dar lugar unas a células con consistencia espumosa que pueden replicarse y provocar lesiones vasculares (primer signo de aterosclerosis). Esas lesiones desencadenan una serie de señales bioquímicas que atraen a las células del musculo liso, que proliferarán y sintetizarán una matriz extracelular, básicamente constituida por colágeno y proteoglicanos. A partir de entonces, la placa de ateroma comienza a desarrollarse con la formación de un mayor volumen de matriz extracelular que conduce a la progresión de la lesión hasta una placa fibrótica, la cual se adhiere a la luz de las arterias coronarias y la reduce, pudiendo llegar a calcificar.
El resultado final es una lesión avanzada y complicada que consiste en un “capuchón” fibrótico recubierto de material necrótico rico en lípidos y altamente trombogénico. Los proteoglicanos producidos por las células del músculo liso pueden unirse a más lipoproteínas y prolongar su presencia en la capa íntima; tales sustancias son susceptibles de modificaciones oxidativas y de glicosilaciones, resultando en productos finales capaces de propagar una respuesta bioquímica pro-inflamatoria. Por ejemplo, en respuesta a la oxidación y las señales inflamatorias y autoinmunes, las células endoteliales pueden secretar metaloproteasas matriciales que son capaces de modular varios procesos, como la activación, migración y proliferación de diversos tipos celulares, remodelado y formación de nuevos vasos, etc. Además, la apoptosis celular es común en las lesiones ateroscleróticas, conduciendo a la deposición de factor tisular que puede activar la cascada de la coagulación sanguínea, contribuyendo al microambiente protrombótico (Malakar et al., 2019).
Mientras que los casos crónicos de cardiopatía isquémica (SCC) se deben a una reducción progresiva, pero estable, del flujo sanguíneo coronario como consecuencia del crecimiento de la placa de ateroma incluso durante varios años (Figura 2), la mayoría de casos de isquemia miocárdica aguda (SCA) se deben a la oclusión de una arteria coronaria importante, siendo el principal motivo una alteración física (rotura o erosión), y posterior complicación trombótica brusca (por agregación plaquetaria) y embolización distal, de una placa aterosclerótica –posiblemente originada en otra parte del organismo–, con o sin vasoconstricción concomitante, que da lugar a una obstrucción crítica del flujo sanguíneo e infraperfusión miocárdica. De no resolverse rápidamente, se produce el infarto de miocardio, caracterizado por la necrosis celular.
Los primeros cambios ultraestructurales que ocurren en los cardiomiocitos ante una situación de isquemia son la disminución de los depósitos de glucógeno, la aparición de miofibrillas relajadas y la rotura del sarcolema, que pueden detectarse en los primeros 10-15 min. Al microscopio electrónico pueden observarse anomalías mitocondriales a los 10 min de iniciarse la oclusión coronaria, las cuales son progresivas. No obstante, en el ser humano pueden transcurrir varias horas hasta que se pueda identificar necrosis de los cardiomiocitos mediante evaluación post mortem.
A pesar de que es indudablemente la causa mayoritaria, existen diversas situaciones en las que se puede producir isquemia miocárdica en ausencia de enfermedad coronaria arterioesclerótica, por disminución del aporte de O2 (debido a un vasoespasmo o embolia coronarios, disección de la arteria coronaria, trombosis in situ, etc.) o por aumento de las demandas (taquiarritmias o enfermedades valvulares, por ejemplo). De hecho, cada vez se observan con más frecuencia casos de angina y de infarto en ausencia de obstrucción coronaria, en particular en mujeres que presentan isquemia microvascular. Se estima, por ejemplo, que un 10% de los IAM aparecen sin aterosclerosis de las arterias coronarias epicárdicas.
Así, el NIH (National Institute of Health) estadounidense distingue entre (NIH, 2017):
- Arteriopatía coronaria obstructiva: cuando la placa de ateroma se acumula en las arterias grandes y provoca su estrechamiento gradual, de manera que se reduce el suministro de sangre oxigenada en más del 50%; eventualmente, el flujo de sangre puede estar completamente bloqueado en una o más de las tres arterias coronarias grandes.
- Arteriopatía coronaria no obstructiva: cuando se demuestra una obstrucción de menos del 50%; este tipo de arteriopatía se observa en entre el 20% y el 50% de las personas que se someten a estudios de imagen del corazón. Esta afección, además de por la placa de ateroma, también puede deberse a una lesión en el revestimiento de las arterias, que afecta a su capacidad para expandirse en respuesta a señales físico-químicas o eléctricas y puede causar espasmos con disminución temporal del flujo sanguíneo coronario.
- Enfermedad coronaria microvascular: afecta a las arterias más pequeñas del corazón, pudiendo coexistir con cualquiera de las dos anteriores patologías coronarias. Sus causas no están completamente claras, pero pueden implicar cambios moleculares en los pequeños vasos coronarios (parte del proceso normal de envejecimiento), y también lesiones endoteliales en dichos vasos por un estado de inflamación crónica, hipertensión o diabetes. En consecuencia, se altera la expresión proteica celular, y las pequeñas arterias no responden adecuadamente (vasodilatación) ante señales indicativas de una mayor demanda miocárdica de O2 (por ejemplo, actividad física), sino que su diámetro no cambia o incluso disminuye, resultando también en isquemia.
En resumen, la cardiopatía isquémica es un fenómeno multifactorial que produce un cambio hacia el metabolismo anaerobio en los cardiomiocitos. Los cambios inducidos pueden ser reversibles –por un aumento en el aporte de O2 o una reducción de los requerimientos energéticos– en una primera etapa antes de llegar al daño irreversible con muerte celular. Desde el punto de vista fisiopatológico, el control y la reducción de la frecuencia cardiaca, añadidos al restablecimiento del flujo coronario, serán la piedra angular en el tratamiento de esta afección.
Epidemiología
Las enfermedades cardiovasculares (ECV) son la primera causa de muerte en el mundo, por delante de los tumores y las enfermedades respiratorias, siendo responsables del 30% de los fallecimientos en varones (la cardiopatía isquémica en primer lugar) y el 36% en mujeres (la enfermedad cerebrovascular en primer lugar y la isquémica en segundo). Así, la OMS apunta a que en 2015 murieron por ECV 17,7 millones de personas (en 2018 se hablaba ya de 17,9 millones), lo cual representa un 30% de todas las muertes registradas en el mundo; más del 75% de todos estos fallecimientos prematuros (16 millones por debajo de los 70 años de edad) se producen en países de ingresos bajos y medios3. El último informe del Global Burden of Disease Study (con cifras relativas al año 2017) confirma esas cifras de mortalidad por ECV e indica que ha habido un incremento superior al 40% desde 1990. Se trata, por tanto, de un problema con un impacto socio-sanitario creciente: se estima que la cifra de muertes anuales por ECV ascenderá a 23 millones para el año 2030.
De las muertes por causa cardiovascular, 7,4 millones se deben a la cardiopatía isquémica o arteriopatía coronaria, lo cual representa el 13,2% del total de muertes, siendo la principal causa de muerte en el mundo (Tibaut et al.; 2017). En particular, el infarto agudo de miocardio es la causa mayoritaria de mortalidad por cardiopatía isquémica, relacionándose con casi 2 de cada 3 muertes (64%); se ha estimado que más de un tercio de los pacientes con IAM muere antes de llegar al hospital. Es previsible que la mortalidad por cardiopatía isquémica continúe aumentando en la próxima década debido a la creciente epidemia de obesidad, diabetes tipo 2 y síndrome metabólico, que, a su vez, pueden elevar el riesgo de enfermedad coronaria prematura en jóvenes.
En España, la mortalidad coronaria ajustada por edad es similar a la de los países mediterráneos y claramente inferior a las de países del centro y el norte de Europa, situándose entre las más bajas del mundo. Conviene destacar que, desde mediados de los años 70 del siglo XX, están descendiendo paulatinamente las tasas de mortalidad por ECV4 en todas las comunidades autónomas (también en los países de nuestro entorno), aunque en mayor medida por la reducción de la mortalidad cerebrovascular en comparación con la de la cardiopatía isquémica. Esa reducción de la mortalidad, motivada por una mejoría de los hábitos de vida y de los tratamientos frente a la enfermedad coronaria, ha llevado a que la prevalencia (número de pacientes que viven con la enfermedad en un determinado momento) de ECV haya seguido aumentando, pues la incidencia (nuevos casos) está estabilizada.
Según datos del Instituto Nacional de Estadística5, referentes al año 2018, del total 427.721 muertes que se produjeron en España ese año, 120.859 (un 28,3%) se atribuyeron a las ECV, por delante de tumores (26,4%) y enfermedades del sistema respiratorio (12,6%). La tasa media estandarizada de mortalidad cardiovascular se situó en 230,5 fallecimientos por cada 100.000 habitantes, presentando algunas comunidades autónomas una mortalidad mayor (Andalucía, Islas Canarias, Murcia) que otras (Madrid, Navarra, Castilla y León). Dentro del grupo de ECV, las cardiopatías isquémicas fueron un año más la primera causa de muerte también en nuestro país (un 25,78% del total de la mortalidad cardiovascular), responsables de 31.152 fallecimientos (18.423 hombres y 12.729 mujeres; en mujeres la mayor mortalidad por causas cardiovasculares se debe a ictus), si bien su mortalidad se redujo en un 3,7% respecto al año anterior. En la mortalidad por cardiopatía isquémica, destaca sobremanera el infarto agudo de miocardio como causa más frecuente, responsable del 46,61% de las muertes (14.521 en 2018: 8.660 en hombres y 5.861 en mujeres), aunque la tasa se ha reducido notablemente desde 2006 (cuando provocó 22.028 defunciones).
Sin embargo, la morbilidad (complicaciones e ingresos en el hospital) de las ECV en general, y de la cardiopatía isquémica en particular, no ha parado de aumentar desde la década 1990. En consecuencia, se vaticina que su impacto sanitario y social seguirá creciendo durante los próximos años.
La prevalencia de la angina de pecho está relacionada directamente con la edad en ambos sexos: en las mujeres varía entre el 0,1 y el 1% a los 45-54 años y el 10-15% a los 65-74 años; en varones, las respectivas cifras son del 2-5% y del 10-20%. Se calcula que en la mayoría de los países europeos sufren angina estable entre 20.000 y 40.000 individuos por millón de habitantes, con una tasa anual de mortalidad en estos pacientes que oscila entre el 0,9 y el 1,4% por año.
Por otro lado, en términos de incidencia, se estima que en España se producen más de 2.500 nuevos casos anuales de síndromes coronarios agudos (SCA) por millón de habitantes, de los que unos 1.500 nuevos casos se corresponden a SCA sin elevación del segmento ST (SCASEST, incluyendo el IAMSEST) del electrocardiograma y unos 1.000 casos a infartos de miocardio con elevación del ST (IAMCEST). La mortalidad de los mismos ronda el 10% en la fase hospitalaria (la mayoría de defunciones acontecen en el medio extrahospitalario) y el 15% en los primeros 6 meses. Así pues, la incidencia anual de IAM no fatal ronda entre el 0,5 y el 2,6%; cifras, como se ve, bastante bajas (Alegría et al., 2012).
En todo caso, para comprender mejor la carga sociosanitaria de la cardiopatía isquémica en España se recomienda la consulta del documento «Estrategia en cardiopatía isquémica del Sistema Nacional de Salud”, publicado en 2011 por el Ministerio de Sanidad, Política Social e Igualdad6.
Factores de riesgo
Teniendo en consideración la etiopatogenia de la enfermedad, se comprende que aquellos factores que faciliten o empeoren el desarrollo de la enfermedad aterosclerótica (especialmente a nivel de las arterias coronarias) jugarán un papel fundamental en el desarrollo y la mortalidad por cardiopatías isquémicas. Se ha descrito la relevancia de diversos factores de riesgo entre los que se pueden destacar los referidos a continuación (Malakar et al., 2019; NIH, 2019).
- Hipertensión arterial. Es uno de los principales factores de riesgo cardiovascular asociado con el desarrollo de cardiopatía isquémica, en la medida en que la aterosclerosis puede verse exacerbada por una elevada presión sanguínea. Además, como consecuencia de la deposición de lípidos y formación de la placa de ateroma, la presión transmural en la pared arterial se eleva, induciendo estrés mecánico y permeabilidad endotelial, que contribuye a una respuesta coronaria menos eficaz. La hipertensión tiene una estrecha interconexión con alteraciones metabólicas como la resistencia a la insulina o la dislipidemia, factores también relacionados con la cardiopatía isquémica. Además de contribuir a la progresión crónica de la aterosclerosis, la hipertensión (como ocurre también con el tabaquismo) puede precipitar la isquemia coronaria aguda al aumentar la demanda y reducir el suministro de oxígeno.
Conviene recordar que los valores que han definido la hipertensión arterial clásicamente han sido los superiores a 140 mm Hg de presión sistólica (PAS) y a 90 mm Hg de diastólica (PAD). No obstante, hace 3 años la Asociación Estadounidense de Cardiología, el Colegio Estadounidense de Cardiología y otras 9 organizaciones profesionales actualizaron estas pautas (Whelton et al., 2018) en base a una revisión de 900 estudios, estableciendo que la hipertensión en adultos se define por valores superiores a 130/80 mm Hg. Si bien no suele presentar síntomas, tiene la ventaja de tratarse de una patología fácilmente controlable (con cambios en el estilo de vida y con fármacos) y medible, por lo que es conveniente una monitorización frecuente.
Un meta-análisis de grandes estudios que incluían a unos 420.000 pacientes seguidos durante 10 años demostró la existencia de una asociación entre cifras de PAD comprendidas entre 76 y 105 mm Hg y el riesgo de cardiopatía coronaria e ictus, que era 10-12 veces superior en individuos con cifras de PAD de 105 mm Hg que en normotensos. Otro meta-análisis de estudios que incluían a más de 1 millón de pacientes sin enfermedad cardiovascular previa demostró que en individuos con cifras de PAS/PAD> 115/75 mm Hg el riesgo cardiovascular se duplica con cada incremento de 20/10 mm Hg. Ello permitió calcular que una reducción de 5-6 mm Hg en la PAS y de 10-12 mm Hg en la PAD se asociaba a una reducción en la incidencia de ictus (38%), cardiopatía isquémica (16%) y mortalidad vascular (22%). La importancia del control de la PA queda reflejada por el hallazgo de que reducciones de solo 2-3 mm Hg en la PAD disminuyen en un 9% el riesgo de accidentes cerebrovasculares y en un 5% el de insuficiencia cardiaca congestiva (Cuéllar, 2013). Sea como fuere, su elevada prevalencia en la población general, unida al mayor riesgo de morbimortalidad cardiovascular en pacientes hipertensos, convierte a la hipertensión arterial en el principal factor de riesgo en pacientes mayores de 50 años.
- Tabaquismo. Los estudios de casos y controles y de cohortes al respecto de la influencia del tabaquismo son concluyentes y revelan una mayor incidencia de cardiopatía isquémica y mortalidad asociada en personas fumadoras. Por ejemplo, en adultos “jóvenes” (< 40-55 años) el hábito tabáquico se ha asociado con una probabilidad 3,3 y 4,6 veces mayor de sufrir infarto de miocardio frente a no fumadores o exfumadores, y en adultos de mayor edad ese riesgo también se incrementa en 2,4 veces (Shah et al., 2016). El tabaquismo se ha asociado a un riesgo de mortalidad por cardiopatía isquémica un 70% mayor (respecto a la ausencia de dicho hábito), con un riesgo dependiente del número de cigarrillos, la duración del hábito y la profundidad de la inhalación. Este factor puede incidir de forma directa o indirecta en el riesgo de desarrollo de la lesión aterosclerótica y de oclusión de las arterias coronarias, al producir una alteración endotelial y promover la adhesión plaquetaria a las capas subíntimas, aumentando la infiltración de lípidos y la proliferación de células musculares lisas mediada por el factor de crecimiento derivado de plaquetas (PDGF). No hay que olvidar la relevancia del tabaquismo pasivo.
- Hipercolesterolemia. Un aumento de las cifras de colesterol total, sobre todo del colesterol-LDL (comúnmente conocido como colesterol malo), o una disminución de los niveles de colesterol-HDL (colesterol bueno) aumenta también el riesgo de su acúmulo, favoreciendo la formación y progresión de la placa de ateroma en las arterias y, con ello, de arteriopatía coronaria. Se ha observado que por cada 1% de aumento de la concentración de colesterol-LDL se observa un aumento del riesgo de acontecimientos coronarios del 2 al 3%. En base a una sólida evidencia que apunta a que una reducción en los niveles de colesterol-LDL reduce el riesgo cardiovascular, algunas guías clínicas recomiendan niveles de c-LDL ≤ 70 mg/dl, con una reducción de hasta 20 mg/dl en pacientes de alto riesgo (Whayne et al., 2019).
- Diabetes. En particular, la diabetes mellitus tipo 2 se ha propuesto como un factor de riesgo importante, habiéndose observado una incidencia significativamente mayor de cardiopatía isquémica en estos pacientes respecto a no diabéticos. Entre las causas de ello, se describe su frecuente asociación con la hiperlipidemia (elevados niveles de triglicéridos y colesterol-LDL y bajos niveles de colesterol-HDL), que puede promover la formación de la placa de ateroma. Además, la diabetes mellitus aumenta la susceptibilidad miocárdica a la lesión isquémica y modifica la respuesta de los cardiomiocitos a las estrategias de condicionamiento isquémico por la disrupción en las rutas de señalización intracelular responsables de la resistencia a la muerte celular. Es, pues, de especial relevancia para el riesgo cardiovascular, controlar adecuadamente los niveles de glucemia y, en caso de desarrollar diabetes tipo 2, tratarla eficazmente.
Los factores de riesgo hasta aquí comentados (tabaquismo, diabetes, hipertensión arterial e hipercolesterolemia) son los responsables del 69% de la incidencia de la enfermedad arterial periférica (EAP), siendo el tabaquismo el factor más importante. De hecho, la EAP se considera un equivalente de la enfermedad coronaria y un marcador de alto riesgo de eventos coronarios y cardiovasculares, y de mortalidad.
- Obesidad. Definida como un exceso de acumulación de grasa en el tejido adiposo y directamente relacionada con los malos hábitos alimenticios y una reducida actividad física (sedentarismo), se reconoce como una causa frecuente de muerte cardiovascular, especialmente en países desarrollados. El acúmulo excesivo de lípidos en las vísceras abdominales junto a la desregulación de los factores endocrinos derivados de los adipocitos, eventos ambos que ocurren en la obesidad, llevan al desarrollo de enfermedad aterosclerótica. Algunos trabajos han estimado que la tasa de obesidad se ha duplicado en España en los últimos 20 años y se estima que más de la mitad de las personas adultas (el 53%) está por encima de su peso, con un 17% de obesos; ha sido calificada por los expertos como la gran epidemia del siglo XXI, responsable del 7% del gasto sanitario total. La combinación de la obesidad con otros factores de riesgo cardiometabólico (como hipertensión, hiperglucemia o dislipidemias), como ocurre en el conocido como síndrome metabólico, determina una sinergia del riesgo cardiovascular, siendo éste superior al estimado a través de la cuantificación a través de cada uno de los factores de riesgo considerados independientemente.
- Factores de riesgo no modificables. Destacan entre ellos los siguientes:
Sexo: la cardiopatía isquémica afecta tanto a hombres como a mujeres, si bien se acepta que la arteriopatía coronaria obstructiva es más común entre los hombres que en las mujeres mientras que la arteriopatía coronaria no obstructiva es más común entre las mujeres. En general, los varones tienen un riesgo cardiovascular más elevado (reflejado en un riesgo coronario similar al de mujeres con 10 años más de edad) pero, puesto que la cardiopatía isquémica es más frecuente en edades avanzadas y las mujeres alcanzan de media una mayor edad, las mujeres presentan una mayor mortalidad bruta por esta causa. Además, las mujeres pueden tener un riesgo más alto de lo normal de desarrollar una cardiopatía isquémica a partir de la menopausia o si tienen una de las siguientes afecciones: diabetes, endometriosis, diabetes gestacional, síndrome metabólico, infección por VIH, síndrome de ovario poliquístico o preeclampsia (Rosen et al., 2015).
Edad avanzada: los factores genéticos o del estilo de vida hacen que la placa se acumule en las arterias a medida que se envejece. En hombres, el riesgo de cardiopatía isquémica aumenta de forma marcada a partir de los 45 años. En mujeres, se estima que el riesgo aumenta al mismo ritmo que en hombres a partir de los 55 años, después de la menopausia, probablemente debido a que los efectos protectores de los estrógenos disminuyen en esa etapa. Además, las modificaciones estructurales y funcionales en los vasos cardiacos a medida que se envejece aumentan el riesgo de enfermedad coronaria microvascular.
Factores genéticos y antecedentes familiares: la presencia de un antecedente familiar de enfermedad cardiovascular temprana se reconoce como un factor de riesgo para la cardiopatía isquémica, especialmente si se trata de familiares de primer grado (varones de < 55 años o mujeres < 65 años). Estudios genéticos han demostrado, además, que la hipercolesterolemia familiar (enfermedad debida a mutaciones en el gen del receptor de LDL, de la apoplipoproteína B100 y de la proteína PCSK9) se asocia con una mayor incidencia de cardiopatía isquémica. Se ha apuntado a la implicación en la patogénesis de la cardiopatía isquémica de más de 45 genes (Malakar et al., 2019; Whayne et al., 2019).
- Otros factores de riesgo. El consumo excesivo de alcohol7, altos niveles de estrés (emocional o motivado por el trabajo), un descanso insuficiente, la contaminación ambiental, la dieta poco saludable, la presencia de comorbilidades (como infección por VIH, hiperuricemia, trastornos del sueño o algunas enfermedades inflamatorias o autoinmunes) o los antecedentes personales de cardiopatía isquémica son otros de los factores que se han descrito como potenciadores del riesgo de padecer cardiopatía isquémica.
Hay que subrayar, además, que la combinación de dos o más de los factores de riesgo hasta aquí citados hace que el riesgo de padecer angina de pecho o infarto de miocardio se maximice. Para definir la probabilidad de sufrir un evento isquémico coronario en pacientes con múltiples factores de riesgo, se emplean diversas escalas que permiten una mejor estratificación del riesgo cardiovascular que la evaluación clínica por sí sola. Existen varias calculadoras y puntuaciones de riesgo isquémico, que se basan en datos clínicos, alteraciones electrocardiográficas y biomarcadores. Las escalas GRACE/calculadora GRACE 2.0 y TIMI son las más usadas, habiéndose observado que esta última es menos sensible (Rodríguez Pardial, 2019).
Aspectos clínicos
Manifestaciones
El síndrome coronario crónico (SCC) se manifiesta fundamentalmente por la llamada angina de pecho estable, cuyo síntoma más frecuente es el dolor torácico, localizado normalmente en la parte central, sobre el esternón; sin embargo, se puede sentir en cualquier parte del cuerpo, desde el epigastrio a la mandíbula o los dientes, entre los omóplatos o en cualquiera de los dos brazos (más común la irradiación al izquierdo) hasta la muñeca y los dedos. Los pacientes suelen describir este dolor como opresión, tensión o pesadez, más que como dolor propiamente dicho, y característicamente se acompaña de sensación de estrangulamiento, constricción o quemazón, y en ocasiones de sudoración y náuseas. Su intensidad puede variar mucho y no está relacionada directamente con la gravedad de la enfermedad coronaria subyacente. Algunas personas con SCC pueden tener una isquemia “silenciosa” (más frecuente en mujeres), siendo posible que no experimenten ningún síntoma hasta la aparición de complicaciones graves, como eventos coronarios agudos. Se asume como norma general, no obstante, que los pacientes presentan las manifestaciones típicas de la angina estable cuando la placa aterosclerótica de la arteria coronaria obstruye aproximadamente el 90% de la luz del vaso, dejando un flujo sanguíneo limitado.
En la mayoría de casos de SCC, los episodios de angina son breves, de menos de 10 minutos (raramente > 20 min o < 1 min), siendo muy característica su relación con el ejercicio, una actividad específica, el frío o el estrés. Así, es típico que se acentúen los síntomas con la actividad física, después de una comida pesada o a primera hora de la mañana (cuando las demandas de oxígeno no son suplidas adecuadamente por el aporte provisto por la arteria coronaria estenótica) y que remitan rápidamente en unos minutos, cuando desaparecen los factores causales (el dolor desaparece en reposo o con medicación). El umbral anginoso –grado de esfuerzo a partir del cual el paciente padece angina– es fijo en la mayoría de los casos. Cabe destacar que algunos pacientes presentan dolor torácico atípico u otras molestias como dificultad para respirar (disnea) con el esfuerzo, astenia o arritmias; estos son los denominados equivalentes anginosos, más frecuentes en los pacientes con diabetes mellitus.
Por otro lado, se acepta que el síndrome coronario agudo (SCA) se manifiesta por un dolor en el pecho que se mantiene durante más de 20 min y puede ir acompañado de fatiga, sudor, frío, mareos o sensación de angustia. Sin embargo, en ocasiones, el primer síntoma es el paro cardiaco que, salvo asistencia sanitaria urgente, provoca la muerte del paciente.
Como un tipo de SCA, se habla de angina de pecho inestable cuando la angina no es predecible y reproducible a un nivel de ejercicio relativamente constante, sino que es un evento inesperado que permanece incluso con el reposo (siempre > 20 min) y se puede presentar en personas sanas, aunque generalmente es más frecuente en quienes tienen factores de riesgo o ya han padecido otra manifestación de cardiopatía isquémica (por ejemplo, una desestabilización de angina estable). Se manifiesta como un dolor torácico cardiaco de nueva aparición que, igualmente, tiene carácter opresivo, empieza en el centro del pecho y puede extenderse a brazos, cuello, mandíbula y espalda. A pesar de que en esa situación clínica no existe una oclusión completa de la arteria coronaria8 por el trombo (no hay elevación del segmento ST del electrocardiograma, englobándose entre los SCASEST) y no se ha llegado a producir muerte de células cardiacas (no hay elevación de troponina sanguínea), el dolor tiende a ir en aumento y, de no ser tratada urgentemente, puede desembocar en una arritmia grave, infarto de miocardio o muerte súbita.
—Cada año más de 7 millones de personas fallecen en el mundo por cardiopatía isquémica, la principal causa de muerte (> 13% del total)—
Con unas manifestaciones clínicas –y características– similares a la angina inestable, aunque de mayor duración e intensidad, el infarto agudo de miocardio (IAM) se considera un SCA muy grave, consecuencia en este caso de la obstrucción completa –o casi- completa– de una arteria coronaria por un trombo (generado por la rotura o erosión de la placa aterosclerótica), que provoca necrosis progresiva de las células miocárdicas en el territorio cardiaco que irriga la arteria obstruida y se acompaña de datos serológicos de necrosis miocárdica. La importancia del infarto de miocardio dependerá de la cantidad de músculo cardiaco que se necrose.
Como se avanzó anteriormente, si en el electrocardiograma se observa elevación concomitante del segmento ST se habla de IAM con elevación del segmento ST (IAMCEST), mientras que, si no se observa elevación del segmento ST, se dice que presenta un IAM sin elevación del segmento ST (IAMSEST). De forma similar a la angina inestable, los pacientes con IAMSEST suelen manifestar dolor torácico, presión, constricción o pesadez retroesternal, que puede ser intermitente y recurrente (episodios de entre unos minutos y varias horas de duración) o persistente, e irradiarse a zonas anatómicas próximas. Puede ocurrir en reposo y no remite espontáneamente. A veces se manifiesta con dolor en la parte alta del abdomen y/o se acompaña de sudoración, disnea, náuseas y pérdida de conocimiento. Se asocia comúnmente con una sensación de gravedad, por la percepción del propio enfermo y del personal sanitario que lo atiende, si bien la ausencia de tal sensación no excluye su presencia. Con una clínica similar, el IAM con elevación del segmento ST (IAMCEST) se caracteriza por una isquemia miocárdica aguda –motivada por una interrupción completa del flujo sanguíneo coronario– que suele afectar a áreas relativamente extensas del miocardio, lo que se suele traducir en un dolor más intenso y con frecuente componente vegetativo (náuseas, mareo, palidez, sudoración, etc.) y sensación de muerte inminente asociados.
Cabe destacar que el daño cardiaco de un IAM se incrementa con el tiempo: la necrosis miocárdica comienza tras solo 15-20 min de oclusión coronaria y progresa con rapidez con un frente de avance desde el endocardio al epicardio; su extensión depende de las necesidades metabólicas del corazón y del flujo coronario colateral. Toda vez que muere una porción de miocardio, es imposible recuperar su función, si bien el daño sí se puede detener si el miocardio vuelve a recibir sangre por medio de procedimientos (farmacológicos o no farmacológicos) que desatascan la arteria bloqueada y permiten la reperfusión en un periodo de 3-6 h, como se verá más adelante. El pronóstico del IAM será más favorable cuanto más rápido reciba asistencia médica el paciente: es fundamental realizar una evaluación clínica muy rápida para iniciar el tratamiento adecuado lo antes posible.
Si el IAM es de pequeña extensión, el paciente puede llevar posteriormente una vida normal, controlando estrechamente los factores de riesgo para evitar recidivas. No obstante, es común que aparezca una angina estable posterior al IAM e incluso, si el IAM ha sido muy extenso, el paciente pueda padecer una insuficiencia cardiaca crónica, a veces con congestión pulmonar. Además, en algunos pacientes que sufren un IAM extenso (sobre todo, IAMCEST), pueden aparecer arritmias ventriculares o bloqueos cardiacos que, por lo general, pueden ser controlados con el uso de dispositivos especiales (desfibrilador, marcapasos); estos eventos suelen aparecer en el ingreso hospitalario y, una vez superados, el pronóstico ya no depende de haber presentado dichas complicaciones (FEC, 2018).
Entre los subtipos de SCA destaca por su frecuencia el SCASEST (y, en particular, el IAMSEST). Así, en España se estima que en 2021 habrá unos 109.000 pacientes con SCA, el 56% de los cuales tendrá un SCASEST, bien como angina inestable o como IAMSEST9; la tendencia estimada hasta 2049 será a una estabilización en la población de 25 a 74 años, mientras que aumentará significativamente en mayores de 74 años, debido al envejecimiento de la población. A pesar de que el IAMSEST tenga una menor mortalidad inicial (se ha reducido de forma evidente en dos tercios desde 2008), esta acaba por igualarse a los 6 meses e, incluso, duplica a la del IAMCEST al cabo de 4 años. El peor pronóstico a medio y largo plazo en los pacientes con IAMSEST probablemente se deba a las características de estos pacientes (mayor edad, diabetes, insuficiencia renal, etc.), que incrementan el riesgo de nuevos episodios de SCA.
En conjunto, la letalidad del SCA entre los pacientes hospitalizados se ha reducido, pero la proporción de muertes súbitas se mantiene sin cambios. De forma general, el riesgo de muerte con un SCA se estima más elevado en el momento del diagnóstico, estando las complicaciones tardías normalmente relacionadas con la progresión de la aterosclerosis crónica y la disfunción ventricular izquierda. Los pacientes con angina inestable tienen un mejor pronóstico a corto plazo que los que presentan un IAMSEST o un IAMCEST, dado que tienen una mortalidad < 2 % en los primeros 30 días, lo que hace que se beneficien menos de estrategias terapéuticas agresivas e invasivas precoces; en el pronóstico también influyen los niveles de inflamación del tejido cardiaco, que se correlacionan con los niveles de proteína C reactiva. Tras un episodio de SCA, el riesgo de presentar nuevas complicaciones isquémicas depende tanto de la lesión responsable del cuadro clínico como de la presencia y estabilidad de otras lesiones coronarias en diferentes áreas. Al año, las tasas de muerte, infarto de miocardio o nuevo episodio de inestabilidad en los registros actuales son > 10 %. Un tratamiento médico agresivo de las placas inestables, y la prevención de la aparición de otras nuevas puede mejorar el pronóstico al prevenir eventos posteriores.
Diagnóstico
El diagnóstico de la cardiopatía isquémica se fundamenta básicamente en tres aspectos: la clínica, el electrocardiograma (ECG) y la elevación de los biomarcadores de lesión miocárdica.
La angina de pecho –el SCC– se diagnostica únicamente en función de la clínica de molestia precordial característica, cuyos 4 aspectos definitorios –descritos en el apartado anterior– son la localización, su carácter, la duración y la relación con el ejercicio u otros factores que la acentúan o alivian. La probabilidad del diagnóstico aumenta cuando el paciente reúne uno o más factores de riesgo cardiovascular, tales como tabaquismo, hipertensión arterial, elevación del colesterol, diabetes mellitus, etc. Es importante también identificar las circunstancias clínicas que pueden exacerbar o precipitar la aparición de eventos isquémicos, como anemia, infección, inflamación, fiebre o trastornos metabólicos o endocrinos. El diagnóstico clínico de los citados equivalentes anginosos (dolor torácico atípico, disnea con el esfuerzo, astenia o arritmias) es algo más difícil y debe basarse en la realización de exploraciones dirigidas a la detección de la isquemia miocárdica.
A grandes rasgos, la exploración física de un paciente con cardiopatía isquémica puede ser normal. No obstante, en los pacientes con isquemia más extensa pueden detectarse signos que indican una mayor gravedad de la enfermedad coronaria, como la sudoración profusa, la palidez, taquicardia, la disminución del nivel de conciencia o signos de insuficiencia cardiaca en la auscultación (crepitantes, tercer ruido, presión venosa yugular elevada). El diagnóstico diferencial requiere la detección de signos de enfermedad vascular periférica (soplos en grandes vasos, ausencia o disminución de pulsos en miembros inferiores), valvulopatías (estenosis aórtica, miocardiopatía hipertrófica, etc.) u otras patologías acompañantes (neumopatía crónica) que puedan ser las causantes del dolor torácico. Incluso algunos signos (déficit de pulso, taquipnea, elevación de la presión venosa central, etc.) permiten orientar el diagnóstico a otros cuadros graves con tratamiento específico: disección aórtica, neumotórax, tromboembolismo pulmonar o taponamiento cardiaco.
En todo caso, la presencia y gravedad de isquemia en las arterias coronarias se estudia inicialmente mediante procedimientos diagnósticos incruentos: el electrocardiograma, el ecocardiograma y la gammagrafía con infusión de isótopos (por ejemplo, 99Tc tetrofosmina) como procedimientos de detección de la isquemia, y la sobrecarga o pruebas de estrés mediante ejercicio o fármacos como métodos de inducirla. La indicación de las más modernas técnicas radiológicas de tomocoronariografía (TAC coronario), que permite definir la anatomía exacta de las lesiones y aporta información pronóstica, se reserva para los casos de bajo riesgo con pruebas de sobrecarga dudosas o los de riesgo intermedio.
La evaluación del riesgo en función de los resultados de las pruebas de estrés señala la indicación de coronariografía directamente si el riesgo es alto o tras comprobar la respuesta al tratamiento médico en los casos de riesgo intermedio o bajo (Alegría et al., 2012). La coronariografía es un paso previo fundamental para decidir la mejor estrategia de revascularización (intervencionismo coronario o cirugía), de ser esta factible. Las guías clínicas más recientes recomiendan precisamente el uso preferente de las técnicas de imagen de las arterias coronarias con independencia de la realización de otras evaluaciones, si bien las pruebas de estrés (sobrecarga) son las más frecuentes en la práctica, y son especialmente necesarias para confirmar el diagnóstico de angina estable o si hay un algún cambio clínico en el curso del paciente.
En la evaluación de pacientes con sospecha de síndrome coronario agudo (SCA) (Figura 3), el electrocardiograma (ECG) de 12 derivaciones es la principal herramienta diagnóstica, que debe realizarse preferiblemente en los primeros 10 minutos de atención médica10, comparándolo si es posible con registros de ECG previos. Las anomalías más frecuentes y sugestivas de isquemia miocárdica durante las crisis de dolor son las alteraciones inespecíficas del segmento ST (ascenso o descenso) o de la onda T (negativización o pseudonormalización de ondas T previamente negativas). Así, por ejemplo, la evolución clásica de un caso de SCACEST consiste en la aparición inicial de ondas T “picudas”, seguidas tras unos minutos de ascenso del segmento ST, pérdida de voltaje de la onda R con aparición de ondas Q “patológicas”, con progresiva normalización del ST en horas/días e inversión progresiva y persistente de la onda T.
Por otro lado, la medición de los marcadores bioquímicos de daño miocárdico complementa al ECG y permiten estratificar el riesgo y diferenciar entre los subtipos de SCA. Se orienta el diagnóstico de IAM cuando se elevan en sangre los marcadores más sensibles y específicos de necrosis: las troponinas cardiacas (T e I) y la creatínfosfokinasa isoenzima MB (CPK-MB); éstas, si bien reflejan el daño en el miocardio, no indican su mecanismo de aparición, de forma que un valor elevado sin evidencia clínica de isquemia obliga a buscar otras causas de lesión (entre otras, aneurismas aórticos con disección o embolia pulmonar). En los pacientes con SCACEST se produce un aumento inicial de las troponinas dentro de las primeras 4 horas aproximadamente desde el inicio de los síntomas, pudiendo estar sus niveles elevados hasta 2 semanas. En los casos de SCASEST, en cambio, se produce una elevación menor de las troponinas, que suele desaparecer a las 48-72 h.
Los pacientes con síntomas típicos sin elevación persistente (> 20 min de forma continuada) del segmento ST en al menos 2 derivaciones electrocardiográficas contiguas, pero con elevación (> 99% percentil normal) de biomarcadores de daño miocárdico son clasificados como IAMSEST. Los pacientes sin síntomas típicos y marcadores de necrosis miocárdica seriados negativos se clasifican como angina inestable. En pacientes cuyo ECG demuestra la elevación del segmento ST, antes de disponer de la concentración de troponina se hablará de SCA con elevación del ST (SCACEST), pudiendo evolucionar el diagnóstico a IAMCEST o a angina inestable según se detecte o no elevación de troponina en plasma (Gómez et al., 2012).
No obstante, en el diagnóstico de IAM debe tenerse presente la definición universal actualizada (Thygesen et al., 2019) que define la necrosis de los miocitos como una combinación de criterios que requieren la detección de un aumento o disminución de un marcador de daño miocárdico –preferiblemente troponina de alta sensibilidad– con al menos un valor por encima del percentil 99 del límite superior de referencia y, al menos, uno de los siguientes: 1) síntomas de isquemia; 2) cambios isquémicos nuevos o presumiblemente nuevos en el ECG (del ST-T o bloqueo de rama izquierda); 3) aparición de ondas Q patológicas en el ECG; 4) evidencia por técnicas de imagen de pérdida de miocardio viable o nuevas anomalías regionales de la motilidad de la pared (siguiendo un patrón compatible con una etiología isquémica); o 5) identificación de un trombo intracoronario por angiografía o autopsia.
Tratamiento
El tratamiento de la cardiopatía isquémica debe individualizarse según el tipo de paciente, bien sea éste asintomático pero con aterosclerosis coronaria significativa, o bien presente un cuadro clínico de SCC o SCA. El denominador común en todos los casos será la adopción de medidas farmacológicas y no farmacológicas para evitar, minimizar o ralentizar la progresión de la ateroclerosis, a fin de prevenir el desarrollo de complicaciones agudas. Además, se administrarán tratamientos específicos para prevenir o solucionar en lo posible las consecuencias locales de la isquemia cardiaca y se aportará a los pacientes educación sanitaria y asesoramiento sobre cuestiones como el cumplimiento de la medicación, el control de los factores de riesgo y el ejercicio regular.
En general, los objetivos de la atención médica a pacientes con cardiopatía isquémica son la evaluación de la gravedad de la enfermedad (esencial para establecer el mejor tratamiento y conocer el pronóstico), la identificación de los pacientes que pueden beneficiarse de revascularización, el tratamiento de los síntomas y la adopción de medidas terapéuticas que pueden mejorar el pronóstico. Los pacientes que presenten un riesgo bajo o moderado y que tengan su clínica controlada suelen ser tratados solo con fármacos, mientras que los pacientes que tengan un riesgo alto o continúen con clínica a pesar del tratamiento médico adecuado suelen ser sometidos a revascularización coronaria, bien mediante cateterismo o mediante cirugía. El tratamiento de los cuadros clínicos de SCC y SCA coincide en algunos aspectos, pero tienen detalles diferenciales, y se abordan por separado.
A modo de resumen previo, en la Tabla 1 se presentan los procesos fisiopatológicos subyacentes y las posibilidades de actuación preventiva y terapéutica –mediante fármacos u otros procedimientos– sobre cada uno de ellos.
1. Modificación del riesgo
El control de los factores de riesgo cardiovascular debe ser un componente central del tratamiento de todos los pacientes con enfermedad coronaria aterosclerótica que sufran una angina de pecho estable o hayan sobrevivido a un evento de SCA. Entre las medidas a tomar, destacan las siguientes recomendaciones generales, sobre las que hay una evidencia notable de su efecto beneficioso:
- Abandono radical y definitivo del tabaquismo. Si bien tiene un componente muy importante de convicción y decisión personal, pueden emplearse fármacos con tal fin, como el bupropión, la vereniclina o la nicotina (para más información, ver la revisión publicada por Mateos et al., 2019).
- Cambios terapéuticos en el estilo de vida. Un paso primordial es iniciar y mantener en el tiempo la práctica de ejercicio físico regular, bien sea por libre (siempre según recomendación médica) o en programas de rehabilitación cardiaca y actividad física de rutina. Tal y como recoge en su web la Fundación Española del Corazón, suele recomendarse evitar esfuerzos intensos e isométricos (levantar pesos, carrera rápida, ejercicios de brazos), especialmente en climas fríos o tras una comida. Se aconseja, en cambio, la práctica de ejercicio dinámico diario, aprovechando también la actividad física que exigen algunas tareas cotidianas (ir a pie o en bicicleta, subir por las escaleras, etc.). La intensidad del ejercicio variará según las características del paciente, la limitación funcional por la enfermedad y el entrenamiento previo, pero una recomendación básica suele ser la de emplear 30-60 min todos –o casi todos– los días de la semana en la práctica de ejercicio aeróbico moderado, como puede ser caminar unos 5 km o en torno a 10.000 pasos al día, pudiendo aumentar el tiempo, la distancia o la intensidad según estado físico y recomendaciones del médico. Ejercicios equivalentes serían el ciclismo o bicicleta estática (unos 30 a 60 minutos), natación suave (de 15 a 30 minutos), gimnasia acuática suave (30 a 60 minutos), carrera suave (20 a 40 minutos) o montañismo.
- Alimentación saludable. El modelo de dieta mediterránea tradicional ha demostrado los mejores resultados en la reducción del riesgo cardiovascular (Whayne et al., 2014). Se basa en limitar el consumo de alimentos con alto contenido en grasas saturadas y trans (bollería industrial, lácteos enteros, carne de vacuno o cerdo, aceites saturados, pan blanco), recomendando en su lugar el uso de aceites poliinsaturados (oliva), y limitar los hidratos de carbono refinados (azúcar, dulces, pastelería, bebidas edulcoradas, pasta, patatas). Se debe optar, en cambio, por consumir una mayor cantidad diaria de piezas de fruta y hortalizas (4 o 5 piezas/raciones), pescado (≥ 2 días/semana, de preferencia azul) y carnes magras; los cereales, las legumbres y los frutos secos también son aconsejables, cuidando su cantidad por el alto contenido calórico. Una dieta adecuada, junto con la práctica de ejercicio físico, contribuirá a la reducción del sobrepeso en pacientes que lo padezcan: se suele aconsejar una pérdida de peso progresiva en la medida de lo posible hasta valores de índice de masa corporal (IMC) óptimos de < 25 kg/m2 (en todo caso, < 30 kg/m2). Las modificaciones dietéticas o restricciones calóricas con carácter terapéutico deben siempre estar supervisadas por un médico o especialista en nutrición clínica. Dentro de la alimentación saludable, se recomienda también moderar el consumo de alcohol y restringir la ingesta de sal, especialmente en pacientes hipertensos o con insuficiencia cardiaca.
- Reducir el estrés (o evitar situaciones que puedan producirlo) y, en su caso, considerar el tratamiento de la depresión y la ansiedad subyacentes. Se desconoce el impacto de estas intervenciones en pacientes con SCC y angina estable, aunque su papel en pacientes con IAM previo está mejor establecido.
- Control de la hiperglucemia. En pacientes con diabetes mellitus y enfermedad cardiovascular, ciertos medicamentos tales como los inhibidores del cotransportador de sodio-glucosa tipo 2 y los agonistas del receptor del péptido-1 similar al glucagón disminuyen las complicaciones cardiovasculares a medio y largo plazo, por lo que serán el tratamiento de elección, solos o asociados a metformina.
- Tratamiento de la hipertensión. El objetivo de presión arterial debería ser siempre menos de 140 mm Hg de PA sistólica (si el paciente lo tolera bien, < 130 mm Hg) y menos de 90 mm Hg de PA diastólica. Puede abordarse con los diversos grupos de fármacos que comúnmente se emplean para ello, como los inhibidores de la enzima convertidora de angiotensina (IECA), los antagonistas del receptor de angiotensina II (ARAII) o los diuréticos, entre otros muchos. Los IECA y los ARAII tienen beneficios conocidos para el subconjunto de pacientes con SCC con hipertensión, diabetes mellitus, reducción de la fracción de eyección del ventrículo izquierdo (< 40%) o enfermedad renal crónica; en ausencia de tales circunstancias clínicas, es incierto si dichos fármacos tienen un efecto cardioprotector.
- Tratamiento de la hiperlipidemia. Las estatinas (Figura 4), fármacos inhibidores de la 3-hidroxi-3-metilglutaril coenzima A (HMG CoA) reductasa, han demostrado en numerosos ensayos clínicos aleatorizados una eficacia significativa y uniforme en la prevención primaria y secundaria de la enfermedad coronaria, y en las complicaciones y mortalidad asociadas. Así, en base a la evidencia disponible, se recomienda que los pacientes con angina estable sean tratados a diario y de forma temprana con una estatina de alta potencia (atorvastatina 80 mg o rosuvastatina 20 o 40 mg); en EEUU esta recomendación se hace con independencia del nivel colesterol-LDL basal, mientras que la Sociedad Europea de Cardiología (Kuuti et al., 2020) recomienda controlar las concentraciones de LDL, a menudo fijando un objetivo de reducción del 50% o < 55 mg/dl (< 40 mg/dl en pacientes que han sufrido un segundo evento vascular en un periodo de 2 años). De ser necesario, también puede añadirse al tratamiento con estatinas la ezetimiba, que potencia la reducción de colesterol-LDL incluso cuando las estatinas son muy eficaces y atenúa los subsiguientes episodios isquémicos en pacientes que han sobrevivido a un SCA, y/o los inhibidores de iPCSK9 (alirocumab, evolocumab), que pueden reducir las concentraciones de LDL en un 60% y permiten alcanzar obtener objetivos terapéuticos a largo plazo.
Terapéutica antiagregante
Por su relevancia en la reducción del riesgo cardiovascular y su extenso uso en todos los pacientes que padecen o han padecido algún evento de cardiopatía isquémica (salvo contraindicación absoluta), mención aparte merece el tratamiento antiplaquetario. Este se basa en la inhibición de la activación y la agregación de las plaquetas para evitar el riesgo de formación de trombos arteriales, y presenta un balance favorable de beneficio frente al riesgo de hemorragias.
Clásicamente se ha empleado, y se emplea ampliamente en la actualidad, el ácido acetilsalicílico (AAS) o aspirina (Figura 5) a dosis bajas, que reduce el riesgo de acontecimientos cardiovasculares adversos en un 33% en pacientes con angina estable. Actúa mediante la inhibición irreversible de la encima ciclooxigenasa-1 (COX-1) en las plaquetas, reduciendo así la producción de tromboxanos. Genera una inhibición completa generalmente con una dosis crónica de ≥ 75 mg/día, considerándose la reducción de los acontecimientos vasculares equivalente con dosis de 75 a 325 mg al día. Dado que los eventos adversos gastrointestinales que produce el AAS aumentan con la dosis, la evidencia actualmente disponible apoya el uso de 75-100 mg/día para la prevención de enfermedad coronaria en pacientes con o sin antecedentes de IAM. Tiene la ventaja de que en pacientes adherentes la eficacia del AAS en la inhibición de la COX-1 es predecible y constante y no requiere monitorizar la respuesta individual. Aunque otros fármacos como los antiinflamatorios no esteroideos (por ejemplo, ibuprofeno) son también inhibidores –reversibles– de COX-1, sus efectos adversos en el riesgo cardiovascular impiden su uso como alternativa en pacientes con intolerancia a la aspirina.
Actualmente, el tratamiento antiplaquetario dual con AAS y un inhibidor oral de P2Y12 (Figura 6) es de elección sobre el AAS solo, por su efecto sinérgico. Estos fármacos bloquean el receptor P2Y12, un receptor plaquetario de ADP que juega un papel crucial en la activación de las plaquetas y en la amplificación de la formación de los trombos arteriales. Clopidogrel (Plavix® y EFG) y prasugrel (Efient® y EFG) son profármacos de tipo tienopiridinas que bloquean irreversiblemente el receptor a través de sus metabolitos activos, mientras que ticagrelor (Brilique®) ejerce un bloqueo reversible –el más rápido, eficaz y consistente– sin activación enzimática hepática previa y es el de elección en pacientes con riesgo isquémico moderado-alto.
A pesar de que clopidogrel y ticagrelor han demostrado un efecto beneficioso cuando se combinan con el AAS en pacientes con SCA y en los sometidos a intervención coronaria percutánea (ICP), especialmente con endoprótesis liberadoras de fármacos, estas combinaciones no se han mostrado superiores al AAS solo en dosis bajas en pacientes con cardiopatía isquémica estable. No obstante, la adición al AAS a dosis bajas de ticagrelor a dosis de 60-90 mg/12 h en pacientes con antecedentes de IAM previo (entre 1 y 3 años) es superior al AAS solo en pacientes de alto riesgo tromboembólico y bajo riesgo hemorrágico. Por su parte, clopidogrel (normalmente a 75 mg/día) debe emplearse en pacientes que no toleran el AAS, o bien en pacientes que no toleren tampoco ticagrelor ni prasugrel, siendo el único fármaco compatible con anticoagulación oral.
En cualquier caso, se requiere personalizar el tratamiento antiagregante y su duración en función de la evaluación del riesgo isquémico frente al hemorrágico en cada paciente. Aunque el tratamiento con AAS puede ser crónico, se han descrito duraciones óptimas del tratamiento dual que van desde los 6 meses en pacientes con angina estable tras ICP hasta 12 meses o más para pacientes con SCA sometidos a cirugía de revascularización coronaria (Valgimigli et al., 2018).
Por otra parte, la combinación de dosis bajas de rivaroxabán (2,5 mg/12 h) con dosis bajas de AAS (80-100 mg/día) también se ha mostrado superior al AAS solo para la reducción de un criterio de valoración compuesto —muerte, IAM, accidente cerebrovascular—, incluyendo una reducción del 23% de la mortalidad, en pacientes con enfermedad coronaria estable, aunque causa más hemorragias. En pacientes con fibrilación auricular, deberá utilizarse anticoagulación —anticoagulantes de acción directa o anti-vitamina K— asociada a la terapia antiagregante durante los primeros meses tras el infarto, con duración variable según se haya realizado intervencionismo con endoprótesis. Sin embargo, pasado un año, el paciente debe dejarse solo con la anticoagulación, pues se ha visto que su asociación con antiagregantes incrementa más el riesgo de sangrado de lo que reduce el de tromboembolismo.
2. Síndrome coronario crónico
El planteamiento general del tratamiento de la cardiopatía isquémica crónica o angina de pecho estable, realizado en el ámbito ambulatorio (sin requerir ingreso hospitalario), implica necesariamente las modificaciones terapéuticas en el estilo de vida previamente mencionadas –en cuanto a tabaco, ejercicio, dieta, peso y estrés–, así como el control de factores precipitantes de la angina, como la anemia, insuficiencia cardiaca u otras enfermedades concomitantes. Requerirá también del uso de fármacos antiagregantes, antianginosos y vasculoprotectores y de procedimientos de revascularización.
Grosso modo, el tratamiento preventivo general de la enfermedad aterotrombótica se basa en la aplicación simultánea de diversas medidas farmacológicas y no farmacológicas que pretenden conseguir unos objetivos biológicos concretos, entre los que destacan: niveles de presión arterial < 130/80 mm Hg, concentración en sangre de colesterol-LDL < 70 mg/dl, de colesterol-HDL > 50 mg/dl, de triglicéridos < 150 mg/dl, niveles de glucemia preprandial de 90-130 mg/dl, de glucemia posprandial < 180 mg/dl y de HbA1c < 7% (Alegría et al., 2012).
Antes de comentar el tratamiento farmacológico específico de la angina estable, conviene recordar que serán la clínica del paciente, la respuesta al tratamiento médico y el resultado de las exploraciones realizadas en la evaluación inicial —prueba de esfuerzo, estudios de imagen con estrés, función ventricular y coronariografía— los factores que determinen qué pacientes pueden beneficiarse de la revascularización miocárdica, bien sea la intervención coronaria percutánea (ICP) o la cirugía de derivación aortocoronaria (CDC). Dichos procedimientos se realizan en el paciente con angina estable con dos finalidades: mejorar el pronóstico y aliviar los síntomas.
La revascularización está indicada en varias situaciones: a) cuando no se controla adecuadamente con el tratamiento médico óptimo e interfiere con el estilo de vida del paciente; b) cuando las características clínicas y los resultados de las exploraciones realizadas indican una alta probabilidad de que exista una enfermedad coronaria grave (prueba de esfuerzo muy positiva, afectación del tronco principal de la coronaria izquierda, estenosis proximales de las tres arterias principales u otros datos que indican la existencia de una amplia extensión de miocardio viable isquémico); y c) en casos de disfunción sistólica del ventrículo izquierdo (fracción de eyección < 50%) y datos de riesgo moderado o la presencia de isquemia en la evaluación no invasiva. En todos estos casos la coronariografía debe revelar previamente una anatomía coronaria susceptible de revascularización y en la que se haya demostrado beneficio pronóstico en los estudios.
Farmacoterapia específica
Además de uno o más de los fármacos mencionados en el apartado anterior para la minimización del riesgo cardiovascular (todos los pacientes estarán en tratamiento con al menos un antiagregante y una estatina), los tratamientos farmacológicos del paciente con angina se dividen en dos grandes grupos: los fármacos vasculoprotectores, que se aplican en todos los pacientes con cardiopatía isquémica crónica –con independencia de su sintomatología– para prevenir nuevos episodios, y los fármacos antianginosos propiamente dichos, que se aplican exclusivamente para el control sintomático rápido en las crisis de angina.
Cuando sobreviene una crisis de angina, normalmente por un esfuerzo físico, para su tratamiento sigue siendo insustituible en primera línea la nitroglicerina (Figura 7), cuyas peculiaridades de empleo deben explicarse con detalle a los pacientes: se les debe indicar que los usen al inicio de la angina o para la profilaxis de episodios anginosos cuando prevean que van a realizar una actividad que suele desencadenar angina. Se trata de un nitrato orgánico de acción corta que, al ser captado por las células de la musculatura lisa vascular, se transforma en nitritos orgánicos, y estos posteriormente en óxido nítrico (NO), el cual aumenta la producción de GMPc y da lugar a la relajación de la fibra lisa vascular y, con ello, a la vasodilatación. La vasodilatación de las arterias coronarias aumenta el aporte de O2 y reduce la isquemia miocárdica, también por la reducción de la demanda de O2 al reducir el trabajo cardiaco. Permite, además, una redistribución de la sangre en la masa muscular cardiaca, favorece la vasodilatación de vasos epicárdicos y arterias colaterales y aumenta el riego del subendocardio, región con mayor riesgo de necrosis.
Las formulaciones de nitroglicerina sublingual en comprimidos (Solinitrina® y Cafinitrina®, esta última en combinación con cafeína) y por pulverización (Trinispray®) proporcionan un alivio inmediato de la angina de esfuerzo (a los 1-3 min se inicia la acción terapéutica), más rápido con la formulación en spray. Al inicio de los síntomas agudos de la angina, el paciente debe sentarse —estar de pie promueve el síncope y estar acostado aumenta el retorno venoso y la presión de llenado del ventrículo izquierdo, lo que puede agravar la isquemia— y tomar nitroglicerina (0,3-0,6 mg en comprimido por vía sublingual y no ingerido, o 0,4 mg en aerosol aplicado debajo de la lengua y no tragado o inhalado) cada 5 minutos hasta que el dolor desaparece o se ha tomado un máximo de 1,2 mg en 15 min. Si la angina persiste tras este periodo de tiempo debe buscarse asistencia médica.
Para el tratamiento agudo podría valorarse también otro nitrato, el dinitrato de isosorbida (IsoLacer®, comprimidos de 5 mg por vía oral), si bien tiene un inicio de acción ligeramente más lento que la nitroglicerina debido a la conversión hepática a mononitrato. El efecto del dinitrato de isosorbida puede durar ≤ 1 h si el medicamento se toma por vía sublingual o persistir durante varias horas si el medicamento se toma por vía oral.
Por otro lado, en el tratamiento crónico –o de base– vasculoprotector de la angina la elección inicial del fármaco depende de la tolerancia esperada en función del perfil del paciente y de sus comorbilidades, de posibles interacciones farmacológicas con otros tratamientos, y de las preferencias del paciente tras ser informado de posibles efectos adversos. En general, cualquiera de las opciones buscará corregir los factores que producen el desequilibrio entre oferta y demanda de oxígeno en el miocardio a fin de reducir los episodios de angina y mejorar la tolerancia al ejercicio.
La recomendación más común en primera línea es la monoterapia con betabloqueantes con un efecto mantenido las 24 h del día, que en una mayoría de casos suele aportar un control suficiente (junto al uso de nitroglicerina de acción rápida en crisis). Este grupo de fármacos reduce la angina11 a través de una inhibición competitiva de los efectos miocárdicos de las catecolaminas circulantes: disminuyen la frecuencia cardiaca, la contractilidad y la presión arterial, determinantes del consumo miocárdico de O2. De tal manera, incrementan el umbral de isquemia y retrasan la aparición de los síntomas; el paciente tolerará una mayor intensidad de esfuerzo físico y mejorará su calidad de vida. No se han establecido diferencias entre ellos y todos los betabloqueantes (propranolol, carvedilol, metoprolol, etc.) son en principio igual de eficaces en el tratamiento de la angina, debiendo ajustarse su dosis a una frecuencia cardiaca de 55-60 lpm en reposo.
No deben utilizarse los betabloqueantes en los pacientes con angina vasoespástica (angina de Prinzmetal, que aparece en reposo), dado que pueden incrementar el espasmo de las coronarias e incluso empeorar los síntomas: los receptores α de las coronarias, no antagonizados por los receptores β bloqueados, pueden provocar espasmo en esas arterias. Los principales efectos secundarios de los betabloqueantes son fatiga, depresión, bradicardia, bloqueo cardiaco, broncoespasmo, vasoconstricción, hipotensión postural e impotencia.
En asociación con los betabloqueantes (si no es suficiente la monoterapia) pueden emplearse los antagonistas de los canales de calcio, si bien algunos pacientes pueden no tolerar la combinación debido a hipotensión. Los calcioantagonistas también podrían emplearse como monoterapia en primera línea en pacientes intolerantes a betabloqueantes o que continúan teniendo síntomas con ellos. En líneas generales, este grupo de fármacos permite mejorar la angina al producir vasodilatación periférica y de las arterias coronarias (reducen la vasoconstricción coronaria que aparece con el ejercicio), además de una reducción de la frecuencia cardiaca, de la presión arterial y de la contractilidad del ventrículo izquierdo, todo lo cual disminuye el consumo de O2 del miocardio; el grado en el que predomina cada una de estas acciones depende del fármaco utilizado. Puesto que no deprimen la contractilidad del corazón, pueden utilizarse, de ser necesario, en los pacientes con insuficiencia cardiaca.
Normalmente se prefieren los fármacos de tipo dihidropridínicos o de 2ª generación (amlodipino y nifedipino), que permiten reducir la taquicardia refleja producida por los betabloqueantes cuando se combinan con éstos, si bien el valor clínico incremental de la asociación es incierto. Nifedipino, de vida media corta, debe evitarse en monoterapia, ya que la rápida vasodilatación puede desencadenar un estímulo simpático que incrementa el consumo miocárdico de O2 y desencadena isquemia y angina; de hecho, en pacientes con IAM y disfunción ventricular se ha observado que nifedipino de acción rápida (disponible como Adalat®) puede aumentar la mortalidad. En cambio, amlodipino (Astudal®, Norvas® y EFG), de vida media más larga, y nifedipino si se administra en su formulación de liberación retardada (Adalat Oros® y Adalat Retard®) son eficaces en el control de la angina de pecho incluso en monoterapia, con escasos efectos adversos significativos.
También pueden emplearse los calcioantagonistas no dihidropiridínicos de vida media más larga, como verapamilo (Manidon®, Manidon HTA® y Manidon Retard®) o diltiazem (diversos medicamentos), aunque con ellos, y especialmente en la combinación con los betabloqueantes, habría que extremar las precauciones por el riesgo de un empeoramiento de insuficiencia cardiaca o de desarrollar bradicardia excesiva y/o bloqueo auriculoventricular; de hecho, estos fármacos están contraindicados en pacientes con disfunción sistólica del ventrículo izquierdo. En términos de eficacia antianginosa, verapamilo ha demostrado ser similar a metoprolol y superior en su comparación con atenolol en pacientes coronarios e hipertensos, en quienes incluso se relaciona con una menor incidencia de diabetes mellitus y de depresión. Por su parte, diltiazem tiene un mejor perfil de efectos adversos, por lo que tiene ciertas ventajas en el tratamiento de la angina de pecho.
Por último, también se recomienda como primera elección la opción de combinar un betabloqueante con un nitrato de acción prolongada (nitroglicerina, dinitrato de isosorbida y mononitrato de isosorbida), pues la asociación atenúa la taquicardia refleja producida por estos últimos. De igual modo, los nitratos podrían llegar a usarse en monoterapia de la angina de pecho, pero, por la ausencia de datos clínicos comparativos con otras opciones, suelen considerarse como terapia de 2ª línea para el alivio de la angina cuando la terapia inicial con un betabloqueante y/o un calcioantagonista no dihidropiridínico está contraindicada, es mal tolerada, o resulta insuficiente para un buen control. Los nitratos de acción prolongada son capaces de aliviar la angina, aumentar la tolerancia al ejercicio y retrasar la aparición del descenso del segmento ST, si bien su uso durante un periodo prolongado de tiempo provoca tolerancia y pérdida de eficacia, debiendo dejarse una ventana sin tratamiento de 12-14 h para evitarlo.
En el tratamiento de base a largo plazo, la nitroglicerina puede administrarse por vía oral o transdérmica a través de sistemas de parches de liberación retardada (Cordiplast®, Dermatrans®, Epinitril®, Minitran®, Nitroderm TTS®, Nitroplast® y Trinipatch®). La biodisponibilidad del dinitrato de isosorbida depende de la variabilidad interindividual en la conversión en el hígado y generalmente es menor que la biodisponibilidad de su metabolito activo mononitrato de isosorbida (Coronur®, Coronur Retard®, Dolak Retard®, Uniket®, Uniket Retard® y EFG), que es del 100%. La titulación de la dosis es esencial con todas las formulaciones para obtener el máximo control de los síntomas a una dosis tolerable. Los efectos secundarios más comunes con estos fármacos son hipotensión, dolor de cabeza y sofocos. Las contraindicaciones incluyen miocardiopatía obstructiva hipertrófica, estenosis valvular aórtica grave y uso conjunto con inhibidores de la fosfodiesterasa (sildenafilo y similares) o riociguat.
Con independencia de la estrategia terapéutica inicial, la respuesta a la terapia antianginosa debe ser reevaluada tras 2-4 semanas desde el inicio, y si la primera línea del tratamiento no es suficiente (casos refractarios), puede ser necesario complementarla con uno de los fármacos antianginosos por vía oral considerados en segunda línea. En España están disponibles los siguientes:
- Ivabradina (Corlentor®, Procorolan® y EFG): es un inhibidor selectivo y específico de la corriente If del marcapasos cardiaco que controla la despolarización diastólica del nódulo sinoauricular de Keith-Flack; da lugar a una disminución de la frecuencia cardiaca (bradicardia sinusal con reducción de unos 10 lpm) tanto en reposo como en esfuerzo sin afectar a la conducción auriculoventricular ni a la contractilidad del miocardio. Ha demostrado no ser inferior a atenolol o amlodipino para el tratamiento de la angina y la isquemia en pacientes con cardiopatía isquémica crónica. Se utiliza en dosis de 5 o 7,5 mg/12 h y, de ser necesario, puede asociarse a calcioantagonistas o betabloqueantes; en este último caso, debe vigilarse estrechamente para evitar bradicardia significativa.
- Ranolazina (Ranexa®): es una piperazina de la que no se conoce por completo el mecanismo de acción, habiéndose planteado que inhibe selectivamente la corriente tardía de entrada de Na+ en las células cardiacas y reduce los desequilibrios iónicos intracelulares durante la isquemia: se cree que la reducción de la sobrecarga de Ca2+ celular puede aumentar la relajación miocárdica y, con ello, reducir la rigidez diastólica de la cavidad ventricular izquierda. En diversos estudios ha demostrado ser eficaz en el control de la angina de pecho –reducción de la frecuencia de las crisis, del empeoramiento de la angina o de la intensificación de la farmacoterapia– sin afectar a la frecuencia cardiaca ni a la contractilidad del miocardio. Se puede agregar, incluso, como tercer fármaco a una combinación de un betabloqueante y un calcioantagonista si es necesario por persistencia de los síntomas con doble terapia o cuando la baja frecuencia cardiaca del paciente no permita incrementar la dosis del betabloqueante o del calcioantagonista no dihidropiridínico. No hay evidencia suficiente, en cambio, que apoye una eficacia significativa en pacientes con angina sometidos a ICP y con angina residual. Sus efectos secundarios incluyen mareos, náuseas y estreñimiento; además, aumenta el intervalo QTc del ECG y, por ello, debería debe usarse con cuidado en pacientes con prolongación del intervalo QTc.
- Trimetazidina (Idaptan® y EFG): es un derivado de piperazina que parece tener efecto hemodinámico neutro, sin afectar a la frecuencia cardiaca ni a la contractilidad. Mediante la preservación del metabolismo energético de las células expuestas a hipoxia o isquemia, trimetazidina previene una disminución de las concentraciones de ATP intracelular, asegurando de esta manera el funcionamiento adecuado de las bombas iónicas y del flujo transmembrana de Na+/K+, al mismo tiempo que se mantiene la homeostasis celular. Es decir, modifica el metabolismo del miocardio haciéndolo más resistente a la isquemia. La EMA confirmó que la combinación de trimetazidina (35 mg/12 h) con el betabloqueante atenolol mejora la isquemia miocárdica inducida por el esfuerzo. Diversos estudios también han demostrado su eficacia, asociado a otros fármacos antianginosos, para reducir el número de episodios de angina de pecho y el uso de nitratos. Está contraindicado en la enfermedad de Parkinson y en trastornos del movimiento, como temblor, rigidez muscular, trastornos de la marcha, y síndrome de piernas inquietas.
Por el momento, ningún estudio aleatorizado ha evidenciado cuál es el fármaco o la combinación de fármacos óptima para iniciar el tratamiento antianginoso, pero los betabloqueantes o los calcioantagonistas se consideran como opciones preferentes para iniciar la terapia. Un meta-análisis de 46 estudios y 71 comparaciones de tratamientos apoyó la combinación inicial de un betabloqueante y un calcioantagonista como la mejor estrategia terapéutica, y sugirió, además, que varios fármacos de segunda línea (nitratos de acción prolongada, ranolazina, trimetazidina, y, en menor medida, ivabradina) pueden resultar beneficiosos en combinación con un betabloqueante o un calcioantagonista como terapia inicial. No obstante, no existen datos sobre el impacto de estas combinaciones en la mortalidad y la morbilidad de la patología.
Finalmente, hay ciertos subgrupos de pacientes que requerirán un enfoque terapéutico específico (Figura 8). Por ejemplo, en el manejo de pacientes con bradicardia basal deben utilizarse fármacos que no disminuyan la frecuencia cardiaca, como amlodipino, ranolazina o trimetazidina; pueden utilizarse antes los betabloqueantes o los calcioantagonistas a baja dosis. En los pacientes con hipotensión arterial, debe darse prioridad a los fármacos que no afectan a la presión arterial, como ivabradina, ranolazina o trimetazidina. El enfoque para el tratamiento de pacientes mayores es esencialmente el mismo que para los más jóvenes: aunque muchas veces están infra-representados en los ensayos, todos los fármacos usados en pacientes más jóvenes son apropiados para el control de los síntomas de angina en adultos mayores, aunque éstos pueden experimentar más efectos secundarios (particularmente hipotensión con nitratos y bloqueantes de canales de Ca2+ y efectos del sistema nervioso central de los betabloqueantes), siendo posible que necesiten comenzar con dosis más bajas (Kuuti et al., 2020).
3. Síndrome coronario agudo
Lo más importante ante un episodio agudo de isquemia coronaria es que la persona acuda al hospital lo antes posible, siendo lo ideal que reciba atención médica en el transcurso de la primera hora desde el inicio de los síntomas, especialmente en casos de infarto agudo de miocardio. Si no fuera posible, en las siguientes horas desde que se produzca, se deberán aplicar tratamientos diversos que consigan reperfundir la zona isquémica. Estos pueden ir desde la trombólisis mediante fármacos fibrinolíticos intravenosos a la angioplastia primaria (recanalización mecánica con catéteres de la arteria obstruida), o incluso la cirugía cardiaca urgente.
El objetivo básico y fundamental (Figura 9) es conseguir minimizar la pérdida de músculo cardiaco y, con ello, conseguir que el paciente salve su vida y tenga la máxima capacidad funcional. Parece evidente que cuanto antes sea atendido y tratado el paciente, mayores posibilidades tiene de evitar daños definitivos.
Para todos los pacientes que sobreviven a un evento isquémico agudo, es crucial el control de otros factores de riesgo cardiovascular a fin de evitar las complicaciones a largo plazo: las medidas más importantes son dejar de fumar, controlar la presión arterial, la obesidad y la diabetes mellitus. Parece que el cumplimiento del tratamiento médico de por vida reduce el riesgo de presentar un acontecimiento isquémico en el futuro en hasta un 80%.
3.1. Síndrome coronario agudo sin elevación del segmento ST (SCASEST)
El SCASEST es una enfermedad coronaria inestable propensa a las recurrencias isquémicas y otras complicaciones que pueden conducir a la muerte o al IAM a corto plazo. El manejo integral de cualquier paciente con SCASEST, con independencia del nivel de riesgo, busca evitar la propagación de la trombosis con fármacos antitrombóticos y antiplaquetarios, a la vez que se trata la isquemia –corrección del desequilibrio entre la oferta y la demanda miocárdica de O2– con fármacos antianginosos y se estabiliza la subyacente placa aterosclerótica vulnerable con estatinas. Muchos casos también requieren revascularización por angioplastia percutánea o quirúrgica. Además, en un primer momento, el alivio del dolor es de suma importancia no solo por razones humanitarias, sino porque el dolor se asocia a la activación simpática que causa vasoconstricción y aumenta la carga de trabajo del corazón: a los pacientes cuyos síntomas isquémicos no remiten con nitratos y/o betabloqueantes, es razonable administrarles opiáceos por vía intravenosa mientras se espera a la coronariografía inmediata, con la desventaja de que la morfina podría ralentizar la absorción intestinal de los inhibidores plaquetarios orales; los AINES estarían contraindicados debido a su posible efecto protrombótico (Gómez et al., 2012).
Como ya se ha sugerido, el tratamiento debe ajustarse al riesgo cardiovascular del paciente, de forma que cuanto mayor sea el riesgo más probable es que se beneficie del tratamiento antitrombótico intensivo o de la angiografía coronaria y la revascularización de rutina (si la anatomía coronaria es adecuada). Ese abordaje intensivo, que también parece preferible en pacientes de más de 75 años, produce una reducción del 20-40% del riesgo de isquemia recurrente e IAM, y una reducción de alrededor del 10% de la mortalidad. En todo caso, se acepta que todos los pacientes con SCASEST –con independencia del nivel de riesgo– deben recibir inmediatamente antianginosos, antiplaquetarios y una estatina.
Farmacoterapia específicaLa guía de la Sociedad Europea de Cardiología (Roffi et al., 2015) orienta sobre el uso de los siguientes fármacos:
a) Fármacos antianginosos.
Según se ha avanzado, la nitroglicerina es un dilatador venoso (a dosis bajas) y dilatador arteriolar (a dosis más altas) que puede evitar la recurrencia de la isquemia en pacientes con angina inestable, pero no se ha establecido si reduce el riesgo de IAM. Además de por vía sublingual, cuando el dolor es mantenido o recurrente, puede utilizarse la vía intravenosa (Solinitrina® y Solinitrina Fuerte®), que tiene mayor eficacia en el alivio de los síntomas y la regresión de la depresión del ST, y es de elección en pacientes con angina recurrente, hipertensión incontrolada o signos de insuficiencia cardiaca. Bajo una estrecha monitorización de la presión arterial, la dosis se aumentará gradualmente (desde 5-10 μg/min, aumentando de 10 en 10 μg/min) hasta que remitan los síntomas y, en pacientes hipertensos, hasta que la presión arterial se normalice, excepto cuando aparezcan efectos secundarios. Entre las reacciones adversas más frecuentes por el uso de nitroglicerina intravenosa destacan: cefalea, náuseas, mareo, hipotensión y taquicardia refleja. Aparte del control de los síntomas, no hay otras indicaciones para el tratamiento con nitratos.
Por otra parte, se recomienda el tratamiento precoz con betabloqueantes para pacientes con síntomas isquémicos agudos si no hay contraindicaciones12. La evidencia de los efectos beneficiosos de estos fármacos en los SCASEST deriva de un meta-análisis de 27 estudios que mostró que el tratamiento con betabloqueantes se asoció a una reducción relativa del riesgo del 13% en la mortalidad durante la primera semana tras el infarto de miocardio (Yusuf et al., 1998). Un meta-análisis posterior, que incluyó datos de más de 73.000 pacientes, mostró una reducción del riesgo de mortalidad intrahospitalaria del 8%, sin aumento de la incidencia de shock cardiogénico (Chatterjee et al., 2013). En cambio, en pacientes con riesgo elevado de shock debe evitarse la administración precoz de betabloqueantes si se desconoce la función ventricular; tampoco deben usarse en pacientes con síntomas relacionados con vasoespasmo coronario o que consuman cocaína (pues se puede favorecer el espasmo al dejar la vasoconstricción mediada por la actividad α sin oposición por la vasodilatación mediada por la actividad β).
Así, en pacientes normotensos puede administrarse, por ejemplo, metoprolol en una dosis inicial de 25-50/6-8 h por vía oral, aumentando la dosis hasta 100 mg/12 h según la respuesta clínica. En pacientes de alto riesgo, con taquicardia o con elevación de la presión arterial, el metoprolol puede administrarse inicialmente por vía intravenosa (3 bolos de 5 mg cada uno con 5 min de diferencia), tras lo que se iniciará la administración oral. Un objetivo razonable es que la frecuencia cardiaca sea de 50-60 lpm. Pueden utilizarse otros betabloqueantes como bisoprolol, atenolol, etc., si bien ninguno de ellos debe administrarse en pacientes con insuficiencia cardiaca descompensada, hipotensión arterial, inestabilidad hemodinámica o bloqueo auriculoventricular avanzado. Otras patologías crónicas, como EPOC o la enfermedad vascular periférica, toleran los betabloqueantes sin problemas, por lo que pueden administrarse. La norma general recomienda continuar el tratamiento crónico con estos fármacos, excepto en pacientes con alto riesgo de mortalidad (clases 3 y 4 de la clasificación funcional de Killip).
En pacientes que no puedan usar los betabloqueantes o que presenten síntomas a pesar del tratamiento con nitroglicerina o con un betabloqueante, se pueden usar los antagonistas del calcio, concretamente los no dihidropiridínicos. El preferido es el diltiazem oral (30-90 mg/6 h o hasta 360 mg/24 h del preparado de larga duración), que reduce la incidencia de isquemia miocárdica y de recurrencia del IAM en pacientes con SCASEST. Diltiazem está contraindicado en pacientes con disfunción sistólica del ventrículo izquierdo o con congestión vascular pulmonar y también debe evitarse su combinación con betabloqueantes, por el citado riesgo de acción sinérgica que puede deprimir la función sistólica del ventrículo y la conducción en los nódulos sinusal y auriculoventricular. En caso de necesidad de asociación con un betabloqueante, se debe utilizar un derivado dihidropiridínico (amlodipino, nifedipino de larga duración). Los calcioantagonistas son especialmente útiles cuando existe espasmo coronario.
b) Fármacos antiagregantes.
En pacientes con SCASEST se debe administrar de forma aguda (lo más pronto posible) AAS a todo paciente sin contraindicaciones, con una dosis oral de carga de 150-300 mg (para pacientes no pretratados) y una dosis de mantenimiento de 75-100 mg/día a largo plazo, independientemente de la estrategia de tratamiento seleccionada. Además, se debe añadir al AAS un inhibidor de P2Y12 y mantenerlo durante 12 meses (excepto cuando haya contraindicaciones como un excesivo riesgo de sangrado), periodo tras el cual se mantendrá solo el AAS –de por vida–, pues reduce el riesgo de muerte o IAM en aproximadamente un 50%.
- En cuanto a la selección del inhibidor de P2Y12, hay que tener en cuenta las características del paciente, los costes y las propiedades de los fármacos:
- Se recomienda ticagrelor (dosis de carga de 180 mg, seguido de 90 mg/12 h), si no existen contraindicaciones, para todos los pacientes con un riesgo de eventos isquémicos moderado-alto (por ejemplo, troponinas elevadas), incluso para los pretratados con clopidogrel; su contraindicación la constituyen los pacientes con antecedentes de hemorragia intracraneal. La combinación de ticagrelor y AAS redujo los acontecimientos isquémicos alrededor del 15% en comparación con el tratamiento con clopidogrel y AAS, pero aumentó las hemorragias.
- Prasugrel (dosis de carga de 60 mg, seguido de 10 mg/día) será de elección en pacientes que vayan a someterse a ICP, en quienes su combinación con AAS reduce los acontecimientos isquémicos en un 20% en comparación con el tratamiento con clopidogrel y AAS (reducción del riesgo absoluto del 2,2%). No obstante, implica un aumento del riesgo de hemorragias, por lo que debe evitarse en pacientes con antecedentes de ictus, > 75 años y < 60 kg.
- Clopidogrel (dosis de carga de 300-600 mg, seguido de 75 mg/día) será la alternativa para pacientes a los que no se pueda tratar con ticagrelor o prasugrel o que requieran anticoagulación oral concomitante. La adición de clopidogrel al AAS disminuye un 20% (reducción del riesgo absoluto del 2,1%) el criterio de valoración compuesto por muerte cardiovascular, IAM no mortal o ictus; tal beneficio se aprecia desde las primeras 24 h del tratamiento y persiste durante los 12 meses del estudio, a pesar de un ligero aumento de las hemorragias.
- Los pacientes con alergia/intolerancia al AAS deben tratarse solo con un inhibidor del receptor de P2Y12, el cual debe mantenerse durante toda la vida.
Cabe destacar que junto con la terapia antiagregante dual se recomienda coadministrar un inhibidor de la bomba de protones (por ejemplo, omeprazol) para pacientes con un riesgo aumentado de hemorragia intestinal, esto es, pacientes con historia de úlcera/hemorragia gastrointestinal, tratamiento anticoagulante, uso crónico de AINE/corticoides, o ≥ 2 de los siguientes factores: edad ≥ 65 años, dispepsia, enfermedad por reflujo gastroesofágico, infección por Helicobacter pylori o uso crónico de alcohol.
Por último, se dispone de los antagonistas de la glucoproteína IIb/IIIa, que bloquean la agregación plaquetaria en respuesta a todos los posibles agonistas, y son los antiagregantes más potentes que existen. Son tres fármacos de uso por vía parenteral: el abciximab (Reopro®, recientemente anulado por la AEMPS), es el fragmento Fab de un anticuerpo monoclonal contra el receptor, la eptifibatida (Intergrilin®), un péptido, y el tirofibán (Agrastat® y EFG), una molécula peptidomimética. Reducen la incidencia de acontecimientos isquémicos recurrentes en pacientes con SCASEST a quienes se va a practicar una ICP, pero no en pacientes que reciben solo farmacoterapia. Solo se recomiendan en los pacientes con mayor riesgo trombótico, en los que durante la coronariografía se objetive una carga trombótica elevada, o bien en situaciones de rescate. En esos pacientes, se empezará la infusión del fármaco en el momento de la angiografía (y no antes, por el mayor riesgo de hemorragia) y se mantendrá en las 12-24 h siguientes a la ICP.
c) Fármacos anticoagulantes.
Las guías clínicas recomiendan instaurar, en todos los pacientes salvo contraindicación, la anticoagulación al momento del diagnóstico de SCASEST, acorde con los riesgos tanto isquémico como hemorrágico de cada paciente. A diferencia del tratamiento antiiplaquetario, que se mantendrá en el tiempo, la anticoagulación debe limitarse a la fase aguda del SCASEST.
Con independencia de la estrategia de manejo del paciente (en cuanto a fármacos antiagregantes y antianginosos usados), y especialmente en aquellos con alto riesgo de complicación hemorrágica con anticoagulantes, se aconseja el uso en primera línea de fondaparinux (Apixtra®, 2,5 mg/día vía subcutánea, durante 5 días máximo) por tener el perfil más favorable de beneficio-riesgo. Se trata de un derivado de polisacáridos sulfatados relacionado con la heparina, que inhibe de forma selectiva el factor Xa; es tan eficaz como la enoxaparina en la prevención de los acontecimientos isquémicos, pero con un 50% menos de episodios hemorrágicos importantes (2,2 vs. 4,1%), y no precisa ajuste de dosis ni monitorización. No produce trombocitopenia, pero su uso está contraindicado en pacientes con insuficiencia renal grave y en aquellos de ≤ 50 kg, y su administración aumenta la incidencia de trombosis relacionada con el catéter; por tanto, en caso de que se vaya a practicar una ICP, se prefiere la administración de heparina durante el procedimiento.
La heparina ejerce su efecto anticoagulante incrementando la velocidad de la acción de la antitrombina circulante, lo que impide que el trombo se propague, aunque no lisa los trombos existentes. Se demostró que la adición de heparina al AAS reduce la tasa de acontecimientos isquémicos en el hospital en un 33%. Puede administrarse en forma de heparina no fraccionada (HNF, bolo intravenoso de 60 UI/Kg, seguido de infusión continua de 12 UI/Kg/h13 hasta revascularización o máximo de 48 h) o heparinas de bajo peso molecular, como la enoxaparina (Clexane®, Crusia®, Hepaxane®, Inhixa® y Enoxaparina Rovi®) (1 mg/kg/12 h, vía subcutánea) o la dalteparina (Fragmin®) (120 UI/kg/12 h, vía subcutánea). Estas últimas son fragmentos de HNF que presentan un efecto anticoagulante más predecible (por lo que tienen la ventaja de que no es necesario controlar su efecto anticoagulante), con una semivida más prolongada y menos probabilidades de causar trombocitopenia que la HNF. Se prefieren sobre la HNF en pacientes con SCASEST de alto riesgo de problemas isquémicos –son similares en los de bajo riesgo– y se mantendrán mientras el paciente esté hospitalizado, hasta un máximo de 8 días o hasta la revascularización.
La bivalirudina (Angiox® y EFG), un inhibidor directo de la trombina, se ha recomendado como anticoagulante alternativo para pacientes a quienes se va a practicar una ICP, pero no suele emplearse en el abordaje inicial de un SCASEST, pues no es tan eficaz como la HNF y la combinación de heparina y un inhibidor de la GP IIb/IIIa en la prevención de acontecimientos isquémicos. Tiene la ventaja de que causa menos episodios hemorrágicos importantes, y podría usarse en pacientes con SCA que presentan trombocitopenia inducida por heparina. Por último, hay que destacar que la adición de un nuevo anticoagulante oral directo (apixabán, rivaroxabán, dabigatrán, edoxabán) a un único antiagregante plaquetario parece tener escaso efecto sobre las complicaciones cardiovasculares en pacientes con SCA (modesta reducción de episodios cardiacos adversos del 14%), pero sí aumenta de manera significativa el riesgo de hemorragia (hasta 2,2 veces), por lo que no suelen usarse. Para una mayor información sobre el uso de estos anticoagulantes orales de acción directa, se recomienda consultar la revisión de (Cuéllar, 2016a).
RevascularizaciónLa revascularización coronaria en los SCASEST alivia los síntomas de angina persistente o recurrente (a pesar de la farmacoterapia óptima), acorta el ingreso hospitalario y mejora el pronóstico, previniendo la isquemia, especialmente de pacientes de alto riesgo, y mejorando la supervivencia. En general, su mayor beneficio frente a un enfoque conservador está bien definido en pacientes con SCASEST, por la disminución de la incidencia de IAM o muerte cardiovascular; alivia los síntomas en el 90% de los pacientes con angina refractaria al tratamiento médico.
La indicación de una revascularización miocárdica y la elección del método más adecuado depende de muchos factores entre los que se incluyen el estado del paciente, comorbilidades y la determinación de la anatomía coronaria (extensión y gravedad de las lesiones). El momento óptimo para realizar tanto la angiografía como la técnica de revascularización viene definido sobre todo por la gravedad de los pacientes. Por su efecto en la reducción de la incidencia de acontecimientos cardiacos isquémicos, se acepta que pacientes con SCASEST y elevación de troponina cardiaca, de > 75 años edad o de alto riesgo para un evento posterior (con ≥ 3 variables de riesgo) deben someterse a una angiografía coronaria y, de ser posible, revascularización en las primeras 24-48 h. En pacientes de menor riesgo, el tratamiento invasivo en las 24 h siguientes al ingreso no es superior a su realización algo más tarde (60 h de mediana). Y en aquellos de bajo riesgo (niveles séricos normales de troponina, < 75 años y ≤ 2 variables de riesgo), se debe realizar una evaluación no invasiva de isquemia inducible antes del alta, practicando la angiografía coronaria y, en su caso, la revascularización, si el paciente presenta isquemia espontánea o provocable.
Si se opta por la intervención coronaria percutánea (ICP), la revascularización completa en una sola fase –con posible utilización de endoprótesis (stent) liberadoras de fármacos– es preferible a la revascularización por etapas. Cuando sea más adecuada la revascularización quirúrgica de derivación coronaria, hay que tener en cuenta que los pacientes en tratamiento con un inhibidor de P2Y12 deben suspender el fármaco (5 días antes el clopidogrel o el ticagrelor y, al menos, 7 días para el prasugrel), a fin de permitir la desaparición del efecto antiplaquetario y el riesgo de hemorragia.
3.2. Síndrome coronario agudo con elevación del segmento ST (SCACEST)
En el tratamiento del SCACEST o IAMCEST, en que se produce una interrupción completa del flujo de sangre regional al miocardio por oclusión de una arteria coronaria epicárdica, la rapidez en la aplicación de los cuidados resulta crucial14. Se puede salvar una parte del miocardio –en proporción inversa a la duración y extensión de la isquemia– si se realiza una reperfusión lo más rápida posible (en un máximo de en 3-6 h desde la aparición de los síntomas), de lo que dependerá la mejora del pronóstico del paciente. Un diagnóstico rápido y una estratificación temprana del riesgo en pacientes con SCACEST son importantes para identificar a aquellos en que una intervención temprana puede aportar el máximo beneficio. Se ha identificado la edad avanzada, una clase Killip alta, la frecuencia cardiaca elevada, la presión sistólica baja y la localización anterior del infarto como los predictores independientes más importantes en cuanto al mal pronóstico de los pacientes.
Así pues, el tratamiento del SCACEST debe comenzar de forma óptima en el mismo momento del diagnóstico. Las directrices europeas vigentes (Ibañez et al.; 2017), que se comentarán a continuación, establecen diferentes objetivos y recomendaciones según la fase que se considere: antes, durante o después del ingreso hospitalario.
En la FASE PRE-HOSPITALARIA el diagnóstico precoz pretende iniciar cuanto antes la terapia de reperfusión coronaria y evitar la parada cardiaca, que junto con la necrosis extensa del miocardio son las causas fundamentales de la morbimortalidad asociada al IAM agudo. La primera hora desde el comienzo de los síntomas es la mejor oportunidad para salvar el miocardio con un tratamiento de reperfusión. Por ello, en esta fase se busca reconocer rápidamente los síntomas y solicitar atención médica, que debe contar con un desfibrilador para tratar las arritmias graves, activar el sistema de urgencias médicas y trasladar al paciente con rapidez a una unidad coronaria en la que se pueda realizar tratamiento de reperfusión (ICP o fibrinólisis primaria). Las recomendaciones de la Sociedad Europea de Cardiología recogen un objetivo de tiempo medio entre el primer contacto médico y la reperfusión de ≤ 90 min (que pueden aumentar hasta ≤ 120 min en los pacientes que ingresan inicialmente en un hospital sin dotación de ICP15). Con el objetivo de minimizar los retrasos, si se espera que el tiempo de traslado del paciente al hospital sea largo (> 120 min), es posible administrar tratamiento fibrinolítico sobre el terreno o durante el traslado en la ambulancia.
En un primer momento, el alivio del dolor es de suma importancia tanto por razones humanitarias como por el riesgo de activación simpática, que produciría vasoconstricción y aumento de la carga de trabajo del corazón. Los analgésicos más utilizados son los opiáceos intravenosos con ajuste de dosis (por ejemplo, morfina a dosis de 1-4 mg repetidos a demanda en 5-30 min para aliviar el dolor). En el primer contacto médico también se debe administrar AAS (162-325 mg masticables) y nitroglicerina sublingual (0,4 mg cada 5 min hasta 3 dosis) si se considera adecuado; la bradicardia es una contraindicación relativa para los nitratos, pues pueden agravarla. Además, se puede considerar la administración de un tranquilizante suave –normalmente una benzodiacepina– a los pacientes con ansiedad ante el dolor y las circunstancias que implica un IAM. El aporte de oxígeno solo está indicado para pacientes hipóxicos con una saturación arterial de O2 de < 90%. El tratamiento pre-hospitalario antiagregante con ticagrelor no mejora la perfusión coronaria de los pacientes con un IAMCEST antes de la ICP.
La FASE HOSPITALARIA se inicia con la llegada del paciente al servicio de Urgencias, donde el objetivo primario será identificar la isquemia miocárdica aguda con rapidez, diferenciar entre SCACEST y SCASEST, y estratificar el riesgo del paciente (ECG, anamnesis, exploración física y biomarcadores séricos) para dirigir el tratamiento. El primer paso del mismo será la reperfusión coronaria, siempre en las primeras 12 h tras el inicio de los síntomas y cuando se verifica la elevación del segmento ST del ECG. Se recomiendan dos métodos (Figura 10):
- ICP primaria: La ICP rápida
(< 90 min desde el primer contacto médico) es el abordaje de elección para los pacientes con IAMCEST siempre que se realice en los plazos establecidos (Tabla 2). Está indicada especialmente en los pacientes que presentan shock cardiogénico, dolor torácico presente o recurrente refractario a tratamiento médico, arritmias potencialmente mortales, pacientes reanimados tras una parada cardiaca con ECG compatible con IAMCEST o con insuficiencia cardiaca aguda grave independientemente del tiempo transcurrido. En comparación con la trombólisis, la ICP primaria consigue menos mortalidad precoz, reinfartos y hemorragias intracraneales. Se recomienda, de ser necesario, utilizar endoprótesis intracoronarias liberadoras de fármacos (stents) en lugar de la angioplastia con balón, mientras que la trombectomía sistemática no aporta beneficio, por lo que solo debe realizarse en casos muy seleccionados. Debe utilizarse la vía radial en lugar de la femoral, ya que produce menos hemorragias.
- Trombólisis: la administración de farmacoterapia fibrinolítica está indicada cuando la ICP se vaya a retrasar más de 120 min y siempre durante las primeras 12 h desde el comienzo de los síntomas, si bien la amplia disponibilidad de centros dotados de ICP ha reducido su frecuencia de uso. De forma óptima, se debería iniciar inmediatamente en el servicio de urgencias (o en la propia ambulancia, si es posible) a fin de reducir el tiempo puerta-pinchazo a < 30 min. No obstante, se encuentra contraindicada en casos de hemorragia activa o diátesis hemorrágica (excepto menstruación), ictus hemorrágico o isquémico en los 3 meses previos (excepto evento isquémico agudo en las 3-4,5 h previas), neoplasia intracraneal o medular, malformación arteriovenosa, sospecha o confirmación de disección de aorta o traumatismo craneal o facial cerrado en los 3 meses previos. Si fracasa la trombólisis, e incluso en los pacientes que se reperfunden con buenos resultados con este método, se recomienda el traslado rápido a un hospital donde se pueda realizar la angiografía y la ICP de rescate lo más pronto posible (en las primeras 3-24 h posteriores a la fibrinólisis), ya que así reduce el riesgo de isquemia recidivante, reinfarto, insuficiencia cardiaca, shock cardiogénico o muerte en aproximadamente un 35%.
En general, para la fibrinólisis se prefiere un régimen acelerado en perfusión endovenosa de alteplasa (Actilyse®), un activador del plasminógeno tisular de origen recombinante que activa el paso de plasminógeno a plasmina, la cual hidroliza las redes de fibrina que forman el trombo sanguíneo. Se administra conjuntamente con heparina intravenosa. El riesgo fundamental del tratamiento fibrinolítico es la hemorragia, siendo la complicación más grave –a menudo mortal– de este tratamiento la hemorragia intracraneal, que acontece en un 0,5-1% de casos con los regímenes actuales; la edad avanzada (> 70-75 años), el sexo femenino, la hipertensión y las dosis relativas más altas de activadores del plasminógeno y heparina aumentan el riesgo de hemorragia intracraneal.
En líneas generales, el manejo inicial de los pacientes con IAMCEST debe incluir monitorización del ECG y reposo en cama durante 12 h o hasta que se alivie la isquemia y se estabilicen los parámetros hemodinámicos. Deben ingresar en una UCI de coronarios, donde puedan detectarse y tratarse precozmente las arritmias mortales, frecuentes en las primeras horas, y otras complicaciones en fase aguda. Por lo general, las complicaciones del IAM agudo han disminuido con la reperfusión precoz y el tratamiento médico moderno, pero siguen siendo una causa importante de morbimortalidad que suele requerir un tratamiento urgente, a menudo quirúrgico. Tras 1-3 días, el paciente puede ser trasladado a una planta de hospitalización normal. Desde el principio debe realizarse un programa de rehabilitación cardiaca, con la educación sanitaria adecuada.
Como complemento de la reperfusión, y con independencia de la técnica empleada, en la fase aguda de un IAMCEST la anticoagulación y la terapia antiagregante dual son las piedras angulares del tratamiento antitrombótico, de forma similar a la estrategia usada frente al SCASEST. Así, se deben usar:
- Fármacos antiagregantes. Se administrará AAS (dosis de carga de 162-325 mg sin cubierta entérica) en todos los pacientes en el momento del ingreso, salvo contraindicación, continuando posteriormente y de forma indefinida con una dosis de AAS de mantenimiento diario (75-325 mg/día). Junto al AAS, se administrará un inhibidor de P2Y12 lo más pronto posible o cuando se realiza la ICP primaria (antes o en el momento de la intervención como tarde), con las mismas dosis de carga y mantenimiento ya indicadas; el tratamiento dual se mantendrá durante al menos 1 año. Se recomienda usar los fármacos más potentes, como prasugrel o ticagrelor, cuando el riesgo hemorrágico sea aceptable. Por el contrario, se prefiere el clopidogrel en pacientes con antecedentes de ictus o ataque isquémico transitorio y en quienes se someten a trombólisis.
Otras alternativas de fármacos antiplaquetarios son: a) cangrelor, un inhibidor de P2Y12 de corta duración (semivida 3-6 min) y de administración por vía intravenosa (bolo de 30 µg/kg seguido de infusión de 4 µg/kg/min durante ≥ 2 h o hasta el fin del procedimiento), que presenta una acción de inicio/final rápido y es mejor que clopidogrel para prevenir los episodios isquémicos, aunque con un aumento del riesgo de hemorragias y mayor coste; y b) inhibidores de la glucoproteína IIb/IIIa, los cuales pueden conseguir una actividad antiplaquetaria de inicio rápido de interés para prevenir y tratar las complicaciones trombóticas durante la ICP, pero su uso se limita a los casos con mayor carga trombótica.
- Fármacos anticoagulantes. Se recomienda la administración de un anticoagulante parenteral en el momento de presentación del IAMCEST: la heparina HNF intravenosa y la bivalirudina son igual de eficaces como soporte de una ICP con tratamiento antiagregante. Los anticoagulantes se suelen suspender tras una ICP no complicada. En caso de fibrinólisis, se puede utilizar la HNF, la enoxaparina o el fondaparinux.
Los pacientes con fibrilación auricular constituyen una excepción y requieren anticoagulación crónica, en su caso con warfarina o anticoagulantes de acción directa: puede utilizarse una pauta de terapia triple (warfarina + AAS + clopidogrel) durante un periodo breve de unos 6 meses, considerando como regímenes alternativos posteriores la combinación de warfarina más clopidogrel sin AAS, rivaroxabán en dosis bajas con un inhibidor de P2Y12 (sobre todo clopidogrel) sin AAS, o rivaroxabán en dosis muy bajas (2,5 mg/12 h) más un tratamiento antiagregante doble; estos últimos regímenes se asocian a menor tasa de sangrado, sin aumento de los episodios trombóticos.
Además de todo lo anterior, la evidencia respalda que un paciente que ha sufrido un IAMCEST inicie o mantenga, desde el ingreso hospitalario, el tratamiento de alta intensidad con estatinas (80 mg/día de atorvastatina o 20-40 mg/día de rosuvastatina). Para una adecuada prevención secundaria, también hay que iniciar durante el ingreso hospitalario el tratamiento con betabloqueantes, especialmente en pacientes con taquicardia e hipertensión arterial, con la misma pauta indicada en el SCASEST. Se recomienda evitarlos en quienes padezcan una insuficiencia cardiaca activa o shock cardiogénico, si bien en aquellos con una fracción de eyección del ventrículo izquierdo < 40% tras la resolución de la insuficiencia cardiaca aguda puede ser preferible el bloqueo de receptores β con carvedilol.
Por otra parte, cuando no existen contraindicaciones (por ejemplo, hipotensión), en pacientes con un IAM anterior, disfunción del ventrículo iquierdo o insuficiencia cardiaca se debe empezar la administración de inhibidores de ECA (o bloqueantes del receptor de angiotensina II si no se toleran los IECA) en las primeras 24 h, comenzando con dosis bajas tituladas al alza según respuesta clínica. Pacientes con una insuficiencia cardiaca sintomática (fracción de eyección ≤ 40%) o diabetes son candidatos de adicionar posteriormente (a los 3-14 días) a su tratamiento un antagonista de la aldosterona como eplerenona (25 mg/día) o espironolactona (12,5-25 mg/12 h).
Pasada la fase aguda, algunos pacientes que han padecido infartos complicados pueden requerir otros tratamientos: antiarrítmicos y desfibriladores implantados si la función ventricular queda comprometida; el tratamiento de la disfunción ventricular izquierda con inhibidores angiotensínicos, betabloqueantes y diuréticos; anticoagulación si hay trombosis mural, dilatación ventricular, fibrilación auricular o antecedentes de tromboembolia en la fase aguda; e hipolipemiantes complementarios como fibratos o ácidos grasos ω-3.
Finalmente, la FASE POSHOSPITALARIA requiere que el paciente sea estratificado en su riesgo y su función cardiaca al alta (puede darse en 2-3 días en pacientes no complicados con una reperfusión adecuada) para definir el tratamiento posterior. Por lo general, al alta debe remitirse al paciente a una unidad de Prevención Secundaria Integral o rehabilitación cardiaca (si está disponible), donde realizará un programa de ejercicio físico progresivo y se completará el control de los factores de riesgo. La educación sanitaria que debe realizarse en este momento tendrá como objetivo conseguir que el paciente mantenga los hábitos saludables, incluida la práctica regular de ejercicio, a lo largo de toda su vida. Así pues, las recomendaciones de tratamientos crónicos y de cambios terapéuticos en el estilo de vida son las mismas que para pacientes con cardiopatía isquémica crónica.
Prevención
Habida cuenta del impacto sociosanitario y económico que se asocia con las enfermedades cardiovasculares y, en particular, con la cardiopatía isquémica en sus distintas formas de presentación, gran parte de los esfuerzos del sistema sanitario se orientan a potenciar la concienciación de la sociedad en una prevención cardiovascular primaria y para, una vez ha ocurrido un evento isquémico a nivel cardiaco, minimizar el riesgo cardiovascular a fin de prevenir recurrencias de los mismos, sus complicaciones y la morbimortalidad asociada. Conviene subrayar que, en la actualidad, gracias a las mejoras en los tratamientos médicos y en las técnicas de revascularización arterial, se consigue en muchos casos atenuar el daño miocárdico tras un evento coronario agudo, de forma que la mayoría de pacientes podrá volver a realizar una vida relativamente normal en un plazo breve de tiempo, pudiendo reincorporarse a su actividad diaria y laboral en un plazo medio de unas 4 semanas (con obvias excepciones individuales). Así pues, la educación sanitaria y prevención secundaria tras un primer evento cobran, si cabe, una mayor importancia.
Para identificar y comprender mejor cuáles son las medidas preventivas más eficaces y el motivo de su eficacia, se requiere tener presente dos aspectos tratados en apartados anteriores: la etiopatogenia de la cardiopatía isquémica y sus factores de riesgo (y la influencia de los mismos sobre la enfermedad aterosclerótica). Aunque en el epígrafe sobre Tratamiento se han mencionado cuáles son las medidas terapéuticas que permiten la modificación del riesgo cardiovascular, en línea con el Plan de Acción Mundial para la Prevención y el Control de las Enfermedades No Transmisibles 2013-2020 de la OMS, podemos resumir las principales estrategias preventivas de la cardiopatía isquémica en las siguientes medidas:
- Dejar de fumar y reducir el consumo excesivo de alcohol.
- Controlar las cifras de presión arterial.
- En pacientes diabéticos, monitorizar el tratamiento para controlar las cifras de glucemia.
- Alcanzar un peso corporal ideal (IMC < 25 kg/m2), evitando el sobrepeso y la obesidad.
- Reducir los niveles de colesterol sanguíneo (hasta cLDL < 100 m/dl, o incluso < 70 mg/dl en algunos casos).
- Llevar una dieta variada y sana (por ejemplo, la dieta mediterránea), que incorpore una mayor cantidad de fruta, verduras y pescado, reduciendo en la medida de lo posible los alimentos con elevado contenido en grasas (sobre todo, saturadas o trans) y el consumo de sal y azúcar.
- Evitar una vida sedentaria y realizar regularmente un ejercicio físico moderado –preferentemente aeróbico–, que contribuye decisivamente a controlar otros factores de riesgo (hipertensión, diabetes, hipercolesterolemia) e incluso a mantener el tono muscular, también del miocardio. Existen, a este respecto, programas de rehabilitación cardiaca cuyo fundamento es la realización de ejercicio físico controlado, dirigido especialmente a pacientes con antecedentes de SCA.
- Asegurar un alto nivel de adherencia al tratamiento farmacológico antianginoso, antiagregante y/o anticoagulante prescrito tras un primer evento isquémico. También se debe cumplir adecuadamente, en su caso, la farmacoterapia antihipertensiva, antidiabética o hipolipemiante.
- Aprender a controlar el estrés y la ansiedad.
Por último, hay que recordar también que, ante la situación de crisis sanitaria motivada durante el año 2020 por la pandemia mundial de COVID-19, la evidencia emergente ha demostrado que las personas con patologías crónicas subyacentes, incluidas las cardiovasculares, se encuentran en una situación más vulnerable para sufrir complicaciones de la infección por el nuevo coronavirus SARS-CoV-2. Es obvia, por tanto, la importancia de una adecuada prevención. La Federación Mundial del Corazón (World Heart Federation, WHF) ha advertido del riesgo de que los pacientes con enfermedades cardiacas eviten o retrasen la visita a sus controles médicos de rutina o, en su caso, a los servicios de emergencia de los hospitales, por el miedo al contagio. A este respecto, la WHF recuerda que los riesgos de sufrir un ataque de isquemia o un infarto sobrepasan claramente a los riesgos de contraer la infección por SARS-CoV-2, de manera que se deben cumplir las revisiones necesarias; a pesar de que la implantación de la telemedicina pueda ayudar en ciertas situaciones, no debe sustituir a las visitas regulares al médico especialista.
El papel asistencial del farmacéutico
Todos los profesionales farmacéuticos, desde sus diversos ámbitos profesionales y de competencias, pueden contribuir al adecuado asesoramiento y asistencia sanitaria a los ciudadanos y pacientes con antecedentes de cardiopatía isquémica. Si se tienen en cuenta las particularidades de la enfermedad comentadas en la presente revisión y el hecho de que la mayoría de pacientes que han sufrido un evento isquémico van a estar en tratamiento crónico ambulatorio (a pesar de que los eventos agudos requieran ingresos hospitalarios) con varios medicamentos de dispensación a nivel de oficina de farmacia, la figura del farmacéutico comunitario cobra especial relevancia en la consecución de los objetivos del proceso terapéutico, en la promoción de la prevención –primaria y secundaria– de los principales factores de riesgo y en la detección de signos de alerta para un diagnóstico precoz.
Atendiendo al hecho de que cada día más de 2,3 millones de pacientes y usuarios acuden a las más de 22.000 farmacias españolas, y que en ellas se ofrecen al año más de 182 millones de consejos sanitarios, parece evidente el enorme potencial divulgador del farmacéutico como profesional sanitario, así como su incuestionable papel para canalizar hacia el médico a personas con problemas relevantes de salud, para un estudio clínico detallado. En definitiva, la oficina de farmacia constituye un establecimiento sanitario accesible (con amplitud de horarios y sin necesidad de cita previa) y ubicuo capaz de suministrar una información rigurosa, de ofrecer un servicio de máximas garantías sanitarias con la debida confidencialidad, y de promover un mejor uso de los medicamentos a fin de prevenir los problemas relacionados con los mismos. Facilita, además, la disponibilidad de los medicamentos usados en el tratamiento de base de la cardiopatía isquémica y en el control de los factores de riesgo, con claras implicaciones en la sostenibilidad del Sistema Nacional de Salud.
En ese contexto, la proximidad y accesibilidad del farmacéutico comunitario para los pacientes y ciudadanos permite que pueda ejercer una labor sanitaria proactiva a través de los Servicios Profesionales Farmacéuticos Asistenciales. Con la integración efectiva del farmacéutico en los equipos multidisciplinares de atención primaria y hospitalaria, se pueden identificar varias vías asistenciales de actuación para con los pacientes con cardiopatía isquémica activa o antecedentes de la misma.
Educación sanitaria orientada a la prevención
Sin duda alguna, la medida global más eficaz y eficiente desde la perspectiva de salud pública en el ámbito de cualquier enfermedad cardiovascular es la prevención primaria, esto es, la actuación sobre los factores de riesgo modificables antes de que se produzca un primer evento. A este respecto, el farmacéutico comunitario está en una posición privilegiada para transmitir a pacientes y ciudadanos una información veraz –con rigor científico pero en un lenguaje adaptado al nivel sociocultural del receptor– sobre el riesgo cardiovascular y consejos sobre las distintas medidas profilácticas y modificaciones saludables del estilo de vida consignadas en el apartado previo sobre Prevención.
Cabría destacar, entre ellas, la conveniencia del abandono del hábito tabáquico y del consumo excesivo de alcohol, la realización de ejercicio físico moderado y regular, llevar una dieta variada y sana (siendo la dieta mediterránea un modelo idóneo), evitar el sobrepeso y controlar periódicamente parámetros ligados al mantenimiento de la salud cardiovascular: presión arterial, glucemia y colesterolemia. Es crucial explicar el porqué de cada medida de ayuda para que los pacientes (y sus cuidadores, dado el caso) la acepten y la apliquen racionalmente.
No menos importante es reincidir en la formación sobre tales medidas ante un paciente que ha sufrido un evento de cardiopatía isquémica aguda o que presenta un síndrome coronario estable, a fin de prevenir recurrencias y reducir las complicaciones y mortalidad asociadas (prevención secundaria). Habida cuenta de que la deambulación y el alta tempranas son la mejor opción para pacientes sin complicaciones que han sufrido eventos coronarios agudos, el tiempo disponible para promover la prevención secundaria es muy corto, por lo que es muy importante la estrecha colaboración entre todos los profesionales sanitarios responsables de la asistencia a estos pacientes.
A la hora de afrontar la recuperación de un SCA, como un infarto de miocardio, es importante transmitir, con la sensibilidad adecuada, que se trata de un proceso que requiere un tratamiento farmacológico múltiple y crónico, en el que una estrecha adherencia es fundamental, pero que no impide que los pacientes lleven una vida prácticamente normal (aunque con algunas limitaciones de actividad física).
En todos los casos, el farmacéutico puede y debe aportar a los pacientes información relevante sobre: a) los medicamentos usados en el tratamiento antianginoso y en el control de los factores de riesgo (estatinas, betabloqueantes, nitratos, antihipertensivos, antidiabéticos, antiagregantes, anticoagulantes): incidiendo sobre su objetivo y mecanismo, las peculiaridades de conservación (si las hubiera), el momento óptimo de administración, la posibilidad e importancia de interacciones con otros medicamentos (incluidos los de automedicación), etc.; y b) su pauta de administración: se puede aconsejar la adaptación de la toma coincidiendo con eventos cotidianos o aportar diagramas que ayuden a relacionar la medicación con hábitos de vida.
Además, conviene transmitir a los pacientes otros aspectos importantes relacionados con su patología, de vertiente más social. Por ejemplo, se debe recordar que la normativa vigente en España (RD 1598/2004) no permite la conducción de vehículos en las primeras 4 semanas tras un SCA o una angioplastia coronaria, ampliándose ese periodo hasta los 3 meses posteriores a una cirugía de derivación arteriocoronaria (bypass). También se puede orientar a los pacientes a que se enrolen en asociaciones de pacientes, como es el caso de Cardioalianza (https://cardioalianza.org/), la principal asociación española de pacientes del corazón, que normalmente cuentan con puntos de atención especializados dedicados a mejorar la calidad de vida y el bienestar de las personas con ECV.
—El farmacéutico comunitario tiene una posición privilegiada para la educación sanitaria sobre riesgo cardiovascular a toda la población—
Detección precoz y diagnóstico temprano
En línea con el apartado anterior, en aras de una adecuada prevención, el farmacéutico puede contribuir al control de los factores de riesgo mediante ciertas determinaciones de parámetros biológicos susceptibles de llevarse a cabo en el ámbito de la farmacia comunitaria, que permitirán identificar personas –sintomáticas o no– que tengan un alto riesgo cardiovascular o no estén adecuadamente controladas, a fin de asesorarlas de forma individualizada sobre la adopción de medidas eficaces de control. En su caso, se puede proceder también con su derivación a la consulta médica de Atención Primaria o directamente al servicio de Urgencias en caso de detectar signos de alerta.
Las actuaciones dirigidas a una detección precoz serían las siguientes:
- Conocimiento y revisión del historial de enfermedades cardiovasculares y metabólicas (en especial, diabetes tipo 2) diagnosticadas previamente y del estado de su tratamiento.
- Determinación de la glucemia y de la colesterolemia, mediante sencillas pruebas analíticas.
- Determinación del IMC a través de la medida de peso y altura.
- Determinación de la tensión arterial. Para una mayor información sobre la técnica y la conveniencia de recomendar la Automedida Domiciliaria de la Presión Arterial (AMPA), se puede consultar la sección específica en (Cuéllar, 2016b).
- Detección de –y lucha contra– los estilos de vida no saludables: inactividad física, consumo excesivo de alcohol, tabaquismo, consumo de drogas y tóxicos, o dieta inapropiada (exceso de calorías, grasas o sal). En este punto, se puede aportar un asesoramiento específico sobre las posibles medidas farmacológicas para la deshabituación tabáquica.
- Vigilancia estrecha del consumo de medicamentos y otros productos por mujeres embarazadas.
Según se ha indicado en el apartado de Tratamiento, en los casos de SCA (y, especialmente, de IAMCEST), resulta fundamental minimizar el tiempo hasta que se recibe la atención médica, facilitando un diagnóstico lo más precoz posible. Puesto que el máximo retraso hasta la reperfusión de un paciente viene determinado por el tiempo que tarda el paciente en llamar para pedir ayuda, el farmacéutico puede contribuir a su minimización ante pacientes que puedan presentarse en la farmacia aquejados de alguno de los signos de alarma sugerentes de un infarto de miocardio o ataque cardiaco:
- Dolor fuerte u opresión en el pecho o en la espalda entre los hombros, o bien en otras zonas de la parte superior del cuerpo (brazos, cuello, mandíbula, parte superior del estómago). La severidad del dolor puede variar e incluso empeorar: si aparece u ocurre con más frecuencia o en estado de reposo, puede ser indicativo de isquemia aguda. Ante la duda, todo dolor torácido debe ser evaluado por un médico.
- Falta de aliento.
- Sudoración fría repentina.
- Cansancio inusual o inexplicable.
- Sensación de mareo o aturdimiento.
Frente a cualquiera de esos supuestos, la actuación del farmacéutico será la de remitir al paciente al servicio de Urgencias del hospital más próximo para una atención especializada.
Cuando no sea posible disponer de ayuda especializada a tiempo, cabría una intervención de emergencia. En algunas ocasiones, la oficina de farmacia es el destino provisional de pacientes que han experimentado crisis cardiovasculares espontáneas en plena calle o en un domicilio próximo, y al que se recurre si no es posible disponer inmediatamente de una atención médica específica de urgencia. A fin de afrontar esas situaciones, como profesional sanitario, siempre es positivo manejar conocimientos de la técnica de reanimación cardiopulmonar (RCP) para actuar ante una posible parada cardiaca, que puede ocurrir en cualquier lugar y situación, mayoritariamente lejos de un hospital. Las posibilidades de supervivencia de una persona en parada cardiorrespiratoria aumentan en un 70% si se actúa antes de que lleguen los equipos de emergencias, a poder ser durante los 4 primeros minutos.
Tras reconocer que un paciente ha sufrido una parada cardiaca (pérdida del conocimiento, desmayo, inmovilidad y ausencia de respiración y de respuesta a palabras/estímulos físicos), lo primero que se debe hacer es avisar al número de emergencias (llamando al 112), para seguidamente iniciar un masaje cardiaco. En líneas generales, éste se realiza solo con las manos: colocando al paciente boca arriba sobre el suelo con brazos y piernas alineados sobre una superficie rígida y con el tórax al descubierto, hay que situarse de rodillas en el suelo con los brazos extendidos (sin doblar los codos) y comenzar a comprimirle el centro del pecho con ambas manos entrelazadas a un ritmo de 100-120 compresiones por minuto; idealmente, se hará bajar el tórax 5 cm en cada compresión. Tras varios minutos de masaje cardiaco, puede iniciarse la ventilación (el boca a boca), para lo cual se debe tapar la nariz del paciente e insuflarle aire en la boca a un ritmo de 2 ventilaciones por cada 30 compresiones; puede comprobarse si la maniobra está siendo efectiva si el pecho se eleva. Es conveniente que varias personas se alternen en la maniobra para mantener un ritmo constante, y no interrumpir el ciclo hasta que el paciente recupere la respiración de forma espontánea o hasta que lleguen los servicios de emergencias.
Adicionalmente, la desfibrilación también puede usarse en casos de parada cardiorrepiratoria en un paciente inconsciente. En muchos lugares públicos, incluyendo algunas oficinas de farmacia, existen desfibriladores externos automáticos (DEA) que permiten su uso en emergencias sin necesidad de personal sanitario especializado. Reconocen la arritmia y proporcionan instrucciones precisas de cómo proceder por medio de una locución. El proceso consiste en colocar unas pegatinas en el pecho del paciente y esperar a que el aparato indique si hay que realizar o no una descarga. En caso afirmativo, es importante no tocar al paciente y confirmar la descarga en el botón correspondiente. Y, a continuación, reanudar el masaje cardiaco hasta que lleguen los servicios de emergencias.
Optimización de la terapia farmacológica
Una vez establecido el diagnóstico de cardiopatía isquémica y el tratamiento por el cardiólogo, como profesional sanitario experto en el medicamento, el farmacéutico debe velar por el uso seguro y eficaz de los mismos, para que los pacientes alcancen el máximo beneficio clínico. Esto es aplicable tanto en el entorno hospitalario, donde acudirán los pacientes en los casos de SCA, como, con igual o mayor relevancia, en el ámbito comunitario para pacientes con angina estable o recuperados tras un SCA. Conviene recordar que el farmacéutico comunitario conoce toda la medicación que utiliza un paciente ambulatorio, no solo la medicación prescrita frente al problema cardiaco, sino también los tratamientos para enfermedades concomitantes, medicamentos que no necesitan prescripción, el uso de complementos alimenticios, etc.
En el momento de la dispensación de cualquier medicamento prescrito en el curso de la enfermedad, el farmacéutico comprobará que el paciente cuente con toda la información necesaria para que el uso del mismo sea efectivo y seguro. Para ello, hay que averiguar si existe algún criterio que impida la dispensación, tal como: alergia a algún componente del medicamento, una contraindicación absoluta, interacciones con otros medicamentos (o alimentos), una duplicidad o una situación fisiológica especial, como puede ser el embarazo o lactancia. Si es la primera vez que el paciente va a utilizar un medicamento, la labor del farmacéutico será asegurar que la persona sale de la farmacia conociendo para qué es ese medicamento y cuál es su correcto proceso de uso. Si no fuera la primera vez (dispensación de continuación), el farmacéutico evaluará si dicho medicamento está siendo eficaz y seguro, fundamentalmente verificando si ha habido cambios en el tratamiento (dosis, pauta posológica, duración, adición de nuevos medicamentos, etc.) y si el paciente ha experimentado algún problema de seguridad que pudiera hacer sospechar de una posible reacción adversa, interacción, contraindicación, etc. Además de los medicamentos prescritos, en muchas ocasiones el propio paciente solicitará consejo al farmacéutico sobre los diferentes síntomas que van apareciendo.
Como en tantas enfermedades que requieren tratamiento crónico, la adherencia terapéutica ha sido descrita como uno de los factores de mayor influencia sobre los resultados de la farmacoterapia en la cardiopatía isquémica. Si bien los pacientes que han sufrido un SCA suelen cumplir adecuadamente los tratamientos en las etapas inmediatamente posteriores al evento isquémico (son conscientes de la gravedad de la enfermedad y del riesgo de recurrencia y mortalidad), la promoción de la adherencia a los tratamientos de base en la prevención secundaria posterior, o también de la angina de pecho estable, es una de las facetas que pueden reforzarse desde la farmacia comunitaria. Las estrategias para asegurar que el paciente se involucre voluntariamente en su tratamiento deben desarrollarse de forma personalizada, con el paciente y la familia, fomentando su confianza en los fármacos administrados; pueden incluir información verbal y escrita y recursos interactivos, debiendo siempre recordarse que las consecuencias de la falta de adherencia pueden ir desde un empeoramiento de la calidad de vida, una falta de control de la enfermedad y una mayor probabilidad de complicaciones, hasta la aparición de efectos secundarios o incluso de mortalidad. Todo ello, además, puede suponer ingresos hospitalarios adicionales y otras intervenciones sanitarias que impliquen ineficiencia del gasto farmacéutico y sanitario.
A este respecto, los pacientes con cardiopatía isquémica en tratamientos crónicos –particularmente, aquellos de edades avanzadas– pueden beneficiarse de la realización de un servicio personalizado de dispensación (SPD) en la farmacia comunitaria, empleando dispositivos que permiten una adecuada distribución de los medicamentos para su administración en el horario adecuado. La revisión sistemática de estos dispositivos por el farmacéutico puede facilitar el control de la adherencia al tratamiento y, en consecuencia, la mejora de éste.
Por otra parte, tras una dispensación de inicio o de continuación, y especialmente en los tratamientos prolongados, un adecuado seguimiento farmacoterapéutico (ofrecido por el farmacéutico de forma rutinaria, sistematizada y registrada/documentada, con reuniones periódicas con el paciente) permitirá detectar, atenuar y resolver la posible aparición de resultados negativos y problemas relacionados con la farmacoterapia. La farmacovigilancia ante posibles reacciones adversas (con su correspondiente notificación, en su caso, al Sistema Nacional de Farmacovigilancia), y la identificación y prevención de interacciones farmacológicas y contraindicaciones de los tratamientos antianginosos y vasculoprotectores16 revertirán en una mejor calidad de vida de los pacientes con cardiopatía isquémica. Además, mediante una actitud vigilante, la detección precoz desde la oficina de farmacia de los signos y síntomas que acompañan a una posible refractariedad a una línea de tratamiento (dolor torácico con un menor nivel de actividad física, alteración de parámetros biológicos, etc.) también puede contribuir a activar la ruta asistencial que asegure un cambio de tratamiento temprano.
Dentro de la labor asistencial farmacéutica en relación con los medicamentos usados en cardiopatía isquémica, un aspecto de especial relevancia desde una perspectiva de la salud pública es combatir algunos tópicos erróneos que se manejan habitualmente en la población e incluso inundan las redes sociales, como, por ejemplo, los siguientes:
- Uno de los más comunes es considerar que el ácido acetilsalicílico es un remedio antiguo y que, por tanto, está superado. Nada menos cierto: diversos estudios controlados y meta-análisis han demostrado que el AAS es uno de los fármacos más eficaces en la prevención de nuevos episodios de isquemia coronaria y, además, reduce el riesgo de otros eventos vasculares, sobre todo de ictus.
- Puede plantearse por los pacientes que, dado que el AAS es tan importante para la prevención secundaria de eventos coronarios, podrían usarse dosis mayores que las normalmente prescritas (75-100 mg/día) para alcanzar una mayor protección. Esto también debe ser desmentido, en base a que el efecto antiagregante plaquetario, en que se basa la utilidad profiláctica del AAS en cardiopatía isquémica, se manifiesta especialmente con dosis inferiores a 300 mg/día y, sobre todo, las complicaciones hemorrágicas son notablemente inferiores a las que se asocian al empleo de dosis mayores.
- Es bastante corriente entre pacientes con antecedentes de patología coronaria la creencia de que llevar permanentemente un parche de nitroglicerina (en ocasiones, incluso están convencidos de que hay que llevarlo justo encima del corazón) les protege de futuras complicaciones. Se trata de un error de concepto, ya que la nitroglicerina no tiene efecto preventivo, sino únicamente antianginoso en ataques agudos.
- El clopidogrel es un profármaco que se metaboliza por la vía del citocromo P-450 para convertirse en su forma activa. Algunos polimorfismos genéticos, presentes en el 15-20% de las personas, enlentecen el metabolismo del profármaco y disminuyen el grado de inhibición plaquetaria. Los inhibidores de la enzima CYP2C19 (por ejemplo, omeprazol, esomeprazol, ketoconazol, fluoxetina, etc.) no deberían administrarse junto con clopidogrel, pues pueden reducir su efecto antiplaquetario, si bien no se han observado claras repercusiones clínicas.
- Otro antiagregante plaquetario, ticagrelor, también se metaboliza por el citocromo P-450 hepático, en su caso por la isoenzima CYP3A; en consecuencia, no debe ser empleado junto con inhibidores (antifúngicos azólicos, claritromicina, ritonavir, etc.) o inductores potentes (carbamazepina, hipérico, rifampicina, fenitoína, etc.) de dicha isoenzima.
- No debe recomendarse la utilización de sildenafilo y otros inhibidores de la fosfodiesterasa 5 (tadalafilo, vardenafilo) en pacientes coronarios con disfunción eréctil que están en tratamiento con nitratos o nitroglicerina transdérmica; los nitratos no se administrarán en las 24 h siguientes al uso de sildenafilo o vardenafilo, o en las 48 h posteriores al uso de tadalafilo. También está contraindicado su uso en pacientes con tensión arterial baja, ya sea espontánea o inducida por fármacos.
- En pacientes con angina estable en tratamiento con betabloqueantes, la interrupción de los mismos debe realizarse de forma progresiva –no brusca– para evitar efecto rebote. Lo mismo ocurre con los nitratos orgánicos de acción larga.
- El tratamiento preventivo con ácido acetilsalicílico y estatinas debe administrarse de por vida. Es un error suspenderlos (salvo por intolerancia o indicación del médico), incluso aunque se alcancen niveles de colesterol normalizados. No se deben se interrumpir dichos tratamientos sin que lo indique el médico.
Por último, conviene recordar y tener presente algunos conceptos sobre el perfil beneficio-riesgo de los tratamientos más comúnmente empleados en cardiopatía isquémica, entre los que podemos destacar:
Se confirma la caída de hidroxicloroquina como tratamiento de la infección por coronavirus
Habiéndose comentado ampliamente en números anteriores de PAM los resultados clínicos que se han ido divulgando para la hidroxicloroquina en el tratamiento de la COVID-19, se puede destacar ahora la reciente publicación de una revisión sistemática y meta-análisis de la evidencia disponible al respecto.
Para este trabajo, los autores recopilaron todos los artículos publicados (e incluso aquellos pre-publicados, no aceptados aún en revistas científicas tras revisión por pares) hasta el 8 de junio de 2020. Seleccionaron y revisaron un total de 12 estudios observacionales y 3 ensayos clínicos aleatorizados, que incluyeron datos de 10.659 pacientes, de los cuales 5.713 recibieron tratamiento con cloroquina/hidroxicloroquina y 4.966 recibieron tratamiento de soporte estándar. Evaluaron los resultados de eficacia y seguridad de los distintos estudios mediante el enfoque del riesgo de sesgos de la Cochrane y la Escala de Newcastle Ottawa, definiendo la calidad de la evidencia en base al sistema GRADE.
Los resultados les permiten concluir que la eficacia de la hidroxicloroquina no fue consistente entre los distintos estudios, y que dicho fármaco no mejora los resultados clínicos. El meta-análisis de los datos apunta a que no hubo una reducción significativa de la mortalidad con el uso de hidroxicloroquina en pacientes ingresados, en comparación con el tratamiento estándar (riesgo relativo o RR= 0,98; IC95% 0,66-1,46); tampoco en el tiempo hasta la resolución de la fiebre (diferencia media: -0,54 días; IC95% -1,19-0,11) o en la variable de deterioro clínico o desarrollo de síndrome de distrés respiratorio (RR: 0,90; IC95% 0,47-1,71). Además, se confirma un mayor riesgo de anormalidades en el electrocardiograma o arritmias con el uso del fármaco (RR: 1,46; IC95% 1,04-2,06).
A pesar de que la calidad de la evidencia se consideró baja para los mencionados resultados, estas conclusiones –unidas a las del ensayo clínico RECOVERY (ver PAM 435)– confirman que la hidroxicloroquina no es eficaz como tratamiento de la COVID-19, si bien aún queda por determinar si ejerce un beneficio en el contexto de prevención de la infección. También es necesario elucidar su papel en el tratamiento de la infección leve-moderada.
- Elavarasi A, Prasad M, Seth T, Sahoo RK, Madan K, Nischal N et al. Chloroquine and Hydroxychloroquine for the Treatment of COVID-19: a Systematic Review and Meta-analysis. J Gen Intern Med. 2020; 10.1007/s11606-020-06146-w. DOI: 10.1007/s11606-020-06146-w.
¿Es la anticoagulación sinónimo de mayor supervivencia a la COVID-19?
Según avanzamos en esta misma sección de PAM 433, diversos grupos de investigación continúan profundizando en el papel del estatus de coagulabilidad de la sangre como un marcador determinante de la mortalidad por la COVID-19, habida cuenta de que la generación de eventos tromboembólicos (ictus o infartos) se asume ya como uno de los procesos fisiopatológicos que en mayor medida complica el manejo clínico y el estado de los pacientes. Se acaban de publicar a este respecto los resultados de un análisis retrospectivo de la asociación de la anticoagulación con la tasa de mortalidad, de intubación y de hemorragias mayores. Los autores evaluaron, además, el efecto de la anticoagulación terapéutica o profiláctica (en función de la dosis) administrada en las primeras 48 h desde el ingreso hospitalario. Para ello, emplearon los datos clínicos de 4.389 pacientes (44% mujeres, media de edad 65 años) con diagnóstico de COVID-19 que habían ingresado en 5 hospitales de Nueva York entre el 1 de marzo y el 30 de abril de 2020, quienes podían haber sido tratados con uno de hasta 6 regímenes distintos (anticoagulantes orales, o heparina subcutánea o intravenosa).
Los resultados revelan que, en comparación con aquellos pacientes que no recibieron ningún fármaco anticoagulante (N= 1.530, 34,9%), quienes fueron tratados en cualquier momento con dosis terapéuticas (N= 900, 20,5%) y profilácticas (N= 1.959; 44,6%) de anticoagulantes presentaban una mortalidad intrahospitalaria reducida, con un riesgo de muerte un 47% (HR: 0,53; IC95% 0,45-0,62) y un 50% menor (HR: 0,50; IC95% 0,45-0,57), respectivamente. También presentaban una menor tasa de intubación, con una reducción del riesgo del 31% (HR: 0,69; IC95% 0,51-0,94) y del 29% (HR: 0,72; IC95% 0,58-0,89), respectivamente. Cuando el tratamiento anticoagulante se iniciaba en las primeras 48 h tras el ingreso, no había diferencias estadísticamente significativas entre las dosis terapéuticas y profilácticas, aunque las cifras de supervivencia eran numéricamente favorables a las dosis terapéuticas. Adicionalmente, los autores observaron que el riesgo de hemorragias no difería excesivamente en base al uso de anticoagulantes: se verificaron hemorragias severas en 27 pacientes (3%) del grupo de dosis terapéuticas de anticoagulantes, 33 (1,7%) del grupo de dosis profilácticas y 29 (1,9%) del grupo de los pacientes no anticoagulados.
Si bien aún se requieren ensayos clínicos prospectivos y controlados que aporten una evidencia sólida para la anticoagulación sistemática en el manejo de pacientes con COVID-19, la asociación de tal estrategia con una menor mortalidad y tasa de intubación en pacientes hospitalizados defiende que puede ser una opción muy eficaz. Entre los regímenes posológicos de anticoagulantes, parece que pueden ser preferibles las dosis terapéuticas, y que, específicamente, los regímenes más eficaces serían las dosis terapéuticas de apixabán oral y las terapéuticas y profilácticas de heparinas de bajo peso molecular por vía subcutánea, aunque esto también debe confirmarse. Además, el ligero mayor riesgo de hemorragias con dosis terapéuticas de anticoagulantes sugiere que se debe evaluar el balance beneficio-riesgo de forma individualizada en cada paciente.
- Nadkarni GN, Lala A, Bagiella E, Chang HL, Moreno P, Pujadas E et al. Anticoagulation, Mortality, Bleeding and Pathology Among Patients Hospitalized with COVID-19: A Single Health System Study. J Am Coll Cardiol. 2020; S0735-1097(20)36408-1. DOI: 10.1016/j.jacc.2020.08.041.