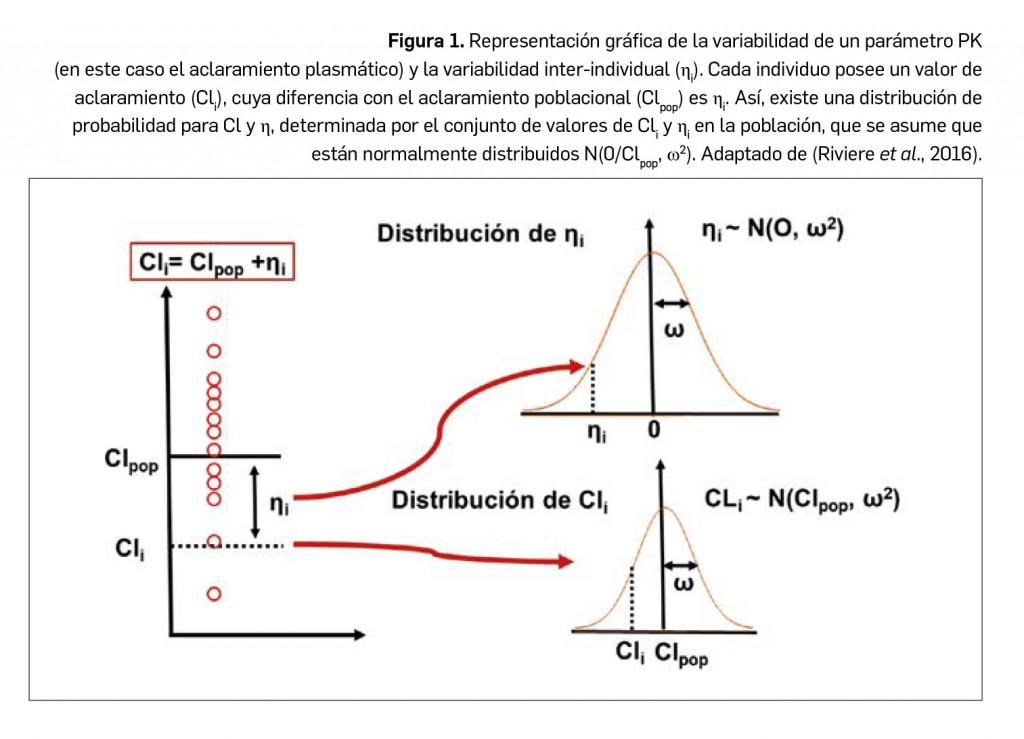
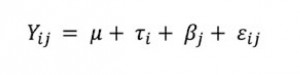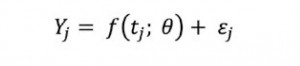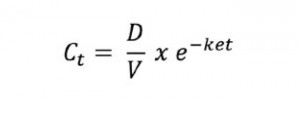Queridos lectores,
Habiendo transcurrido más de un tercio de este atípico año 2020, no podemos sino recordar desde este editorial con nuestro mayor afecto a todas las personas que han fallecido durante la crisis sanitaria generada por la pandemia de COVID-19 que aún estamos combatiendo, y expresar nuestras más sinceras condolencias a todas aquellas familias que han sufrido alguna pérdida de seres queridos. Hacemos un recuerdo especial a todos los profesionales sanitarios –y, si se nos permite, con mayor cariño a los 16 farmacéuticos y 2 técnicos en Farmacia– que han luchado hasta sus últimos días aportando su grano de arena para que el resto de la sociedad pueda superar esta pandemia. A ellos, desde estas líneas, nuestro más sincero y profundo homenaje.Poco a poco se van conociendo algunos datos preliminares de ensayos clínicos, por ahora de tamaño reducido, y se tiene constancia de un número creciente de estudios aprobados por las agencias regulatorias con diversas opciones experimentales que se están evaluando frente al SARS-CoV-2. En su mayoría, fármacos aprobados contra otras patologías: es el llamado reposicionamiento terapéutico. Algunos de los resultados ya divulgados se comentan en este nuevo número de Panorama Actual del Medicamento –por ejemplo, para remdesivir o hidroxicloroquina–, si bien no son aún concluyentes de una eficacia que permita su autorización para el uso sistemático contra la COVID-19. Debemos esperar a que se publiquen los datos de ensayos en marcha para extraer conclusiones sólidas. Y lo mismo ocurre con el desarrollo de la ansiada vacuna, aunque bien deberíamos hablar en plural: se están desarrollando más de 100 candidatos a nivel internacional, pero solo unos pocos han entrado en las fases clínicas de su investigación. Creemos que debe imperar la paciencia y la cautela ante las noticias que puedan ir surgiendo, pero confiamos, alineados con los mayores expertos en la materia, en que se dispondrá de una vacuna eficaz y segura en plazos de tiempo razonables, no inferiores a 6-12 meses.
En otro orden de cosas, aprovechando que el primer martes del mes de mayo se celebra anualmente el Día Mundial del Asma, este número 433 de PAM se inaugura con una revisión monográfica sobre esta patología respiratoria crónica, de gran prevalencia a nivel mundial y con un elevado impacto socioeconómico y sobre la calidad de vida de los pacientes; se revisa ampliamente el conocimiento sobre su etiopatogenia y el estado actual de su epidemiología y su tratamiento, que en líneas generales permite un adecuado control de las manifestaciones clínicas. Se incluye también un interesante artículo de revisión, desde un prisma clínico de Atención Primaria, sobre los cuadros dolorosos del raquis, algunos tan frecuentes como la lumbalgia o la cervicalgia, haciendo referencia a su terapéutica específica.
Con respecto a la evaluación de medicamentos con nuevos principios activos comercializados por primera vez en España, a lo largo del mes de abril solo se incorporó al mercado farmacéutico el risankizumab, un anticuerpo monoclonal específico frente a la subunidad p19 de la proteína IL-23, que ha sido autorizado para el tratamiento de la psoriasis en placas moderada-grave en adultos candidatos a tratamiento sistémico. Comparte mecanismo de acción con los previamente comercializados guselkumab y tildrakizumab, y sus resultados clínicos son similares, por lo que no parece que vaya a representar una innovación terapéutica significativa. Se vislumbra, no obstante, que el mes de mayo trae alguna novedad interesante que analizaremos en el siguiente número de PAM.
Esperamos, queridos lectores, que disfruten de la lectura y que estas páginas nos aporten algo de esperanza en estos difíciles momentos donde la ciencia se nos muestra, más que nunca, como el único horizonte capaz de devolver a nuestras vidas la normalidad deseada. Cuídense.