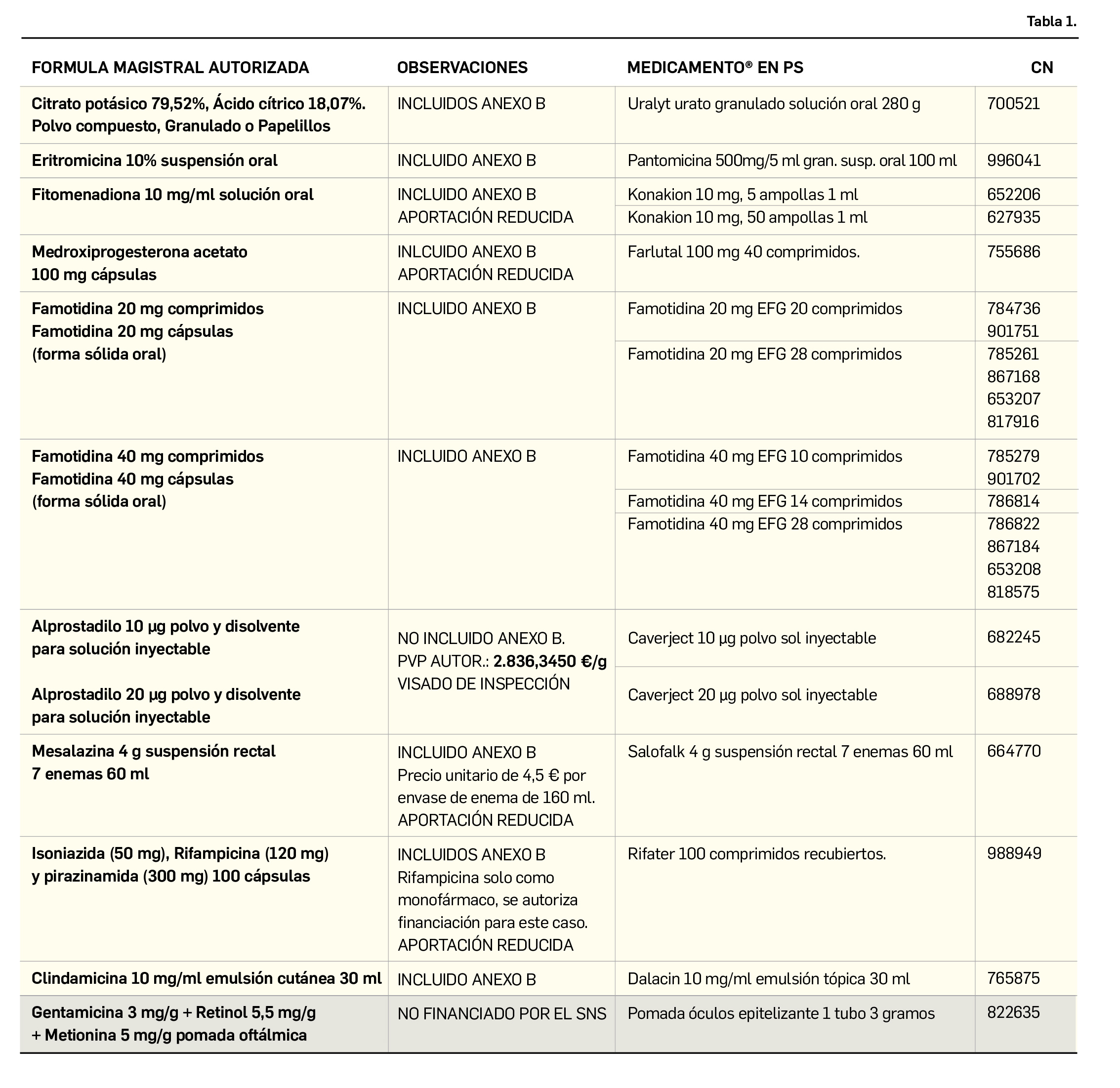
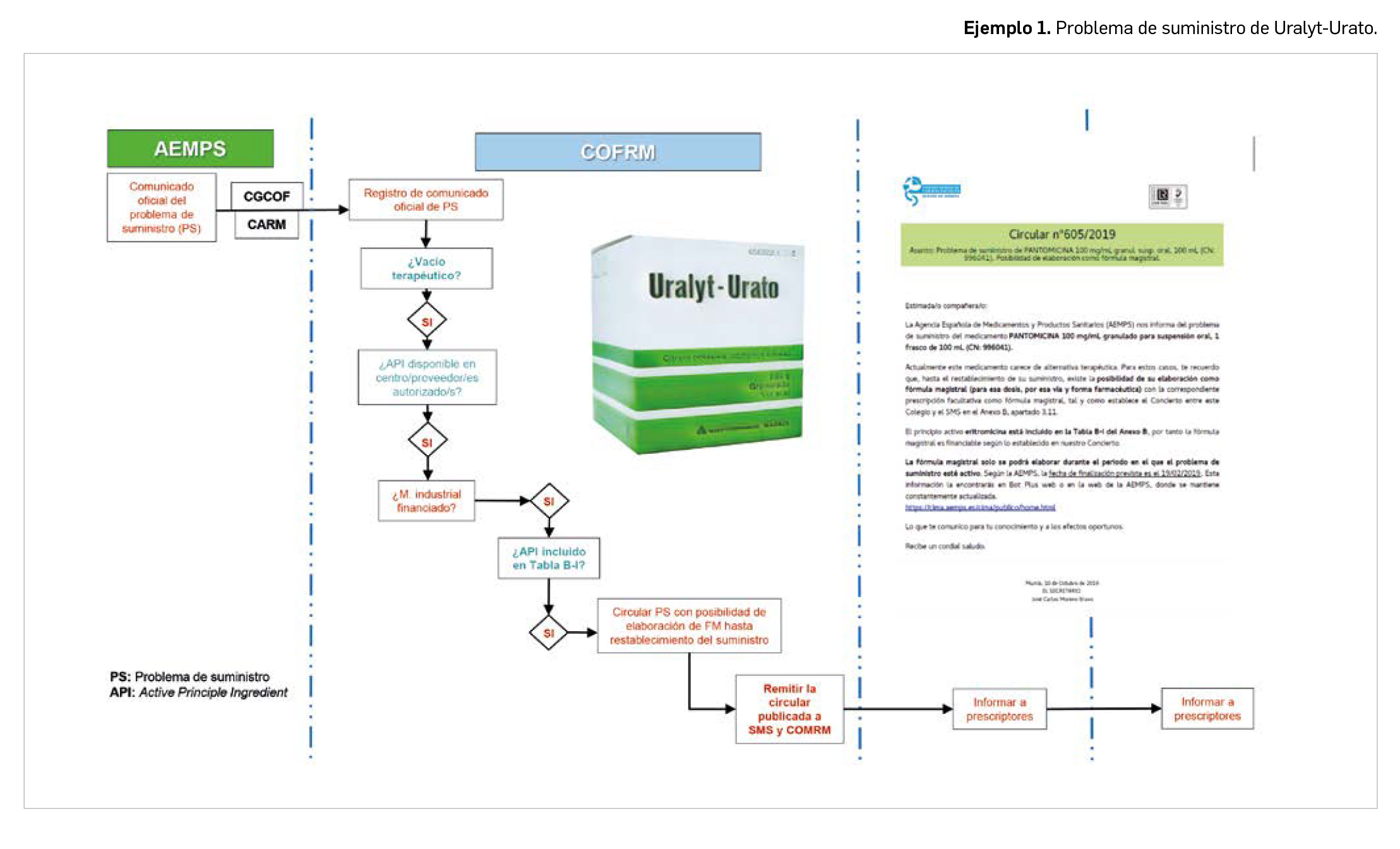
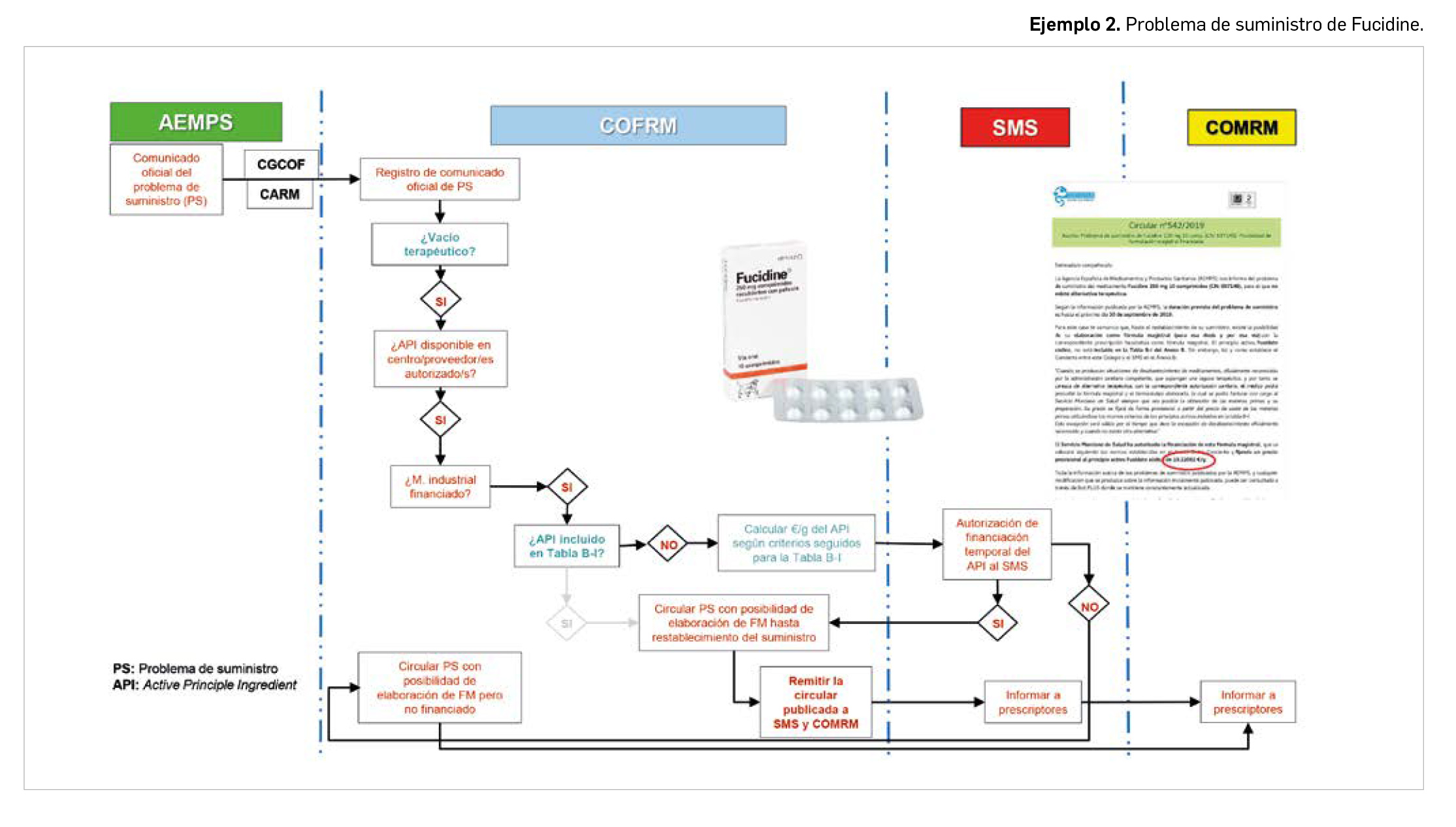
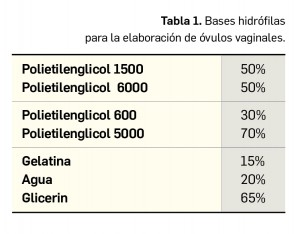
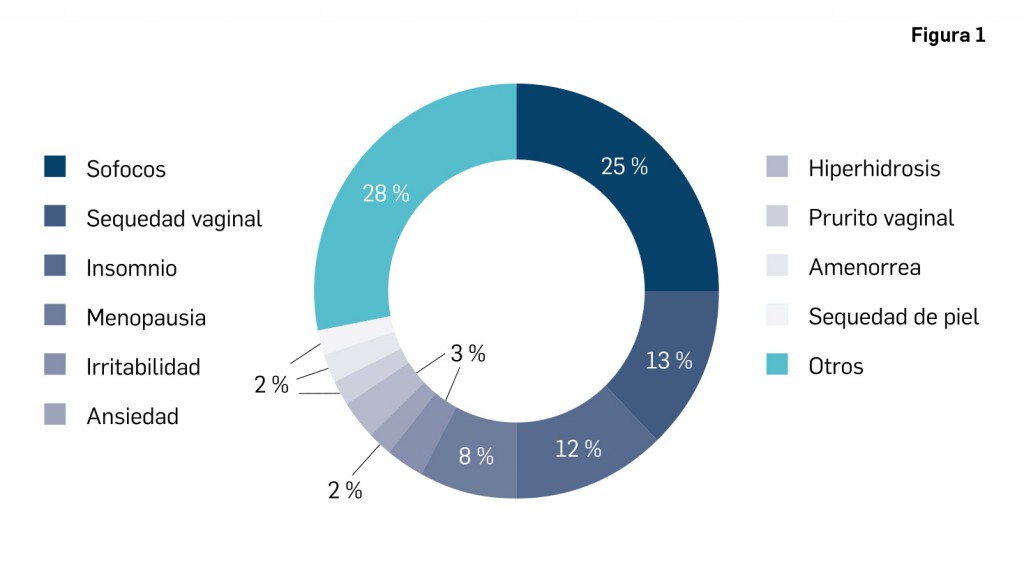
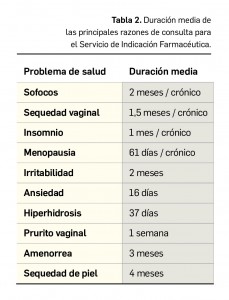
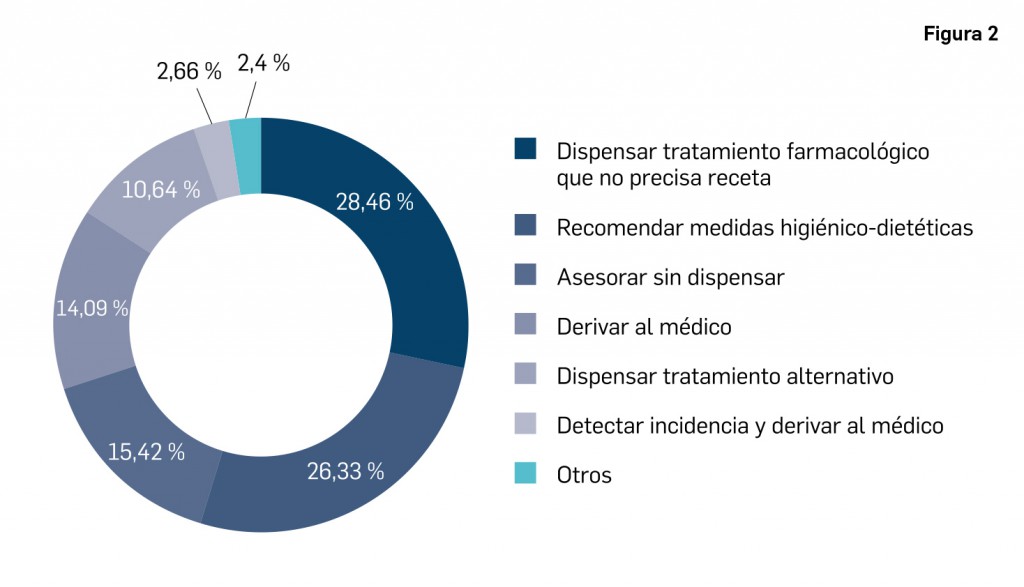
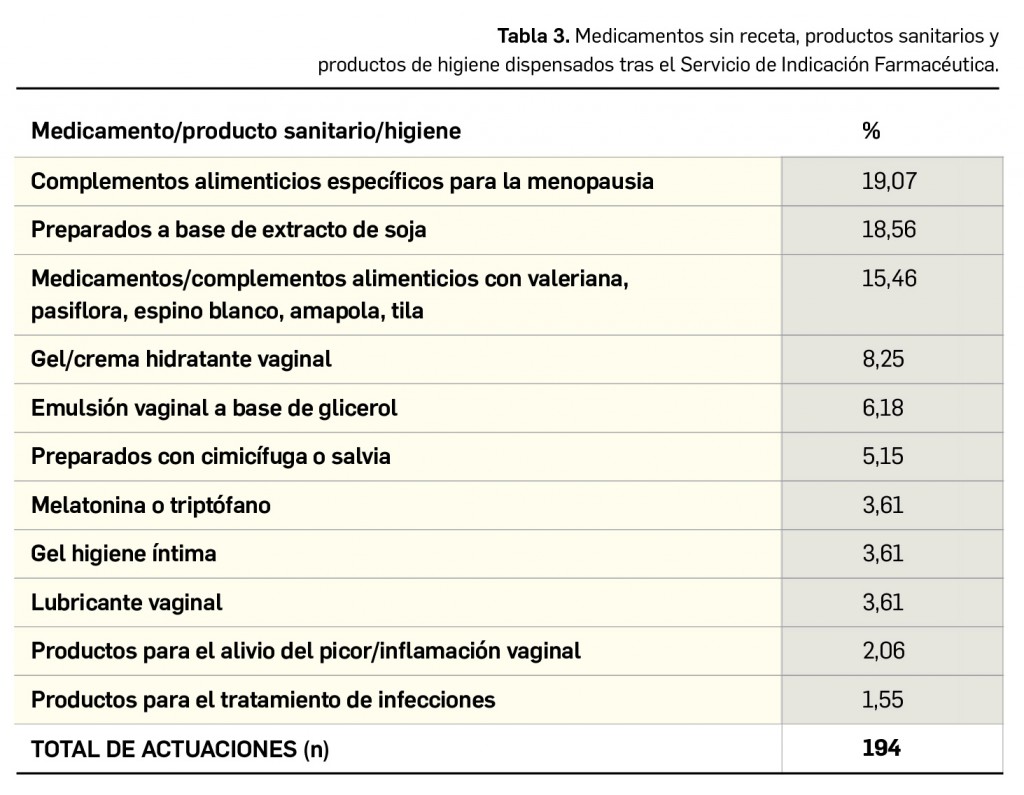
La pandemia del coronavirus ha hecho que, ahora más que nunca, nuestra sociedad ponga sus esperanzas en la vacunología. No obstante, la realidad es que los estudios para desarrollar una vacuna contra la infección por SARS-CoV-2 y la enfermedad que produce (COVID-19) están poco avanzados. Antes de la pandemia, la investigación en vacunas frente a coronavirus se volcaba fundamentalmente en la protección de animales, en concreto la diana eran perros y ganado, aunque es cierto que las epidemias del SARS de 2003 y sobre todo la de MERS, con una alta mortalidad, en 2012, impulsaron la investigación en el desarrollo de vacunas humanas.
Los trabajos de desarrollo de vacunas contra el coronavirus se enmarcan en seis líneas principales de trabajo, que usan como candidatos: virus completo inactivado, virus atenuado, vector viral, vacuna de ADN, subunidades y partículas. En general, están basadas en la proteína S de la espina viral, aunque también en otras como la de la nuclecápsida (N), la envoltura (E) e incluso en proteínas no estructurales (NSP16).
Hace ya unos años, la OMS incluyó a las infecciones por coronavirus entre las prioridades a investigar. Ahora, tras la emergencia por COVID-19, este campo ha recobrado interés y financiación. Por una parte, la CEPI (Coalition for Epidemic Preparedness Innovations) ha hecho una reciente inversión para financiar tres líneas importantes en el desarrollo de vacunas. Y, por otro lado, destaca China, con recursos suficientes como para dar un impulso definitivo al desarrollo de vacunas frente al coronavirus.
En este sentido, en la principal base de datos donde se registran los ensayos clínicos ClinicalTrials.gov (perteneciente a la Biblioteca Nacional de Medicina de EE.UU., de libre acceso), aparecen en estado de reclutamiento dos ensayos clínicos: uno llevado a cabo en Hubei (China), donde se estudiará una vacuna de adenovirus recombinante (vector viral) en adultos de 18 a 60 años, y otro donde se estudiará la seguridad y eficacia de una vacuna sintética antígeno-específica en 100 pacientes esta vez en Shenzhen, también en China.
En cualquier caso, a pesar de la reciente inversión, la necesidad de que aparezca esta ansiada vacuna y la demostrada capacidad de organización y ejecución que tiene China, es poco probable que exista una vacuna frente a COVID-19 en el mercado en menos de 6-12 meses. Estaremos pendientes de los avances en este campo e informaremos oportunamente en PAM.