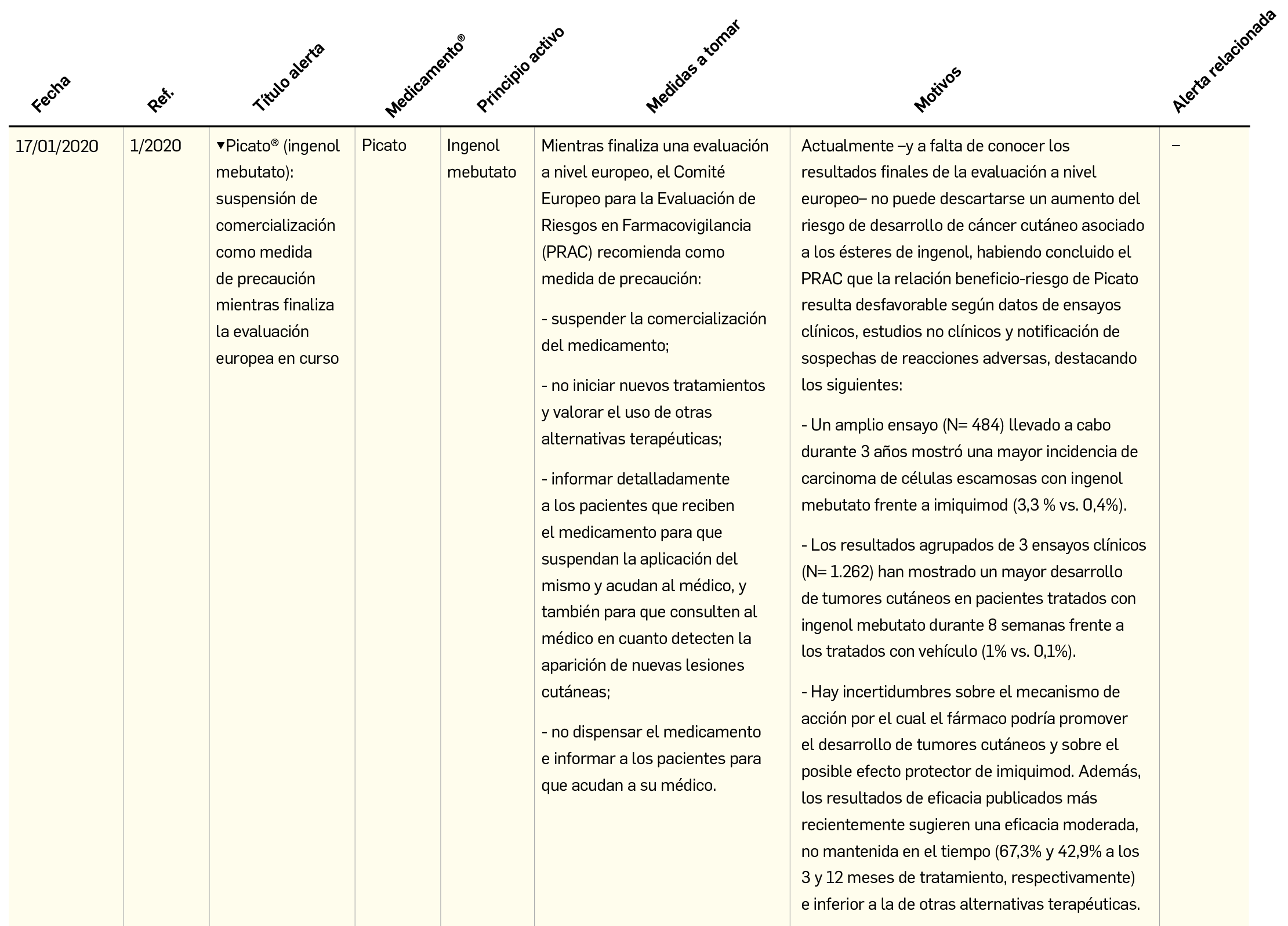
Resumen de las notas sobre seguridad y farmacovigilancia publicadas por la AEMPS desde principios del año 2020. Para información más ampliada y acceso al documento de la AEMPS, puede consultar BOT PLUS.
Archive
Revista PAM: 431
Número 431, Marzo 2020
Variaciones en medicamentos previamente comercializados
CAMBIOS DE NOMBRE DE MEDICAMENTOS
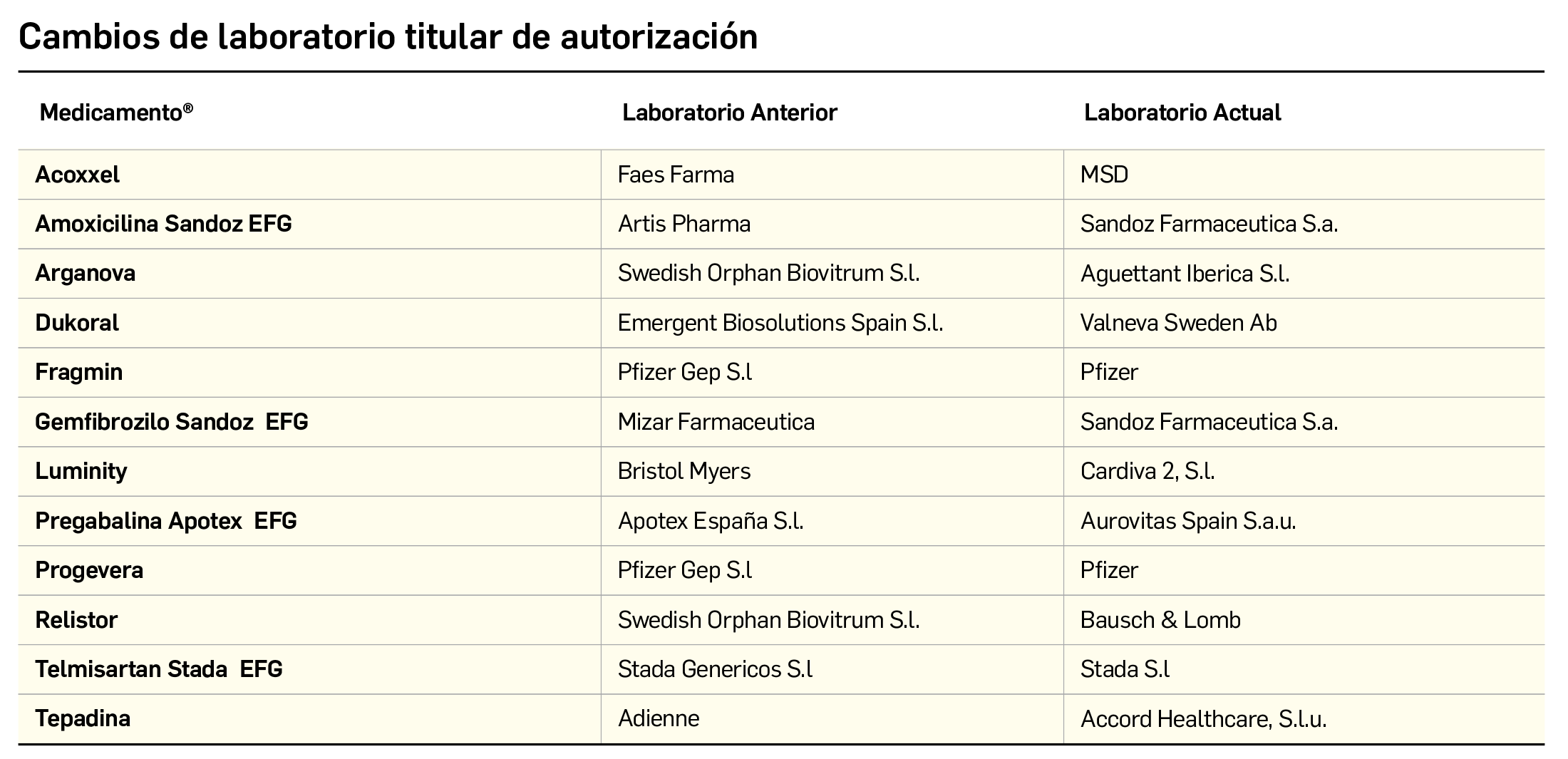
CAMBIOS DE LABORATORIO TITULAR DE AUTORIZACIÓN
CÓMO LOCALIZAR CAMBIOS DE NOMBRE Y DE LABORATORIO CON BOT PLUS
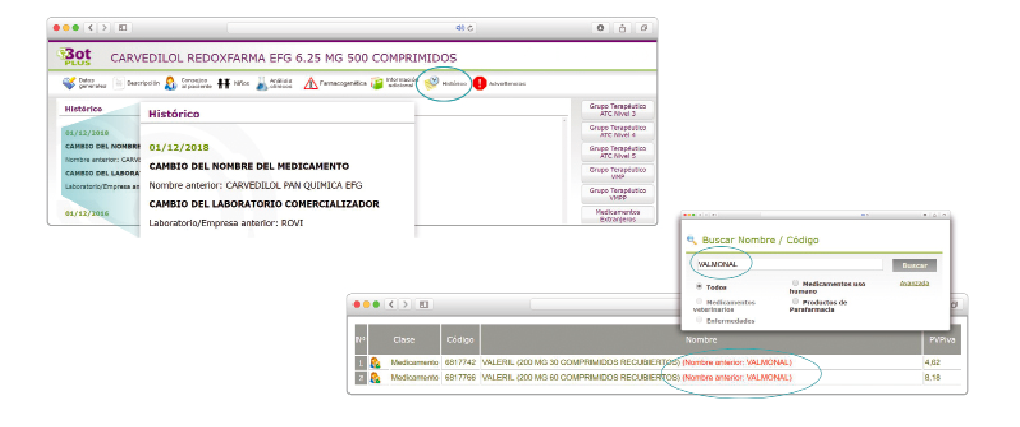
Además de la información que se incluye en los listados mensuales publicados en PAM, en Bot PLUS se incluye un apartado de Histórico, en las fichas de medicamentos, en el que se presenta información referente a cambios que haya sufrido anteriormente el medicamento o producto, entre otros, los cambios de nombre y los cambios de laboratorio. Esta información también está disponible para productos sanitarios financiados o dietoterápicos.
Se añade la posibilidad de visualización de las situaciones anteriores (o incluso futuras) relacionadas con un cambio de nombre.
Con automatismos que nos permiten localizar un medicamento que haya cambiado de nombre, independientemente de cuál usemos
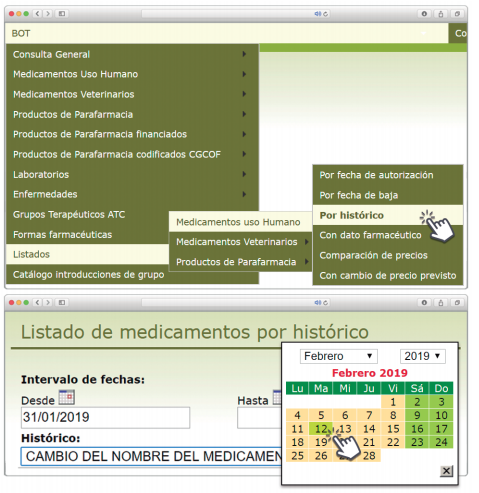
Posibilidad de generar listados por Histórico
Además de la información existente en Histórico, se permite la explotación de la información incluida en Bot PLUS en este apartado, mediante la integración de la información almacenada en Histórico en el apartado de Listados de Bot PLUS, que permite realizar consultas entre rangos de fechas y por un concepto en concreto de entre los almacenados en el apartado de Histórico. Entre ellos se incluyen, precisamente, los conceptos “Cambio del nombre del medicamento” y “Cambio del laboratorio comercializador”.
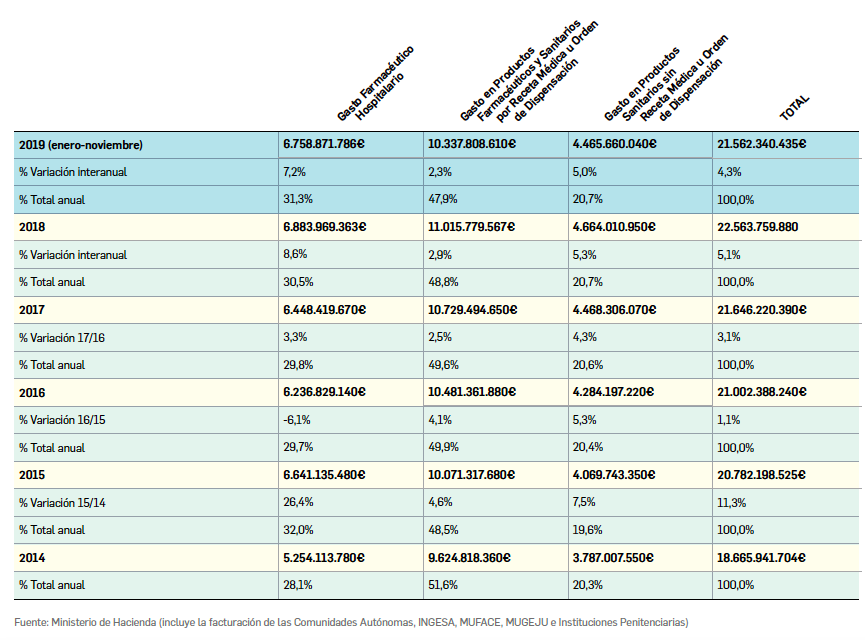
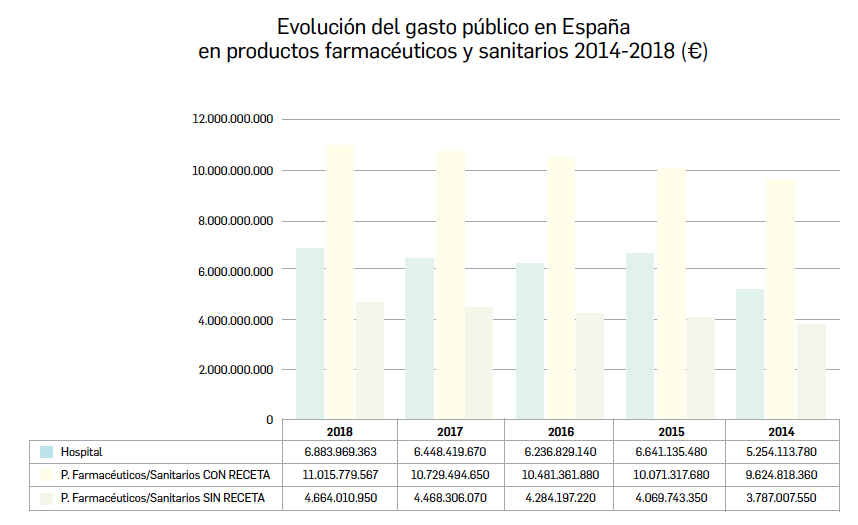
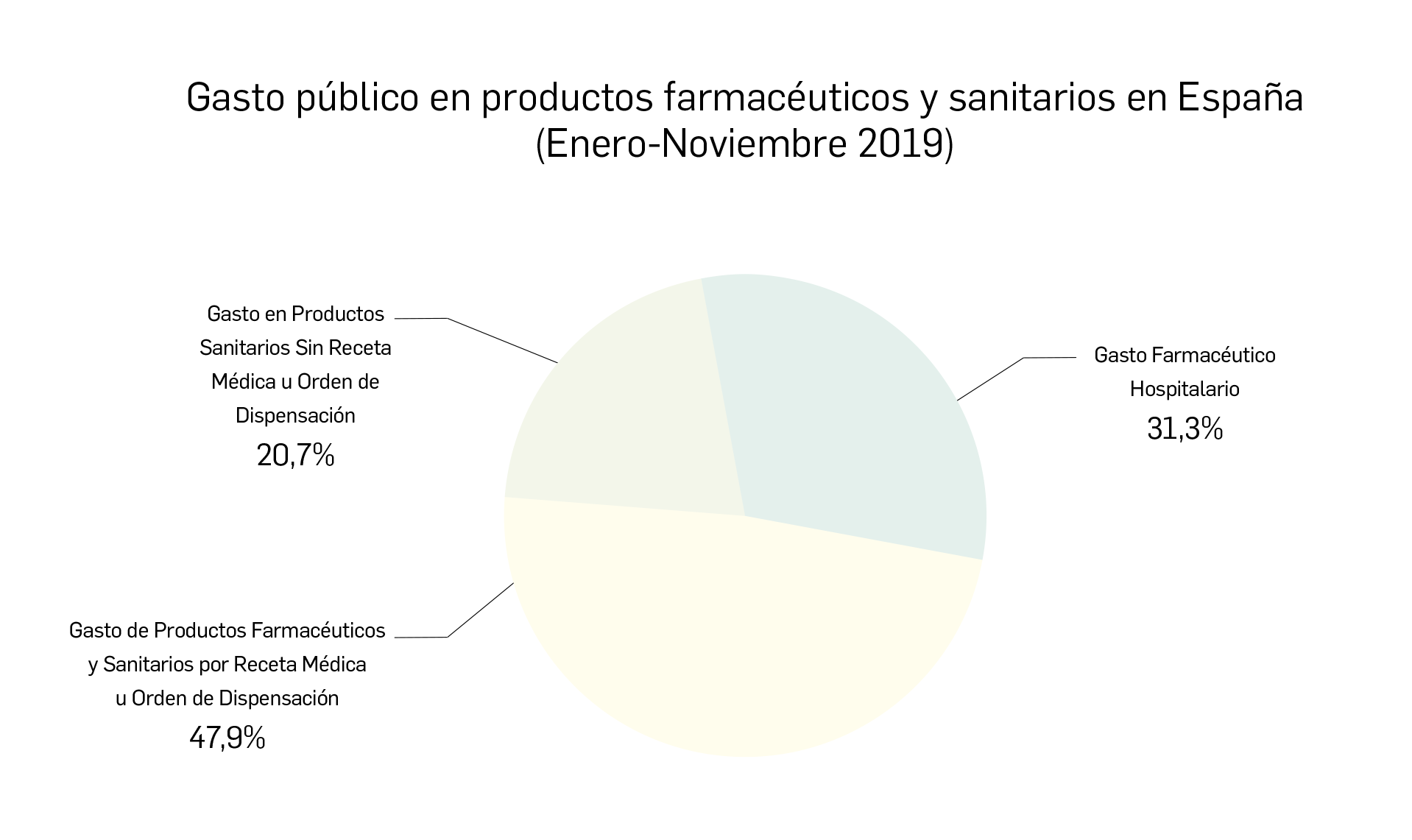
Gasto público en productos farmacéuticos y sanitarios
Estadísticas de altas y bajas, composición, precio y características de medicamentos
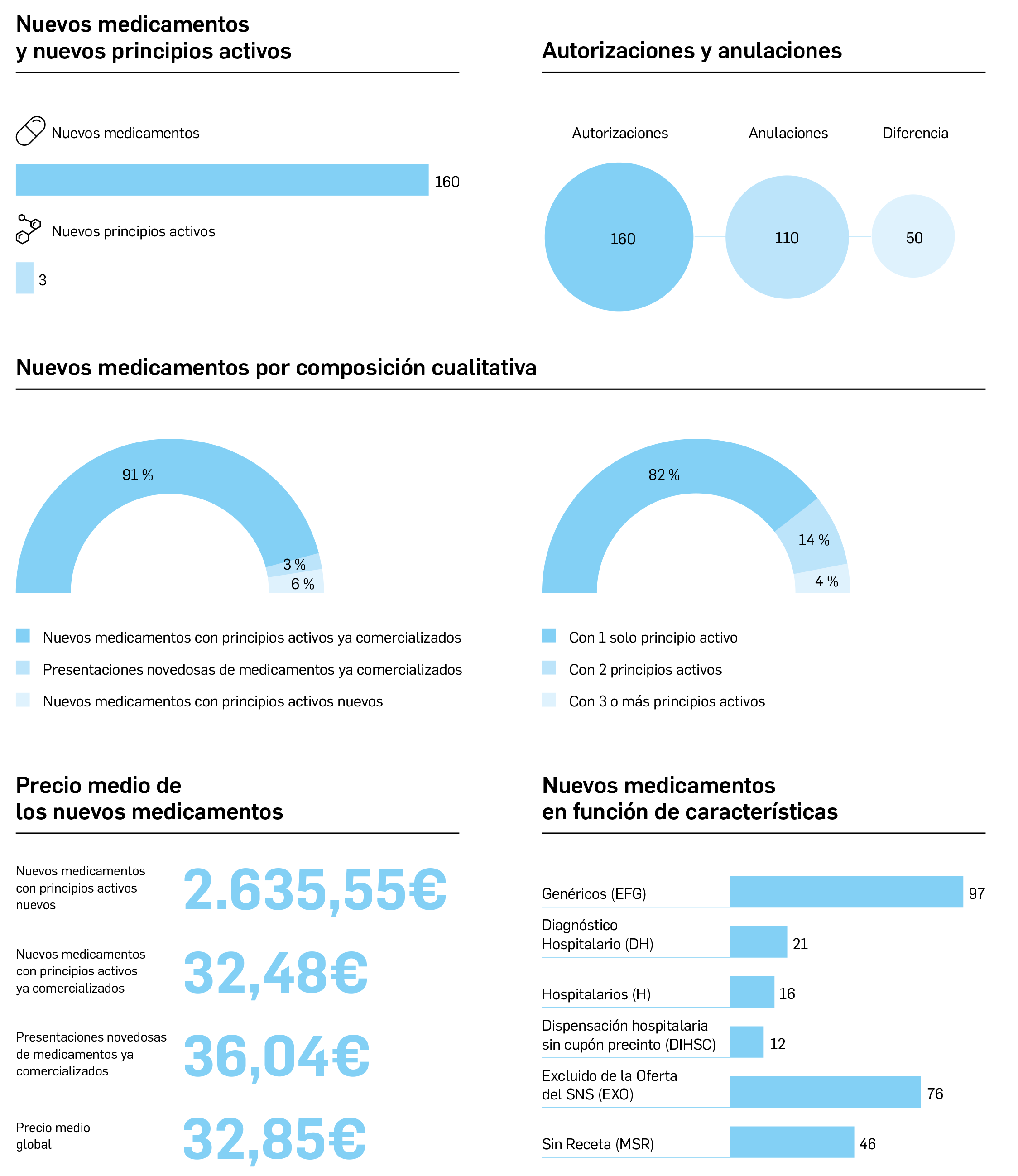
Medicamentos con nuevos principios activos o biosimilares
COMERCIALIZADOS EN ESPAÑA EN LOS ÚLTIMOS DOCE MESES
_______________________________________________________________________________________________
Valoración de la innovación terapéutica en PAM
Es importante indicar que se valora el grado de innovación. Todos los medicamentos, sean innovadores o no, tienen utilidad terapéutica, en tanto que su autorización por las autoridades sanitarias implica que han demostrado rigurosamente su eficacia, su seguridad, su calidad y las condiciones de uso (incluyendo la información contenida en la ficha técnica – sumario de características – y en el prospecto del medicamento). Por tanto, la valoración que se hace se refiere a la incorporación, en el grado que se determine, de algún elemento innovador con respecto a otros medicamentos autorizados previamente para iguales o similares indicaciones terapéuticas o, en su caso, cubriendo la ausencia de éstas.
Asimismo, debe considerarse que ésta es una evaluación que se practica coincidiendo con la comercialización inicial del medicamento. Se trata, por consiguiente, de una valoración provisional de la innovación realizada en función de la evidencia clínica disponible hasta el momento, lo que no prejuzga, en ningún caso, la disponibilidad posterior de nuevas evidencias científicas (de eficacia o de seguridad) en la indicación autorizada o el potencial desarrollo y autorización, en su caso, de nuevas indicaciones terapéuticas o la imposición de restricciones de uso en las anteriores.
Se consideran tres posibles niveles, adjudicados en función de la relevancia de la(s) innovación(es) presentes en el nuevo medicamento, siempre en relación al arsenal terapéutico disponible clínicamente en España en el momento de la comercialización:
- SIN INNOVACIÓN (*). No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas.
- INNOVACIÓN MODERADA (**). Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar.
- INNOVACIÓN IMPORTANTE (***). Aportación sustancial a la terapéutica estándar.
Se distinguen dos niveles de evidencia científica para los aspectos innovadores de los nuevos medicamentos:
- Evidencia clínica: mediante estudios controlados, específicamente diseñados y desarrollados para demostrar la eficacia y la seguridad del nuevo medicamento, con demostración fehaciente de lo que puede ser un avance o mejora sobre la terapia estándar hasta ese momento, en el que caso de que exista.
- Plausibilidad científica (potencialidad): existencia de aspectos en el medicamento que teórica y racionalmente podrían mejorar la terapéutica actual, pero que no han sido adecuadamente demostrados mediante ensayos clínicos, bien por motivos éticos o bien por imposibilidad de realización en el momento de la comercialización del nuevo medicamento: perfil de interacciones, mecanismos nuevos que permiten nuevas vías terapéuticas, nuevos perfiles bioquímicos frente a mecanismos de resistencia microbiana, posibilidad de combinar con otros medicamentos para la misma indicación terapéutica, efectos sobre el cumplimiento terapéutico (por mejoras en la vía, número de administraciones diarias, etc.), mejora de la eficiencia económica, etc.
El rigor de los datos contrastados mediante ensayos clínicos controlados (evidencia clínica) es determinante en la valoración de la innovación, mientras que las potencialidades solo pueden ser valoradas accesoriamente, como aspectos complementarios de esta valoración. En ningún caso, un medicamento es valorado con un nivel de innovación importante en función de sus ventajas potenciales, si no aporta otras ventajas demostradas clínicamente. Se analizan cinco aspectos de la innovación: clínica, molecular, toxicológica, físico-química y económico-tecnológica. Como ya se ha indicado, la fundamental y determinante es la novedad clínica.
Glaucoma
Resumen
Bajo el término glaucoma se designan un grupo de enfermedades caracterizadas por la pérdida progresiva de la capacidad visual –como consecuencia del daño sobre el nervio óptico– que representan un importante problema de Salud Pública. De hecho, es la segunda causa de ceguera en los países desarrollados, tras la retinopatía diabética, y tiene una prevalencia elevada a nivel mundial, afectando en torno al 1% de la población: se calcula que más de 60 millones de personas en todo el mundo están afectadas por la enfermedad, sobre todo personas de más de 40 años, y unos 12 millones tienen deficiencia visual o ceguera debido al glaucoma. La OMS considera que el glaucoma representa al menos el 2% de los casos de discapacidad visual y el 8% de los casos de ceguera. En España, se estima que puede haber en torno a un millón de personas afectadas y hasta un 15% de las personas mayores de 65 años padece la enfermedad. Más del 90% de los casos de glaucoma son de tipo primario y de ángulo abierto.
Tradicionalmente se ha identificado al glaucoma con un aumento de la presión intraocular (PIO), si bien a día de hoy se sabe que puede o no estar asociado a un aumento de la PIO. Por el elevado impacto social de las discapacidades visuales, el tratamiento precoz del glaucoma resulta fundamental, pues puede detener o enlentecer el progreso de la pérdida de visión. Este tratamiento se enfoca en la mayor parte de casos a reducir la PIO mediante la administración de colirios oftálmicos, que pueden incluir diversos tipos de fármacos (análogos prostaglandínicos, betabloqueantes, inhibidores de la anhidrasa carbónica, etc.). Cuando la farmacoterapia no está indicada o no es efectiva, se recurre a tratamiento quirúrgico o por láser.
El presente artículo pretende ser una revisión sobre el estado actual de la terapéutica del glaucoma (con especial atención al tratamiento farmacológico), con referencias a la situación epidemiológica y al conocimiento sobre la etiopatología. Centra también el foco sobre el importante papel que el profesional farmacéutico puede desarrollar, en sus distintos ámbitos de actuación profesional, en la asistencia sanitaria de los pacientes con glaucoma.
Introducción: características anatomo-fisiológicas del ojo
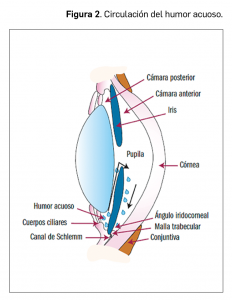
Desde el punto de vista anatómico, el ojo tiene una forma irregularmente esferoidal y está formado por tres capas concéntricas: la externa (córnea y esclera), cuya función fundamental es la de dar forma al globo ocular y contribuye a mantener la presión intraocular, la media (uvea) y la interna (retina), que es donde se inicia el proceso de la visión y es la parte especializada del sistema nervioso destinada a recoger, elaborar y transmitir las sensaciones visuales (Figura 1).
La córnea es un casquete esférico transparente que se continúa con la esclera a nivel del limbo esclerocorneal. Se encuentra en la parte más anterior del globo ocular y tiene funciones protectoras y ópticas bien definidas (poder de refracción de 43 dioptrías, un 70% del poder dióptrico del ojo). La córnea carece de estructura vascular, y se nutre del humor acuoso, de la lágrima y de los vasos arteriales del limbo esclerocorneal. La esclera constituye la capa que da integridad estructural al globo ocular. Está formada por tejido conjuntivo (fibroblastos, colágeno y proteoglicanos) y es de color blanco debido al gran contenido en agua y a la disposición irregular de sus fibras; su inervación corre a cargo de los nervios filiares posteriores.
El iris, el cuerpo ciliar y la coroides constituyen la túnica media. El iris es la parte más anterior del ojo y está constituido por tejido conectivo laxo recubierto en la parte posterior por un epitelio pigmentado. En su estroma se encuentra el músculo dilatador y el esfínter pupilar, y su coloración depende de la cantidad de melanina presente en el estroma. Posee un orificio central, la pupila, que regula la entrada de luz en el ojo y está unido al cuerpo ciliar en la periferia por tejido conjuntivo. La pupila normal es redonda y regular, su diámetro oscila entre 2,5 y 5,5 mm con 4 mm como promedio. El movimiento de la pupila es un indicador cinético de la función ocular, tanto sensorial como motora, estando modulado por el sistema parasimpático –a través del III par que inerva el músculo constrictor– y por el sistema simpático –que inerva el músculo dilatador de la pupila–; así pues, el diámetro de la pupila está determinado por el equilibrio entre las acciones antagonistas de estos dos sistemas (López et al., 2014).
El ángulo iridocorneal es el punto donde el iris se une a la esclera y representa el lugar de drenaje –a través del canal de Schlemm– del humor acuoso. El cuerpo ciliar está formado por los procesos ciliares y el músculo ciliar es el encargado de regular la curvatura del cristalino (lente de forma biconvexa, situada detrás del iris, clave en la función óptica del ojo). Interviene en la producción del humor acuoso y en el proceso de acomodación. Está unido a la coroides, una capa rica en vasos que tapiza la cara interna de la esclera, la cual impide que penetre la luz (por estar muy pigmentada) y se encarga de la nutrición de las estructuras adyacentes.
La córnea, el iris y el cuerpo ciliar delimitan tres compartimentos: la cámara anterior, la cámara posterior y la cavidad vítrea. La cámara anterior o compartimento frontal del ojo es un espacio delimitado por la córnea, el iris, la pupila y el cristalino; está rellena de un líquido muy fluido, llamado humor acuoso, cuya misión es la de nutrir y oxigenar la córnea y el cristalino y eliminar los productos de desecho. La cavidad vítrea, por su parte, está rellena de un gel transparente (su transparencia es indispensable para la visión) y avascular, el gel vítreo, que ocupa un 80% del globo ocular; está localizado por detrás del cristalino y por delante de la retina, y da soporte a las estructuras internas.
El eje anteroposterior del globo ocular atraviesa una serie de lentes (córnea y cristalino) cuya función es la de enfocar nítidamente las imágenes sobre la retina. Los impulsos generados en la retina se transmiten –a través del nervio óptico y la vía óptica– al córtex occipital, donde se establecen las asociaciones precisas que permiten transformar los estímulos visuales en imágenes reales. Cuando la cantidad de humor acuoso es excesiva, bien por un aumento de la producción o, lo que es más frecuente, por una reducción de su drenaje, la presión intraocular aumenta. Ello, si bien no pone en peligro la anatomía ocular por la resistencia mecánica del ojo, puede afectar a las zonas más débiles de su estructura interna. Y la parte más débil es la zona de la esclera por donde el nervio óptico sale del globo ocular.
El nervio óptico (II par craneal) es parte del sistema nervioso central y no es susceptible de regeneración. Con una longitud de 35-55 mm, está formado aproximadamente por un millón de células nerviosas y está recubierto por las tres meninges. Cuando la presión del ojo alcanza valores elevados durante períodos de tiempo prolongados, las células nerviosas sufren una intensa compresión, provocándoles daños o incluso su muerte. La pérdida de una cantidad significativa de estas células provoca la pérdida parcial o incluso total de la visión. El nervio óptico forma parte de la llamada vía óptica, formada además por el quiasma, las cintillas, las radiaciones, los núcleos visuales y la corteza occipital. Las alteraciones en esta vía óptica se traducen en el campo visual en forma de defectos monoculares o binoculares que varían dependiendo de dónde se produzca la lesión: escotomas (puntos, agujeros o bandas en el campo visual en los que no se ve nada), cuadrantanopsias (desaparición de un cuadrante de la visión binocular) y hemianopsias (desaparición de la mitad –dos cuadrantes– del campo visual). Las alteraciones del nervio óptico se manifiestan como defectos campimétricos unilaterales.
El quiasma representa la unión de las ramas del óptico de cada ojo. Se relaciona con el esfenoides y la hipófisis y contiene fibras directas (del lado temporal de cada ojo) y fibras cruzadas (del lado nasal). Las lesiones en el quiasma –normalmente bilaterales– vienen dadas por las de las estructuras que lo rodean, siendo la más típica la hemiapnosia bitemporal por tumores hipofisarios. La cintilla óptica, en la parte posterior del quiasma, recoge las fibras pupilomotoras y fibras visuales temporales, por un lado, y las nasales por el otro. Las lesiones de esta zona producen defectos raros, como la hemianopsia homónima contralateral con afección pupilar.
El cuerpo geniculado lateral está situado en la cara posterior del tálamo y a él llegan el 80% de las fibras de la cintilla óptica; se considera como una estación de relevo de la cintilla óptica, cuya lesión produce una hemianopsia homónima contralateral. De su superficie posterior parten las radiaciones ópticas, que se dirigen hacia atrás y afuera, y atraviesan los lóbulos temporal, parietal y occipital. Cuanto más posteriores son las lesiones más congruentes son los defectos: si la lesión se sitúa en la porción anterior, se produce una pérdida del hemicampo contralateral, sin respeto macular y habitualmente congruente, pero si es más posterior, se produce una cuadrantanopsia homónima.
Por último, la corteza visual, situada en el córtex occipital, es el lugar de destino de las fibras, pero, sobre todo, contiene las áreas de asociación: el área 17 o área estriada es la responsable de las sensaciones visuales primarias, mientras que las zonas del córtex que le rodean elaboran la información integrándola con otras zonas. Las lesiones más comunes de la corteza visual se traducen en escotomas o hemianopsias homónimas contralaterales congruentes (Kaplan, 2007).
Volviendo sobre la importancia del humor acuoso y su papel en el glaucoma, cabe destacar, como se ha sugerido previamente, que es el principal responsable del mantenimiento de la presión necesaria en el mantenimiento de la forma del globo ocular para una correcta visión: la denominada presión intraocular (PIO). Puesto que las estructuras como la córnea y el cristalino no están irrigadas, el humor acuoso debe estar constantemente formándose a partir de la sangre y eliminándose, a razón de 2-6 μl/min, por lo que cada minuto se renueva aproximadamente el 1-2% del volumen total (0,2-0,4 ml). El mantenimiento de una PIO en valores fisiológicos requiere que exista un equilibrio casi perfecto entre su formación y su eliminación o drenaje.
El humor acuoso se produce en la cámara posterior del ojo a partir de los vasos sanguíneos presentes en el cuerpo ciliar y pasa a la cámara anterior a través de la pupila con un flujo pulsátil –debido a la resistencia ofrecida por el iris–, en un 80% por mecanismos activos (sobre todo un proceso metabólico que depende de sistemas enzimáticos, como el de la anhidrasa carbónica) y en un 20% por secreción pasiva (procesos de ultrafiltración o difusión, que dependen fundamentalmente de la presión sanguínea de los capilares y de la PIO). En su mayoría (90%), drena o se elimina hacia la cámara anterior a través del sistema o malla trabecular, un delgado tejido esponjoso dispuesto de forma circular (estructura similar a una rejilla) en la periferia de la córnea, justo en el ángulo –por delante– con el iris (Figura 2).
Como el iris se sitúa plano sobre la cara anterior del cristalino, el humor acuoso no puede vencer esta resistencia hasta que la presión en la cámara posterior aumenta lo suficiente para despegar el iris del cristalino (primera resistencia fisiológica); es por ello que el flujo no es continuo, sino pulsátil. Tras pasar a través del sistema trabecular (segunda resistencia fisiológica), el humor acuoso es eliminado a través del canal de Schlemm, un pequeño capilar circular que drena al sistema circulatorio y desde donde salen 20-30 canales colectores que conectan directa o indirectamente con las venas epiesclerales. El 10% restante del humor acuoso drena a través de los tejidos blandos de la zona frontal del ojo (cuerpo ciliar) hacia el espacio supracoroideo, alcanzando la circulación venosa general; éste es el denominado drenaje uveoescleral.
—El glaucoma es la segunda causa de ceguera en los países desarrollados: la padecen más de 60 millones de personas en el mundo—
Etiopatogenia y relevancia epidemiológica
El término glaucoma designa a un grupo de enfermedades caracterizadas por la existencia de una neuropatía óptica típica, que se asocia con una pérdida visual. Formalmente, se define como una neuropatía óptica irreversible y progresiva, ocasionada por la muerte de las células ganglionares de la retina y está caracterizada por la pérdida de la capa de fibras nerviosas y la alteración del nervio óptico.
El glaucoma es una de las enfermedades oculares más temidas, al estar considerada como una de las principales causas de ceguera en el mundo occidental. Se ha estimado que afecta a unos 64-67 millones de personas globalmente, lo que representa aproximadamente el 1% de la población mundial (Sambhara et al., 2014; Tham et al., 2014); otros autores han apuntado que afecta a un 3,54% de personas entre 40 y 80 años, lo que supone una elevada prevalencia. No obstante, diversos estudios indican que existe un infradiagnóstico importante –de hasta el 50%– (McMonnies, 2017), si bien en algunos países esta proporción se reduciría al 1,2% en la población de más de 55 años. En todo caso, hay consenso en torno a la idea de que el glaucoma es la segunda causa de ceguera después de las cataratas y la causa principal de ceguera irreversible en el mundo (Castiñeira et al., 2018).
El término glaucoma no designa a una entidad única sino a un grupo de enfermedades cuya característica común es la aparición de neuropatía típica y de cambios en el campo visual. La mitad de ellas implican deficiencias significativas en la visión y un 10% de estas últimas acaban en ceguera prácticamente completa. Aunque el número exacto de afectados es difícil de conocer, se estima que en torno a 11,9 millones de personas en todo el mundo tienen deficiencia visual o ceguera debido al glaucoma; la OMS considera que el glaucoma representa al menos el 2% de los casos de discapacidad visual y el 8% de los casos de ceguera (OMS, 2019).
Según se ha sugerido, la prevalencia del glaucoma es mayor a partir de los 40 años, siendo la edad el principal factor de riesgo para el desarrollo de glaucoma, si bien éste se puede presentar a cualquier edad. Además, existen importantes diferencias raciales, ya que el glaucoma es particularmente prevalente en la raza negra; así, la mayor prevalencia de glaucoma de ángulo abierto se encuentra en África. De acuerdo con las estimaciones de Quigley y colaboradores (Quigley et al., 2006), más del 80% de los afectados por glaucoma de ángulo abierto viven en Asia, y la mayoría de ellos son de origen africano. El sexo también es un factor de riesgo relevante, pues –según datos de 2010– el 59% de los pacientes con glaucoma eran mujeres (representan el 55% de los glaucomas de ángulo abierto y el 70% de los de ángulo cerrado).
Tradicionalmente se ha identificado al glaucoma con un aumento de la presión o hipertensión intraocular. Sin embargo, hoy en día se sabe que son dos conceptos distintos y que el glaucoma puede o no estar asociado a un aumento de la PIO; en realidad, se trata de una causa y de un efecto, que en ambos casos no son únicos.
El rango de normalidad de la PIO se sitúa entre 10 y 20 mmHg (otros autores hablan de 14-20 o incluso de 13-18 mmHg) y se mantiene así a lo largo de la vida, aunque existen discretas variaciones diurnas y estacionales. Se considera globalmente que el límite superior de la presión intraocular es de 21 mmHg y, por consiguiente, un valor de 22 mmHg es valorado como representativo de hipertensión intraocular1. Pero no existe un punto de corte absoluto de la PIO a partir del cual ésta se relacione directamente con la aparición de glaucoma, y ese límite máximo de 21 mmHg representa solo un valor de carácter estadístico, ya que hay pacientes con lesiones glaucomatosas con PIO inferior a 21 mmHg, mientras otros continúan ilesos, al menos a corto plazo, con PIO de 30 mmHg.
En cualquier caso, el mantenimiento de la presión intraocular (PIO) es necesario para la correcta formación de imágenes en la retina, ya que garantiza una curvatura de la superficie de la córnea uniformemente lisa, una distancia constante entre la córnea, el cristalino y la retina, y una alineación uniforme de los fotorreceptores y del epitelio pigmentario de la retina sobre la membrana de Bruch, que queda tirante y sin arrugas. En base a lo anterior, los principales factores que condicionan la agudeza visual son: i) la velocidad de producción del humor acuoso por el cuerpo ciliar; ii) la resistencia al drenaje del humor acuoso en la malla trabecular; y iii) la presión venosa epiescleral. Generalmente, el aumento de la presión intraocular se debe a un aumento de la resistencia en la malla trabecular.
Por tanto, cualquier variación de la PIO, por encima o por debajo de los límites fisiológicos, puede provocar trastornos en la visión. Dos teorías principales pretenden explicar el papel de la PIO en el glaucoma:
- directa o mecánica: el aumento de la PIO por encima de los niveles normales va a comprimir las fibras nerviosas en su salida a través de la esclera;
- indirecta o vascular: el aumento de la PIO va a dificultar el flujo sanguíneo a nivel de la cabeza del nervio óptico, lo que produce isquemia crónica y atrofia de las fibras nerviosas.
La elevación de la PIO por encima de ciertos valores puede originar la lesión de las fibras nerviosas que da lugar al glaucoma, aunque no se sabe si tal lesión se produce por un efecto directo sobre las fibras nerviosas de la retina cuando pasan por la cabeza del nervio óptico o por una interferencia en la microcirculación de la cabeza del nervio óptico, originando una necrosis de las fibras nerviosas.
Entre los factores exógenos involucrados en la hipertensión ocular, se postuló el posible efecto del consumo de cafeína, sobre el cual los datos eran parcialmente contradictorios. Un meta-análisis pretendió arrojar luz sobre el asunto y demostró que la cafeína tenía diferentes efectos sobre la presión intraocular según el grupo de individuos: en individuos con PIO normal, ésta no cambia por la ingestión de cafeína, mientras que en los pacientes con glaucoma o hipertensión ocular, sí aumenta significativamente. En concreto, la PIO en individuos “normotensos” medida a 0,5 h, 1 h y 1,5 h después de la ingestión de cafeína no se vio afectada por ésta, siendo la diferencia ponderada de medias para cada punto de medición de -0,74, de +0,52 y de +0,58 mmHg; sin embargo, en pacientes con glaucoma o hipertensión ocular, la PIO aumentó en cada punto de medición, con la diferencia ponderada de medias de +0,35 mmHg, +2,39 y +1,998 mmHg, respectivamente (Li et al., 2011). Con todo, siguen existiendo muchas dudas sobre el mecanismo responsable de este efecto.
Sea como fuere, la hipertensión ocular es, ciertamente, la causa más común de glaucoma en los países occidentales (entre un tercio y la mitad de los pacientes galucomatosos tienen aumentada la PIO en los estadios iniciales); sin embargo, existen variedades de glaucoma con presión ocular normal o –normotensionales– que son más comunes en algunas zonas (como extremo Oriente) que las asociadas a hipertensión ocular, representando entre un 30% y un 40% de los pacientes con defectos campimétricos glaucomatosos.
Así pues, por glaucoma también se entiende la pérdida gradual y progresiva de la capacidad visual que puede llegar a la ceguera absoluta, como consecuencia del daño sobre el nervio óptico en el punto en el que sale del globo ocular, con independencia de cuál sea la causa de dicho daño.
Por otro lado, en el glaucoma suele producirse, independientemente de la PIO, un aumento de la excavación papilar, esto es, un mayor tamaño de la papila o canal por donde salen las fibras nerviosas del nervio óptico (Figura 3), lo cual determina la aparición de los defectos campimétricos mencionados anteriormente.
Grosso modo, la gradación del glaucoma se determina en función de la gravedad de la lesión:
- Grado 1: lesión leve caracterizada por defectos iniciales del campo visual y una excavación mínima.
- Grado 2: lesión moderada caracterizada por un escotoma arqueado evidente y un adelgazamiento del anillo neurorretiniano.
- Grado 3: lesión grave caracterizada por una extensa pérdida de campo visual y una excavación acusada.
- Grado 4: lesión en fase terminal caracterizada por un pequeño campo visual residual y un ribete neurorretiniano mínimo.
Además del daño ocasionado por el aumento de la PIO y por la disregulación vascular (mecanismos primarios), en la patogenia del glaucoma intervienen sustancias neurotóxicas, como el glutamato o la glicina, que contribuyen a la producción de la apoptosis de las células ganglionares (mecanismos secundarios). A día de hoy, se sabe, por tanto, que el glaucoma responde a una etiopatogenia multifactorial y compleja en que intervienen factores mecánicos, vasculares, inmunológicos y moleculares con la consiguiente apoptosis de las células ganglionares de la retina y la consecuente lesión del nervio óptico y de la capa de fibras nerviosas.
Tipos de glaucoma: aspectos clínicos
Existen más de 40 tipos de glaucomas que pueden ser clasificados según diferentes criterios:
- Según la localización de la causa que impide el correcto drenaje del humor acuoso: glaucomas pretrabeculares (cuando la causa es un obstáculo delante del trabeculum o malla trabecular), glaucomas postrabeculares (cuando se debe a un aumento de la presión de las venas epiesclerales), o los más frecuentes, los glaucomas trabeculares (debidos a una resistencia localizada en el mismo trabeculum).
- Según la edad de comienzo: congénito, infantil, juvenil y del adulto.
- Según el origen: glaucoma primario2, si no está relacionado con otras patologías conocidas, y glaucoma secundario, si esa relación existe.
- Según la amplitud del ángulo formado por la raíz del iris y la córnea (ángulo camerular o iridocorneal), que determina la apariencia y el grado de obstrucción del drenaje del humor acuoso, se clasifican en: glaucomas de ángulo cerrado o estrecho, en los que ambas estructuras están en contacto íntimo, y glaucomas de ángulo abierto, en los que no existe tal contacto.
Esta última división en dos grandes categorías ha sido y es la más ampliamente empleada en medicina; a su vez y dentro de cada una de estas categorías se subclasifican en función de que sean primarios o secundarios. La clasificación completa se resume en la Figura 4.
Glaucoma primario de ángulo abierto
El glaucoma primario de ángulo abierto (GPAA) representa un importante problema de salud pública, con una prevalencia que se sitúa en torno al 1,8% de la población, con independencia del sexo pero no de la raza, ya que es cuatro veces más prevalente entre la población de raza negra. Hasta un 15% de las personas mayores de 65 años padece la enfermedad. En cualquier caso, es una enfermedad ocular crónica fundamentalmente asintomática, de ahí su peligrosidad: una gran mayoría de pacientes permanecen asintomáticos durante largos períodos (sobre todo al inicio), y en torno a la mitad de ellos desconocen que lo padecen y, por tanto, no son evaluados ni intervenidos para diagnosticar y controlar la progresión de la enfermedad.
El GPAA supone más del 90% de todos los casos de glaucoma en los países occidentales, incluida España, y es responsable de cerca del 12% de todos los casos registrados de ceguera, siendo la 2ª causa más frecuente en los países desarrollados. La enfermedad puede estar muy avanzada antes de que el paciente note un extenso defecto del campo visual en uno o en ambos ojos, soliendo debutar en la edad adulta y mayoritariamente a partir de los 40 años. Resulta crucial, pues, diagnosticar la enfermedad lo antes posible, con controles periódicos, ya que el pronóstico en los estadios iniciales es mejor que cuando el glaucoma está avanzado.
En el GPAA, el ángulo iridocorneal se mantiene abierto, pero aumenta la resistencia al paso del humor acuoso a través de la malla trabecular, si bien la causa concreta se desconoce. Su aparición está condicionada por una serie de factores de riesgo entre los que merece la pena destacar la PIO elevada (factor condicionante de la aparición y evolución de la enfermedad), la edad, la raza negra o personas hispanas, la diabetes, la miopía, la retinitis pigmentosa, el menor espesor corneal y los antecedentes familiares de glaucoma.
El aumento de la presión intraocular, mantenida durante períodos prolongados, puede conducir a la destrucción de células nerviosas del nervio óptico que, cuando el número es suficientemente elevado, hace que los pacientes comiencen a experimentar una pérdida paulatina de la visión. Inicialmente se trata de pequeños puntos o pecas ciegos (escotomas) en el campo visual, generalmente en las zonas periféricas y de forma asimétrica. Posteriormente es la parte central la que es afectada por la ceguera parcial. Una vez que se ha perdido una parte de la visión el proceso es ya irreversible y, poco a poco, sino no se controla el proceso, se puede llegar a la ceguera completa (Mantravadi et al., 2015).
Aunque la enfermedad suele ser bilateral, la progresión es a menudo asimétrica, de forma que el paciente presenta con frecuencia una pérdida significativa del campo visual en un ojo y menor en el otro. En ocasiones, un pequeño número de pacientes experimentan síntomas inespecíficos, como dolor en el ojo, cefaleas, enrojecimiento y disminución de la visión, que el paciente atribuye a la falta de gafas o una corrección óptica insuficiente. Otros pacientes describen halos coloreados alrededor de las luces en visión nocturna causados por un edema transitorio del epitelio, como ocurre en el glaucoma por cierre angular.
El glaucoma primario normotensional (GPNT) es un tipo de glaucoma muy similar al GPAA en términos de afectación típica del nervio óptico, con la salvedad de que en estos pacientes no es posible detectar nunca una PIO superior a los valores fisiológicos (13-18 mmHg, hasta 21 mmHg se considera normal). Aunque tampoco se ha dilucidado por completo su etiología, se presupone la existencia de factores genéticos y/o raciales predisponentes, pero sobre todo se ha relacionado con factores vasculares3 y hemodinámicos que disminuyen la irrigación (isquemia) de la cabeza del nervio óptico o bien una mayor vulnerabilidad de las fibras del nervio óptico a niveles normales de PIO.
Durante muchos años se ha considerado como una forma minoritaria de glaucoma (en países occidentales) en pacientes especialmente susceptibles, si bien hoy se sabe que está infravalorado, habiendo países asiáticos –como Japón– en los que su incidencia es hasta del doble que la del glaucoma asociado a hipertensión ocular. La realización de un perfil de presión arterial en 24 horas descubre frecuentemente fases nocturnas de hipotensión ocular, que producen una neuropatía óptica de origen vascular.
Se ha descrito este tipo de glaucoma en pacientes con presión arterial baja, espasmos vasculares y pérdidas elevadas de sangre (hemorragias gastrointestinales o uterinas). En torno a la mitad de los casos, el GPNT se mantiene estable sin tratamiento, pero la otra mitad evoluciona progresivamente y es preciso realizar tratamiento hipotensor intentando mantener la PIO <12 mmHg. Por ello, diversos expertos han cuestionado la necesidad de intentar reducir la PIO en estos pacientes. Un ensayo clínico controlado y aleatorizado demostró que, tras 5 años de seguimiento, en solo un 12% (7/61) de los pacientes tratados –bien con tratamiento médico o quirúrgico– progresaba el daño en el campo visual frente a un 35% (31/79 controles) de los no tratados; además, vieron que este efecto beneficioso se conseguía cuando se reducía la presión un 30%, si bien es cierto que, a largo plazo, la enfermedad seguía progresando.
En cuanto al diagnóstico, los glaucomas crónicos, y fundamentalmente el GPAA, reúnen las características necesarias para justificar la implantación de un programa de screening. Sin embargo, no existe un nivel de evidencia suficiente como para establecer la recomendación de un método de cribado concreto para su detección en la población, pues la medida de la PIO no reúne las características de un buen método de cribado. Utilizando estudios con niveles de PIO >21 mmHg los valores de sensibilidad se aproximan a un 50%; por otro lado, se ha visto que un 90% de los pacientes no tratados con niveles elevados de PIO (24-32 mmHg) no desarrollan daño glaucomatoso a los 5 años de seguimiento.
El diagnóstico requiere la realización de una exploración oftalmológica completa que incluya la determinación del espesor corneal, la gonioscopia para estimar la amplitud del ángulo iridocorneal, la evaluación de la papila y, como exploraciones complementarias, la campimetría (Figura 5) y la tomografía de coherencia óptica (OCT). La evaluación del nervio óptico y de la capa de fibras nerviosas provee información muy útil acerca del daño glaucomatoso así como de su progresión.
Los pacientes con glaucoma suelen tener un reflejo pupilar anormal a la luz, de manera que la comparación de las respuestas entre los dos ojos puede, en parte, permitir distinguir pacientes con glaucoma y quienes no tienen la enfermedad. La incorporación de nuevos dispositivos y de enfoques analíticos para evaluar la función pupilar están mejorando el rendimiento de la detección del glaucoma (Chang et al., 2013).
Glaucoma secundario de ángulo abierto
En este tipo de glaucoma la anatomía de la raíz del iris, la malla trabecular y la córnea no están alteradas pero, sin embargo, hay una obstrucción de la malla trabecular que dificulta el drenaje del humor acuoso. Globalmente, supone el 2-4% de todos los casos de glaucoma. Si bien son varias las entidades que pueden dar lugar a un glaucoma secundario, las más frecuentes son:
- Glaucoma pigmentario. Se caracteriza porque el flujo por la malla trabecular se ve enlentecido por el depósito de gránulos de pigmento del iris. Afecta especialmente a hombres miopes jóvenes.
- Glaucoma cortisónico. Debido a que el flujo por la malla trabecular se ve enlentecido por el depósito de mucopolisacáridos, su nombre deriva del hecho de que el 35-40% de los pacientes responden con una elevación de la PIO al administrar corticoides tópicos o sistémicos durante 3 semanas (posiblemente por un aumento de los depósitos de mucopolisacáridos en la malla trabecular y el consiguiente aumento de la resistencia a la salida del humor acuoso); el efecto es reversible tras la interrupción de los corticoides.
- Glaucoma inflamatorio. Provocado porque el flujo a través de la malla trabecular se ve enlentecido por el depósito de células inflamatorias y restos celulares, se cree que la causa puede ser un aumento de la viscosidad del humor acuoso debido a la extravasación de proteínas plasmáticas de los vasos del iris inflamado o a una obstrucción de la malla trabecular por células inflamatorias y restos celulares.
- Glaucoma exfoliativo (o pseudoexfoliativo). Es la forma más común de glaucoma no idiopático, cuya principal característica es la presencia de una fina capa de material de color grisáceo amorfo acelular en la superficie exterior del cristalino, que parece ser responsable del taponamiento del sistema trabecular y del incremento de la PIO a veces hasta niveles muy elevados. Suele diagnosticarse como glaucoma idiopático, aunque su curso clínico y su pronóstico suelen ser peores que este último: en general, la PIO es más alta que en la forma idiopática, las alteraciones visuales más severas, el proceso es más rápidamente progresivo y la respuesta al tratamiento farmacológico es peor.
Glaucoma primario de ángulo estrecho
El glaucoma primario de ángulo cerrado o ángulo estrecho (GPAE) se caracteriza por la obstrucción del drenaje del humor acuoso por el cierre del ángulo iridocorneal y la malla trabecular (lo cual provoca un aumento de la resistencia al flujo a través de la pupila y de la presión en la cámara posterior4), hecho que se ha asociado a cierta predisposición anatómica caracterizada por el abombamiento –debido al proceso de envejecimiento– de un cristalino más engrosado de lo habitual, la presencia de una cámara anterior poco profunda o un iris en meseta, y a veces, por la dilatación de la pupila en ángulos particularmente estrechos (Figura 6).
El GPAE representa el 5-10% del total de casos de glaucoma. Tradicionalmente, se había considerado que su prevalencia era pequeña, de en torno a 1 caso por cada 1.000 individuos mayores de 40 años (0,1%) y con mayor incidencia a mayor edad. Sin embargo, una amplia revisión epidemiológica basada en la evidencia real de prevalencia estimó que en 2012 había 1,6 millones de casos de glaucoma primario de ángulo cerrado en Europa (de ellos, 130.000 en el Reino Unido) y 581.000 en Estados Unidos; además, atendiendo a las tendencias de envejecimiento poblacional, se preveía que en una década el número de casos hubiera aumentado en un 9% en Europa y en un 18% en Estados Unidos (Day et al., 2012).
Según estos datos, la prevalencia global de GPAE en personas mayores de 40 años es del 0,4% en Europa y Estados Unidos, con aumentos progresivos con la edad: un 0,02% entre los 40 y 49 años, un 0,60% entre los 50 y 59 años, un 0,20% entre los 60 y 69 años y un 0,94 % entre mayores de 70 años. Casi tres cuartas partes de todos los casos ocurren en mujeres (3,25 mujeres por cada varón). Estas cifras muestran, en definitiva, que el GPAE es más común de lo que se pensaba anteriormente, hasta el punto de que se ha sugerido que todos los casos de glaucoma primario deberían ser considerados como de ángulo cerrado hasta que la gonioscopia demuestre que el ángulo de la cámara anterior realmente es abierto.
Clínicamente, el GPAE puede ser agudo, intermitente (subagudo) o crónico según el tipo de oclusión del ángulo, que será súbito y total en el primero e intermitente o parcial en los demás tipos. El ataque agudo de GPAE suele ser unilateral (afecta a un solo ojo) y se ha descrito que, en pacientes con los factores anatómicos predisponentes, el cierre completo del ángulo puede verse desencadenado por determinados estímulos que favorecen la midriasis de la pupila de forma fisiológica, como ambientes continuados con escasa iluminación (mirar al televisor en una habitación que está a oscuras), el empleo de algunos tipos de fármacos anticolinérgicos (antihistamínicos, antipsicóticos, antiparkinsonianos) o adrenérgicos, o el estrés emocional.
La crisis aguda se caracteriza por un dolor intenso de inicio, con una intensa elevación de la PIO –valores variables desde 16 a 80 mmHg– que actúa sobre las neuronas corneales; ese dolor sordo puede irradiarse a través de las tres ramas del trigémino hacia sienes, nuca y maxilares, y puede acompañarse también de náuseas y vómitos o cefalea (lo cual puede enmascarar su origen ocular), visión borrosa y halos de colores5, enrojecimiento ocular y edema corneal y estrechamiento de la cámara anterior. De forma previa, pueden existir signos y síntomas prodrómicos, constituidos por episodios ocasionales y transitorios de visión borrosa o de halos de colores alrededor de las luces con anterioridad al ataque propiamente dicho.
Aunque, en algunas ocasiones, los casos de GPAE son episodios incompletos y leves que vuelven espontáneamente a la normalidad (e incluso los síntomas pueden pasar desapercibidos por el paciente), por lo general el ataque de GPAE está considerado como una urgencia y debe ser remitido de inmediato al oftalmólogo, pues el buen pronóstico depende de que se instaure un tratamiento temprano.
Glaucoma secundario de ángulo estrecho (glaucoma neovascular)
Se debe también a un bloqueo de la malla trabecular, como la forma primaria, pero en la forma secundaria la configuración de la cámara anterior no es el factor decisivo, sino que se debe frecuentemente a una rubeosis del iris, que consiste en la formación de vasos nuevos –neovasos– que cierran el ángulo de la cámara anterior (Figura 7). Se trata de un glaucoma secundario doloroso que se asocia a una reducción de la irrigación sanguínea a la retina debido al bloqueo de los vasos sanguíneos, y la existencia de un tejido fibrovascular que tapiza el ángulo en su totalidad y bloquea el drenaje del humor acuoso. Para compensar la falta de flujo sanguíneo, la retina libera factores de crecimiento endotelial vasculares que estimulan la formación de vasos sanguíneos de neoformación anormales. Se produce un cierre progresivo del ángulo y un aumento de la PIO.
Entre sus principales causas se encuentran aquellos procesos que cursan con isquemia de la retina, como la retinopatía diabética o la obstrucción de la vena central de la retina, o los traumatismos; así, la presencia postraumática de sangre o exudados en el ángulo de la cámara anterior y el contacto prolongado entre el iris y la malla trabecular, tras heridas o cirugía, puede conducir a la formación de adherencias iridocorneales y al cierre angular.
Este tipo de glaucoma, también denominado glaucoma neovascular o glaucoma rubeótico, supone el 2-4% de todos los casos de glaucoma; es, pues, poco frecuente pero de nefastas consecuencias, ya que –tras un curso progresivo– potencialmente deviene en ceguera. Suele presentarse inicialmente como un glaucoma agudo o subagudo con dolor, fotofobia, epifora (lagrimeo persistente) y aumento de la PIO, así como disminución de la agudeza visual. De cara a su diagnóstico, es importante tener en cuenta que al principio los neovasos solo son visibles como pequeñas yemas en el reborde pupilar. En estadios avanzados aparecen dilatados y con grandes anastomosis (López et al., 2014).
Glaucoma congénito
El glaucoma congénito se produce por una alteración del drenaje del humor acuoso como consecuencia de una alteración en el desarrollo gestacional de la malla trabecular y de las estructuras angulares, no asociada a otras anomalías oculares o enfermedades sistémicas. Puede apreciarse el desarrollo de un tejido mesodérmico embrionario en forma de una membrana fina y transparente que cubre la malla trabecular, dificultando su salida por el canal de Schlemm.
El glaucoma infantil aparece en 1 de cada 12.000-18.000 nacimientos y supone el 1% de todos los glaucomas. El glaucoma congénito primario es una enfermedad hereditaria autosómica recesiva y afecta a niños varones en un 70% de los casos. Dependiendo de la edad de presentación, pueden considerarse tres tipos:
- Glaucoma congénito verdadero. Responsable del 40% de los casos, se caracteriza por una elevación de la PIO durante la vida intrauterina, de modo que el recién nacido ya presenta buftalmos (también llamados ojo de buey) y un aumento del volumen del globo ocular.
- Glaucoma infantil. Representa el 55% de los casos, y se manifiesta después de nacer y antes de cumplir los 2 años. En el glaucoma congénito e infantil aparecen signos clásicos como fotofobia, lagrimeo, enturbiamiento corneal y aumento unilateral o bilateral de la córnea. Los niños suelen ser irritables, comen mal y se frotan los ojos con frecuencia.
- Glaucoma juvenil. Se caracteriza por la elevación de la PIO después de los 2 y antes de los 16 años. En estos casos las manifestaciones clínicas pueden ser similares a las del glaucoma primario de ángulo abierto.
Tratamiento
En la terapéutica del glaucoma es importante subrayar el hecho de que una vez que se ha perdido una parte de la visión, ésta es irreversible y poco a poco, sino no se controla la enfermedad, se puede llegar a la ceguera completa. Si bien se puede controlar, por el momento, el glaucoma es una enfermedad incurable, con el agravante de que en la mayoría de sus formas no hay síntomas hasta que aparecen las primeras pérdidas del campo visual y los pacientes no son conscientes de la necesidad del tratamiento.
En líneas generales, el tratamiento va a depender del tipo de glaucoma de que se trate y, dado que la gran mayoría de los casos –sobre todo de glaucoma en ángulo abierto en los países occidentales– cursan con hipertensión ocular, el objetivo principal del tratamiento del paciente con glaucoma es la consecución de unos niveles de PIO estables que limiten la progresión del daño del nervio óptico y la capa de fibras nerviosas.
El límite superior de PIO (21 mmHg) se conoce como presión objetivo, y varía de un paciente a otro dependiendo del estado general del ojo y, sobre todo, de las lesiones previas producidas por la hipertensión ocular crónica; por ello, son necesario reajustes terapéuticos durante el seguimiento para alcanzar una individualización del tratamiento. En todo caso, mejor criterio clínico de la eficacia del tratamiento que la medida de la presión intraocular (PIO) es la comprobación de que el deterioro visual no progresa.
Dicha presión objetivo puede alcanzarse mediante tratamiento farmacológico o quirúrgico, tal y como se describirá en detalle a continuación. Como norma, el tratamiento farmacológico constituye el primer escalón terapéutico, y se recurre a tratamientos no farmacológicos en los casos en que no sea suficiente con el primero.
Tratamiento farmacológico
Los tratamientos farmacológicos del glaucoma tienen su origen en 1862, con el descubrimiento de los agentes mióticos. En 1901, se descubrieron los efectos reductores de la presión intraocular de la adrenalina. Los inhibidores de la anhidrasa carbónica sistémicos fueron descubiertos a principios de 1950, aunque el desarrollo de la farmacoterapia del glaucoma experimentó su auténtica explosión tras la autorización de timolol oftálmico en 1978. La utilidad en este campo de los análogos de la prostaglandina se descubrió de forma accidental, incorporándose al mundo de la clínica a partir de 1996 (Conlon et al., 2017).
Los pacientes con glaucoma tratados farmacológicamente no solo previenen o retrasan el daño del nervio óptico, sino que parecen vivir más tiempo, según los resultados de un estudio que analizó durante cuatro años los resultados de más de 21.000 voluntarios con enfermedad ocular y sin ella. Los fármacos utilizados para tratar el glaucoma, tanto betabloqueantes como análogos de prostaglandinas, podrían reducir hasta un 74% el riesgo de muerte en comparación con las personas que no reciben estos tratamientos. Los autores apuntaron como posibles hipótesis responsables de ese aumento de la esperanza de vida el mayor control médico de los pacientes que acuden regularmente al oftalmólogo y los efectos reductores de la tensión arterial de ciertos tipos de fármacos antiglaucoma (Stein et al., 2010).
En la actualidad, se dispone básicamente de dos estrategias para reducir la presión intraocular:
- Aumentar la eliminación de humor acuoso:
Facilitando el drenaje uveoescleral: análogos de las prostaglandinas.
Favoreciendo la eliminación a través de la estructura trabecular y el canal de Schlemm: agonistas colinérgicos.
Propiciando la salida de la cámara del ojo a la sangre aumentando la osmolaridad plasmática: agentes osmóticos.
- Disminuir la formación de humor acuoso:
Actuando directamente sobre la formación en el cuerpo ciliar: betabloqueantes.
Inhibiendo enzimas que participan en el proceso activo de su formación: inhibidores de la anhidrasa carbónica.
Produciendo vasoconstrición: agonistas alfa-adrenéregicos.
En muchas ocasiones no basta con el uso de un solo fármaco hipotensor para controlar el proceso sino que es necesario recurrir a la combinación de varios agentes hipotensores (tratamiento máximo). A continuación se describen las principales características de los citados grupos de fármacos.
—El tratamiento farmacológico depende del tipo de glaucoma, pero el objetivo principal es estabilizar la presión intraocular y limitar el avance del daño del nervio óptico—
1. Análogos de prostaglandinas
Son profármacos que liberan prostaglandina F2α (PGF2α) o análogos con similares propiedades farmacológicas. Disminuyen en un 20-35% la presión intraocular (en menor medida por la noche, en torno al 5-10%), manteniendo el efecto durante todo un día con una única administración local. Su eficacia está ligada a un efecto vasodilatador local intenso, que mejora el drenaje del humor acuoso que llena la cámara anterior del ojo a través de la vía uveoescleral. Este sistema, que en condiciones normales es secundario y solo representa un 10% del total del drenaje, al ser estimulado por las prostaglandinas toma mayor relevancia, siendo suficiente para controlar la PIO.
El primer fármaco introducido fue el latanoprost (Arulatan®, Latanest®, Monoprost®, Tonlit®, Xalatan® y EFG; todos ellos colirios oftálmicos al 0,005% o 50 µg/ml). Posteriormente, por orden cronológico, se han autorizado e incorporado al arsenal terapéutico el travoprost (Travatan® y EFG; colirios oftálmicos al 0,004%), el tafluprost (Saflutan®; colirio oftálmico al 0,0015%) y el bimatoprost (Abiprost®, Lumigan®, Vizibim® y EFG; colirios oftálmicos al 0,01% y 0,03%) (Figura 8). Se pueden administrar en monoterapia y en asociación con timolol. Son considerados como el grupo de fármacos más eficaces para bajar la PIO y para muchos oftalmólogos constituyen el grupo de elección. Tienen la principal ventaja de que se administran una sola vez por la noche.
Producen una baja incidencia de efectos adversos sistémicos (de frecuencia rara, destacando solo la cefalea), menor que los betabloqueantes y otros fármacos antiglaucomatosos; por el contrario, la incidencia de efectos locales es mayor. El excesivo crecimiento de las pestañas alcanza hasta un 45% de los pacientes y son también muy frecuentes (>10%) la hiperemia conjuntival y el picor en los ojos, aunque son de gravedad leve y no suelen obligar a suspender el tratamiento. Además, puede aparecer oscurecimiento de la piel de los párpados y aumento de pigmentación del iris (se producen lentamente y puede pasar desapercibido durante varios meses); algunos de estos cambios pueden ser permanentes, dando lugar a diferencias de aspecto entre los ojos.
Si bien no se ha observado alteración de la función pulmonar, debe vigilarse a los pacientes con asma grave o inestable tratados con estos fármacos; asimismo, debe tenerse especial precaución en casos de inflamación ocular activa (por ejemplo, iritis o uveítis) o infecciones oftalmológicas, ya que se han descrito algunos casos de edema macular. Debe mantenerse una especial vigilancia clínica en pacientes con ataques agudos de glaucoma de ángulo estrecho, glaucoma congénito o glaucoma inflamatorio.
La tolerancia ocular parece ser algo mejor con latanoprost que con travoprost y bimatoprost (menor hiperemia conjuntival). El tafluprost y el latanoprost están disponibles en formatos monodosis, formulados sin detergentes catiónicos (como el cloruro de benzalconio o los polímeros de amonio cuaternario), lo cual les permite estar especialmente indicados en pacientes alérgicos o intolerantes a los detergentes catiónicos. Algunos estudios in vitro, realizados sobre líneas celulares epiteliales de la conjuntiva, han sugerido que la formulación sin conservantes de tafluprost es capaz de mantener la integridad de las membranas de forma significativamente mayor que formulaciones de latanoprost, bimatoprost y travoprost con conservantes de tipo catiónico.
2. Agonistas colinérgicos
Son fármacos que aumentan la eliminación del humor acuoso a través de la estructura trabecular y el conducto de Schlemm mediante la contracción del músculo ciliar y del esfínter del iris. Este efecto lo producen por estimulación de los receptores colinérgicos presentes en el músculo liso del esfínter del iris, produciendo su contracción y, por tanto, la llamada miosis.
Antiguamente se utilizaban los inhibidores de la colinesterasa, pero por sus problemas de seguridad más importantes que los agentes colinérgicos de acción directa cayeron en desuso en la indicación de glaucoma. El fármaco más representativo de los colinérgicos mióticos –y único actualmente disponible, aunque escasamente empleado– es la pilocarpina (Figura 9) (Colircusí pilocarpina®; colirio oftálmico al 2%). Se suele instilar cada 6-8 horas.
Puede producir reacciones locales adversas importantes, particularmente trastornos de la acomodación, debido a que la estimulación colinérgica contrae el músculo ciliar, dejando el cristalino en una miopía acomodativa; por este motivo, los agentes colinérgicos son mal tolerados, especialmente por los pacientes jóvenes. También puede producir miosis, con empeoramiento de la visión nocturna, estrechamiento del campo visual periférico y visión borrosa, dolor e irritación ocular. A nivel sistémico, se ha descrito dolor de cabeza al inicio del tratamiento. El fármaco está contraindicado en pacientes con iritis aguda u otras circunstancias en las que no se desea constricción pupilar, y su uso debe ser estrechamente controlado en pacientes con asma bronquial.
3. Agentes osmóticos
Al aumentar la osmolaridad de la sangre, los fármacos osmóticos provocan una salida de líquido desde dentro del globo ocular al torrente sanguíneo, con lo que reducen el volumen del cuerpo vítreo. Solían emplearse usarse únicamente en terapia de corta duración, fundamentalmente como tratamiento preoperatorio y producen bastantes efectos adversos. La glicerina (Glicerotens®, actualmente suspendido) se administra por vía oral como solución concentrada; su acción es más lenta que la de los preparados inyectables como el manitol (Osmofundina® y EFG; soluciones al 10% y 20%) pero causa menos problemas, aunque puede alterar la glucemia. De los preparados inyectables, el manitol es preferible a la urea, que es más irritante para los tejidos y que suele penetrar en el globo ocular si está inflamado, perdiendo parte de su eficacia. El empleo de agentes osmóticos en la práctica habitual del manejo clínico de glaucoma es prácticamente inexistente.
4. Betabloqueantes adrenérgicos
Estos fármacos disminuyen la formación de humor acuoso por el cuerpo ciliar. La disminución de la PIO que aportan no es muy superior a la producida por los agentes mióticos o los α-adrenérgicos, pero los betabloqueantes presentan la ventaja de que no actúan sobre el diámetro pupilar y, por tanto, no producen trastornos de acomodación, como sí ocurre con los otros dos grupos de fármacos citados. Los betabloqueantes reducen la PIO en un 20-27% y sus efectos son aditivos con los de otros fármacos, como mióticos o inhibidores de anhidrasa carbónica, por lo que suelen emplearse en asociación; el beneficio de la asociación con α-adrenérgicos es más dudoso. Un aspecto a tener en cuenta es que no reducen la PIO durante la noche, a diferencia de los análogos prostaglandínicos.
No se han descrito grandes diferencias farmacodinámicas entre los distintos betabloqueantes disponibles (Figura 10). Se administran en forma de colirio y el fármaco de referencia del grupo, por veteranía y eficacia contrastada, es el timolol (Cusimolol®, Timakak®, Timoftol® y EFG; colirios oftálmicos al 0,25% y 0,5%); a día de hoy también están autorizados en España el betaxolol (Betoptic®; colirio al 0,25%) y el carteolol (Arteoptic® y Elebloc®; colirios al 1% y 2%). Todos ellos se suelen instilar cada 12 horas.
En líneas generales, los betabloqueantes son fármacos bien tolerados, aunque ocasionalmente pueden producir irritación ocular, disminución de la secreción lacrimal y visión borrosa. Rara vez producen efectos secundarios sistémicos porque su absorción a circulación general es reducida o residual. A pesar de ello, como precaución, están contraindicados en asma bronquial o EPOC, por el riesgo de empeoramiento del broncoespasmo, así como en pacientes con enfermedades cardiacas graves o no controladas (bradicardia sinusal, bloqueo cardiaco, insuficiencia cardiaca manifiesta o shock cardiogénico), por el riesgo hipotético de reducir el ritmo cardiaco y la conducción auriculoventricular; asimismo, deben usarse con precaución en pacientes diabéticos, ya que podrían –hipotéticamente– enmascarar algunos síntomas de una hipoglucemia. Posiblemente, el betaxolol es el que presenta menos problemas sistémicos, pero es peor tolerado localmente.
5. Inhibidores de la anhidrasa carbónica
La isoforma II de la anhidrasa carbónica (isoforma ocular) juega un papel clave en el control de la producción de humor acuoso, ya que, al generar bicarbonato e hidrogeniones en la cámara anterior del ojo, arrastra líquido desde los capilares sanguíneos y favorece su formación. Por tanto, la inhibición de este enzima disminuye la formación local de bicarbonato y, en consecuencia, de humor acuoso.
Cuando se administran por vía oral, los inhibidores de la anhidrasa carbónica son los reductores de presión intraocular más potentes, pero suelen producir efectos secundarios sistémicos que limitan su utilidad y, por ello, solo se emplean en casos resistentes a los antiglaucomatosos tópicos.
La acetazolamida (Edemox®, comprimidos 250 mg) es el único comercializado para uso por vía oral. Es muy potente pero, al presentar muchos efectos adversos, se utiliza solo para casos especiales; por ejemplo, se añade al tratamiento tópico cuando éste no es suficiente para mantener un adecuado control de la enfermedad durante un corto periodo de tiempo, en espera del momento de la cirugía en pacientes con glaucoma primario de ángulo cerrado.
Los derivados de administración tópica oftálmica reducen la presión intraocular en un 13-22% durante el día, pero tienen un efecto nocturno mucho más tenue. Entre ellos, se dispone de colirios con dorzolamida al 2% (Arzolam®, Trusopt® y EFG) o brinzolamida al 1% (Azopt® y EFG) (Figura 11). Se suelen instilar cada 8 horas y se emplean en monoterapia o asociados a otros antiglaucomatosos para incrementar el efecto. La brinzolamida da lugar a similares resultados que la dorzolamida, pero produce menos irritación (quemazón y picor), si bien se asocia a un riesgo incrementado de visión borrosa.
Un porcentaje pequeño pero significativo de pacientes (~3%) tratados con inhibidores de la anhidrasa carbónica tópicos abandonan el tratamiento, sobre todo por la conjuntivitis y la inflamación en los párpados; algunos pacientes también describen reacciones adversas sistémicas, como sabor amargo, cefalea, astenia o fatiga. Por otro lado, los efectos adversos tras la administración sistémica de acetazolamida son bien conocidos y hacen abandonar la medicación al 30-50% de los pacientes; entre ellos se incluyen parestesias, tinnitus, náuseas, anorexia, astenia, molestias gastrointestinales, acidosis metabólica, formación de cálculos renales y discrasias sanguíneas. En general, los tres inhibidores de la anhidrasa carbónica están contraindicados en pacientes con insuficiencia renal grave o acidosis metabólica.
6. Agonistas alfa-adrenérgicos
Los agonistas α2 adrenérgicos, debido a su efecto vasoconstrictor, disminuyen la producción de humor acuoso y, además, favorecen la salida del humor por la vía uveoescleral. En la práctica clínica actual del manejo del glaucoma, no se emplean los agonistas α-adrenérgicos inespecíficos (α1 y α2), como la adrenalina, la dipivefrina (profármaco de adrenalina) o la fenilefrina. Entre los agonistas α2 selectivos, se utilizan colirios de apraclonidina al 0,5% y 1%6 (Iopimax®) y de brimonidina al 0,2% (Abradel®, Alphagan®, Brimvera® y EFG) (Figura 12); ni tan siquiera la propia clonidina, también α2 selectiva, es empleada actualmente en esta indicación.
Estos dos fármacos tienen una buena capacidad de reducir la PIO (13-29%), pero sus inconvenientes principales son una incidencia alta de reacciones de hipersensibilidad en uso crónico, y la pérdida progresiva de la eficacia al cabo de un mes de tratamiento aproximadamente (tolerancia farmacológica). Están indicados, por tanto, en asociación con otros fármacos de los grupos anteriores para retrasar la cirugía o en tratamientos cortos en la profilaxis del aumento de la PIO en pacientes sometidos a cirugía láser.
Con respecto a su seguridad, entre el 11 y el 15% de los pacientes abandonan el uso de estos medicamentos por la aparición de reacciones adversas. Se producen con relativa frecuencia reacciones de intolerancia (10-12%), con hiperemia ocular, prurito, lagrimeo, sensación de cuerpo extraño y edema de párpados y conjuntiva. También, a nivel sistémico, se ha observado somnolencia, sequedad bucal y nasal, y alteraciones del gusto. Están contraindicados en pacientes con alteraciones cardiovasculares graves.
Por último, cabe destacar que en el arsenal terapéutico se dispone de numerosas presentaciones tópicas antiglaucoma a base de combinaciones del betabloqueante timolol con fármacos de otros grupos, sobre todo con análogos de prostaglandinas –bimatoprost (Ganfort® y EFG), latanoprost (Arucom®, Fixaprost®, Xalacom® y EFG), tafluprost (Taptiqom®) y travoprost (Duotrav®, Kivizidiale® y EFG)–, pero también con inhibidores de la anhidrasa carbónica –dorzolamida (Arzotim®, Cosduo®, Cosopt®, Duokopt® y EFG) y brinzolamida (Azarga®)– y con el agonista alfa-adrenérgico brimonidina (Combigan®). También está comercializado un medicamento que combina los principios activos brimonidina y brinzolamida (Simbrinza®).
Criterios de selección y estrategias farmacoterapéuticas
El objetivo del tratamiento farmacológico es evitar la aparición o frenar la evolución de la lesión nerviosa y conservar la función visual. En general, no se requiere ningún tratamiento en pacientes sin glaucoma y presión intraocular (PIO) ≤ 21 mmHg; tampoco se aconseja el tratamiento farmacológico en pacientes con un espesor central de la córnea (ECC) ≥ 590 μm. Para pacientes con ECC entre 555 y 590 μm, no es preciso ningún tratamiento cuando presentan una PIO ≤ 24 mmHg, mientras que la primera opción contemplada con una PIO de 25 a 32 mmHg son los betabloqueantes. Con una ECC < 555 μm se consideran de primera elección los derivados prostaglandínicos para una PIO de 22-25 mmHg y menores de 65 años, y para aquellos con una PIO de 25-32 mm Hg y menores de 80 años. Para cualquier paciente, con independencia de su ECC, con una PIO mayor de 32 mmHg el tratamiento de primera elección son también los derivados prostaglandínicos.
En pacientes tratados, si la PIO es de 12 mmHg o menos se considera que el control es idóneo y no hay que hacer cambios en el tratamiento ya que el glaucoma probablemente no evolucionará. En pacientes con glaucoma, si la PIO está entre 13 y 17 mmHg el control es bueno pero hay riesgo de deterioro. Si la PIO es de 18 o más mmHg el control se considera regular y el glaucoma muy probablemente evolucionará. Las decisiones sobre el cambio de tratamiento dependerán de la evolución del campo visual. Cuanto mayor es el daño del nervio óptico y mayor es la pérdida de campo visual, más intenso tiene que ser el tratamiento.
Actualmente, se considera un objetivo óptimo la reducción de un 30% de la PIO o, como mínimo, del 20%. La mayoría de tratamientos de monoterapia aportan reducciones medias de entre 4 y 8,5 mmHg, aunque la respuesta de los pacientes es bastante variable. Como norma general, se recomienda utilizar la concentración más baja del fármaco, con la mínima frecuencia posible (preferiblemente, una vez al día), para obtener el efecto deseado. Lo ideal es que se trate inicialmente un ojo, de forma que el otro actúe como control, y una vez conseguido el descenso esperado, se iniciará el tratamiento en el otro ojo.
Si la PIO no se reduce hasta un nivel satisfactorio, se puede considerar un aumento de la concentración del fármaco utilizado, su sustitución por otro del mismo grupo o incluso de otros grupos, o la adición de un segundo fármaco, aunque añadir un segundo fármaco en combinaciones a dosis fija aporta en general pequeñas reducciones adicionales (1-3 mmHg). En pacientes con daño glaucomatoso avanzado y niveles de PIO en el límite (alrededor de 22 mmHg), debe utilizarse una terapia más intensa para reducir la presión tanto como sea posible (unos 10-12 mmHg).
Si la PIO está dentro del rango considerado como fisiológico pero sigue existiendo un aumento de la excavación de la papila o defectos del campo visual a pesar del tratamiento, se puede sobreentender que esa PIO es demasiado elevada para el nervio óptico del paciente en particular. En tal caso, se debe introducir una terapia farmacológica adicional, evitando especialmente minimizar las oscilaciones diarias de la PIO.
Los betabloqueantes son considerados como los fármacos de elección en pacientes sin bradicardia, bloqueo cardiaco, asma, EPOC o insuficiencia cardíaca. Los análogos prostaglandínicos también se consideran de primera línea pero son algo peor tolerados, ya que, como se ha indicado, pueden producir hiperemia conjuntival, prurito ocular, hiperpigmentación del iris, depósitos corneales, hipertricosis de las pestañas (alargamiento y engrosamiento) y, a nivel sistémico, cefalea, astenia, alteración de la función hepática e hipertensión arterial. Algunos pacientes que no toleran o no responden a un fármaco de alguno de los grupos mencionados, pueden hacerlo a otro del mismo grupo.
Si hay falta de respuesta satisfactoria, puede intentarse un tratamiento combinado, aunque, como se ha dicho, las combinaciones no producen un marcado incremento del efecto sobre la presión intraocular. Entre esas combinaciones, se considera como primera elección la de un betabloqueante con un inhibidor de anhidrasa carbónica; otras alternativas son los betabloqueantes con análogos de prostaglaninas o con inhibidores de la anhidrasa carbónica por vía oral. La asociación de alfa-adrenérgicos con betabloqueantes no es antagónica, sino también aditiva.
La evidencia disponible apunta a que los betabloqueantes, los agonistas α2-adrenérgicos y los inhibidores de la anhidrasa carbónica tienen una eficacia muy similar en la reducción media de la PIO diurna cuando se utilizan en combinación con un análogo de la prostaglandina. Así, un meta-análisis demostró que no había diferencias estadísticamente significativas en el efecto neto ni en el efecto máximo, aunque la persistencia de la reducción de la PIO fue mayor en los pacientes tratados con los inhibidores de la anhidrasa carbónica (p< 0,001) y los betabloqueantes (p< 0,001) que en el grupo tratado con los agonistas α2-adrenérgicos. En términos de seguridad, el dolor ocular o de párpados, la sensación de quemazón y la xerostomía fueron significativamente más frecuentes en el grupo de los agonistas α2-adrenérgicos; de forma similar, la fatiga, la debilidad o mareos parecen más frecuentes con agonistas α2-adrenérgicos y con betaboqueantes en comparación con el grupo de los inhibidores de la anhidrasa carbónica, para los cuales tuvo una mayor incidencia la alteración del gusto o disgeusia (Tanna et al., 2010).
Otro meta-análisis de ensayos clínicos controlados –que realizó un estudio comparativo de la eficacia de las combinaciones de fármacos y la monoterapia para el glaucoma de ángulo abierto– concluyó que las combinaciones a dosis fijas de análogos de prostaglandinas y timolol son más eficaces en la reducción de la PIO que sus componentes individuales: en comparación con timolol en monoterapia, la combinación fija de latanoprost y timolol redujo en mayor medida la PIO (-2,74 mmHg) que la combinación fija de bimatoprost y timolol (-1,49 mmHg) o la combinación fija de timolol y travoprost (-1,93 mmHg). En cambio, las combinaciones a dosis fijas son menos eficaces que sus respectivas combinaciones no fijadas (diferencia de medias de 0,69; IC95% 0,29 a 1,08). Las combinaciones fijas conducen a un riesgo más bajo de hiperemia que las combinaciones no fijas (riesgo relativo, RR: 0,70; IC95% 0,43 a 1,14) y sus respectivos análogos de prostaglandinas en monoterapia (RR: 0,61; IC95%0,53 a 0,70) (Quaranta et al., 2013).
Un tercer meta-análisis de 11 ensayos clínicos controlados (1.493 pacientes) puso de manifiesto que la brimonidina proporciona un mayor beneficio clínico que los inhibidores de la anhidrasa carbónica por vía tópica, evaluados ambos como tratamiento adyuvante a betabloqueantes o análogos de prostaglandinas. Independientemente del fármaco principal, la disminución de PIO fue mayor en pacientes tratados con brimonidina como adyuvante que en el grupo tratado con inhibidores de la anhidrasa carbónica como adyuvante, tanto en los valores máximos (diferencia de medias: 0,99 mmHg) como en la curva diurna (0,62 mmHg) (Cheng et al., 2012)
Las consideraciones previas aplican en el tratamiento del glaucoma primario de ángulo abierto, el mayoritario. Por otro lado, en el caso del glaucoma agudo cerrado o estrecho, el tratamiento de fondo es quirúrgico, por lo que el único propósito de la terapia farmacológica es provocar el descenso rápido de la PIO (para alcanzar la recuperación de la transparencia de la córnea y un alivio del dolor) de forma previa a la intervención quirúrgica.
Con dicho fin, el tratamiento de los ataques agudos de glaucoma (fundamentalmente, de ángulo estrecho) consiste en administrar tópicamente un fármaco hipotensor para tratar de reducir la PIO a la vez que se intenta, por un lado, provocar una eliminación rápida de humor acuoso mediante el empleo de agentes osmóticos (manitol por vía intravenosa 1-2 g/kg, o glicerina por vía oral 1,0-1,5 g/kg) y, por otro, reducir su formación mediante el empleo de inhibidores de la anhidrasa carbónica por vía sistémica (acetazolamida 250 mg vía oral).
Con la administración de ambos fármacos se consigue reducir la PIO por debajo de 50 mmHg, permitiendo la reperfusión del ojo nuevamente y que el iris esté reactivo (por encima de estos valores el músculo del esfínter del iris está isquémico y refractario a estímulos o fármacos). La separación del iris del ángulo de la cámara anterior se puede conseguir mediante la instilación de colinérgicos tópicos para producir miosis (por ejemplo, una gota de pilocarpina al 1% cada 15 min y, si no responde, cada 5 min o a concentraciones de hasta el 4%) como paso previo a una iridotomía que permita la comunicación entre las cámaras anterior y posterior e impida que se produzca de nuevo el bloqueo pupilar. Si fuera necesario, pueden emplearse analgésicos, antieméticos y ansiolíticos; la administración de corticoides tópicos también ayuda a controlar la inflamación.
El tratamiento del glaucoma secundario depende de su etiología, pero en cualquier caso se deberá controlar la PIO con los mismos fármacos utilizados en el tratamiento del glaucoma primario del ángulo abierto. Si el tratamiento farmacológico no es suficiente, también está indicado el tratamiento quirúrgico; en general, el pronóstico de los glaucomas secundarios es peor que el de los casos primarios. Por último, el tratamiento del glaucoma congénito siempre es quirúrgico, siendo su pronóstico más favorable cuanto más precozmente se opere (Cuéllar, 2014; MSSSI, 2017; Castiñeira et al., 2018).
En estos últimos años y debido al aumento de los niveles de glutamato y al aumento del estrés oxidativo que se ha descrito en el glaucoma, algunos autores han planteado la posibilidad de considerar esta enfermedad como un proceso neurodegenerativo, y el tratamiento con agentes neuroprotectores como una nueva alternativa de farmacoterapia. Sin embargo, aunque es cierto que los fármacos neuroprotectores previenen la muerte celular, algunos ensayos clínicos realizados no han demostrado que sean capaces de prevenir la muerte de las células ganglionares en los pacientes con glaucoma primario de ángulo abierto, al menos a corto plazo (Sena et al., 2017).
Tratamiento no farmacológico
El tratamiento no farmacológico está justificado cuando el farmacológico es insuficiente, el paciente no tolera el tratamiento farmacológico –por reacciones alérgicas, reducción de la visión o dolor por espasmo ciliar, etc.– o no es capaz de cumplirlo adecuadamente. Asimismo, hay formas de glaucoma –como el congénito– que son remitidas directamente al tratamiento quirúrgico, con o sin láser.
Hoy día disponemos de diferentes tipos de láser, que permiten que la intervención se practique de forma ambulatoria (MSSSI, 2017). La trabeculoplastia láser de argón consiste en la aplicación de impactos de láser en la parte más anterior de la porción de filtración de la malla trabecular, con el fin retraerla y facilitar el drenaje del humor acuoso. Es una técnica eficaz que permite reducir al máximo el tratamiento farmacológico hipotensor, pero que presenta como una de sus principales limitaciones el hecho de que al cabo de 2 a 5 años, hasta la mitad de los pacientes (30-50%) suelen requerir tratamiento farmacológico o quirúrgico adicional, debido a un nuevo incremento de la PIO. Por su parte, las esclerostomías consisten en practicar mediante el láser orificios esclerales para que, bajo la conjuntiva, se permita la salida de humor acuoso; el problema de esta técnica radica en el frecuente cierre de los orificios.
La trabeculoplastia láser selectiva se asocia con una eficacia mayor de la reducción de la PIO en comparación con la trabeculoplastia con láser de argón, en particular en lo referente a facilitar una mayor reducción de la cantidad de medicamentos para el glaucoma; también parece ser más eficaz para los pacientes que no respondieron adecuadamente al tratamiento con láser anterior. La diferencia en la tolerabilidad entre ambos tratamientos con láser no parece ser significativa. Por otro lado, atendiendo al hecho de que la tasa de eficacia de la cirugía del glaucoma depende en buena medida de la velocidad de cicatrización tras la trabeculectomía, la utilización de radiación beta parece ralentizar dicha cicatrización y mejorar los resultados de la intervención.
La técnica quirúrgica filtrante o cirugía filtrante es un procedimiento también encaminado a favorecer la salida del humor acuoso y que se considera como el último escalón terapéutico. Consiste en la extirpación de una porción de tejido esclerocorneal profundo, lo cual permite poner en comunicación la cámara anterior con el espacio subconjuntival creando así una vía más eficaz para el drenaje del humor acuoso. Su eficacia fue claramente establecida en el estudio GIS hace ahora 20 años (AGIS, 2000). Se trata de un procedimiento invasivo, no exento de efectos secundarios y que no siempre resulta eficaz, de ahí la necesidad de recurrir en ocasiones a la aplicación local concomitante de ciertos agentes antineoplásicos (antimetabolitos como la mitomicina C o el fluorouracilo) que inhiben la cicatrización en la zona intervenida y mejoran los resultados de esta técnica, permitiendo a un alto porcentaje de pacientes mantener una reducción permanente de la PIO.
Una revisión de la Cochrane comparando las intervenciones farmacológicas frente a las quirúrgicas para el glaucoma de ángulo abierto (Burr et al., 2012) concluyó que la cirugía primaria reduce la PIO en mayor medida que la administración primaria de fármacos, pero se asocia con una mayor incidencia de molestias en los ojos. Además, hay datos que sugieren que la restricción del campo visual o la necesidad de cirugía de cataratas a los 5 años (y más allá) no son significativamente diferentes en función de si el tratamiento inicial es la farmacoterapia o la trabeculectomía. En los casos glaucoma de ángulo abierto más graves, parece que el inicio del tratamiento con farmacoterapia podría asociarse con una progresión mayor que la cirugía de glaucoma.
Con respecto al tratamiento quirúrgico del glaucoma primario de ángulo cerrado, una vez que la córnea está de nuevo transparente tras el tratamiento farmacológico de urgencia, como se ha comentado, debe realizarse una iridotomía con láser, tanto en el ojo afectado como en el contralateral, ya que un ataque agudo se presenta en el ojo opuesto en al menos el 50% de los casos. Si no se puede utilizar láser, es precisa la iridectomía periférica mediante apertura del globo ocular. Esta última es en la actualidad el tratamiento de elección, aunque solo el 42-72% de pacientes obtienen resultados satisfactorios; en caso de no poder controlar la PIO médicamente se recurre a la cirugía filtrante.
El tratamiento quirúrgico del glaucoma congénito tiene un pronóstico tanto más favorable cuanto más precozmente se realice. La goniotomía consiste en realizar una incisión en la malla trabecular hasta el canal de Schlemm, facilitando así la salida del humor acuoso; para ello, el cirujano oftalmólogo se ayuda de una lente de gonioscopia colocada en el ojo, que permite dirigir un goniotomo a través de la cámara anterior hacia la malla trabecular. Pueden necesitarse dos o tres goniotomías en diferentes localizaciones para conseguir una regulación eficiente en la PIO. Si la opacidad corneal evita la visualización del ángulo o si la goniotomía ha fracasado, puede precisarse una trabeculectomía mediante la que se elimina parte de la malla trabecular para establecer la comunicación entre la cámara anterior y el canal de Schlemm.
Hay que mencionar que en los últimos años han aparecido diversas máquinas y procedimientos quirúrgicos para reducir la PIO de forma menos invasiva y, en principio, más segura que la cirugía tradicional del glaucoma (Kerr et al., 2017). Una creciente evidencia ha sugerido que estas técnicas, conocidas como cirugía mínimamente invasiva, podrían ser utilizadas con éxito como tratamiento de inicio y permitirían reducir el uso de fármacos tópicos durante al menos 1 año. No obstante, un meta-análisis de estudios clínicos controlados y no controlados ha demostrado que la evidencia del favorable perfil beneficio-riesgo de estas técnicas deriva de estudios no comparativos, por lo que se requieren futuros ensayos clínicos controlados y amplios que permitan esclarecer su utilidad real y ventajas potenciales en el tratamiento del glaucoma (Lavia et al., 2017).
Finalmente, el tratamiento convencional para el glaucoma neovascular es la fotocoagulación panretiniana, método por el cual se utiliza el láser para destruir áreas de la retina y así minimizar la irrigación sanguínea innecesaria de la misma y reducir el crecimiento de neo-vasos sanguíneos anormales a fin de combatir la isquemia; sin embargo, la visión deficiente de la retina en la parte posterior del ojo puede limitar o incluso contraindicar su uso. La administración intravítrea de agentes antiangiogénicos –como ranibizumab o bevacizumab– frente a este tipo de glaucoma es otro tratamiento útil. Estos agentes pueden impedir el crecimiento de vasos sanguíneos anormales, con la ventaja potencial sobre la fotocoagulación panretiniana de que disminuyen el tiempo necesario para la recuperación tras el procedimiento (debido a la inflamación ocular o la visión borrosa asociada con esa técnica). Sin embargo, los efectos de los agentes antiangiogénicos para tratar el glaucoma neovascular tienden a ser temporales, persistiendo habitualmente entre 4 y 6 semanas.
—El tratamiento no farmacológico está justificado cuando el farmacológico es insuficiente, el paciente no tolera el tratamiento farmacológico o no es capaz de cumplirlo adecuadamente—
El papel asistencial del farmacéutico
El glaucoma es, según lo visto hasta aquí, una patología clínica y epidemiológicamente importante y, desde luego, un problema de Salud Pública de importante magnitud e impacto social (por la frecuente ausencia de síntomas y el riesgo de desembocar en ceguera), que adquiere una relevancia aún mayor en pacientes de edad avanzada, quienes pueden reunir diversas comorbilidades. Puesto que no se conoce la causa concreta que origina el glaucoma, son escasas –y de eficacia cuestionable– las medidas profilácticas que pudieran plantearse en la prevención de la patología.
Los pacientes con glaucoma van a desarrollar su vida en el ámbito ambulatorio y la práctica totalidad de los medicamentos indicados para el tratamiento del glaucoma son de dispensación y uso extrahospitalario. Por ello, es evidente que la proximidad del farmacéutico comunitario para el ciudadano permite que pueda ejercer una labor activa en la asistencia sanitaria a través de los Servicios Profesionales Farmacéuticos Asistenciales.
En este sentido, la oficina de farmacia es el establecimiento sanitario por el que pasan diariamente más 2,3 millones de personas y desde donde se ofrecen más de 182 millones de consejos sanitarios al año. De ahí que, sumado a su accesibilidad (con amplitud de horarios y sin necesidad de cita previa) y ubicuidad, la red española de más de 22.000 farmacias comunitarias dota al farmacéutico de una posición privilegiada en la divulgación de información rigurosa, adecuado para formar a los pacientes y promover una educación sanitaria que también redunde en una mejora del pronóstico y del uso de los tratamientos farmacológicos, contribuyendo a prevenir o informar rápidamente de los problemas relacionados con los mismos mediante la farmacovigilancia.
En cualquier caso, todos los profesionales farmacéuticos, desde sus diversos ámbitos profesionales y de competencias, pueden contribuir activamente al adecuado asesoramiento y asistencia a los ciudadanos y pacientes con glaucoma y otros trastornos visuales, a través de las vías asistenciales que se describen a continuación.
I. Contribución a la detección y diagnóstico precoz
Habida cuenta de la extraordinaria repercusión social que tienen los trastornos de la visión y de que la mayoría de los casos de glaucoma tienen un carácter progresivo y, en muchas ocasiones, insidioso (progresión lenta y prácticamente imperceptible para el propio paciente hasta que se alcanza un nivel de limitación visual importante e irreversible), la precocidad en el tratamiento se ha revelado como uno de las claves más importantes en el éxito terapéutico.
Para ello, obviamente, el farmacéutico puede prevenir y detectar problemas importantes de salud ocular, encauzándolos hacia el médico (de atención primaria o especialista), en su caso, para un diagnóstico y tratamiento detallados.
Un argumento que conviene trasladar a los pacientes con glaucoma –o con sospechas de padecerlo– es que su tratamiento no solo previene o retrasa el daño del nervio óptico y, por tanto, la evolución negativa del glaucoma (hacia una mayor deficiencia visual), sino que los pacientes parecen vivir más tiempo. Los resultados de un estudio, que analizó durante 4 años los resultados de más de 21.000 voluntarios con enfermedad ocular y sin ella, apuntan a que los fármacos antiglaucoma, tanto betabloqueantes como análogos de prostaglandinas, podrían reducir hasta un 74% el riesgo de muerte en comparación con las personas que no reciben estos tratamientos. Ese aumento en la esperanza de vida puede relacionarse con el mayor control médico de los pacientes que acuden regularmente al oftalmólogo o con los efectos antihipertensivos de ciertos tipos de fármacos antiglaucoma (Stein et al., 2010).
Resulta, por tanto, evidente la trascendencia que tiene la actuación de los farmacéuticos comunitarios en esa labor de prevención secundaria. Cualquier cambio brusco en la visión (reducción del campo visual, turbidez o deformación manifiesta de las imágenes) que pueda relacionarse con un ataque agudo de glaucoma debe ser identificado como una señal de alerta y representa una urgencia médica y, ante estos casos, la recomendación imperativa es la consulta inmediata al oftalmólogo. Pero, dado que la mayoría de los casos de glaucoma son lentamente progresivos, raramente el paciente se da cuenta de ello, por lo cual desde la farmacia es conveniente transmitir la recomendación de visitar periódicamente al oftalmólogo –preferiblemente, al menos 1 consulta anual– para hacer evaluaciones sistemáticas de la visión y, en general, del estado de salud ocular.
El glaucoma es, junto con la retinopatía diabética, la principal causa de ceguera adquirida, pero existen otras patologías oculares diversas que cursan con pérdida de visión progresiva (como la degeneración macular asociada a la edad, las cataratas, etc.), por lo que, ante cualquier sospecha de problema de visión, se debe derivar al paciente a la consulta con el médico.
II. Optimización de la terapéutica farmacológica
Una vez establecido, en su caso, el tratamiento farmacológico por el médico, la participación del farmacéutico en la dispensación y seguimiento farmacoterapéutico del mismo contribuirá a maximizar los beneficios clínicos y minimizar los riesgos de seguridad. Es importante informar al paciente de que, si se ajusta al tratamiento y a las instrucciones dadas por su médico y por su farmacéutico, la probabilidad de que su glaucoma evolucione hacia una ceguera completa es baja y, en cualquier caso, el proceso evolucionará de forma mucho más lenta si se realiza un buen cumplimiento del tratamiento y se acude periódicamente a una revisión oftalmológica.
A la hora de la dispensación de un medicamento que se empleará para el tratamiento del glaucoma, el farmacéutico deberá asegurarse de que el paciente conoce el método para una correcta administración y uso de los colirios oftálmicos prescritos, bien sea en formato multidosis (solución o suspensión para aplicar con un gotero) o en monodosis (aplicación en plástico para un solo uso).
Los consejos o informaciones que se pueden aportar a este respecto son los siguientes:
- Debe evitarse la utilización de lentes de contacto blandas con los colirios que contienen cloruro de benzalconio u otros detergentes catiónicos (como los polyquaternium)7, por el riesgo de hipersensibilidad al conservante. Se recomienda no colocarse las lentes hasta pasados 15 minutos tras la instilación del colirio o bien, si es posible, utilizar las formulaciones sin este tipo de conservantes, generalmente en forma de monodosis.
- Es conveniente establecer una rutina para la instalación de los colirios, procurando que se haga siempre a la misma hora. En caso de que la posología sea de una única administración al día, el medicamento debe administrarse preferiblemente por la noche, poco antes de acostarse, ya que así se obtiene el efecto óptimo.
- El paciente o quien vaya a aplicar las gotas debe realizar un lavado de manos tanto antes como después de aplicarlas.
- Proceso de aplicación: inclinar la cabeza del paciente hacia atrás y con el dedo índice de la misma mano separar el párpado inferior del ojo para formar una especie de saco. Dejar “caer” el medicamento en él y cerrar los ojos suavemente, manteniéndolos así durante 1-2 minutos. Tras la administración del colirio se debe presionar con el dedo medio de la misma mano el ángulo interno del ojo (así se reduce la posibilidad de absorción sistémica del fármaco). La punta del aplicador no debe entrar en contacto con ninguna superficie, incluida la del ojo.
- Cuando se utilice más de un colirio, se debe esperar de 10 a 15 minutos entre la instilación de cada medicamento para evitar el efecto “lavado” del segundo fármaco.
- Salvo que se trata de envases monodosis, debe mantenerse el envase siempre bien cerrado. En el momento que se abre un colirio, éste pierde su esterilidad y su estabilidad comienza “la cuenta atrás”, pudiéndose utilizar únicamente durante 30 días.
- Debe tenerse presente que es normal que el envase no esté totalmente lleno con el fin de facilitar la salida de las gotas.
Algunas consideraciones adicionales sobre el tratamiento farmacológico del glaucoma que deben ser tenidas en cuentas por farmacéuticos y pacientes son las siguientes:
- Algunos agentes antiglaucoma, particularmente ciertos derivados prostaglandínicos, pueden llegar a modificar la pigmentación del iris (haciéndola más oscura, en general) a lo largo del tratamiento, lo cual debe ser advertido antes del inicio del tratamiento.
- En caso de hiperemia, dolor o disminución de la visión, debe acudir a su médico.
- La sintomatología no se relaciona directamente con la PIO, por lo que el paciente no percibirá subjetivamente si está normal.
- Debe tenerse precaución para conducir o utilizar maquinaria especializada, ya que estos fármacos producen alteraciones visuales.
Según se ha sugerido, el éxito del tratamiento del glaucoma depende en gran medida del grado de cooperación por parte del paciente, y de la existencia de altos niveles de adherencia terapéutica. En el tratamiento del glaucoma se han descrito bajas tasas de adherencia terapéutica, por el riesgo evidente de que el paciente infravalore la importancia del tratamiento y de sus efectos a medio y largo plazo, sobre todo teniendo en cuenta que el glaucoma es asintomático para la mayoría.
Se estima que aproximadamente uno de cada tres pacientes a los que se les prescriben gotas oftálmicas por primera vez para el tratamiento del glaucoma, no utilizan las prescripciones en el primer año e incluso cuando lo hacen no siempre usan las gotas con la frecuencia que deberían. Además de la falta de conocimiento sobre el glaucoma y su tratamiento (que implica la no percepción de un beneficio claro con el mismo), se han propuesto como motivos la falta de memoria, la utilización de múltiples fármacos, la dificultad para colocarse las gotas y un estilo de vida ajetreado.
Las intervenciones desde la oficina de farmacia para paliar este problema –como la educación de pacientes combinada con intervenciones personalizadas de cambios de comportamiento y adaptación de las rutinas diarias para promover la administración de las gotas oftálmicas siempre a la misma hora– pueden mejorar significativamente el cumplimiento con la medicación del glaucoma. Aunque no hay suficientes pruebas como para recomendar una intervención en particular, la simplificación de los regímenes farmacológicos también podría ser beneficioso; en todo caso, las revisiones publicadas al respecto no aportan evidencias concluyentes (Waterman et al., 2013).
En caso de pacientes polimedicados, el farmacéutico debe estar alerta ante el riesgo de contraindicaciones o interacciones farmacológicas entre los medicamentos antiglaucomas y los usados para otras dolencias. Conviene recordar que algunos fármacos pueden empeorar un glaucoma, lo cual será dependiente del tipo de glaucoma. Así, en el caso del glaucoma de ángulo estrecho, no es aconsejable el uso de medicamentos que provoquen midriasis, como fármacos con propiedades anticolinérgicas (como espasmolíticos, antipsicóticos típicos, antidepresivos tricíclicos, algunos antihistamínicos de la primera generación –como difenhidramina, hidroxizina, doxilamina–, colirios midriáticos o ciclopléjicos utilizados en estudios de fondo de ojo) o estimulantes α1-adrenérgicos, como los descongestionantes vasoconstrictores, muchas veces también utilizados como colirios. En cambio, en el glaucoma de ángulo abierto (el mayoritario) no hay ningún inconveniente con el uso de estos fármacos. En todos los casos, no obstante, se deben tener en cuenta los efectos de los corticoides, que elevan la presión intraocular en el 40% de la población, incluso en gente que nunca tuvo glaucoma antes.
Trastornos de la córnea
Resumen
La córnea es la capa más externa del ojo y cumple funciones defensivas frente a traumatismos e infecciones, protegiendo al ojo de gérmenes y otros factores externos de riesgo. A grandes rasgos, los trastornos o afectaciones de la córnea pueden provocar dolor, lagrimeo y disminución de la agudeza visual.
Las enfermedades que pueden afectar a la córnea son muy diversas, y pueden producirse por virus, bacterias e incluso agentes tóxicos. El diagnóstico de las mismas implica normalmente la visualización de la estructura corneal mediante la tinción del ojo con fluoresceína. Para el tratamiento, es importante identificar la causa concreta y aplicar tratamiento tópico mediante el uso de colirios. En el caso de que el tratamiento médico no funcione puede ser necesario el empleo de cirugía y la realización de trasplante corneal. El presente artículo revisa, desde un punto de vista clínico, las principales patologías corneales.
Introducción
La córnea es la capa externa del ojo. Es una capa transparente y curvilínea que actúa como la primera lente que encuentra la luz cuando penetra en nuestro globo ocular. Para su correcta función, la córnea debe mantenerse transparente y es necesario que posea una curvatura adecuada, de modo que cumpla unas buenas propiedades ópticas de refracción.
Por su parte, la superficie ocular está formada por una serie de componentes que trabajan de forma conjunta para proteger el ojo y proporcionar una buena visión (Figura 1). Entre ellos, destacan, además de la córnea, las glándulas lagrimales y los párpados –encargados de la producción y distribución de la lágrima– y la conjuntiva; en general, son muy sensibles a las agresiones externas.
La córnea y la superficie ocular son una de las estructuras cuyo manejo clínico y tratamiento ha recibido un mayor número de innovaciones técnicas de diagnóstico y cirugía en los últimos años.
Como se ha indicado, de la transparencia de la córnea depende la capacidad visual de cada persona, por lo que podemos considerar a la córnea como la primera lente del sistema óptico de nuestros ojos, y se comprende que una deformidad o una falta de transparencia causará una imagen deteriorada en la retina. Así, una de sus principales funciones es el enfoque de las imágenes adaptándose a la visión cercana y lejana.
Adicionalmente a las involucradas en la visión, la córnea cumple funciones defensivas frente a traumatismos e infecciones, protegiendo al ojo de gérmenes y otros factores externos de riesgo. Por tanto, ayuda a proteger fundamentalmente la órbita ocular, el párpado, las lágrimas y la esclerótica (la parte “blanca” del ojo). Muchas enfermedades adquiridas o congénitas pueden afectar a la córnea.
Las fuentes para mantener la córnea nutrida son principalmente los capilares del limbo (nutren la parte periférica de la córnea), las lágrimas (aporte de glucosa en la película lagrimal), y el humor acuoso (encargado de nutrir las capas más externas de la córnea al ser el endotelio una capa unicelular).
Internamente, la córnea se estructura en varias capas:
- Epitelio corneal: está formado por 5-7 capas de células unidas entre ellas y a la membrana basal, la cual queda sustentada mediante fibras de anclaje denominadas hemidesmosomas. Su función es mantener la transparencia de la córnea y protegerla de los agentes externos. Posee la propiedad de una rápida cicatrización.
- Estrato de Bowman: es una superficie lisa, acelular, no regenerativa, situada entre el epitelio, el estroma y la córnea del ojo, que se hace más fina conforme envejecemos. Si bien la función de esta membrana aún no está del todo clara, los últimos estudios apuntan a que actúa como barrera física para proteger el plexo nervioso subepiteliar y ayudar a la recuperación sensorial, así como a la inervación del epitelio; también ayuda a la recuperación de la transparencia de la córnea. Está ausente en seres no primates, como por ejemplo en gatos, perros y ratones.
- Estroma corneal: es la parte más gruesa de la córnea en el ojo. Está compuesto por fibras de colágeno (aproximadamente 200) ordenadas en láminas paralelas a la superficie; la dirección entre ellas es oblicua, lo que ayuda a garantizar la transparencia de la córnea.
- Capa de Dua: se trata de la última capa que forma la anatomía de la córnea, separando la última capa de queratocitos.
- Membrana de Descemet: está formada por fibras de colágeno IV y, de forma dependiente de la edad, esta capa aumenta su tamaño (una micra de espesor cada 10 años). Su principal funcionalidad es la de servir como membrana basal modificada del epitelio posterior o endotelio corneal.
- Endotelio corneal: se forma por células hexagonales cuya función es la de deshidratar la córnea para mantenerla transparente. Puesto que las células endoteliales no se regeneran, se van perdiendo con la edad; además de por la edad, pueden perderse consecuencia de alguna distrofia, patología o cirugía ocular. Cuando existe un número desproporcionado de células en el endotelio, la córnea puede perder su humor acuoso y, con ello, su transparencia.
Trastornos o enfermedades de la córnea
Los trastornos o el daño en la córnea pueden causar dolor, lagrimeo y disminución de la agudeza visual. Para la exploración de la córnea suele utilizarse una lámpara de hendidura, un instrumento que permite al médico explorar la totalidad del ojo a gran aumento. Durante la exploración, suelen aplicarse colirios que contienen un colorante de color amarillo-verdoso llamado fluoresceína, que tiñe temporalmente las áreas dañadas de la córnea y permite ver dichas áreas, que de otro modo no serían visibles.
Los trastornos de la córnea, que se describirán a continuación, incluyen los siguientes:
- Queratopatía ampollar.
- Síndrome de Cogan.
- Úlcera corneal.
- Queratitis por herpes simple.
- Herpes zóster oftálmico.
- Queratitis intersticial.
- Queratoconjuntivitis seca.
- Queratocono.
- Queratomalacia.
- Queratitis ulcerativa periférica.
- Queratoconjuntivitis flictenular.
- Queratitis punteada superficial.
Queratopatía ampollar
La queratopatía ampollar o queratopatía vesicular es un trastorno que implica una hinchazón de tipo ampollar en la córnea. Los síntomas de esta enfermedad produce están relacionados con la inflamación corneal y la formación de ampollas o vesículas llenas de líquido en su superficie: puede aparecer sensibilidad al mirar luces brillantes y visión significativamente nublada. Además, las ampollas pueden romperse y provocar un dolor intenso, generalmente acompañado de una sensación de cuerpo extraño en el ojo, afectando en mayor medida a la visión.
El diagnóstico se realiza a través de la evaluación clínica, pues se basa en el aspecto característico de la córnea (hinchada, turbia y con ampollas en la superficie). Para la exploración, se debe emplear una lámpara de hendidura, utilizando fluoresceína durante la exploración.
Esta patología debe ser tratada por un oftalmólogo, bien mediante tratamiento farmacológico o, en los casos más graves, mediante tratamiento quirúrgico. Suelen emplearse, en primera instancia, gotas oftálmicas salinas (suero fisiológico hipertónico) y pomadas salinas (cloruro sódico hipertónico) para evacuar el exceso de líquido de la córnea. En algunas ocasiones también se administran fármacos reductores de la presión intraocular. También puede recomendarse el uso de lentes de contacto blandas durante un breve periodo de tiempo para disminuir la incomodidad, ya que actúan como vendaje de la córnea. Si se pierde visión o las molestias son importantes y prolongadas, se suele recurrir a un trasplante de córnea o queratoplastia.
Sindrome de Cogan
El síndrome de Cogan es una enfermedad autoinmunitaria (disfunción del sistema inmunitario que provoca que éste ataque a los tejidos propios del organismo) que causa inflamación de los ojos, los oídos y, a veces, de los vasos sanguíneos (vasculitis); cuando afecta los vasos sanguíneos, puede causar un problema potencialmente mortal llamado aortitis. A nivel ocular, el síndrome de Cogan puede afectar a diferentes partes del ojo, incluida la córnea.
Los pacientes pueden desarrollar dolor ocular, visión reducida, hipersensibilidad a la luz brillante y enrojecimiento ocular. Si los oídos se ven afectados, presentarán pérdida de audición, zumbidos en los oídos y vértigo. Si se afectan los vasos sanguíneos, podrían aparecer soplos cardíacos y claudicación vascular (dolor en las extremidades durante la actividad física).
El diagnóstico del síndrome de Cogan se sospecha cuando una persona tiene síntomas de inflamación de la córnea sin causa conocida. No obstante, se debe descartar la sífilis, la enfermedad de Lyme y el virus de Epstein-Barr, que pueden dar lugar a síntomas similares a los del síndrome de Cogan.
El tratamiento consiste en gotas oculares con corticoesteroides y comprimidos orales de estos fármacos. Como norma general, en un inicio se administra localmente en el ojo una gota con corticoesteroides para disminuir la inflamación corneal. Si no hay mejoría, si la inflamación es muy profunda, si el oído está afectado o si se detecta inflamación de los vasos sanguíneos (vasculitis-aortitis), los corticoesteroides se administran por vía oral. A veces, las personas afectadas se tratan con otros medicamentos, como ciclofosfamida, metotrexato, ciclosporina o infliximab.
Úlcera corneal
Una úlcera corneal es la presencia de una solución de continuidad en la córnea, producida por una infección o un traumatismo, que provoca la formación de una úlcera abierta en la córnea (Figura 2).
La causa pueden ser infecciones provocadas por bacterias, hongos, virus o parásitos como Acanthamoeba (que vive en aguas contaminadas). Pueden comenzar con la aparición de una lesión en la córnea, como sucede cuando un cuerpo extraño araña, penetra o se aloja en un ojo que está muy seco o, con mayor frecuencia, por el uso prolongado de lentes de contacto (debido a la irritación producida por las mismas, en especial si se han dejado puestas durante la noche o si no se han desinfectado correctamente).
Las recidivas de las úlceras corneales de origen vírico (a menudo causadas por virus del herpes simple) pueden estar provocadas por el estrés o producirse de manera espontánea. La deficiencia de vitamina A y de proteínas se consideran posibles factores de riesgo para la formación de una úlcera corneal.
Cuando los párpados no cierran correctamente, la córnea se seca y se irrita. Esta irritación puede provocar lesiones y la formación de úlceras en la córnea. También pueden ser la consecuencia del crecimiento de las pestañas hacia dentro (triquiasis) o de una inversión de los párpado (entropión) o de la inflamación de estos (blefaritis).
En general, cualquier úlcera corneal produce las siguientes manifestaciones clínicas: enrojecimiento, dolor, a menudo con sensación de cuerpo extraño, molestias e hipersensibilidad a la luz brillante, y mayor producción de lágrimas. Se puede observar la presencia de una zona blanquecina o grisácea en la córnea. En ciertos casos se desarrollan úlceras sobre toda la córnea y penetran en profundidad. Puede acumularse pus detrás de la córnea, que a veces forma una capa blanca en la parte inferior de ésta (hipopion). La conjuntiva suele estar inyectada en sangre. Cuanto más profunda es la úlcera, más graves son los síntomas y las complicaciones.
Las úlceras de la córnea pueden curarse con tratamiento, pero en algunos casos dejan una cicatriz fibrosa que impide la visión. Otras posibles complicaciones consisten en infecciones muy arraigadas, perforación de la córnea, desplazamiento del iris y destrucción de todo el tejido en la cavidad ocular, o de su mayor parte.
El diagnóstico se basa en la exploración ocular y la evaluación de la úlcera mediante el uso de una lámpara de hendidura previa tinción del ojo con fluoresceína. En algunas situaciones, es necesario raspar la superficie de úlceras grandes para tomar una muestra y realizar cultivos microbiológicos y así saber el germen causante de la infección y poder tratarlo de la forma más adecuada.
En todo caso, se trata de una urgencia médica que debe recibir tratamiento inmediato, para lo cual suele requerirse la aplicación de colirios antibióticos, antivíricos o antifúngicos, que deben administrarse con frecuencia, a veces incluso cada hora (día y noche) durante varios días. Las gotas que dilatan el ojo, tales como atropina o escopolamina, pueden aliviar el dolor y reducir la posibilidad de complicaciones. En los casos más graves puede ser necesario un trasplante de córnea (queratoplastia).
—Los trastornos que afectan a la córnea pueden causar dolor, lagrimeo y disminución de la agudeza visual, y suelen detectarse mediante una lámpara de hendidura—
Queratitis herpética
La queratitis herpética es una infección ocular que afecta a la córnea y que está causada por el virus del herpes simple, el virus también causante del herpes labial o febril; este virus nunca abandona el cuerpo después de una infección inicial (infección primaria), permanece en una fase latente (inactiva) y, a veces, puede reactivarse y causar una recidiva y una síntomatología más intensa.
Las infecciones primarias del ojo por herpes simple suelen darse en niños y causan una queratoconjuntivitis leve, que suele resolverse sin tratamiento en la mayoría de las ocasiones. Sin embargo, si la infección se reactiva, puede afectar más gravemente a la córnea y dar lugar a una pérdida visual temporal o permanente. Los síntomas de las infecciones primarias por herpes simple suelen parecerse a los de la conjuntivitis común, por lo que no es común un diagnóstico de la infección con este virus.
Los síntomas de una reactivación incluyen lagrimeo, enrojecimiento, sensación de cuerpo extraño en el ojo y sensibilidad a la luz brillante. En raros casos puede que la infección empeore y la córnea se inflame, dando lugar a visión borrosa. Cuantas más veces se repita la infección, más probable es que dañe una mayor superficie de la córnea y, si se repite varias veces, pueden producirse úlceras profundas, cicatrices permanentes, crecimiento de vasos sanguíneos en la córnea y pérdida de sensibilidad en la superficie del ojo. En caso de múltiples recurrencias virales, la queratitis herpética puede causar una discapacidad visual significativa, que puede ser permanente.
Para diagnosticar una infección por herpes simple se debe realizar una exploración ocular a través de la lámpara de hendidura y la tinción con fluoresceína. En este caso, suele ser necesario tomar muestras para analizar por microbiología y aislar el virus.
El tratamiento de la queratitis por herpes simple debe iniciarse tan pronto como sea posible. Se puede prescribir un fármaco antivírico, como trifluridina en colirio o ganciclovir en gel ocular. El aciclovir, otro fármaco antivírico, puede tomarse por vía oral o por vía intravenosa, en función de la gravedad de la afectación; el valaciclovir también puede tomarse por vía oral. Las infecciones profundas que causan una gran inflamación pueden requerir el uso de colirios con corticoesteroides y fármacos que dilatan la pupila, como ciclopentolato, atropina o escopolamina.
Herpes zóster oftálmico
El herpes zóster oftálmico es la infección ocular provocada por el virus varicela-zóster, el virus causante de la varicela. Una vez la persona se infecta, el virus permanece en una fase latente en las raíces nerviosas, de forma que puede reactivarse y extenderse a la piel en algunas personas y situaciones de inmunodeficiencia, causando el herpes zóster. Entre sus signos clínicos, pueden aparecer parestesias en la frente antes que cualquier otro síntoma; la piel de la frente y, a veces, la punta de la nariz se cubren de pequeñas ampollas rojas, extremadamente dolorosas.
La infección del ojo se manifiesta con dolor, enrojecimiento, sensibilidad a la luz e hinchazón de los párpados. La córnea puede infectarse e inflamarse. Meses o años después, la córnea infectada puede hincharse, resultar gravemente dañada y desarrollar cicatrices. Es posible que se inflamen las estructuras situadas detrás de la córnea (uveítis), que la presión ocular aumente (glaucoma) y que la córnea se insensibilice, lo cual la hace más propensa a sufrir otras lesiones.
De forma similar a cualquier infección por herpes zóster en otra parte del cuerpo, el tratamiento precoz con un fármaco antivírico como aciclovir, valaciclovir o famciclovir por vía oral reduce la duración del cuadro clínico. Cuando el herpes zóster infecta la cara y pone en peligro el ojo, el tratamiento con un fármaco antivírico reduce el riesgo de complicaciones oculares. También puede requerirse la administración de corticoesteroides, normalmente en colirios, si el ojo está inflamado. Los colirios de fármacos como ciclopentolato o atropina se usan para mantener la pupila dilatada, ayudan a evitar una forma grave de glaucoma y alivian el dolor.
En términos de prevención, se recomienda una vacuna frente al herpes zóster recombinante para adultos inmunocompetentes de más de 50 años, independientemente de si padecieron herpes zóster o recibieron la vacuna a virus vivos atenuados más antigua. Esta vacuna recombinante disminuye la probabilidad de contraer herpes zóster un 97% en los adultos entre 50 y 69 años y un 91% en los adultos ≥ 70 años.
Queratitis intersticial
La queratitis intersticial es un trastorno ocular grave que lleva consigo la inflamación de las capas medias de la córnea. Por lo general, ocurre en personas que han tenido infecciones oculares. Aunque es muy poco frecuente, la mayoría de los casos ocurren en niños o adolescentes como una complicación de la sífilis congénita; otras causas de queratitis intersticial son el síndrome de Cogan, la enfermedad de Lyme, la infección por el virus de Epstein Barr, la sífilis adquirida, el herpes simple, el virus de la varicela zóster y la tuberculosis.
Esta patología puede afectar a un solo ojo o a ambos. Se manifiesta con lagrimeo, dolor ocular, visión borrosa y aumento de la sensibilidad a la luz brillante. A veces, con la queratitis intersticial debida a la sífilis, la córnea se vuelve turbia y puede causar una pérdida permanente de la visión.
El diagnóstico se basa en la exploración ocular donde se puede apreciar una opacificación corneal y otros hallazgos, siendo fundamental determinar la etiología específica. Los estigmas de la sífilis congénita, los síntomas vestíbulo-auditivos, los antecedentes de exantema progresivo y la exposición a garrapatas pueden apoyar etiologías específicas. Sin embargo, en todos los pacientes deben realizarse pruebas serológicas, que incluyen todas las siguientes:
- prueba de absorción de anticuerpos fluorescentes antitreponema o ensayos de microhemaglutinación para Treponema pallidum;
- determinación del título de Borrelia burgdorferi (enfermedad de Lyme);
- panel del virus Epstein-Barr.
Los pacientes con pruebas serológicas negativas pueden tener un síndrome de Cogan, o un síndrome idiopático consistente en queratitis intersticial y déficits vestibulares y auditivos. Para impedir un daño vestíbulo-auditivo permanente, ante la presencia de hipoacusia, acúfenos o vértigo debe derivarse con urgencia al paciente a un otorrinolaringólogo.
El tratamiento de la enfermedad subyacente puede resolver la queratitis. Suele ser aconsejable el tratamiento adicional con un corticoide, como prednisolona al 1% cuatro veces al día.
Queratoconjuntivitis seca
La xeroftalmía (queratoconjuntivitis seca) es la sequedad de la conjuntiva y la córnea. Puede deberse a una inadecuada producción de lágrimas (sequedad ocular por deficiencia en el componente acuoso de la lágrima), en cuyo caso las glándulas lagrimales no producen lágrimas suficientes para cubrir completamente la conjuntiva y la córnea. Es el más frecuente en mujeres posmenopáusicas y también en el Síndrome de Sjögren; en raras ocasiones, la xeroftalmía por deficiencia en el componente acuoso de las lágrimas puede ser un síntoma de enfermedades como la artritis reumatoide o el lupus eritematoso sistémico (lupus).
Pero también puede deberse a una anomalía en la composición de las lágrimas que da como resultado una rápida evaporación de las mismas (sequedad ocular por evaporación). Aunque las glándulas lagrimales produzcan una cantidad suficiente de lágrimas, el grado de evaporación es tan alto que la superficie del ojo no está bien lubricada con una capa completa de lágrimas, en especial durante ciertas actividades o en determinados ambientes. Una causa menos frecuente de xeroftalmía podría relacionarse con una apertura parcial de los ojos durante ciertos periodos de tiempo por la noche (lagoftalmía nocturna) o por una tasa insuficiente de parpadeo (como puede ocurrir en la enfermedad de Parkinson).
Los síntomas de la xeroftalmía son irritación, quemazón, prurito, sensación de tirantez, presión detrás del ojo y sensación de “arenilla” o de cuerpo extraño en el ojo. Las lesiones de la superficie del ojo aumentan las molestias y la sensibilidad a la luz brillante. Si bien suelen disminuir con tiempo frío, lluvioso o nublado y en lugares húmedos (como la ducha), las manifestaciones clínicas empeoran en los casos o situaciones siguientes:
- Actividades en que la frecuencia del parpadeo disminuye, fundamentalmente las que requieren un gran esfuerzo visual (tales como leer, trabajar con la computadora, conducir o ver la televisión).
- Lugares donde haya corrientes de aire, polvo o humo, ambientes secos (como el interior de los aviones o centros comerciales), áreas con baja humedad y áreas donde se utilicen aires acondicionados (en especial en el interior de vehículos), ventiladores o estufas.
- El tratamiento con ciertos fármacos, incluidos la isotretinoína y algunos ansiolíticos, diuréticos, antihipertensivos, anticonceptivos orales y antihistamínicos, así como otros fármacos con efectos anticolinérgicos.
Es muy poco frecuente que la xeroftalmía, incluso en los casos más graves, produzca pérdida de la visión. Sin embargo, algunos pacientes pueden presentar visión borrosa o irritación ocular grave, frecuente y prolongada, hasta el punto que les resulta difícil realizar actividades cotidianas con normalidad. En algunos pacientes con xeroftalmía grave, es posible que la superficie de la córnea se vuelva más espesa o que se desarrollen úlceras y cicatrices; a veces, se observa el crecimiento de vasos sanguíneos a lo largo de la córnea. Tanto las cicatrices como el crecimiento de los vasos sanguíneos pueden dañar la visión.
El diagnóstico se realiza mediante la exploración ocular con lámpara de hendidura y tinción con fluoresceína. También existen algunas herramientas útiles como es el test de Schirmer, en el que se coloca una tira de papel de filtro en el borde del párpado para medir la cantidad de lágrimas producidas durante la prueba, que dura 5 minutos; posteriormente, se mide la longitud de papel que está humedecido por la lágrima que ha migrado por el mismo (normal más de 10 mm). La medición del tiempo que tarda el ojo en secarse cuando la persona fija la mirada (prueba del tiempo de ruptura de la película lagrimal) también puede ser una técnica útil para el diagnóstico.
Con respecto al tratamiento, las lágrimas artificiales, aplicadas cada pocas horas, pueden controlar el problema en muchos casos. Las pomadas lubricantes aplicadas antes de acostarse duran más que las lágrimas artificiales y ayudan a evitar la sequedad matutina; pero no suelen utilizarse durante el día ya que pueden nublar la vista.
Por otro lado, los colirios con ciclosporina pueden disminuir significativamente la inflamación asociada a la xeroftalmía. Si bien la instilación de estas gotas produce picor y han de pasar meses antes de que se note su efecto (solo son eficaces en algunas personas). Entre las medidas no farmacológicas, resulta beneficioso evitar ambientes secos y con corrientes de aire o humo, y usar humidificadores.
Un oftalmólogo puede llevar a cabo un procedimiento para ayudar a las personas con ojo seco, que consiste en la inserción de unos tapones pequeños en los puntos lagrimales para evitar que las lágrimas salgan del ojo; así, se bloquea la secreción de lágrimas desde la superficie ocular a través del conducto lagrimal y hacia el interior de la nariz, consiguiendo que aumente la cantidad de lágrimas que bañan los ojos. En personas con sequedad ocular muy grave, se procede a cerrar los párpados parcialmente cosiéndolos entre sí (tarsorrafia) para reducir la evaporación de las lágrimas.
Si una persona que padece xeroftalmia tiene además blefaritis, se trata con medidas como compresas tibias, dispositivos de masaje y calefacción, friegas en los párpados y, a veces, antibióticos orales.
Queratocono
El queratocono, también llamado córnea cónica o estafiloma cónico, es un trastorno ocular que consiste en un cambio gradual de la forma de la córnea, que se vuelve irregular y adopta una forma cónica, lo que empeora la visión. Es una afección que, por lo general, comienza entre los 10 y los 25 años de edad, afecta siempre a ambos ojos produciendo alteraciones significativas de la visión; en la mayoría de las personas exige frecuentes cambios en la graduación de las gafas o las lentes de contacto.
Aunque la causa es desconocida, la propensión a desarrollar queratocono aumenta si existem los siguientes factores de riesgo:
- un familiar con queratocono;
- tendencia a desarrollar muchas alergias (lo que en ocasiones se denomina atopia);
- tendencia a frotarse vigorosamente los ojos;
- laxitud de los párpados;
- ciertos trastornos del tejido conjuntivo (por ejemplo, síndrome de Ehlers-Danlos, síndrome de Marfan y osteogénesis imperfecta);
- síndrome de Down;
- trastornos evidentes desde el nacimiento que causan problemas de visión (por ejemplo, amaurosis congénita de Leber, retinopatía del prematuro y ausencia de iris en un ojo o aniridia);
- o apnea obstructiva del sueño.
Las lentes de contacto a menudo corrigen los problemas de la visión mejor que las gafas. Hay muchos diseños de lentes de contacto (por ejemplo, rígidas permeables al gas, híbridas, esclerales) que pueden ser bien tolerados y dar una buena visión. Sin embargo, a veces el cambio en la forma de la córnea es tan grande que, o bien no puede usarse ningún tipo de lentes de contacto, o bien no consiguen corregir la visión.
Los tratamientos con luz ultravioleta que endurecen la córnea (conocidos como entrecruzamiento de colágeno) son eficaces para el queratocono en estado inicial, a fin de evitar su progresión. La inserción de segmentos de anillos corneales (objetos que cambian la forma de la córnea para ayudar a corregir la refracción) parecen mejorar la visión al permitir una mejor tolerancia de las lentes de contacto; pueden evitar que ciertas personas necesiten un trasplante de córnea, aunque en casos extremos éste se hace necesario para recuperar la visión.
Queratomalacia
La queratomalacia es un trastorno que comporta la desecación y el enturbiamiento de la córnea como consecuencia de un déficit de vitamina A, que se produce básicamente en personas con desnutrición.
En la queratomalacia, la superficie de la córnea y de la conjuntiva se secan, lo cual a veces provoca que aparezcan úlceras e infecciones bacterianas. Las glándulas lagrimales también se ven afectadas, derivando en una inadecuada producción de lágrimas y sequedad ocular; las personas con sequedad ocular extrema pueden desarrollar manchas espumosas (manchas de Bitot) en la conjuntiva. La ceguera nocturna puede desarrollarse por la deficiencia de vitamina A en la retina.
En una persona mal nutrida, el diagnóstico de queratomalacia se basa en la presencia de sequedad y de úlceras en la córnea. Se trata mediante la aplicación de colirios o pomadas con antibióticos, que pueden ayudar a curar la infección, pero también es importante corregir la carencia de vitamina A y la desnutrición con una mejor dieta, que podría enriquecerse con suplementos.
Queratitis ulcerativa periférica
La queratitis ulcerativa periférica es un trastorno ocular grave que implica inflamación y ulceración de la córnea que suele aparecer en personas que padecen enfermedades del tejido conjuntivo. La causa de la queratitis ulcerativa periférica reside probablemente una reacción autoinmune. Los trastornos del tejido conjuntivo que acompañan a la queratitis ulcerativa periférica incluyen la artritis reumatoide, la granulomatosis de Wegener y la policondritis recidivante. También puede estar causada por una infección.
Los afectados sufren vista borrosa, hipersensibilidad a la luz brillante y sensación de cuerpo extraño en el ojo. A diferencia de algunos trastornos previamente comentados, la úlcera se halla localizada en la periferia de la córnea y suele tener una forma ovalada.
El diagnóstico de queratitis ulcerativa periférica se sospecha cuando el médico observa la córnea afectada en una persona que también tiene una enfermedad grave o de larga duración del tejido conjuntivo. Ante la sospecha de que exista una infección como causa de queratitis ulcerativa periférica, se suele raspar la úlcera y los márgenes de los párpados para obtener una muestra y poder así aislar el germen.
En caso de no recibir tratamiento, alrededor del 40% de los pacientes que padecen de forma concomitante una patología autoinmune del tejido conjuntivo y queratitis ulcerativa periférica fallecen –en la mayoría de los casos por infarto de miocardio– en los 10 años siguientes al desarrollo de la queratitis. En cambio, con el tratamiento adecuado solo mueren antes de los 10 años aproximadamente el 8% de los afectados. La causa de la muerte no suele ser el trastorno ocular, sino más bien el efecto sistémico de la enfermedad autoinmune subyacente.
En base a lo anterior, el tratamiento de la queratitis ulcerativa periférica se aborda con fármacos inmunosupresores, como el metotrexato, la ciclofosfamida o el rituximab por vía oral o por vía intravenosa. Otra opción de tratamiento consiste en rellenar la úlcera con un material especial (llamado adhesivo tisular) y luego cubrir la zona con unas lentes de contacto especiales para controlar la inflamación. Alternativamente, se puede reparar quirúrgicamente la córnea con un trasplante de córnea de espesor parcial.
Queratoconjuntivitis flictenular
La queratoconjuntivitis flictenular es un trastorno ocular –más frecuente en niños que en adultos– cuyo origen es una reacción inmunitaria de la córnea y la conjuntiva a las bacterias. No es una infección, sino una reacción del sistema inmunitario a las bacterias que se encuentran en o alrededor de los ojos. Algunas de las bacterias que provocan este trastorno son estafilococos y, con muy poca frecuencia, Mycobacterium tuberculosis y especies de Chlamydia.
En muchas personas se manifiesta con enrojecimiento ocular, visión borrosa, mayor sensibilidad a la luz brillante, sensación cuerpo extraño y, a veces, escamas visibles en los bordes de los párpados (blefaritis seborreica). Por lo general, aparecen unas protuberancias pequeñas, de color amarillo con tonos grises –llamadas flicténulas– en el limbo (área donde la conjuntiva se adhiere a la córnea), en la propia córnea o en la conjuntiva, que duran entre varios días y dos semanas.
En la conjuntiva, estas flicténulas se convierten en llagas abiertas (úlceras), pero se curan sin dejar cicatriz. Pero cuando la córnea resulta afectada, puede hacerse patente un desgarre severo, fotofobia (dolor al enfocar una luz en el ojo), visión borrosa, dolor y sensación de cuerpo extraño. Las personas con recidivas frecuentes pueden desarrollar opacidad de la córnea, pudiendo crecer en la superficie de ésta pequeños vasos sanguíneos, de forma que la visión puede deteriorarse.
El diagnóstico de la queratoconjuntivitis flictenular se basa en el aspecto característico de los ojos. Es necesario en ocasiones hacer despistaje de la tuberculosis y, una vez descartada esta infección, se pueden administrar colirios que contienen una combinación de corticosteroides y antibióticos. Las personas que sufren blefaritis como consecuencia de una dermatitis seborreica concomitante (blefaritis seborreica) pueden darse masajes suaves en los bordes de los párpados para ayudar a prevenir una nueva aparición de la enfermedad.
Queratitis punteada (punctata) superficial
La queratitis punteada es un trastorno ocular provocado por la muerte de pequeños grupos de células de la superficie de la córnea. La causa de esa muerte celular de la queratitis punteada puede ser cualquiera de las siguientes:
- una infección vírica;
- una infección bacteriana (incluyendo el tracoma);
- sequedad ocular (xeroftalmía);
- lesión ocular por contacto con productos químicos fuertes;
- exposición a los rayos ultravioleta (luz solar, lámparas solares o arcos de soldadura);
- uso prolongado de lentes de contacto;
- alergia a colirios;
- blefaritis (inflamación de los párpados);
- la parálisis de Bell;
- o un efecto secundario de ciertos fármacos administrados por vía oral o intravenosa.
La queratitis punteada suele producir dolor ocular, lagrimeo, hipersensibilidad a la luz brillante, enrojecimiento ocular y visión ligeramente borrosa. A menudo puede sentirse ardor, sensación de arenilla o de cuerpo extraño en el ojo.
Cuando los rayos ultravioleta son la causa del trastorno, los síntomas no se manifiestan hasta varias horas después de la exposición y duran entre 1 y 2 días. Cuando la causa del trastorno es un virus, el ganglio linfático que se encuentra delante del pabellón auditivo aparece inflamado y sensible al tacto.
El diagnóstico de la queratitis punteada se basa en los síntomas, debiéndose determinar si ha habido exposición a alguna de las causas conocidas, y en la exploración de la córnea con una lámpara de hendidura. Durante la exploración, se utiliza fluoresceína para teñir el ojo y poder visualizar áreas dañadas de la córnea.
El tratamiento depende fundamentalmente de la causa, pero casi todos los pacientes con queratitis punteada se recuperan por completo. Se debe tener en cuenta lo siguiente:
- Cuando la causa es un virus (que no sea una infección ocular por herpes simple o herpes zóster), no se requiere tratamiento y la recuperación suele producirse al cabo de 3 semanas.
- Si la causa es una infección bacteriana o el uso prolongado de lentes de contacto se recurre a la administración tópica de antibióticos y, temporalmente, se prescinde de las lentes de contacto.
- Si la causa es la xeroftalmía (ojo seco), son efectivas las pomadas y las lágrimas artificiales, a fin de humedecer el ojo.
- Si la causa del trastorno es la exposición a los rayos ultravioleta, las pomadas con antibiótico y las gotas que dilatan la pupila pueden proporcionar alivio.
- Por último, en caso de que la causa del trastorno sea la reacción a un fármaco o la irritación provocada por una alergia a los colirios, deben suspenderse el fármaco o las gotas para los ojos.
Cannabis y cannabinoides: perspectiva actual de su uso terapéutico
Resumen
En los últimos años el debate mundial sobre el uso medicinal del cannabis se ha intensificado. La demanda de ciertos colectivos de pacientes sobre la utilización de preparados estandarizados a base de cannabis para aliviar determinados síntomas o mitigar sus dolencias plantea nuevos retos en la terapéutica y en el ámbito de la jurisprudencia. Además, la legalización del cannabis para otros usos que no se circunscriban al ámbito médico genera gran controversia por el hecho de que su consumo podría derivar en un problema importante de Salud Pública, más aún cuando se está comprobando que las concentraciones de tetrahidrocannabinol (THC) en los preparados a base de cannabis se ven incrementados con respecto a las de cannabidiol (CBD). Por lo tanto, la aplicación de políticas sanitarias que regulen el uso medicinal del cannabis y permitan o restrinjan el acceso a determinadas preparaciones resulta imprescindible para preservar la salud de los pacientes.
El presente artículo pretende realizar una revisión profunda sobre el conocimiento de la farmacología y el potencial terapéutico del cannabis, con especial referencia a su situación actual –uso medicinal vs. uso recreativo– en España y a nivel internacional, tanto de consumo como en la legalidad vigente.
Introducción
Farmacéutico. Dirección de Internacional. Consejo de Colegios Farmacéuticos de España.
El interés científico por el uso medicinal (o uso médico, del inglés medical use) de preparados derivados de la planta del cannabis está siendo un importante foco de atención en los últimos años. Tal y como se recogió en la Convención Única de Estupefacientes de 1961, con la palabra cannabis se designa a “las sumidades, floridas o con fruto, de la planta cannabis (a excepción de las semillas y las hojas no unidas a las sumidades) de las cuales no se ha extraído la resina, cualquiera que sea el nombre con que se las designe”. Se entiende por planta del cannabis o marihuana a todas las plantas del género Cannabis (familia Cannabaceae), y la resina de cannabis o hachís hace referencia a aquella parte separada, en bruto o purificada, obtenida de la planta del cannabis. La trascendencia de estas definiciones radica en que a partir de ellas se establecerán los controles que caracterizarán el uso de la planta y sus partes aplicables en la fabricación de medicamentos, cosméticos o complementos alimenticios.
Existen distintas variedades (en ocasiones denominadas subespecies) de cannabis de posible utilidad en terapéutica. El Cannabis indica, catalogado por Jean-Baptiste Lamarck en 1783, es una variedad de cannabis originaria de Asia Central (Pakistán, Afganistán, etc.) y ampliamente cultivada en Quebec y el resto de Canadá. Suele proporcionar especímenes con mayores concentraciones en tetrahidrocannabinol (THC) que Cannabis sativa, la variedad más común en casi todo el mundo, que fue descrita por primera vez por Carl Von Linneo en 1753. Más tarde, en 1924, Dmitrij Janichevsky catalogó una nueva variedad de cannabis, Cannabis ruderalis, principalmente cultivada en el norte del Himalaya y al sur de Rusia y cuyo contenido en THC era mínimo.
En la actualidad, las variedades de cannabis más ricas en THC, que son aquellas más susceptibles de tráfico ilegal, se obtienen de cultivos hidropónicos (que emplean disoluciones minerales en vez de suelo agrícola) y producciones domésticas. Para la resina del cannabis, los cambios en las concentraciones de THC se han atribuido a la introducción de variedades de cannabis provenientes de Marruecos con niveles muy superiores de THC de lo esperado, especialmente desde 2011. Además de esto, el mejor precio –en comparación con la propia planta– al que se puede encontrar actualmente en el mercado ilegal ha fomentado que la resina de cannabis parezca ser ahora más atractiva, desde el punto de vista del consumo recreativo, para los consumidores europeos de cannabis (Freeman et al., 2019).
Historia
Para entender mejor la situación actual del uso del cannabis y cannabinoides, es importante poner en contexto la evolución que éste ha experimentado a lo largo de su historia.
El inicio del cultivo del cannabis se circunscribe a la zona de Asia central. La primera evidencia de su uso se encontró en China, donde descubrimientos arqueológicos reportaron el uso de sus fibras para fines textiles. El emperador chino, Shen Nung, descubridor del té, del ginseng y de la efedrina, es considerado como la primera persona que describió las propiedades y el uso terapéutico del cannabis en su compendio de plantas medicinales Pen Ts’ao, escrito en el año 2737 a.C. (Li et al., 1974). Desde China, el cannabis se extendió a India, donde su uso se encuentra estrechamente asociado con rituales religiosos (Ben Amar et al., 2018). De hecho, el Atharvaveda, una colección de textos hinduistas de origen anónimo, la considera como una de las plantas sagradas, refiriendo de ella que es fuente de felicidad, aporta la alegría y trae la libertad (Touwn et al., 1981).
Los efectos psicoactivos de la planta eran ya bien conocidos en la India, posiblemente debido a la forma en que se preparaba. La preparación más débil era el Bhang, que consistía en las hojas secas de las cuales las flores se eliminaban cuidadosamente. Una preparación más fuerte era el Ganja, que se preparaba con las flores de la planta femenina. Y la más fuerte de todas era el Charas, hecho exclusivamente de la resina procedente de las flores femeninas que contenían los tricomas en los cuales se encuentran la mayor concentración de cannabinoides activos. En Persia, el efecto de la planta ya se empezaba a conocer, haciéndose una distinción clara entre sus efectos eufóricos iniciales y sus efectos disfóricos tardíos (Touwn et al., 1981).
Por otra parte, la introducción del cannabis en Europa parece remontarse a la época de los pueblos escitas1, quienes fumaban los granos de cannabis y experimentaban la manifestación de sus efectos euforizantes. Como se ha indicado previamente, no fue hasta 1753 cuando el botánico sueco Carl von Linneo describe la primera variedad de cannabis, dándole el nombre de Cannabis sativa e introduciendo dicha especie en su obra Species plantarum (“Las especies de las plantas”). En el siglo posterior, en 1830, el profesor de farmacología y botánico Theodor Friedrich Ludwing Nees von Esenbeck habla abiertamente de la utilización terapéutica del cannabis en numerosos problemas del sistema nervioso con menos efectos que los derivados del opio o el beleño (Hyoscyamus spp). Nueve años más tarde, en 1839, el médico irlandés William O’Shaughnessy describe por primera vez las propiedades analgésicas, orexígenas, antieméticas, antiespásticas y anticonvulsivantes del cannabis (Ben Amar et al., 2018).
En el siglo XX se producen acontecimientos de gran notoriedad en la historia del uso del cannabis. En 1940, los investigadores americanos Adams, Hunt y Clark aíslan el cannabidiol de la marihuana (Burstein, 2015). Un año después, el cannabis se retira de la doceava edición de la Farmacopea americana, perdiendo así su legitimidad terapéutica (Russo et al., 2003). En 1964, los israelíes Raphael Mechoulam y Yechiel Gaoni, aislaron e identificaron por primera vez el Δ9-tetrahidrocannabinol (THC), al que nombran inicialmente como Δ1-trans-tetrahidrocannabinol (Mechoulam et al., 1965). La identificación del THC supuso la dinamización de la investigación farmacológica sobre los cannabinoides, lo que condujo a un mejor entendimiento del sistema endocannabinoide y los receptores implicados. Fue así como se llegó a la caracterización de los receptores CB1 por William Devane y sus colegas en 1988 (Devane et al., 1988) y de los receptores CB2 por Sean Munro y colaboradores en 1993 (Munro et al., 1993).
A nivel internacional, destacan tres fechas de vital importancia que marcarán las limitaciones en el uso que se haga de los preparados estandarizados con cannabis y desencadenarán la “problemática” actualmente existente en torno al empleo medicinal de la planta y de sus principios activos. En el año 1961 se incluyó el cannabis y su resina, así como los extractos y tinturas, en la lista I y IV de la Convención Única sobre Estupefacientes de las Naciones Unidas como droga sin usos médicos. Ello supondría que las sustancias y productos incluidos en estas listas estarían sujetos a fiscalización, pasando a la consideración de estupefacientes, y por tanto, en el caso de España, su producción, fabricación, exportación, importación, distribución y comercialización requeriría la autorización previa de la Agencia Española de Medicamentos y Productos Sanitarios.
Por otro lado, la adopción del Convenio sobre Sustancias Sicotrópicas de febrero de 1971 establece una categorización en cuatro niveles, donde los tetrahidrocannabinoles quedaban inscritos en la Lista I, y el dronabinol2 y sus estereoisómeros en la lista II. No obstante, en el año 1992, esta clasificación se verá ligeramente modificada en España debido a la Orden Ministerial del 27 de febrero de 1992, del Ministerio de Sanidad y Consumo, por la que se transfiere el Δ9-THC de la Lista I a la Lista II, anexas al Convenio de Sustancias Sicotrópicas de 1971, la cual obligaba a las entidades interesadas en actuar como fabricantes, importadoras, exportadoras, distribuidoras o dispensadoras de la sustancia a adecuarse a las exigencias legales para los productos psicotrópicos de la Lista II del anexo I del Real Decreto 2829/1977.
Por último, en 1988, la ONU celebra la Convención contra el Tráfico Ilícito de Sustancias Estupefacientes y Sicótropas (la llamada Convención de Viena) que afianza la fiscalización de estas sustancias. No obstante, tal y como indicó la Junta Internacional de Fiscalización de Estupefacientes (JIFE) de Naciones Unidas en su último informe de 2018 (ONU, 2019), el uso de cannabinoides con fines médicos está permitido con arreglo a los tratados de fiscalización internacional de drogas únicamente si los Estados cumplen los requisitos de los tratados que se han concebido para impedir la desviación a fines no médicos. Además, los gobiernos que permitan el uso medicinal de los cannabinoides deberán vigilar y evaluar los efectos de los programas de cannabis medicinal y velar para que, en la práctica, esos programas no se utilicen para legalizar el cannabis con fines no médicos.
Farmacología
Receptores cannabinoides
En los años ochenta y noventa, Mechoulam y colaboradores (Harvey et al., 1991; Devane et al., 1992) empezaron a trabajar experimentalmente con derivados cannabinoides marcados con isotopos radioactivos y consiguieron establecer mapas de sus receptores en el organismo. En 1990, se describió por primera vez la estructura molecular del receptor CB1, que se distribuye principalmente en el sistema nervioso central (SNC). De hecho, es especialmente relevante la abundancia de receptores CB1 en las regiones del cerebro responsables del movimiento (ganglios basales, cerebelo), del procesamiento de la memoria y control del apetito (amígdala, hipocampo) y de la modulación del dolor (ciertas partes de la médula espinal y sustancia gris periacueductal); en corteza cerebral la cantidad de receptores es más moderada, y mínima en tronco cerebral.
En 1993 se describió la estructura del receptor CB2, el cual se encuentra predominantemente distribuido en elementos del sistema inmunitario (bazo y células inmunitarias), habiéndose postulado que los receptores CB2 son responsables de un efecto inmunomodulador en el mecanismo de los cannabinoides. Además, no se descarta la presencia de otros tipos de receptores cannabinoides (por ejemplo, el receptor GPR55) que pudiesen presentar un efecto similar.
Endocannabinoides
Se han identificado tres familias principales de lípidos endógenos, derivados de ácidos grasos poliinsaturados, que se unen con mayor o menor afinidad a los receptores CB1 y CB2 y producen los mismos efectos que el THC en modelos de experimentación animal, es decir, antinocicepción, inmovilidad, reducción de la actividad espontánea e hipotermia. Éstas serían las siguientes (Izzo et al., 2009):
- Anandamida y otras etanolamidas: descubierta en 1992, la anandamida está constituida por una molécula de ácido araquidónico unida por un enlace amida a la etanolamida. Presenta afinidad por el receptor CB1 y comparte gran parte de los efectos del THC. Tiene una duración de acción corta, degradándose de manera rápida por las amidasas del organismo. Se ha aislado tanto en el SNC como en los tejidos periféricos de ratas y seres humanos, y sus concentraciones más altas se encuentran a nivel de hipocampo, núcleo estriado y cerebelo; en el tálamo, aunque la densidad de los receptores CB1 es baja, también se han detectado concentraciones elevadas de anandamida. En tejidos periféricos se ha aislado en bazo, corazón y pulmones, plasma y líquido cefalorraquídeo. Entre otras etanolamidas que se unen a los receptores cannabinoides y que tendrían actividad cannabinomimética pueden destacarse la homo-gamma-linoleiletanolamida y la docosatetraeniletanolamida.
- 2- araquidonil-glicerol (2-ARA-G): fue el segundo endocannabinoide caracterizado (en 1995). Químicamente relacionado con la anandamida y con estructura de prostaglandina, 2-ARA-G es el único endocannabinoide del grupo de los ésteres del ácido araquidónico y parece que participa en la regulación de la sensación de apetito y de la temperatura corporal. Se encuentra sobre todo en SNC y en intestino; en el SNC hay concentraciones elevadas en tronco cerebral, núcleo estriado e hipocampo, y sus concentraciones más bajas se han descrito en corteza cerebral y cerebelo.
- Noladina (éter de 2-araquidonil-gliceril): este endocannabinoide se une a los receptores CB1 y CB2 y ha mostrado efectos sedantes, hipotérmicos, analgésicos e inhibidor de la motilidad intestinal en animales de experimentación.
Fitocannabinoides
Los fitocannabinoides o cannabinoides de origen vegetal son aquellos que proceden directamente de la planta de Cannabis y son los que se consumen con fines médicos. En la planta existen alrededor de 400 componentes, de los cuáles más de 120 son fitocannabinoides, que aparecen junto a una amplia variedad de terpenos y flavonoides. Entre los más relevantes y mayoritarios (Figura 1) encontramos el Δ9-tetrahidrocannabinol (THC) y el cannabidiol (CBD), los cuales se sintetizan a partir de un compuesto común de partida denominado cannabigerol (CBGA). También encontraríamos algunos antagonistas de receptores cannabinoides, como la cannabidavirina y la tetrahidrocannabivarina, que mediante ese antagonismo podrían tener un papel compensatorio en los efectos psicomiméticos del THC. Otros derivados naturales cannabinoides son el cannabicromeno, cannabigerol y el Δ8-tetrahidrocannabinol.
- THC3 : agonista parcial de los receptores CB1 y CB2. Es el principal componente psicoactivo o con efecto psicógeno del cannabis, localizado principalmente en los tricomas de los cogollos de las flores femeninas. Por vía oral, la absorción del THC es lenta, irregular y con alta variabilidad interindividual. Su biodisponibilidad es generalmente baja, pudiendo variar entre un 5 y un 10%, debido a que es destruido parcialmente por el jugo gástrico y también sometido a metabolización hepática de primer paso (a 11-OH-THC, un potente metabolito psicoactivo). Su efecto máximo se alcanza a los 2 h después de su ingesta y suele durar de 2 a 6 h. Las concentraciones plasmáticas de THC pueden verse modificadas por la presencia de alimentos, en especial por los lípidos, que aumentarían su absorción hasta en un 95%. Por vía inhalatoria (inhalación de humo procedente de cigarrillos, pipas de agua o vaporizadores), la absorción es mucho más rápida y la cantidad absorbida dependerá de la forma en que se fume, pudiendo variar la concentración entre un 10-50% según la profundidad de las inspiraciones y la retención del humo en los pulmones.
- CBD4 : el CBD actúa como un modulador alostérico negativo del receptor CB1. Este efecto es terapéuticamente importante ya que un agonismo puro estaría limitado por sus efectos psicomiméticos y un antagonismo puro estaría limitado por sus efectos depresivos. La evidencia científica respalda que el CBD atenúa los efectos psicomiméticos del THC, posiblemente por modulación del sistema dopaminérgico mesolímbico. También se ha demostrado que el CBD activa el receptor serotoninérgico 5-HT1A (responsable de su efecto ansiolítico tipo buspirona) y los receptores vanilloides TRPV1 y TRPV2 (relacionados con su efecto analgésico). Antagoniza, además, otros receptores como el α-1 adrenérgico, los receptores opioides de tipo µ y el receptor GPR55, con los efectos analgésicos asociados, y se cree que también podría actuar como inhibidor enzimático de las fosfolipasas A2, las ciclooxigenasas de tipo 1 y 2 (COX-1 y COX-2), así como del enzima ácido graso amida hidrolasa (FAAH) (Deutsch, 2016).
Migraña: eptinezumab, la primera alternativa por vía intravenosa para la profilaxis
Un ensayo clínico de fase 3 ha demostrado que eptinezumab –de administración intravenosa cada 3 meses– reduce significativamente en comparación con placebo el número de días con migraña al mes en pacientes con migraña episódica (de -3,9 a -4,3 días vs. -3,2 días con placebo); la eficacia que se observa de forma rápida tras la infusión. El nuevo fármaco, además, parece bien tolerado, destacando únicamente un ligero aumento de la incidencia de infecciones del tracto respiratorio superior y de fatiga. De reciente aprobación por la FDA, es probable que sea autorizado a corto-medio plazo en Europa.
En los últimos meses se han comercializado en España dos anticuerpos monoclonales específicamente diseñados para unirse al péptido relacionado con el gen de la calcitonina (CGRP), que juega un papel fundamental en la fisiopatología de la migraña. Estos dos fármacos representan la primera opción de tratamiento profiláctico –por vía subcutánea– para la migraña, tanto episódica como crónica; con una administración mensual, aportan una ventaja en términos de adherencia terapéutica en comparación con otras opciones preventivas.
La FDA estadounidense acaba de aprobar otro anticuerpo específico anti-CGRP, el eptinezumab, el primer fármaco de administración intravenosa en la indicación de profilaxis de migraña y, además, con un régimen posológico más favorable que galcanezumab y erenumab, de una única administración (de 100-300 mg) cada 3 meses. Los resultados conducentes a la autorización derivan de los ensayos clínicos PROMISE-1 y PROMISE-2, realizados en pacientes con migraña episódica y crónica, respectivamente, en que el nuevo fármaco ha logrado el objetivo primario de reducir la media de días con migraña por mes (DMM).
Hace escasamente algo más de un mes, se han publicado los resultados del estudio PROMISE-1, un ensayo aleatorizado de fase 3, multicéntrico, de grupos paralelos y controlado con placebo. Un total de 888 pacientes adultos con migraña episódica fueron asignados a recibir eptinezumab (en 3 dosis, de 30, 100 mg y 300 mg) o placebo, en una inyección intravenosa cada 12 semanas. Los resultados demuestran que la reducción en el número de DMM desde el inicio –variable principal de eficacia– es significativamente mayor en los pacientes tratados con las dos dosis mayores del fármaco respecto al grupo control. La medida de DMM al inicio del estudio se situó globalmente en 8,6, y el tratamiento con eptinezumab 100 mg y 300 mg redujo esa cifra en 3,9 días (p= 0,0182) y 4,3 días (p= 0,0001), respectivamente, entre las semanas 1-12; la diferencia fue estadísticamente significativa en comparación con placebo (-3,2 días). De manera interesante, los beneficios clínicos con eptinezumab se observaron ya desde el primer día posinfusión. En términos de seguridad, solo el 1,9% de los pacientes tratados con el fármaco abandonó el tratamiento debido a reacciones adversas. La incidencia de eventos adversos con eptinezumab (58-63%) fue muy similar a placebo (60%), destacando por su mayor frecuencia las siguientes reacciones adversas: infección del tracto respiratorio superior –rinofaringitis- (10-11% vs. 7% con placebo) y fatiga (2,3-3,6% vs. <1%).
A la espera de la publicación de los datos del PROMISE-2, se ha sugerido que muchos pacientes pueden lograr una reducción de los DMM de al menos el 75% y experimentar una mejoría sostenida clínicamente significativa de migraña durante 6 meses, por lo que eptinezumab puede ser un complemento interesante para ayudar a reducir la carga de esta grave enfermedad. Aunque la EMA europea aún no ha autorizado el fármaco, es previsible, a la vista de los resultados, que el mismo esté disponible en España a corto-medio plazo.
Linfoma no Hodgkin o leucemia linfocítica crónica: se amplían las posibilidades de la generación de células CAR
Un ensayo clínico de fase 1-2 ha revelado que la infusión de células NK transducidas para expresar un CAR anti-CD19 en pacientes con linfoma no Hodgkin o leucemia linfocítica crónica es un tratamiento bien tolerado (no se asocia con síndrome de liberación de citocinas o neurotoxicidad) y proporciona una eficacia notable: tasa de respuesta objetiva del 73%, con 7 pacientes –de 11 tratados– mostrando una remisión completa. A falta de la realización de ensayos más amplios, los medicamentos de terapia génica a base de células NK emergen como un potencial nuevo tratamiento de tumores hematológicos.
Con la comercialización en Europa el pasado año de los primeros medicamentos CAR-T frente a ciertos tipos de leucemias y linfomas de células B, se produjo un cambio de paradigma en la terapéutica de tumores onco-hematológicos. Con esa nueva generación de fármacos (células T transfectadas para expresar un receptor de antígeno quimérico o CAR anti-CD19) se abría una prometedora vía de investigación farmacológica. Habida cuenta de que las principales limitaciones de dichos tratamientos se refieren a una toxicidad sustancial, así como a la complejidad de fabricación de las células, recientemente se ha planteado que la utilización de las células asesinas naturales (NK, natural killers) para la modificación y expresión del CAR podría superar esos problemas.
A fin de verificar esa hipótesis, un nuevo ensayo de fase 1-2 ha evaluado la seguridad y la eficacia de la administración de células CAR-NK anti-CD19 no compatibles con HLA y derivadas de sangre del cordón umbilical a 11 pacientes con cánceres CD19-positivos en recaída o refractarios (linfoma no Hodgkin o leucemia linfocítica crónica –LLC–). Las células NK se transdujeron con un vector retroviral para expresar los genes que codifican para el CAR anti-CD19, para interleucina-15 y para la enzima caspasa-9 (inducible este último como un “interruptor” de seguridad). Posteriormente, se expandieron ex vivo y se administraron en una única infusión (en una de las tres dosis: 1×105, 1×106, o 1×107 células/kg) tras la quimioterapia linfodepletiva.
Los resultados revelan que dicho tratamiento no se asoció con el desarrollo del síndrome de liberación de citocinas, neurotoxicidad o signos enfermedad de injerto contra huésped; tampoco hubo un aumento significativo en los niveles de citocinas inflamatorias, incluida IL-6. Todo ello sugiere que no se había alcanzado la dosis máxima tolerada. En cuanto a la eficacia del tratamiento, 8 de los 11 pacientes tratados (73%) tuvieron una respuesta objetiva: 7 de ellos (4 pacientes con linfoma y 3 con LLC) tuvieron una remisión completa, y 1 tuvo una remisión parcial (remisión del componente de transformación de Richter pero persistencia de la LLC). Además, resulta interesante que las respuestas fueron rápidas, observadas dentro de los 30 días posteriores a la infusión en cualquiera de las tres dosis, y que las células CAR-NK se expandieron y persistieron –aunque en niveles bajos– durante al menos 12 meses.
Por tanto, la interesante tasa de respuesta unido a un favorable perfil de seguridad del tratamiento plantea que los medicamentos de terapia génica a base de células NK pueden emerger como un potencial nuevo tratamiento de neoplasias hematológicas que incluso pueda mejorar los prometedores resultados que ya se están verificando en la práctica clínica real para los medicamentos CAR-T anti-CD19.
- Liu E, Marin D, Banerjee P, Macapinlac HA, Thompson P, Basar R et al. Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors. N Engl J Med. 2020 Feb 6; 382(6): 545-53. DOI: 10.1056/NEJMoa1910607.