Resumen
La Organización Mundial de la Salud (OMS) define como fumador a todo individuo que fume a diario durante el último mes al menos un cigarrillo. El tabaquismo es la primera causa de muerte evitable en los países industrializados, así como uno de los principales problemas de Salud Pública a nivel mundial, provocando más de 4 millones de muertes evitables al año, de las cuales 60.000 tienen lugar en España.
El tabaquismo debe ser considerado como un trastorno adictivo, una drogodependencia, en la que la principal sustancia adictiva es la nicotina, que produce rápidamente dependencia tanto física como psíquica. Sus efectos son devastadores, desde el aumento de la incidencia y prevalencia de cánceres (pulmón, estómago, esófago, etc.) hasta la aparición de enfermedades coronarias, vasculares periféricas y cerebrales, pasando por la enfermedad pulmonar obstructiva crónica (EPOC).
Se dispone de diferentes tratamientos para la deshabituación; entre los farmacológicos se encuentran: la terapia sustitutiva de nicotina (Nicokern®, Nicorette®, Nicotinell®, Niquitin®, Quitt®), el bupropión (Zyntabac®) y la vareniclina (Champix®). No obstante, cabe destacar que es esencial para su eficacia que este tratamiento farmacológico vaya acompañado de un deseo del propio paciente a abandonar el hábito tabáquico y de terapia psicológica.
Considerando todas estas cuestiones, es obvio que el farmacéutico comunitario tiene una importante labor que desarrollar dada su influencia sociosanitaria, principalmente, en relación con las siguientes vías asistenciales: la educación sanitaria, la prevención del tabaquismo, el asesoramiento a quienes desean cesar este hábito, la propuesta de tratamientos que no requieren receta médica (farmacológicos o no) y el reforzamiento de las pautas y seguimiento de aquellos tratamientos farmacológicos establecidos por el médico.
Introducción
El consumo de tabaco es considerado como uno de los principales problemas de Salud Pública, tanto por su magnitud como por las consecuencias sanitarias que conlleva. La Organización Mundial de la Salud (OMS) define como fumador a todo individuo que fume a diario durante el último mes, al menos un cigarrillo. Se considera no fumador al individuo que jamás ha fumado, y ex-fumador a la persona que se mantiene al menos 12 meses sin fumar.
El tabaquismo es la primera causa de muerte evitable en los países industrializados. Provoca en el mundo más de 4 millones de muertes evitables al año y es el principal factor patogénico ligado a las enfermedades cancerosas, siendo considerado como responsable de al menos un 30% de los cánceres en su conjunto. En España se asocia a más de 60.000 muertes al año, y se estima que es responsable del 40% de las muertes prematuras en hombres entre 35 y 70 años, y del 15% en las mujeres (MSSSI, 2016).
Hay que subrayar que no hay un grado de consumo sin riesgo. Así, las mujeres que fuman entre uno y cuatro cigarrillos diarios presentan un riesgo 2,5 veces mayor de presentar un evento coronario que el de las no fumadoras y, si usan anticonceptivos hormonales, tienen hasta 20 veces más riesgo de sufrir un accidente cerebrovascular. Durante la gestación existe mucho mayor riesgo de presentar complicaciones como abortos espontáneos, prematuridad, bajo peso al nacimiento, además de muerte súbita del lactante.
Dependencia
El tabaquismo debe ser considerado como un trastorno adictivo, cuya principal sustancia adictiva es la nicotina. Sus propiedades adictivas derivan de los efectos presinápticos, que influyen sobre la liberación de diversos neurotransmisores, como noradrenalina y, especialmente, dopamina en el sistema de “recompensa” del nucleus accumbens del sistema mesolímbico cerebral, en la misma región cerebral donde actúan la cocaína o la morfina. La estimulación de dicha región por cualquiera de estas sustancias produce efectos placenteros, estimulantes y ansiolíticos, lo que implica un refuerzo positivo encaminado a continuar el consumo.
En base a ello, el consumo de tabaco produce rápidamente dependencia tanto física como psíquica. De hecho, la capacidad adictiva de la nicotina ha sido comparada a la de la heroína, hasta el punto de que bastan tres semanas de consumo continuado para provocar un síndrome de abstinencia, caracterizado por trastornos del estado de ánimo (generalmente, depresión), insomnio, irritabilidad, ansiedad y, frecuentemente, bradicardia y aumento del apetito. El cuadro es provocado por el cese repentino del consumo de nicotina y su intensidad depende en buena manera del nivel de consumo de tabaco:
- Fumadores ligeros: menos de 10 cigarrillos/día.
- Fumadores moderados: 10-25 cigarrillos/día.
- Fumadores intensos: más de 25 cigarrillos/día.
Efectos del tabaquismo crónico
En general, el tabaco incrementa el riesgo de padecer cáncer de pulmón (25 veces entre los hombres y 12,5 veces entre las mujeres). Este riesgo no desaparece rápidamente después de abandonar el hábito, precisando entre 10 y 15 años para igualarse con el de los no fumadores. El tabaquismo crónico incrementa también el riesgo de otros cánceres como boca, labio, faringe, estómago, esófago y de vejiga urinaria.
En lo referente a otras alteraciones pulmonares no cancerosas, el tabaquismo incrementa 14 veces el riesgo de enfermedad pulmonar obstructiva crónica (EPOC). En cualquier caso, parece existir una susceptibilidad individual específica al tabaco para esta alteración. El abandono del tabaquismo no mejora la capacidad ventilatoria, pero al menos sirve para frenar la evolución de la enfermedad.
El tabaquismo crónico también aumenta la incidencia de infecciones, como neumonía y bronquitis, y la hipoxemia crónica que da lugar favorece el desarrollo de insuficiencia cardíaca del ventrículo derecho, que puede derivar en “cor pulmonale” e hipertensión pulmonar. Otras patologías vasculares potenciadas por el tabaquismo son las enfermedades coronarias, como el infarto de miocardio y la angina de pecho, así como enfermedades vasculares periféricas y cerebrales; el cese del tabaquismo sí que anula el riesgo de estas últimas de forma relativamente rápida.
Se ha descrito que el tabaquismo también produce un aumento de las concentraciones de fibrinógeno y de LDL-colesterol, reduciendo las de HDL-colesterol. De igual manera, se ha asociado a otros trastornos, entre los que destacan el envejecimiento cutáneo, la hiperacidez gástrica, la exacerbación de las enfermedades inflamatorias intestinales, la reducción del apetito o el distrés fetal. Y ya casi nadie discute que el tabaquismo materno durante el embarazo afecta negativamente el desarrollo pulmonar del niño, provocando una reducción persistente de su función pulmonar y un mayor riesgo de asma (Hollams et al., 2014).
Riesgos del tabaquismo pasivo
El tabaquismo pasivo o involuntario se produce en personas no fumadoras que están expuestas al humo del tabaco. El humo más peligroso para el no fumador es el de corriente secundaria, que supone el 85% del humo generado por los fumadores y que, a diferencia del humo de corriente principal, no es filtrado por ningún dispositivo (filtro) o por los pulmones del fumador activo.
Convivir con una persona fumadora aumenta el riesgo de cáncer de pulmón en un 30% para el no fumador, y el de muerte de origen cardíaco en un 25%. Asimismo, los niños expuestos al humo del tabaco tienen mayor riesgo de sufrir resfriados u otras infecciones respiratorias y de oído, amén de trastornos pulmonares.
Epidemiología del tabaquismo
En España, como en el resto de países desarrollados, el consumo de tabaco resulta ser la principal causa aislada de mortalidad prematura y evitable. Cada año, los productos del tabaco son responsables de más de 1,2 millones de muertes (14% de todos los fallecimientos) en la región europea de la OMS. En el quinquenio 2010-2014, se produjeron en España 259.348 muertes atribuibles al tabaco, lo que supuso una media anual estimada de 51.870 muertes. De éstas, nueve de cada diez muertes atribuibles al tabaco ocurrieron en hombres.
En nuestro país fuma de forma continuada 9 millones de personas (según datos del Instituto Nacional de Estadística en 2017), el 23,95% de la población mayor de 15 años (el 27,87% de los varones y el 20,22% de las mujeres), porcentaje al que hay que añadir otro 3,01% adicional de fumadores ocasionales (3,5% y 2,55%). Otro 19,58% (26,77% varones y 12,73% mujeres) de la población es exfumadora, mientras que nunca ha fumado el 53,46% (41,86% varones y 64,5% mujeres). El mayor porcentaje de fumadores españoles se sitúa entre los 25 y los 54 años (31,68%; 34,28% varones y 28,82% mujeres).
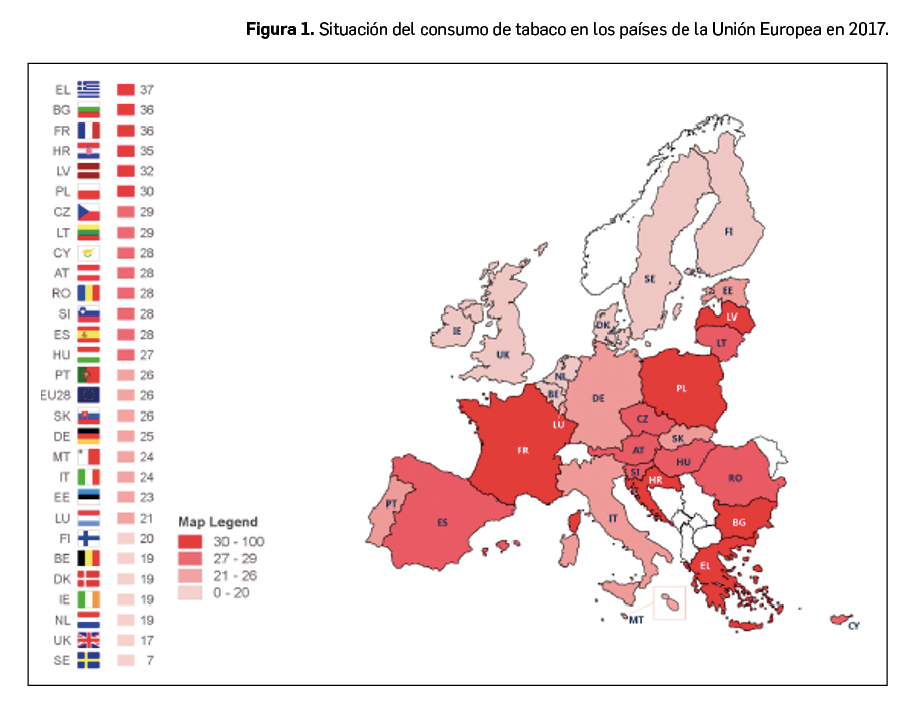
El último Eurobarómetro1 sobre la situación del consumo de tabaco en la Unión Europea, publicado en marzo de 2017, señala que el 26% de los habitantes de la Unión Europea son fumadores (habituales u ocasionales), el 20% son exfumadores y el 53% no ha fumado nunca. Hay diferencias significativas en cuanto al consumo de tabaco entre los países que componen la Unión Europea, situándose las tasas de fumadores más altas en el sur de Europa. En Grecia, el 37% de la población fuma, en Bulgaria y Francia, el 36% y, en Croacia, el 35%. Las tasas más bajas dentro de la Unión Europea, las encontramos en Suecia –con un 7%– y en Reino Unido –con un 17%.
España se sitúa ligeramente por encima de la media de la Unión Europea. Sin embargo, es uno de los países cuya media de cigarrillos consumidos al día por fumador es más baja, situándose en 11,7 cigarrillos/día mientras que la media de la Unión Europea es de 14,1 cigarrillos/día.
Tratamiento de la deshabituación del tabaquismo
El tratamiento de deshabituación del tabaquismo tiene dos partes complementarias, una psicológica y otra farmacológica, siendo la primera tan importante como la propia desintoxicación química; en no pocos pacientes resulta preciso recurrir a técnicas específicas de psicoterapia, que deben ser desarrolladas por profesionales especializados. La dificultad para abandonar el hábito del tabaco se ilustra fácilmente por el hecho de que es el que tiene peor índice de eficacia entre los tratamientos de deshabituación de drogas de abuso, como alcohol, opiáceos, cocaína, etc. Durante el año 2017, un 18,72% de los fumadores diarios hizo al menos un intento de abandonar el tabaquismo, con porcentajes prácticamente idénticos entre varones y mujeres (INE).
Según se ha sugerido, la principal dificultad que experimenta el fumador que quiere cesar el hábito tabáquico es la aparición de un síndrome de abstinencia de la nicotina al poco tiempo de suspender el consumo de tabaco.
Para diseñar un plan efectivo para dejar de fumar es importante analizar cuáles son los motivos que impulsan al paciente a consumir tabaco y su postura ante el hecho de abandonar este hábito. Es fundamental una convicción absoluta en el paciente para que el tratamiento sea eficaz, siendo también recomendable implicar a otras personas próximas, en especial a la pareja, en el proceso de deshabituación.
Frecuentemente, el aumento de peso es una preocupación, por lo que debe recomendarse una dieta equilibrada, con reducción del consumo de grasas. La ganancia de peso media durante los 6 meses primeros es de 2 a 5 kg, pero, en cualquier caso, este aumento no supone un riesgo para la salud si se le compara con el riesgo de morbilidad y mortalidad prematura por el uso continuado del tabaco.
Algunos fumadores usan, sin saberlo, el tabaco para combatir estados depresivos. Por esta razón, se les debe recomendar un asesoramiento médico especializado.
Tratamiento farmacológico
El tratamiento farmacológico de deshabituación tabáquica se basa en prevenir los efectos del síndrome de abstinencia nicotínico. Actualmente se utilizan dos estrategias básicas con ese objetivo:
1) Administrar cantidades limitadas y fijas de nicotina.
2) Reproducir de forma limitada los efectos psicológicos placenteros de la nicotina, mediante:
- Estimulación de los circuitos neuronales de recompensa, por medio de un incremento de los niveles de dopamina en el sistema límbico (bupropión).
- Activar los receptores neuronales colinérgicos de tipo nicotínico responsables de los efectos psicológicos de la nicotina (vareniclina).
Tanto bupropión (Zyntabac®) como vareniclina (Champix®) son fármacos sujetos a prescripción médica, en tanto que las terapias de sustitución de la nicotina (Nicokern®, Nicorette®, Nicotinell®, Niquitin®, Quitt®) no requieren receta médica.
Nicotina
La terapia sustitutiva de nicotina (Nicokern®, Nicorette®, Nicotinell®, Niquitin®, Quitt®) permite reducir el síndrome de abstinencia y consigue hacer desaparecer los comportamientos sensoriales placenteros asociados. Se deben usar en fumadores con dependencia moderada o alta, y motivados para el abandono del hábito. No se recomienda en fumadores de menos de 10 cigarrillos/día o equivalente.
Si se administra una terapia sustitutiva de nicotina, se recomienda evitar el consumo de tabaco puesto que puede darse una sobredosis de nicotina (Figura 2), la cual cursa con náuseas, aumento de la salivación, dolor abdominal, diarrea, sudoración, cefalea, mareo, hipertensión, alteraciones auditivas, alteraciones de la vista y debilidad marcada.
Los chicles y los comprimidos para chupar están dosificados para aportar algo más de la mitad de la nicotina procedente del consumo de un cigarrillo. Por su parte, los parches varían en la concentración y velocidad de absorción de la nicotina según el fabricante y generalmente se utilizan de forma complementaria con los chicles.
En cuanto a la eficacia a largo plazo (por encima de un año de abstinencia), los porcentajes de cesación tabáquica están en torno al 15-25% con los parches de nicotina (eventualmente apoyados con chicles), frente a menos del 10% con placebo. No se han demostrado diferencias significativas en función de la vía de administración de la nicotina, ni tampoco entre el uso de parches durante 16 horas frente a 24 horas o entre las pautas de chicles de manera reglada. Tratamientos de 8 semanas de duración son tan eficaces como los de 16 semanas y no es necesario reducir paulatinamente las dosis. En lo referente a la dosis de nicotina administrada, a mayor dosis se observa una mayor disminución de los síntomas a corto plazo; así, los chicles de 4 mg son más eficaces que los de 2 mg en fumadores altamente dependientes, pero no existen evidencias que aconsejen el uso de más de 21 mg/día en parches.
Bupropión
El bupropión (Zyntabac®) es un fármaco antidepresivo (Figura 3), inhibidor de la recaptación de dopamina y serotonina, lo cual permite el mantenimiento de mayores niveles dopaminérgicos en el sistema límbico, asegurando la estimulación de las áreas de respuesta, en ausencia de nicotina. Se debe utilizar en sujetos con elevada motivación y alta dependencia de la nicotina. Durante la primera semana de administración, el paciente puede seguir fumando, pero se debe fijar una fecha de abandono del tabaco dentro de las dos primeras semanas de tratamiento. La duración total del mismo no debe superar las 9 semanas.
El efecto adverso más relevante asociado al tratamiento con bupropión es la posible aparición de convulsiones, que aparece con una incidencia de aproximadamente 1 de cada 1.000 pacientes tratados, mayoritariamente en quienes presentan uno o más factores de riesgo para el desarrollo de un episodio convulsivo.
Esto fue motivo de una comunicación de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), que recomendaba el ajuste de la pauta de administración diaria a 150 mg durante 6 días, dosis que puede aumentarse a partir del 7º día a un máximo de 300 mg repartidos en 2 tomas de 150 mg, debiendo transcurrir como mínimo 8 horas entre dosis sucesivas. Además, a las contraindicaciones que figuraban anteriormente (hipersensibilidad al producto, pacientes con trastorno convulsivo actual o previo, diagnóstico actual o previo de bulimia o anorexia nerviosa, cirrosis hepática, diagnóstico actual o previo de enfermedad maniaco-depresiva, tratamiento concomitante con antidepresivos IMAO), se añadieron como contraindicaciones absolutas:
- pacientes con tumor en el sistema nervioso central.
- pacientes que estén en proceso de deshabituación alcohólica o de retirada de benzodiazepinas.
Todo paciente susceptible de ser tratado con bupropión debe ser evaluado previamente para descartar posibles factores de riesgo que predispongan a la aparición de convulsiones. Si a pesar de todo, se decide iniciar el tratamiento en un paciente con factores de riesgo identificados (insuficiencia renal o hepática, diabetes mellitus tratada con hipoglucemiantes o insulina, uso de estimulantes o productos anorexígenos, uso excesivo de alcohol), no se sobrepasará la dosis de 150 mg/día durante toda la duración de la terapia. Conviene recordar que la administración concomitante de fármacos que disminuyen el umbral convulsivo supone un factor de riesgo para la aparición de convulsiones; entre ellos, se encuentran los antipsicóticos, antidepresivos, teofilina, esteroides sistémicos, antimaláricos, tramadol, antibióticos quinolónicos y antihistamínicos sedantes.
Vareniclina
Vareniclina (Champix®) (Figura 4) es un agonista parcial colinérgico, que se une de forma selectiva a los receptores nicotínicos de tipo α4β2, provocando su estímulo, aunque con menor intensidad que la nicotina; su elevada afinidad por el receptor, superior a la de la nicotina, impide el acceso de ésta al receptor. La consecuencia de este efecto es el bloqueo de la reacción placentera que el sujeto experimenta al fumar (efecto antagonista) y, al mismo tiempo, alivia los síntomas de abstinencia nicotínica (efecto agonista).
No obstante, el efecto agonista, aunque débil, sugiere un cierto potencial de dependencia, debido a sus propiedades “reforzantes” del comportamiento de auto-satisfacción, aunque este potencial es menor que el de la nicotina. De hecho, se ha observado en algunos pacientes un aumento de la irritabilidad, ansias de fumar, depresión y/o insomnio tras finalizar el tratamiento de deshabituación tabáquica con vareniclina, aunque los datos disponibles no parecen sugerir ningún potencial de abuso de este fármaco.
La vareniclina también ha sido objeto de una comunicación de seguridad por parte de la AEMPS que indicaba que “debe tenerse especial precaución en pacientes con alteraciones psiquiátricas subyacentes. Existe la posibilidad de que cualquier paciente desarrolle síntomas depresivos y debe de informarse a los pacientes en tratamiento a este respecto. En el caso de que en un paciente en tratamiento con Champix® aparezcan ideación o comportamiento suicidas, debe suspenderse el tratamiento inmediatamente”.
Junto con los tratamientos psicológicos y farmacológicos, existen otras alternativas cuya eficacia es difícil de establecer en términos objetivos, debido a la falta de estudios clínicos controlados con placebo y/o terapias activas de eficacia reconocida. Entre ellas, cabe citar a las terapias homeopáticas y los dispositivos que imitan la forma, el sabor, el tacto o incluso el humo de los cigarrillos (boquillas mentoladas, cigarrillos generadores de vapor de agua, etc.).
Financiación pública del tratamiento de deshabituación
Con respecto a la financiación pública del tratamiento farmacológico para la cesación del hábito tabáquico, existen diferentes políticas a nivel de la Unión Europea. En diversos estudios farmacoeconómicos se ha planteado y demostrado que el hecho de financiar estos medicamentos podría resultar una estrategia de salud pública económicamente beneficiosa para el Sistema Nacional de Salud a largo plazo, a pesar de los gastos iniciales.
Por ejemplo, el estudio titulado “Budgetary impact analysis on funding smoking-cessation drugs in patients with COPD in Spain” (Análisis del impacto presupuestario sobre la financiación de medicamentos para dejar de fumar en pacientes con EPOC en España), realizado por el Programa Integrado de Investigación en Tabaquismo, llegó a la conclusión de que un total de 17.756 fumadores con EPOC podrían dejar de fumar en 5 años si los tratamientos para la deshabituación tabáquica en estos pacientes estuvieran financiados por el Sistema Nacional de Salud, frente a una situación en la que estas terapias no estuvieran financiadas donde solo dejarían de fumar alrededor de 1.303 pacientes en esos 5 años. Otra conclusión importante de este estudio fue que la financiación de las terapias de deshabituación tabáquica no solo podría conducir a un mayor número de pacientes dispuestos a dejar de fumar, sino que generaría más ahorros para el Sistema Nacional de Salud (Jiménez-Ruiz et al, 2015).
Entre las posibles ventajas que se destacan en cuanto a la financiación pública del tratamiento farmacológico para la deshabituación tabáquica, tanto para el paciente fumador como para el conjunto de la población, se encontrarían:
- reducción de la morbimortalidad asociada al consumo de tabaco.
- mejora en la calidad de vida de los pacientes.
- reducción del número de personas que sufren el tabaquismo pasivo y, por tanto, disminución de sus riesgos.
- reducción del gasto sanitario derivado de los problemas de salud asociados al tabaco a medio/largo plazo.
Situación en Europa
Como alguno de los ejemplos más ilustrativos, cabe destacar que en Bélgica, país con una de las tasas más bajas en cuanto a consumo de tabaco de la Unión Europea, el tratamiento farmacológico de la deshabituación tabáquica con vareniclina y bupropión (máximo 3 ciclos/consultas en un periodo de 5 años) se encuentra financiado, contribuyendo el paciente con 15 euros por envase dispensado; para la dispensación de medicamentos con ambos principios activos es necesaria una prescripción facultativa. Sin embargo, la terapia sustitutiva de nicotina no se encuentra financiada en Bélgica y tampoco necesita prescripción médica para su dispensación.
En Portugal, con una tasa de consumo de tabaco del 26%, se da una situación parecida a Bélgica, pues se financian la vareniclina y el bupropión (en un 37% cada uno) pero no la terapia sustitutiva de nicotina. Además, algunas farmacias comunitarias ofrecen otros servicios que incluyen, entre otros, la promoción de la salud y prevención de actividades, estimulación a los pacientes para dejar de fumar, o el asesoramiento sobre estrategias de intervención y sobre opciones no farmacológicas para mejorar la motivación de los pacientes.
En Irlanda del Norte, cuya tasa de consumo de tabaco es del 17%, hay servicios de deshabituación tabáquica cuyo objetivo es apoyar a los fumadores que están motivados para dejar de fumar centrando su atención en jóvenes y adolescentes, mujeres embarazadas y personas con discapacidad. Además, este país contempla suministrar la terapia sustitutiva de nicotina a fumadores de forma semanal y hasta un máximo de 12 semanas.
Sin embargo, hay otros países de la Unión Europea en los que no se encuentra financiado el tratamiento farmacológico para la deshabituación tabáquica, como son Alemania y Eslovaquia.
Situación en España
En la Comunidad Foral de Navarra, en diciembre de 2017, se aprobó el Decreto Foral 111/20172, de 13 de diciembre, por el que se establecen las condiciones de acceso a la prestación farmacológica de ayuda a dejar de fumar. En él se incluían dentro de la prestación farmacológica aquellos medicamentos que tuviesen en su ficha técnica la indicación de la deshabituación al tabaco, tales como parches de nicotina, bupropión y vareniclina.
A lo largo de 2018, un total de 6.139 personas se beneficiaron del programa de ayudas para dejar de fumar en Navarra, al que se destinaron 734.000 euros para subvencionar el coste del tratamiento farmacológico. Una encuesta a más de 1.000 personas que iniciaron tratamiento entre enero y febrero de 2018 mostró que en torno al 35% declaraba que seguía sin fumar al año de comenzar dicho tratamiento. Con los datos disponibles, la valoración de financiar las ayudas para dejar de fumar era muy satisfactoria tanto para los exfumadores como para el conjunto de la población.
En 2013, la Dirección General de Salud Pública diseñó el “Programa de ayuda al fumador en Canarias” (PAFCAN)3, financiando el Servicio Canario de la Salud el tratamiento farmacológico en un 50%. Para el tratamiento de tabaquismo dentro del Programa PAFCAN se dispone de dos tipos de fármacos: vareniclina y parches de nicotina. El modo de dispensación de los tratamientos en todas las oficinas de farmacia es siempre presentando una receta firmada y sellada por su médico. El programa PAFCAN complementa con herramientas farmacológicas, médicas y psicológicas las actuaciones de los profesionales sanitarios del Servicio Canario de la Salud en el tratamiento del paciente fumador.
Más recientemente, la Comisión Interministerial de Precios de Medicamentos y Productos Sanitarios4 , reunida en septiembre de 2019, llegó a un acuerdo para la inclusión de la vareniclina (Champix®) en la oferta del Sistema Nacional de Salud, y en octubre de 2019, para la inclusión de bupropión (Zyntabac®), basándose en “el valor terapéutico y social del medicamento y beneficio clínico incremental del mismo teniendo en cuenta su relación coste-efectividad”. En dichas Comisiones se ha fijado el precio de las presentaciones de Champix® y de Zyntabac® que se incluirán en financiación, informándose que dicho precio se revisaría en función del volumen de ventas.
La Comisión ha acordado su financiación a partir del 1 de enero de 2020 (a la espera de la correspondiente resolución de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia y su posterior inclusión en el Nomenclátor oficial de la prestación farmacéutica del SNS) con las siguientes condiciones:
- Se financiará un único intento anual por paciente.
- El paciente debe estar incluido en un programa de apoyo (individual y/o grupal) de deshabituación tabáquica implementado en las Comunidades Autónomas, INGESA o mutualidades.
- El paciente debe presentar motivación expresa de dejar de fumar (que se pueda constatar con un intento de dejar de fumar en el último año) o ser un paciente que fume 10 cigarrillos o más al día y presente un alto nivel de dependencia (puntuación en el test de Fagerström de 7 o superior).
La prescripción se restringirá a los médicos profesionales que así se definan en los programas de deshabituación tabáquica de cada comunidad o mutualidad. Cada prescripción incluirá 1 envase, es decir, 1 mes de tratamiento, y deberá valorarse la evolución de la efectividad del tratamiento antes de la siguiente prescripción. La duración máxima del tratamiento financiado será de 12 semanas para Champix® y de 7-9 semanas en el caso de Zyntabac®. Las dispensaciones se realizarán por el sistema de receta electrónica del SNS.
El test de Fagerström mide el grado de dependencia, consta de 6 preguntas a contestar, y el resultado puede oscilar entre 0 (dependencia nula) y 10 puntos (dependencia extrema).
1. ¿Cuánto tarda en fumar el primer cigarrillo después de levantarse por la mañana?
a. 5 minutos (3 puntos)
b. 6-30 minutos (2)
c. 31-60 minutos (1)
d. Más de 60 minutos (0)
2. ¿Le cuesta no fumar en lugares donde está prohibido (cine, autobús, establecimientos cerrados, etc.)?
a. Sí (1)
b. No (0)
3. ¿A qué cigarrillo le costaría más renunciar?
a. El primero de la mañana (1)
b. Otros (0)
4. ¿Cuántos cigarrillos fuma al día?
a. 31 o más (3)
b. 21-30 (2)
c. 11-20 (1)
d. 10 o menos (0)
5. ¿Fuma más durante las primeras horas del día que durante el resto?
a. Sí (1)
b. No (2)
6. Si está tan enfermo que se queda en la cama, ¿fuma?
a. Sí (1)
b. No (0)
El papel asistencial del farmacéutico
El papel del farmacéutico comunitario en la deshabituación tabáquica es muy importante por el potencial sanitario que ejerce en el desarrollo de acciones de Salud Pública. Así, resulta fundamental la promoción del conocimiento riguroso sobre las diferentes opciones farmacológicas existentes, mediante la sensibilización de la población y la difusión de información científica veraz sobre el tabaco y su tratamiento.
Resulta fundamental aclarar al paciente que el tratamiento de deshabituación del tabaquismo es complicado y puede requerir la realización de varios intentos antes de alcanzar el éxito deseado. Se le debe informar con rigor científico pero sin excesivo alarmismo de los riesgos del tabaquismo, insistiendo tanto en las ventajas de su abandono como en las consecuencias de su mantenimiento. Además, se debe hacer hincapié en la información al paciente sobre todas las opciones farmacológicas existentes, sujetas o no a prescripción médica y/o financiación pública, recomendando asimismo la existencia de terapias psicológicas que podrían complementar a los tratamientos farmacológicos.
De forma interesante, la farmacia comunitaria puede actuar como centro de detección de pacientes en riesgo; en general, toda persona que refiera cualquier patología o tratamiento de carácter crónico, estén o no típicamente asociados al tabaquismo (bronquitis, EPOC, etc.) deberá ser remitido al médico para su evaluación y establecimiento del tratamiento más idóneo. Igualmente, se deberá derivar al médico a las embarazadas o madres lactantes, así como a aquellas personas que refieran conductas adictivas.
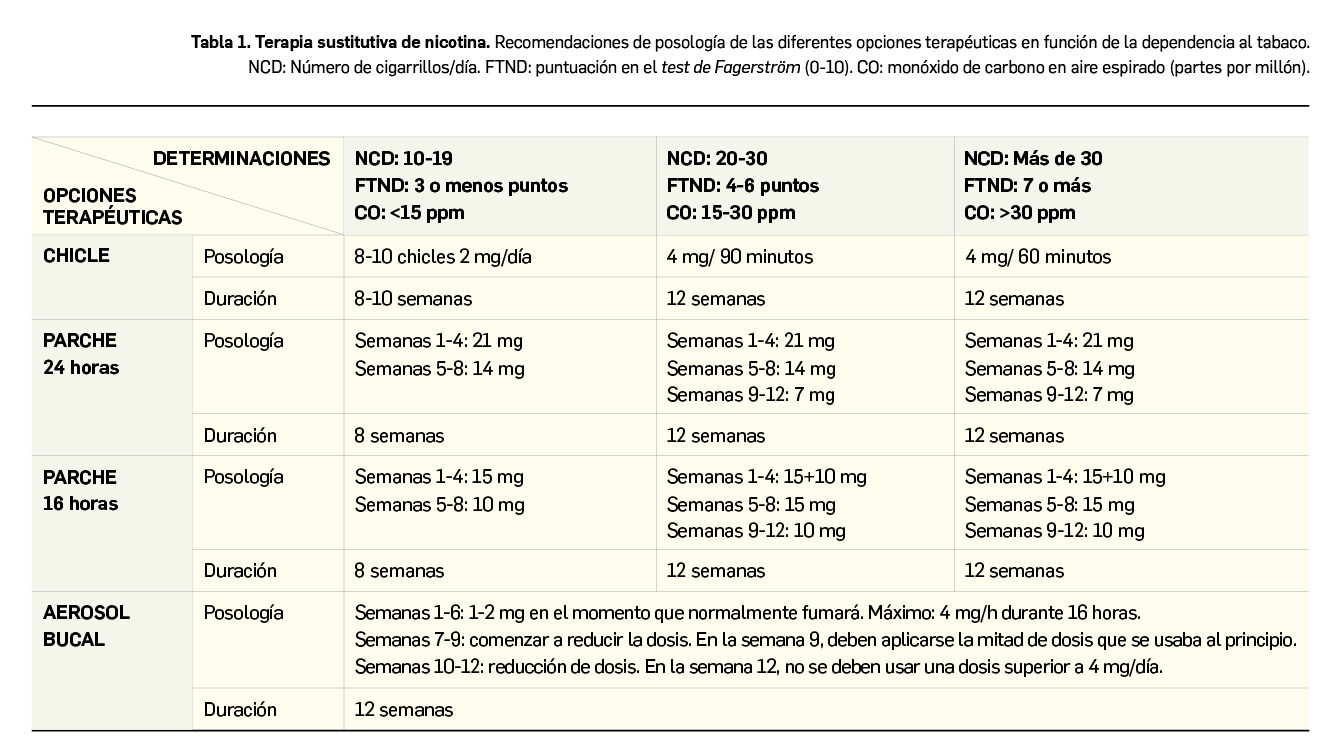
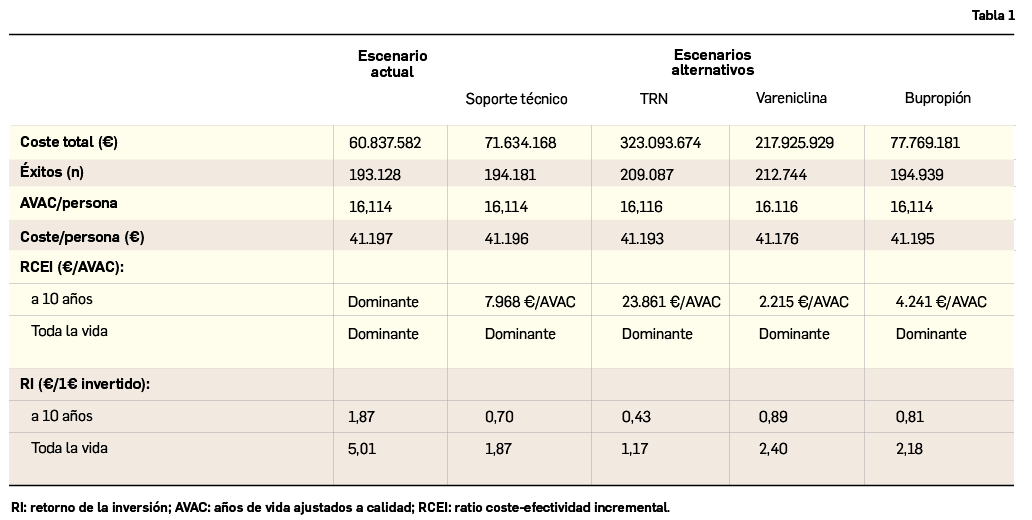
Ante el caso de que un paciente solicita al farmacéutico ayuda para dejar de fumar, y si no existe ninguna contraindicación, se puede proceder con la proposición o indicación de un tratamiento sustitutivo con nicotina (TSN), que no está sujeto a prescripción médica (Tabla 1). Para ello, es importante individualizarlo según el valor del test de Fagerström y la cantidad de nicotina que consume al día. El resultado de este test –que mide el grado de dependencia en base a 6 preguntas y cuyo resultado puede oscilar entre 0 (dependencia nula) y 10 (dependencia extrema)– condiciona el tipo de tratamiento, mientras que la dosis dependerá de la cantidad de nicotina absorbida.
Si la valoración del test de Fargerström es inferior a 6, el farmacéutico puede indicar el uso a demanda de chicles o comprimidos de nicotina para chupar, entendiéndose que se tomará un chicle o caramelo en el momento en que aparezcan las ganas de fumar, sin esperar a la urgencia y/o deseo fuerte de fumar. En cambio, si el resultado del test es superior a 6, el farmacéutico debe preguntar si la persona padece insomnio y, en caso de respuesta afirmativa, se deberá recomendar, como en el caso anterior, el uso de chicles y comprimidos, puesto que los parches pueden agravar ese insomnio (incluido entre sus reacciones adversas frecuentes); si el paciente no suele padecer insomnio, se recomendará el uso de parches. La selección del tipo de parche dependerá del tiempo transcurrido desde que se despierta hasta que fuma el primer cigarrillo: si ese tiempo es superior a 30 minutos se recomendará el parche de 16 horas, mientras que si es inferior a 30 minutos se recomendará el de 24 horas. En cualquier caso, hay que subrayar que el individuo podrá utilizar chicles o caramelos para chupar cuando tenga el deseo de fumar. En caso de utilización de parches no deberá fumarse un cigarrillo, ante el riesgo de sobredosis de nicotina.
El farmacéutico comunitario, por su cercanía y accesibilidad, está en una posición privilegiada para aportar una serie de consejos útiles relativos a la administración de la terapia sustitutiva de nicotina (TSN). Para ello, se debe tener en cuenta lo siguiente:
- Los parches transdérmicos permiten obtener unos niveles estables de nicotina en plasma. La forma correcta de uso es aplicarlo todos los días al levantarse en una zona cualquiera de la piel (limpia, seca, sin pelo y sin heridas), preferiblemente cubierto por la ropa (glúteos y muslos pueden ser zonas adecuadas, por ejemplo), y debe retirarse al acostarse (parche de 16 h) o al día siguiente (de 24 h). Esta forma farmacéutica está recomendada para fumadores con baja y moderada dependencia nicotínica.
- Los chicles están formados por un complejo resinoso de nicotina, y pueden contener 2 o 4 mg de nicotina, que se libera al masticar gracias al pH alcalino salivar y se absorbe por la mucosa orofaríngea. Su administración puede realizarse a demanda o bien de forma pautada (más recomendable). Existen dos presentaciones:
Chicles de 4 mg cada 1-1,5 h: para fumadores con alta o moderada dependencia nicótica.
Chicles de 2 mg cada 1,5-2 h: para fumadores con baja dependencia nicótica.
- El tratamiento con chicles de nicotina no debería tener nunca una duración inferior a 8 semanas, si bien generalmente se recomienda una duración mínima de 3 meses; en aquellos pacientes con alta dependencia física, puede prolongarse el tratamiento hasta 6 meses. La dosis máxima al día es de 60 mg, pero en la fase inicial no se deben superar los 30 mg/día (15 chicles de 2 mg). No es conveniente tampoco el cese brusco de la administración de chicles, puesto que el paciente podría recaer. Cuando haya reducido la dosis a 1 o 2 unidades diarias, el paciente podrá abandonar el tratamiento.
Por otro lado, en cuanto al uso de vareniclina (Champix®, medicamento sujeto a prescripción médica), el tratamiento debe comenzarse con una titulación semanal tal y como se indica a continuación:
- Días 1-3: 0,5 mg de vareniclina una vez al día.
- Días 4-7: 0,5 mg de vareniclina dos veces al día.
- Día 8 y hasta el final del tratamiento: 1 mg de vareniclina dos veces al día.
La duración del tratamiento con vareniclina es de 12 semanas. En aquellos pacientes que transcurrido este periodo hayan conseguido dejar de fumar, se puede considerar un tratamiento adicional de 12 semanas con 1 mg de vareniclina 2 veces al día para el mantenimiento de la abstinencia.
Con respecto al tratamiento con bupropión (Zyntabac®, medicamento sujeto a prescripción médica), hay que recordar que éste debe iniciarse con una dosis de 150 mg una vez al día durante los 6 primeros días de tratamiento; a partir del séptimo día, se debe aumentar a 150 mg dos veces al día, deberían transcurrir al menos 8 horas entre dosis sucesivas. El tratamiento debe mantenerse durante 7-9 semanas, sin embargo, si no se observa ningún efecto a las siete semanas, se deberá suspender.
En definitiva, se puede concluir que las mejores campañas contra el tabaquismo son las que contemplan e integran los distintos ámbitos (Plaza et al., 2016): prevención del inicio al consumo del tabaco por parte de los jóvenes (incremento de precio, restricción de publicidad directa e indirecta, campañas en escuelas, etc.), protección de la salud de los no fumadores (control del consumo en lugares públicos), información sanitaria a la población general (avisos sanitarios, información en programas comunitarios, en TV, o en otros medios de comunicación social) y, por último, ayuda para que los fumadores dejen de consumir tabaco (disponibilidad de recursos asistenciales, y financiación de los tratamientos del tabaquismo).