resumen
La listeriosis es una toxiinfección causada por el germen patógeno Listeria monocytogenes, debida en la práctica totalidad de casos al consumo de alimentos contaminados. La enfermedad, que en los últimos años se ha convertido en un problema emergente de seguridad en la industria alimentaria con alto impacto en salud pública (y sobre la cual existe una creciente conciencia y conocimiento), afecta principalmente a mujeres embarazadas, recién nacidos, adultos mayores y personas con el sistema inmunitario debilitado. Se trata de una de las principales causas de mortalidad por toxiinfecciones alimentarias.
El tratamiento de la listeriosis es sencillo en la mayoría de los casos, con una alta eficacia de los antibióticos orales cuando se trata a tiempo. No obstante, la profilaxis es la medida más eficaz y eficiente contra este problema de salud.
La presente revisión aborda la importancia de conocer las medidas preventivas que ayudan a reducir el riesgo de infección, poniendo en valor el papel fundamental que el profesional farmacéutico ejerce desde la farmacia comunitaria y hospitalaria, y como agente activo en Salud Pública, en todo lo referente a una posible detección/prevención de listeriosis.
AGENTE ETIOLÓGICO
Las bacterias pertenecientes al género Listeria son bacilos gram-positivos, cortos, no esporulados, ramificados, ni encapsulados (sin formas de resistencia), que suelen observarse en disposición individual o formando cortas cadenas; presentan de 1 a 5 flagelos peritricos que les confieren una notable movilidad en temperaturas alrededor de los 25 ºC (Oteo et al., 2018).
A nivel microbiológico, las bacterias del género Listeria son anaerobias facultativas o microaérofilas, catalasa positivo y oxidasa negativo. En cultivos, pueden aparecer formando filamentos de 6-20 mm de longitud; las colonias son pequeñas (de 1 a 2 mm tras uno o dos días de incubación) y lisas. Al analizarse a la lupa con epi-iluminación y un ángulo de luz de 45-60°, se observan reflejos de color azul-verdoso sobre una superficie finamente granular. Su temperatura óptima de crecimiento está entre 30 ºC y 37 ºC, pero pueden crecer a 4 ºC en pocos días.
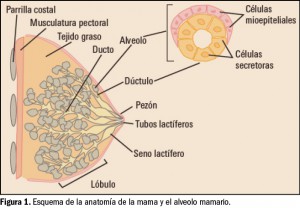
De las seis especies comprendidas en este género, solo son potencialmente patógenas Listeria monocytogenes y L. ivanovii, afectando esta última principalmente a los animales, por lo que L. monocytogenes (Figura 1) –debido fundamentalmente a su gran resistencia en condiciones poco favorables– es la única implicada en la patología humana conocida como listeriosis. Las otras cuatro, L. innocua, L. seeligeri, L. welshimeri y L. grayi (sin. murrayi) son inocuas para el ser humano y para los animales (Montville et al., 2005).
El primer aislamiento y descripción del agente responsable de una infección por Listeria se realizó hace más de 80 años tras la muerte de un elevado número de conejos y cobayas. El agente causal se describió como un bacilo corto, Gram positivo, no esporulado, que infectaba los monocitos sanguíneos, y se denominó Bacterium monocytogenes (Murray et al., 1926). En 1930 se aisló una bacteria parecida del hígado de unos jerbos enfermos, que se denominó Listerella hepatolytica, en homenaje al médico británico Sir Joseph Lister (1827-1912), quien en 1867 estableció las bases de la antisepsia en cirugía, la cual permitió intervenciones quirúrgicas “limpias” y seguras. Sin embargo, como el nombre del género Listerella ya se había aplicado a un género de mohos productor de mucílago, éste se cambió –igual que el de la especie– por Listeria (L. monocytogenes) (Pirie, 1940).
Listeria monocytogenes puede presentar una localización ubicua, habiéndose descrito su presencia en el intestino de animales, de personas sanas (que actúan como portadores asintomáticos) y en el medio ambiente; se distribuye y sobrevive tanto en suelo, paredes o techos, tierra, aguas, materia fecal o vegetación (especialmente materia vegetal en descomposición), como en equipos de plantas de procesado de alimentos, de donde es muy difícil de erradicar. Además de éstos, como reservorios animales u hospedadores pueden actuar el ganado bovino, caprino u ovino, las aves (pavos, gallinas, faisanes, etc.), los peces e incluso los crustáceos.
Se trata de un microorganismo psicrotrofo –cuya temperatura óptima de crecimiento se encuentra en el rango mesófilo (20-45 ºC) pero que puede multiplicarse con facilidad a temperaturas inferiores a 7 ºC– y resistente a ambientes poco favorables para el crecimiento de otras bacterias, pues tolera amplios rangos de temperaturas, de pH y de concentraciones de sal (Tabla 1). Así, L. monocytogenes sobrevive en alimentos ácidos, con alto contenido en sales, y a bajas temperaturas, durante meses en alimentos refrigerados (<5 ºC); incluso podría resistir largos periodos en diferentes alimentos a temperaturas de congelación (<-18 ºC). También puede crecer muy lentamente en alimentos con pH neutro y con un alto contenido de nutrientes a temperaturas alrededor de 0 ºC.
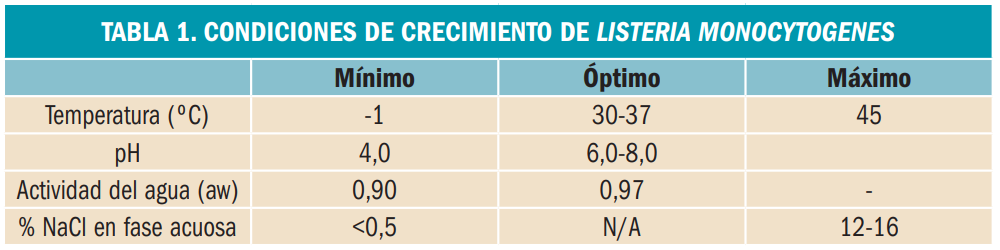
Es importante subrayar que L. monocytogenes es resistente a tratamientos térmicos hasta casi el límite de la pasteurización, por ejemplo, 74 ºC durante 1 segundo en leche cruda o de 82 ºC en carnes envasadas al vacío (por ejemplo, de pollo). Su resistencia a la temperatura aumenta en condiciones favorables de pH y actividad de agua, especialmente si ha habido crecimiento previo a temperatura ambiente.
ETIOPATOGÉNESIS
Los alimentos contaminados son los principales vehículos de transmisión de L. monocytogenes: el consumo de los mismos se asocia al 99% de casos de listeriosis humana (Vázquez-Boland et al., 2001).
A este respecto, se debe subrayar que la bacteria puede estar presente tanto en alimentos vegetales como animales, si bien se asocia mayoritariamente al consumo de quesos poco curados (blandos) y otros derivados lácteos elaborados con leche cruda o sin pasteurizar, frutas y verduras crudas, patés y pescados crudos o ahumados en frío, carne de rumiantes y aves no cocinadas o poco cocinadas, y embutidos cocidos y curados. Puede encontrarse también en alimentos y comidas preparadas listas para su consumo (pre-cocinados) de origen vegetal, lácteo, marino o cárnico. Las causas de la contaminación de los alimentos suelen estar relacionadas con la falta de higiene, la contaminación cruzada y, sobre todo, el inadecuado procesado de los alimentos tanto en la transformación de los alimentos en la industria como en la preparación y el cocinado de los alimentos en el hogar.
Adicionalmente, aunque en casos raros, la bacteria L. monocytogenes se puede transmitir al ser humano por vía vertical (de madre embarazada a feto) o por vía zoonótica (contacto directo con animales infectados o sus tejidos o excrementos, quizá de mayor riesgo para veterinarios y ganaderos en situaciones como, por ejemplo, durante y después del parto sin protección de un animal infectado). Algunos artrópodos, tales como garrapatas y moscas, pueden ser portadores de la bacteria y, por tanto, actuar como vectores. A excepción de la transmisión vertical, la transmisión persona-persona es rara, pero no se puede descartar la transmisión por vía nosocomial, es decir, la adquisición hospitalaria, principalmente en técnicas obstétricas y ginecológicas.
El mecanismo general de patogenicidad implica que, tras la ingestión de un alimento contaminado, la bacteria atraviesa la barrera intestinal, pasando –a través de los ganglios linfáticos– al torrente circulatorio y diseminándose posteriormente a tejidos, en especial, a hígado y bazo. En las personas adultas, salvo en las embarazadas, L. monocytogenes muestra un tropismo específico por el sistema nervioso central, provocando meningitis y meningoencefalitis con relativa frecuencia. De forma excepcional, la vía de entrada de la bacteria podría ser parenteral, inhalatoria o a través de otras mucosas distintas a la intestinal. Su dosis infectiva mínima (DIM) puede encontrarse entre 10 y 108 unidades formadoras de colonias (UFC) en hospedadores sanos, y entre 0,1 y 106 UFC en hospedadores con riesgo elevado de infección.
Listeria invade células no fagocíticas (células epiteliales, células caliciformes, trofoblastos) a través de endocitosis mediada por internalinas (InlA, InlB, InlP), así como células fagocíticas (macrófagos), en las cuales la bacteria se internaliza en una vacuola o fagolisosoma. En el fagolisosoma, el pH ácido y la baja concentración de hierro favorecerá que la bacteria produzca una toxina citolítica y hemolítica, llamada listeriolisina O, que actúa como un importante factor de virulencia capaz de provocar la modificación de histonas, lisis mitocondrial, aumento del estrés del retículo endoplasmático o de la permeabilidad lisosomal, generando, en última instancia, la formación de poros en la membrana extracelular. Esta listeriolisina se fija al colesterol y promueve –junto a las fosfolipasas A y B– la ruptura de la membrana del fagolisosoma (Radoshevich et al., 2018). Parece que el fagolisosoma es el principal factor que favorece la supervivencia intracelular y una de las características patogénicas más definitorias de L. monocytogenes.
EPIDEMIOLOGÍA
En las últimas tres décadas, la listeriosis se ha convertido en los países desarrollados en una de las principales zoonosis emergentes de transmisión alimentaria (Domínguez, 2010). Se han aislado bacterias del género Listeria del suelo, de materia vegetal en putrefacción, aguas residuales, comida animal, pollo fresco y congelado, alimentos frescos y procesados, queso, leche no procesada, desechos de los mataderos, así como en el tracto digestivo de humanos y animales asintomáticos. Presenta una distribución mundial, sin circunscribirse específicamente a una región o continente concreto. Si bien no todos los grupos poblacionales tienen el mismo riesgo del desarrollo de la enfermedad por el consumo de alimentos contaminados, algunos de ellos, como las embarazadas, presentan un riesgo crítico.
Sobre todo desde la década de 1980 se comenzaron a reportar un número notable de brotes de listeriosis debidos a la ingestión de alimentos, los cuales fueron declarados y estudiados, especialmente, en Europa y América del Norte. A modo de ejemplo, uno de los primeros ocurrió en Canadá y afectó a 34 recién nacidos y a 7 adultos, con una mortalidad superior al 28% (Schlech et al., 1983). Pruebas epidemiológicas y cultivos bacterianos demostraron que en los adultos la infección se debía a la ingestión de coles cultivadas en un campo abonado con estiércol procedente de un rebaño de ovejas, varias de las cuales habían muerto de listeriosis. Otro brote que tuvo lugar en Boston (EE.UU.) en 1979 afectó a 20 pacientes adultos de 8 hospitales; aunque no se pudo concluir cuál era el alimento implicado, todos los enfermos habían ingerido hortalizas crudas (Ho et al., 1986).
Fue quizá el brote que aconteció en el estado de California en 1985, que afectó a 93 bebés y a 49 adultos, provocando 48 muertes, el que alertó a la comunidad científica internacional y motivó el impulso de la investigación sobre el rol que desempeñaban los alimentos en la transmisión de la listeriosis. La cepa de L. monocytogenes responsable de ese brote se aisló en un queso blanco mejicano y en la fábrica donde se elaboró. El brote cesó cuando se retiró del mercado todo el lote del citado queso (Linnan et al., 1988).
En la toma de conciencia de la relevancia de la infección por L. monocytogenes en Europa, se podría destacar un brote que duró de 1983 a 1987 y afectó a 122 personas, la mitad de ellas bebés, y que resultó en 31 fallecimientos. En ese caso, el origen se debió a un queso blando de tipo vacherin francés, cuya retirada del mercado también terminó con el brote (Bille, 1990). Posteriormente, de marzo a diciembre de 1992, se produjeron 279 casos de listeriosis humana en casi toda Francia, fallecieron 63 pacientes y abortaron 32 mujeres embarazadas. El alimento responsable fue una conserva de lengua de cerdo recubierta de gelatina, de la que se aisló L. monocytogenes del serotipo 4b (Goulet et al., 1993).
Hasta el año 2010, se estima que L. monocytogenes ha causado alrededor de un total de 23.150 casos en todo el mundo (Radoshevich, et al., 2018). En definitiva, debido a su amplia y ubicua distribución, este microorganismo tiene muchas oportunidades de contaminar alimentos en distintos pasos de la producción alimentaria, siendo ésta la vía más frecuente por la que el ser humano adquiere la infección.
En base a lo anterior, y a la calificación de Listeria monocytogenes como agente de riesgo biológico del grupo 21 (según lo dispuesto en el Anexo II del Real Decreto 664/1997, de 12 de mayo, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes biológicos durante el trabajo), se consideran actividades laborales de riesgo: las que impliquen contacto con animales o con sus productos y aquellas relacionadas con el procesado, conservación y elaboración de productos cárnicos (despojos, triperías, sebos, grasas), con el procesado de la leche y fabricación de productos lácteos. También se incluirían aquellas actividades profesionales asociadas al suministro de aguas, actividades de saneamiento, gestión de residuos y limpieza urbana, así como servicios de comidas y bebidas y actividades sanitarias y laboratorios.
Situación actual en la Unión Europea
El informe anual sobre las principales zoonosis transmitidas por alimentos en Europa durante 2017, publicado por la EFSA (Autoridad Europea de Seguridad Alimentaria)2, pone de manifiesto que, a diferencia de la salmonelosis y la campilobacteriosis, cuyo número de casos en la UE se ha mantenido estable durante los últimos cinco años, la listeriosis mantiene una tendencia sostenida de crecimiento. Si bien su incidencia es mucho menor que la de otras zoonosis y aún es relativamente rara, la listeriosis es de gran relevancia para la salud pública por ser una de las enfermedades más graves y con mayores tasas de hospitalización y mortalidad de las transmitidas por los alimentos. Para la EFSA, la reversión de esa tendencia representa una de las prioridades de Salud Pública.
La vigilancia epidemiológica de la listeriosis humana en la UE se centra en las formas graves e invasivas de la enfermedad, que afectan especialmente a los grupos de mayor riesgo (ancianos, personas inmunocomprometidas, mujeres embarazadas y bebés). En el 2017 se notificaron en la UE 2.480 casos confirmados de listeriosis invasiva y, con una mortalidad global de uno de cada 10 pacientes. Así, la tasa de notificación en la UE en 2017 se situó en 0,48 casos/100.000 habitantes. Finlandia, Dinamarca y Alemania presentaron las tasas más altas con 1,62, 1,01 y 0,88 casos/100.000 habitantes, respectivamente, mientras que las menores tasas fueron notificadas en Bulgaria, Croacia y Chipre, con ≤ 0,2 casos/100.000 habitantes.
En cualquier caso, la incidencia de la listeriosis invasiva ha mostrado una significativa tendencia alcista desde que se inició su vigilancia en la UE en 2008, especialmente acrecentada en los últimos 5 años (2013-2017), lo cual podría deberse a causas diversas, tales como cambios en la forma de producción, almacenamiento, distribución y consumo de alimentos, pero también al envejecimiento de la población y al aumento de la esperanza de vida de los pacientes inmunocomprometidos.
Un ejemplo de la visibilidad que está alcanzando esta toxiinfección podría ser uno de los últimos brotes investigados por el Centro Europeo de Prevención y Control de Enfermedades (ECDC) y la Autoridad de Seguridad Alimentaria Europea (EFSA), que se ha relacionado con el consumo en frío de productos ahumados de pescado procedentes en su práctica totalidad de una empresa de procesamiento de alimentos de Estonia, y que entre julio de 2014 y febrero de 2019 ha afectado a 22 personas en 5 países de la UE, con un balance de 5 muertes por listeriosis.
En la lucha epidemiológica algunos Estados Miembros se centran especialmente en el muestreo de aquellos alimentos y comidas preparadas listas para el consumo, las cuales se almacenan refrigerados durante largos periodos antes de su consumo y facilitan el crecimiento de L. monocytogenes. De hecho, en 2017, los niveles más altos de la bacteria se detectaron fundamentalmente en las etapas de procesamiento de estos productos y, en mayor medida, en pescado y productos pesqueros (6%), seguidos de ensaladas preparadas (4,2%), carne y productos cárnicos pre-cocinados (1,8%), quesos blandos y semiblandos (0,9%), frutas y verduras frescas (0,6%) y quesos duros (0,1%). Sin embargo, a nivel global, siguen siendo raros los casos en que el recuento de Listeria supera el límite de seguridad alimentaria en alimentos listos para el consumo.
Situación actual en España
En España la listeriosis está clasificada como una enfermedad de declaración obligatoria (EDO) desde marzo de 2015. Así, las (CC.AA) notifican de forma individualizada y con periodicidad semanal los casos probables y confirmados de listeriosis al Centro Nacional de Epidemilogía (CNE) a través de la Red Nacional de Vigilancia Epidemiológica (RENAVE). La información del caso puede actualizarse después de la declaración inicial y se realiza una consolidación anual de la información. En caso de brote, el Servicio de Vigilancia de la Comunidad Autónoma envía el informe final del brote al CNE en un periodo de tiempo no superior a tres meses después de que haya finalizado su investigación. Ante casos acumulados o brotes en los que se sospeche una asociación con cierto alimento comercializado, la Comunidad Autónoma lo comunicará de forma urgente al Centro de Coordinación de Alertas y Emergencias Sanitarias (CCAES) y al CNE. Estos valoran, junto con las CC.AA. afectadas, las medidas a tomar y, si fuera necesario, su notificación al Sistema de Alerta y Respuesta Rápida de la Unión Europea y a la OMS de acuerdo con el Reglamento Sanitario Internacional.
Según el Informe de la EFSA previamente comentado, España notificó una tendencia significativamente creciente en el número de casos entre 2013 y 2017 (considerando que antes de 2015 la notificación de casos de listeriosis era voluntaria), y contabilizó 284 casos confirmados de listeriosis invasiva en 2017.
No obstante, algunos expertos apuntan a que la listeriosis es una enfermedad emergente que, por el momento, se considera infradiagnosticada y con importantes lagunas a nivel epidemiológico. Así, un reciente estudio epidemiológico ha analizado los datos –limitados en calidad y cantidad– de hospitalizaciones por listeriosis en España entre 1997 y 2015 (Herrador et al., 2019). En ese periodo, según la base de datos de altas hospitalarias centralizada del Ministerio de Sanidad (Conjunto Mínimo Básico de Datos), se tiene constancia de 5.696 hospitalizaciones con diagnóstico de listeriosis (edad media de los pacientes 58,6 años, 59% hombres). La tasa media fue de 0,67 casos por 100.000 habitantes, con una tendencia creciente en el número de hospitalizaciones durante el período de estudio y con las mayores tasas correspondientes al grupo etario de >65 años, seguido por el grupo de 45 a 64 años (Figura 2).
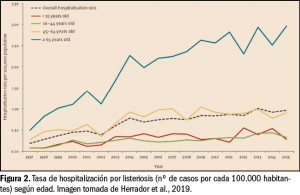
La distribución geográfica de los casos apunta una concentración mayoritaria en el norte de España, siendo Cataluña, Cantabria y La Rioja las CC.AA. que notificaron las tasas más elevadas de hospitalización por listeriosis, con 23,19, 18,87 y 17,09 casos/100.000 habitantes, respectivamente. La duración media de estancia hospitalaria fue de 21 días y el coste medio de la misma fue superior a 6.300 euros por paciente. Se observó meningoencefalitis y/o septicemia en el 44% (con más frecuencia en varones) y el 8% de los casos. Por su parte, la tasa de mortalidad se situó en 0,06 casos por 100.000 habitantes, representando el 17% de los casos de hospitalización; dos de cada tres muertes se produjeron en pacientes >65 años, con incidencia mayor en los casos de septicemia.
El estudio plantea que en la tendencia al aumento de casos y su concentración en ciertas zonas geográficas o grupos etarios pueden subyacer causas como las diferencias en los hábitos alimenticios (consumo de ciertos alimentos o diversas regulaciones), la edad media de la población por la mayor esperanza de vida, diferencias en las medidas preventivas educativas y/o la mayor propensión de los profesionales sanitarios a buscar el diagnóstico de listeriosis en ciertas CC.AA.
Los autores advierten del potencial riesgo que implica un mayor consumo de alimentos pre-cocinados o listos para el consumo (por unas prácticas de preparación/conservación posiblemente no muy estrictas o una falta de capacitación de los manipuladores de alimentos) y la aparición de cepas de Listeria especialmente virulentas o resistentes a desinfectantes en un aumento de los casos de listeriosis. Concluyen que es necesaria una mayor atención a la prevención y el control de esta enfermedad en nuestro país.
Por último, se debe hacer mención a los brotes que han surgido en las últimas semanas. El día 15 de agosto de 2019, la Dirección General de Salud Pública y Ordenación Farmacéutica de la Junta de Andalucía decretó la alerta sanitaria sobre un producto alimenticio de carne mechada3, tras comprobar que este producto era el agente causante de los casos de listeriosis que se habían registrado en las semanas previas en la región. A pesar de que entró en remisión el 23 de agosto, causó, hasta mediados de septiembre, un total de 215 casos de infección con la bacteria, alcanzando, pues, una magnitud destacable. Solo existen precedentes comparables en un brote en EE.UU en 2011, con 147 pacientes infectados, y otro en Sudáfrica en 2017-2018, con 1.060 casos (y una mortalidad del 27%).
Posteriormente, la propia Junta de Andalucía ha declarado otros dos casos –uno de alerta alimentaria y un segundo de alerta sanitaria– relacionados con productos cárnicos, pero con mucho menor impacto (0 y 7 casos leves, respectivamente).
MANIFESTACIONES CLÍNICAS
La listeriosis es una enfermedad normalmente asintomática e infrecuente, pero potencialmente grave, de elevada tasa de mortalidad (20-30%) en sectores poblacionales con alta susceptibilidad si se compara con la de otras toxiinfecciones alimentarias.
La listeriosis se puede presentar en dos formas clínicas. Por un lado, la listeriosis gastrointestinal no invasiva, también conocida como leve o gastroenteritis febril aguda, es el tipo de listeriosis más habitual, mayoritaria en adultos sanos. Suele manifestarse a las 24 horas del contacto con alimentos contaminados y se caracteriza por fiebre esporádica acompañada de problemas gastrointestinales (dolor abdominal, diarreas acuosas, náuseas y vómitos) y, en ocasiones, cefalea y mialgias. Estos síntomas pueden durar entre 11 y 18 días.
La otra posible presentación clínica es la listeriosis invasiva o severa, en la cual existe afectación neurológica que puede ocasionar desde cefalea hasta una meningitis o meningoencefalitis. Es la forma complicada de la enfermedad y la más preocupante desde el punto de vista clínico y de salud pública. En general, las personas con listeriosis invasiva presentan síntomas entre 1 y 4 semanas después de haber comido alimentos contaminados con Listeria. Si bien la media del periodo de incubación se suele fijar en unos 21 días, algunos casos pueden “dar la cara” hasta 70 días tras la exposición. No obstante, también hay casos en que los síntomas aparecen tan temprano como el mismo día de la exposición. Además, el periodo de transmisibilidad de la bacteria es también muy variable; por ejemplo, las madres infectadas pueden transmitir la bacteria por las secreciones vaginales y la orina entre 7 y 10 días después del parto, y otras personas infectadas la pueden excretar por las heces durante meses.
Tal como se ha sugerido, la listeriosis severa afecta principalmente a grupos susceptibles, tales como mujeres embarazadas, recién nacidos y niños pequeños, adultos mayores de ≥65 años y personas con el sistema inmunitario debilitado. Siempre que la listeriosis acontece en estos grupos de riesgo es considerada como listeriosis severa. A pesar de que la afectación neurológica es la más relevante, las infecciones por Listeria a veces pueden afectar otras partes del cuerpo, entre ellas los huesos, las articulaciones y partes del pecho y el abdomen. Los síntomas más típicos de la enfermedad suelen ser fiebre, dolores musculares, vómitos o diarreas, rigidez de cuello, confusión y fatiga. Se desconoce si la bacteria puede tener efectos alérgicos, tóxicos o cancerígenos.
Cabe destacar que la enfermedad se puede transmitir verticalmente –por vía transplacentaria o durante el parto (perinatal)– de la madre al feto o al recién nacido, lo cual suele producirse con mayor frecuencia en el tercer trimestre de embarazo y cursar en la embarazada como un cuadro pseudogripal de evolución favorable, con fiebre y otros síntomas inespecíficos como fatiga, escalofríos, cefalea, artralgias, mareos o síntomas gastrointestinales; esta transmisión vertical se puede producir incluso aunque la madre sea asintomática. Es muy poco frecuente el desenlace fatal en la madre, pero si no se instaura tratamiento adecuado se puede producir corioamnionitis (infección del líquido amniótico y de las membranas que lo contienen) e infección fetal.
Si la transmisión es por vía transplacentaria, la afectación fetal puede ser causa de aborto, alumbramiento de un niño muerto o parto prematuro de un neonato infectado, que suele manifestarse con un cuadro clínico de aparición temprana (pocos días después del parto) y puede dar lugar a neumonía, sepsis, meningitis o, en casos más graves, un cuadro denominado granulomatosis diseminada o infantiséptica. En casos de transmisión perinatal puede producirse una listeriosis neonatal de aparición tardía, mostrándose síntomas de meningitis una o varias semanas después del parto (Cabezas et al., 2015).
Por último, se debe mencionar que se han descrito otras manifestaciones más infrecuentes de listeriosis, entre las que se incluye la listeriosis local o cutánea, asociada al contacto con animales infectados y cursa con una erupción cutánea caracterizada por la aparición de pápulas o pústulas en los brazos o en las manos, pudiendo acompañarse de fiebre, escalofríos, cefaleas, mialgias y dolor generalizado. La listeriosis óculo-glandular (síndrome febril agudo caracterizado por conjuntivitis e inflamación de los ganglios linfáticos delante de las orejas) y la listeriosis tifoidea (caracterizada por fiebre alta) son más frecuentes en personas inmunocomprometidas (Oteo et al., 2018).
CONSIDERACIONES LEGALES
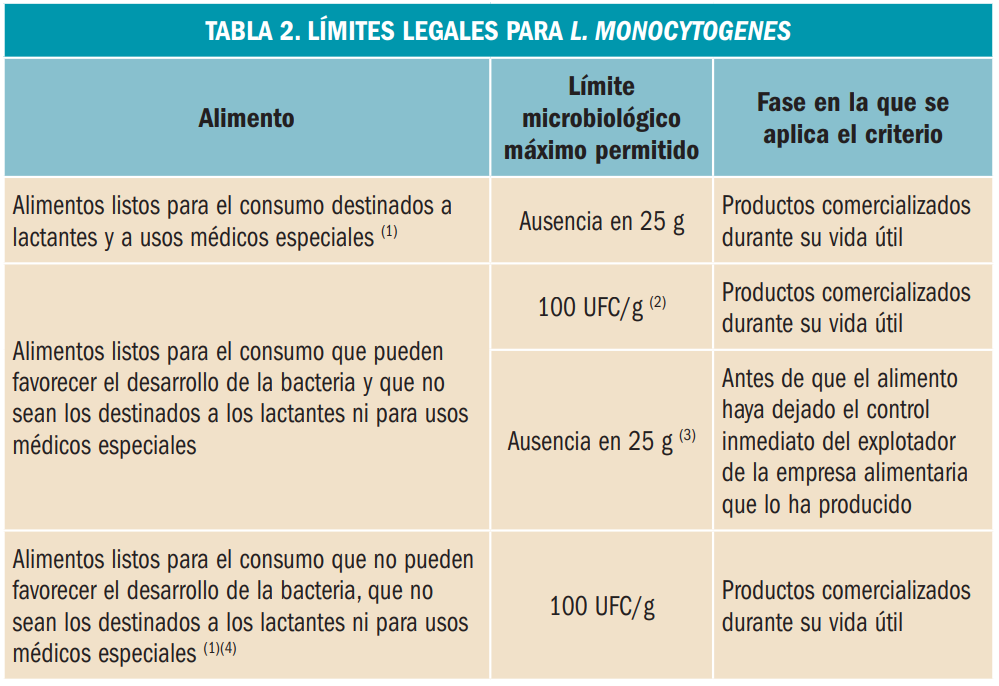
Las explotaciones ganaderas y mataderos deben cumplir los criterios de higiene de los procesos, establecidos en el Reglamento (CE) 2073/2005, de la Comisión Europea de 15 de noviembre de 2005, relativo a los criterios microbiológicos aplicables a los productos alimenticios y sus posteriores modificaciones (Tabla 2).
4. Además de una estrecha vigilancia sanitaria y el aislamiento de animales infectados (con destrucción de los cadáveres o fetos abortados en condiciones de seguridad), las estrategias más eficaces de control de L. monocytogenes durante la transformación de los alimentos en alimentos de mayor riesgo incluyen:
- Buenas prácticas de fabricación, procedimientos eficaces de limpieza y desinfección y la aplicación de programas de control de peligros (APPCC), que minimicen la contaminación ambiental por L. monocytogenes y prevengan la contaminación cruzada en plantas de procesado, despiece y venta. Se debe garantizar un adecuado mantenimiento, desinfección y/o esterilización de las herramientas, los equipos y las superficies de trabajo.
- Un programa intensivo de muestreo para detectar la contaminación ambiental por L. monocytogenes en plantas de procesado de los alimentos de mayor riesgo y evitar así su propagación a los alimentos preparados.
- Controles eficaces de tiempo y temperaturas de distribución y almacenamiento para los alimentos preparados, incluyendo la determinación de un tiempo razonable de vida útil de aquellos alimentos que permiten el desarrollo de numerosas colonias de L. monocytogenes.
- Es especialmente importante evitar que las trabajadoras embarazadas manipulen animales de riesgo (por ejemplo, rumiantes, roedores, aves, etc.).
- Reformulación de los alimentos para prevenir o retrasar el desarrollo de L. monocytogenes.
- Utilizar tratamientos tras el envasado de los alimentos que permitan la inactivación de células viables de L. monocytogenes.
En línea con este último punto, entre los tratamientos de inactivación en la industria alimentaria, destaca la pasteurización (calentamiento a 75 ºC durante unos 15 segundos), que garantiza la destrucción de la Listeria en alimentos como leche y queso, con la posterior refrigeración. Asimismo, la esterilización (120 ºC durante 4 minutos) es eficaz en alimentos como leche, zumos de frutas y concentrados o nata, sin necesidad de refrigeración. Por otra parte, una dosis de radiación ionizante de 2 kGy es suficiente para destruir la bacteria en las concentraciones que se puede encontrar normalmente en los alimentos.
En el hogar
Puesto que la mayor parte de los casos de listeriosis ocurren en el hogar por consumo de alimentos contaminados con Listeria, es recomendable seguir unas buenas prácticas de higiene y manipulación en la preparación, cocinado y consumo de los alimentos:
- Limpieza y lavado profuso de las manos antes de manipular cualquier alimento.
- Garantizar una correcta higiene o, en caso de duda, la desinfección de las superficies, utensilios de cocina y tablas para cortar, a fin de evitar riesgos de contaminación cruzada con productos contaminados.
- Cocinar completamente los productos derivados de animales como carnes, pescados y aves (incluyendo huevos) y mantenerlos calientes hasta su consumo. Se aconseja cocinar a temperaturas mayores de 65 ºC, recalentando los platos precocinados y preparados, así como otras sobras de alimentos, incluso por encima de esa temperatura (suele recomendarse alcanzar los 70 ºC) (AESAN, 2014).
- Tras el consumo de los alimentos preparados (y, en general, de cualquier alimento), refrigerar los excedentes lo antes posible, preferiblemente a <5 ºC, antes de 2 horas tras su preparación y en recipientes con tapa; deben consumirse en 2-3 días. Si se congelan el día de la preparación, pueden guardarse más tiempo. Respetar siempre las fechas de caducidad de los alimentos que se mantienen refrigerados.
- Evitar el consumo de leche cruda que no ha sido pasteurizada o derivados elaborados con leche cruda. Las personas con el sistema inmunitario débil (por ejemplo, embarazadas) deben evitar comer quesos suaves o blandos como feta, Camembert, Brie y quesos azules (Roquefort); por el contrario, pueden consumir quesos duros, procesados, de crema y requesón.
- Evitar la contaminación cruzada de alimentos crudos con cocinados.
- Lavado adecuado y abundante con agua corriente las frutas, verduras y hortalizas que vayan a consumirse crudas, preferiblemente justo antes de su consumo. En grupos de especial riesgo, se aconseja incluso la desinfección de verduras crudas en una solución acuosa de hipoclorito sódico5, a las dosis indicadas por el fabricante, durante 5 minutos.
- Mantener la cadena de frío durante el transporte de los alimentos crudos susceptibles de ser contaminados con Listeria.
- No descongelar los alimentos a temperatura ambiente, sino en la parte baja del frigorífico.
EL PAPEL ASISTENCIAL DEL FARMACÉUTICO
A la vista de todo lo anterior, podemos concluir que el profesional farmacéutico tiene un papel fundamental desde la farmacia comunitaria y hospitalaria y también como agente activo en salud pública desde las Administraciones Públicas, Asociaciones y Colectivos Profesionales y Direcciones de Salud Pública en todo lo referente a la posible prevención y detección precoz de la listeriosis.
En pos de la promoción de la salud y prevención de la enfermedad, se pueden destacar, entre otras, varias vías de actuación profesional que adquieren especial relevancia en la labor asistencial del farmacéutico comunitario desde la oficina de farmacia:
- Preguntar al usuario/paciente acerca de la posibilidad de haber consumido alimentos contaminados en zonas donde se ha producido un brote de listeriosis.
- Sospechar la relación de síntomas como diarrea o fiebre con el consumo reciente de productos susceptibles de transmitir la Listeria. No obstante, en este punto es conveniente destacar que los síntomas, muchos de ellos inespecíficos, pueden presentarse de forma tardía a la ingestión de un alimento y dificultar el establecimiento de una asociación directa entre el alimento y la posible infección por Listeria. Ante una sospecha, la pertinente derivación y el diagnóstico por parte del especialista será decisivo en este aspecto.
- Informar sobre cuestiones fundamentales de la enfermedad a la población general, y especialmente a grupos de riesgo, profundizando en los métodos de prevención de la transmisión.
- Fomentar buenas prácticas de alimentación para evitar el contagio, en especial en grupos de riesgo; por ejemplo, recordando la conveniencia de consumir solo carnes perfectamente cocinadas y productos lácteos pasteurizados y de calentar las sobras de comidas. La Figura 3 resume aspectos fundamentales que el farmacéutico debe tener presente en relación con la listeriosis.

- Divulgar información científica rigurosa y veraz entre los pacientes y la población general, con fines de tipo preventivo y de promoción de la salud pública, a fin de dar a conocer la fuente donde se originó un posible brote y las medidas llevadas a cabo por las diferentes autoridades sanitarias. Desde la Administración, los farmacéuticos también actúan como “agentes centinela” desarrollando una intensa vigilancia epidemiológica. En esta línea, se aconseja desechar los alimentos potencialmente contaminados de forma segura, entregándolos a las autoridades sanitarias, así como no ofrecer restos de carne posiblemente contaminada a los animales domésticos y salvajes.
- Concienciar sobre la relevancia de un uso racional de los antibióticos empleados en el tratamiento de la listeriosis a fin de mitigar o prevenir la aparición de resistencias bacterianas y el elevado riesgo que conllevan.
- Colaborar con médicos y otros profesionales de la salud para proporcionar la mejor asistencia sanitaria posible al afectado, especialmente en los niveles de atención primaria. A este respecto, y con motivo de los últimos brotes de listeriosis detectados inicialmente en la Comunidad Autónoma de Andalucía, el Servicio Andaluz de Salud estableció las medidas de actuación a acometer desde los Servicios de Atención Primaria en el manejo de los pacientes que hayan ingerido un alimento contaminado por Listeria monocytogenes (Tabla 3).

Una mención especial merece, en relación con esta toxiinfección alimentaria que representa la listeriosis, el importante papel de los farmacéuticos de Salud Pública, quienes, desde las distintas áreas de control de riesgos –como son la Seguridad Alimentaria y la Salud Ambiental– desarrollan una labor clave, y quizá poco conocida, en la Prevención a través del control de riesgos ambientales y alimentarios, a fin de conseguir la protección de la salud de la población. Estos profesionales, funcionarios pertenecientes a las Consejerías de Salud de la distintas Comunidades Autónomas, son expertos altamente cualificados en seguridad alimentaria que realizan inspecciones –dentro de los planes y procesos establecidos en base al riesgo– a todas las empresas de la industria alimentaria en cualquiera de sus fases de actuación, desde fabricantes, distribuidores, almacenistas, y la venta final al consumidor (minoristas y restauración).
La labor que ejercen estos farmacéuticos de Salud Pública se ha demostrado imprescindible, por ejemplo, en el brote de listeriosis declarado el pasado verano en Andalucía, habiendo implementado de forma inmediata, en colaboración y coordinación con otros profesionales, los protocolos de trabajo y las actuaciones necesarias para investigar un brote de origen alimentario, a fin de conseguir reducir el número de afectados, localizar los alimentos implicados en el brote y retirarlos rápidamente de los canales de venta. Entre esas acciones destacan aquellas medidas de control realizadas en el establecimiento alimentario en que se presente el alimento causante del brote, donde se actúa de manera urgente mediante la toma de muestras de los alimentos implicados para identificar el agente causal, la intervención cautelar de la mercancía y la suspensión de la actividad de la empresa, si procede.
Todas las empresas alimentarias han de tener implantados los Sistemas de Autocontrol y Análisis de Peligros y Control de Puntos Críticos (APPCC), así como llevar a cabo controles microbiológicos exigidos por el Reglamento CE 2073/2005, de la Unión Europea, y el farmacéutico de Salud Pública es el control oficial que verifica y audita el cumplimiento de esta normativa alimentaria.
REFERENCIAS