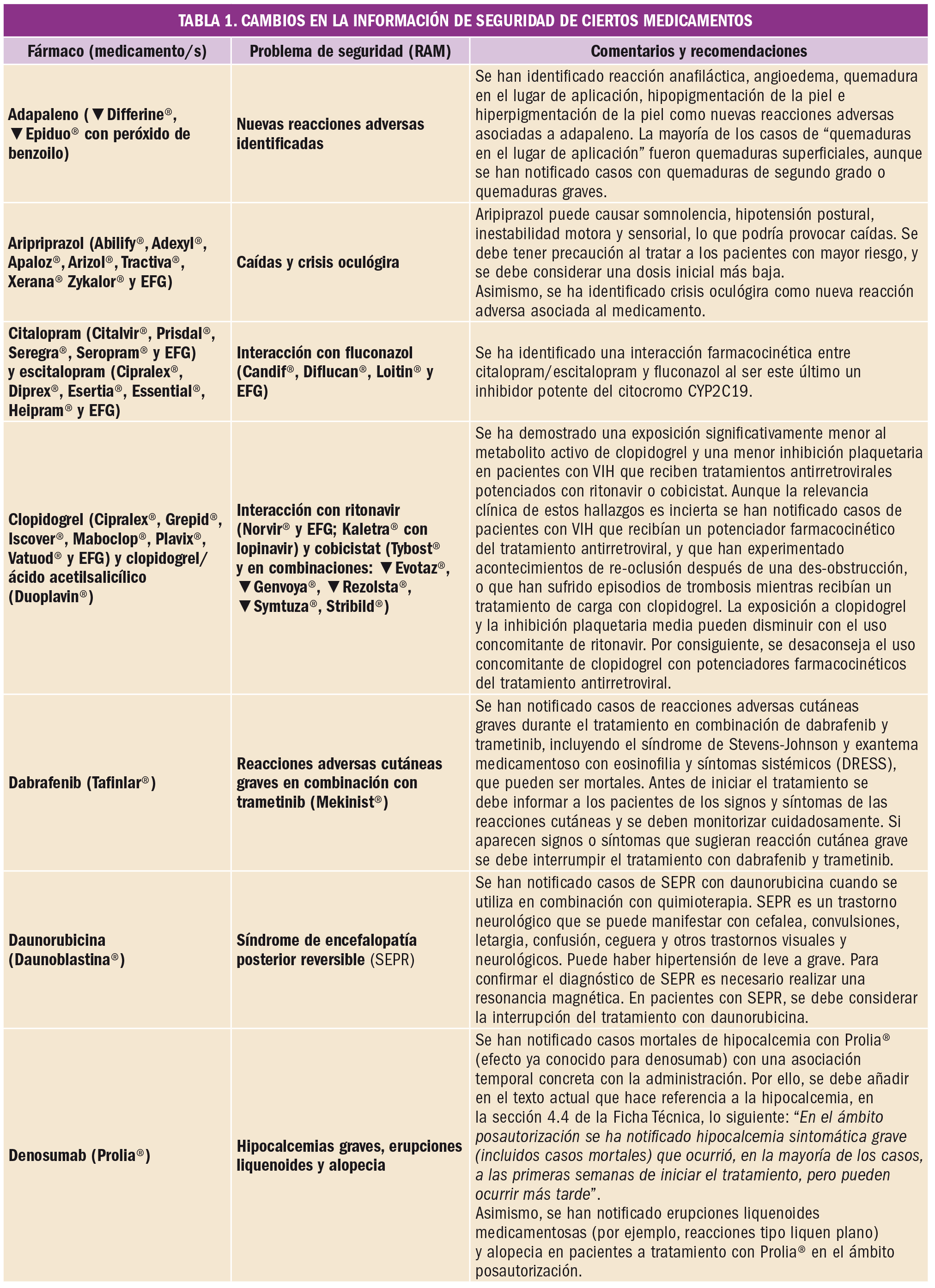
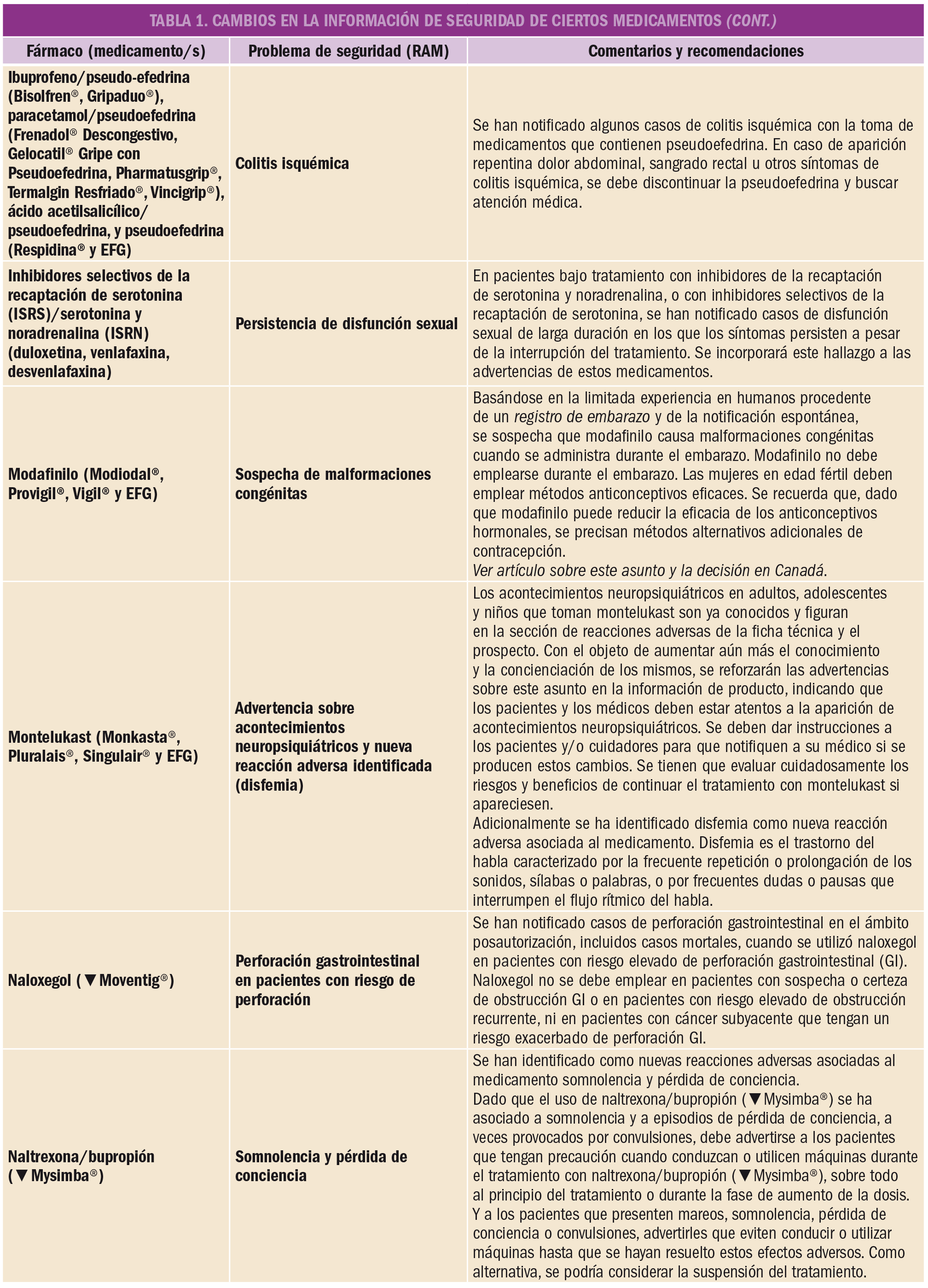
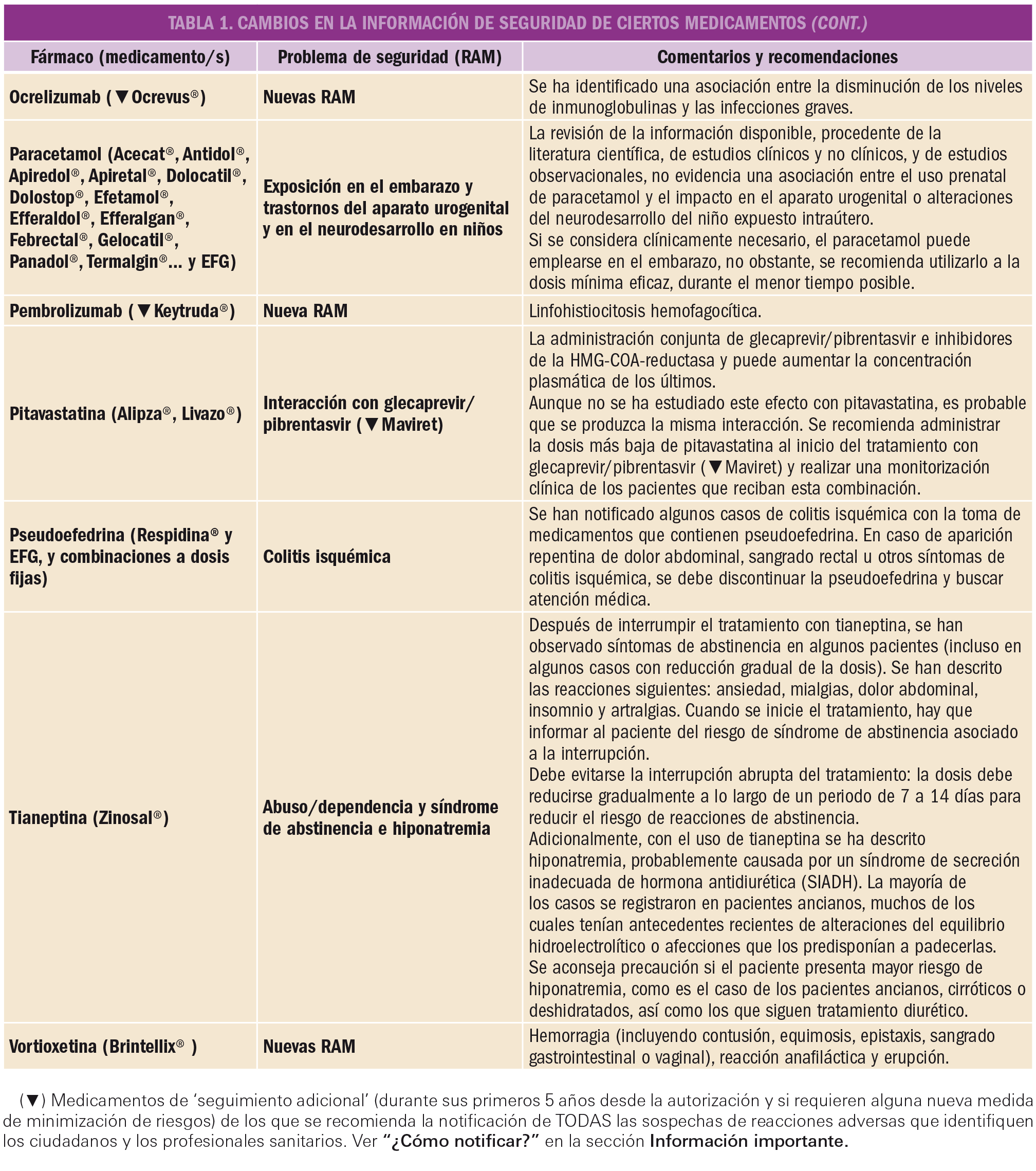
Un artículo reciente demuestra, mediante la evaluación del conjunto de datos con seguimiento a largo plazo procedentes de dos ensayos clínicos, que la terapia inhibitoria combinada BRAF/MEK con dabrafenib y trametinib en primera línea aumenta la supervivencia global a 5 años hasta el 34% y la supervivencia libre de progresión hasta el 19% en pacientes con melanoma inoperable o metastásico con mutación BRAF V600. De forma interesante, entre el 19% de pacientes que muestran respuesta completa al tratamiento, la supervivencia global a 5 años crece hasta el 71%.
La coadministración de dabrafenib (anti-BRAF) con trametinib (anti-MEK) constituye, desde hace poco tiempo, una opción terapéutica de primera línea para los pacientes con melanoma inoperable o metastásico con una mutación de BRAF V600 (V600E o V600K). La doble terapia inhibitoria de tirosina cinasas BRAF/MEK ha demostrado una prolongación significativa de la supervivencia libre de progresión y de la supervivencia global respecto al empleo exclusivo de dabrafenib. Sin embargo, existía cierta incertidumbre sobre la eficacia y seguridad a largo plazo de dicha combinación.
Para arrojar luz sobre ese asunto, los autores de un reciente estudio analizaron el conjunto de datos de supervivencia de dos ensayos clínicos aleatorizados (COMBI-d y COMBI-v), que incluían pacientes previamente no tratados (naïve) y que, durante los ensayos, recibieron el inhibidor de BRAF dabrafenib (a dosis de 150 mg/12 h) más el inhibidor de MEK trametinib (2 mg/24 h). La mediana de duración del seguimiento fue de 22 meses (rango: de 0 a 76) y las variables primarias fueron la supervivencia libre de progresión en COMBI-d y la supervivencia general en COMBI-v. En ambos estudios se aleatorizaron un total de 563 pacientes a recibir dabrafenib más trametinib (211 y 352, respectivamente).
Las tasas de supervivencia libre de progresión fueron del 21% (IC95% de 17 a 24) a los 4 años y del 19% (IC95% de 15 a 22) a los 5 años. Además, las tasas de supervivencia global se situaron en el 37% (IC95% de 33 a 42) a los 4 años y en el 34% (IC95% de 30 a 38) a los 5 años. En el análisis multivariable, se identificaron varios factores pronóstico positivo (en el estado basal inicial) como determinantes para una mayor supervivencia libre de progresión y global: capacidad funcional, edad, género, número de órganos con metástasis y niveles de lactato deshidrogenasa. Un total de 109 pacientes (19%) experimentaron respuesta completa a la combinación dabrafenib/trametinib y ésta se asoció claramente con un mejor resultado a largo plazo, pues en estos pacientes la tasa de supervivencia global crecía hasta el 71% (IC95% de 62 a 79) a los 5 años.
Así pues, se puede concluir que el tratamiento de primera línea con dabrafenib más trametinib conduce a un beneficio a largo plazo en aproximadamente un tercio de los pacientes con melanoma no resecable o metastásico con una mutación BRAF V600E o V600K. La eficacia clínica puede verse maximizado a largo plazo por varios factores y, especialmente, por la presencia inicial de respuesta completa, siendo estos pacientes quienes pueden beneficiarse en mayor medida del tratamiento.