Resumen
Abemaciclib es un nuevo inhibidor competitivo, potente y selectivo de las cinasas dependientes de ciclinas 4 y 6 capaz de reducir la proliferación celular mediante el bloqueo de la progresión de la célula de la fase G1 a la fase S del ciclo celular. El medicamento ha sido autorizado para el tratamiento de mujeres con cáncer de mama localmente avanzado o metastásico, positivo para el receptor hormonal (HR) y negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2), en combinación con un inhibidor de la aromatasa o fulvestrant como hormonoterapia inicial o en mujeres que hayan recibido hormonoterapia previa. En mujeres pre- o perimenopáusicas, la hormonoterapia se debe combinar con un agonista de la hormona liberadora de la hormona luteinizante (LHRH). La eficacia y la seguridad clínica han sido suficientemente contrastadas en dicha indicación mediante los datos procedentes de dos estudios pivotales de fase 3, multicéntricos, multinacionales, aleatorizados, doblemente ciegos y controlados con placebo.
Abemaciclib ha demostrado una notable eficacia sinérgica con los fármacos que normalmente se emplean en el tratamiento hormonal de elección. Administrado en pacientes naïve en combinación con un inhibidor de aromatasa (IA), aumentó la supervivencia libre de progresión (SLP) en más de 13 meses respecto al uso del IA en monoterapia. Coadministrado con fulvestrant también mostró una superioridad clínica frente a fulvestrant más placebo, prolongando la SLP en más de 7 meses en pacientes cuya enfermedad había progresado tras un tratamiento de hormonoterapia previo. Por tanto, independientemente del fármaco con que se asocie y de la línea de tratamiento, abemaciclib reduce el riesgo de progresión de la enfermedad o muerte en cifras cercanas al 45%. Su eficacia se reveló consistente en todos los subgrupos de pacientes con independencia de factores como la edad, la raza, el estado de la patología o el estado hormonal (pre vs. posmenopausia), entre otros, y fue corroborada por los resultados de variables secundarias como la tasa de respuesta objetiva o la duración de la respuesta (de hasta >27 meses con la combinación).
La toxicidad del nuevo fármaco es importante, pero clínicamente manejable. La combinación de abemaciclib con IA o fulvestrant es sustancialmente más tóxica que esos fármacos en monoterapia, habiéndose descrito una mayor tasa de interrupción del tratamiento por eventos adversos (9-17% vs. 3%), si bien ésta es aceptable. El evento adverso más relevante es la diarrea, que es grave (grado ≥3) en aproximadamente el 12% de los pacientes y requiere de tratamiento y/o ajustes posológicos.
En definitiva, asociado a hormonoterapia, abemaciclib –como primera o segunda línea de tratamiento– aporta un beneficio clínico relevante, aunque modesto, en un tipo de cáncer de mama con mal pronóstico y opciones terapéuticas limitadas. El nuevo fármaco no supone ninguna novedad desde el plano mecanístico ni su régimen posológico aporta una ventaja adicional respecto a palbociclib y ribociclib, a los que viene a sumarse en el grupo de inhibidores de cinasas dependientes de ciclinas, opciones preferentes en primera y posteriores líneas de tratamiento. Sin comparaciones directas ni datos maduros de supervivencia global disponibles, parece que abemaciclib se situará como una alternativa de eficacia similar a estos dos fármacos, tratándose, no obstante, de fármacos que buscan el alivio de los síntomas y la prolongación de la supervivencia, sin representar una cura de la patología.
ASPECTOS FISIOPATOLÓGICOS
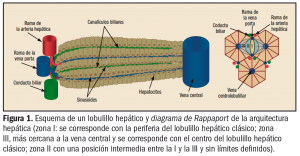
El cáncer de mama se define como el crecimiento desenfrenado de células malignas en el tejido mamario con capacidad invasora y metastatizante. En el 99% de los casos, el cáncer de mama se desarrolla en mujeres. Los 2 tipos principales de cáncer de mama son el carcinoma ductal –el más frecuente–, que comienza en los conductos que llevan leche desde la mama hasta el pezón, y el carcinoma lobulillar, que comienza en los lobulillos, que producen la leche materna (Figura 1).
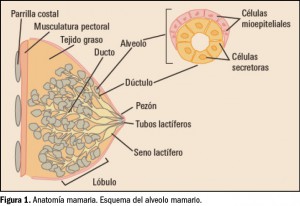
El pronóstico y el tratamiento del cáncer de mama dependen, en gran medida, del estadio (etapa del desarrollo) en que se encuentra el tumor, aunque en los últimos años se está cambiando el concepto en función de la agresividad, según el “perfil genético” que tenga el tumor. La estadificación “clásica” se basa en el tamaño del tumor y su extensión a los ganglios linfáticos regionales o a otras partes del cuerpo. Muchas veces no se sabe la extensión hasta después de la cirugía y el análisis del patólogo.
Considerando los dos sexos, el cáncer de mama es el segundo en frecuencia en el mundo después del cáncer de pulmón. El cáncer de mama es el tumor más común en la mujer, y representa el 20-30% de todos los casos de cáncer en el sexo femenino y continúa siendo la primera causa de muerte por cáncer. En 2012 se estimó que aproximadamente 1,67 millones de mujeres fueron diagnosticadas de cáncer de mama en todo el mundo y 522.000 murieron por esa causa (Ferlay et al., 2015).
En este sentido, España no es una excepción. El cáncer de mama es el cáncer más frecuente en la mujer española; supone un 29% de todos los casos de cáncer. En 2012 se diagnosticaron en nuestro país 25.215 casos de cáncer de mama, y esa cifra ha ido en aumento. La Sociedad Española de Oncología Médica estima que en 2018 casi 130.000 mujeres vivían con cáncer de mama y que a lo largo del año 2019 se diagnosticarán más de 32.500 nuevos casos. Aunque la mortalidad por este tipo de tumor ha descendido en los últimos años gracias a los programas de cribado y a la mejora de los tratamientos, el cáncer de mama sigue siendo la primera causa de muerte por cáncer en España en las mujeres. En 2012 6.075 mujeres fallecieron por esta causa, cifra que se ha incrementado hasta las casi 6.500 muertes descritas en 2017 (SEOM, 2019).
La edad de máxima incidencia está por encima de los 50 años (con un máximo entre los 45 y los 65), pero aproximadamente un 6-10% se diagnostica en mujeres menores de 35-40 años. La supervivencia media relativa del cáncer de mama tras 5 años es del 89,9% de forma global, según datos del National Cancer Institute de Estados Unidos. En Europa también se habla de cifras de supervivencia a los 5 años cercanas al 80%. El estadio en el que se ha diagnosticado el cáncer influye en gran medida en la supervivencia: en el estadio I es de más del 98% y, en cambio, en los estadios III-IV, la supervivencia desciende al 27%.
Su incidencia aumenta con el nivel económico. La incidencia en España es baja, menor que la de los Estados Unidos y Canadá, el Reino Unido, los Países Bajos, Bélgica, Alemania, Francia o Suiza, y similar al resto de los países de Europa Mediterránea, centroeuropeos, Portugal e Irlanda.
Tanto el número de casos como las tasas de incidencia aumentan lentamente en España y en el mundo, probablemente debido al envejecimiento de la población y a un diagnóstico cada vez más precoz. El aumento de la incidencia se estima en un 1-2% anual y el riesgo de padecer cáncer de mama es de, aproximadamente, 1 de cada 8 mujeres. En España existe una distribución geográfica de incidencia notablemente variable según las provincias. Así, la tasa de incidencia en Cataluña es de 83,9 casos/100.000 habitantes, mientras que la media nacional se sitúa en torno a 50,9 casos/100.000 habitantes.
En la etiopatogenia del cáncer de mama, los principales factores de riesgo son:
- Edad: el riesgo se incrementa al aumentar la edad. La mayoría de los casos ocurre en mujeres mayores de 60 años.
- Raza: es más frecuente en mujeres de raza blanca.
- Alcohol: su consumo excesivo aumenta el riesgo.
- Aparición temprana de la primera regla.
- Menopausia tardía.
- Historia familiar: el cáncer de mama familiar supone entre el 5 y el 10% del cáncer de mama en la población general, aumentando el riesgo si existe un familiar de primer grado (madre, hermana o hija) que haya padecido la enfermedad; si la enfermedad apareció en familiares más lejanos, el riesgo es menor.
Los genes involucrados en este padecimiento son: BRCA1 en el 20% de casos, BRCA2 en otro 20%, CHEK2 en 5%, TP53 en 1%; sin embargo, en más del 50% de los casos se desconoce en gen asociado. El BRCA1 es un gen localizado en el cromosoma 17q21, supresor de tumor, involucrado en la regulación del ciclo celular, la reparación del ADN dañado, el mantenimiento de la estabilidad genómica y la regulación de la transcripción. Existen indicaciones precisas para la búsqueda intencionada del gen BRCA en pacientes con historia familiar o personal de cáncer de mama y ovario.
- Antecedentes personales: una mujer que ha tenido cáncer de mama tiene más riesgo de padecer otro cáncer en la mama contralateral.
- Enfermedades previas de la mama: algunas enfermedades de la mama como la hiperplasia atípica o el carcinoma lobulillar in situ pueden aumentar el riesgo.
- Primer embarazo tardío.
- Nuliparidad (ausencia de embarazo previo).
- Terapia hormonal sustitutiva prolongada.
Si bien muchos cánceres de mama se diagnostican en mujeres asintomáticas en estadios iniciales, gracias a los programas de cribado o porque se ha realizado una mamografía de control como seguimiento de otro problema distinto en la mama, los síntomas más frecuentes por los que la mujer acude al médico son: la aparición de un nódulo en la mama (o en la axila) que previamente no existía, dolor en la mama a la palpación, cambio de tamaño o en el contorno de alguna de las mamas, menor movilidad de una mama al levantar los brazos, aparición de úlceras o de piel de naranja en la mama, cambios en el pezón (retracción o secreción) y síntomas más inespecíficos que pueden aparecer en estadios avanzados (cansancio, dolor óseo localizado, etc.).
Diversos estudios han concluido que la realización de mamografías periódicas en mujeres de 50 a 69 años conduce a una disminución del riesgo de morir por cáncer de mama. En mujeres más jóvenes se aconseja un análisis personalizado, ya que la diferente densidad mamaria dificulta el diagnóstico mediante mamografía, con un notable aumento de falsos positivos, que hacen necesarias exploraciones complementarias con ecografía y/o RM, sin que ninguna de ellas se considere un patrón óptimo.
En los estadios que pueden tratarse quirúrgicamente con éxito, los factores pronósticos marcan el riesgo que tiene una paciente de tener una recaída de la enfermedad tras completar el tratamiento ablativo. La mayoría depende de las características anatomopatológicas del tumor, pero algunas dependen del propio paciente. Los factores pronósticos “clásicos” más importantes son:
- Dependientes del tumor:
- Estadio clínico: tamaño tumoral y afectación ganglionar axilar. Ambos siguen considerándose el factor más importante, fundamentalmente la afectación axilar. La supervivencia a 5 años es prácticamente del 100% en el estadio I y de aproximadamente el 20% en el estadio IV.
- Grado de diferenciación celular: cuanto menos diferenciado sea el tumor es de peor pronóstico.
- Receptores hormonales: las pacientes con tumores dependientes de hormona (HR+) se consideran de mejor pronóstico. Además, son sensibles al tratamiento hormonal, lo que amplía el arsenal terapéutico. Representan en torno al 60-65% de los tumores de mama diagnosticados cada año.
- Expresión de Her-2: las pacientes con sobreexpresión de Her-2 tenían peor pronóstico. Representan el 20-25% de los nuevos tumores.
- Dependientes del paciente:
- Edad: tener menos de 35 años es un factor de riesgo.
- Perfil genético tumoral: los perfiles de expresión génica buscan definir patrones que permitan predecir la evolución clínica que tendrán grupos de pacientes muy bien definidos (actualmente desarrollado solo para tumores luminales: receptores hormonales positivos Her2 negativo).
Los tumores de mama positivos para el receptor de hormonas (HR+) y negativos para el factor de crecimiento epidérmico humano receptor 2 (HER2−) dependen del estrógeno para la supervivencia y el crecimiento. Los efectos sobre la proliferación involucran la estimulación de la progresión a través de la fase G1 del ciclo celular, donde el eje de señalización formado por la ciclina D1, la cinasa dependiente de ciclina (CDK) 4/6 y el retinoblastoma (pRB) es de importancia crucial.
Se acepta que los tumores metastásicos HR+/HER2- tienen mejor pronóstico que el conjunto de cánceres de mama metastásicos, siendo la mediana de supervivencia global en este subgrupo de aproximadamente 2,5-4 años. Aproximadamente un tercio de las pacientes actualmente con cáncer de mama metastásico RH+/HER-2 negativo están vivas más allá de los 5 años.
TRATAMIENTO
El tratamiento del cáncer de la mama es multidisciplinar y precisa la combinación de diversas modalidades terapéuticas para conseguir un control eficaz de la enfermedad. Estas modalidades son la cirugía, la radioterapia (RT), la quimioterapia (QT), la hormonoterapia (HT) y la terapia biomolecular (TB).
Las dos primeras –quimioterapia y radioterapia– actúan a nivel local, es decir, sobre la enfermedad en la mama y los ganglios linfáticos, y constituyen el tratamiento de elección en la enfermedad localizada no metastásica.
Las restantes (QT, HT y TB) actúan tanto a nivel local como general de todo el organismo, en lo que se denomina tratamiento sistémico, y se utilizan de forma complementaria al tratamiento local con cirugía y/o RT o como tratamiento de primera elección en la enfermedad metastásica o diseminada.
Las modalidades de aplicación de la QT en los pacientes con cáncer de mama se pueden clasificar en neoadyuvante, adyuvante y enfermedad metastásica o paliativa. Se considera quimioterapia neoadyuvante a la que se administra antes de la cirugía. Está indicada en los cánceres de mama localmente avanzados y en aquellos que midan más de 2 cm o que tengan adenopatías axilares. Los fármacos más utilizados son fundamentalmente las antraciclinas y los taxanos, en combinación con otros agentes (ciclofosfamida, 5-fluorouracilo, carboplatino…). El objetivo de la neoadyuvancia es principalmente la disminución del tamaño tumoral para practicar una cirugía conservadora con márgenes libres de enfermedad, en los tumores localmente avanzados e inflamatorios, además de la valoración de la respuesta a la QT para posteriores tratamientos.
Tiene tres grandes ventajas: a) permite una tasa más elevada de conservación de la mama (68% vs. 60% con QT adyuvante); b) reduce la tasa de recaída ipsilateral (7,6% vs. 10,7% con QT adyuvante); y c) la posibilidad de evaluar la respuesta tumoral mediante muestras del mismo y de ganglios axilares, que permite tomar decisiones terapéuticas oportunamente (por ejemplo, ante resistencia a fármacos). Por todo ello, la QT neoadyuvante se ha convertido en una estrategia cada vez más utilizada en el tratamiento multidisciplinar del cáncer de mama y constituye, además, un marcador pronóstico de respuesta y un criterio de selección en el tratamiento posterior locorregional y/o sistémico del cáncer de mama localmente avanzado. Varios ensayos clínicos han indicado que la ausencia de tumor residual en la mama y en los ganglios linfáticos después de la QT neoadyuvante se asocia a un excelente pronóstico a largo plazo.
Por su parte, la quimioterapia adyuvante es la que se administra después de la cirugía. Su indicación depende de los factores pronósticos clásicos, que son la edad, el tamaño tumoral, la afectación ganglionar axilar, el grado de diferenciación celular (grado histológico) y los receptores hormonales presentes. La QT utilizada depende del riesgo de recaída, aunque en la actualidad en un 80% se utilizan taxanos y antraciclinas, obviando los taxanos en aquellos casos de tumores menores de 2 cm: grado I, sin afectación ganglionar y posmenopáusicas, ya que su utilización no ha demostrado mejoría en la supervivencia libre de progresión (SLP).
Se ha demostrado que la QT adyuvante de 6 meses de duración con esquemas basados en antraciclinas como FEC (5-fluorouracilo, epirubicina y ciclofosfamida) y FAC (5-fluorouracilo, adriamicina y ciclofosfamida) reduce el riesgo anual de muerte por cáncer de mama en un 38% en las mujeres menores de 50 años y en casi el 20% en mujeres con edades comprendidas entre los 50 y los 69 años, con independencia del uso de tamoxifeno, del estado de los receptores hormonales, de la afectación de los ganglios axilares o de otras características del tumor.
En los casos con metástasis ganglionares, generalmente, la asociación de los taxanos (docetaxel o paclitaxel) a los esquemas de QT con antraciclinas mejora claramente la supervivencia libre de enfermedad (SLE) y la supervivencia global (SG). En las pacientes con tumores que sobreexpresan la proteína HER-2, se debe asociar al tratamiento un anticuerpo monoclonal específico frente el receptor HER-21 (trastuzumab, pertuzumab, etc.).
El cáncer de mama metastásico de inicio se observa en un 10% de los casos. En el seguimiento de las pacientes diagnosticadas previamente de enfermedad local, se observan metástasis en el 50%, siendo las localizaciones más frecuentes los pulmones, el hígado, los huesos y el cerebro. Los objetivos del tratamiento paliativo del cáncer metastásico son lograr un alivio sintomático y una atención emocional, social y espiritual para el enfermo y la familia, utilizando un tratamiento oncoespecífico (QT, HT, RT) que haya demostrado en un análisis de riesgo-costo-beneficio previo la conveniencia de su empleo. Se estima que un 20-30% de las pacientes presentan recaídas a distancia tras haber recibido un tratamiento locorregional y sistémico adecuado.
La QT antitumoral ha mostrado beneficio en el incremento de la supervivencia y de la calidad de vida en las pacientes con cáncer de mama, pero no siempre está indicada.
De hecho, en los tumores hormonosensibles (que expresan receptor de hormonas) Her-2 negativos de bajo riesgo, con afectación ósea o de partes blandas, y en pacientes asintomáticas, suele plantearse el tratamiento hormonal (HT), con tratamiento de primera línea con inhibidores de la aromatasa (exemestano, anastrozol o letrozol) o antagonistas de receptores estrogénicos (fulvestrant o, en menor medida, tamoxifeno). La duración media del tratamiento está establecida en 1 año, con tasas de respuestas entre el 30 y el 50%. Las medianas de supervivencia libre de progresión oscilan desde los 10 a los 20 meses en función de la carga de la enfermedad, la localización del tumor y su nivel de sensibilidad a hormonas (AEMPS, 2018).
Hasta hace poco el TH era la única opción de tratamiento de los casos avanzados de tipo de tumores. En la selección del TH óptimo influye el estado hormonal de la paciente, debiéndose realizar una adecuada diferenciación entre la paciente pre-menopáusica y la postmenopáusica. No obstante, aproximadamente el 40% de las pacientes son resistentes al TH desde el inicio y la práctica totalidad de las que presentan respuesta desarrollan con el tiempo resistencias adquiridas. En ese momento, frecuentemente las pacientes reciben QT, con baja o moderada actividad clínica y habitualmente asociada a una toxicidad significativa
Sin embargo, hay cierta controversia sobre la mejor estrategia para alcanzar la eficacia del tratamiento hormonal en casos refractarios tras una primera línea de tratamiento (habiéndose valorado la monoterapia con fulvestrant y la combinación de everolimus y exemestano), lo cual ha motivado la búsqueda de nuevas dianas en el ciclo celular. Esto se ha visto materializado en el reciente desarrollo de una nueva generación de fármacos inhibidores de las cinasas dependientes de ciclinas (CDK) 4 y 6, como palbociclib y ribociclib. Ambos fármacos han demostrado actuar de forma sinérgica con los tratamientos hormonales habitualmente empleados (fulvestrant y letrozol), incrementando significativamente la supervivencia de los pacientes –con una toxicidad importante pero clínicamente manejable– si se compara con el tratamiento con monoterapia hormonal. Palbociclib aumentó la supervivencia libre de progresión una media de 6,6 meses en pacientes que no respondieron a tratamiento hormonal previo y de 10,3 meses en pacientes previamente no tratados. Por su parte, ribociclib incrementó la supervivencia libre de progresión una media de 9,3 meses en general y de 11,4 meses entre aquellos pacientes con metástasis hepáticas y/o pulmonares (Cuéllar, 2017).
Por otro lado, ante tumores con receptores hormonales negativos, enfermedad visceral, intervalo de recaída corto desde la cirugía o sintomatología relacionada con la recaída o la metástasis, o en pacientes Her-2 positivas se suele pautar QT de primera línea. La tasa de respuesta varía entre el 25 y el 60% según las series, alcanzado las mejores tasas cuando se utiliza la poli-QT; aunque ésta solo se utiliza cuando se busca un rápido control de síntomas o una disminución rápida de la carga tumoral, ya que se ha demostrado que la supervivencia global (SG) no se modifica si se emplea mono- o poli-QT, aumentando en esta última modalidad los efectos secundarios.
Las pacientes con sobreexpresión HER-2 positiva son candidatas a recibir tratamiento anti-HER-2, asociado a la QT. A día de hoy hay disponibles 4 fármacos anti-HER-2: el trastuzumab, un anticuerpo monoclonal frente a este receptor; pertuzumab, anticuerpo monoclonal que inhibe la dimerización HER-2; trastuzumab emtansina, un conjugado del anticuerpo y el agente citotóxico antimicrotúbulos DM1, unidos mediante un enlace estable; y el lapatinib, que inhibe su actividad tirosina cinasa.
Actualmente la investigación va dirigida a otras dianas, con la idea de pautar un tratamiento que actúe no solo en las distintas fases de la replicación celular, sino en un aspecto crucial para los tumores como es la angiogénesis. Se han estudiado inhibidores de la tirosina cinasa del receptor del factor de crecimiento endotelial vascular (VEGF) y el anticuerpo monoclonal contra el VEGF (bevacizumab). En el cáncer de mama estadio IV, se han ensayado en estudios fase 3 sunitinib, sorafenib y bevacizumab, aunque solo este último ha demostrado que, en combinación con QT (paclitaxel, docetaxel y capecitabina), mejora las tasas de respuesta y aumenta el tiempo hasta la progresión tumoral, por lo que ha sido autorizado como primea línea de tratamiento de la enfermedad avanzada (Martínez et al., 2017).
ACCIÓN Y MECANISMO
Abemaciclib es un inhibidor competitivo potente y selectivo de las cinasas dependientes de ciclinas 4 y 6 (CDK4 y CDK6) –específicamente más activo frente a la ciclina CDK4– capaz de reducir, por ese mecanismo, la proliferación celular, al bloquear la progresión de la fase G1 a la fase S del ciclo celular. El medicamento ha sido autorizado para el tratamiento de mujeres con cáncer de mama localmente avanzado o metastásico, positivo para el receptor hormonal (HR) y negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2), en combinación con un inhibidor de la aromatasa o fulvestrant como hormonoterapia inicial o en mujeres que hayan recibido hormonoterapia previa. En mujeres pre- o perimenopáusicas, la hormonoterapia se debe combinar con un agonista de la hormona liberadora de la hormona luteinizante (LHRH).
Las ciclinas son proteínas sintetizadas durante la interfase y destruidas al final de la mitosis de cada ciclo celular. Actúan como reguladoras de la actividad enzimática de las cinasas dependientes de ciclinas (CDK) y su concentración varía a lo largo de las diferentes fases del ciclo celular. Las ciclinas C, D y E funcionan durante la fase G1 y en la transición de G1-S; por su parte, las A y B son ciclinas mitóticas que permanecen estables durante la interfase, pero son rápidamente proteolizadas durante la mitosis.
Las cinasas dependientes de ciclinas (CDK) son enzimas que regulan el desarrollo correcto del ciclo celular. Se trata de heterodímeros constituidos por una subunidad cinasa y una subunidad ciclina; su función es fosforilar, a partir de moléculas de ATP, residuos de serina y treonina de proteínas reguladoras específicas. Estos procesos se llevan a cabo cuando las CDK están activadas por las correspondientes ciclinas, las cuales dotan de especificidad a la enzima y permiten la regulación de su actividad, sobre todo mediante proteólisis dependiente de ubiquitinación y posterior traslado al proteasoma. Por el momento, se han descrito 12 CDK (CDK1 a CDK12).
La CDK4 y la CDK6 destacan entre ellas por ser potenciales dianas farmacológicas, las cuales forman complejos con las ciclinas D y funcionan durante la transición G0/G1, fosforilando a la proteína del retinoblastoma (Rb) y activando así la expresión de genes necesarios para la entrada en la fase S. Diversas mutaciones en el gen cdk4, así como en los de sus proteínas asociadas, incluyendo las ciclinas D, p16 (TINTA4un) y pRb, han sido asociadas con la carcinogénesis en una amplia variedad de órganos, incluyendo el de mama y el de esófago.
En base al mencionado mecanismo de inhibición de CDK4 y CDK6, se comprende que, en pacientes con cáncer, abemaciclib previene su unión a la ciclina D1 y la fosforilación de la proteína del retinoblastoma y de la topoisomerasa II (topoII), y bloquea la progresión del ciclo celular desde la fase G1 (que supone un punto de restricción) a la fase S de la división celular, conduciendo a la supresión del crecimiento del tumor.
Así, en estudios sobre líneas celulares de cáncer de mama positivas para el receptor estrogénico, la inhibición mantenida con abemaciclib previno el rebote de la fosforilación de Rb, que resultaba en senescencia celular y apoptosis. También se ha demostrado in vitro que las líneas celulares Rb-negativas y Rb-disminuidas son generalmente menos sensibles a abemaciclib. Todo ello se correlaciona con los hallazgos en modelos in vivo de xenoinjertos de cáncer de mama, en que la monoterapia con abemaciclib a concentraciones clínicamente relevantes indujo reducción del tamaño del tumor, asociado a cambios relevantes en marcadores moleculares de la inhibición del ciclo celular, tales como la fosforilación de las proteínas Rb y la expresión de Topoll α (Torres-Guzmán et al., 2017).
La especificidad molecular de abemaciclib hacia CDK4 y CDK6 fue estudiada en ensayos enzimáticos sin células, obteniéndose valores de concentración inhibitoria para el 50% (CI50) inferiores a 10 mM, tanto para el compuesto original como para sus tres metabolitos más relevantes desde el punto de vista farmacológico (M18 y, sobre todo, M2 y M20). Abemaciclib mostró una afinidad significativamente mayor para CDK4 que para CDK6 (CI50 de 2,0 nM vs. 9,9 nM), que fue incluso mayor en el caso de los tres metabolitos (con valores de CI50 <2 mM). Además de las proteínas diana, abemaciclib parece inhibir otras enzimas, entre las que destaca PIM1, una serina treonina cinasa que juega un papel importante en la regulación del ciclo celular por su gran actividad antiapoptótica. Se ha postulado –pero no confirmado– que la inhibición de esta enzima podría contribuir al efecto terapéutico (EMA, 2018).
Aspectos moleculares
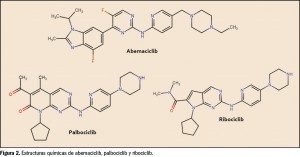
El abemaciclib es un compuesto estructuralmente muy similar a los otros dos fármacos de su grupo terapéutico: palbociclib y ribociclib (Figura 2), con los que comparte un núcleo central de un anillo de piridina unido por enlace amina a una pirimidina. Éstos contienen núcleos análogos al de purina, en una estructura que emula a la del ATP y, como tal, actúan como inhibidores selectivos y reversibles de las cinasas dependientes de ciclinas CDK4 y 6, al competir con el ATP en el proceso de fosforilación, bloqueándolo.
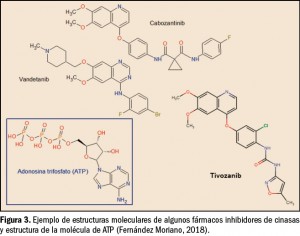
Por extensión, estas moléculas recuerdan a las de otros miembros de la serie de inhibidores de proteína cinasas (Figura 3), que han resultado de la optimización funcional mediante modelización molecular a partir de una serie de 2-fenilaminopirimidinas, de donde surgió el imatinib, cabeza de serie del grupo. Todos ellos guardan –en mayor o menor grado– una familiaridad química con la molécula de ATP (o, en su caso, con la de GTP, como sucede en las cinasas MAPK), con la que compiten para provocar el bloqueo de la cinasa correspondiente. Se han desarrollado modelos moleculares de relación estructura-actividad para este grupo de sustancias y, en todos los casos, las interacciones estéricas y electrostáticas han demostrado ser las más determinantes para el efecto inhibitorio sobre las cinasas.
El nombre químico del abemaciclib es 2-pirimidinamina, N-[5-[(4-etil-1-piperazinil)metil]-2-piridinil]-5-fluoro-4-[4-fluoro-2-metil-1-(1-metiletil)-1H-benzimidazol-6-il], que se corresponde con la fórmula molecular C27H32F2N8 y presenta un peso molecular de 506,59 g/mol. No contiene ningún centro quiral. En la forma polimórfica en que ha sido desarrollado (forma III), abemaciclib es prácticamente insoluble en agua y escasamente soluble en etanol, con una solubilidad es pH-dependiente (EMA, 2018).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de abemaciclib por vía oral han sido adecuadamente contrastadas en la indicación y dosis autorizadas mediante dos ensayos pivotales de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, internacionales, doblemente ciegos y controlados con placebo. Ambos estudios evaluaron el fármaco en mujeres con cáncer de mama localmente avanzado o metastásico, positivo para el receptor de hormonas (HR+) y negativo para HER2.
El estudio clínico MONARCH 3 fue diseñado para comparar el tratamiento de abemaciclib en combinación con un inhibidor de la aromatasa no esteroideo a la dosis recomendada (anastrozol o letrozol) frente a ese mismo inhibidor de la aromatasa –a igual régimen posológico– combinado con placebo. El tratamiento se mantuvo por ciclos completos de 28 días hasta progresión de la enfermedad o cumplimiento de los criterios de interrupción.
Las pacientes presentaban una mediana de edad de 63 años (32-88), el 58% eran de raza caucásica y el 30% asiáticas, tenían una puntación ECOG2 de 0 (60%) o 1 (40%) y, aunque no podían haber recibido tratamiento hormonal sistémico previo, el 34% de ellas había recibido quimioterapia y el 43% había sido tratadas con tratamiento neoadyuvante (finalizado al menos 12 meses antes de la aleatorización), tras lo cual su patología había recaído o progresado. Las pacientes eran todas posmenopáusicas y tenían metástasis (96%), bien solo en los huesos (23%) o también en vísceras (53%). Las características basales de las pacientes estaban bien balanceadas entre los dos grupos de tratamiento.
La variable principal de eficacia del estudio fue la supervivencia libre de progresión (SLP) evaluada por el investigador según los criterios RECIST 1.13. Entre las variables secundarias se evaluaron la supervivencia global (SG) a los 1, 2 y 3 años, la tasa de respuesta objetiva (TRO), la duración de la respuesta (DR) y la tasa de beneficio clínico (TBC). En el análisis de los datos por intención de tratar, quizá el que mejor representa la práctica clínica real, se obtuvieron los resultados que se muestran en la siguiente tabla (Tabla 1).
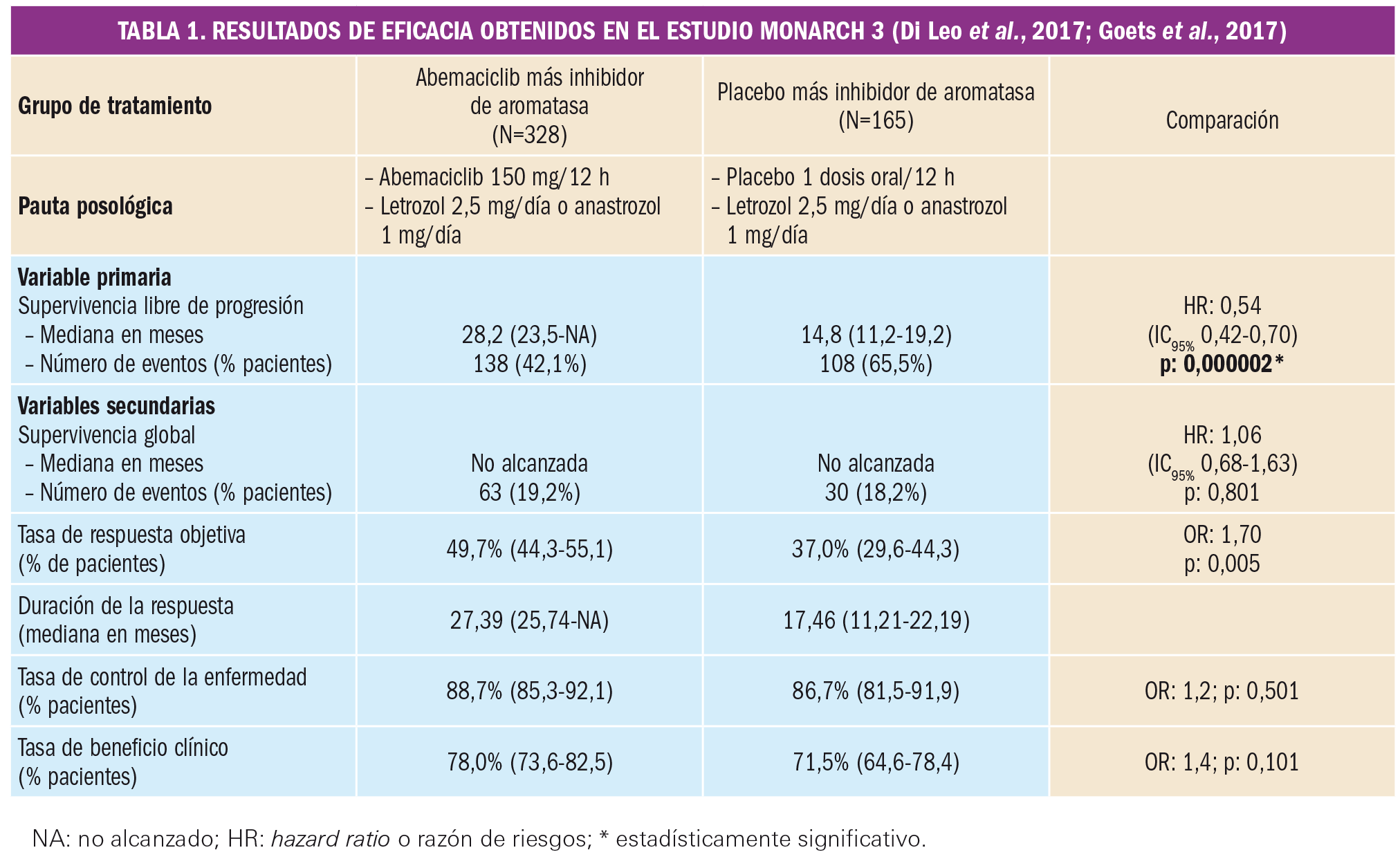
NA: no alcanzado; HR: hazard ratio o razón de riesgos; * estadísticamente significativo.
Cabe destacar que los resultados de eficacia en términos de SLP fueron consistentes entre los distintos subgrupos analizados, confirmándose que la eficacia de abemaciclib es independiente de la edad de las pacientes, la localización o estadio de la enfermedad, entre otros factores. Se verificó una reducción significativa en el riesgo de progresión de la enfermedad o de muerte en pacientes con enfermedad visceral (HR: 0,57; IC95% 0,41-0,79), en pacientes con solo enfermedad ósea (HR: 0,57; IC95% 0,31-1,04) y en pacientes con enfermedad medible (HR: 0,52; IC95% 0,39 – 0,68). Además, en la revisión de los datos por un comité independiente, se obtuvieron incluso resultados más favorables para el brazo de abemaciclib más inhibidor de aromatasa. Se describió un porcentaje de eventos del 27,7% (91 eventos) frente a un 44,2% (73 eventos) en el brazo placebo más inhibidor de aromatasa, que se traducía en una SLP con una mediana no alcanzada para el grupo de abemaciclib y de 19,36 meses para el grupo placebo (HR: 0,47; IC95%: 0,34-0,36; p<0,000001).
Por otra parte, el estudio MONARCH 2 evaluó el tratamiento de abemaciclib en combinación con fulvestrant frente placebo con fulvestrant en la misma pauta posológica, manteniéndose los tratamientos por ciclos completos de 28 días hasta progresión de la enfermedad o cumplimiento de los criterios de interrupción. Entre los criterios de exclusión destacan los tratamientos hormonales sistémicos (no neoadyuvantes) previos y la presencia de metástasis cerebrales o cáncer de mama inflamatorio.
Las pacientes que fueron aleatorizadas (2:1) al inicio del estudio presentaban unas características equilibradas entre ambos grupos de tratamiento: media de edad de 60 años (32-91), mayoría de pacientes de raza blanca (56%) y asiática (32%) y sin tratamiento con quimioterapia para la enfermedad metastásica (53%). En cuanto a la situación hormonal, la mayoría eran pacientes posmenopáusicas (82%), si bien destaca un porcentaje importante (17%) de pacientes pre/perimenopáusicas. Presentaban enfermedad metastásica (97%) de localización predominantemente visceral (56%) y ósea (27%), que había recidivado durante tratamiento endocrino neoadyuvante (45%) o tras una primera línea avanzada con un antagonista estrogénico o inhibidor de aromatasa (45%).
La variable principal de eficacia coincidía respecto a la comentada previamente para MONARCH 3, y las variables secundarias fueron también muy similares. En la Tabla 2 se muestran los resultados para el total de pacientes (N=669) que conformaron la población por intención de tratar.
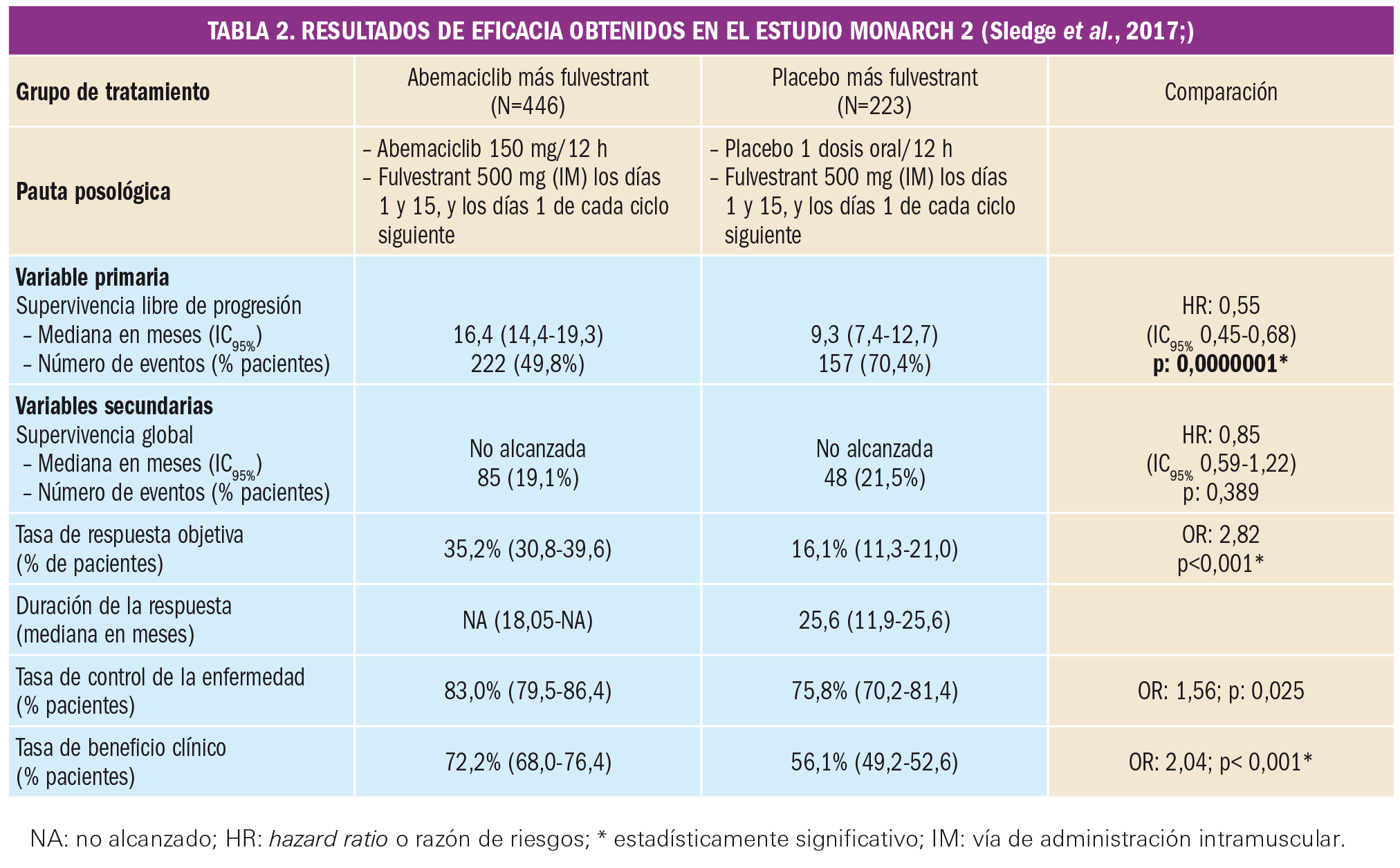
NA: no alcanzado; HR: hazard ratio o razón de riesgos; * estadísticamente significativo; IM: vía de administración intramuscular.
De nuevo, el análisis por subgrupos mostró robustez estadística de los resultados a favor de la eficacia de abemaciclib en todos los pacientes con independencia de la edad, la raza, la región geográfica, localización de la enfermedad, estado menopáusico o susceptibilidad/resistencia previa a hormonoterapia, entre otros factores analizados. La revisión de los resultados de SLP por un comité independiente apoyó la evaluación del investigador: se notificaron eventos de la enfermedad en un 36,8% (164 eventos) en el brazo de abemaciclib más fulvestrant frente a un 55,6% (124 eventos) en el brazo placebo más fulvestrant, lo cual se traducía en una mediana de SLP de 22,4 meses (límite superior del intervalo no alcanzado) para el grupo de abemaciclib y de 10,2 meses para el grupo placebo (HR: 0,46; IC95%: 0,36-0,58; p<0,000001).
De manera interesante, MONARCH 2 incluyó un pequeño grupo de pacientes (N=44) naïve para tratamiento hormonal, cuyos datos se analizaron separadamente. Entre los aleatorizados a recibir abemaciclib+fulvestrant, no se alcanzó la mediana de SLP, mientras que para quienes recibieron placebo+fulvestrant, la mediana fue de 23,2 meses (HR: 0,45; IC95% 0,18-1,15; p: 0,089).
Por otro lado, el perfil toxicológico de abemaciclib en combinación con hormonoterapia parece importante y requiere de un control riguroso para su manejo. En función de los acontecimientos adversos reportados en los pacientes que han recibido abemaciclib en los estudios de fase 3 (N>770), se observó al menos 1 evento adverso relacionado con el tratamiento en la práctica totalidad de pacientes (>98%). Con una media de exposición a abemaciclib de 13-16 ciclos, los eventos adversos más comunes fueron: diarrea (82-86%), neutropenia (44-46%), náuseas (41-45%), fatiga (40-41%), anemia (29-32%), dolor abdominal (31-35%), vómitos (26-30%), dolor de cabeza (20%) y alopecia (16-28%). También destacan los aumentos de los niveles de transaminasas hepáticas (15%).
En cuanto a su gravedad, se notificó una sustancial tasa de eventos adversos de grado ≥3: 22-28% en pacientes tratados con abemaciclib más hormonoterapia vs. 11-17% en pacientes de los brazos control (solo tratados con hormonoterapia). Las interrupciones del tratamiento por eventos adversos fueron más frecuentes en los brazos de tratamiento con abemaciclib que en el control (9-17% vs. 3%). Entre los eventos adversos que motivaron la interrupción del tratamiento sobresalen las infecciones pulmonares (2-4%) y los fenómenos tromboembólicos (1,2-2,4%).
El EPAR de la EMA destaca, por encima de la neutropenia, la diarrea como el evento adverso cualitativa y cuantitativamente más relevante de los asociados con abemaciclib. La incidencia fue del 85% (grado ≥3 en el 12% de pacientes), apareciendo con mayor frecuencia durante el primer mes de tratamiento y con una duración media de 6-12 días; motivó omisión o reducción de la dosis de abemaciclib en un 15-20% de los pacientes e implicó la necesidad de tratamiento con antidiarreicos para su manejo (fundamentalmente, loperamida).
ASPECTOS INNOVADORES
Abemaciclib es un nuevo inhibidor competitivo, potente y selectivo de las cinasas dependientes de ciclinas 4 y 6 (CDK4 y CDK6) capaz de reducir la proliferación celular mediante el bloqueo de la progresión de la célula de la fase G1 a la fase S del ciclo celular. El medicamento ha sido autorizado para el tratamiento de mujeres con cáncer de mama localmente avanzado o metastásico, positivo para el receptor hormonal (HR) y negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2), en combinación con un inhibidor de la aromatasa o fulvestrant como hormonoterapia inicial o en mujeres que hayan recibido hormonoterapia previa. En mujeres pre- o perimenopáusicas, la hormonoterapia se debe combinar con un agonista de la hormona liberadora de la hormona luteinizante (LHRH).
La evidencia clínica contrastada procede de dos estudios pivotales de fase 3, multicéntricos, multinacionales, aleatorizados, doblemente ciegos y controlados con placebo (más la hormonotearapia estándar), realizados en mujeres con cáncer de mama con receptores hormonales positivo (ER-positivo) y HER2-negativo.
A grandes rasgos, el primer estudio (MONARCH 3) demostró que la adición de abemaciclib a un inhibidor de la aromatasa –anastrozol o letrozol– en primera línea de tratamiento (pacientes posmenopáusicas con enfermedad metastásica que no habían recibido previamente tratamiento hormonal sistémico) aumentaba en más de 13 meses la SLP frente al tratamiento con el inhibidor de aromatasa más placebo (mediana de 28,2 vs. 14,8 meses), lo cual implica una notable reducción del riesgo de progresión de la enfermedad o muerte del 46%.
Aunque los datos de supervivencia global –que sería la variable más sólida– no eran maduros al final del análisis (93 eventos entre ambos brazos), otras variables secundarias confirmaron el beneficio clínico de la combinación con abemaciclib frente a la monoterapia con el inhibidor de aromatasa: prolonga significativamente la duración de la respuesta (27,39 vs. 17,46 meses) y la tasa de respuesta objetiva (49,7% vs. 37,0%).
El segundo estudio (MONARCH 2) puso de manifiesto que la combinación de abemaciclib con fulvestrant es clínicamente superior a la combinación de placebo con fulvestrant en pacientes cuyo tumor había progresado a pesar de una primera línea de tratamiento hormonal, pues aumentó significativamente la SLP en una mediana de 7 meses (16,4 meses vs. 9,3 meses), reduciendo el riesgo de progresión en un 45%. La prolongación de la SLP no supuso ningún perjuicio de la calidad de vida relacionada con la salud y, además, la tasa de respuesta objetiva y la de beneficio clínico mejoraron significativamente a favor de abemaciclib en comparación con placebo (35,2% vs. 16,1% y 72,2% vs. 56,1%, respectivamente). Se demostró que dicha eficacia es independiente del estado hormonal de las pacientes (el estudio incluyó un 17% de pacientes pre o perimenopáusicas).
En general, el diseño de los estudios pivotales es adecuado y las poblaciones de pacientes son suficientemente representativas de la población diana recogida en la indicación. La selección de la supervivencia libre de progresión como variable principal de eficacia se considera aceptable y la selección de los fármacos empleados en combinación con abemaciclib es apropiada, de acuerdo a las guías de práctica clínica vigentes. Hay que considerar que en el momento de desarrollarse estos estudios, no estaban disponibles ni palbociclib ni ribociclib, que actualmente se recomiendan en primera línea.
Con respecto a la seguridad, la frecuencia y tipo de eventos adversos descritos en ambos estudios fue muy similar, lo cual revela que la combinación de abemaciclib con inhibidores de aromatasa o fulvestrant es sustancialmente más tóxica que esos fármacos en monoterapia: tasa de eventos adversos de grado ≥3 de 22-28% en el brazo de abemaciclib vs. 11-17% en brazo placebo, y tasa de interrupción del tratamiento por eventos adversos de 9-17% vs. 3%. A diferencia de lo descrito para palbociclib y ribociclib, cuya tolerabilidad se ve limitada principalmente por la neutropenia, la reacción adversa más relevante relacionada con abemaciclib es la diarrea, que es grave (grado ≥3) en aproximadamente el 12% de los pacientes y requiere de tratamiento y/o ajustes posológicos.
A falta de comparaciones directas con ribociclib y palbociclib, las comparaciones indirectas podrían sugerir que el beneficio que aportan los tres fármacos es clínicamente relevante y similar. Así, en sus ensayos clínicos, también asociados a tratamiento hormonal, palbociclib incrementó la SLP en una media de 6,6 meses en pacientes que no respondieron a tratamiento hormonal y en 10,3 meses en pacientes previamente no tratadas; por su parte, ribociclib aumentó la SLP en una media de 9,3 meses en general y de 11,4 entre aquellos con metástasis hepáticas y/o pulmonares (Cuéllar, 2017).
Palbociclib y ribociclib se administran por vía oral durante periodos de 21 días más 7 días de descanso. A priori, abemaciclib podría aportar una ventaja en términos de adherencia por su régimen posológico continuo; sin embargo, puesto que requiere la administración de dos comprimidos diarios (frente a una única toma de los otros dos fármacos), tal ventaja no parece relevante. El perfil de interacciones farmacológicas de abemaciclib también resulta muy similar al de palbo- y ribociclib, debiendo evitarse el uso concomitante con inhibidores potentes de CYP3A4.
En definitiva, abemaciclib asociado a hormonoterapia –como primera o segunda línea de tratamiento– aporta un beneficio clínico sustancial en todos los subgrupos de pacientes con cáncer de mama localmente avanzado o metastásico HR+ y HER2-, con una toxicidad aceptable. Parece que las pacientes que más se pueden beneficiar del tratamiento son aquellas que no han recibido tratamiento hormonal previo.
El nuevo fármaco no aporta ninguna novedad desde el plano mecanístico ni supone una innovación reseñable desde el punto de vista de eficacia o seguridad clínica respecto a los demás fármacos del grupo de los inhibidores de cinasas dependientes de ciclinas. A falta de conocer las consideraciones del IPT de la AEMPS, abemaciclib viene a situarse como una nueva alternativa dentro de este grupo de fármacos, que sí suponen una ventaja –aunque no demasiado espectacular– respecto a la monoterapia con tratamiento hormonal y se sitúan como opciones preferentes tanto en primera como en segunda línea de tratamiento. Se trata, no obstante, de tratamientos que buscan el alivio de los síntomas y la prolongación de la supervivencia, sin representar una cura de la enfermedad.

BIBLIOGRAFÍA