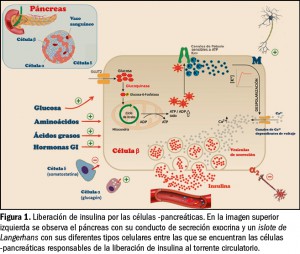
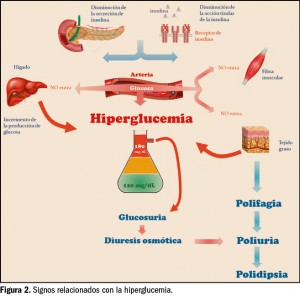
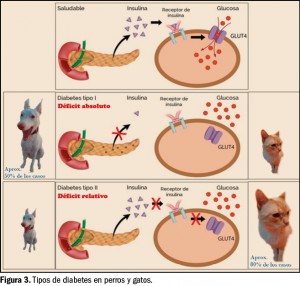
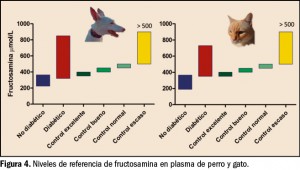
La característica principal que define a los trastornos por consumo de sustancias es la asociación de síntomas cognitivos, comportamentales y fisiológicos que conducen a un uso indefinido del compuesto a pesar de los problemas significativos que derivan de esta práctica. Sin embargo, el consumo de drogas no es indispensable para el desarrollo de adicciones (trastornos adictivos sin sustancias), como ocurre en el caso del trastorno por juego. Este hecho pone de manifiesto que estas conductas comparten mecanismos y circuitos cerebrales comunes.
En el año 2013 la nueva Clasificación de los Trastornos Mentales de la Asociación Americana de Psiquiatría –DSM-5– sustituye el término “drogodependencias” por el de “trastornos relacionados con sustancias y adicciones”.
El manual diagnóstico de EE.UU. divide a los trastornos relacionados con sustancias en dos grupos: trastorno por uso de sustancias y trastorno inducido por sustancias.
Los síntomas que constituyen el síndrome del trastorno por uso de sustancias se agrupan en varias dimensiones:
- Un control deficitario del consumo.
- Un deterioro social asociado al consumo.
- El mantenimiento del consumo a pesar de existir un riesgo evidente para la salud.
- Presencia de los denominados síntomas farmacológicos: tolerancia y abstinencia.
Resulta interesante remarcar que la gran mayoría de personas que consumen sustancias potencialmente adictivas no desarrollan adicción (sujetos resilientes), y que únicamente el 10% de los sujetos vulnerables desarrollan el fenotipo más grave de adicción. La vulnerabilidad viene condicionada por factores genéticos, neurobiológicos y medioambientales.
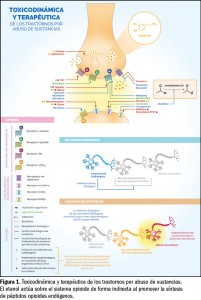
Etiopatogenia. El desarrollo de un trastorno por uso de sustancias involucra varios cambios neuroquímicos cerebrales en diferentes regiones (Figura 1): el sistema límbico dopaminérgico (área tegmental ventral, núcleo accumbens y corteza prefrontal), la amígdala, el estriado e hipocampo y otros circuitos de neurotransmisión, tales como el GABAérgico, glutamatérgico, opioide (neuropéptidos), colinérgico/nicotínico y endocannabinoide
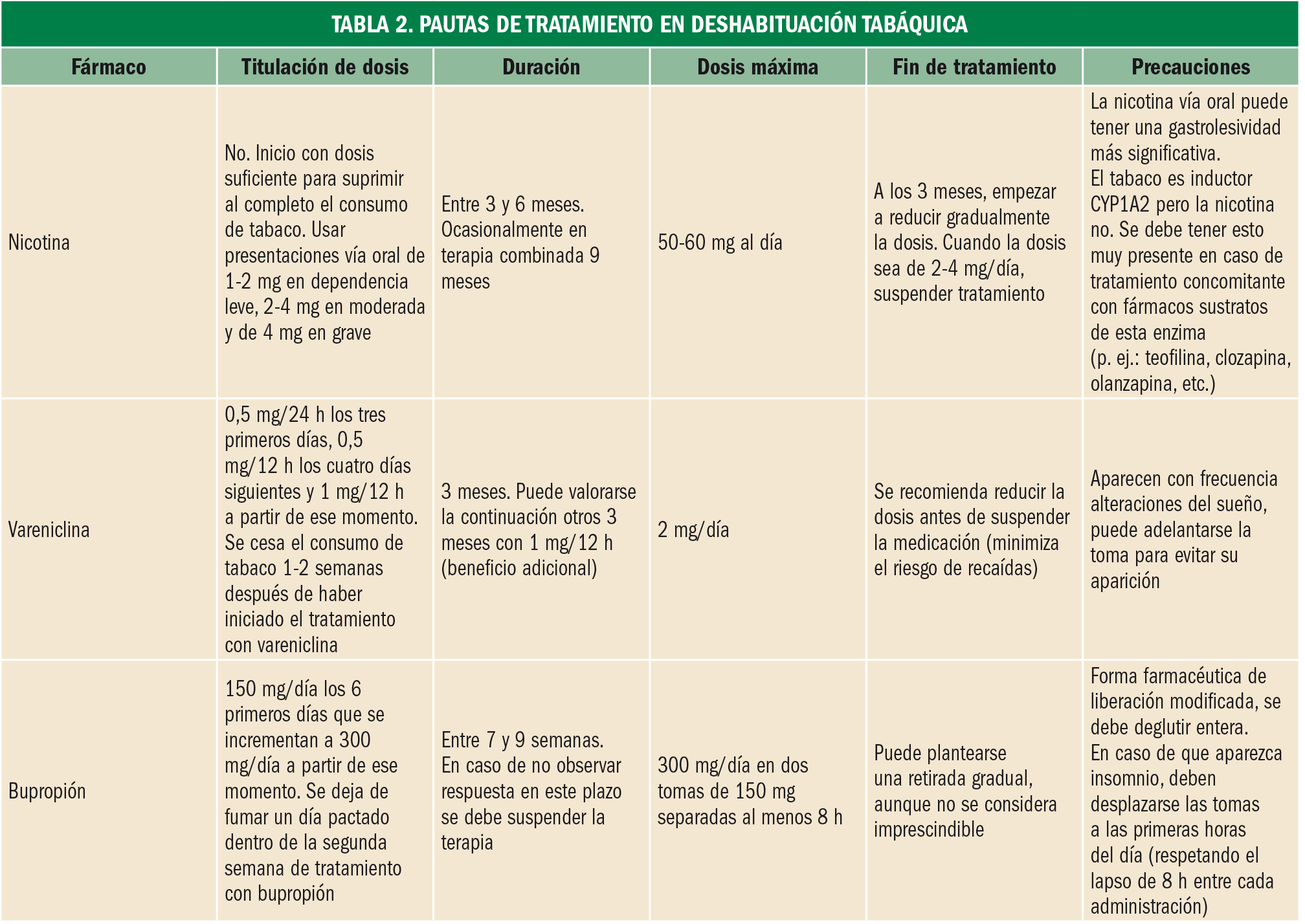
Trastorno por uso de tabaco
Entre los principales trastornos mentales relacionados con el trastorno por uso de tabaco se encuentran: esquizofrenia, trastorno bipolar, depresión mayor, trastorno por déficit de atención con hiperactividad (TDAH), trastorno por ansiedad y los trastornos de personalidad (especialmente de los grupos A –paranoide, esquizoide, esquizotípica– y B –antisocial, límite histriónica y narcisista–). Existen evidencias importantes que relacionan la presencia de polimorfismos genéticos con el riesgo de desarrollo de adicción al tabaco. Tal es el caso de las poblaciones CYP2A6 ultrarrápidas, isoforma del CYP450 de la cual la nicotina es sustrato.
Tratamiento:
A día de hoy se dispone de las siguientes alternativas terapéuticas (Tabla 1):
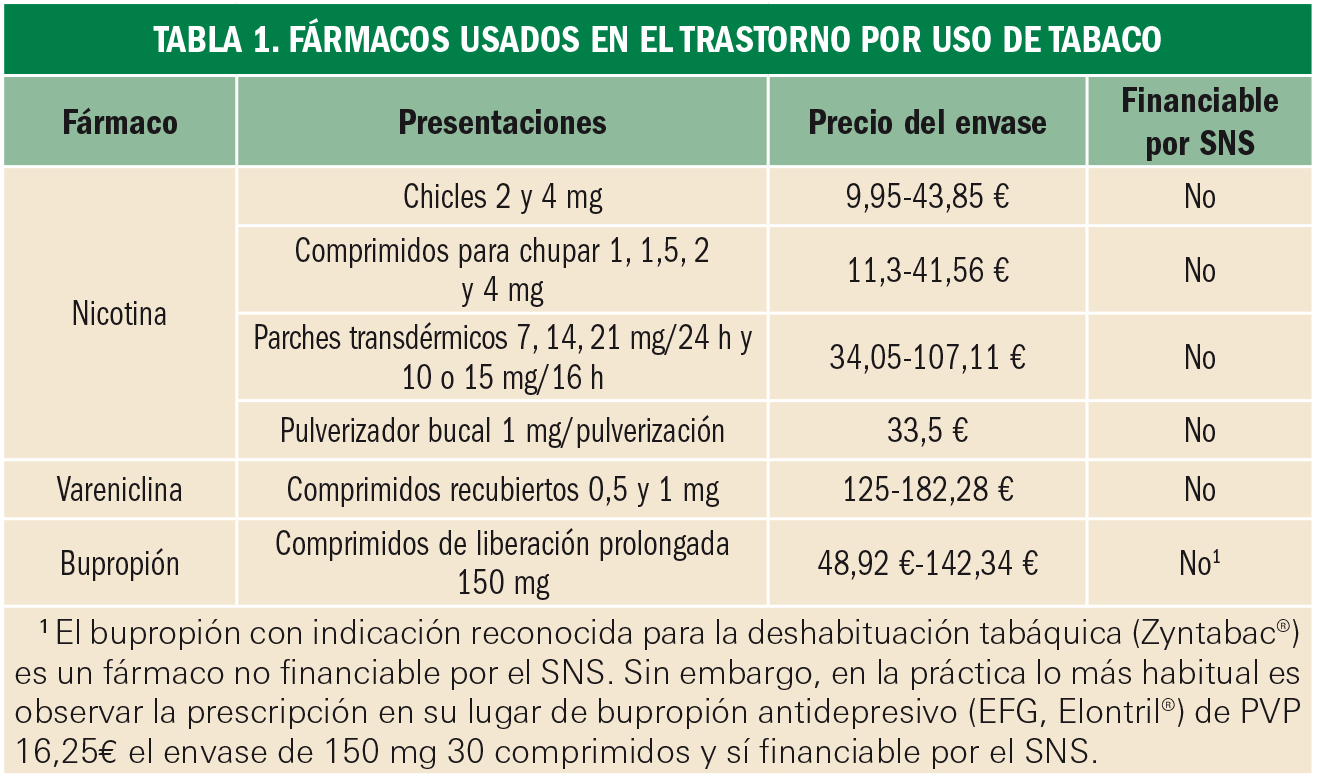
- Bupropión: inhibidor de la recaptación de noradrenalina y dopamina.
- Vareniclina: agonista parcial de los receptores α4β2 del sistema colinérgico/nicotínico, sustrato principal de la recompensa a la nicotina.
- Nicotina: agonista completo del sistema colinérgico/nicotínico.
La vareniclina parece ser la opción terapéutica más efectiva (18-30% de éxito). El incremento de dosis por encima de la recomendación estándar probablemente mejoraría la tasa de éxito en pacientes que no hubiesen obtenido resultados previamente. De igual modo la asociación de vareniclina con bupropión o nicotina mejoraría la respuesta al tratamiento.
El bupropión en monoterapia es la opción menos efectiva, sin embargo es la única alternativa que puede ser financiada por el Sistema Nacional de Salud (SNS) (Tabla 1).
Actualmente no hay evidencia que avale el empleo de cigarrillos electrónicos en terapia sustitutiva. Las pautas de tratamiento (Tabla 2) son notablemente diferentes entre unos fármacos y otros; además, la nicotina es el único principio no sujeto a prescripción médica.
Trastorno por uso de alcohol
Se han identificado diferentes fenotipos de trastorno por uso de alcohol: consumidor regular (ingesta mantenida a lo largo del tiempo) y bebedor en atracones (ingiere grandes cantidades en poco tiempo).
Tratamiento. Se dispone de las siguientes alternativas terapéuticas (Tablas 3 y 4):
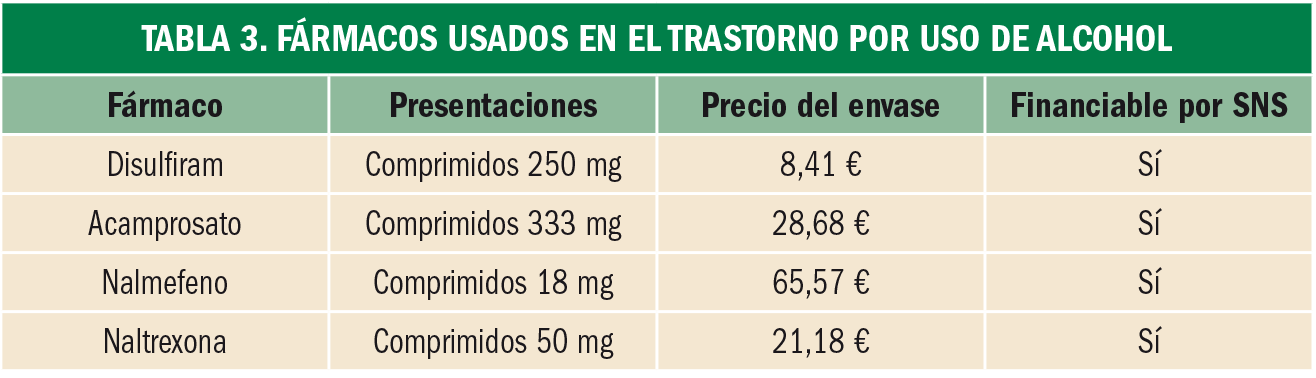
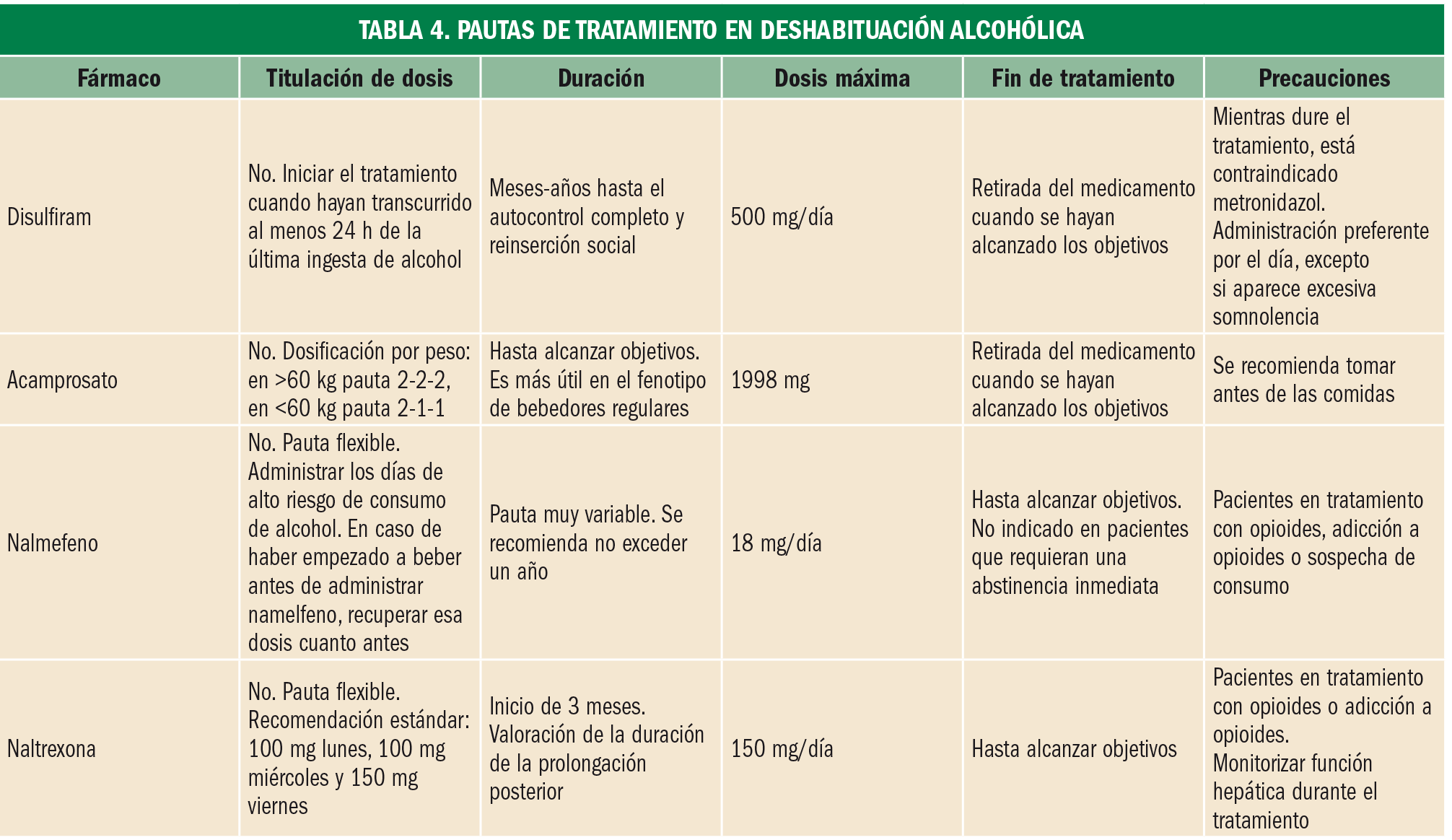
- Disulfiram: inhibe de forma irreversible la enzima acetaldehído deshidrogenasa, por lo que en caso de romper la abstinencia se acumula acetaldehído, compuesto responsable de la aparición de la sintomatología que favorece el rechazo a su consumo.
- Acamprosato: modula la neurotransmisión del receptor del N-metil-d-aspartato (NMDA) y podría tener efectos indirectos sobre el receptor del GABA. No es eficaz en bebedores en atracones.
- Naltrexona: bloquea los receptores opioides µ, lo cual reduce la ingesta compulsiva de alcohol.
- Nalmefeno: agonista parcial de receptores opioides κ y antagonismo de receptores opioides δ y µ.
- Benzodiazepinas (clorazepato dipotásico): utilizadas para tratar los síntomas de abstinencia en pacientes con dependencia fisiológica. Deben usarse el menor tiempo posible, ya que en adictos al alcohol existe un riesgo especialmente elevado de desarrollo de adicción a benzodiazepinas.
- El baclofeno: agonista GABAB que tiene la ventaja diferencial de ser seguro en insuficiencia hepática grave. Indicación únicamente aprobada en Francia.
- Otros fármacos incluidos en ensayos controlados, pero no autorizados actualmente en el tratamiento de la dependencia al alcohol son: topiramato, ondansetrón y gabapentina.
Trastorno por uso de cannabis
Se relaciona frecuentemente con otros trastornos mentales como la esquizofrenia, el TDAH y el trastorno de espectro autista.
Tratamiento. No existe tratamiento aprobado por las agencias reguladoras. Los dos fármacos que parecen haber mostrado algún indicio de utilidad son gabapentina y N-acetilcisteína, aunque con evidencias muy débiles.
Trastorno por uso de cocaína
El TDAH y los trastornos de personalidad antisocial y narcisista son trastornos mentales considerados factores de riesgo para el trastorno por uso de cocaína.
Tratamiento. No existen fármacos aprobados. Los ensayos con agonistas dopaminérgicos no han sido concluyentes. Los psicoestimulantes se muestran como agentes muy prometedores a la espera de mayor investigación sistemática.
Trastorno por uso de heroína y otros opioides
Se relaciona con la presencia de otros trastornos mentales como depresión mayor, trastorno límite de personalidad y trastorno antisocial de la personalidad.
Tratamiento. Se utilizan dos grandes grupos de fármacos (Tablas 5 y 6): agonistas µ (metadona, levometadona, morfina) o agonistas parciales µ (buprenorfina) indicados en la terapia sustitutiva, y antagonistas µ, que buscan mantener la abstinencia total (naltrexona) o evitar un uso inadecuado vía parenteral de los fármacos usados en terapia sustitutiva (asociaciones con naloxona).
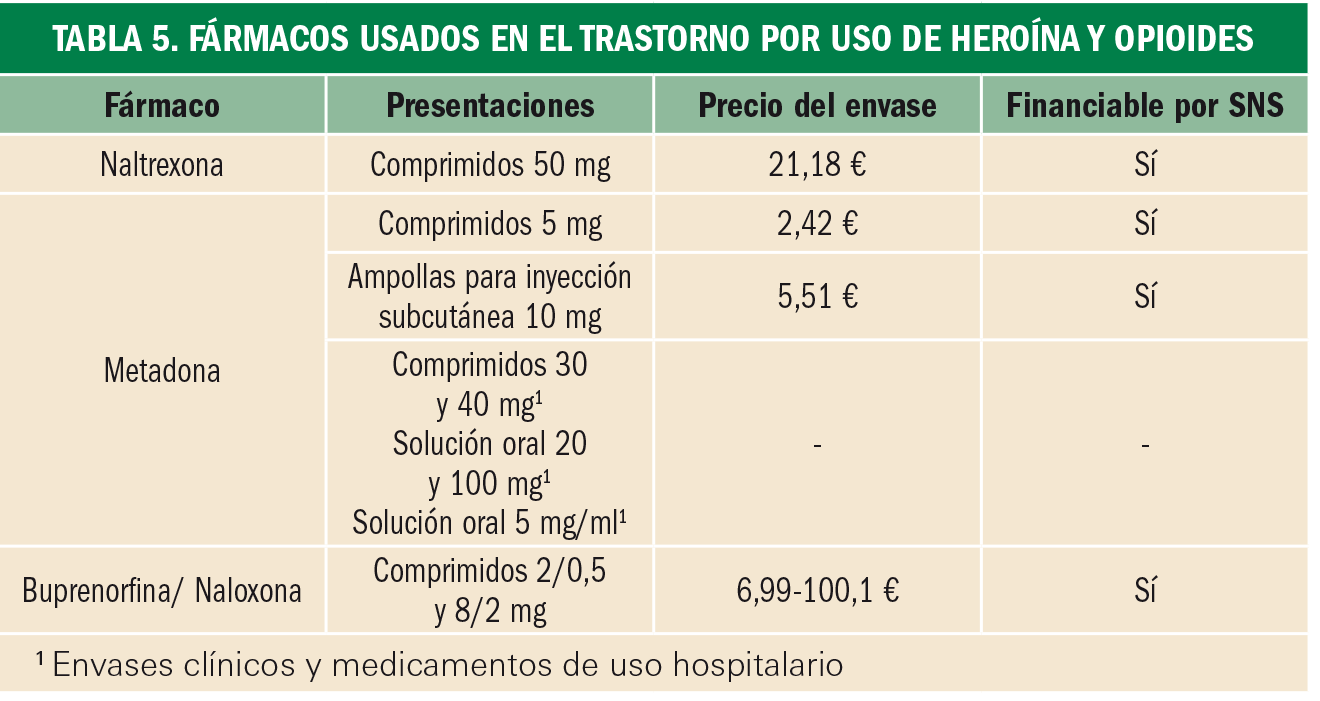
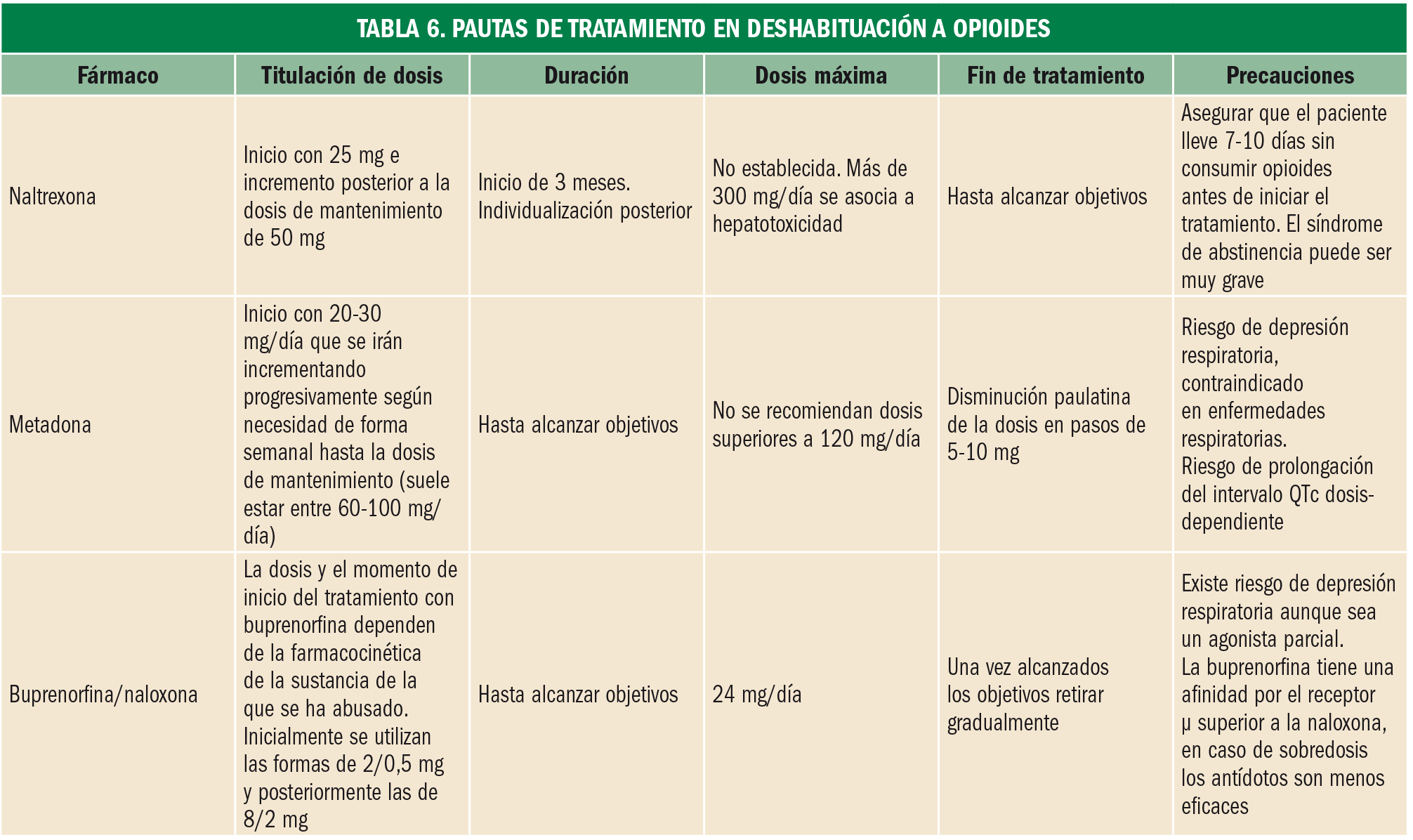
Tiene una gran trascendencia el carácter de estos fármacos sobre otros tipos de receptores opioides, como el caso de los receptores κ. El agonismo κ produce efectos disfóricos que incrementan el riesgo de recaídas, por lo que un efecto antagonista confiere al fármaco propiedades antidisfóricas y antidepresivas de gran utilidad en la deshabituación (p. ej.: buprenorfina).
La heroína inyectable supervisada puede ser efectiva en pacientes que persisten en el consumo de heroína durante el tratamiento con metadona.
Futuro de los tratamientos de los trastornos adictivos y otros trastornos mentales
Las opciones terapéuticas son todavía limitadas. Existe una gran dificultad para llevar a cabo ensayos clínicos en pacientes con trastornos por consumo de sustancias debido a la mala delimitación con otros trastornos mentales frecuentes, problemas legales y mala adherencia a los protocolos de tratamiento entre otros motivos.
- Se requieren nuevas estrategias dirigidas a endofenotipos asociados a las conductas adictivas:
- Potenciadores cognitivos para mejorar el control de impulsos.
- Planificación y toma de decisiones.
- Uso de medicamentos para reducir la reactividad al estrés, la emocionalidad negativa y la disforia para prevenir las recaídas.
- Explorar la “reutilización” de medicamentos ya aprobados para otras indicaciones:
- Combinación de buprenorfina con naltrexona en el trastorno por abuso de heroína y cocaína.
- Lorcaserina, agonista selectivo 5-HT2C aprobado por la FDA en el tratamiento de la obesidad, en el trastorno por abuso de opioides.
- Modafinilo en trastorno por abuso de cocaína.
- Considerar posibles nuevas dianas farmacológicas:
- Oxitocina. Estudios preclínicos y clínicos demuestran su papel en la reducción de la búsqueda de ciertas sustancias, como la nicotina, estimulantes, etc.
- Cannabinoides. Podrían conducir a nuevos tratamientos para los trastornos por consumo de sustancias como el cannabis.
- Pregnenolona. Precursor esteroideo que parece proteger contra los efectos de la intoxicación del THC y está siendo evaluada para el tratamiento del trastorno por consumo de cannabis.
- N-acetilcisteína. Modulador glutamatérgico que presenta cierta utilidad en trastornos por uso de sustancias.
- Estimulación cerebral. La identificación de los circuitos neuronales afectados en la adicción y otros trastornos mentales puede sugerir objetivos terapéuticos para estrategias de estimulación cerebral, como la estimulación magnética transcraneal o la estimulación cerebral profunda.