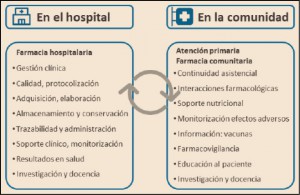
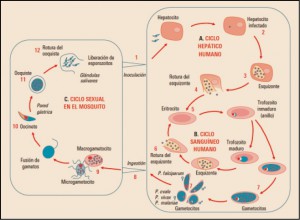
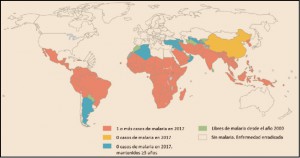
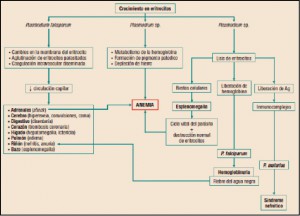
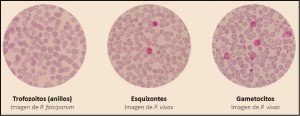
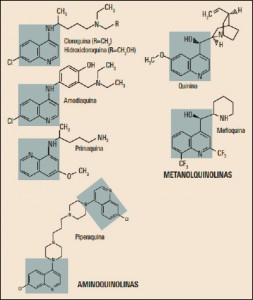
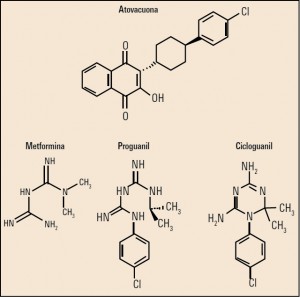
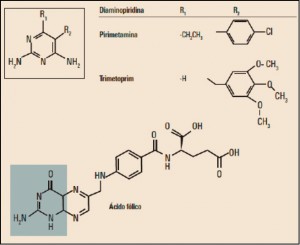
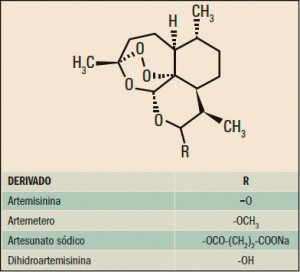
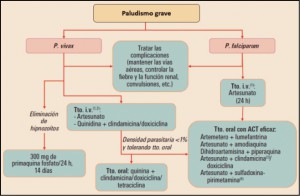
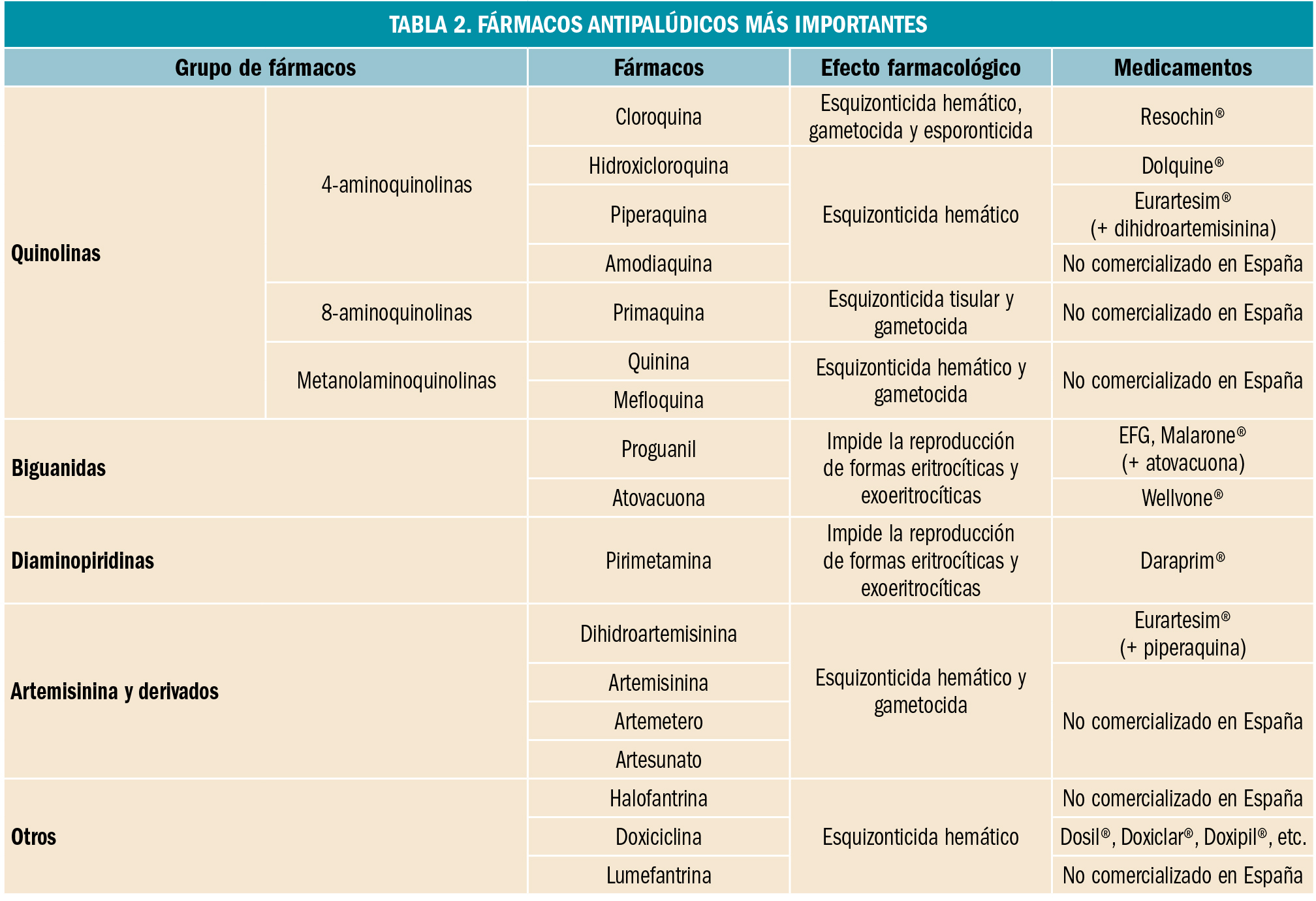
La Agencia Española de Medicamentos y Productos Sanitarios ha incluido en su página web un acceso para consultar los datos acumulados en la base de datos FEDRA, con notificaciones de sospechas de reacciones adversas a medicamentos (RAM).
Con el significado e interpretación que supone esta información, se da así cumplimiento a lo establecido en la normativa en vigor: dar transparencia en la información recibida sobre reacciones adversas a los medicamentos.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado1 del acceso que ha dispuesto con la información recopilada en el Sistema Español de Farmacovigilancia de medicamentos de uso Humano (SEFV-H) relativa a notificaciones de sospechas de reacciones adveras a medicamentos (RAM). La AEMPS publica así, en su página web (en la página principal, en la columna de entradas a la izquierda), información sobre los casos de sospechas de RAM de uso humano registrados en la base de datos española FEDRA, desde 1983. La actualización de los datos se realizará trimestralmente.
Para enviar una notificación de sospecha de RAM únicamente hace falta que la persona que notifica considere que no puede descartarse que el medicamento pueda haber jugado algún papel en la aparición de la reacción adversa. Por lo tanto, se trata de sospechas y no demuestra que el medicamento haya causado realmente la reacción adversa. Los signos, síntomas o enfermedades que se notifican pueden tener otras causas como las enfermedades que padezca el paciente, otros medicamentos que se hayan administrado simultáneamente, otras causas diferentes o simplemente pueden haber aparecido por azar durante el tiempo de utilización del medicamento. Para poder extraer conclusiones en base a estos datos, esta información debe ser analizada por técnicos con experiencia, junto con datos disponibles de otras fuentes de información.
Esta información de FEDRA se pone a disposición de los profesionales sanitarios y demás ciudadanos dando cumplimiento a lo que indica la legislación y como ejercicio de transparencia, ya que gracias a su colaboración se dispone de estos datos.
Cuando un ciudadano o un profesional sanitario notifica una sospecha de RAM a través del sistema de notificación espontánea, estos datos se registran en una base de datos denominada FEDRA. A través de un análisis adecuado de los mismos se contribuye a un mejor conocimiento de la seguridad de los medicamentos tras su comercialización. Es preciso leer detenidamente la información que se aporta en la página web para su correcta interpretación.
El informe muestra el número total de casos notificados por grupos de edad y por sexo del paciente, así como la distribución de los casos por RAM tanto por términos médicos agrupados como por términos médicos más concretos. Además de los datos globales, también se puede consultar por el principio activo que contienen los medicamentos disponibles en España.
Para una interpretación adecuada de toda esta información que se ofrece, debe tenerse en cuenta que:
- La información que se muestra no debe utilizarse para tomar decisiones sobre si se debe cambiar o suspender un tratamiento, ya que solo se trata de casos en los que se sospecha que el medicamento puede estar relacionado.
- Una RAM es una respuesta nociva y no intencionada a un medicamento y todos los medicamentos pueden producirlas, con mayor o menor frecuencia.
- Las sospechas de reacciones adversas que se muestran pueden ser RAM ya conocidas para el medicamento y estar descritas en su ficha técnica y en el prospecto (www.aemps.gob.es/cima), los cuales se recomienda revisar para ver las RAM ya conocidas con el medicamento.
- Finalmente, se recuerda la importancia de notificar todas las sospechas de RAM a través del formulario electrónico disponible en www.notificaRAM.es, tal como se recomienda en los prospectos y en las fichas técnicas, o de cualquier otro medio puesto a disposición por los centros autonómicos de farmacovigilancia del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H).
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Publicación de información de casos de sospechas de reacciones adversas a medicamentos. Nota informativa MUH (FV), nº 05/2019. 9 de abril de 2019. Disponible en la página web de la AEMPS: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2019/docs/NI_MUH_FV-5-2019-Reacciones-adversas.pdf (consultado 8 de mayo de 2019).