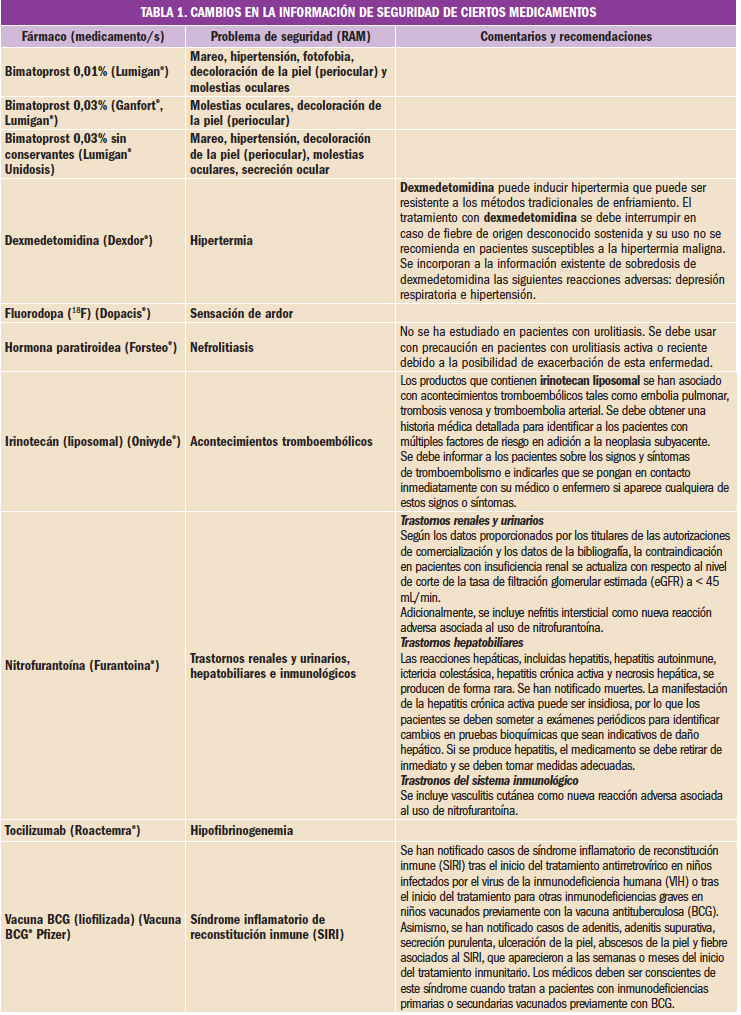
Los datos publicados de un reciente ensayo clínico de fase 3 demuestran que la inmunoterapia en niños y adolescentes alérgicos al cacahuete con AR101 (un nuevo fármaco biológico derivado del cacahuete que libera de forma mantenida 300 mg/día de proteínas específicas) incrementa la tolerancia a la dosis de cacahuete y reduce la severidad de los síntomas derivados de la exposición de estos pacientes a sus proteínas.
La prevalencia de la alergia al cacahuete –también llamado maní– está experimentando en los últimos años un incremento notable en la población infantil de muchos países industrializados, y normalmente se mantiene en la edad adulta. Da lugar a reacciones alérgicas impredecibles y es potencialmente mortal, erigiéndose como la primera causa de muerte entre las alergias alimentarias. Hasta la fecha no existe ningún tratamiento aprobado para esta alergia y el abordaje estándar se limita a la retirada estricta de los cacahuetes de la dieta, así como a la administración de medicación de rescate en caso de reacción alérgica por exposición accidental.
Un reciente ensayo clínico internacional de fase 3, aleatorizado, doblemente ciego y controlado por placebo ha evaluado la eficacia y seguridad clínica de AR101, un novedoso fármaco biológico derivado del cacahuete que libera diariamente una dosis de mantenimiento de 300 mg de proteínas específicas. Previamente al inicio, se investigó si los candidatos presentaban síntomas alérgicos con la exposición a una dosis ≤ 100 mg de proteína de cacahuete (aproximadamente un tercio de un grano de maní). Finalmente, el estudio ha incluido un total de 551 participantes entre 4 y 55 años con alergia al cacahuete (496 de ellos con edades entre 4 y 17 años), que fueron asignados en una proporción de 3:1 a recibir AR101 –en un protocolo de dosis creciente– o placebo.
Los participantes que completaron el régimen de tratamiento –es decir, que habían recibido una dosis de 300 mg/día en un régimen mantenido durante 24 semanas– se sometieron al final del periodo a una prueba de exposición al alérgeno, doblemente ciega y controlada por placebo. La variable primaria de eficacia fue la proporción de participantes de 4 a 17 años de edad que pudieron ingerir una dosis de ≥ 600 mg de proteínas de cacahuete sin mostrar síntomas alérgicos limitantes de la dosis.
Los resultados revelan que 250 de los 372 participantes menores de 18 años (67,2%) que recibieron tratamiento activo pudieron ingerir una dosis de 600 mg (o más) de proteína de cacahuete sin síntomas limitantes de dosis en la prueba final, en comparación con 5 de los 124 participantes (4,0%) que recibieron placebo (diferencia de 63,2 puntos porcentuales; IC95% de 53,0 a 73,3; p<0,001). Además, en relación a aquellos participantes que sí sufrieron síntomas, la gravedad máxima de éstos fue moderada en el 25% de los participantes en el grupo de fármaco activo y en el 59% de los del grupo de placebo y grave en el 5% y el 11%, respectivamente. AR101 no demostró eficacia en los participantes de >18 años.
Por otra parte, los eventos adversos durante el período de intervención –que, en general, afectaron a >95% de los participantes menores de 18 años– fueron de gravedad leve en el 34,7% de los participantes en el grupo de fármaco activo frente al 50,0% de los participantes en el grupo de placebo. El 59,7% y el 44,4% de los participantes, respectivamente, tuvieron eventos calificados como moderados, y el 4,3% y el 0,8%, respectivamente, tuvieron efectos adversos graves.
En definitiva, los datos de este estudio de fase 3 aportan evidencia suficiente de que la inmunoterapia oral con el nuevo fármaco AR101 en niños y adolescentes alérgicos al cacahuete podría emerger como el primer tratamiento preventivo eficaz y seguro frente a esta patología, siendo capaz de aumentar la tolerancia de los pacientes a mayores dosis de cacahuete y de limitar la severidad de los síntomas.