Resumen
Bot PLUS recoge información de apoyo al farmacéutico para comprobar si un medicamento está sujeto a la obligación de verificación, y además puede ayudar a detectar de forma fácil medicamentos afectados por alertas farmacéuticas.
El día 9 de febrero han entrado en vigor las obligaciones para laboratorios, entidades de distribución y oficinas de farmacia recogidas en el Reglamento Delegado (UE) 2016/161 que completa la Directiva 2001/83/CE estableciendo disposiciones detalladas relativas a los dispositivos de seguridad que figuran en el envase de los medicamentos de uso humano.
En dicho reglamento se establecen una serie de medidas destinadas a garantizar que los medicamentos dispensados a los pacientes son auténticos, y consistentes en incorporar dos tipos de dispositivos de seguridad en todos los envases de aquellos medicamentos sujetos a la obligación de ser verificados por las farmacias:
- Un código bidimensional en formato Datamatrix, que permita la identificación individual del envase, y que debe incluir el código de producto (incorporando el código nacional del medicamento), el número de serie único por envase, el número de lote y la fecha de caducidad.
- Un dispositivo contra manipulación, para verificar si el embalaje exterior ha sido manipulado.

Figura 1. Dispositivos de seguridad a incluir en los medicamentos que requieran verificación.
Los medicamentos que obligatoriamente deberán incluir estos dispositivos de seguridad son los siguientes:
- Medicamentos sujetos a receta médica, salvo determinadas excepciones recogidas en la siguiente Tabla 1.

- Determinados medicamentos no sujetos a receta médica, en concreto, aquellas presentaciones que incluyan omeprazol en su composición a dosis de 20 o 40 mg.
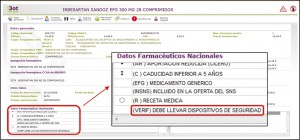
Figura 2. Identificación en Bot PLUS de medicamentos que deben llevar dispositivos de seguridad.
Para ayudar al farmacéutico a identificar de forma rápida y clara aquellos medicamentos que, en base a la información publicada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en su Nomenclátor de Prescripción, tienen la obligación de ser verificados por el farmacéutico antes de su dispensación al paciente, se ha incluido un nuevo Dato Farmacéutico: “VERIF – DEBE LLEVAR DISPOSITIVOS DE SEGURIDAD”.
La codificación de esta información permite igualmente al farmacéutico listar todos aquellos medicamentos que estén obligados a llevar estos dispositivos, empleando para ello la opción del menú Listados → Medicamentos uso Humano → Con dato farmacéutico, y eligiendo en el cuadro de búsqueda el tipo DISPENSACIÓN, y como valor DEBE LLEVAR DISPOSITIVOS DE SEGURIDAD.
Por tanto, a través de Bot PLUS, el farmacéutico puede conocer inmediatamente si el medicamento que va a dispensar al paciente está obligado a llevar dispositivo de seguridad, pudiendo proceder a su verificación y a la desactivación del envase del repositorio nacional de verificación.
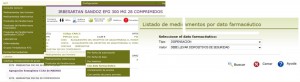
Figura 3. Identificación en Bot PLUS de medicamentos que deben llevar dispositivos de seguridad.
Adicionalmente a esta nueva funcionalidad, y tal y como se informaba en el artículo de Bot PLUS al día del PAM nº 416**, en Bot PLUS se codifica la información relativa a los lotes y fechas de caducidad de medicamentos afectados por alertas de calidad emitidas por la AEMPS. Esta codificación de los lotes retirados es una información puesta a disposición de todos los usuarios con el objetivo de ofrecer una nueva información capaz de integrarse con otros sistemas de información y mejorar la gestión e identificación de estos medicamentos, en los que la labor asistencial y de control del farmacéutico es fundamental.
Los medicamentos afectados por alertas de calidad están identificados por el mensaje de advertencia MEDICAMENTO CON ALERTA CALIDAD AEMPS: RETIRADA DE LOTES, y con su correspondiente pictograma. Adicionalmente, incluyen una pestaña específica “Alertas Calidad”, en la que se puede consultar los lotes concretos que han sido retirados, con sus respectivas fechas de caducidad, así como la descripción del defecto de calidad detectado y las medidas a adoptar. En esa misma pestaña, también se podrá acceder directamente al documento (pdf) de esa alerta publicada por la AEMPS (Figura 4).
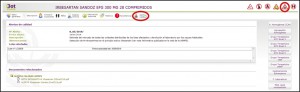
Figura 4. Información sobre alertas de calidad de los medicamentos.
La codificación de esta información, en concreto la referida a lote y fecha de caducidad, que ya se está almacenando en Bot PLUS durante los últimos años, va a suponer una potente herramienta de soporte para aprovechar las nuevas informaciones que proporciona el nuevo código Datamatrix de los medicamentos (número de lote y fecha de caducidad). Aprovechando la codificación de todos los lotes retirados por alertas de calidad, los sistemas de información que se nutren de Bot PLUS tendrán la capacidad de detectar, en el momento de la verificación del medicamento, si un envase en concreto pertenece a uno de los lotes afectados por una alerta de calidad, emitiendo las correspondientes advertencias y actuando, en definitiva, en favor de un mayor control del medicamento por parte del farmacéutico.