resumen
La infección por el virus de la inmunodeficiencia humana (VIH) produce una enfermedad crónica caracterizada por una deficiencia en el número de linfocitos CD4+ y en la función inmunitaria general del paciente, desde la primoinfección hasta una fase final en que suelen aparecer diferentes manifestaciones clínicas (asociadas en muchos casos a infecciones oportunistas o ciertos tipos de tumores) que dan lugar al síndrome de inmunodeficiencia adquirida (SIDA). Con una prevalencia de casi 37 millones de casos en todo el mundo (en torno a 145.000 casos se localizan en España), muy mayoritaria en África, el impacto sanitario y socioeconómico de la infección por VIH es elevado, aunque su incidencia continúa disminuyendo debido a una creciente concienciación social. Si bien a día de hoy la infección por VIH no se puede erradicar, se considera una infección crónica no mortal, gracias a las mejoras introducidas en el tratamiento antirretroviral (TAR), que consigue incrementar el número de linfocitos CD4 y reducir la viremia hasta niveles prácticamente indetectables. El TAR ha reducido drásticamente la morbimortalidad y la transmisión de la infección por VIH-1, permitiendo a los pacientes llevar una buena calidad de vida hasta edades muy avanzadas. Los fármacos antirretrovirales disponibles actualmente se engloban en cinco grandes grupos según su mecanismo de acción: inhibidores de la transcriptasa inversa, de la integrasa, de la proteasa, del correceptor CCR5 e inhibidores de la fusión. La gran variabilidad de cepas de VIH y la susceptibilidad de aparición de resistencias obligan al uso conjunto de más de una clase de fármacos y aportan complejidad al tratamiento. El profesional farmacéutico, tanto a nivel de farmacia comunitaria como de farmacia hospitalaria (donde se dispensan todos los medicamentos antirretrovirales), puede y debe tener un papel clave en la optimización del TAR mediante la promoción y el refuerzo de la adherencia de los pacientes, la educación sanitaria, la identificación y el manejo de problemas relacionados con el TAR –reacciones adversas o interacciones farmacológicas, sobre todo–, y mediante el impulso del diagnóstico precoz de la infección. En este sentido, la dispensación de los test de autodiagnóstico desde la oficina de farmacia puede contribuir significativamente a reducir el infradiagnóstico de la infección.
DEFINICIÓN Y CARACTERÍSTICAS DEL vih
El virus de la inmunodeficiencia humana (VIH) es un retrovirus o virus de ARN monocatenario retrotranscrito (ssRNA-RT, single-stranded RNA virus reverse transcriptase). Su genoma se compone de dos copias idénticas de cadenas de ARN que dependen para su replicación en la célula huésped de una enzima denominada transcriptasa inversa o retrotranscriptasa, que da lugar mediante el proceso de retrotranscripción1 a un ADN provisional que a menudo se inserta en el genoma del hospedador por la acción de una ADN polimerasa dependiente de ARN, la integrasa viral. Posteriormente, ese ADN es replicado y transcrito por el huésped: el virus se apodera de la maquinaria celular y silencia la replicación de numerosos genes celulares en favor de la replicación de los propios.
Por otro lado, el síndrome de inmunodeficiencia adquirida (SIDA) se define como el resultado de la infección crónica por el VIH, que implica una reducción extrema de la población de linfocitos T que expresan CD4 en su superficie, al ser éstos la diana del VIH. Puesto que los linfocitos T CD4+ son claves en la coordinación de la respuesta inmunitaria frente a agentes externos, su reducción conduce a la aparición de infecciones oportunistas, que marcan la evolución de la enfermedad y que, en ausencia de tratamiento antiviral, conducen inexorablemente al fallecimiento del paciente. Afortunadamente, en la actualidad la infección por el VIH se podría considerar una infección crónica, aunque controlada y no mortal, en los países desarrollados que disponen de fármacos específicos, si bien está asociada a una mayor tasa de morbimortalidad, como un mayor porcentaje de ciertos tipos de cánceres o una mayor incidencia de infecciones oportunistas que en población no infectada, y se relaciona con envejecimiento prematuro.
El VIH forma parte de los lentivirus (familia Retroviridae, género Lentivirus), una subfamilia cuyo nombre alude a la forma insidiosa (lenta e inicialmente desapercibida) en que se desarrolla su infección. Sin embargo, el VIH tiene una cinética de replicación muy agresiva, y muy diferente a la que suelen presentar los lentivirus (Fernández del Pozo, 2011). Los VIH son virus de geometría esférica y diámetro medio aproximado de 100 nm (Figura 1). La capa más externa o envuelta está formada por una membrana con alto contenido en lipoproteínas. En dicha membrana se insertan antígenos de histocompatibilidad (HLA) del hospedador y diversos complejos heterodiméricos de glucoproteínas, compuestos por trímeros de la glicoproteína de superficie gp-120 y de la glicoproteína transmembrana gp-41, que le permitirán una primera unión a la célula hospedadora. Por debajo de la membrana lipídica se encuentra la matriz proteica, formada por la proteína p-17, que recubre la cápside propiamente dicha, constituida por la proteína p-24 (uno de los marcadores más comúnmente usados en el diagnóstico de la infección por VIH). En el interior de la cápside se encuentra el material genético, que se presentará como dos hebras idénticas de ARN monocatenario, junto con algunas enzimas como la transcriptasa inversa y la integrasa. El tamaño del genoma del VIH es inferior a 10.000 nucleótidos y contiene varios genes: tres genes principales (gag, pol y env) que codifican, cada uno, varias proteínas (estructurales, enzimas y glicoproteínas de la cubierta viral, respectivamente) y varios genes que codifican proteínas reguladoras (tat, rev, vif, vpu, nef y vpx).
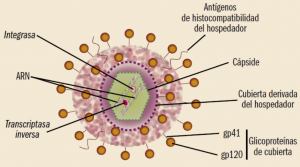
Figura 1. Estructura del VIH.
El origen del virus VIH parece estar en una recombinación de un virus humano con un virus de la inmunodeficiencia del simio, con el que estudios genéticos han establecido una relación filogenética. El VIH causa aproximadamente el 5% de todas las infecciones mundiales. Específicamente, a nivel mundial se describen dos tipos de VIH: VIH-1, derivado del virus de la inmunodeficiencia de los simios (SIV) de los chimpancés (denominado formalmente SIVcpz) y el VIH-2, que se originó a partir del retrovirus que infecta a los primates denominados mangabeys grises (formalmente SIVsm). La muestra de suero más antigua en la que se comprobó la presencia del VIH-1 data de 1959, aunque el estudio de la evolución de la epidemia desde su introducción en Tailandia (1986-1987) lleva a los investigadores a estimar que la infección en humanos se inició entre 1910 y 1950, probablemente alrededor de 1930. En 1983 se identificó el primer tipo de VIH (VIH-1) y en 1986 un segundo tipo (VIH-2) (Cuéllar, 2013).
En general, los virus VIH se encuentran más localizados en individuos de diversos países de África Occidental, donde se distribuyen principalmente los primates portadores, y áreas con lazos históricos como Portugal y la India. Tanto el VIH-1, el más prevalente y distribuido a nivel mundial, como el VIH-2 son capaces de evolucionar a SIDA sin tratamiento. Dentro de cada uno de esos dos grandes grupos de VIH, se han descrito numerosos subtipos, algunos de los cuales han evolucionado mayoritariamente de forma pandémica, pero también se han identificado cepas recombinantes intersubtipo2. La gran variabilidad que presenta el virus VIH es uno de los mayores inconvenientes para conseguir un tratamiento eficaz. La tipificación del VIH resulta muy relevante en cuanto al pronóstico y al tratamiento de la infección, ya que los diferentes subtipos presentan características biológicas diferentes que pueden condicionar su patogenicidad, su capacidad de transmisión y su resistencia o sensibilidad a los antirretrovirales.
Dentro del VIH-1 se distinguen cuatro grupos virales distintos – M, N, O y P –, cada uno de los cuales aparecieron como resultado de un evento de transmisión zoonótica diferente. Los grupos M, N y O se transmitieron desde los chimpancés, y el grupo P, desde gorilas. El grupo M (Main-principal) es el de la cepa pandémica, que se subdivide posteriormente en nueve subtipos virales distintos (A-D, F-H, J-K) y, a su vez, en recombinantes de estos subtipos, denominados formas recombinantes circulantes (CRF). El subtipo C representa casi la mitad de las infecciones por VIH-1 en todo el mundo y predomina en el sur de África y la India. El subtipo B predomina en América del Norte, Europa Occidental y Central, el Caribe y América Latina (Figura 2). El grupo O (outlier-valores atípicos) representa un número mucho menor de cepas, en torno al 1% de las infecciones mundiales, y se limita geográficamente a África Occidental (Camerún, Gabón y Guinea Ecuatorial). El grupo N (‘no-M / no-O’) se ha aislado en muy pocas ocasiones y sólo se ha documentado en Camerún. Por último, el grupo P, un nuevo subtipo de VIH estrechamente relacionado con las cepas de SIV que se encuentran en los gorilas, fue descubierto en 2009 en Camerún y sólo se ha aislado de dos personas.
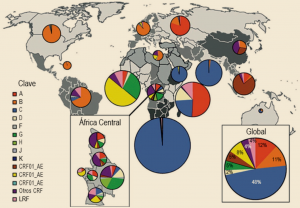
Figura 2. Distribución mundial de los subtipos de VIH-1 (Hemelaar, 2012).
Las distintas cepas del VIH-1 pueden ser más o menos patógenas y presentar distinto tropismo celular. Así, por ejemplo, las cepas del grupo O son naturalmente resistentes a inhibidores de la transcriptasa inversa no análogos de los nucleósidos; dentro del grupo M, algunas cepas del subtipo G son menos sensibles in vitro a inhibidores de la proteasa; los virus del subtipo D dan lugar a una infección con una evolución más rápida; y algunas mutaciones que condicionan la resistencia a inhibidores de la transcriptasa inversa no nucleósidos son más frecuentes, por ejemplo, en el subgrupo C que en el B.
Por su parte, el VIH-2 se consideraba restringido a determinadas regiones de África Central y Occidental, pero, por ejemplo, en Portugal da lugar al 5-10% de los casos. Parece tener una historia natural más indolente que el VIH-1, aunque es intrínsecamente resistente a ciertos agentes antirretrovirales (inhibidores de la retrotranscriptasa no análogos de nucleósidos) y se asocia más frecuentemente que el VIH-1 con el desarrollo de las formas neurológicas del SIDA. Se divide en 8 subgrupos virales, si bien sólo los subgrupos A y B evolucionan de forma pandémica. Para algunos subtipos de VIH-2, la determinación de carga viral (criterio fundamental en el manejo actual de la infección por el VIH) puede dar resultados falsamente negativos.
EPIDEMIOLOGÍA
Según los últimos datos publicados por la OMS en 2018, que hacen referencia a las cifras epidemiológicas del año 2017, en todo el mundo viven infectadas con el virus VIH un total de 36,9 millones de personas de todos los rangos de edades (incluyendo 1,8 millones de niños menores de 15 años). De todos ellos, casi tres cuartas partes de los casos se ubican en el continente africano (25,7 millones), especialmente en África Subsahariana, región en que la tasa media de prevalenciadel VIH se aproxima al 4,7% y alcanza el 25% en algunos países, mientras que en Europa viven “solo” 2,3 millones de infectados, lo que evidencia la desigualdad en la prevalencia de la infección por zonas geográficas (Figura 3).
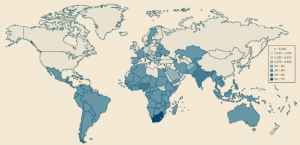
Figura 3. Mapa de prevalencia de VIH en 2018. Datos expresados en millones de casos. (http://www.indexmundi.com/map/?v=32&l=es).
El Caribe tiene la segunda tasa de prevalencia3 de VIH más alta del mundo, donde más del 50% de población infectada se encuentra en Haití. La prevalencia general en Asia es baja (con una tasa cercana al 0,6%), aunque en el Sudeste Asiático se estiman unos 3,5 millones de personas infectadas, de los que más de la mitad de casos (2,1 millones) se localizan en la India. El total de personas en el mundo que han contraído el virus desde el inicio de la epidemia se sitúa en 77,3 millones.
Sin embargo, la epidemia se ha estabilizado o está mostrando signos de recesión. Así, la incidencia4 de la infección continúa en descenso, habiéndose reportado un significativo descenso del 47%, desde los 3,4 millones de nuevos casos a nivel global en 1996 – que supuso un pico histórico – hasta las 1,8 millones de nuevas infecciones en 2017. La mayoría de nuevos casos se concentraron en las poblaciones de riesgo, esto es, mujeres en el continente africano, hombres homosexuales, prostitutas o drogadictos. De forma positiva, las nuevas infecciones por el VIH en niños descendieron un 35% desde 270.000 en 2010 hasta las 180.000 en 2017.
Es importante destacar que el número de muertes anuales debidas a enfermedades relacionadas con el SIDA en personas infectadas también se ha reducido en más del 51% desde el pico de 1,9 millones en 2004 hasta las 940.000 defunciones en 2017. En el registro histórico, este dato eleva a 35,4 millones las muertes producidas por enfermedades relacionadas con el SIDA desde el comienzo de la epidemia. Se estima que más de 25 millones de niños han quedado huérfanos por la muerte prematura de sus progenitores a causa del SIDA.
Por lo que respecta a España, el último informe de Vigilancia Epidemiológica del VIH y SIDA publicado en 2017 hace referencia a datos epidemiológicos correspondientes al año 2016, entre los que cabe destacar los siguientes:
- En España viven entre 140/145.000 personas con VIH, de las cuales alrededor del 18% desconocen que están infectadas por el virus.
- En 2016, se han diagnosticado 3.353 nuevos casos (se estima una tasa final de 8,6 por 100.000 habitantes); el 33,7% de los nuevos diagnósticos se realizó en personas nacidas fuera de España.
- El 83% de nuevos casos eran hombres (las tasas correspondientes para hombres y mujeres fueron 12,3 y 2,2/100.000, respectivamente), y la mediana de edad fue de 35 años.
- Entre las nuevas infecciones en 2016, el 46% presentaba diagnóstico tardío (que se considera cuando hay presencia de una cifra inferior a 350 células CD4+/μl).
- La vía de transmisión más frecuente en los nuevos casos, y con tendencia ascendente, fue la sexual en hombres que mantienen relaciones sexuales con hombres (HSH), seguida de la heterosexual y de la vía parenteral en personas que se inyectan drogas (PID), cuyas tendencias son descendentes (Figura 4).
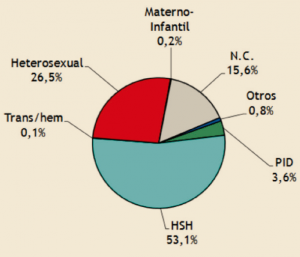
Figura 4. Vías de transmisión en los nuevos contagios por VIH en España en 2016. NC: no consta información.
- Por lo que se refiere a la forma clínica de la enfermedad, el SIDA, se registraron 412 casos en 2016 (se estima un total de 607 casos y una tasa final de 1,8 casos por 100.000 habitantes), de los que el 80,8% eran varones y la mediana de edad fue de 44 años. Los casos en heterosexuales supusieron el 36,2% del total (causa muy mayoritaria en el colectivo de mujeres), los HSH el 32%, y los PID el 12,6%. En 2016 se han notificado dos casos de sida en personas que habían adquirido la infección por VIH a través de transmisión materno-infantil y un caso de transfusión adquirido fuera de España.
Desde el inicio de la epidemia en España en 1981, se han notificado un total de 86.663 casos de sida. Tras alcanzar su cénit a mediados de la década de los 90, el número de casos notificados ha experimentado un progresivo declive desde 1996 hasta 2016, por la generalización de la terapia antirretroviral. Se han reportado evidentes descensos del número de nuevos casos tanto en varones como en mujeres y en las tres vías principales de transmisión. Sin embargo, la proporción de casos de sida en personas cuyo país de origen no es España ha ido subiendo progresivamente desde 1995 (que estaba por debajo del 3%) hasta el 33,5% en 2016, afectando principalmente a personas originarias de Latinoamérica y África Subsahariana.
ETIOPATOGENIA Y CONSIDERACIONES CLÍNICAS
El VIH no puede sobrevivir fuera del torrente sanguíneo o del tejido linfático y es fácilmente destruido por cualquier detergente o desinfectante. Es muy sensible a las altas temperaturas y a la desecación (aunque el ARN es detectable en sangre seca durante 4-5 días, no es infeccioso), y a pH alcalinos o ácidos. Por ello, la transmisión del VIH entre personas ha de producirse por el contacto estrecho a través de fluidos biológicos en los que pueda sobrevivir, sangre o secreciones (vaginal, esperma, etc.), que entren en íntimo contacto con estructuras receptoras, como los vasos sanguíneos o erosiones en la piel o mucosas.
El VIH presenta tropismo por los linfocitos T CD4+, principalmente, y también por los macrófagos. Las células infectadas pueden transferir el virus a las células del sistema inmunitario local presentes en el epitelio vaginal o en la mucosa ano-rectal. El primer tejido en ser infectado, en el caso de las relaciones heterosexuales, es la mucosa del cérvix vaginal, y más concretamente las células dendríticas5 y los linfocitos T CD4 allí presentes. La proporción de linfocitos T CD4 infectados en sangre periférica es mínima (1-10%), pero su capacidad de producir viriones es muy alta y, a partir de éstos, la infección puede difundirse hacia los nódulos linfáticos regionales para posteriormente ser distribuida por todo el organismo a través del torrente circulatorio.
Una vez en los nódulos linfáticos, se produce una intensa replicación del VIH que en unos casos provoca la lisis de las células infectadas, pero en otros casos se perpetúa como una infección latente en los macrófagos y los linfocitos T en reposo, que actuarán como “reservorios naturales” del virus, dificultando tanto la respuesta inmunitaria natural del organismo como la adopción de medidas terapéuticas eficaces desde el inicio de la infección. Cabe destacar que sólo una pequeña proporción (cercana al 1%) de los linfocitos infectados replica activamente el VIH en determinado momento, mientras que la mayoría de ellos permanece en estado latente, en cuyo caso el virus carece de efectos patológicos. El conocimiento exhaustivo del proceso por el que las células con infección latente pasan a la replicación activa permitirá encontrar nuevas dianas terapéuticas.
La relevancia de la infección de los macrófagos tisulares tampoco ha sido completamente esclarecida. Representan, probablemente, un reservorio de replicación con cinética lenta, que puede dar lugar a cambios en la síntesis de factores de crecimiento, citocinas y quimiocinas, así como a alteraciones en la funcionalidad del sistema nervioso central (SNC), estando posiblemente implicados a largo plazo en la perpetuación de la infección y el desarrollo de resistencias a fármacos (Dahabieh, 2015).
La primoinfección por el VIH-1 es sintomática en más de la mitad de los casos, pero generalmente puede pasar desapercibida ya que sus síntomas son los de una virosis común, como un resfriado o una gripe. Los síntomas y signos más comunes son fiebre, odinofagia, adenopatías de predominio laterocervical, mialgias, exantema, sudoración nocturna y artralgias; algunos pacientes pueden tener un cuadro similar al de la mononucleosis infecciosa.
Después de 10-12 días tras el contagio ya se puede detectar el ARN viral en la sangre, momento a partir del cual el paciente puede contagiar a otra persona. Más de un 30% de las partículas virales presentes en el plasma de los pacientes se renuevan diariamente, lo que implica una vida media viral de menos de dos días, mientras que el ritmo diario de sustitución de los linfocitos CD4+ plasmáticos es de un millón, lo que supone entre 10 y 100 veces más de lo normal. La carga viral puede llegar a alcanzar valores de hasta 100 millones de copias de ARN por mililitro de sangre tras la primera replicación viral después de la infección; tan elevada viremia provoca una rápida respuesta del sistema inmunitario.
La respuesta inmunitaria frente al VIH-1 se produce tanto en la vertiente humoral, con una intensa producción de anticuerpos contra las proteínas reguladoras y estructurales, y producción de complemento e interferones (IFN), como en la celular, mediante la activación de poblaciones linfocitarias T colaboradoras, citotóxicas y NK (naturalkiller). El pronóstico y la evolución de la infección dependen del equilibrio entre la virulencia del virus y la respuesta inmunitaria del huésped, entre otros factores fisiopatológicos. Los mecanismos patogénicos son complejos y varían según el estadio de la infección, dependiendo la interacción virus-célula de la expresión de diferentes genes reguladores.
Inicialmente, se produce una intensa expansión clonal de linfocitos CD8+ con actividad citotóxica, dirigida frente a diversas proteínas del VIH-1, que originan una supresión parcial temporal de la replicación del VIH y una drástica disminución de la viremia, pudiendo incluso llegar a niveles indetectables de menos de 50 copias de ARN por mililitro de sangre en algunos casos. Sin embargo, esa potente respuesta antiviral es incapaz de erradicar el virus del organismo. Posteriormente, entre 3 y 5 semanas después de la infección – se habla de una media de 28 días desde la fecha de contagio en la mayoría de personas –, aparecen anticuerpos específicos anti-VIH. Tras ese período ventana denominado seroconversión, el paciente pasa a ser considerado como seropositivo.
A la fase aguda de la infección le sigue una fase asintomática (fase crónica no SIDA) de duración variable pero raramente inferior a 18 meses, durante la que el virus continúa replicándose masivamente en diferentes compartimentos orgánicos, siendo solo parcialmente controlado por la activación constante de la respuesta inmunitaria natural del organismo; esto provoca un estado inflamatorio de carácter crónico que puede mantenerse por largos períodos de tiempo (Figura 5).
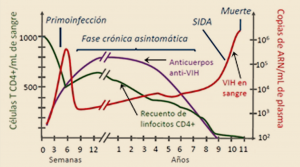
Figura 5. Historia natural de la infección por VIH.
En la gran mayoría de pacientes infectados, a lo largo del periodo asintomático se produce un deterioro progresivo del tejido linfoide, con reducción de los recuentos de linfocitos T CD4, fruto de la replicación viral y del estado inflamatorio crónico. Al ocupar un lugar preeminente en la organización y la activación del sistema inmune, la caída brusca de las células CD4 origina un deterioro funcional de otras poblaciones celulares y se reduce la eficacia del sistema inmunológico: disminuyen los niveles de anticuerpos frente a diversas estructuras virales y se vuelve a elevar significativamente la carga viral, cuya difusión se generaliza por todo el organismo. En estos estadios finales de la enfermedad, la fase de SIDA propiamente dicha viene definida a partir de un contaje del número de linfocitos T CD4+ inferior a 200 células por mililitro de sangre o por la asociación de cualquier manifestación grave independientemente del recuento celular.
En esta fase, se magnifica el riesgo de nuevas infecciones o la reactivación de infecciones latentes, siendo frecuentes las infecciones oportunistas y también ciertas patologías malignas, como ciertos tumores; estas aparecerán cuando el sistema inmune pierde definitivamente la batalla frente a la infección. Antes del uso generalizado de la terapia antirretroviral (TAR), las enfermedades asociadas a SIDA fueron la causa principal de morbimortalidad asociada a la infección por VIH. Las manifestaciones clínicas que definen el SIDA han sido establecidas por el CDC (Centro para el Control y Prevención de Enfermedades) ya desde 1993 (Tabla 1).

A día de hoy, la tuberculosis continúa siendo la principal causa de muerte entre las personas que viven con el VIH (es responsable de una de cada tres muertes relacionadas con el SIDA), seguida de neumonía y candidiasis. En cuanto a las neoplasias emergentes como consecuencia del fracaso inmunológico, las más comúnmente relacionadas con el VIH son el sarcoma de Kaposi y ciertos linfomas. No es infrecuente el desarrollo de una encefalopatía progresiva inducida por el VIH, que consigue infectar células de la microglía.
La progresión de la infección a SIDA es más rápida en los pacientes inicialmente sintomáticos y se asocia a diversos factores de la infección, como la gravedad de la sintomatología en la infección aguda (mayor riesgo a mayor número de síntomas), grado del descenso inicial del número de linfocitos CD4+ (mayor riesgo si es inferior a 500 células/µL), nivel de la carga viral plasmática basal o a partir del cuarto mes (mayor progresión si es mayor de 100.000 copias/mL), la cuantía de ADN proviral inicial, la infección por más de un virus VIH-1 y el perfil genético de los individuos infectados. En ausencia de tratamiento, se estima que la mediana de supervivencia de los pacientes con infección por VIH avanzada (recuento de linfocitos CD4+ < 50 células/µL) es de 12 a 18 meses, y el tiempo medio de evolución natural transcurrido entre la primoinfección y la muerte del paciente se sitúa sobre los 11 años.
Especial atención ha atraído un pequeño grupo de pacientes (5-10%) con infección por el VIH-1 que presenta una progresión lenta o una ausencia de progresión hacia estas fases finales. Estos pacientes de progresión lenta mantienen una carga viral basal reducida y cifras de linfocitos CD4 sanguíneos mantenidas por encima de 500/µL en ausencia de terapia específica. Este grupo de población es un colectivo heterogéneo en cuya protección están implicados diversos factores inmunológicos (potentes y variadas respuestas citotóxicas), virológicos (cepas virales con defectos estructurales) y genéticos (defectos en ciertos correceptores del VIH, tales como, por ejemplo, CCR5 o CXCR4) que permiten esta evolución benigna de la infección.
mecanismos de transmisión VIRAL
Debido a la idiosincrasia del virus, las vías de transmisión del VIH se limitan a la vía sexual, la vía parenteral y la vía vertical (madre-hijo). El riesgo de transmisión varía según la viremia y otros factores como el estadio clínico de la infección o la situación inmunitaria del paciente, además de la vía y el mecanismo de transmisión.
La transmisión por vía sexual es responsable de más del 80% de los contagios que se producen a nivel mundial. Es en África donde se describe la mayor tasa de contagios por VIH, y en torno al 75% se deben a las relaciones sexuales heterosexuales. En este tipo de parejas, la transmisión del virus puede producirse en ambos sentidos, si bien algunos estudios indican que es más fácil el contagio desde el varón a la mujer por la mayor carga viral en el semen respecto a la del fluido vaginal. Cabe destacar que más del 50% de nuevas infecciones se produce en mujeres, y que el riesgo de transmisión se incrementa si se practica el coito anal, se mantienen relaciones durante la menstruación o existen úlceras genitales por otras infecciones de transmisión sexual (como sífilis o linfogranuloma venéreo).
Sin embargo, según el informe la Organización Mundial de la Salud (OMS) de 2018, en los países desarrollados de Europa y EEUU, el patrón epidemiológico es diferente, pues se observa que más del 80% de los casos nuevos son hombres, siendo las relaciones homosexuales entre hombres un factor que facilita la transmisión del virus (este sector se considera 28 veces más propensos que el resto de la población a ser infectados); el riesgo de contagio se incrementa con el número de parejas y las prácticas sexuales que ocasionan traumatismos en mucosas.
La transmisión por vía parenteral o sanguínea, aunque supone una proporción menor respecto al total de nuevos contagios, es de mayor riesgo de contagio incluso que la vía sexual. Afortunadamente, esta vía se asocia en la actualidad, casi de forma exclusiva, al consumo de drogas por vía intravenosa –en especial en países de Europa del Este y Asia Central, donde representa más del 50% de las nuevas infecciones–, pues el elevado control de la sangre y hemoderivados y de los donantes de órganos ha erradicado la práctica totalidad de transmisiones por transfusión (como fue el caso de los hemofílicos en los años 80) o por trasplantes. En base a datos de incidencia, la OMS considera que el riesgo de infección por VIH en adictos a drogas por vía parenteral es 22 veces mayor que el de la población general (sin este factor de riesgo), estimándose en unos 9.250 casos de infección por cada 10.000 exposiciones.
La última opción de transmisión es la que se produce por vía vertical de madre a hijo, la cual puede producirse en cualquier momento del embarazo, el parto e incluso la lactancia, aunque el mayor riesgo acontece en torno al parto (70% de los casos); es la vía mayoritaria de infecciones en población infantil en todo el mundo (90% de los casos). Con la alta prevalencia de infección por VIH existente entre las mujeres jóvenes de África Subsahariana, existe la posibilidad de un gran número de infecciones en recién nacidos – en los países más afectados, hasta un tercio de los bebés nacidos de madres con VIH se infectan –, si bien cabe destacar que, desde 2010 a 2017, las nuevas infecciones en niños han descendido un 35% (hasta 180.000 casos/año), y Tailandia ha sido oficialmente el primer país en conseguir tasas cero de transmisión madre-hijo; en España, esta tasa se sitúa por debajo del 1,2% (ONUSIDA, 2018).
Antes de la intervención profiláctica y farmacológica, la transmisión madre-hijo era del 25-50% incluso en los países desarrollados. La reducción en el número de contagios por esta vía puede explicarse por la recomendación de la OMS de que todas las mujeres con VIH reciban antirretrovirales durante embarazo, parto y lactancia, y del programa impulsado por este organismo desde 2014 para atajar el grave problema de la transmisión vertical.
En 2017, el 77% de las mujeres embarazadas infectadas por el virus en el mundo recibe terapia antirretroviral (frente al 59% del total de infectados), aunque debemos considerar aquí la inequidad en el acceso a medicamentos de zonas como Europa y Asia Central (donde casi la totalidad de mujeres embarazadas serán tratadas) respecto a países con ingresos medios y bajos. En todo caso, aún estamos lejos de los ambiciosos objetivos de la ONUSIDA, que pretende que, en 2020, el 90% de toda la población infectada reciba tratamiento antirretroviral.
DIAGNÓSTICO
El diagnóstico definitorio de la infección por VIH debe realizarse mediante pruebas de laboratorio clínico. En la actualidad, la infección por el VIH se puede detectar con gran exactitud mediante pruebas precalificadas por la OMS en el marco de un enfoque validado. Más adelante en el presente informe se hará referencia especial a los test de autodiagnóstico que han surgido recientemente para promover el diagnóstico precoz de la infección.
En la fase de infección aguda, hasta 3-5 semanas tras la primoinfección, todavía no hay anticuerpos específicos, por lo que en ese período solo puede determinarse por técnicas de reacción en cadena de la polimerasa (PCR) la carga viral plasmática (CVP), detectable a partir del undécimo día; pero debe ser una CVP alta ya que si es inferior a 10.000 copias de ARN/mL puede ser un falso positivo. Las pruebas de enzimoinmunoanálisis (ELISA) más modernas, denominadas de 4ª generación, tienen la capacidad adicional de detectar en la misma reacción, a partir del 15º día, el antígeno p24 del VIH-1, acortando el período ventana en más de una semana.
La CVP en la infección aguda suele estar muy elevada – más de un millón de copias de ARN viral por mililitro – y se relaciona con la intensidad de las manifestaciones clínicas, detectándose la seroconversión entre una y dos semanas más tarde. Posteriormente a la aparición de anticuerpos entre la 6ª y 12ª semana, las pruebas serológicas recomendadas (análisis rápidos y ELISA) permiten detectar la presencia o ausencia de anticuerpos contra el VIH-1 y el VIH-2, que neutralizan el antígeno de superficie p24 y seguirán siendo detectables durante toda la vida. En caso de no disponer de estas técnicas, o a modo de confirmatorio, se puede realizar un ensayo de immunoblot, como el Western Blot. Las pruebas serológicas no bastan para detectar la infección en los lactantes y los niños menores de 18 meses de edad, por lo que se deben realizar pruebas de CVP en niños nacidos de madres infectadas.
Ninguna prueba permite diagnosticar por sí sola la presencia del VIH y hay que tener en cuenta, además, que si se detectan los anticuerpos frente al virus no se está detectando el propio virus. Es importante combinar las pruebas en un orden específico que haya sido validado basándose en la prevalencia del virus en la población objeto de examen (Figura 6). Un resultado negativo en una primera prueba analítica sí aporta elevado valor predictivo, no así el resultado positivo. En general, la práctica más correcta es realizar una nueva prueba a todas las personas que hayan dado positivo en una primera prueba diagnóstica antes de iniciar tratamiento, a fin de descartar que los resultados sean incorrectos. Sin embargo, una vez se ha diagnosticado la infección y se ha empezado el tratamiento no se deben realizar nuevas pruebas diagnósticas.
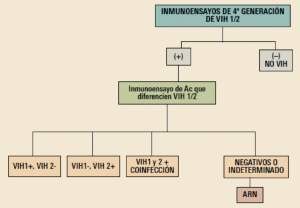
Figura 6. Algoritmo diagnóstico de VIH propuesto por la SEIMC (Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica).
A pesar de la alta disponibilidad de test diagnósticos rápidos, sencillos y precisos, aún existe un alto porcentaje de infección oculta. Se estima que actualmente hasta un 30% de la población infectada desconoce su estado, lo que dificulta el control de la enfermedad.
La evaluación clínica del paciente puede complementar el diagnóstico de laboratorio. En los pacientes infectados por VIH se observan con frecuencia distintos síndromes clínicos (afecciones oculares, renales, hematológicas, alteraciones endocrinas y del metabolismo, neurológicas, gastrointestinales, pulmonares, adenopatías, síndrome febril, anorexia, afecciones cardiacas y manifestaciones reumatológicas) de diferente etiología, ya sean relacionados con la propia infección, con la aparición de nuevas infecciones o incuso con el tratamiento antirretroviral.
PROFILAXIS
Sin duda alguna, como en todas las patologías infecciosas, el mejor tratamiento de la infección por VIH es el preventivo. El elevado impacto socio-económico del SIDA y su relevancia clínica hacen que las herramientas profilácticas cobren particular importancia. Se pueden identificar tres niveles de prevención frente a la infección por VIH:
- Profilaxis primaria o pre-exposición: pretende evitar nuevos contagios con el virus mediante el empleo de estrategias dirigidas tanto a la población general, entre las que se incluirá la promoción de hábitos saludables y la corrección de conductas peligrosas (sexuales, sobre todo), como intervenciones sobre grupos concretos de riesgo que, en nuestro medio, vienen representados principalmente por homosexuales masculinos, usuarios de drogas por vía IV, personas que ejercen la prostitución y sus clientes, o jóvenes y adolescentes. Algunas de estas intervenciones pueden ir desde la promoción del empleo de preservativos tanto masculinos como femeninos, hasta la promoción del uso preventivo de fármacos antirretrovirales.
La profilaxis farmacológica pre-exposición no está aprobada en España, pero sí en otros países como Estados Unidos. Se debe limitar fundamentalmente a esos grupos de personas no infectadas por el VIH-1 con un elevado riesgo de adquirir la infección por vía sexual o intravenosa. Antes de iniciar la terapia debe descartarse que el paciente ya haya contraído el VIH para disminuir el riesgo de que genere resistencia a estos antirretrovirales, valorando además la presencia o ausencia de patologías que puedan incrementar el riesgo de efectos adversos relacionados con los antirretrovirales (por ejemplo, función renal reducida, infección activa por virus de la hepatitis B u osteoporosis).
En este sentido, la OMS elaboró, en 2012, unas recomendaciones para la profilaxis pre-exposición al VIH que proponen que, en los países donde la transmisión del VIH se produce entre parejas serodiscordantes, donde las parejas discordantes pueden ser identificados y donde se necesitan otras opciones de prevención del VIH para los mismos, la utilización oral diaria de tenofovir (con o sin emtricitabina concomitante) se puede considerar como una posible intervención adicional para la pareja no infectada. En cambio, en los países donde la transmisión del VIH se produce entre los hombres y mujeres que tienen sexo con hombres y la prevención adicional del VIH se considera necesaria, la posible intervención supone la administración de tenofovir combinado con emtricitabina; en pautas posológicas adaptadas al perfil de riesgo de los pacientes, esta combinación puede reducir el riesgo de transmisión desde un 44% hasta un 86% en personas que no utilizan otros medios de barrera (Suárez, 2016).
A pesar de que no aporta recomendaciones específicas en colectivos como mujeres embarazadas o usuarios de drogas intravenosas, la OMS admite el creciente consenso científico sobre el uso de antirretrovirales y la reducción significativa que ejercen sobre el riesgo de contagio y transmisión del VIH, independientemente de la población o el comportamiento sexual. Algunos autores consideran que la mejor estrategia de salud pública en la actualidad respecto al VIH implica administrar tratamiento antirretroviral a todos los pacientes infectados y reservar la profilaxis farmacológica pre-exposición para casos muy específicos (Kashuba, 2012; Sánchez, 2016).
- La profilaxis secundaria se orienta al diagnóstico precoz y al consejo asistido.
- La profilaxis terciaria persigue el tratamiento precoz y específico de la infección para enlentecer su evolución y mantener la calidad de vida.
La prevención de la transmisión materno-fetal y la profilaxis posexposición al VIH con fármacos antirretrovirales se tratarán en detalle más adelante en este mismo documento.
TRATAMIENTO ANTIRRETROVIRAL (TAR)
OBJETIVOS e INICIO
Mientras no se disponga de fármacos con capacidad para erradicar definitivamente el VIH (como ha ocurrido ya con el virus de la hepatitis C), el objetivo fundamental de la terapia antirretroviral es suprimir la replicación del VIH para mantener la carga viral plasmática (CVP) en niveles indetectables – el estándar terapéutico es una CVP inferior a 50 copias de ARN por mililitro – durante el máximo tiempo posible. Así se persigue restaurar la función inmunitaria y limitar el desarrollo de resistencias virales. Todo ello revertirá en la reducción de la morbilidad y mortalidad asociadas, mejorando la calidad de vida del paciente para que su esperanza de vida se aproxime a la de la población general, así como en la prevención de la transmisión del VIH.
El cumplimiento de esos objetivos plantea muchas cuestiones (relativas, por ejemplo, al momento de inicio o de la combinación de fármacos a emplear) que no tienen una respuesta definitiva, por lo que el TAR está sometido a una constante evaluación y evolución, y es crucial valorar cada caso de forma individualizada, pues la disposición y la motivación del paciente es un factor crítico a la hora de decidir cuándo empezarlo. Distintas instituciones y paneles de expertos colaboran para desarrollar de forma periódica recomendaciones sobre el empleo de antirretrovirales en la infección por VIH, basadas en la evidencia disponible.
Una de las más empleadas en nuestro país es el Documento de Consenso Gesida/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana, cuya última versión de 2018 establece, en base a diversos estudios observacionales y a dos grandes ensayos clínicos (el ensayo START – Strategic Timing of AntiRetroviral Treatment – (Lundgren, 2015) y el ensayo TEMPRANO (Danel, 2015)) que el TAR debe iniciarse en todos los pacientes con infección por VIH-1 confirmada, con o sin sintomatología, independientemente del número de linfocitos T CD4+ y del valor de la CVP, si bien estos parámetros sí deben determinarse previamente. El inicio precoz del TAR se relaciona con una menor frecuencia de transmisión del VIH y de nuevas infecciones, y con una menor incidencia de manifestaciones clínicas debidas a infecciones o procesos tumorales.
En los casos en que, por diversos motivos, se valore posponer el inicio del TAR, se deben tener en cuenta las ventajas adicionales que aporta el tratamiento precoz en algunos grupos de pacientes, como los que presentan una CVP >50.000 copias/mL, cociente CD4/CD8 <0,5, edad igual o mayor a 50 años, pacientes con comorbilidades cuya progresión se facilita por la infección por VIH (por ejemplo, cirrosis hepática, hepatitis C crónica, tumores no relacionados con el SIDA y trastornos neurocognitivos), mujeres embarazadas, coinfección por virus de la hepatitis B que requiere tratamiento o las parejas serodiscordantes que deseen disminuir al máximo el riesgo de transmisión del VIH (Pérez, 2018).
A día de hoy, el TAR de inicio se basa en combinaciones de, al menos, tres fármacos. El uso combinado de fármacos limita la supervivencia de cepas resistente, pero, obviamente, su uso inadecuado puede limitar el uso de algunas alternativas. Aunque se han estudiado combinaciones eficaces con menor número de fármacos, las autoridades sanitarias no las han autorizado aún como tratamiento de inicio. La aparición de resistencias es un fenómeno inevitable y su detección por métodos genotípicos es muy útil en el fracaso virológico, orientando a la prescripción de terapias de rescate.
Mientras no se disponga de fármacos erradicadores, es fundamental considerar que, una vez iniciado, el TAR debe administrarse por tiempo indefinido, reevaluando periódicamente (dependiendo de comorbilidades, riesgo de interacciones, mala adherencia, etc.) la pauta farmacológica administrada a partir de los 6 meses, cuando la infección pasa a ser crónica.
FÁRMACOS ANTIRRETROVIRALES
INHIBIDORES DE LA TRANSCRIPTASA INVERSA
INHIBIDORES DE LA TRANSCRIPTASA INVERSA ANÁLOGOS DE NUCLEÓSIDOS (ITIAN)
Fue el primer grupo de fármacos anti-VIH. Las primeras moléculas que surgieron son análogos de los nucleótidos naturales, capaces de impedir la síntesis de ADN viral a partir de la cadena de ARN infectante. Actúan como finalizadores de la síntesis de la cadena, pues la enzima viral transcriptasa inversa los incorpora como eslabones en la cadena del ADN en formación y son terminadores del proceso, ya que es incapaz de unir posteriormente el siguiente eslabón nucleotídico. De esa forma, el ADN viral no se incorpora a la dotación genética de la célula infectada. Estos ITIAN precisan transformarse en sus derivados fosforilados en el interior celular para ejercer su acción, y su efecto farmacológico se produce únicamente cuando la célula se encuentra en fase de replicación, siendo ineficaces frente a los virus en células en fase de reposo (Figura 7). La zidovudina fue el primer fármaco anti-VIH (comercializado en 1987), sobre el que hay una mayor experiencia clínica, y aún se considera como base importante del tratamiento.
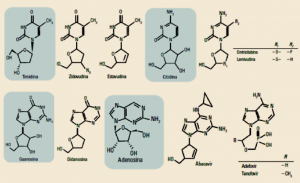
Figura 7. Inhibidores nucleosídicos de la transcriptasa inversa derivados de citidina,
timidina y guanosina y nucleosídicos/nucleotídicos derivados de la adenosina.
De forma general, se describen dos perfiles distintos de efectos adversos dentro del grupo: zidovudina (Retrovir®, EFG) y lamivudina (Epivir®, EFG), con menor intensidad esta última, provocan toxicidad hematológica (anemia y neutropenia) y gastrointestinal (náuseas); emtricitabina (Emtriva®) presenta un marcado parecido estructural, farmacológico y clínico con lamivudina, aunque sólo requiere una única administración diaria, frente a las dos que supone normalmente lamivudina. Por su parte, didanosina (VIdex®) y estavudina (Zerit®) presentan, en diferentes grados, riesgo de neuropatía periférica y pancreatitis.
Abacavir (Ziagen®) produce reacciones hipersensibilidad potencialmente fatales (que van desde a exantema, fiebre, mialgias y síntomas respiratorios o gastrointestinales hasta un fallo multiorgánico) en un 3% de los pacientes por cuestiones de farmacogenética y, por ello, se debe investigar la presencia del alelo HLA-B*5701 en el locus B del antígeno leucocitario humano en todos los pacientes antes de iniciar un régimen antirretroviral que incluya dicho fármaco. Los portadores de ese alelo presentan mucho mayor riesgo de reacciones de hipersensibilidad y en ellos se contraindica la administración de abacavir. La negatividad del estudio tampoco excluye definitivamente el riesgo de reacción de hipersensibilidad.
Aparte de esos seis ITIAN, en España también está comercializado un derivado análogo de nucleótidos, el tenofovir, que por su estructura química acorta el proceso de fosforilación intracelular y facilita su paso a través de membranas celulares. El tenofovir está comercializado en 2 formulaciones diferentes: tenofovir disoproxilo (Viread®, EFG) y tenofoviralafenamida. Este último, de más moderno desarrollo clínico, requiere dosis menores porque se concentra selectivamente como fármaco activo (tenofovir difosfato) en las células diana, y ha demostrado eficacia superior a tenofovir disoproxilo en tratamiento combinado tras tres años de seguimiento, con menor riesgo de nefrotoxicidad y afectación de la densidad mineral ósea, por lo que es preferible en pacientes con alteración renal u osteopenia (Arribas, 2017).
Como grupo, los ITIAN han venido mostrando algunos problemas toxicológicos importantes (como lipodistrofia, acidosis láctica, esteatosis hepática o neuropatía periférica), que han limitado notablemente su utilidad, tanto por la dosis como por el tiempo durante el cual pueden ser usados. Tales problemas parecen estar relacionados con la progresiva destrucción mitocondrial que generan, consecuencia de su afinidad hacia el ADN mitocondrial. Como excepción, tenofovir carece prácticamente de afinidad hacia el ADN mitocondrial.
En general, se debe evitar la asociación de fármacos del mismo perfil tóxico, excepto en el caso de lamivudina, que tiene una toxicidad comparativamente baja, siendo, en cambio, muy susceptible a la resistencia viral. Por ejemplo, la asociación zidovudina/lamivudina es más potente que la zidovudina sola sin mayor indicencia de efectos adversos.
El Documento de Consenso Gesida 2018 considera como combinaciones de ITIAN de elección en regímenes de inicio las formadas por emtricitabina/tenofovir alafenamida y por abacavir/lamivudina, que deberían administrase siempre que sea posible en medicamentos coformulados que incluyan varios principios activos. La combinación abacavir/lamivudina debe ser empleada con precaución en pacientes con CVP elevada (>100.000 copias/mL), especialmente si se asocia a un inhibidor de la transcriptasa inversa no nucleósido (ITINN) o a un inhibidor de la proteasa (IP).
INHIBIDORES DE LA TRANSCRIPTASA INVERSA NO NUCLEÓSIDOS (ITINN)
Presentan una estructura química muy alejada de los ITIAN (Figura 8). En España hay cuatro ITINN comercializados: nevirapina (Viramune®, EFG), efavirenz (Stocrin®, Sustiva®, EFG), etravirina (Intelence®) y rilpivirina (Edurant®). Todos ellos, a excepción de rilpivirina, son inductores (o inhibidores) de algunos isoenzimas del citocromo P-450 y presentan gran potencial de interacciones farmacológicas con otros principios activos metabolizados por esa vía.
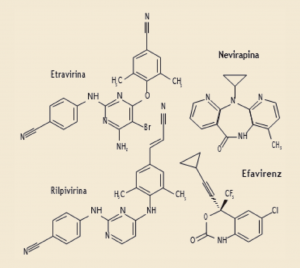
Figura 8. ITINN comercializados en España.
Los ITINN se unen al enzima transcriptasa inversa en una zona relacionada aunque diferente de la utilizada por los ITIAN, y son capaces de evitar la aparición de resistencias asociadas a mutaciones de la zona de fijación de los ITIAN. Así, no parecen presentar resistencia cruzada con los derivados nucleosídicos (zidovudina, especialmente), si bien la resistencia frente a nevirapina aparece de forma relativamente rápida, salvo que se utilice asociada con otros antirretrovirales (dos es el número mínimo recomendado).
Etravirina ha mostrado potente actividad frente a una amplia mayoría de cepas de VIH-1 (e incluso es activo frente a VIH-2, si bien esa indicación no ha sido aún autorizada por la ausencia de datos clínicos); se indica en pacientes previamente tratados con otros antirretrovirales, incluyendo aquellos con resistencia a otros ITINN, pero no está aprobada para el TAR de inicio. En base a la evidencia científica disponible, tampoco se recomienda el uso de nevirapina como TAR de inicio debido a su mayor toxicidad hepática y cutánea.
Efavirenz ha demostrado una eficacia igual o superior a cualquier inhibidor de la proteasa potenciado, con la ventaja de que se administra en una única dosis diaria y existe una presentación coformulada con emtricitabina/tenofovir disoproxilo en un único comprimido. Su uso se ve limitado por la aparición frecuente de síntomas relacionados con el sistema nervioso central (SNC) al inicio del tratamiento, que suelen ser leves y transitorios pero pueden ocasionar discontinuaciones del TAR. Por ello, efavirenz se debe evitar en personas con trastornos psiquiátricos no controlados (incluyendo ideaciones suicidas) o trabajos de riesgo que requieran mucha concentración o tengan turnos laborales cambiantes.
Rilpivirina está estrechamente relacionada farmacológica y estructuralmente con etravirina; se administra en una única dosis diaria (25 mg), con la posibilidad de coformulaciones con emtricitabina/tenofovir disoproxilo o con emtricitabina/tenofovir alafenamida en un solo comprimido. Su perfil de toxicidad gastrointestinal hace recomendable que rilpivirina se administre siempre con alimentos, y está contraindicado su uso con inhibidores de la bomba de protones que pueden reducir sus niveles plasmáticos. Presenta un mayor riesgo de fracaso virológico que efavirenz cuando hay elevada carga viral, por lo que no se recomienda en pacientes con CVP superior a 100.000 copias/mL. En pacientes con CVP inferior a 100.000 copias/mL, la combinación rilpivirina/emtricitabina/tenofovir alafenamida se considera un régimen preferente.
INHIBIDORES DE LA PROTEASA (IP)
Se trata de principios activos que interfieren con una etapa clave del ensamblaje de nuevos viriones y de la diseminación del virus: al inhibir la aspartil proteasa viral, impiden su acción catalítica sobre las cadenas precursoras de muchas proteínas esenciales para el VIH (incluyendo la transcriptasa inversa, la propia proteasa y varias proteínas estructurales), de manera que el virus no es capaz de producir las proteínas funcionales y se liberarán partículas víricas no infectantes.
Estructuralmente, los IP imitan la estructura de los puntos de cadena peptídica donde el enzima produce los cortes (tirosina-prolina y fenilalanina-prolina) y suplantan al propio polipéptido en el sitio activo de la enzima. Su potencia antiviral es, grosso modo, superior a la de los inhibidores de la transcriptasa inversa, siendo también muy susceptibles a las resistencias debidas a mutaciones, pero con las ventajas de no precisar activación del fármaco en el interior de la célula infectada y de presentar actividad frente a la mayoría de cepas de VIH-1 y también de VIH-2 (incluyendo cepas resistentes a otros antirretrovirales).
En la actualidad los IP disponibles en España son 8: atazanavir (Reyataz®), darunavir (Prezista®), indinavir (Crixivan®), lopinavir, fosamprenavir (Telzir®), ritonavir (Norvir®, EFG), saquinavir (Invirase®), y tipranavir (Aptivus®) (Figura 9). Salvo indinavir (prácticamente en desuso) y ritonavir, todos ellos se emplean en clínica potenciados con ritonavir o cobicistat (Tybost®); de hecho, cobicistat ha sido recomendado por la Agencia Europea de Medicamentos para potenciar atazanavir o darunavir, existiendo presentaciones coformuladas con ellos.
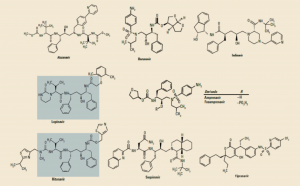
Figura 9. Estructuras de los IP comercializados en España.
Todos los fármacos de este grupo presentan características farmacocinéticas similares: biodisponibilidad oral moderada (baja en el caso de saquinavir), distribución elevada pero que no incluye el acceso del fármaco al SNC, y eliminación relativamente rápida por metabolismo hepático. La potenciación con ritonavir o cobicistat tiene ventajas de eficacia y barrera genética respecto a los IP no potenciados, aunque con el inconveniente de un aumento de la incidencia de efectos adversos. Se trata de una potenciación simplemente farmacocinética que permite salvar las limitaciones de algunos fármacos; por ejemplo, la formulación conjunta de lopinavir con ritonavir en proporción de 4:1 (Kaletra®, EFG) permite obtener una biodisponibilidad del lopinavir entre 50 y 100 veces superior a la observada tras la administración de lopinavir en solitario.
Los IP son generalmente bien tolerados, aunque cabe destacar como reacciones adversas poco frecuentes las alteraciones del metabolismo en forma de lipodistrofia (aumento de grasa central con pérdida de grasa periférica, aumento de la grasa intraabdominal y visceral, ginecomastia y acumulación de grasa dorsocervical), así como anormalidades metabólicas, como aumento de colesterol, triglicéridos, hiperglucemia y resistencia a la insulina.
Indinavir fue el primer fármaco comercializado dentro de este grupo y ha sido la referencia en términos de relación eficacia/riesgo. Ritonavir es igual de potente pero tiene una incidencia superior de efectos adversos y saquinavir es menos eficaz in vivo por su menor biodisponibilidad. Atazanavir está químicamente relacionado con saquinavir e indinavir y está autorizado para el tratamiento de pacientes adultos y pediátricos infectados por el VIH-1 en combinación con otros fármacos antirretrovirales y en aquellos previamente tratados con otros antirretrovirales; presenta ventajas de orden cinético y de seguridad, pues puede ser administrado en una única dosis diaria (siendo especialmente apto para combinaciones con otros antirretrovirales) y su efecto dislipémico parece inferior al de otros IP.
Por su parte, darunavir ha demostrado una eficacia sinérgica con la de otros IP, ITIAN e ITINN, e incluso con el inhibidor de la fusión enfuvirtida. Además, el desarrollo de resistencias frente a darunavir es lento y complejo, y parecen requerirse al menos 8 mutaciones en la proteasa viral para conferir una resistencia significativa al fármaco. Estrechamente relacionado con darunavir, fosamprenavir es un profármaco que tras su administración oral es rápidamente hidrolizado mediante una fosfatasa alcalina casi por completo en amprenavir – que fue retirado en 2008 –, antes de alcanzar la circulación sanguínea sistémica.
Tipranavir está aprobado solamente para pacientes en fracaso terapéutico pre-tratados con otros antirretrovirales. Se considera opción terapéutica de rescate, ya que mantiene una actividad antiviral significativa frente al 80-90% de las cepas clínicas que después del tratamiento muestran una disminución de la susceptibilidad al resto de IP. No obstante, dado su perfil de toxicidad y su potencial de interacciones, se recomienda que sea administrado como última opción, cuando la resistencia del VIH-1 no aconseje el uso de otros inhibidores de la proteasa.
Por tanto, atazanavir y darunavir presentan un mejor perfil toxicológico, y son los fármacos de elección dentro de este grupo, sobre todo en el TAR de inicio, potenciados con 100 mg de ritonavir o 150 mg de cobicistat. Alternativamente, se pueden utilizar fosamprenavir, saquinavir o lopinavir potenciados con ritonavir, aunque éstos no se recomiendan en la actualidad como TAR de inicio debido a que no aportan ventajas significativas en cuanto a simplicidad o tolerabilidad.
Según la evidencia disponible, el Documento de Consenso Gesida 2018 recomienda que, cuando se considere conveniente iniciar un tratamiento basado en IP, se recomienda utilizar darunavir+cobicistat/emtricitabina/tenofovir alafenamida o darunavir+ritonavir/emtricitabina/ tenofovir alafenamida. Como alternativa se puede utilizar atazanavir+ritonavir/emtricitabina/ tenofovir alafenamida o atazanavir+cobicistat/emtricitabina/tenofovir alafenamida.
INHIBIDORES DE LA INTEGRASA (INI)
La integrasa es un enzima codificado por el virus que facilita la integración del genoma del VIH en el genoma de la célula huésped (linfocitos T), en un proceso que es indispensable para la replicación viral: una vez integrado el ADN viral, la maquinaria celular llevará a cabo la duplicación del ADN. El proceso tiene cuatro pasos consecutivos – ensamblaje, procesamiento en 3’, transferencia de hebras y reparación –, siendo los tres primeros catalizados por la integrasa. Los fármacos de este grupo actúan específicamente inhibiendo el tercer paso, la transferencia de hebras de la integrasa.
Los INI actualmente comercializados en España son: raltegravir (Isentress®), elvitegravir y dolutegravir (Tivicay®). En julio de 2018, tras completar los ensayos confirmatorios, se ha autorizado también el bictegravir en formulación conjunta con emtricitabina y tenofovir alafenamida (Biktarvy®), aún no disponible en el mercado farmacéutico español. Todos ellos presentan una estructura pseudo-peptídica que emula químicamente una fracción proteica y así son capaces de actuar de señuelo bioquímico para bloquear la integrasa del VIH (Figura 10).
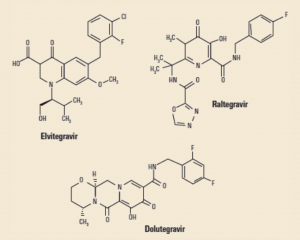
Figura 10. Estructuras de los INI comercializados en España.
Raltegravir fue el primer INI comercializado y del que se tiene mayor experiencia clínica. Aparentemente, no produce problemas serios de seguridad. Combinado con emtricitabina/ tenofovir disoproxilo, raltegravir ha demostrado ser superior a darunavir+ritonavir y a atazanavir+ritonavir y no-inferior a efavirenz, alcanzando eficacia superior al cuarto y quinto año de seguimiento (Rockstroh, 2013). Aunque no se dispone de evidencia del empleo de raltegravir con emtricitabina/tenofovir alafenamida, el Panel de expertos de Gesida considera que resulta preferible asociar raltegravir a esa combinación.
Por otro lado, elvitegravir requiere potenciación farmacológica y solo está disponible en forma de combinación con cobicistat, tenofovir (tanto en forma disoproxilo como alafenamida) y emtricitabina. Elvitegravir demostró una eficacia no inferior a raltegravir en tratamiento de rescate (Molina, 2012), pero tiene mayor incidencia de resistencias cruzadas con otros INI, lo que limita su uso secuencial. Con un perfil toxicológico en que predomina la toxicidad digestiva, elvitegravir en combinación no se considera preferente debido a su mayor potencial de interacciones con respecto a los otros INI comercializados, que también pueden utilizarse ya en combinación con emtricitabina/tenofovir alafenamida.
Desde 2014, también está disponible dolutegravir, que es probablemente el fármaco más potente del grupo, con una IC50 de 0,2-2 nM (frente a valores de 7-10 nM para elvitegravir), y no necesita potenciación. Es importante destacar que el grado de resistencias a dolutegravir es mucho menor, y permite su uso en rescates frente a fracasos con regímenes que incluyen raltegravir o elvitegravir; la administración conjunta de dolutegravir con antirretrovirales de otras familias reduce la aparición de cepas de VIH resistentes al fármaco (Cuéllar, 2014). Se ha sugerido una posible mayor incidencia de eventos neuropsiquiátricos en pacientes tratados con dolutegravir, que aún requiere mayor evidencia para su confirmación.
Un reciente meta-análisis promovido por la OMS para comparar las diversas pautas de inicio disponibles en la actualidad evidenció que los 3 INI comercializados muestran mayor eficacia a 48 semanas que efavirenz, fármaco considerado como referente (Kansers, 2016). Dolutegravir sería el fármaco de elección dentro de los INI en pautas de inicio, coadministrado con abacavir/lamivudina o con emtricitabina/tenofovir alafenamida, seguido de raltegravir con emtricitabina/tenofovir alafenamida.
INHIBIDORES DEL CO-RECEPTOR CCR5
Maraviroc (Celsentri®) (Figura 11) es el único principio activo comercializado en España e indicado frente a la infección por VIH que actúa por este mecanismo. Ejerce una inhibición alostérica no competitiva del co-receptor humano de quimiocinas CCR5 (requerido, junto con el CD4, para facilitar la unión de la membrana celular con la cápside del VIH), que impide la penetración del contenido de los virus VIH con tropismo CCR5 (virus R5) en el citoplasma de la célula.
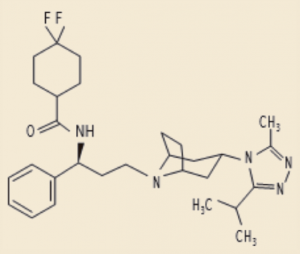
Figura 11. Fórmula química del maraviroc.
Maraviroc se une a la región proteica de CCR5 – exterior a la membrana celular – y provoca un cambio estable de su conformación, haciéndola inasequible para las quimiocinas del VIH-1, que no podrá unirse a la célula para infectarla. Sin embargo, maraviroc carece de actividad frente a cepas de VIH con tropismo CXCR4 (virus X4) o con tropismo dual CCR5/CXCR4. Por ello, su uso está desaconsejado en infecciones por VIH-2, capaz de utilizar otros co-receptores además del CCR5 y del CXCR4 (Pérez, 2018).
Cabe reseñar que las primeras cepas seleccionadas por el VIH-1, las que infectan inicialmente monocitos y macrófagos y los convierten en reservorios celulares, son R5 o monocitotropas. El virus evoluciona posteriormente cambiando hacia un tropismo X4 (cepas que utilizan el co-receptor CXCR4) o tropismo dual/mixto (cepas que pueden usar ambos correceptores), se vuelve más agresivo e infecta preferentemente a los linfocitos T, cuya destrucción es la causa del desarrollo del SIDA.
Como principal ventaja, maraviroc no presenta resistencia cruzada con otros fármacos antirretrovirales, por lo que el Documento de Consenso Gesida 2018 indica que se debe administrar maraviroc exclusivamente en tratamientos de rescate en pacientes con cepas multirresistentes de VIH-1 que sean R5-trópicas. Por tanto, el tropismo del virus debe ser analizado previamente con métodos genotípicos que determinan la secuencia de la región V3 de la envuelta viral (gp120).
Maraviroc ha mostrado un elevado margen de seguridad, con la misma tasa de abandonos del tratamiento por efectos adversos que el placebo; estos son, en general, leves, pasajeros e inespecíficos. Al ser un sustrato metabólico de citocromo P-450, requiere ajuste de dosis si se emplea en combinación con inhibidores potentes del CYP3A4, como los IP (excepto tipranavir), ketoconazol, itraconazol, claritromicina y telitromicina.
INHIBIDORES DE LA FUSIÓN (IF)
La enfuvirtida (Fuzeon®) es el único agente autorizado de este grupo de fármacos, que actúa inhibiendo el proceso en que la cubierta viral se funde con la membrana de los linfocitos, bloqueando así la penetración del VIH-1 en los linfocitos T CD4+. Estructuralmente, enfuvirtida es un péptido sintético constituido por 36 aminoácidos que emula al heptámero de repetición HR2 de la gp41: es capaz de unirse con alta afinidad al HR1 e impide el acoplamiento entre éste y el auténtico HR2, con lo que el proceso de fusión VIH-célula huésped queda bloqueado, ya que esta asociación impide el cambio conformacional requerido en la gp41 para fusionarse con la membrana de los linfocitos T CD4+. Como consecuencia de su mecanismo de acción, enfuvirtida no es activa frente al VIH-2.
Su relativamente frecuente toxicidad (evidenciada, sobre todo, por pérdida de peso y neuropatía periférica) y su complejidad de administración – al tratarse de un péptido, no es absorbible por vía oral y debe administrarse por vía subcutánea – restringen su empleo al TAR de rescate avanzado a pacientes sin otras posibilidades terapéuticas.
ESTRATEGIAS TERAPÉUTICAS
Todas las guías clínicas publicadas sobre el manejo de la infección por VIH y, en particular, el Documento de Consenso Gesida 2018, emplean el recuento de linfocitos CD4+ y la carga viral plasmática (CVP) como las principales variables para indicar el tratamiento antirretroviral, monitorizar su eficacia y guiar la tomar decisiones respecto a cambios.
La cifra de linfocitos CD4+ es el indicador fundamental del estado inmunológico del paciente y de la necesidad de tratamiento por riesgo de progresión clínica de la infección. Permite evaluar el estado de la infección, el riesgo de comorbilidades, la necesidad de profilaxis de infecciones oportunistas y una eventual discontinuación. Se recomienda determinar el número absoluto y el porcentaje de linfocitos CD4+ antes de iniciar el TAR y, una vez iniciado, como parámetro de monitorización periódica de la respuesta inmunológica al mismo cada 3-6 meses (a las 4 semanas en pacientes que inician con una cifra inferior a 300 células/μL o en caso de cambios en el tratamiento). Un TAR eficaz persigue la restauración inmunológica e induce un aumento lento pero paulatino del contaje linfocitario (muy evidente en las primeras semanas), que deberá materializarse en un aumento mínimo de aproximadamente 50-100 linfocitos CD4+/μL el primer año, aunque no hay evidencia para establecer esas cifras como inamovibles.
La carga viral plasmática (CVP) del VIH-1 es el principal medidor de la respuesta virológica ante el TAR, cuyo objetivo primario de supresión virológica se fija en conseguir niveles inferiores a 50 copias/mL. Se ha de determinar en la valoración inicial del paciente y antes del comienzo del TAR; posteriormente, es conveniente monitorizar la CVP a las 4 semanas del inicio del TAR (y cada vez que éste se modifique) y de forma periódica cada 3-6 meses, como medida directa de la eficacia e indirecta de adherencia. El control de la CVP y el contaje de linfocitos CD4+ pueden espaciarse más en pacientes con eficacia del tratamiento estabilizada (>300 células/μL y CVP repetidamente suprimida).
Por lo general, el TAR provocará inicialmente un descenso rápido de la CVP alcanzando el punto más bajo a las 4-8 semanas. Se considera respuesta virológica eficaz cuando se produce un descenso de la CVP a menos de la décima parte a las 4 semanas de tratamiento, si bien pacientes que inicien con cifras basales elevadas pueden tardar hasta 24 semanas en alcanzar el objetivo terapéutico. Una CVP en niveles deseables inferiores a 50 copias/mL se asocia normalmente a una recuperación inmunológica más duradera (respecto a valores de CVP entre 50-500 copias/mL) y también se ha descrito que previene la aparición de mutaciones de resistencia.
Cabe destacar que los casos de discordancia entre la respuesta virológica y la inmunológica son relativamente frecuentes. Estos casos, como un contaje de linfocitos CD4+ estable o que disminuye unido a una CVP indetectable, podrían enmascarar la existencia de una carga viral detectable en tejido linfático, que indicaría que el tratamiento no es óptimo, o bien situaciones no relacionadas con falta de eficacia antirretroviral que provocan la reducción de linfocitos, tales como hipertensión portal o toxicidad farmacológica. En los pacientes con CVP controlada se han descrito ocasionalmente brotes transitorios de viremia de bajo nivel(blips) – implican niveles cercanos a 500-1.000 copias/mL –, que vuelven espontáneamente a ser indetectables sin ningún cambio en el tratamiento y cuya aparición eventual no suele implicar un fracaso virológico. De forma aislada, los blips no tienen repercusión clínica, pero su aparición frecuente se ha asociado a mayor riesgo de fracaso y resistencias; ante un paciente que presente blips, es conveniente evaluar la adherencia y la barrera genética del TAR. Si la medida de la CVP se efectúa tras un proceso viral concomitante (gripe, etc.) o tras vacunación se considera normal la posible existencia de brotes transitorios.
Además de los dos criterios mencionados hasta ahora – recuento de linfocitos CD4+ y determinación plasmática de la carga viral –, hay otros factores o parámetros con una relevancia creciente que pueden afectar a la toma de decisiones farmacoterapéuticas.
Ante un nuevo diagnóstico de infección por VIH-1 y antes de iniciar el TAR, se debe estudiar las posibles resistencias primarias del virus frente a los fármacos antirretrovirales, mediante un estudio genotípico de mutaciones de resistencias a la transcriptasa inversa y proteasa. Su conocimiento permite optimizar el TAR, especialmente en pacientes inmigrantes o en caso de evolución clínica rápida. Conviene recordar, en este sentido, que las resistencias son más frecuentes cuando se utilizan los fármacos en monoterapia (su incidencia se reduce cuando se asocian varios fármacos, incluso del mismo grupo farmacológico) y cuando el cumplimiento del tratamiento por parte del paciente es deficiente; las resistencias no son necesariamente cruzadas y se relacionan con la duración del tratamiento.
La tasa de mutación espontánea de los retrovirus se estima en un nucleótido por cada 104 o 105 nucleótidos (el número de variantes genéticas distintas presentes en un momento dado en un individuo infectado se estima entre 5×105 y 5×106) y la prevalencia global en España de resistencias primarias en la transcriptasa inversa y proteasa es del 7,9% (Álvarez, 2017), mientras que transmisión de resistencias hasta el momento en la integrasa es excepcional. Si bien las variantes resistentes representan una proporción mínima de la población viral, con la introducción del TAR pueden convertirse en población dominante tras semanas o meses, si no se suprime la replicación viral global.
En nuestro país, la colaboración de diversas instituciones de investigación y hospitales ha permitido obtener una base de datos actualizada de secuencias de pacientes en fracaso virológico, facilitando la identificación de la relevancia de diversas mutaciones (Poveda, 2018). El Documento de Consenso Gesida 2018 recomienda la realización de un estudio genotípico de resistencias del VIH-1 en todos los pacientes con fracaso virológico, incluyendo resistencias en la integrasa si el régimen incluye un INI.
En línea con ese estudio genotípico, otras recomendaciones relevantes en la práctica clínica previamente apuntadas en este informe son las siguientes:
- La determinación del alelo HLA-B*5701 en todos los pacientes que vayan a iniciar tratamiento con abacavir tras el diagnóstico de infección, para excluir el riesgo de desarrollo de reacciones de hipersensibilidad potencialmente graves.
- La evaluación del tropismo R5/X4 del VIH-1 en todos los pacientes que hayan fracasado a cualquier línea de tratamiento y vayan a iniciar un tratamiento de rescate, si se considera maraviroc como una opción terapéutica.
Por último, la medición de niveles plasmáticos de los fármacos antirretrovirales, aunque no está recomendada de forma rutinaria, podría ser útil en el manejo de situaciones clínicas concretas, como interacciones farmacológicas, TAR en trasplante de órgano, delgadez u obesidad mórbida, embarazo, insuficiencia hepática o renal, sospecha de mal cumplimiento terapéutico, etc.
TRATAMIENTO DE LA INFECCIÓN PRIMARIA
Las recomendaciones actualizadas a 2018 según el Documento de Consenso Gesida, a diferencia de versiones antiguas de la misma (anteriores a 2014), establecen que el TAR debe iniciarse en todos los pacientes con infección por VIH-1 confirmada, con o sin sintomatología, independientemente del número de linfocitos T CD4+ y del valor de la CVP. El tratamiento precoz de la infección primaria, referida al período de 4 a 7 semanas tras la infección (en que se produce replicación viral prolífica), resulta esencial para controlar el curso de la patología y ofrece un mejor pronóstico a futuro. Es especialmente crítico iniciar cuanto antes el TAR en los casos en que exista un alto riesgo de transmisión del VIH, incluyendo a las mujeres infectadas durante el embarazo. Se recomienda que aquellos pacientes diagnosticados simultáneamente de la infección VIH-1 y de una infección oportunista definitoria de SIDA (particularmente, meningitis criptocócica y tuberculosa) sean tratados de forma precoz, a poder ser en el primer mes e, idealmente, en las dos primeras semanas.
Actualmente, la pauta de elección para el tratamiento inicial de la infección por VIH-1 consiste en la combinación de tres principios activos: dos ITIAN asociados bien a un INI, a un ITINN o bien a un IP potenciado. Esta estrategia de empleo de fármacos de distintos grupos permite atenuar la susceptibilidad a la aparición de resistencias, demostrando retrasar eficazmente la progresión clínica (morbilidad e ingresos hospitalarios), reducir los costes y aumentar la supervivencia. Hasta el momento, ningún régimen de TAR que evite el empleo de ITIAN ha demostrado superioridad de eficacia (sino que algunos estudios han demostrado lo contrario), respecto a regímenes que sí los incluyen; además, los regímenes libres de ITIAN ensayados no se han relacionado con una menor incidencia de efectos adversos (Orkin, 2018).
Las combinaciones farmacológicas de elección se recogen en la siguiente Tabla 2. En base a la creciente evidencia científica de su eficacia y seguridad clínicas, se clasifican en pautas preferentes, pautas alternativas y otras pautas posibles. Cualquiera de estas combinaciones puede conseguir una CVP inferior a 50 copias/mL en más del 80% de los pacientes a las 48 semanas. Algunas de ellas presentan la ventaja de estar formuladas en un mismo medicamento (principios activos separados por una barra en la Tabla 2) frente a otras que requieren la administración de dos medicamentos (indicado con una separación por el signo +). En la Tabla 3 de este informe, se muestran los medicamentos que incluyen coformulaciones de varios principios activos.
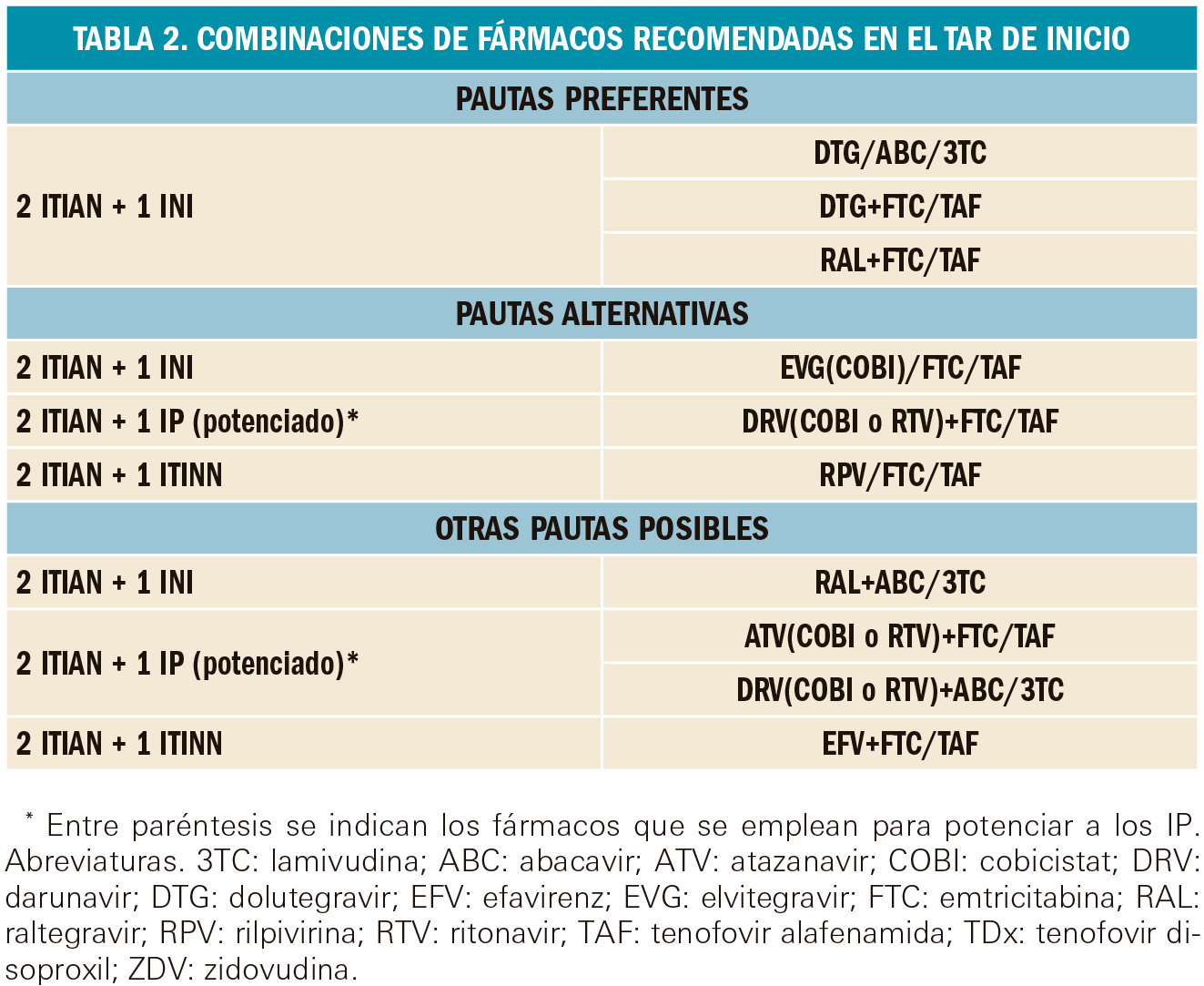
Para seleccionar una u otra familia de fármacos se valorarán las ventajas que aportan: el potencial de interacciones farmacológicas (menor en los INI, seguido de ITINN y mayor en los IP), la mayor barrera genética frente a resistencias (en los IP), y el menor coste (de los ITINN). Una pauta con dos ITIAN (preferentemente tenofovir/emtricitabina) y un INI (raltegravir) puede tener la ventaja de una mayor concentración en las secreciones genitales para reducir más rápidamente la CVP durante las primeras 4-8 semanas en comparación con los IP o ITINN, facilitando la reducción de los contagios por vía sexual. Si no se dispone del resultado del estudio de mutaciones de resistencia es preferible comenzar con una pauta basada en un IP potenciado (que presentan actividad frente a la mayoría de cepas VIH-1) hasta tener los resultados. No se recomiendan como tratamientos de inicio pautas libres de ITIAN ni monoterapia con IP potenciados.
TRATAMIENTO DE LA INFECCIÓN CRÓNICA
Las combinaciones de tres fármacos (2 ITIAN + 1 INI o 1 ITINN o 1 IP potenciado) previamente indicadas constituyen también el tratamiento de inicio de elección de la infección crónica por VIH, referida al período de más de seis meses tras la primoinfección. En este período de la infección, rige igualmente la recomendación principal de iniciar el tratamiento en todos los pacientes diagnosticados de VIH-1, presenten o no sintomatología, e independientemente del recuento de linfocitos T CD4+ y la determinación de CVP.
El objetivo del tratamiento en esta fase es, del mismo modo, conseguir una CVP indetectable menor de 50 copias/mL (aunque, en la práctica, las pruebas más modernas sí que pueden detectar tales niveles) durante el mayor tiempo posible, para lo que la adherencia al tratamiento juega un papel fundamental, particularmente sobre la duración de la respuesta antiviral. Afortunadamente, la toxicidad es un factor cada vez menos limitante del tratamiento, si bien a medio y largo plazo puede obligar a buscar alternativas terapéuticas para mantener la potencia antiviral.
Con el tratamiento actualmente recomendado es posible alcanzar cierta restauración cuantitativa y cualitativa del sistema inmune independientemente de la inmunodepresión de partida. La recuperación es lenta y constante mientras el tratamiento sea efectivo y es más difícil a partir de un determinado grado de deterioro y en la edad avanzada.
Diversas circunstancias (además del fracaso virológico, que se tratará a continuación) obligan a un cambio proactivo del TAR, como es el caso de evidencias sólidas que avalen, en un determinado paciente, la posibilidad de un efecto adverso grave o irrecuperable si se mantiene cierto tratamiento; un ejemplo paradigmático es la lipoatrofia causada por los análogos de nucleósidos timidínicos. El cambio de TAR es también obligado si, en presencia de cierto efecto adverso, se sabe que éste va a desaparecer tras el cambio, como es el caso de las afectaciones del SNC debidas al uso de efavirenz.
En pacientes naïve (que no han recibido TAR previo), hay ocasiones en que los efectos adversos aparecen de forma rápida e intensa, por lo que se deberá abordar un cambio precoz del TAR, antes incluso de la supresión de la replicación viral. Hay que destacar que algunos pacientes realizan un sobreesfuerzo para continuar con el TAR, sobrellevando efectos adversos erróneamente entendidos como inevitables; en esos casos, a pesar de que se alcance el objetivo de CVP, también se debe valorar el cambio de TAR. En todos estos cambios de TAR, serán preferentes las combinaciones de antirretrovirales descritas en la Tabla 2. Tras el cambio, el nuevo TAR se debe evaluar en un plazo de 3-6 semanas, analizando el mantenimiento de la supresión virológica y realizando las determinaciones de laboratorio pertinentes que dependerán del motivo del cambio (lipidograma, función renal, etc.).
FRACASO DEL TAR
El Documento de Consenso Gesida 2018 considera fracasovirológico cuando se confirma una CVP detectable superior a 50 copias/mL transcurridas 24 semanas del inicio del TAR o, si tras alcanzar una CVP casi indetectable (<50 copias/mL), la CVP vuelve a ser detectable en dos determinaciones consecutivas posteriormente. El fracaso virológico puede ocurrir con o sin selección de mutaciones de resistencias, que es un fenómeno inevitable cuando el VIH se continúa replicando bajo presión selectiva de fármacos, pero siempre requerirá cambio del TAR. Por su parte, el fracaso inmunológico viene definido por recuentos de linfocitos CD4+ superiores a 200 células/μL a pesar de mantener la supresión virológica con una CVP <50 copias/mL; por la falta de evidencia que demuestre mejoría inmunológica, no se recomienda modificar el TAR por este motivo, salvo retirar fármacos que pueden causar linfopenia, como zidovudina o la combinación tenofovir disoproxilo/didanosina (aunque en la actualidad casi no se emplean).
La incidencia de fracaso virológico y sus causas, así como el perfil de mutaciones de resistencia seleccionadas han cambiado radicalmente desde el inicio del TAR, de forma paralela a la mejoría paulatina en la eficacia de los regímenes utilizados. En los ensayos clínicos que evalúan TAR de inicio con las combinaciones que hoy se consideran preferentes, las tasas de fracaso virológico a las 48 semanas son inferiores al 10%, mientras que no existen datos de incidencia en pacientes que están en segundo tratamiento o siguientes.
Los factores que determinan el fracaso terapéutico se asocian a: i) el paciente: mala adherencia al tratamiento (el mejor predictor de respuesta virológica), dificultad de acceso a la atención sanitaria o de seguimiento de los controles médicos; ii) el fármaco y el sistema sanitario: esquema de TAR inadecuado que implique, entre otras, falta de eficacia, concentraciones plasmáticas inadecuadas, interacciones farmacológicas o errores posológicos; y iii) el virus: pre-existencia de mutaciones de resistencia transmitidas o adquiridas. Un dato a reseñar, que concierne a las propiedades del fármaco, es que la baja barrera genética de los antirretrovirales puede favorecer el desarrollo de mutaciones en caso de fracaso virológico, pero no conlleva un mayor riesgo de fracaso en sí.
Además de éstos, el origen de los pacientes infectados por el virus ha emergido en los últimos años con importancia creciente como otro factor a tener en cuenta en la aparición de fracaso virológico: la inmigración ha modificado el patrón de mutaciones de resistencias virales típicamente identificadas en nuestro país, incrementándose de forma significativa la prevalencia de subtipos VIH-1 no-B, más comunes en otras latitudes. Algunos pacientes originarios del África Subsahariana también padecen infección por VIH-2 (o infección mixta por VIH-1 y VIH-2), que muestra patrones diferentes de mutaciones tras la exposición a ITIAN y es intrínsecamente resistente a los ITINN y enfuvirtida.
El objetivo terapéutico de la pauta de rescate frente a un fracaso virológico consiste en conseguir de nuevo la supresión viral mantenida (<50 copias/mL) mediante la instauración de un nuevo régimen de TAR con tres – o, al menos, dos – fármacos antirretrovirales activos, incluyendo como mínimo un fármaco de una nueva familia respecto al TAR previo. Los ITINN de primera generación se limitan a su uso en el tratamiento inicial, ya que en las pautas de rescate tienen menos actividad que otras familias de fármacos. El TAR de rescate debe realizarse lo más pronto posible tras fracaso virológico, para evitar el acúmulo de mutaciones de resistencia, la elevación de la CVP y el deterioro inmunológico. El éxito de eficacia del TAR de rescate será más probable si se verifica un recuento de linfocitos CD4+ ≥100 células/μL, una CVP basal inferior a 5 log10, no haber recibido previamente más de 10 fármacos antirretrovirales diferentes y disponer de dos o más fármacos activos en el nuevo TAR.
En la búsqueda del éxito de la pauta de rescate, el Documento de Consenso Gesida 2018 recomienda abordar varias estrategias:
- Establecer un TAR cómodo y bien tolerado (de escasa toxicidad) teniendo en cuenta las posibles co-morbilidades del paciente a fin de corregir las causas de la mala adherencia al tratamiento.
- Detectar las mutaciones de resistencias por métodos genotípicos, incluso aunque se disponga de determinaciones genotípicas en fracasos virológicos previos. La detección de resistencias feno y genotípicas es especialmente útil si la prueba se realiza mientras que el paciente recibe el TAR que ha fracasado, o en las primeras 4 semanas posteriores. Para algunos IP potenciados y etravirina se ha elaborado un índice ponderado de resistencia genotípica que cuantifica el impacto de cada mutación y es de utilidad para predecir la actividad de fármacos que potencialmente se incluirán en el TAR.
- Determinar el tropismo del VIH-1 por análisis genotípico en cada fracaso virológico (salvo si ya se ha documentado previamente un tropismo no-R5) cuando se plantea el uso de maraviroc o se espera resistencia múltiple.
- Revisar el historial farmacoterapéutico previo del paciente para identificar aquellos fármacos no tolerados o fracasos virológicos anteriores con fármacos de baja barrera genética.
Obviamente, sucesivos fracasos virológicos con acumulación de mutaciones de resistencia frente a las diferentes familias de fármacos antirretrovirales limitan las posibilidades de éxito de posteriores tratamientos, obligan al uso de regímenes más tóxicos, complejos y caros, y se asocian con mayor incidencia de progresión a SIDA y muerte.
En pacientes con fracaso virológico, darunavir (potenciado con ritonavir) es el IP que ha demostrado la mayor eficacia en todas las líneas de rescate y sería la primera opción en sujetos que no han recibido previamente IP y/o que habiéndolos recibido no presenten mutaciones primarias en la proteasa ni frente a darunavir. En el grupo de los INI, dolutegravir será el fármaco de elección en pacientes con fracaso virológico a los que no se ha tratado previamente con INI o ITINN, o incluso han fracasado previamente con otros INI (raltegravir o elvitegravir). El uso de tipranavir (potenciado con ritonavir), de enfuvirtida o de análogos de la timidina debe evitarse en pautas de rescate, quedando restringido a pacientes sin otras posibilidades terapéuticas.
Finalmente, no se recomienda suspender el TAR en pacientes con fracaso virológico avanzado y sin opciones terapéuticas de rescate, aunque reciban pautas con resistencia demostrada. En ese caso extremo, se recomienda usar fármacos que, en la medida de lo posible, disminuyan la capacidad replicativa viral y no seleccionen nuevas mutaciones de resistencia que comprometan futuros tratamientos (tales como lamivudina, emtricitabina o tenofovir), y se vigile de cerca los niveles de linfocitos CD4+ y la CVP. En pacientes sin posibilidades de TAR supresor, el manejo de la patología es complejo y la recomendación dirige a clínicos y virólogos expertos en tratamientos de rescate avanzado y opciones limitadas. Se debe valorar el acceso a fármacos de uso restringido que permitan construir un esquema no supresor temporal en espera de la disponibilidad de nuevos fármacos activos.
EL FUTURO DEL TRATAMIENTO
En 2018, se están desarrollando nuevos fármacos antirretrovirales, algunos de familias ya conocidas y otros que actúan sobre nuevas dianas. Aunque algunos aún están en fase de investigación, su potencial papel terapéutico puede enfocarse mayoritariamente a pacientes con fracaso virológico e infectados por virus resistentes a dos o más de las familias de fármacos y/o con limitadas opciones de rescate. Se pueden destacar los siguientes:
- Fostemsavir (GSK3684934): inhibidor del acoplamiento que está siendo evaluado en ensayos clínicos de Fase IIb y III. Por ejemplo, el estudio de fase IIb englobó un total de 251 pacientes con amplia experiencia en TAR (y disponibilidad de menos de 2 fármacos activos), sobre los que demostró una eficacia similar a atazanavir (potenciado con ritonavir) en la semana 48 (Thompson, 2017).
- Doravirina: nuevo fármaco del grupo de los inhibidores de la transcriptasa inversa no nucleosídicos (ITINN), recientemente autorizado por la FDA americana bajo el nombre comercial de Pifeltro®. En los ensayos de eficacia en pacientes naïve (aleatorizados, doble ciego y controlados por placebo), la monoterapia con doravirina demostró una notable actividad antirretroviral sin evidencia de resistencias, en general con buena tolerabilidad, mientras que, en regímenes de combinación con dos ITIAN, ha demostrado no-inferioridad frente a regímenes basados en darunavir (potenciado con ritonavir) y en efavirenz, con buen perfil de seguridad clínica y de interacciones. Se ha sugerido que podría convertirse en el fármaco de elección en el grupo de los ITINN en el TAR de inicio (Colombier, 2018).
- PRO 140: anticuerpo monoclonal humanizado que bloquea el correceptor CCR5, y que se encuentra en ensayos clínicos de fase III. Administrado por vía intravenosa o subcutánea, PRO-140 ha mostrado actividad frente a virus resistentes a maraviroc. Presenta, al igual que éste la limitación de ser activo exclusivamente frente a virus con tropismo CCR5. En ensayos clínicos de fase 2b, PRO 140 demostró gran potencial para ser empleado en monoterapia (vía subcutánea, una vez a la semana) por largos períodos de tiempo (de hasta 12 semanas) en pacientes con supresión viral estable con TAR previos (Dodhi, 2018).
- Ibalizumab: anticuerpo monoclonal humanizado que bloquea el receptor CD4 de los linfocitos. Ha finalizado ensayos clínicos de fase III, en que su administración intravenosa mostró eficacia antiviral sostenida (con perfil de tolerancia adecuado) durante 24 semanas en un total de 40 pacientes, empleado en combinación con una pauta de rescate optimizada. Se plantea como una opción interesante frente a virus multirresistentes (Bettiker, 2018). Este fármaco ha sido autorizado en marzo de 2018 por la FDA americana (Trogarzo®).
TRATAMIENTO EN SITUACIONES ESPECIALES
PACIENTES CON VIH-1 Y OTRAS PATOLOGÍAS CONCOMITANTES
En la bibliografía científica ha existido cierta controversia sobre el momento idóneo para iniciar el TAR en pacientes con una infección oportunista (Lawn, 2011). Entre las ventajas del inicio precoz del TAR sobresalen una recuperación inmune más rápida, una mayor resolución de la infección concomitante, la aparición de otras nuevas y la reducción del riesgo de mortalidad. Sin embargo, entre las desventajas se incluyen la potencial aparición de toxicidades e interacciones, así como del síndrome inflamatorio de reconstitución inmune (SIRI).
En primer lugar, en pacientes infectados por el VIH con tuberculosis, cualquiera que sea su recuento de linfocitos CD4+, parece claro que se debe iniciar el tratamiento antirretroviral durante el tratamiento de la tuberculosis, según la evidencia científica derivada de estudios clínicos (revisada en Tiberi, 2017). El momento óptimo de inicio del TAR sí que va a depender del recuento de linfocitos T CD4+ en cada paciente: en aquellos con cifras inferiores a 50 células/μL se debe iniciar el tratamiento en las dos primeras semanas del tratamiento de la tuberculosis (una vez comprobada la buena tolerancia a éste), mientras que en pacientes con cifras superiores a 50 células/μL puede retrasarse el TAR hasta que finalice la fase intensiva del tratamiento (sobre 8 semanas).
Estas recomendaciones permitirán reducir el riesgo de muerte y desarrollo de SIDA, especialmente en pacientes con recuentos linfocitarios más bajos, de aparición de efectos adversos y del síndrome inflamatorio de reconstitución inmune (SIRI). Si bien se desconoce el momento óptimo de inicio del TAR en pacientes con meningitis tuberculosa, se recomienda utilizar en este escenario los criterios anteriores.
En cuanto al TAR a emplear, el Documento de Consenso específico sobre este tema (Rivero, 2018) aconseja que, en pacientes con ambas infecciones que estén en tratamiento antituberculoso basado en rifampicina –que debe incluirse en el tratamiento siempre que sea posible–, se emplee la combinación de inicio de 2 ITIAN, tenofovir disoproxilo/emtricitabina o abacavir/lamivudina (dosis habituales), más efavirenz (600 mg/día), que es de elección como tercer fármaco en sujetos con tuberculosis. Como regímenes alternativos, se puede considerar la combinación de raltegravir (800 mg/12horas) con tenofovir disoproxilo/emtricitabina o con abacavir/lamivudina, o bien la combinación de dolutegravir (50 mg/12horas) con abacavir/lamivudina o con tenofovir disoproxilo/emtricitabina.
En situaciones especiales en que no se pueda administrar ninguno de los regímenes anteriores, se puede valorar la combinación de fármacos como maraviroc (600 mg/12horas) o nevirapina (dosis habituales), entre otros, con tenofovir disoproxilo/emtricitabina o con abacavir/lamivudina. Por riesgo de interacciones, no se puede coadministrar la rifampicina con otros ITINN (rilpivirina y etravirina), ningún IP potenciado con ritonavir (si el IP fuese la única opción de TAR, debe sustituirse rifampicina por rifabutina y realizar el ajuste posológico correspondiente), ni con elvitegravir. Las recomendaciones para el tratamiento de la tuberculosis multirresistente o extensamente resistente en pacientes con infección por VIH son las mismas que para la población VIH-negativa, revisando la compatibilidad de tratamientos.
En presencia de síndrome inflamatorio de reconstitución inmune (SIRI) no debe discontinuarse ni el tratamiento antituberculoso ni el antirretroviral, requiriéndose en las formas clínicas leves o moderadas de SIRI el empleo de antiinflamatorios no esteroideos o de corticosteroides en aquellos pacientes con manifestaciones clínicas moderadas-graves. La administración de prednisona (40 mg/día durante 2 semanas, más 20 mg/día durante 2 semanas más) ha demostrado la prevención del desarrollo de SIRI en personas con tuberculosis y <100 linfocitos CD4+/µL.
Con respecto a otras infecciones oportunistas diferentes de tuberculosis, son pocos los estudios aleatorizados y de cohortes que han evaluado el momento idóneo de inicio del TAR. Actualmente, ante cualquier infección oportunista concomitante (por ejemplo, neumonía por Pneumocystis jiroveci o criptosporidiosis), se recomienda de forma general iniciarlo lo antes posible, preferiblemente en los primeros 15 días tras el diagnóstico, con la excepción de la meningitis meningocócica, en que se recomienda diferir el comienzo del TAR cinco semanas por el riesgo incrementado de mortalidad asociada. Es importante recordar en este punto que en nuestro país disponemos de varios medicamentos (tales como Flebogamma Dif®, Gammagard S/D®, Hizentra®, Intratec®, Kiovig®, etc.) que contienen inmunoglobulinas inespecíficas y que tienen autorizada la indicación de tratamiento de reposición en pacientes con SIDA congénito con infecciones bacterianas recurrentes.
En España, las comorbilidades más relevantes que presentan los pacientes infectados por VIH, tanto por su frecuencia como por la rápida progresión a enfermedad hepática terminal que inducen, y por incrementar la hepatotoxicidad del TAR, son las hepatitis virales. A este respecto, en pacientes coninfectados por el virus de la hepatitis B (VHB) o por el virus de la hepatitis C (VHC), se recomienda siempre iniciar el TAR tan pronto como sea posible, con dos puntualizaciones importantes: i) en pacientes que precisan tratamiento de la hepatitis C, es generalmente preferible iniciar el TAR antes, vigilando la aparición de posibles reacciones adversas; y ii) en pacientes coinfectados por el VHB, se debe evitar interrumpir una pauta de tratamiento eficaz frente a este virus.
En principio, ante una función hepática normal, ningún fármaco antirretroviral presenta contraindicación de uso en casos de coinfección con VHB o VHC, pero se debe individualizar su elección dentro del TAR según la existencia de cirrosis hepática y priorizando en base a la menor hepatotoxicidad, que suele ser más intensa en pacientes coinfectados. A excepción de los dideoxinucleósidos y nevirapina, que pueden causar fallo hepático agudo y toxicidad crónica, el resto de principios activos utilizados actualmente se asocian con un bajo riesgo de hepatotoxicidad y pueden emplearse en pacientes con hepatopatía crónica que conservan la funcionalidad hepática. Por sus características farmacocinéticas, los INI presentan ciertas ventajas en esta comorbilidad, al no requerir ajustes posológicos.
Así, el Documento de Consenso Gesida 2018 recomienda rilpivirina o darunavir como fármacos de elección en sujetos coinfectados que presenten insuficiencia hepática leve/moderada (Child-Pugh A o B). En sujetos con mayor insuficiencia hepatocelular (Child-Pugh C), raltegravir y dolutegravir son de uso preferente, pues tampoco precisan ajuste de dosis; los IP potenciados, tales como atazanavir+ ritonavir y fosamprenavir+ritonavir, también pueden ser seguros en este escenario. Algunos autores recomiendan suspender todo el tratamiento en caso de hepatitis aguda sintomática – también asintomática si se sospecha de toxicidad mitocondrial o de una reacción de hipersensibilidad, o si se verifica intensa elevación de los niveles de transaminasas – y reintroducirlo una vez superado el problema.
Se han descrito numerosas interacciones farmacológicas entre los antirretrovirales y los antivirales de acción directa frente al VHC, salvo sofosbuvir, que pueden hacer necesaria un ajuste posológico o incluso desaconsejar la administración concomitante. En este sentido, bases de datos actualizadas con información pormenorizada sobre interacciones farmacológicas, como Bot PLUS, pueden ser de gran utilidad a la hora de optimizar un tratamiento con antivirales directos en un paciente ya sometido a TAR. En pacientes coinfectados por el VHB, el tratamiento anti-VIH se debe iniciar incluyendo tenofovir entre los 2 ITIAN: tenofovir disoproxilo o tenofovir alafenamida más emtricitabina o lamivudina.
En el caso de sujetos infectados por el VIH y que padecen insuficiencia renal crónica, los expertos recomiendan vigilar estrechamente la función renal (incluyendo función tubular en el caso de utilizar tenofovir) y, obviamente, evitar los fármacos nefrotóxicos. La evidencia disponible apunta a que resulta indispensable ajustar la dosis de la mayoría de los fármacos antirretrovirales de tipo ITIAN (salvo abacavir) y de maraviroc (si se emplea en combinación con inhibidores de CYP3A4), pero no se requiere tal ajuste en el caso de los ITINN, los IP, enfuvirtida, ni para raltegravir o dolutegravir (como representantes de INI).
Habrá que analizar las fichas técnicas de cada medicamento para verificar si requieren un cierto grado de funcionalidad renal (por ejemplo, cifras mínimas de tasa de filtración glomerular) o determinados ajustes posológicos para ser empleados con seguridad. Ante el riesgo de efectos adversos, se desaconseja el uso de coformulaciones de fármacos antirretrovirales en pacientes con insuficiencia renal significativa. En definitiva, si no existen contraindicaciones, se puede considerar de elección el uso conjunto de abacavir más lamivudina con un ITINN, un INI (raltegravir o dolutegravir) o darunavir potenciado con ritonavir.
Por último, el riesgo de inmunodepresión en pacientes con cáncer tratados con quimio o radioterapia es mayor, lo que de por sí justificaría el inicio del TAR. De hecho, éste se considera un pilar clave en el tratamiento de sarcoma de Kaposi y los linfomas no-Hodgkin. En general, en pacientes con otras neoplasias que se infecten por VIH, se debe iniciar el TAR lo antes posible. En estas comorbilidades, de forma más sensible si cabe, hay que valorar cuidadosamente el perfil de toxicidad de los antirretrovirales y las posibles interacciones farmacocinéticas con los fármacos antineoplásicos; por ejemplo, los IP potenciados se asocian a neutropenia más profunda y prolongada cuando se coadministran con la quimioterapia de los linfomas. Raltegravir, por sus características farmacológicas, excelente tolerancia y menor potencial de interacciones, será de elección en pacientes que reciban quimioterapia. Como alternativa a raltegravir se puede considerar el uso de dolutegravir.
MUJERES FÉRTILES Y EMBARAZO
A priori, el inicio y los objetivos del TAR son los mismos en las mujeres que en los hombres. En la asistencia sanitaria a mujeres infectadas por VIH en edad reproductiva debe primar el consejo pre-concepcional. La elección del TAR de inicio en la mujer fértil debe de tener en cuenta su deseo o el posible riesgo de embarazo y el uso de anticonceptivos orales (que interaccionan con muchos fármacos antirretrovirales), y deberán valorarse posibles ajustes posológicos y complementar la anticoncepción con un método de barrera (protección dual). Destaca también la mayor incidencia de exantema y hepatotoxicidad por nevirapina en mujeres, que condicionan modificaciones en su uso. En general, si una mujer infectada está bajo cierto régimen de TAR y se queda embarazada, debe mantenerlo siempre que sea bien tolerado y eficaz. En este sentido, se desaconseja la combinación de estavudina y didanosina debido al riesgo de acidosis láctica.
El Documento de Consenso para este grupo de población específica (Polo, 2018) recomienda realizar una prueba serológica de VIH a toda mujer embarazada y, si fuera negativa, debería repetirse en el tercer trimestre, principalmente en caso de que existan prácticas de riesgo. En mujeres que llegan al parto sin conocer su estado serológico, se aconseja realizar una prueba rápida, ya que la cesárea electiva – que se indica en la semana 38 en mujeres infectadas cuya CVP previa al parto es >1.000 copias/mL – reduce la transmisión materno-fetal un 50%.
Sea como fuere, igual que en cualquier otra persona, si el diagnóstico de infección por VIH se realiza durante el embarazo, se recomienda iniciar el TAR lo antes posible, dada la posibilidad de transmisión intrauterina. El objetivo del TAR en la embarazada es conseguir una CVP indetectable durante el mayor tiempo de gestación posible, sobre todo en el tercer trimestre y en el momento del parto. En general, el régimen antirretroviral debe incluir dos ITIAN que atraviesen la barrera placentaria, como zidovudina, lamivudina, emtricitabina, tenofovir o abacavir.
Previamente al inicio del tratamiento, se recomienda realizar una prueba de resistencias en todas las mujeres embarazadas con infección por el VIH-1. En base a los resultados obtenidos, se recomienda que el TAR de inicio preferente incluya tenofovir disoproxilo (o abacavir)/lamivudina (o emtricitabina)/raltegravir o atazanavir (potenciado con ritonavir) o darunavir (potenciado con ritonavir). En caso contrario, tras una valoración individualizada, podrán recibir cualquier combinación recomendada o alternativa de las recogidas en la Tabla 2. En base a la evidencia disponible, no se recomienda la combinación tenofovir disoproxilo/emtricitabina + lopinavir (potenciado con ritonavir).
En el embarazo se aconseja explícitamente la administración de zidovudina, que además deberá ser administrado al recién nacido tras el parto. De hecho, se recomienda el tratamiento intraparto con zidovudina por vía IV, independientemente del TAR que llevase o hubiese llevado la embarazada, si la CVP es >1.000 copias/mL o desconocida en el momento del parto.
Por último, se considera fundamental planificar el control de la CVP antes del parto ya que, como se ha indicado, puede ser necesaria una cesárea programada. Después del parto, las madres infectadas deben abstenerse absolutamente de lactar a sus hijos y deberán alimentarlos con una fórmula adaptada.
INFECCIÓN POR VIH-2
El virus de la inmunodeficiencia humana tipo 2 (VIH-2) posee una organización genómica similar al VIH-1 aunque presenta algunas diferencias estructurales que influyen significativamente sobre su patogenicidad y perfil de sensibilidad al TAR: presenta, por ejemplo, resistencia intrínseca a los ITINN y enfuvirtida, cuyo uso se contraindica para su tratamiento. Se transmite por las mismas vías que el VIH-1 y, por ello, es recomendable emplear sistemas de cribado de la infección por VIH capaces de detectar tanto VIH-1 como VIH-2, especialmente en pacientes procedentes de zonas geográficas con mayor prevalencia de este subtipo del virus (o parejas de personas de esta procedencia), como África Occidental.
En pacientes infectados por VIH-2, la decisión del momento de inicio del TAR y la combinación adecuada de fármacos (tanto de terapia inicial como de siguientes líneas) se ve dificultada especialmente por la falta de evidencia procedente de ensayos clínicos sobre tratamientos frente a este tipo viral; además, afectan otros motivos:
- La infección por VIH-2 tiene una historia natural más lenta y progresiva, con un período asintomático más largo. De forma óptima, el TAR debería comenzarse antes de que exista progresión clínica.
- No se dispone, en la actualidad, de pruebas comerciales para medir CVP ni resistencias genotípicas del VIH-2 (algunos laboratorios sí disponen de técnicas definidas). Además, los algoritmos genotípicos usados para predecir las resistencias farmacológicas del VIH-1 no son directamente aplicables.
- Cuando la enfermedad progresa, los pacientes presentan menor respuesta al TAR y menor ascenso de linfocitos CD4+.
A pesar de estas limitaciones, el Documento de Consenso Gesida 2018 establece que los principios generales del TAR en infección por VIH-2 (o en casos de infección dual por VIH-1/2) deben ser los mismos que se consideran para VIH-1, y que se deben asumir los mismos objetivos terapéuticos. En base a su perfil de sensibilidad farmacológica, el tratamiento de inicio en una infección por VIH-2 se debe basar en la combinación de 2 ITIAN más un INI o bien 2 ITIAN más 1 IP potenciado. En general, los INI (elvitegravir, raltegravir y dolutegravir) son activos frente al VIH-2, mientras que este virus presenta una sensibilidad variable frente a los IP, siendo lopinavir, saquinavir y darunavir los más activos. El uso de maraviroc se desaconseja por el tropismo específico de VIH-2, capaz de utilizar otros correceptores (como CXCR4) aparte del CCR5. Una vez iniciado el TAR, se aconseja la monitorización clínica del paciente y el contaje de linfocitos CD4+ cada 3-6 meses (según el estadio de la enfermedad), midiendo la CVP si fuera posible.
PROFILAXIS POSEXPOSICIÓN
Según diversas guías clínicas, la profilaxis posexposición ha demostrado ser beneficiosa en individuos sin diagnóstico confirmado que han sufrido un contacto de riesgo en las 72 horas previas tanto en casos ocupacionales como fuera de este entorno, debiendo recomendar su inicio lo antes posible, mejor en las 2-4 horas primeras y hasta las 24-36 horas. Esta profilaxis pretende prevenir la transmisión del VIH de una persona ya infectada a su pareja heterosexual y entre personas con otras prácticas de riesgo.
Preferentemente, la profilaxis posexposición se realiza con una triple terapia que ofrezca mayores probabilidades de éxito en la prevención del contagio, y en caso de producirse éste, disminuya la posibilidad de transmisión de VIH con mutaciones de resistencia. La combinación recomendada es la combinación de 2 ITIAN como tenofovir disoproxilo/emtricitabina, asociados a un tercer fármaco. Este tercer fármaco puede ser un IP (potenciado con ritonavir) o un INI. Por su mejor tolerancia y menor número de interacciones, en aras de maximizar la adherencia al tratamiento del individuo expuesto, se prefieren los IP. Entre los INI, serán de elección raltegravir o dolutegravir. Otras pautas alternativas de profilaxis posexposición pueden incluir tenofovir disoproxilo/lamivudina como combinación de ITIAN. Respecto a la duración de este tratamiento preventivo, se recomienda una pauta de 28 días, en base a resultados de estudios en modelos animales.
Para conseguir la optimización del tratamiento profiláctico, se ha sugerido la conveniencia de que los servicios sanitarios dispongan de un protocolo sobre las actuaciones y derivaciones a seguir en el caso de exposición al VIH-1, con disponibilidad de diagnóstico serológico rápido y con accesibilidad de 24 horas a los fármacos utilizados. Se debe valorar el caso fuente (VIH-1 confirmado o sospechoso), el estado serológico de la persona expuesta y las características de la exposición para indicar la profilaxis farmacológica. En caso de duda, se administrará la primera dosis y se valorará la necesidad de continuación a las 24-72 horas de iniciado el tratamiento. Esta estrategia preventiva debe completarse con el control del cumplimiento y tolerabilidad al tratamiento, así como con serología al VIH-1, VHB y VHC (estos en caso de fuente infectada o con sospecha) en los meses 1, 3 y 6 tras la exposición.
LAS VACUNAS ANTI-VIH: ESTADO ACTUAL
La aparición durante el siglo XX de diversas vacunas eficaces y seguras frente e numerosas enfermedades de etiología vírica ha sido el paradigma que ha guiado la investigación científica relacionada con la infección por VIH. Tras identificarse el agente causal del SIDA a principios de los años 80, y a pesar de los numerosos esfuerzos, no se ha conseguido una vacuna preventiva ni terapéutica ampliamente eficaz frente al VIH-1 que esté disponible para su uso actualmente.
En resumen, las vacunas preventivas se enmarcarían en el concepto tradicional de vacuna y supondrían la protección en personas sanas frente al contagio por VIH, para así frenar la propagación de la pandemia. La búsqueda de una vacuna preventiva eficaz constituye el objetivo último de este campo de la investigación, si bien por la complejidad observada hasta el momento para el virus, no se descarta la necesidad de administrar varias vacunas con acción complementaria para alcanzar un resultado de protección aceptable. Por otra parte, las vacunas terapéuticas buscan tratar a los pacientes ya infectados con el fin de potenciar su sistema inmunitario, teniendo en consideración que la producción fisiológica de anticuerpos neutralizantes por el propio sistema inmunitario de los pacientes infectados se considera como el mejor método de protección frente a la infección por el VIH.
El desarrollo de una vacuna frente al VIH tiene la complicación adicional, respecto a cualquier vacuna para otros virus o bacterias, de que el VIH actúa selectivamente sobre muchas de las células del sistema inmunitario implicadas precisamente en la producción de la respuesta inmunitaria. Además, el VIH presenta una extraordinaria variabilidad genética y una elevada tolerancia a las mutaciones, todo lo cual le confiere una gran capacidad para evadir la respuesta inmunitaria natural, facilitando la persistencia viral. Por si todo esto fuera poco, se debe añadir que las dos glucoproteínas de la cubierta viral, la gp120 y la gp41, que constituyen las principales dianas para los anticuerpos neutralizantes, están protegidas parcialmente por un escudo de N-glucanos entrelazados junto con otras estructuras que dificultan el acceso de los anticuerpos a las zonas de unión neutralizante (epítopos) de dichas glucoproteínas.
Afortunadamente, en los últimos años, se han comenzado a vislumbrar ciertas debilidades en este escudo protector de la cubierta viral, susceptibles de ser utilizadas en el diseño de vacunas específicas anti-VIH. Por otro lado, resulta interesante que el suero procedente de algunos pacientes seropositivos ha mostrado una potente capacidad neutralizante del VIH, lo que parece indicar la existencia de algún mecanismo inmunitario específico, aún por esclarecer, capaz de enfrentarse con eficacia a la invasión viral. Concretamente, los linfocitos B – que no son objetivo preferente del VIH – podrían ser estimulados para provocar la respuesta frente al VIH.
Uno de los motivos que podrían justificar la ausencia actual de vacunas eficaces frente al VIH es la disgregación del esfuerzo investigador desde su inicio, frente a lo cual se han desarrollado iniciativas de coordinación como la creación, a finales de la primera década del siglo XXI, de la Coalición Mundial para las Vacunas contra el VIH y de la Coalición de Activismo en Vacunas contra el Sida, que hicieron un llamamiento para acelerar y aunar los esfuerzos a fin de probar nuevos candidatos a vacunas en ensayos de gran tamaño, apuntando como prioridades máximas conseguir una mejor integración, dentro de los nuevos estudios, de la última información proveniente de la ciencia básica, de estudios preclínicos y de ensayos clínicos, así como de otras áreas de la investigación científica. En nuestro país, por ejemplo, la Red Española de Investigación en SIDA (REDRIS) tiene un programa específico de coordinación y puesta en común de conocimientos para el desarrollo y evaluación de vacunas frente al VIH (https://www.redris.es/web/guest/programa-5#program-teams-section).
El fracaso en 2007 de un candidato de vacuna contra el VIH basada en un vector adenovirus supuso un duro golpe para el proceso, provocando el cuestionamiento de los principios básicos de la investigación en este campo. Aún hoy existe cierta incertidumbre respecto a importantes cuestiones como los cambios en el sistema inmunitario que, tras la vacunación, se correlacionan con la protección frente al VIH, o los mecanismos a través de los cuales el sistema inmunitario protege frente a la infección por VIH en determinadas personas, lo que además ha limitado sobremanera la comparabilidad de los resultados entre estudios preclínicos con lo acontecido en ensayos clínicos. Hay que tener en mente, además, que un ensayo clínico de confirmación de eficacia y seguridad (fase III) fácilmente supera los 100 millones de dólares de coste, por lo que se entiende la dificultad de plantear nuevos ensayos si no se comprenden profundamente los conceptos fundamentales a nivel molecular del VIH.
Con todo y con ello, el panorama científico de la investigación en vacunas contra el VIH ha cambiado mucho en los últimos años, a medida que nuevas estrategias preventivas hacían su aparición. A pesar de que no se han autorizado vacunas para uso fuera de ensayos clínicos, en la actualidad se realizan diversos estudios de vacunas experimentales para prevenir y tratar la infección, algunos de los cuales han arrojado y están arrojando resultados interesantes.
De los seis ensayos clínicos finalizados hasta 2017 para evaluar la eficacia de vacunas frente al VIH-1 (Vax 003, Vax 004, STEP HVTN502, Phambili HVTN503, RV144 y HVTN505), que han sido analizados en una reciente revisión (Hsu, 2017), sólo uno de ellos demostró eficacia. Se trata del estudioRV144, realizado en Tailandia sobre hombres y mujeres considerados como población de riesgo (un total de 16.000 voluntarios), y que en 2009 marcó un hito en la búsqueda de vacunas anti-VIH al determinar, por primera vez, la eficacia de una vacuna preventiva contra el virus, algo de cuya consecución se llegó a dudar (Rerks-Ngarm, 2009).
Los resultados iniciales mostraron que las personas vacunadas con una régimen combinado de tipo inducción/refuerzo de dos vacunas (AIDSVAX B/E gp120 y ALVAC-HIV – vCP1521, un vector de tipo canarypox virus –) tuvieron un riesgo un 60% menor de infectarse por VIH que las que recibieron placebo; sin embargo, al finalizar el periodo de seguimiento, la eficacia apreciada se había reducido a un 31%, en un análisis de los datos por intención de tratamiento modificado6, si bien no se considera, en general, el más riguroso. Los sub-análisis posteriores también incluyeron los enfoques por intención de tratamiento7 (se considera el más riguroso) y por protocolo8, y sugirieron, aunque sin poder estadístico, que la vacuna ensayada funcionó mejor en personas con poco riesgo de infección. Los tres análisis coincidían en apuntar hacia la misma tendencia protectora en el régimen de vacunación, pues, en todos los casos, se observaron menos infecciones en el brazo de vacuna que en el de placebo.
Sin embargo, la vacuna no pareció ejercer ningún efecto sobre la carga viral de las personas que se infectaron pese a la vacunación; además, las respuestas inmunitarias de anticuerpos neutralizantes (uno de los objetivos buscados en la vacunación preventiva) fueron relativamente débiles y la presencia de anticuerpos no neutralizantes se relacionó con la protección. La aparición del anticuerpo inmunoglobulina A (IgA) dirigido contra la proteína de la cubierta del virus se relacionó con una menor eficacia protectora de la vacuna, mientras que la presencia en plasma de anticuerpos monoclonales dirigidos a las regiones variables 1 y 2 (V1V2) del virus estuvo relacionada con una mayor protección. En definitiva, a pesar del interés desde el punto de vista científico, los resultados del estudio RV144 no tuvieron la relevancia suficiente como para justificar la aprobación del régimen de vacunación ensayado.
En base a los resultados de ese estudio RV144, los progresos en vacunas con un enfoque similar de inducción/refuerzo – que tienen el objetivo de generar un conjunto más fuerte y variado de respuestas por parte de las distintas partes del sistema inmunitario – han sido lentos, pero finalmente desembocaron en el lanzamiento de nuevos estudios clínicos de eficacia (por ejemplo, se inició el estudio de eficacia HVTN702 en Sudáfrica en 2016, aún en marcha). La intensa búsqueda de una vacuna efectiva a nivel mundial condujo al desarrollo nuevas estrategias (Excler, 2016), como la combinaciones de inmunógenos con diseño de mosaico (por ejemplo, adenovirus tipo 26 (Ad26)/Vacuna de Ankara modificada (MVA)/gp140) que comenzaron a evaluarse en estudios de eficacia a mediados de 2017 y las vacunas vectorizadas con citomegalovirus (CMV) que iniciaron estudios de fase I al mismo tiempo.
A colación de lo anterior, conviene puntualizar que en los estudios clínicos actualmente se valoran dos principales mecanismos protectores para conseguir la inducción de anticuerpos funcionales contra la región V1V2 de la envuelta del VIH: generación de inmunidad protectora a través de anticuerpos ampliamente neutralizantes (bnAb, broadly neutralizing antibodies) e inducción de anticuerpos funcionales (no neutralizantes pero con otras posibles funciones antivirales). La inmunización pasiva usando anticuerpos ampliamente neutralizantes ha entrado en ensayos de fase II, y los anticuerpos funcionales se están evaluando en el presente, por ejemplo, mediante el citado ensayo de eficacia HVTN702. En cambio, la inducción de los mismos usando miméticos del trímero natural Env o diseños de vacunas basadas en células del linaje B están aún en fase pre-clínica (Hsu, 2017).
Parece evidente, por tanto, que con la optimización de todas estas estrategias preventivas, y a pesar de que aún no se ha producido ninguna autorización para su uso en individuos sanos, el futuro de las vacunas anti-VIH nunca ha sido tan prometedor. Es previsible que en los próximos años aparezcan nuevos resultados de los diversos ensayos clínicos que se desarrollan actualmente, con mayores probabilidades de ser favorables. A modo de resumen, se pueden destacar algunos de los estudios que se han realizado recientemente o que están en progreso:
Estudio APPROACH
Se trata de un estudio que evaluó ciertos candidatos de vacunas basadas en un vector de tipo adenovirus serotipo 26 (Ad26) como portador de un mosaico antigénico9, en paralelo tanto en humano como en monos Rhesus, a fin de definir el régimen óptimo de vacunación. El estudio clínico desarrollado a lo largo de 2015 fue multicéntrico, aleatorizado, doble ciego y controlado por placebo, de fase I/IIa, e involucró inicialmente a un total de 393 sujetos sanos de entre 18 y 50 años de edad, considerados como de bajo riesgo de infección, de diversos centros de Sudáfrica, Ruanda, Uganda, Tailandia y Estados Unidos; estos voluntarios recibieron aleatoriamente, por vía intramuscular a lo largo de 48 semanas, un total de 4 dosis de uno de los siete regímenes de vacunación experimentales o de placebo. El estudio demostró que todos los regímenes de tipo mosaico ensayados eran bien tolerados – el efecto adverso más frecuente fue dolor en el punto de inyección – y capaces de generar una respuesta inmunitaria frente al VIH en sujetos sanos (Borouch, 2018).
De forma interesante, la vacuna que demostró la mayor protección en estudios preclínicos en monos (protección final del 67% frente a la exposición por vía rectal a una cepa de un virus híbrido entre el VIH y el virus de la inmunodeficiencia símica), fue también la que generaba la mayor inmunogenicidad en humanos, si bien ambas respuestas se reducían con el tiempo. Esta vacuna – de tipo mosaico Ad26 prime/Ad26 (que portaba fragmentos de ARN de los genes env y de gag/pol, procedentes de distintos tipos de VIH, potenciada con altas dosis de antígeno de la gp140 de la cápside viral – indujo respuestas de anticuerpos de unión específica frente a Env (100% de los casos) y respuestas de fagocitosis celular dependiente de anticuerpos (80%) en la semana 52, y respuestas de células T (83%) en la semana 50; esto refleja que, en la mayoría de los casos, fueron estimuladas las dos ramas del sistema inmunitaria.
A pesar de que se comprobó que no se generaba una respuesta fuerte de anticuerpos ampliamente neutralizantes, las respuestas de los anticuerpos observadas fueron capaces de provocar la actuación de otros componentes del sistema inmunitario para eliminar las células infectadas por el VIH. En todo caso, dicha respuesta no indica necesariamente que la vacuna sea capaz prevenir el contagio por VIH, lo cual se evaluará en los ensayos de eficacia posteriores. Por el momento, el mencionado régimen vacunal – vacunación de inducción basada en vectores virales administrada en las semanas 0 y 12, y dos dosis de refuerzo basadas en la proteína gp140 administradas a las semanas 24 y 48 – ha entrado a un ensayo clínico de fase 2b más amplio (https://clinicaltrials.gov/ct2/show/NCT03060629), que se desarrolla en población femenina no-infectada, pero considerada de riesgo, de países del África subsahariana.
Estudio TRAVERSE
Es un ensayo clínico de fase I/IIa en marcha que pretende comparar la capacidad inmunógena y protectora de dos tipos de vacunas que contienen mosaicos de tres antígenos – trivalentes – frente a mosaicos de cuatro antígenos – tetravalentes –, respectivamente, basados ambos en vectores adenovirus Ad26 como portadores de fragmentos de ARN de env y gag/pol. El régimen de vacunación de inducción/refuerzo incluye dos administraciones de inducción a los 0 y 3 meses, más dos dosis posteriores de refuerzo a los meses 6 y 12 (que incluyen antígeno de la gp140).
Sus resultados preliminares, referentes a un análisis de datos de seguridad e inmunogenicidad en 198 participantes de EEUU y el este de África, cuatro semanas después de la primera administración de refuerzo, han sido publicados en el encuentro científico HIV Research For Prevention (HIVR4P) celebrado en Madrid a finales de octubre de 2018 (Stieh, 2018). Ambas vacunas presentan buena tolerabilidad, con efectos adversos moderados o leves. La vacuna tetravalente ejerció un incremento significativo de la respuesta en pruebas de ELISA10; de hecho, dio lugar a tasas de respuesta inmunitaria humoral de casi el 100% en los ensayos humorales funcionales y de unión, con una producción de anticuerpos frente a Env significativamente superior a la vacuna trivalente. Los resultados se comparan favorablemente con el estudio APPROACH y apoyan el empleo de la vacuna tetravalente (Ad26. Mos4. HIV) en futuros ensayos clínicos.
Otros trabajos
En la última conferencia sobre el SIDA que tuvo lugar en Ámsterdam en julio del presente año, se han presentado algunos estudios que revelan los últimos avances la investigación sobre vacunas anti-VIH (22nd International AIDS Conference Abstract Supplement, 2018). Cabe destacar, por ejemplo, la potenciación de la eficacia vacunal que ha mostrado un compuesto mimético de CD4 de molécula pequeña, BNM-III-170, que se une a la gp120 de la envuelta del VIH-1 y promueve cambios conformacionales similares a los inducidos por CD4, exponiendo las glicoproteínas a la acción de los anticuerpos. En un estudio en monos, su administración concomitante con una vacuna basada en antígenos de la envuelta viral (gp120) demostró incrementar significativamente la eficacia de los anticuerpos neutralizantes inducidos por éstas, presentando esta estrategia como una posibilidad en la prevención de la transmisión sexual del VIH (Madani, 2018).
Se ha sugerido, por otro lado, que la generación de nanopartículas específicas puede aportar ciertas ventajas y ser eficaz en la presentación de antígenos virales en estrategias de vacunación destinadas a aumentar y ampliar las respuestas de anticuerpos neutralizantes contra proteínas de la envoltura viral, según se ha comprobado en ensayos in vitro y en modelos animales (Brouwer, 2018). Se están evaluando, incluso, vías de administración de vacunas diferentes a las parenterales (como la oral o sublingual) en estudios preclínicos, con resultados de respuesta inmunitaria interesantes (Jones, 2018).
Aun cuando no se dispone de vacunas para prevenir ni curar la infección por el VIH, las personas que la padecen se pueden beneficiar de las vacunas contra otras numerosas enfermedades. A este respecto, por ejemplo, el Documento de Consenos Gesida 2018 recomienda la vacunación en pacientes infectados por el VIH frente a los virus de hepatitis A y B (si no se han vacunado con anterioridad), a poder ser cuando la carga viral sea indetectable y la cifra de linfocitos CD4 >200 células/µL, aunque en estos pacientes las vacunas disponibles frente a esos virus se han mostrado menos eficaces que en población general.
EL PAPEL ASISTENCIAL DEL FARMACÉUTICO
Teniendo en consideración la calificación otorgada por parte de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) a todos los medicamentos (más de 200 presentaciones) aprobados frente a la infección por VIH como de “Uso Hospitalario” – y, por tanto, de dispensación exclusiva por los servicios de farmacia de hospitales – la implicación de los farmacéuticos especialistas en farmacia hospitalaria en la atención a pacientes VIH positivos cobra quizá especial relevancia.
Con la integración de los farmacéuticos en los equipos multidisciplinares y de gestión a nivel de hospitales, el papel asistencial del farmacéutico hospitalario ha ido tomando cada vez más peso. Aunque a continuación se tratarán algunas de ellas en detalle, se pueden enfocar sus principales líneas de actuación en el abordaje al paciente con VIH en cuatro vertientes:
I. Promoción de la adherenciaal TAR.
II. Información al pacientesobre: a) los medicamentos – incidiendo sobre su objetivo y mecanismo, las peculiaridades de conservación (si las hubiera), el momento óptimo de administración, la posibilidad e importancia de interacciones con otros medicamentos (incluidos los de automedicación), etc. –; y b) su pauta de administración – se puede aconsejar la adaptación de la toma coincidiendo con eventos cotidianos o aportar diagramas que ayuden a relacionar la medicación con hábitos de vida –. Todo ello se englobaría dentro de la correcta dispensación de los antirretrovirales, adaptada al caso de una primera dispensación en TAR de inicio o de dispensación de continuación.
III. Educación sanitaria y recordatorio de medidas higiénico-dietéticas.
IV. Optimización de la terapia farmacológica: vigilancia ante posibles reacciones adversas (y, en su caso, notificación al Sistema Nacional de Farmacovigilancia), e identificación y prevención de interacciones y situaciones de contraindicación del TAR.
V. Comunicación con el resto del equipo multidisciplinar para aportar información relevante al equipo clínico sobre los medicamentos, participando de la actualización de protocolos de actuación interdisciplinar, del control de los costes del TAR, y del análisis y resolución de problemas relacionados con el uso de medicamentos por parte de pacientes concretos.
El desarrollo de procedimientos y herramientas para registrar el seguimiento de los pacientes o para evaluar la adherencia, y la implantación de medios de comunicación e información con otros profesionales, entre otros factores, han permitido simplificar el TAR, mejorar su cumplimiento global y reducir la posibilidad de selección de resistencias.
En el ámbito de sus competencias, desde la farmacia comunitaria, el profesional farmacéutico también puede – y debe – participar en la atención sanitaria a sujetos con VIH. Si bien, por el momento, el farmacéutico comunitario no procede con la dispensación de los medicamentos antirretrovirales, sí entrará en contacto con la mayoría de pacientes que normalmente no están hospitalizados y acudirán a la oficina de farmacia para para retirar otros medicamentos relacionados – o no – con el TAR. En esas circunstancias, su margen de actuación es muy importante y se puede orientar a varios objetivos:
I. Incidir en la educación sanitaria a los pacientes infectados con VIH para evitar prácticas que impliquen riesgo de transmisión viral, y promover métodos profilácticos en la población general. Aquí se incluirían, por ejemplo, los programas de intercambio de jeringuillas para los usuarios de drogas por vía parenteral y de dispensación de metadona para ayudar a la deshabituación, así como las campañas de promoción de prácticas sexuales seguras (como el uso del preservativo masculino y femenino) para la prevención de la transmisión.
II. Contribuir al diagnóstico precoz de la infección por VIH, especialmente en población de riesgo, mediante la dispensación del test de autodiagnóstico con la aportación de las pertinentes recomendaciones psicosociales, así como la explicación del modo de uso e interpretación de resultados. La participación en programas autonómicos de detección precoz del VIH (y de otras infecciones de transmisión sexual, como la sífilis) se encamina también hacia este objetivo.
III. Reincidir en la promoción de la adherencia al TAR, y reforzarla en su caso, así como en la prevención e identificación de posibles problemas relacionados con el uso del TAR, como pueden ser interacciones farmacológicas y efectos adversos.
ADHERENCIA AL TRATAMIENTO ANTIRRETROVIRAL
Definida como la capacidad del paciente para implicarse correctamente en la elección, inicio y cumplimiento del tratamiento para conseguir una supresión mantenida de la replicación viral, una adherencia que sea incorrecta o escasa constituye la primera causa de fracaso terapéutico en infección por VIH. Son muchos los factores que se asocian a una mala adherencia, pudiendo clasificarse en tres tipos:
- Relacionados con el paciente: falta de apoyo social y/o familiar, falta de recursos, bajo nivel educativo, rechazo del diagnóstico o del TAR, olvidos, falta de formación acerca de la enfermedad y su tratamiento, temor a los efectos adversos del tratamiento (falta de percepción de la relación riesgo/beneficio), deterioro neurocognitivo o abuso de drogas.
- Relacionados con el tratamiento: efectos adversos, complejidad terapéutica, número de dosis diarias, falta de adaptación a las preferencias del paciente, dificultad o sensación desagradable en la administración (por ejemplo, tamaño o sabor de los comprimidos).
- Relacionados con el equipo asistencial: falta de coordinación entre los profesionales implicados, falta de formación específica, escasez de recursos y de accesibilidad, o mala comunicación sanitario-paciente.
Así pues, resulta esencial que el paciente sea consciente de su enfermedad, entienda el objetivo del tratamiento y la importancia de tomar la medicación de forma adecuada y continua y se sienta implicado tanto en la decisión de iniciarlo como en su cumplimiento. Indudablemente, a ello ayudarán el apoyo emocional de familiares y personas cercanas y la capacidad para incluir la medicación en las actividades de la vida diaria.
El Documento de Consenso Gesida 2018 recomienda que, antes de iniciar el TAR, se debe preparar al paciente, identificando y corrigiendo causas que puedan dificultar su adherencia, pudiendo incluso valorarse retrasar el inicio si se concluyera que el paciente no está preparado. Una vez iniciado, se recomienda evaluar la adherencia al TAR en un control a las 2-4 semanas, corrigiendo, si fuera preciso, los factores asociados al tratamiento o al paciente que estén limitando esa adherencia. Ante una adherencia inicial adecuada, ésta debe monitorizarse y reforzarse desde el equipo multidisciplinar, aprovechando las visitas clínicas, con participación activa del farmacéutico hospitalario junto a médicos, personal de enfermería, psicólogos, etc.
Desde el servicio de farmacia, es conveniente evaluar la adherencia empleando más de un método, como la entrevista, el recuento de medicación sobrante, los cuestionarios estructurados (por ejemplo, el cuestionario SMAQ o el cuestionario SERAD, específico para el TAR) y el registro de la dispensación. Si se detecta falta de adherencia, se debe intervenir para corregirla, insistiendo en la adherencia óptima del 100% incluso en pacientes con viremia indetectable, pues en caso contrario se han observado elevaciones de biomarcadores inflamatorios (Castillo, 2016). En la detección de una mala adherencia, así como en el refuerzo de la misma, el papel del farmacéutico comunitario como parte del equipo multidisciplinar es también clave, pues los pacientes que tienen infección por VIH visitan probablemente la oficina de farmacia en muchas más ocasiones que las que acuden al hospital a controles clínicos y a retirar su medicación.
Para alcanzar una buena adherencia, es indispensable que el paciente comprenda que niveles sub-terapéuticos de fármacos antirretrovirales conllevan el desarrollo de resistencias, y que hay una relación directa entre falta de adherencia al TAR, el fracaso virológico y un empeoramiento clínico. Sin embargo, algunas de las pautas usadas actualmente frente al VIH son más permisivas con un cumplimiento sub-óptimo. Así, en pacientes con irregular adherencia, se prefiere el uso de pautas que incluyan fármacos con elevada barrera genética, como los IP (y preferentemente darunavir) potenciados con ritonavir, frente a las basadas en ITINN, pues se consigue limitar la selección de resistencias. Si existe riesgo de interacciones con los IP, se preferirá la administración del INI dolutegravir, que se ha demostrado efectivo incluso en casos de resistencia a otros INI.
Parece evidente que la coformulación de varios principios activos antirretrovirales a dosis fijas en un solo medicamento es la herramienta más eficaz para el objetivo de simplificar el TAR y prevenir la falta de adherencia a alguno o todos los componentes de la pauta terapéutica. El uso de regímenes completos en comprimido únicodiariose ha mostrado clave para conseguir una adherencia constante y se ha relacionado, de hecho, con menores tasas de ingresos hospitalarios y costes globales (Cohen, 2013). En la Tabla 3 se muestran los principales medicamentos autorizados en España que incluyen combinaciones de fármacos antirretrovirales, que emergen como posibilidades de mejora de la adherencia al TAR. No se muestran los medicamentos genéricos, de los que se dispone para las combinaciones abacavir/lamivudina, efavirenz/emtricitabina/tenofovir disoproxilo, emtricitabina/tenofovir disoproxilo o lamivudina/zidovudina.
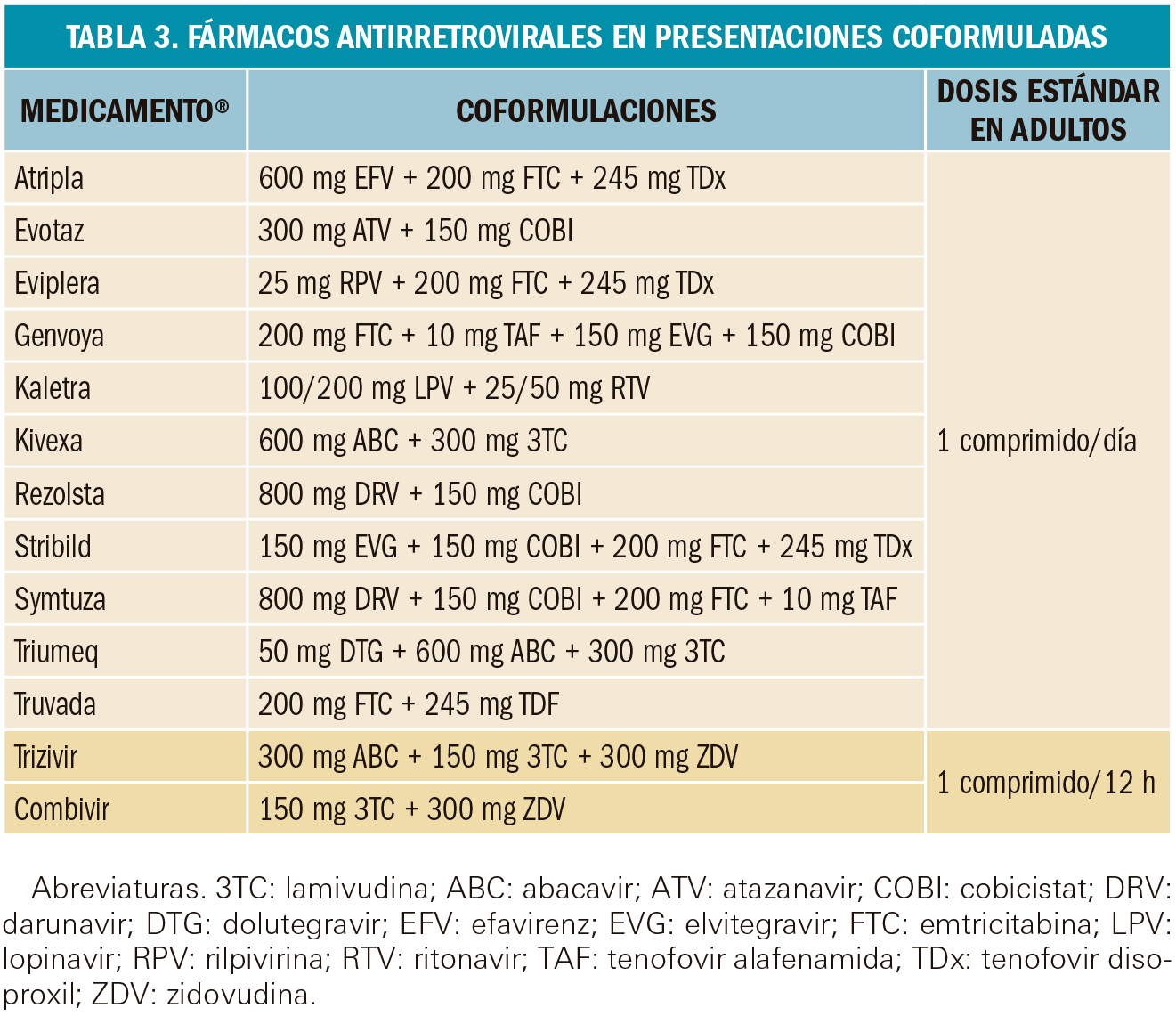
Otras estrategias que se han asociado a una mejora de la adherencia y que, por tanto, se pueden considerar coste-efectivas, incluyen: el envío de mensajes recordatorios, la terapia cognitiva, las intervenciones educativas y de soporte, o la identificación y corrección de factores de riesgo como el uso de marihuana o drogas recreacionales asociadas al sexo. La estrategia del tratamiento directamente observado ha demostrado, como en el caso de la tuberculosis, mejorar los resultados del tratamiento con una adherencia >95%, si bien los beneficios no se mantienen a largo plazo cuando cesa la observación. Por último, en pacientes polimedicados, el empleo de sistemas personalizados de dosificación puede tener un impacto positivo sobre la adherencia.
La superlativa importancia de la adherencia al TAR se pone de manifiesto si se considera que, a pesar del arsenal terapéutico disponible, un alto porcentaje de pacientes infectados fracasan relativamente rápido al primer tratamiento y que la segunda línea de TAR normalmente aporta peores resultados. A la espera de la llegada de nuevos fármacos y estrategias de tratamiento en un futuro, la forma de atajar actualmente el problema de las resistencias virales consiste en combinar fármacos con distintos mecanismos, por lo que el cumplimiento estricto a ese tratamiento es trascendental.
Las revisiones sistemáticas más recientes que han evaluado la adherencia al TAR apuntan a que ésta sigue siendo insuficiente (Iacob, 2017). Se han descrito datos de adherencia entre el 27% y el 80%, variable en función del grupo de población estudiada, pero que aún se mantienen alejados del 95% que se requeriría como nivel óptimo de adherencia. El cambio a un régimen posológico de una vez al día es una de las formas de simplificación más atractivas en pacientes virológicamente suprimidos (CVP <50 copias/μL) con pautas terapéuticas complejas (dos o más veces al día).
De hecho, un meta-análisis que revisó 35 estudios publicados entre 2005 y 2014 confirmó que se evidencia una adherencia significativamente mayor en pacientes con un régimen basado en un único comprimido y en una única toma diaria frente a cualquier otro régimen multi-dosis (Clay, 2015), por lo que se erige como el método más sencillo para mejorar la adherencia al TAR. Otra alternativa prometedora a futuro en esta línea es la administración parenteral cada 1-3 meses de antirretrovirales de larga duración (específicamente dolutegravir y rilpivirina), que ayudaría a simplificar sobremanera el TAR. Esta opción se encuentra aún en desarrollo, si bien parece no provocar efectos adversos significativos (Llibre, 2017).
A pesar de los beneficios sobre la adherencia que aporta la simplificación del tratamiento, resulta crítico seleccionar adecuadamente a los pacientes en cuyo TAR se puede intervenir en este sentido, pues no se puede realizar a costa de la pérdida de eficacia virológica, y sólo se puede plantear si no ha existido un fracaso virológico previo y si se utilizan fármacos plenamente activos (con ausencia de mutaciones de resistencia) para mantener el éxito virológico. Los candidatos para la simplificación terapéutica son aquellos pacientes con supresión vírica prolongada (≥6 meses), adherencia previa >90%, y sin coinfección por VHB.
Sin embargo, existen numerosos matices y excepciones a tener en cuenta:
- El cambio de una pauta que incluya 2 ITIAN más atazanavir o lopinavir o darunavir (todos los IP potenciados con ritonavir) a terapia dual con un único ITIAN, como lamivudina/atazanavir (potenciado con ritonavir) o lamivudina/darunavir (potenciado con ritonavir), es una opción para evitar o prevenir los efectos adversos debidos a los ITIAN.
- El cambio a dolutegravir y rilpivirina desde pautas que contienen 2 ITIAN e IP, ITNN o INI es seguro virológicamente al menos hasta las 48 semanas de seguimiento, y constituye una opción efectiva de simplificación del régimen en pacientes que así lo deseen o quieran evitar efectos adversos debidos a su pauta actual.
- El cambio a monoterapia con dolutegravir no es seguro virológicamente y no se recomienda.
- Por un mayor riesgo de rebrote virológico respecto a la terapia dual darunavir (potenciado con ritonavir)/lamivudina, la monoterapia con darunavir (potenciado con ritonavir) debe ser considerada como una opción excepcional, siempre que el paciente cumpla los mismos criterios que para la terapia dual.
- No se recomienda simplificar un IP potenciado por ritonavir a abacavir si el paciente ha recibido previamente tratamientos subóptimos con un ITIAN. Se contraindica la simplificación a abacavir/tenofovir disoproxilo/lamivudina o tenofovir/didanosina.
En definitiva, las intervenciones múltiples sobre la adherencia (mediante educación conductual del paciente y las distintas estrategias comentadas) son más efectivas que las únicas aunque, en general, el efecto es modesto y disminuye con el tiempo.
IDENTIFICACIÓN Y PREVENCIÓN DE PROBLEMAS RELACIONADOS CON EL USO DEL TAR
VIGILANCIA ANTE POSIBLES REACCIONES ADVERSAS
A la hora de instaurar por primera vez el TAR, se deben evitar los fármacos que puedan reagudizar o empeorar enfermedades preexistentes en el paciente. Durante las primeras 2-4 semanas de tratamiento se debe monitorizar estrechamente la tolerabilidad y las reacciones adversas inmediatas tras tratamiento, especialmente en pacientes con comorbilidades predisponentes y tratados con otros fármacos que pudieran dar lugar a interacciones clínicamente significativas. Para ello, resulta fundamental el contacto y la colaboración entre el paciente y los profesionales sanitarios, incluyendo tanto al farmacéutico hospitalario – que forma parte del equipo multidisciplinar que prescribe y dispensa el medicamento antirretroviral – como al farmacéutico comunitario – que, por su privilegiada posición de cercanía al paciente ambulatorio puede ser conocedor de las comorbilidades o medicación concomitante de un sujeto concreto y será capaz de detectar reacciones adversas de reciente aparición –.
En general, tal y como se ha venido apuntando en apartados anteriores del presente documento, las manifestaciones más relevantes de toxicidad aguda clínicamente relacionadas con el TAR se relacionan con la toxicidad mitocondrial, las reacciones de hipersensibilidad, la hepato y nefrotoxicidad, la dislipemia, los trastornos neuropsiquiátricos, la lipodistrofia y la osteoporosis. Las reacciones adversas que aparecen en primer lugar suelen afectar al aparato digestivo, piel y mucosas o esfera neuropsicológica, si bien son, en principio, esperables y fáciles de controlar.
Los efectos adversos tardíos son menos previsibles: pueden llegar a potenciar los síntomas de las enfermedades crónicas propias del envejecimiento del paciente con VIH, aunque el peso relativo que tienen en esta aparición es pequeño y siempre inferior a los beneficios del TAR; los factores de riesgo clásicos, como el tabaco, el alcohol o drogas, la dieta o el sedentarismo, afectan más que los fármacos a la aparición de estas patologías. Si el efecto adverso es de gran intensidad o su presentación es prolongada, se debe valorar el cambio de los fármacos potencialmente implicados. A modo de resumen, en la siguiente Tabla 4, se recogen las principales reacciones adversas asociadas a cada principio activo.
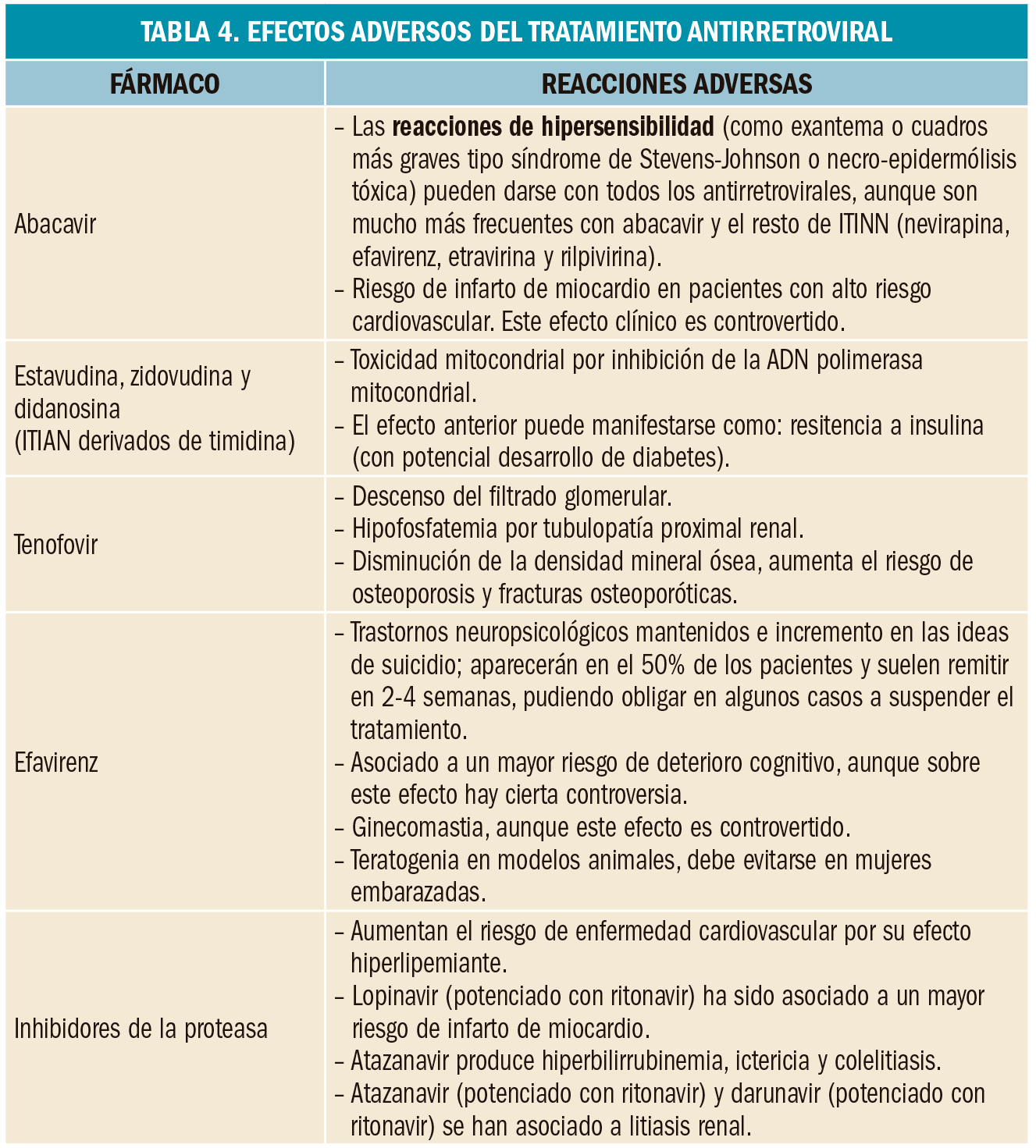
La nefrotoxicidad debe considerarse especialmente si el paciente presenta otros factores de riesgo, tales como insuficiencia renal previa o concomitante, diabetes, hipertensión arterial, necesidad de otros fármacos nefrotóxicos, edad avanzada, bajo peso corporal o cifras bajas de CD4+. En este sentido, los fármacos más nefrotóxicos son el tenofovir, que puede inducir toxicidad renal transitoria en algunos pacientes (suele revertir al suspender el fármaco), y en menor medida, indinavir y atazanavir, que pueden producir nefrolitiasis por depósito tubular de cristales. Se recomienda hacer un estudio elemental de orina con proteinuria y calcular la tasa de filtrado glomerular renal antes de iniciar el tratamiento, en la primera visita y anualmente, si no hay factores de riesgo, o cada 6 meses si los hubiera. En pacientes en tratamiento con tenofovir, se recomienda vigilar más estrechamente la función renal, pues no se debe emplear en pacientes con insuficiencia renal aguda o causada por el propio fármaco.
Por otra parte, la hepatotoxicidad es el efecto adverso específico de grupo más importante de los ITINN; suele ser leve o moderada y raramente da lugar a cuadros sintomáticos.
Con respecto a los trastornos metabólicos, la dislipemia (aumento de los niveles plasmáticos de colesterol total, LDL y, sobre todo, de triglicéridos) es el más frecuente de estos trastornos y se manifiesta, igual que la resistencia a la insulina, más frecuentemente con los IP clásicos, sobre todo indinavir y ritonavir, que con los IP potenciados. La administración de ITIAN análogos de timidina (estavudina y, en menor grado, didanosina), se considera un factor de riesgo para el desarrollo de resistencia a la insulina y diabetes, en mayor medida que otros inhibidores de la transcriptasa inversa. Por el contrario, los INI como raltegravir y el antagonista del CCR5maraviroc presentan el perfil metabólico más favorable. Se recomienda monitorizar en cada visita control la glucemia y los lípidos plasmáticos en ayunas de los pacientes, teniendo en cuenta que la propia infección por el VIH y algunas pautas de TAR pueden incrementar el riesgo cardiovascular.
Pero, sin duda, uno de los efectos adversos del TAR más temidos por los pacientes es la lipodistrofia. Suele manifestarse como lipoatrofia periférica (afecta a la grasa subcutánea en el rostro y las extremidades) y/o lipoacumulación perivisceral, abdominal y en mamas y cuello. Se asocia particularmente a ITIAN análogos de timidina (didanosina, zidovudina y estavudina); las pautas que combinan estos fármacos con IP y efavirenz son las que presentan mayor riesgo de lipodistrofia. Pautas sin estos ITIAN o su sustitución por abacavir o tenofovir reducen el riesgo.
Los trastornos neuropsiquiátricos debidos al TAR no son normalmente frecuentes, aunque se hacen especialmente relevantes en caso de administración de efavirenz, en cuyo caso el 50% de los pacientes presentan mareos, somnolencia, confusión, ansiedad, alteraciones del sueño, etc. Estos síntomas suelen remitir en 2-4 semanas, pero pueden obligar en algunos casos a suspender el tratamiento.
Finalmente, existe una evidencia científica creciente que relaciona el TAR con el desarrollo de osteopenia y osteoporosis en pacientes infectados por el VIH, aunque no se ha establecido definitivamente su relevancia clínica (Hoy, 2016). Algunos autores proponen que sería propicio analizar la densidad mineral ósea al inicio del tratamiento y posteriormente de manera periódica en pacientes con otros factores de riesgo de osteoporosis (mujeres postmenopáusicas, fumadores, bajo peso corporal, >50 años, déficit de vitamina D, hepatitis C, insuficiencia renal, diabetes, recuentos de CD4+ <250 células/μL o uso crónico de corticoesteroides sistémicos).
INTERACCIONES FARMACOLÓGICAS Y CONTRAINDICACIONES
El profesional farmacéutico, bien a nivel de atención primaria o bien en la oficina de farmacia, en su condición de experto en el medicamento, debe conocer, identificar y ser capaz de prevenir, en la medida de lo posible, la aparición de interacciones farmacológicas relacionadas con el TAR, habida cuenta de que los agentes antirretrovirales presentan un importante perfil de interacciones farmacocinéticas yfarmacodinámicas. Analizar el perfil de interacciones de los fármacos seleccionados para el TAR de inicio en el paciente concreto es, por el riesgo de efectos tóxicos o de pérdida de eficacia terapéutica, una cuestión básica de la atención farmacéutica a estos pacientes, como lo es revisar posteriormente la influencia que pueda ejercer la introducción de un nuevo medicamento (antirretroviral o no) en una pauta establecida, pero también productos de herboristería, suplementos dietéticos o drogas ilegales.
Un número significativo de pacientes infectados por VIH-1 reciben de forma simultánea otros tratamientos diferentes al TAR, siendo susceptibles de sufrir interacciones con repercusión clínica entre los fármacos antirretrovirales y los empleados para otras patologías, e incluso entre los propios antirretrovirales. La probabilidad de interacciones aumenta con el número de fármacos que recibe un paciente determinado. Así, en un estudio de cohortes que evaluó un total 1.497 pacientes (de la Cohorte Suiza del VIH), se estimó que el 35% de los pacientes menores de 50 años y el 51% de los que superaban esa edad presentaban interacciones potencialmente importantes, que implicaban asociaciones contraindicadas o que requerían ajuste de dosis que no había sido realizado (Marzolini, 2011). Estos resultados se pueden explicar por la polimedicación, que es más frecuente a mayor edad del paciente debido a la aparición de nuevas comorbilidades. Se ha descrito un amplio abanico de interacciones del TAR: con estatinas, con antidepresivos, con antibióticos e incluso con drogas de abuso.
Las interacciones más relevantes en que se ven implicados los agentes antirretrovirales son de tipo farmacocinético, afectando principalmente a los procesos de metabolismo y de distribución. Los fármacos antirretrovirales son sustrato de uno o varios sistemas enzimáticos y se pueden comportar a su vez como inductores o inhibidores de los mismos. A nivel de metabolismo, muchos fármacos anti-VIH afectan, por un efecto de inducción o inhibición enzimática, al principal sistema metabólico en nuestro organismo – el citocromo P-450 hepático – y pueden alterar los niveles sanguíneos de muchos otros principios activos metabolizados por las isoenzimas CYP (particularmente el CYP3A4), como es el propio caso de muchos antirretrovirales.
También pueden ejercer un efecto significativo sobre la actividad enzimática de las glucuroniltransferasas (como la uridindifosfato-glucuroniltransferasa o UDPGT), enzimas encargadas del metabolismo de diversos fármacos. A nivel de distribución, los fármacos antirretrovirales pueden modular, a modo de ejemplo, la expresión de la glicoproteína-P y verse afectados en su distribución por ella; este transportador transmembrana determina la absorción, distribución y excreción de numerosos sustratos (incluyendo los IP o ITINN), cuyo efecto puede verse modificado por la inducción o inhibición del transportador que provocan algunos fármacos (incluido ritonavir).
La relevancia clínica de interacciones a nivel de distribución mediadas por otros transportadores proteicos, como OATP, OCT2 y MATE1, aún no ha sido plenamente esclarecida en el caso de los antirretrovirales. Habitualmente, la inducción o la inhibición del CYP y de la glicoproteína-P van en el mismo sentido pero, tal como sucede con la glucuronización, ambos efectos pueden ser discordantes; así, por ejemplo, ritonavir inhibe varias subfamilias del CYP y es inductor de UDPGT, mientras que atazanavir inhibe tanto CYP como UDPGT.
No olvidemos, sin embargo, que algunas de las interacciones farmacológicas que se producen en el contexto del TAR son beneficiosas. La potenciación de los IP con ritonavir o cobicistat, que inhiben potentemente el metabolismo de los primeros a través del CYP3A4, consigue concentraciones más eficaces, disminuye su susceptibilidad al efecto inductor de otros medicamentos y reduce las restricciones dietéticas. El éxito de estas asociaciones ha abierto la puerta a la investigación de otros potenciadores.
Se pueden establecer una serie de consideraciones generales por familias de fármacos anti-VIH que pueden proporcionar al farmacéutico una visión global sobre las posibles interacciones en pacientes bajo TAR:
- Los ITIAN tienen pocas interacciones metabólicas: tenofovir disoproxilo y abacavir se glucuronizan, mientras que lamivudina, emtricitabina, estavudina y tenofovir se eliminan principalmente por vía renal y son poco susceptibles de padecer interacciones metabólicas relevantes. Se ha descrito un aumento del riesgo de toxicidad renal al asociar tenofovir disoproxilo a algunos IP potenciados con ritonavir.
- En el grupo de los ITINN, nevirapina es metabolizada principalmente por el CYP3A4 y se comporta como inductor del CYP3A4 y del CYP2B6. Efavirenz es sustrato del CYP2B6 y del CYP3A4 y actúa fundamentalmente como inductor del CYP3A4, CYP2B6 y de la UDPGT1A1, mientras que etravirina actúa como sustrato e inductor del CYP3A4 y como inhibidor débil del CYP2C9 y 2C19. Por último, rilpivirina es sustrato del CYP3A4 y, por tanto, los fármacos inductores o inhibidores del mismo pueden alterar su aclaramiento, por lo que no se recomienda su uso conjunto con estos; a las dosis empleadas en terapéutica no parece probable que rilpivirina ejerza un efecto inductor o inhibidor clínicamente importante sobre otros fármacos metabolizados por el citocromo P-450.
- Los IP son quizá, junto a los ITINN, los fármacos con una mayor susceptibilidad de inducir y/o padecer interacciones por su efecto sobre las isoenzimas CYP.
- Como ejemplo que ilustra bien este hecho, ritonavir es un sustrato de CYP3A4 y del CYP2D6 y, a la vez, es inhibidor potente del CYP3A4 y moderado del CYP2D6, lo que se traduce en que el mismo fármaco puede actuar como un auto-inductor de su propio metabolismo, pero también afecta al de otros fármacos que utilicen estas vías metabólicas (entre ellos, la mayoría de los IP), y tiene un efecto inductor sobre otros isoenzimas del CYP (1A2, 2B6, 2C8, 2C9, 2C19), así como de la glucuronización. Además, ritonavir tiene afinidad por la glicoproteína-P y puede inhibir el transportador.
- Indinavir es un sustrato e inhibidor del CYP3A4, mientras que saquinavir es sustrato e inhibidor débil del CYP3A4. Fosamprenavir es sustrato e inhibidor del CYP3A4. La combinación de lopinavir con ritonavir inhibe el CYP3A4 e induce su propio metabolismo, los CYP2C9 y 2C19 y la glucuronización. Atazanavir es sustrato e inhibidor del CYP3A4 y de la UDPGT1A1 y la combinación de tipranavir con ritonavir es sustrato del CYP3A4, ejerce como inductor de CYP2C9, CYP1A2 y de la glucuronización, e inhibe el CYP3A4 y 2D6.
- Con respecto a los INI, raltegravir no es sustrato ni influye en la actividad del CYP, sino que se metaboliza por glucuronización, sin inhibir ni inducir esta enzima, pero los inhibidores e inductores de UDPGT1A1 modifican sus parámetros farmacocinéticos, aunque no de forma clínicamente relevante. Elvitegravir es sustrato mayoritario de CYP3A4 y dolutegravir se metaboliza extensamente por glucuronidasas, por lo que sus concentraciones plasmáticas y efectos farmacológicos se pueden ver aumentados o disminuidos por inhibidores o inductores de dichas enzimas.
- El maraviroc, el único inhibidor del correceptor CCR5 actualmente comercializado, no es inhibidor ni inductor de las isoenzimas CYP, pero sí es sustrato mayoritario de CYP3A4, por lo que los inhibidores e inductores de CYP3A4 alteran sus parámetros farmacocinéticos, obligando a ajustes posológicos relevantes.
- Finalmente, enfuvirtida, único inhibidor de la fusión disponible, se metaboliza a través de las vías catabólicas de las proteínas y aminoácidos, y no es sustrato ni influye en la actividad de ningún sistema metabólico de otros antirretrovirales, por lo que no es susceptible de presentar interacciones farmacocinéticas relevantes.
Teniendo en cuenta todo lo anterior, mención específica merece la asociación de los IP al síndrome de Cushing iatrogénico en uso conjunto con corticoides. Este síndrome puede resultar de la coadministración de ritonavir y fluticasona (por vía nasal o inhalada), o budesonida (inhalada) o triamcinolona (intraarticular), pues el efecto de ritonavir sobre el citocromo P-450 prolonga la vida media y aumenta los niveles plasmáticos de corticosteroides. Éstos, en última instancia, causan las características del síndrome de Cushing por la supresión de los niveles endógenos de la hormona adrenocorticotropa y cortisol (insuficiencia suprarrenal secundaria), de tal manera que la retirada brusca puede precipitar una crisis addisoniana clásica. Además, el fenotipo típico de síndrome de Cushing puede no ser reconocido cuando existe la lipodistrofia asociada al TAR. Por tanto, los corticosteroides exógenos, administrados por cualquier vía, deben usarse con precaución en los pacientes que utilizan IP.
También son ejemplos clásicos de interacciones farmacocinéticas de especial interés las producidas entre antirretrovirales y medicamentos susceptibles de automedicación, como el caso de los IP junto con los inhibidores de la bomba de protones u otros antiácidos, que al incrementar el pH gástrico provocan una reducción de la absorción y disminución notable de las concentraciones plasmáticas de los antivirales, con riesgo de fracaso terapéutico. Dicha interacción es de especial relevancia en el caso de administración conjunta de atazanavir y omeprazol, y no se ha descrito para darunavir y lopinavir.
Los productos naturales tampoco están exentos de riesgo. Así, se ha descrito la contraindicación de la coadministración de los ITIAN, los ITINN o maraviroc con la hierba de San Juan (Hypericum perforatum) por el efecto inductor enzimático de esta última.
Ciertas interacciones farmacodinámicas (modificación del efecto farmacológico, sin cambios en las concentraciones) también tienen interés clínico. Algunos ejemplos son el incremento de toxicidad renal al administrar conjuntamente dos fármacos que pueden producir nefrotoxicidad como tenofovir con antimicrobianos nefrotóxicos o AINE. Los IP potenciados se asocian a neutropenia más profunda y prolongada cuando se coadministran con la quimioterapia de los linfomas. Además, algunos IP (atazanavir, lopinavir, saquinavir) así como rilpivirina alargan el intervalo QT, lo que podría potenciar este efecto cuando se usan junto a otros muchos fármacos que son prolongadores del intervalo QT, como ciertos antiarrítmicos o antineoplásicos.
El Documento de Consenso Gesida 2018 recomienda reseñar claramente en la historia clínica del paciente todos los medicamentos, así como aquellos productos naturales y medicinas alternativas que tome el paciente, para evaluar posibles interacciones teniendo en cuenta las contraindicaciones y realizando los ajustes de dosis correspondientes cuando sea necesario. Adicionalmente, indica que se debe considerar la monitorización de los niveles plasmáticos de antirretrovirales cuando se administren dos o más fármacos con posibles interacciones farmacocinéticas relevantes, a fin de evitar toxicidad o ineficacia terapéutica.
Dada la prolijidad y complejidad de interacciones farmacológicas con los antirretrovirales, y teniendo en consideración que la información científica se actualiza constantemente, cobran especial relevancia las bases de datos que incluyan información actualizada y pormenorizada a este respecto. Además de la recomendación de consultar las fichas técnicas autorizadas, la base de datos Bot PLUS, por ejemplo, permite la búsqueda y detección de interacciones farmacológicas entre múltiples medicamentos comerciales y/o principios activos, para su identificación y evaluación a la hora de optimizar el TAR.
DETECCIÓN PRECOZ DE LA INFECCIÓN: TEST DE AUTODIAGNÓSTICO
A raíz de la reciente comercialización en España del auto-test VIH, un producto sanitario de autodiagnóstico de dispensación exclusiva en oficinas de farmacia, se abrió la posibilidad de profundizar en una tarea asistencial muy importante: la búsqueda o el favorecimiento del diagnóstico temprano de la infección por VIH (especialmente en grupos de riesgo) y la lucha contra el infradiagnóstico de la enfermedad.
Cabe destacar, sin embargo, que esta función ya venía siendo desarrollada por numerosos farmacéuticos comunitarios de determinadas comunidades autónomas (Asturias, Baleares, Cantabria, Castilla y León, Cataluña y País Vasco), en algunas desde 2009, donde la realización de los llamados test rápidos de VIH en la oficina de farmacia está co-financiada y ha permitido la realización de un total de casi 44.000 pruebas.
Según datos de 2017, todavía una de cada cuatro personas infectada por el VIH en España no conoce su estado. El diagnóstico tardío de la infección es, además, uno de los principales obstáculos de la respuesta a esta epidemia, ya que aumenta la morbimortalidad asociada, disminuye la respuesta al tratamiento e incrementa la tasa de transmisión y el coste de la asistencia sanitaria. Al contrario, las personas con diagnóstico precoz pueden beneficiarse antes del TAR y, desde la perspectiva de salud pública, generalmente reducen la transmisión de la enfermedad – con un uso más consistente del preservativo – y las prácticas de riesgo.
Las pruebas serológicas de diagnóstico de VIH han de ser voluntarias y confidenciales, y se debe reconocer el derecho de las personas a declinar someterse a ellas. La carga psicológica que implican ha favorecido en numerosos países la introducción del autoanálisis con el fin de promover que se lleven a cabo pruebas diagnósticas de la infección por el VIH que permitan que sea la persona que quiera conocer su estado serológico quien recoja la muestra, realice la prueba e interprete los resultados en privado o con alguien en quien confíe.
Desde la farmacia comunitaria se debe clarificar que estas pruebas autodiagnósticas no proporcionan un diagnóstico definitivo, ni pueden sustituir nunca al mismo, sino que son un primer análisis después del cual se debe acudir a un profesional sanitario para realizar nuevos estudios. Por tanto, en los casos necesarios, se debe proceder mediante la derivación al médico para confirmar o descartar el diagnóstico de la infección.
La cobertura, proximidad y accesibilidad de la red de más de 22.000 establecimientos sanitarios, hacen de las oficinas de farmacia lugares idóneos para la dispensación de estos productos sanitarios. Además de la dispensación, el farmacéutico proporciona consejo profesional, atención personalizada y, en su caso, una derivación del paciente hacia los recursos asistenciales más idóneos. En dicha actuación pueden concurrir una serie de circunstancias en las que el farmacéutico, como profesional sanitario y agente de salud, debe proporcionar información básica y breve sobre la realización y el significado de la prueba. Por ello, desde el Plan Nacional sobre el Sida se ha contado con la colaboración de la Agencia Española de Medicamentos y Productos Sanitarios y del Consejo General de Colegios Oficiales de Farmacéuticos para la elaboración de una guía de uso de este tipo de productos sanitarios (Figura 12).

Figura 12. Guía de actuación farmacéutica en la dispensación del auto-test VIH.
El profesional farmacéutico, desde su privilegiada posición de cercanía y contacto con numerosos pacientes cada día, debe ser capaz de identificar grupos de riesgo o personas que hayan podido estar expuestas al contagio, en los que la realización de la prueba autodiagnóstica es más recomendable. Entre ellos, las parejas sexuales de personas con diagnóstico confirmado de infección y toda aquella persona que consuma drogas inyectables (o haya compartido material de punción) con una persona infectada tienen una mayor probabilidad de ser VIH-positivos. La promoción de la realización de estos tests debe ir unida a una potente educación sanitaria, incidiendo en minimizar prácticas de riesgo para el contagio del VIH en estos grupos de población, especialmente si se desconoce el estado serológico.
La obtención del resultado del test es inmediata (en unos 30 minutos), no siendo necesario enviar la prueba a ningún laboratorio para ello. Esta prueba permite detectar anticuerpos frente a la infección por el VIH-1 y VIH-2, si bien no se detecta el virus directamente. Son pruebas muy sensibles y específicas, y generalmente un resultado negativo suele indicar ausencia de infección (excepto si se está en el periodo ventana, por lo que se recomienda repetir a los 3 meses). Pero es importante destacar que sus resultados no son definitivos, y cualquier resultado positivo exige ser confirmado mediante técnicas más específicas realizadas en laboratorios clínicos, siendo muy importante acudir al médico para confirmar el diagnóstico.
Para un adecuado uso de los test de autodiagnótico del VIH se deberán seguir fielmente las instrucciones que el fabricante incluye en el kit de la prueba, incluyendo sus condiciones de conservación previa al uso. La prueba debe realizarse en un ambiente entre 18 y 30 grados, y no es necesario que el paciente esté en ayunas. Además, no se han observado interacciones o interferencias en los resultados del test con fármacos, alcohol, drogas u otro tipo de sustancias. La prueba es de un solo uso y por un único individuo.
Ante una solicitud y dispensación de la prueba de autodiagnóstico, el farmacéutico debe informar al usuario de que dispone de una red asistencial (en la que se incluye la propia oficina de farmacia) de información, asesoramiento y apoyo a la que puede acudir, especialmente en caso de resultado positivo de la prueba y, después, en caso de que se confirme el diagnóstico. Es conveniente aportar información por escrito sobre centros de salud especializados en infecciones de transmisión sexual, laboratorios clínicos, y organizaciones de pacientes o grupos de riesgo (por ejemplo, LGTBI).
Por último, ante un positivo de la prueba, cuyo usuario regresa a la oficina de farmacia, se deben aportar las recomendaciones psicosociales pertinentes, con atención específica en un entorno privado, mostrando empatía y apoyo al usuario, y recordándole que el TAR disponible hoy en día frente a la infección por VIH es eficaz, seguro y fácil de administrar, y le permitirá llevar una vida normal, sana y larga (Protocolo de actuación del farmacéutico comunitario en la dispensación de pruebas de autodiagnóstico del VIH, 2018).
A la vista de todo lo anterior, podemos concluir que el profesional farmacéutico, tanto en los servicios de farmacia hospitalaria como desde la farmacia comunitaria, tiene un papel fundamental en la infección por VIH en todo lo referente a:
- Información sobre cuestiones fundamentales de la enfermedad (evolución, comorbilidades, etc.) a la población general, y especialmente a grupos de riesgo, profundizando en los métodos de prevención de la trasmisión.
- Uso racional de los medicamentos antirretrovirales: impulso de la adherencia y seguimiento farmacoterapéutico para la optimización del TAR en el paciente concreto. Aporte de información básica sobre el tratamiento (objetivo y distintas opciones de TAR, riesgo de interacciones, etc.).
- Implicación activa en labores de tipo preventivo y asistencial con los consumidores de drogas.
- Favorecer el diagnóstico temprano de la infección por VIH. Promoción de la realización de pruebas diagnósticas.
- Colaboración con médicos y otros profesionales del equipo multidisciplinar para proporcionar la mejor asistencia sanitaria posible al paciente.
Bibliografía
- Álvarez M, Camacho-Luque R, Pérez AB, et al. Evolución en la transmisión de resistencias a antirretrovirales de primera línea en pacientes VIH en CoRIS (2007-2017). Programa de Vigilancia en la Integrasa Viral. IX Congreso Nacional de GeSIDA, diciembre 2017, Vigo. Abstract OR-05.
- Arribas JR, Thompson M, Sax PE, et al. Randomized, double-blind comparison of tenofovir alafenamide (TAF) vs tenofovir disoproxil fumarate (TDF), each coformulated with elvitegravir, cobicistat, and emtricitabine (E/C/F) for initial HIV-1 treatment: week 144 results. J Acquir Immune Defic Syndr. 2017; 75: 211-8. DOI: 10.1097/QAI.0000000000001350.
- Barouch DH, Tomaka FL, Wegmann F, et al. Evaluation of a mosaic HIV-1 vaccine in a multicentre, randomised, double-blind, placebo-controlled, phase 1/2a clinical trial (APPROACH) and in rhesus monkeys (NHP 13-19). Lancet. 2018; 392(10143): 232-43. DOI: 10.1016/S0140-6736(18)31364-3.
- Bettiker RL, Koren DE, Jacobson JM. Ibalizumab. Curr Opin HIV AIDS. 2018; 13(4): 354-58. DOI: 10.1097/COH.0000000000000473.
- Boulougoura A, Sereti I. HIV infection and immune activation: the role of coinfections. Curr Opin HIV AIDS. 2016; 11(2): 191-200. DOI: 10.1097/COH.0000000000000241.
- Brouwer P, Ellis D, Antanasijevic A, et al.Two-component self-assembling nanoparticle vaccines that present multiple HIV-1 envelope trimers. 22nd International AIDS Conference Abstract Supplement, Amsterdam 2018. J Int AIDS Soc. 2018; 21(S6): e25148. Abstract TUAA0101.
- Castillo Mancilla JR, Brown TT, et al. Suboptimal Adherence to Combination Antiretroviral Therapy Is Associated With Higher Levels of Inflammation Despite HIV Suppression. Clin Infect Dis. 2016; 63: 1661-7. DOI: 10.1093/cid/ciw650.
- Clay PG, Nag S, Graham CM, Narayanan S. Meta-Analysis of Studies Comparing Single and Multi-Tablet Fixed Dose Combination HIV Treatment Regimens. Medicine (Baltimore). 2015; 94(42): e1677. DOI: 10.1097/MD.0000000000001677.
- Cohen CJ, Meyers JL, Davis KL. Association between daily antiretroviral pill burden and treatment adherence, hospitalisation risk, and other healthcare utilisation and costs in a US medicaid population with HIV. BMJ Open. 2013; 3:e003028. DOI: 10.1136/bmjopen-2013-003028.
- Colombier MA, Molina JM. Doravirine: a review. Curr Opin HIV AIDS. 2018; 13(4): 308-14. DOI: 10.1097/COH.0000000000000471.
- Compton AA, Malik HS, Emerman M.Host gene evolution traces the evolutionary history of ancient primate lentiviruses. Philos Trans R Soc Lond B Biol Sci. 2013; 368(1626): 20120496. DOI: 10.1098/rstb.2012.0496.
- Cuéllar Rodríguez S. Dolutegravir (Tivicay – GlaxoSmithKline). Panorama Actual Med. 2014; 38 (377): 852-60.
- Cuéllar Rodríguez S.Farmacología de los antivirales. En: Trastornos infecciosos y parasitarios. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2016. p. 143-88.
- Cuéllar Rodríguez S. Infección por VIH. Panorama Actual Med. 2013; 37 (369): 1127-52.
- Dahabieh MS, Battivelli E, Verdin E. Understanding HIV latency: the road to an HIV cure. Annu Rev Med. 2015; 66: 407-21. DOI: 10.1146/annurev-med-092112-152941.
- Danel C, Moh R, Gabillard D, et al. A trial of early antiretrovirals and isoniazid preventive therapy in Africa. N Engl J Med. 2015; 373: 808-22. DOI: 10.1056/NEJMoa1507198.
- Dhody K, Pourhassan N, Kazempour K, et al. PRO 140, a monoclonal antibody targeting CCR5, as a long-acting, single-agent maintenance therapy for HIV-1 infection. HIV Clin Trials. 2018; 19(3): 85-93. DOI: 10.1080/15284336.2018.1452842.
- Excler JL, Michael NL. Lessons from HIV-1 vaccine efficacy trials. Curr Opin HIV AIDS. 2016; 11(6): 607-13. DOI: 10.1097/COH.0000000000000312.
- Fernández del Pozo MB, Díez LM. Sida y herpes. En: Terapéutica farmacológica de los trastornos infecciosos y parasitarios sistémicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid; 2011. p. 339-75.
- Global aids update 2018.http://www.unaids.org/en/resources/documents/2018/global-aids-update
- Global Health Observatory data repository.http://www.who.int/hiv/data/en/
- Guía de actuación farmacéutica en la dispensación de productos sanitarios para autodiagnóstico del VIH.Ministerio de Sanidad, Servicios Sociales e Igualdad y Consejo General de Colegios Oficiales de Farmacéuticos. 2017.
- Hemelaar J.The origin and diversity of the HIV-1 pandemic. Trends Mol Med. 2012; 18(3): 182-92. DOI: 10.1016/j.molmed.2011.12.001.
- Hoy J, Young B. Do people with HIV infection have a higher risk of fracture compared with those without HIV infection? Curr Opin HIV AIDS. 2016; 11(3): 301-5. DOI: 10.1097/COH.0000000000000249.
- Hsu DC, O’Connell RJ. Progress in HIV vaccine development. Hum Vaccin Immunother. 2017; 13(5): 1018-30. DOI: 10.1080/21645515.2016.1276138.
- Iacob SA, Iacob DG, Jugulete G. Improving the Adherence to Antiretroviral Therapy, a Difficult but Essential Task for a Successful HIV Treatment-Clinical Points of View and Practical Considerations. Front Pharmacol. 2017; 8: 831. DOI: 10.3389/fphar.2017.00831.
- Jones A, Das R, Wyatt L, et al. Oral MVA/protein HIV vaccination with a needle-freeinjector induces robust systemic and mucosal antibodyresponses in rhesus macaques. 22nd International AIDS Conference Abstract Supplement, Amsterdam 2018. J Int AIDS Soc. 2018; 21(S6): e25148. Abstract TUAA0103.
- Kashuba ADM, Patterson KB, Dumond JB, Cohen MS. Preexposure prophylaxis for HIV prevention: how to predict success. Lancet 2012; 379: 2409-11. DOI: 10.1016/S0140-6736(11)61852-7.
- Lawn SD, Torok ME, Wood R. Optimum time to start antiretroviral therapy during HIV-associated opportunistic infections. Curr Opin Infect Dis. 2011; 24: 34-42. DOI: 10.1097/QCO.0b013e3283420f76.
- Llibre JM, Chien-Ching H, Brinson C, et al.Phase III Sword 1& 2: switch to DTG+RPV maintains virologic suppression through 48 Wks. CROI Conference (Washington DC: CROI Seattle), 2017. Abstract 44LB.
- Lundgren JD, Babiker AG, Gordin F, et al. Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med. 2015; 373: 795-807. DOI: 10.1056/NEJMoa1506816.
- Madani N, Princiotto A, Mach L, et al. CD4-mimetic compound enhances vaccine efficacyagainst stringent immunodeficiency virus challenge. 22nd International AIDS Conference Abstract Supplement, Amsterdam 2018. J Int AIDS Soc. 2018; 21(S6): e25148. Abstract TUAA0102A.
- Marzolini C, Back D, Weber R, et al. Ageing with HIV: medication use and risk for potential drug-drug interactions. J Antimicrob Chemother. 2011; 66: 2107-11. DOI: 10.1093/jac/dkr248.
- Molina JM, LaMarca A, Andrade-Villanueva J, et al.Efficacy and safety of once daily elvitegravir versus twice daily raltegravir in treatment-experienced patients with HIV-1 receiving a ritonavir-boosted protease inhibitor: randomised, double-blind, phase 3, non-inferiority study. Lancet Infect Dis. 2012; 12: 27-35. DOI: 10.1016/S1473-3099(11)70249-3.
- ONUSIDA, julio 2018. http://www.unaids.org/es/resources/fact-sheet
- Organización Mundial de la Salud.Guidance on pre-exposure oral prophylaxis for serodiscordant couples, men and transgender women who have sex with men at high risk of HIV: Recommendations for use in the context of demonstration. Ginebra 2012. ISBN-13: 978-92-4-150388-4.
- Orkin C, Llibre JM, Gallien S, Antinori A, Behrens G, Carr A. Nucleoside reverse transcriptase inhibitor-reducing strategies in HIV treatment: assessing the evidence. HIV Med. 2018; 19(1): 18-32. DOI: 10.1111/hiv.12534.
- Pérez Molina JA, Polo R, Martínez E, et al. Panel de expertos de Gesida y Plan Nacional sobre el Sida. Documento de consenso de Gesida/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana. Actualización enero 2018. http://www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/publicaciones/profSanitarios/TARGesidaPNS2018_9Enero.pdf
- Polo Rodriguez R, Muñoz Galligo E, Iribarren JA, et al.Documento de Consenso para el seguimiento de la infección por el VIH en relación con la reproducción, embarazo, parto y profilaxis de la transmisión vertical del niño expuesto. Grupo de expertos de la Secretaría del Plan Nacional sobre el Sida (SPNS), Grupo de Estudio de Sida (GeSIDA)/Sociedad Española de Ginecología y Obstetricia (SEGO) y Sociedad Española de Infectología Pediátrica (SEIP). Marzo 2018. http://gesida-seimc.org/wp-content/uploads/2018/05/gesida_VIH_embarazo.pdf
- Poveda E, Aguilera A, García F, et al. Guía de resistencias a los antirretrovirales. Red de investigación en SIDA. Actualización 2018. http://www.iisgaliciasur.es/wp-content/uploads/2018/01/Guia_Resistencias_RIS_25Enero2018.pdf
- Protocolo de actuación del farmacéutico comunitario en la dispensación de pruebas de autodiagnóstico del VIH. Consejo General de Colegios Oficiales de Farmacéuticos y Confederación Española LGBT “Colegas”. Noviembre 2018.
- Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S, et al.Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand. N Engl J Med. 2009; 361: 2209-20; DOI: 10.1056/NEJMoa0908492.
- Rivero A, Pulido F, Velasco M, et al.Recomendaciones de GeSIDA sobre el tratamiento de la tuberculosis en adultos infectados por el virus de la inmunodeficiencia humana. Panel de expertos del grupo de estudio del SIDA (GeSIDA-SEIMC). Actualización Mayo 2018. http://gesida-seimc.org/wp-content/uploads/2018/06/gesida_TB_en_VIH_Version_FINAL_5_de_junio_2018.pdf
- Rockstroh JK, DeJesus E, Lennox JL, et al. Durable efficacy and safety of raltegravir versus efavirenz when combined with tenofovir/emtricitabine in treatment-naive HIV-1-infected patients: final 5-year results from STARTMRK. J Acquir Immune Defic Syndr. 2013; 63: 77-85. DOI: 10.1097/QAI.0b013e31828ace69.
- Saag MS, Benson CA, Gandhi RT, et al.Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2018 Recommendations of the International Antiviral Society-USA Panel. JAMA. 2018; 320(4): 379-96. DOI: 10.1001/jama.2018.8431.
- Sánchez-Rubio J, Martínez-Sesmero JM. Pre-exposure prophylaxis for the prevention of HIV infection: a new prevention paradigm? Farm Hosp. 2016; 40(3): 219-24. DOI: 10.7399/fh.2016.40.3.10439.
- Stieh DJ, Callewaert K, Sarnecki M, et al. Primary Analysis of TRAVERSE: A Phase 1/2a Study to Assess Safety/Tolerability and Immunogenicity of 2 Different Prime/Boost HIV Vaccine Regimens. HIV Research For Prevention (HIVR4P). Octubre 2018, Madrid. Abstract OA02.06LB.
- Suárez López A, Ponce Alonso M, Galán JC, Rodríguez Domínguez M.Síndrome de Inmunodeficiencia Adquirida (SIDA) y Herpes. En: Trastornos infecciosos y parasitarios. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2016. p. 373-405.
- Thompson M, Lalezari JP, Kaplan R, et al. Safety and efficacy of the HIV-1 attachment inhibitor prodrug fostemsavir in antiretroviral-experienced subjects: week 48 analysis of AI438011, a Phase IIb, randomized controlled trial. Antivir Ther. 2017; 22: 215-23. DOI: 10.3851/IMP3112.
- Tiberi S, Carvalho AC, Sulis G, et al.The cursed duet today: Tuberculosis and HIV-coinfection.Presse Med. 2017; 46(2 Pt 2): e23-e39. DOI: 10.1016/j.lpm.2017.01.017.
- Vallejo Hernández R, Rosa González ME, Ortega Polar E, Gómez González del Tánago P, Panadero Carlavilla FJ.VIH y SIDA. Panorama Actual Med. 2018; 42 (414): 537-542.
- Vázquez M. Se confirman los resultados positivos del ensayo tailandés de la vacuna contra VIH. Grupo de Trabajo sobre Tratamientos del VIH. 2013. http://gtt-vih.org/actualizate/la_noticia_del_dia/26-10-09.
- Vigilancia Epidemiológica del VIH y SIDA. Dirección General de Salud Pública, Calidad e Innovación. Sistemas Autonómicos de vigilancia epidemiológica – Centro Nacional de Epidemiología. Actualización junio 2017. https://www.mscbs.gob.es/en/ciudadanos/enfLesiones/enfTransmisibles/sida/vigilancia/InformeVIH_SIDA_2017_NOV2017.pdf
- 22nd International AIDS Conference Abstract Supplement, Amsterdam 2018.J Int AIDS Soc. 2018; 21(S6): e25148.

