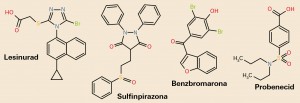
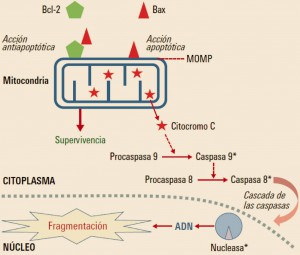
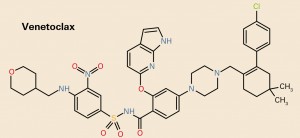
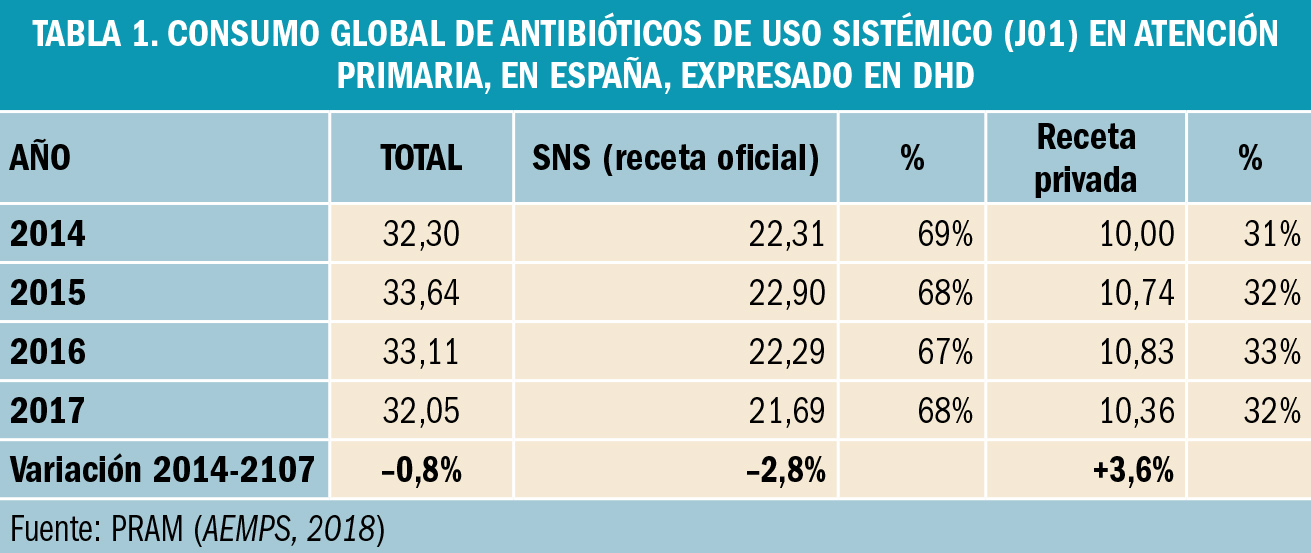
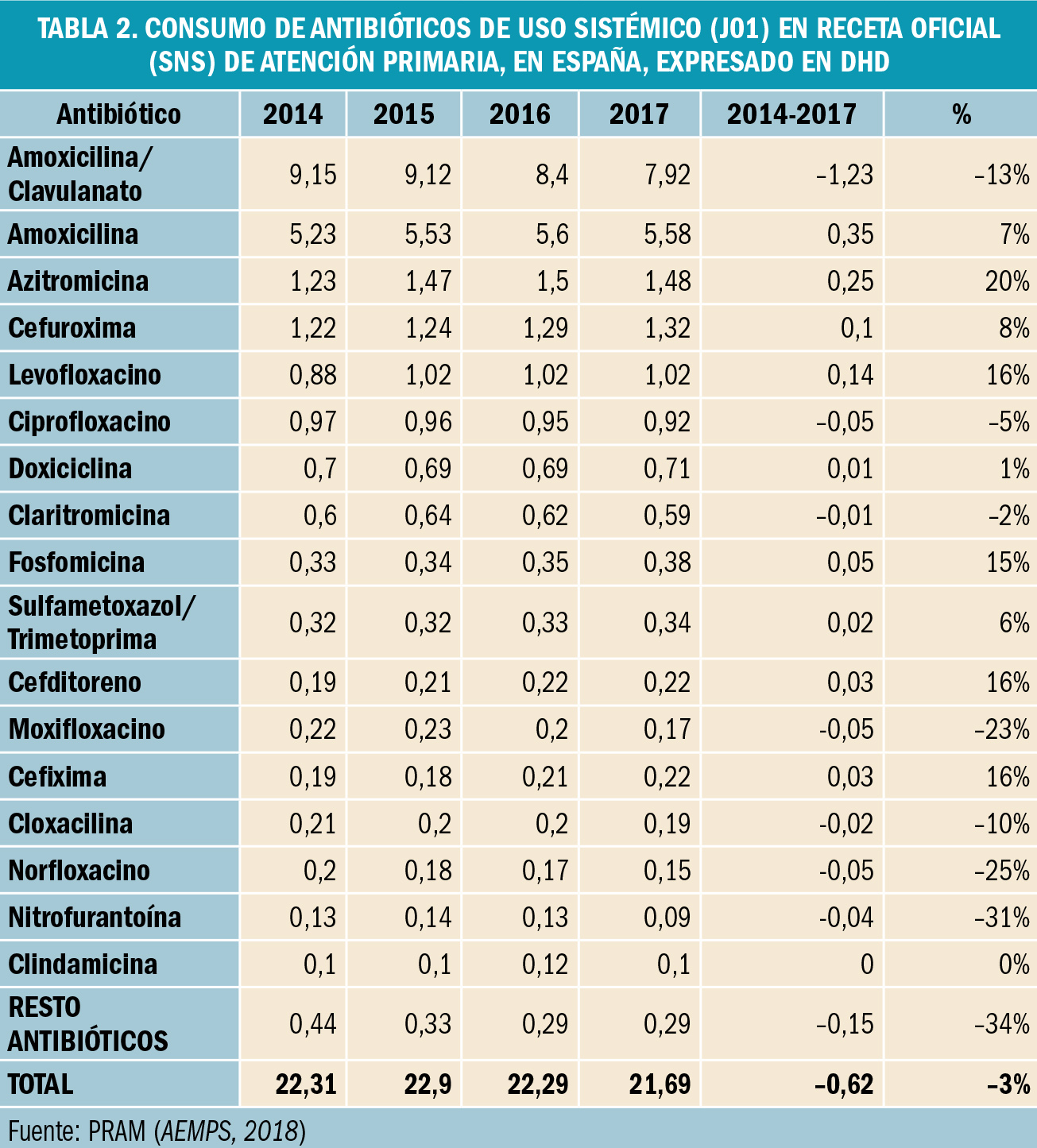
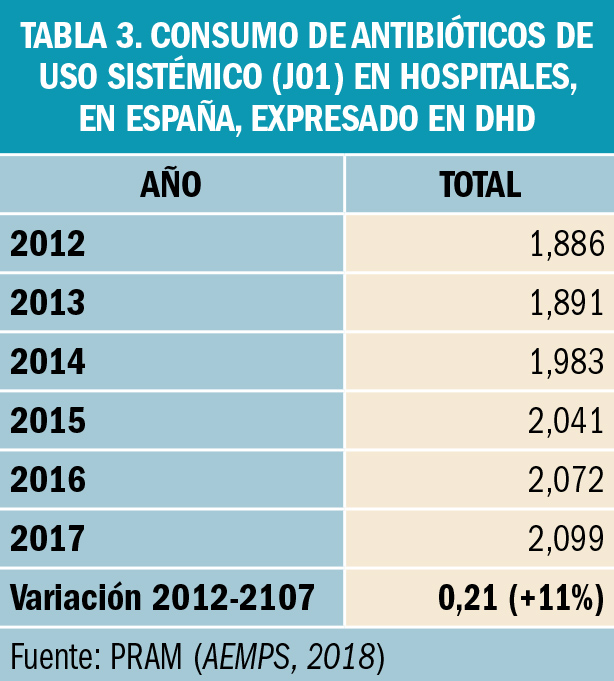
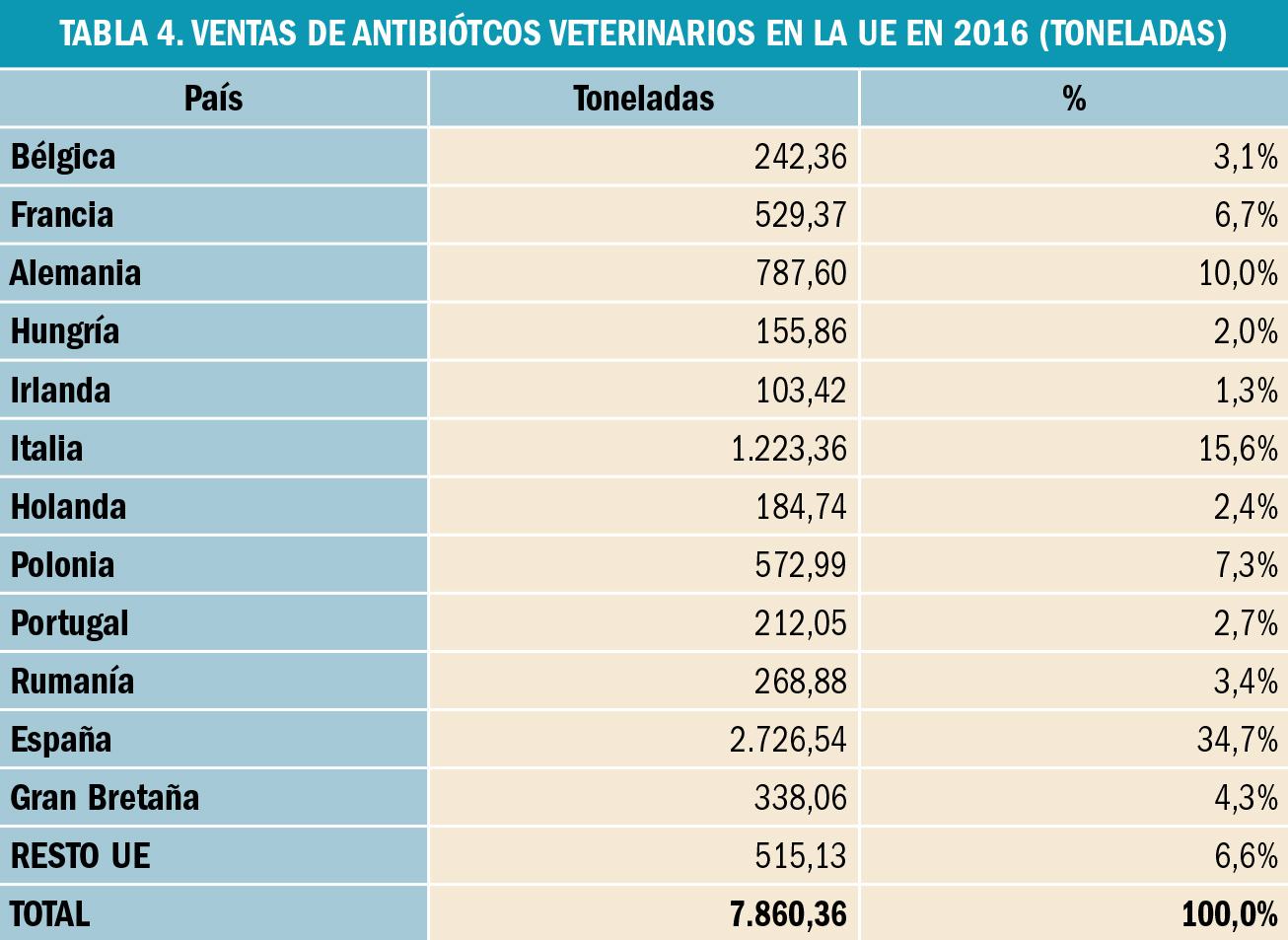
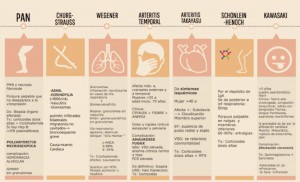
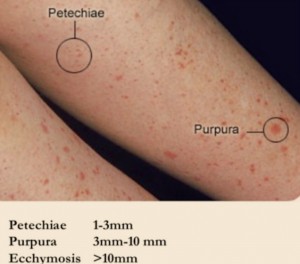
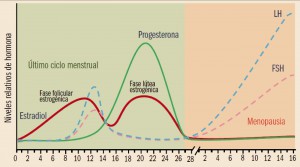
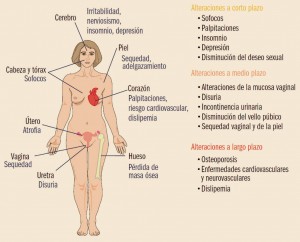
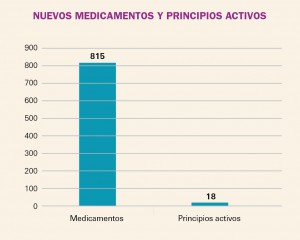
NUEVOS MEDICAMENTOS Y PRINCIPIOS ACTIVOS
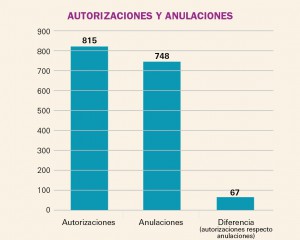
AUTORIZACIONES Y ANULACIONES
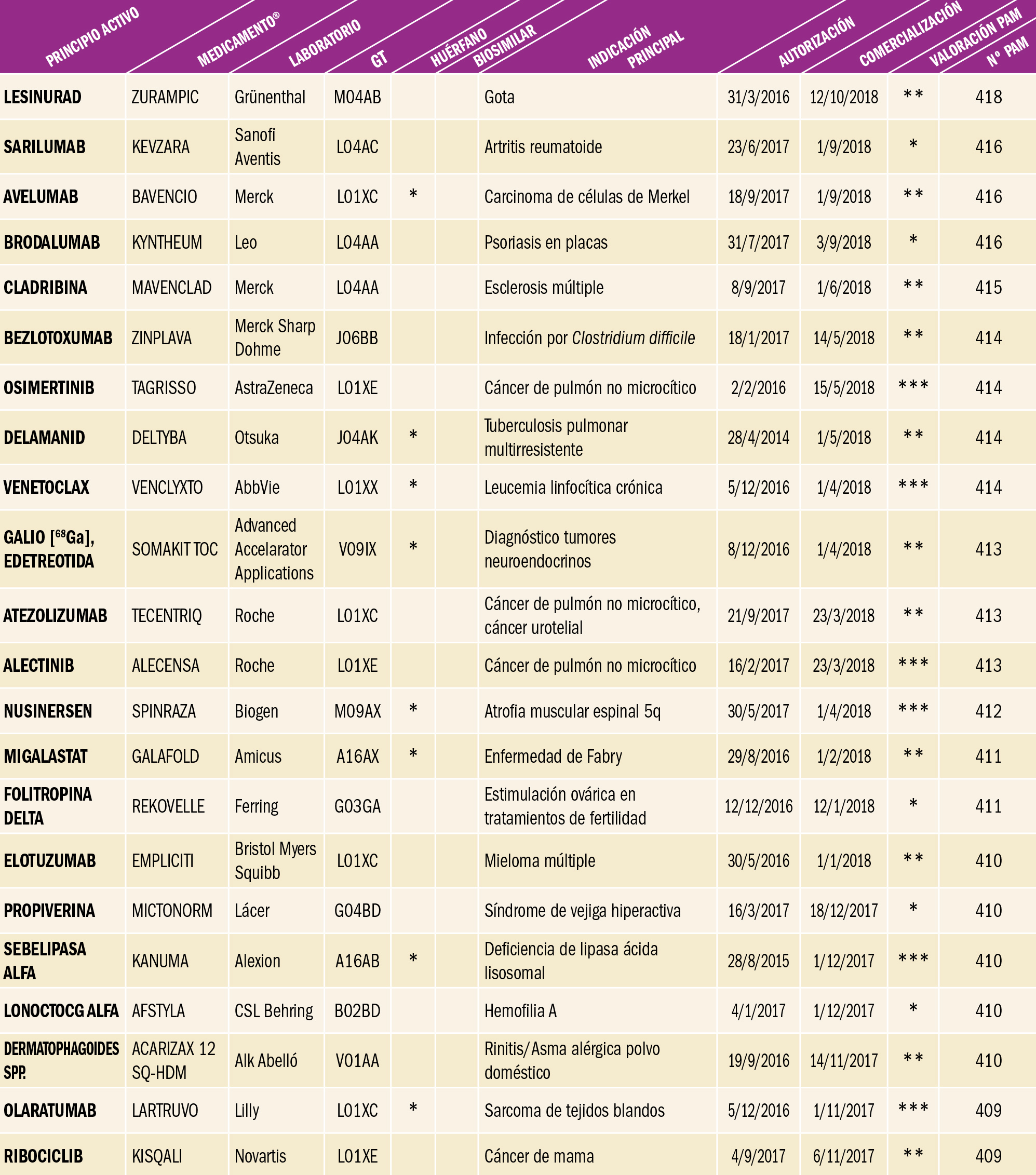
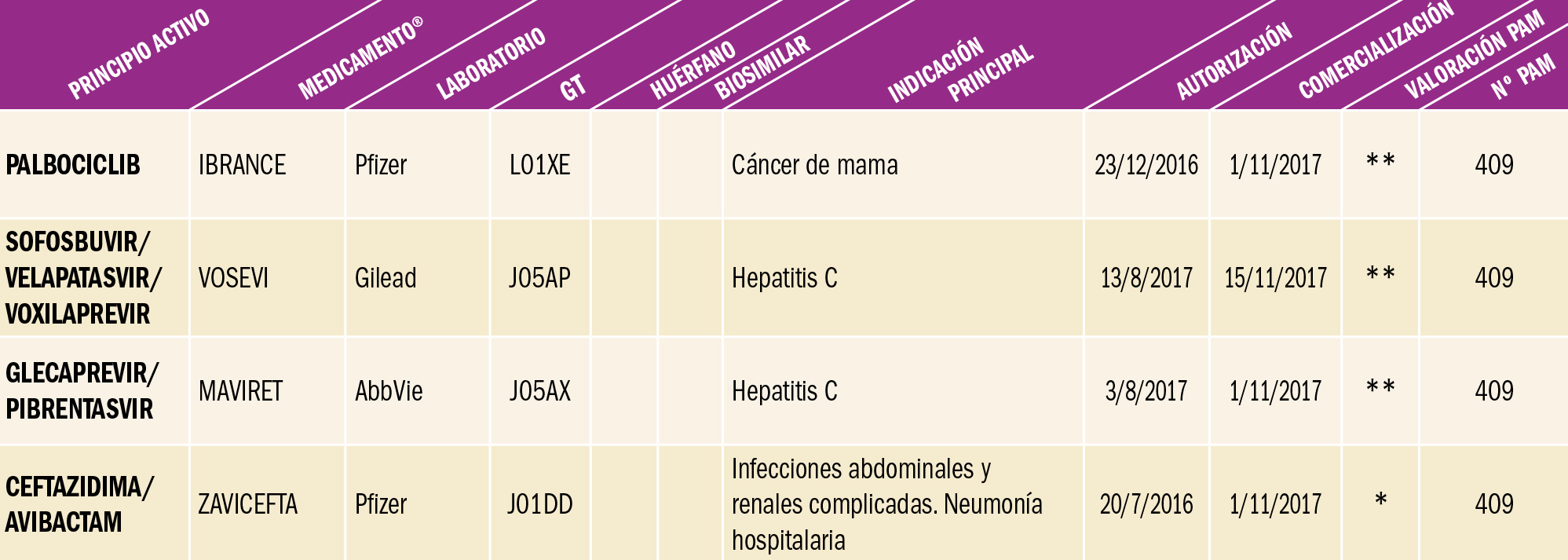
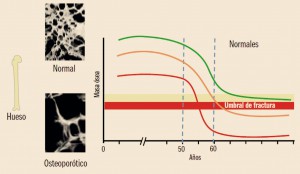
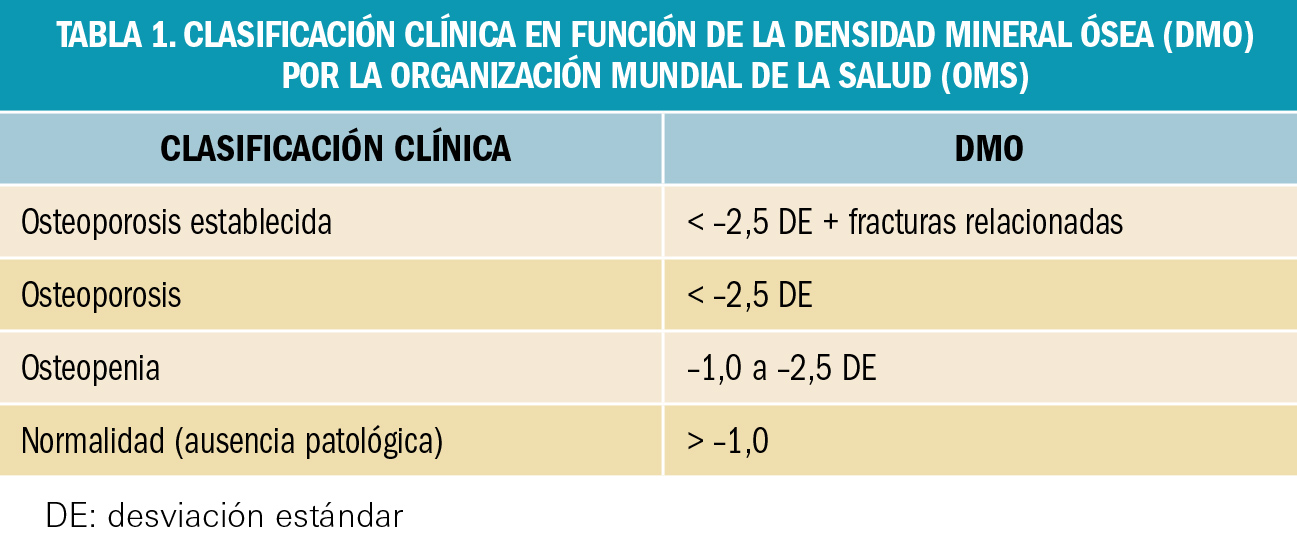
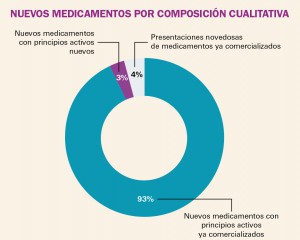
NUEVOS MEDICAMENTOS POR COMPOSICIÓN CUALITATIVA
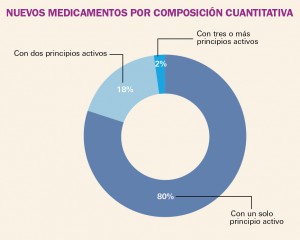
NUEVOS MEDICAMENTOS POR COMPOSICIÓN CUANTITATIVA
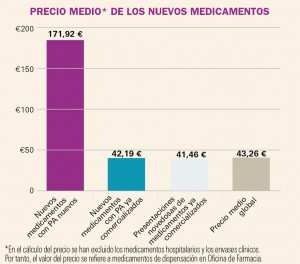
PRECIO MEDIO* DE LOS NUEVOS MEDICAMENTOS
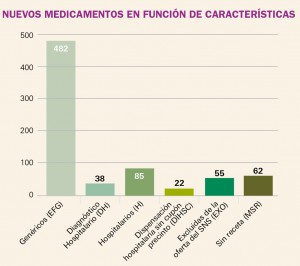
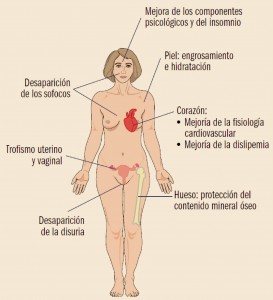
NUEVOS MEDICAMENTOS EN FUNCIÓN DE CARACTERÍSTICAS