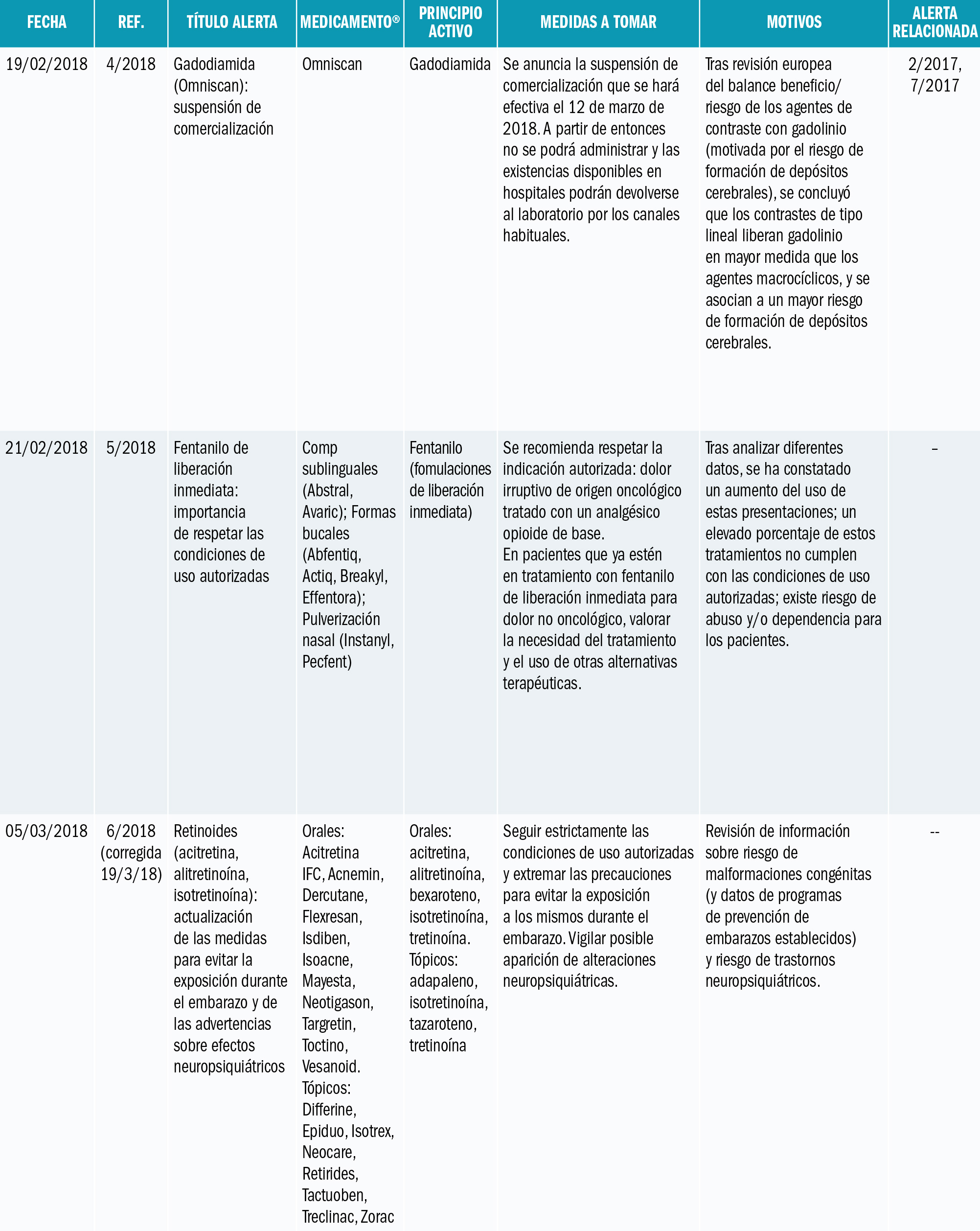
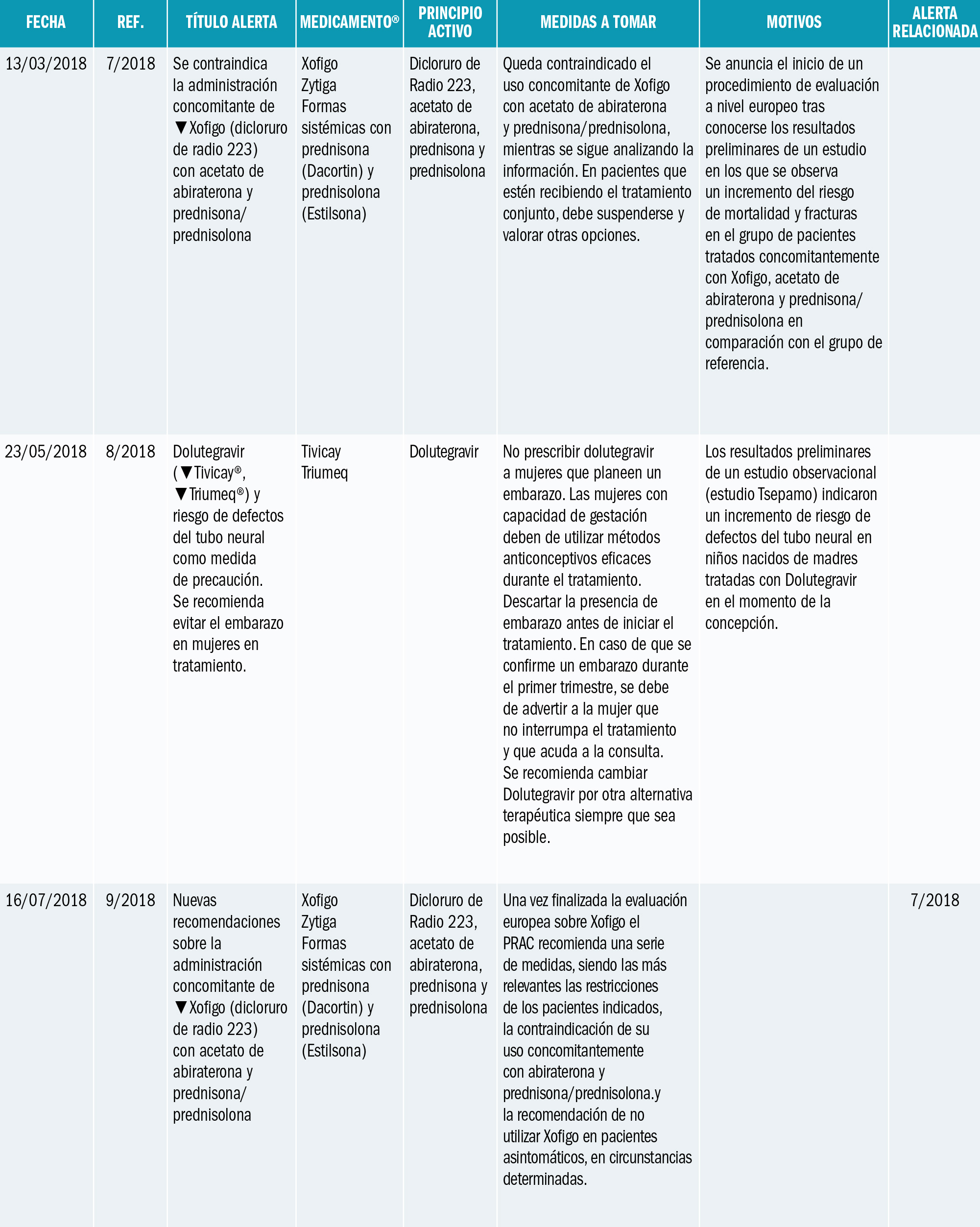
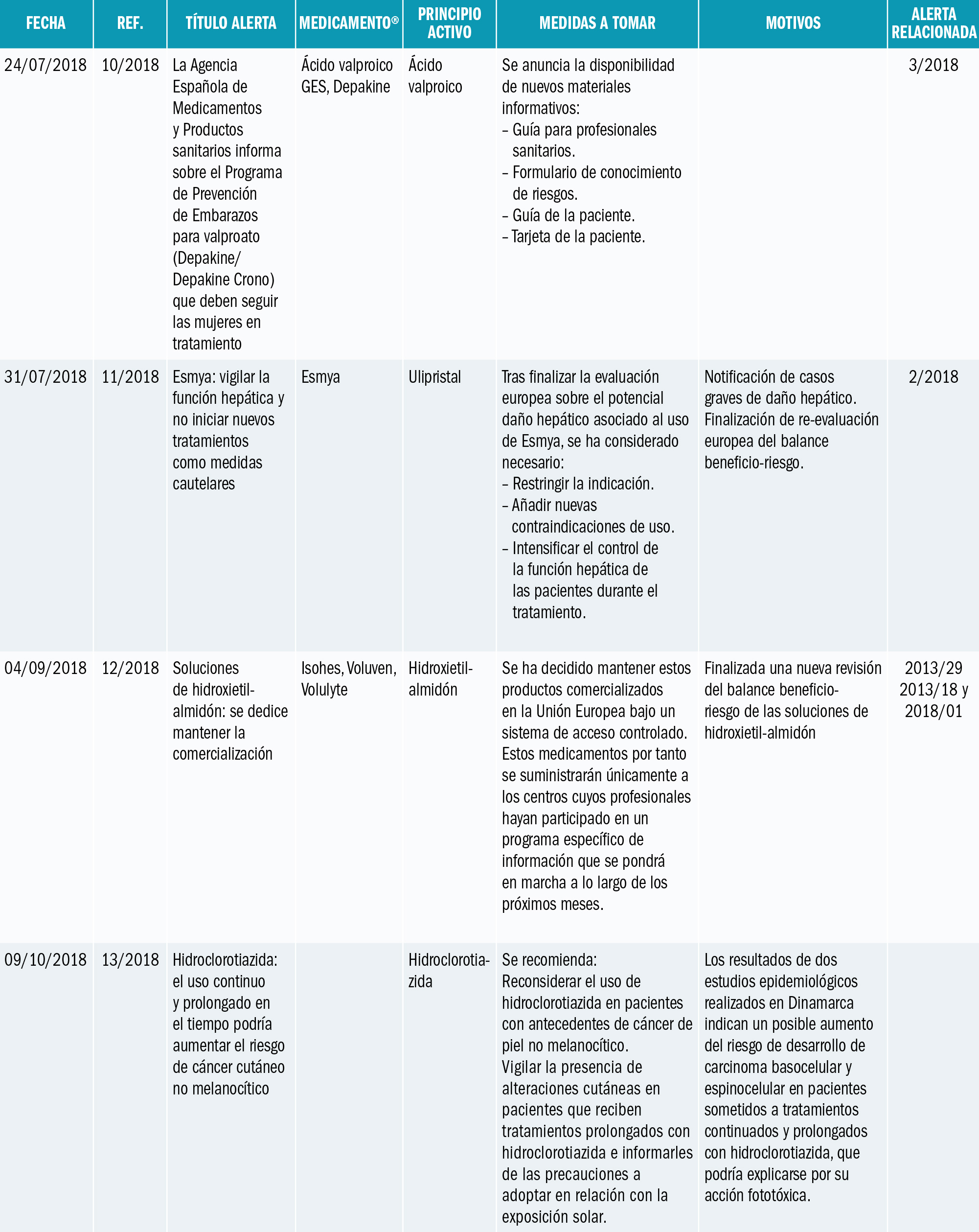
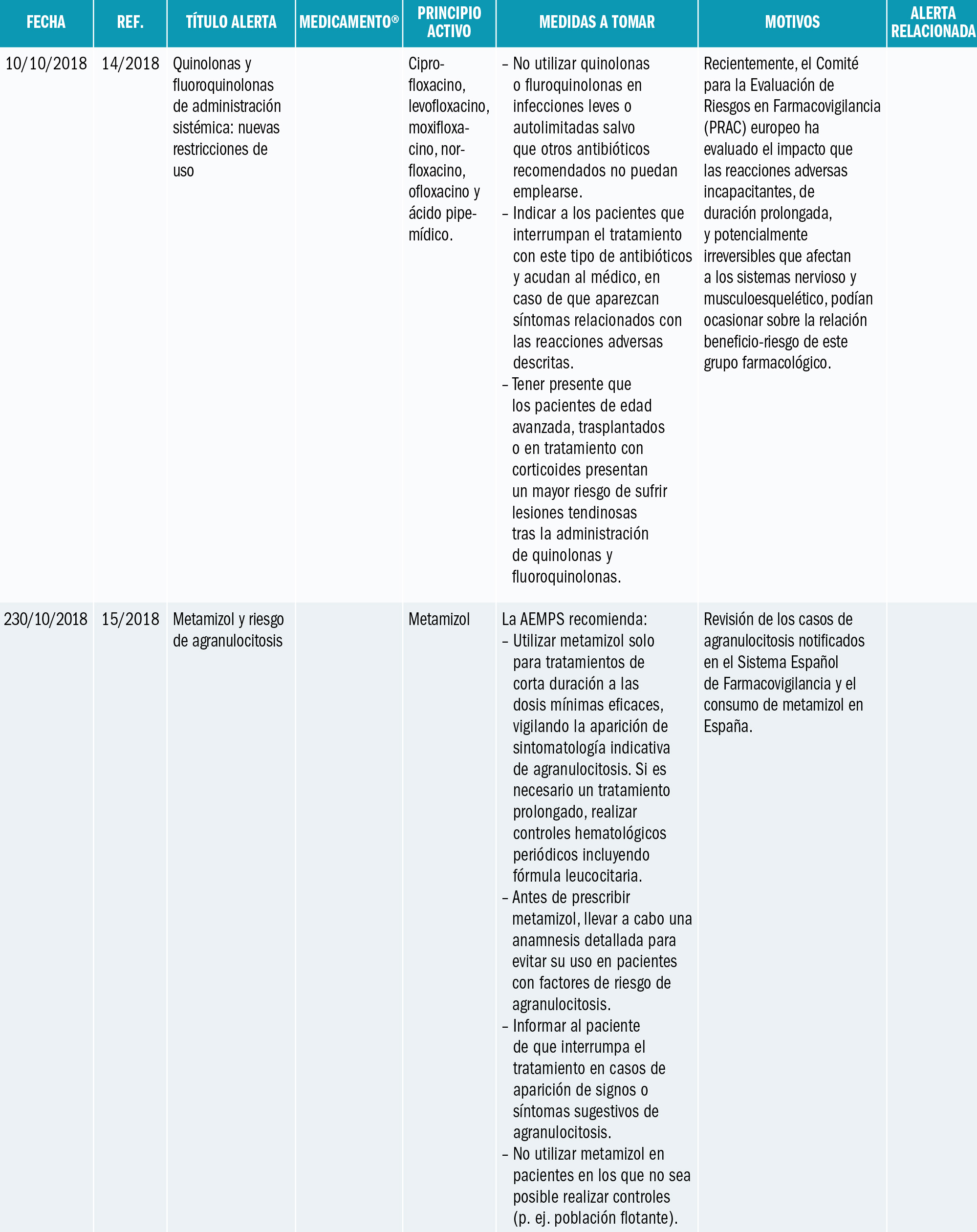
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado de recomendaciones tras la revisión de los casos de agranulocitosis notificados en el Sistema Español de Farmacovigilancia y el consumo de metamizol en España. La AEMPS recuerda que los medicamentos que contienen metamizol, son medicamentos sujetos a prescripción médica y recomienda: Utilizar metamizol solo para tratamientos de corta duración a las dosis mínimas eficaces, vigilando la aparición de sintomatología indicativa de agranulocitosis. Si es necesario un tratamiento prolongado, realizar controles hematológicos periódicos incluyendo fórmula leucocitaria. Antes de prescribir metamizol, llevar a cabo una anamnesis detallada para evitar su uso en pacientes con factores de riesgo de agranulocitosis. Informar al paciente de que interrumpa el tratamiento en casos de aparición de signos o síntomas sugestivos de agranulocitosis, por ejemplo: malestar general, infección, fiebre persistente, dolor de garganta, cambios dolorosos en la mucosa de la boca o nariz, hematomas, sangrado, palidez o deterioro inesperado en el estado general. No utilizar metamizol en pacientes en los que no sea posible realizar controles (p. ej. población flotante).
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado1 de las recomendaciones tras la revisión de los casos de agranulocitosis notificados en el Sistema Español de Farmacovigilancia y el consumo de metamizol en España.
El metamizol es un analgésico y antipirético comercializado desde hace más de 50 años en nuestro país con diferentes nombres comerciales: Algi-Mabo®, Metalgial®, Nolotil®, y varios medicamentos genérico como Metamizol EFG (monofármacos), además de Buscapina Compositum® (asociado a escopolamina). Se trata de medicamentos muy utilizados en España, indicados como analgésicos en distintas situaciones que cursan con dolor agudo moderado a severo, y como antipirético cuando otras alternativas no son eficaces (consultar ficha técnica de los medicamentos con metamizol en la web CIMA: https://cima.aemps.es/cima/publico/lista.html?multiple=metamizol).
Entre sus posibles reacciones adversas, es conocida la aparición de agranulocitosis o de neutropenia y, aunque de frecuencia muy baja2, es una reacción grave que puede llegar a producir la muerte del paciente. Aunque se desconoce su etiopatogenia, se considera una reacción de tipo inmunológico (consultar ficha técnica de los medicamentos con metamizol: https://cima.aemps.es/cima/publico/lista.html?multiple=metamizol).
La AEMPS ha informado1 de la revisión de la situación en España con motivo de la notificación reciente al Sistema Español de Farmacovigilancia de casos de agranulocitosis, particularmente en pacientes de origen británico. La AEMPS ha consultado al Comité de Seguridad de Medicamentos de Uso Humano y a expertos clínicos sobre este asunto.
En la información de los casos notificados en España se constata que su número se ha incrementado en los últimos años de forma paralela al aumento del consumo de este analgésico. Sin embargo, los datos disponibles no posibilitan el cálculo de la incidencia de aparición y es probable que exista una importante infranotificación al ser una reacción adversa conocida. Los datos confirman también el mayor riesgo en pacientes de edad avanzada, algo ya conocido. Aunque esta reacción adversa puede aparecer en cualquier momento del tratamiento, en más de la mitad de los casos notificados en los que se dispone información, la duración del mismo fue superior a una semana.
La utilización de metamizol en España, en base a los datos de prescripción con cargo a recetas del Sistema Nacional de Salud se ha duplicado en los últimos 10 años, siendo el aumento más acusado en los 5 últimos (a modo de ejemplo en 2013 y 2017 se dispensaron en este ámbito ambulatorio 14,6 y 22,8 millones de envases de cápsulas respectivamente). Los datos procedentes de la base de datos BIFAP (Base de datos para Investigación Farmacoepidemiológica en Atención Primaria, http://www.bifap.org) corroboran también un incremento de la prevalencia de uso de metamizol, con un mayor uso en pacientes de edad avanzada.
Si bien se ha discutido desde hace años sobre una mayor susceptibilidad para la agranulocitosis en la población del norte de Europa3-5 y se han estudiado ciertos factores genéticos6, con la información disponible no se puede ni descartar ni confirmar un mayor riesgo en poblaciones con características étnicas específicas7. El caso ocurrido en agosto de 2018, de un turista británico visitando España es un posible ejemplo de la desproporción en la incidencia de casos de agranulocitosis en ciertas poblaciones nórdicas de Europa, como británicos, irlandeses, escandinavos. De hecho, en Suecia se retiró el metamizol en 1974, se reintrodujo en 1995, y de nuevo se retiró definitivamente en abril de 1999 en Suecia. Pero se encuentra disponible en Suiza, en Alemania, Polonia y en países de Iberoamérica. Los datos de frecuencia de agranulocitosis son tan bajos como en España7: menos de 1 caso por millón de tratamientos al año. ¿Deberíamos pensar en evitar el uso de metamizol en los turistas europeos del norte, como británicos, irlandeses o escandinavos? Es una opción legítima, si nos guiamos por el principio de prevención en la seguridad del paciente. Un ejemplo más de que no todas las personas somos iguales, necesitamos las mismas dosis de medicamentos, y tenemos reacciones similares con los medicamentos: la farmacogenética y la farmacogenómica nos apuntan soluciones y respuestas.
Recomendaciones para todos los profesionales sanitarios
En base a los datos de consumo de metamizol y los casos de agranulocitosis notificados, la AEMPS recuerda que estos medicamentos están catalogados como medicamentos de prescripción y recomienda a los profesionales sanitarios:
- Utilizar metamizol solo para tratamientos de corta duración (7 días como máximo), dentro de sus indicaciones autorizadas y a las dosis mínimas eficaces.
- Si es necesario un tratamiento más prolongado, realizar controles hematológicos periódicos, incluyendo fórmula leucocitaria.
- Durante el tratamiento, vigilar la aparición de sintomatología indicativa de agranulocitosis, por ejemplo, malestar general, infección, fiebre persistente, dolor de garganta, cambios dolorosos en la mucosa de la boca o nariz, hematomas, sangrado, palidez o deterioro inesperado en el estado general, informando a los pacientes que, en tal caso, suspendan el tratamiento.
- Antes de prescribir metamizol, realizar una anamnesis detallada para evitar su uso en pacientes con antecedentes de reacciones de hipersensibilidad o hematológicas a metamizol, pacientes con tratamiento inmunosupresor o con medicamentos que pueden producir agranulocitosis.
- Adoptar especial precaución en caso de pacientes de edad avanzada.
- No utilizar metamizol en pacientes en los no sea posible realizar controles (p. ej. población flotante).
Recomendaciones para los pacientes
Los pacientes deben ser informados, por parte de los profesionales sanitarios, tanto prescriptores como desde las farmacias comunitarias, sobre lo siguiente:
- Deben vigilar durante el tratamiento la posible aparición de sintomatología indicativa de agranulocitosis, por ejemplo, malestar general, infección, fiebre persistente, dolor de garganta, cambios dolorosos en la mucosa de la boca o nariz, hematomas, sangrado, palidez o deterioro inesperado en el estado general. En ese caso deben suspender el tratamiento y consultar con su médico prescriptor o su farmacéutico.
- Los tratamientos deben ser de corta duración (7 días como máximo), dentro de sus indicaciones autorizadas y a las dosis mínimas eficaces. Para esto, deben leer atentamente el prospecto, y si tiene dudas debe consultar con su farmacéutico.
- Se debe evitar su uso en pacientes con:
- antecedentes de reacciones de hipersensibilidad o hematológicas a metamizol,
- pacientes con tratamiento inmunosupresor, o
- pacientes con medicamentos que pueden producir agranulocitosis.
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Metamizol y riesgo de agranulocitosis. Nota MUH (FV) nº 15/2018, 30 de octubre de 2018. Disponible en la web: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2018/NI_MUH_FV-15-2018-metamizol-agranulocitosis.htm (consultado 31 de octubre de 2018).
- Ibañez L, et al. Agranulocytosis associated with dipyrone (metamizol). Eur J Clin Pharmacol 2005;60:821-9.
- Metamizole. Analysis of Swedish adverse reaction. WHO Pharmaceuticals Newsletter 2002, No. 03. Disponible en la web: http://apps.who.int/medicinedocs/es/d/Js4942e/3.2.html).
- Hedenmalm K, Spigset O. Agranulocytosis and other blood dyscrasias associated with dipyrone (metamizole). Eur J Clin Pharmacol 2002;58:265-74.
- Bäclström M, et al. Utilization pattern of metamizole in northern Sweden and Risk estimates of agranulocitosis. Pharmacoepidemiology and Drug Safety 2002;11:239-45.
- Vlahov V, Bacracheva N, Tontcheva D, et al. Genetic factors and risk of agranulocytosis from metamizol. Pharmacogenetics 1996;6:67-72.
- Shah R. Metamizole (dypirone)-induced agranulocytosis: Does the risk vary according to ethnicity? J Clin Pharm Ther 2018; 00:1-5. Disponible en la web: https://doi.org/10.1111/jcpt.12768 (consultado 31 de octubre de 2018).
IMPORTANTEEl Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) se basa en el programa de notificación espontánea de un profesional sanitario (médico, odontólogo, farmacéutico, enfermero, otros) de una sospecha de relación entre un medicamento (incluidos vacunas, sueros, gases medicinales, fórmulas magistrales, plantas medicinales) y un síntoma o signo adverso (reacción adversa, RAM) que manifieste el paciente (programa de tarjeta amarilla). El Real Decreto 577/2013 de Farmacovigilancia de medicamentos de uso humano (BOE núm. 179, de 27 de julio de 2013) entró en vigor el 28 de julio de 2013. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) coordina el SEFV-H. A su vez se integra en el Sistema Europeo de Farmacovigilancia que desde 1995 coordina la Agencia Europea de Medicamentos (EMA), y participa desde 1984 en el Programa Internacional de Farmacovigilancia de la OMS, junto con más de 130 países. |
| ¿DÓNDE CONSULTAR LAS FICHAS TÉCNICAS Y PROSPECTOS DE LOS MEDICAMENTOS? En la página web de la AEMPS http://www.aemps.gob.es >> seleccionando >> ”CIMA: Centro de Información on-line de Medicamentos de la AEMPS, Humanos”, se pueden consultar por nombre comercial o por sus principios activos. También están disponibles en la base de datos BOT Plus. NOTA: la mención de marcas comerciales en el texto solo tiene fines de identificación, y en absoluto se les debe asignar directamente lo descrito en el texto. |