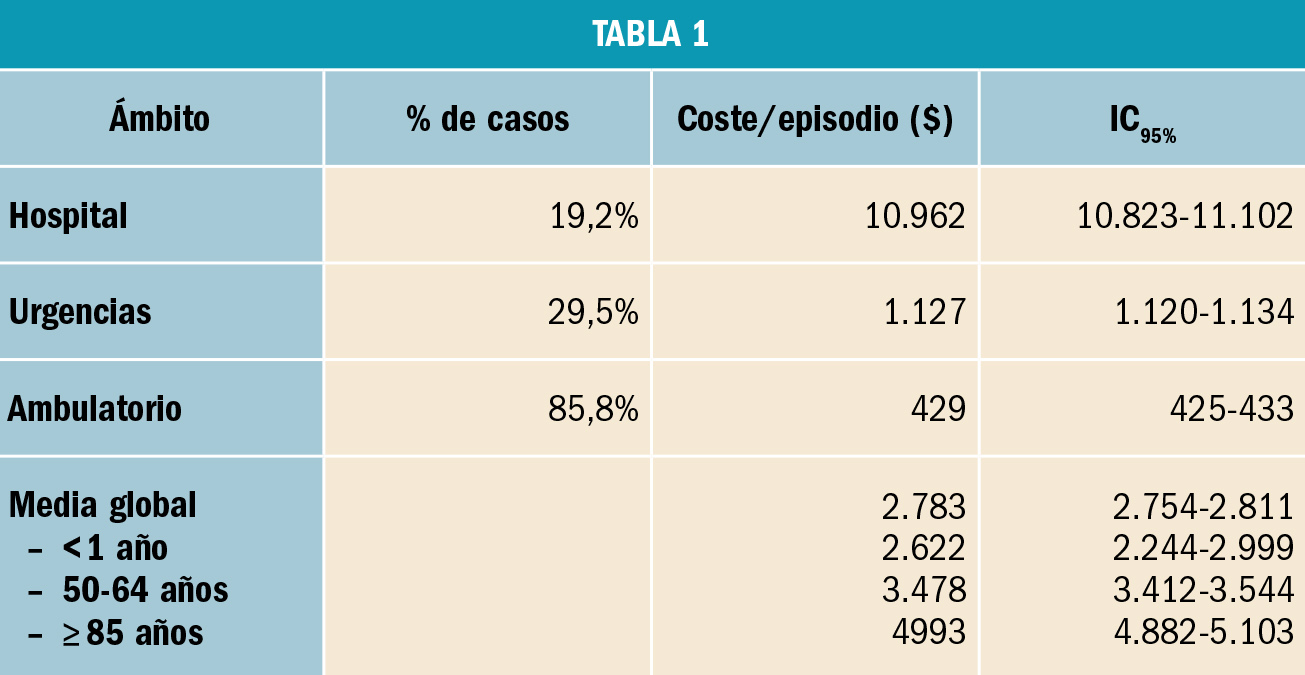
Los ensayos clínicos pivotales tienen como objetivo mostrar con pruebas si una nueva tecnología sanitaria presenta una eficacia suficiente para ser utilizada en la práctica médica, así como si presenta un perfil de seguridad aceptable. Para su realización se precisa de un grupo control respecto del cual se comparan las variables mencionadas, de eficacia y seguridad. El coste de la realización de estos ensayos clínicos muestra variaciones importantes, en función del campo en el que se realizan; así, un estudio estimó en una media de 11,5 millones $ en dermatología y de 52,9 millones $ en dolor y anestesia; otro indicó un rango de 67 a 135 millones $ en el ámbito cardiovascular. Por ello, los autores3 estiman el coste de los ensayos pivotales de todos los nuevos agentes terapéuticos aprobados por la FDA en 2015 y 2016.
Se extrajeron los datos sobre estudios de nuevos fármacos, excluyendo agentes diagnósticos y de imagen, adyuvantes a cirugía o procedimientos médicos y nuevas formas de liberación de fármacos previamente aparecidos. Posteriormente, se estimó el coste de cada estudio utilizando el programa informático IQVIA CRO CostPro Mid-Level Tool, que es un software diseñado por IQVIA que emplean las CROs (Contract Research Organizations u Organización de Investigación por Contrato) para estimar los costes de los estudios. Los datos para la estimación de los costes se estimaron a partir de 49 variables de cada estudio, que evalúan la patología, el tipo de estudio, el número de pacientes incluidos, de visitas de control de éstos, tiempo de seguimiento, etc., así como la región geográfica en la que se desarrollan. Tres características científicas fueron tomadas en consideración adicionalmente: tipo de resultado, duración del tratamiento y fármaco activo. A partir de estos datos se estimó el valor mediano del coste de los estudios, así como los percentiles 25 y 75.
En el periodo analizado (2015-2016) se aprobaron 59 nuevos fármacos (18 de los cuales fueron biológicos), cuyas indicaciones más relevantes fueron en el ámbito del cáncer (18 fármacos), trastornos endocrinos y metabólicos (9 fármacos) y sistema nervioso central (8 fármacos). Finalmente, del total de fármacos, 27 de ellos fueron desarrollados frente a enfermedades raras. La aprobación de los 59 fármacos se realizó en base a 138 ensayos pivotales, teniendo en cuenta que sólo en 27 fármacos se realizaron ensayos únicos, mientras que en 14 se efectuaron 2 ensayos clínicos y en los 18 fármacos restantes se llevaron a cabo entre 3 y 11 estudios pivotales en cada uno de ellos.
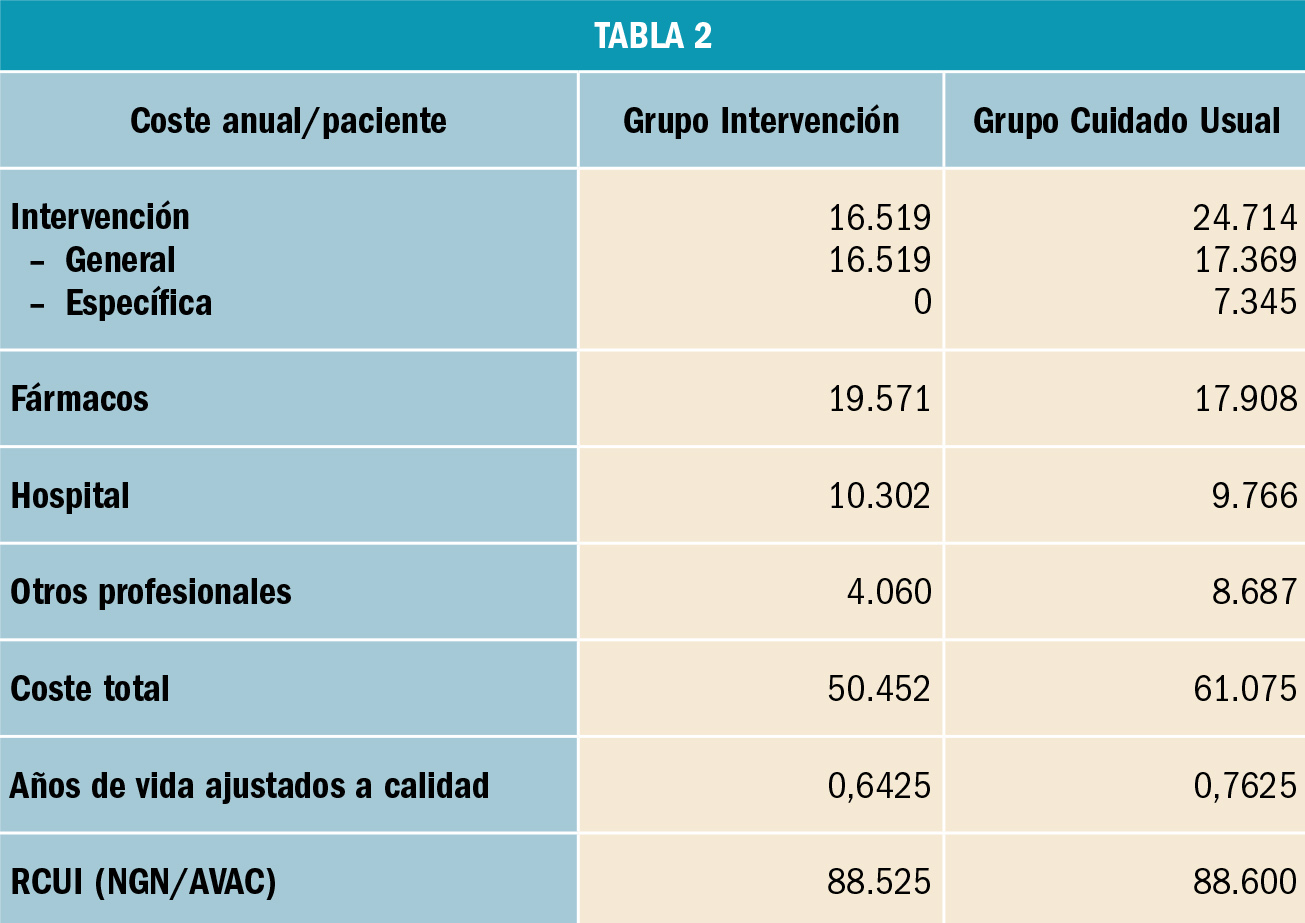
El coste mediano de los 138 ensayos clínicos pivotales fue de 19,0 millones $ (rango intercuartil: 12,2-33,1 millones $). Asimismo, se observó una gran diferencia entre el coste máximo (346 millones $; IC95%: 225-441) y mínimo (2,1 millones $; IC95%: 1,8-2,5). Finalmente, se estimó que el coste mediano por paciente enrolado en el estudio fue de 411.117 $. El tipo de control en el diseño del estudio mostró una gran influencia en el coste final, así como el tipo de variable resultado, el número de pacientes y la duración del tratamiento (Tabla 3).
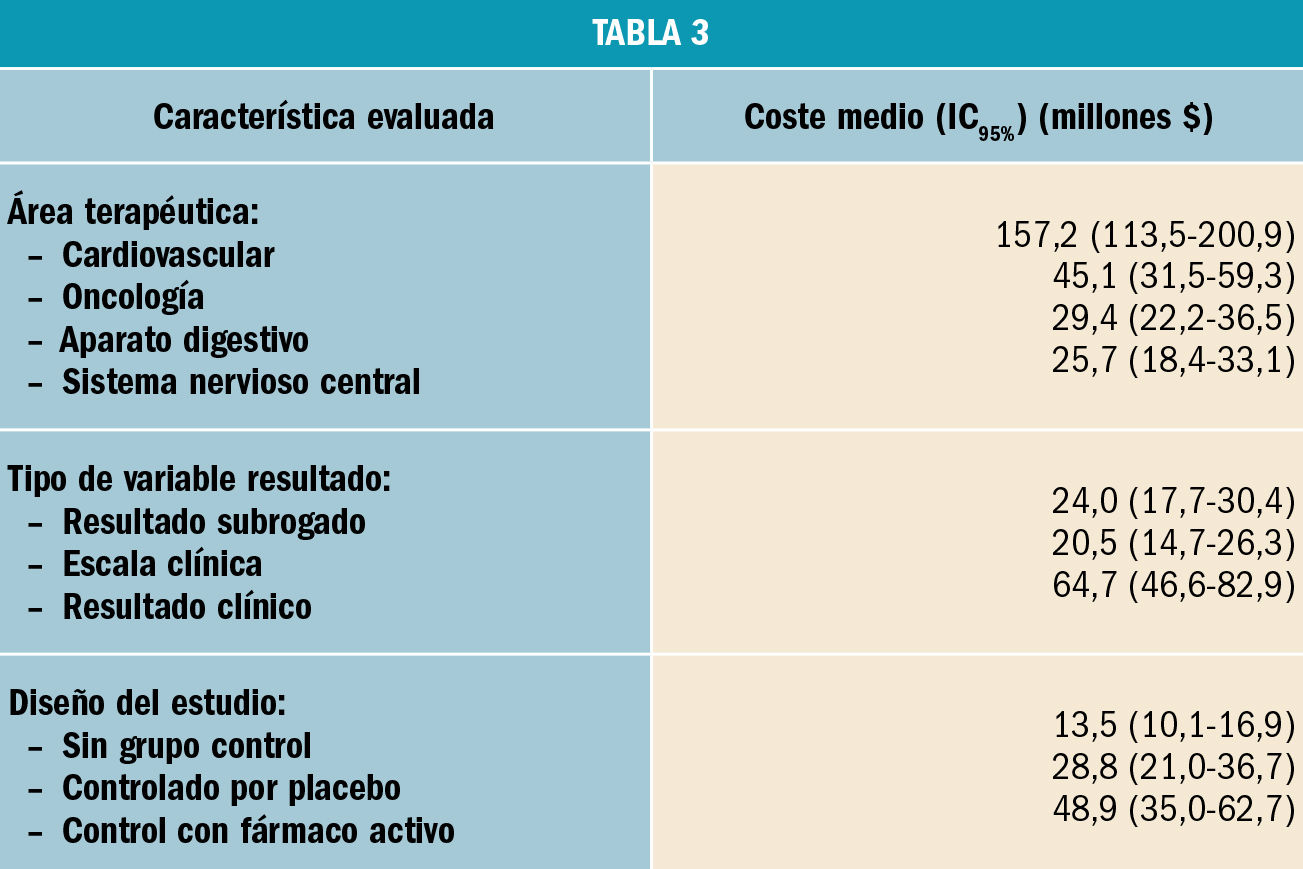
Los autores concluyen que existe una gran diferencia entre el coste de los ensayos clínicos pivotales, llegando a ser de hasta cien veces. El coste de un estudio aumenta a medida que se incluyen más pacientes en el estudio con el objetivo de detectar diferencias de eficacia con el comparador (placebo o fármaco activo); asimismo, el coste fue superior si el estudio se diseñaba como de no inferioridad respecto de otro fármaco. Finalmente, los autores indican que se observa un elevado coste del ensayo clínico en el caso de que el nuevo fármaco presente un beneficio pequeño o que otro fármaco ya presente beneficios clínicos, así como se observan menores costes del desarrollo de los estudios en fármacos nuevos que se asocian a importantes beneficios clínicos.