resumen
Hay numerosas causas de pancreatitis aguda, pero las más frecuentes son patología biliar y consumo abundante de alcohol. En los casos leves, la inflamación se limita al páncreas pero, al aumentar la gravedad, pueden aparecer necrosis pancreática, pseudoquistes o una respuesta inflamatoria sistémica grave. Una vez que se diagnostica pancreatitis, se realiza una TC para identificar si existe necrosis pancreática o un pseudoquiste. Los resultados de la TC y los signos de Ranson ayudan a establecer el pronóstico. El tratamiento consiste en reposición de líquidos IV, nutrición desde el ingreso, analgésicos parenterales y antiácidos. Las complicaciones identificadas se tratan según sea necesario (p. ej., drenaje de pseudoquistes, antibióticos en caso de necrosis pancreática infectada, etc.). La pancreatitis crónica es una patología cuya etiología aún está por esclarecer de una manera amplia. El diagnóstico de PC no siempre es sencillo, los tratamientos actuales son insuficientes y básicamente tratan de paliar los síntomas, en especial el dolor de muy difícil manejo médico.
PANCREATITIS AGUDA
INTRODUCCIÓN
La pancreatitis aguda (PA) es uno de los trastornos gastrointestinales más comunes dentro de los cuadros que requieren hospitalización. Las tres causas principales en orden de importancia son: los cálculos biliares, el consumo prolongado de alcohol y la existencia de hipertrigliceridemia. La mayoría de casos no son graves (80%), el resto son casos serios que conllevan una mortalidad de hasta del 50%, siendo clave conocer la etiología, la existencia o no de patologías de base, gravedad, para manejar un pronóstico y unas complicaciones que pueden aparecer desde el ingreso, de manea que se pueda proporcionar un manejo adecuado y oportuno de esta patología que puede llegar a terminar con la vida del paciente.
Los síntomas, signos, hallazgos clínicos y criterios diagnósticos están bien establecidos. Existen muchos Sistemas de Puntuación que combinan criterios clínicos y pruebas complementarias para establecer predicción de severidad y pronóstico, a la vez que detectar complicaciones locales y sistémicas; de manea que sea posible establecer pautas de manejo y actuar frente a las consecuencias inflamatorias que acarrean las pancreatitis. La presente revisión sistemática integra aportes recientes en la etiología, epidemiología, diagnóstico, complicaciones, pronóstico y cambios en el tratamiento, siendo el más novedoso la administración de los inhibidores de la heparanasa que podrían ser beneficiosos.
ETIOLOGÍA
Los cálculos biliares suponen la primera causa (40%), con mayor prevalencia entre las mujeres; al migrar desde la vesícula biliar pueden obstruir el conducto pancreático. Este mecanismo fisipatológico también se presenta ocasionalmente durante la realización de una CPRE (colecistografía pancreática retrógada endoscópica) (5-10%), en el páncreas divisum y si existe disfunción del esfínter de Oddi. El consumo prolongado de alcohol (4-6 bebidas/día durante más de 5 años) es la segunda causa etiológica (30%). Más frecuente en hombres probablemente por las diferencias en la ingesta o por factores genéticos. Este tipo de pancreatitis se produce al disminuir el umbral de activación de la tripsina llegando a causar necrosis celular. La hipertrigliceridemia es la tercera causa (2-5%) en ausencia de otros factores etiológicos, y representa un riesgo del 1,5% para el desarrollo de la inflamación pancreática. Cuando sus niveles son >1.000 mg/dl el porcentaje se eleva hasta un 20,2%. El tabaquismo está asociado al 50% de los casos de Pancreatitis Aguda (PA). Debido a los efectos nocivos y cancerígenos que conlleva su consumo, unido a una elevada prevalencia, se considera el factor de riesgo modificable más importante. Los fármacos causan menos del 5% de los casos de PA (pancreatitis aguda), la mayoría leves. Entre ellos: azatioprina, didanosina, estrógenos, furosemida, pentamidina, sulfonamidas, tetraciclina, ácido valproico, 6-mercaptopurina, inhibidores de la enzima convertidora de la angiotensina y mesalamina.
Existen casos de PA idiopática, cuya incidencia aumenta con la edad, donde se han descrito posibles factores de riesgo como polimorfismos genéticos, tabaquismo y otras toxinas ambientales.
Las causas autoinmunes suponen menos del 1%. Existen dos tipos, la tipo 1 que afecta páncreas, riñones y glándulas salivales, en la que observamos la aparición de ictericia obstructiva, con leve elevación de Inmunoglobulina G4; la tipo 2 solo afecta al páncreas. Se presenta en pacientes jóvenes y no se observa una elevación de Inmunoglobulina G4; ambas responden bien al tratamiento con glucocorticoides.
Los traumatismos abdominales penetrantes, particularmente los de columna vertebral pueden actuar como desencadenantes de una PA hasta en el 1% de los casos. Del mismo modo sucede con causas infecciosas (citomegalovirus, virus de la parotiditis, Epstein Barr virus) y parásitos como áscaris y tenia.
La obesidad es un factor de riesgo bien establecido para sufrir una PA que es más severa si se trata de una obesidad central; la DM2 aumenta 2-3 veces el riesgo de padecerla. La cirrosis duplica su mortalidad.
EPIDEMIOLOGÍA
La PA es uno de los trastornos gastrointestinales más comunes de entre los que requieren hospitalización. Su incidencia anual es de 13- 45/100000 personas. La mayoría son leves y autolimitadas, sin embargo el 30% son moderadamente graves y el 10% son graves. La mortalidad global es de 3-6% y aumenta a 30% en PA grave, siendo las infecciones secundarias, y la sepsis, las responsables de más muertes en los últimos años.
DIAGNÓSTICO
Se realiza confirmando 2 o más de los siguientes criterios: dolor abdominal superior característico, niveles elevados de lipasa y amilasa sérica al menos 3 veces el valor normal y/o hallazgos en imágenes de abdomen: ECO, TC (tomografía computarizada) o RM (resonancia magnética).
Historia clínica y examen físico
El dolor abdominal en el cuadrante superior izquierdo, región periumbilical y/o epigastrio por lo común aparece súbitamente y puede generalizarse e irradiarse a tórax y espalda. Se suele iniciar después de una ingesta de comida rica en grasas o en alcohol. Se asocia a náuseas y vómitos, sensación de plenitud, distensión abdominal, y oliguria.
Los hallazgos físicos son variables y puede incluir fiebre, hipotensión, taquicardia, taquipnea, ictericia, diaforesis y alteración del estado de conciencia. Puede encontrarse hipersensibilidad y defensa abdominal a la palpación e incluso signos de irritación peritoneal. El signo de Cüllen (equimosis y edema del tejido subcutáneo) y el signo de Grey Turner (equimosis en el flanco) se asocian a PA grave e implican un mal pronóstico. Es importante reseñar si existen antecedentes personales de PA previa, cálculos biliares, ingesta de alcohol y fármacos, hiperlipidemia, traumatismo o procedimientos invasivos abdominales recientes y antecedentes familiares de enfermedad pancreática.
Pruebas de laboratorio
Deben ser específicos para poder realizar una valoración completa y sistemática del paciente. Incluyen: hematología completa, pruebas metabólicas (triglicéridos, función renal y hepática), niveles de lipasa y amilasa, lactato deshidrogenasa, calcio, magnesio, fósforo (si hay antecedente de abuso de alcohol) y uroanálisis. A veces en función de la evolución del pacientes también es necesario: PCR, gases arteriales y niveles de IL-6 o IL-8. Los niveles de lipasa son más sensibles y específicos que los de amilasa. Puede existir hiperamilasemia en insuficiencia renal, parotiditis, isquemia y obstrucción intestinal, macroamilasemia y tras la ingesta de múltiples medicamentos. La lipasa puede elevarse espontáneamente en peritonitis bacteriana, isquemia intestinal y esofagitis.
Pruebas de imagen
Las guías recomiendan que a todo paciente con sospecha de PA se le realice ecografía abdominal, la cual es útil para el diagnóstico de una PA de origen biliar, pero limitado en presencia de gas intestinal superpuesto y coledocolitiasis. No es útil para evaluar pronóstico.
La TC es el método diagnóstico estándar para la evaluación radiológica y nos informa del pronóstico y la severidad de una PA. Es de elección para establecer el diagnóstico diferencial en pacientes con dolor abdominal severo, cuadro que podría remedar una PA, o con síntomas atípicos y elevaciones leves de las enzimas pancreáticas séricas, en caso de fracaso del tratamiento conservador, o en el marco de un deterioro clínico progresivo. El tiempo óptimo para realizarla es de 72-96 horas después del inicio de los síntomas.
La RM es útil en casos de hipersensibilidad al medio de contraste y muestra ventaja sobre TC para evaluar el conducto pancreático principal y la presencia o no de colecciones líquidas.
La CPRE (colangiopancreatografía retrógrada endoscópica) se utiliza como método diagnóstico en casos de coledocolitiasis y es su rendimiento es similar a la colangiopancreatografía por RM, método este último no invasivo, que no requiere la administración de gadolinio.
TIPOS DE PANCREATITIS
- PA intersticial edematosa: Ocurre en 80-90% de los casos. Consiste en la inflamación aguda del parénquima pancreático y/o peripancreático sin tejido necrótico identificable por TC. Se suele resolver en la primera semana.
- PA necrotizante (PAN): Inflamación asociada a necrosis pancreática y/o peripancreática detectable por TC. Es la forma más agresiva.
Grados de Severidad y Pronóstico
La identificación de severidad al ingreso es trascendental para:
- Determinar si el paciente ingresa a cuidados intermedios o intensivos,
- Decidir el inicio de terapia efectiva y oportuna, y
- Evaluar el riesgo de morbimortalidad.
Se establece al ingreso y en las primeras 48 horas, combinando los siguientes parámetros:
Parámetros clínicos: Edad ≥ 60 años, enfermedad preexistente (puntaje ≥2 en el índice de comorbilidad de Charlson), obesidad (IMC>30) e ingesta prolongada de alcohol. La existencia de estos parámetros aumentan el riesgo de complicaciones o muerte.

Figura 1. Criterios de Ranson.
Estudios de Laboratorio: La hemoconcentración y azoemia, o alteración de los marcadores de inflamación (PCR>150 mg/L y de IL-6, IL-8, IL-10) nos ofrecen una evaluación de la disminución del volumen intravascular, debido a pérdidas por la formación de un “tercer espacio” (extravasación de líquido libre a cavidad peritoneal). Si el BUN, creatinina y hematocrito elevados no se restablecen a un rango normal después de una resucitación agresiva con fluidos, se convierten en predictores de una PA grave. Los valores de amilasa y lipasa no son predictores de severidad. Los biomarcadores séricos como el péptido de activación de tripsina urinaria y amiloide sérico A, han sido estudiados como predictores de severidad temprana.
Existen varias clasificaciones aunque las que más se usan son las que se basan en los criterios de Ranson (Figura 1) y Apache (Figura 2).

Figura 2. Criterios APACHE II.
Los criterios APACHE tienen una sensibilidad del 95%, si se aplican diariamente en pacientes en cuidados intensivos, valorándose 12 criterios. Una puntuación ≥8 es considerada como de alto riesgo de fallecimiento del paciente, y es mayor a medida que aumenta el score. Los criterios de Ranson, tienen una sensibilidad del 80% en las primeras 48 horas. Valora 11 factores (5 al ingreso y 6 a las 48 horas), un valor ≥3 puntos se considera una PA grave.
Se podría expresar que los Criterios de Ranson tienen su utilidad al abordar el paciente en la Sala de Urgencias o al ingreso, pero que definitivamente el APACHE II Score es la base para la monitorización constante clínico-analítica para brindar un exacto valor predictivo y pronóstico y para la detección de complicaciones.
TRATAMIENTO
Es imprescindible realizar un diagnóstico preciso, triaje apropiado, cuidados de soporte de alta calidad, monitorización de constantes y tratamiento de las complicaciones, además de prevención de recaídas. La PA leve puede tratarse ambulatoriamente con analgesia oral; sin embargo, la mayoría requiere hospitalización as primeras 48-72 horas para detectar posibles complicaciones y/o un empeoramiento clínico.
Control del dolor
Los opioides son los analgésicos de elección. Tienen la ventaja de disminuir la necesidad de analgesia suplementaria comparados con otras opciones, aunque no existe diferencia en el riesgo de complicaciones: bupremorfina, petidina, pentazocina, fentanilo y morfina.
Fluidoterapia
Las pérdidas sustanciales en el tercer espacio y la depleción de volumen intravascular (hipovolemia) que llevan a hipoperfusión del lecho esplénico son predictores negativos para la PA. Estudios retrospectivos sugieren que la administración agresiva de fluidos durante las primeras 24 horas reduce la morbimortalidad. La mayoría de las guías actuales proveen directrices para su administración temprana y vigorosa, que es más importante durante las primeras 12-24 horas y de escaso valor una vez transcurrido este tiempo.
Se recomienda administrar solución cristaloide balanceada a 200-500 mL/hora o 5-10 mL/kg de peso/hora (2.500-4.000 mL en las primeras 24 horas) para mantener una PAM (presión arterial media) efectiva y un gasto urinario de 0,5 mL/kg de peso/hora, disminuyendo de este modo los niveles de BUN.
El principal riesgo con la restitución de fluidos es la sobrecarga de volumen que incrementa el riesgo de SCA (síndrome coronario agudo), sepsis, necesidad de intubación y muerte; por lo que debe adaptarse según el grado de depleción del volumen intravascular y la reserva cardiopulmonar disponible, debiendo considerar situaciones especiales como pacientes con fallo renal y/o cardiopulmonar.
Nutrición
En la última década, el soporte nutricional se ha convertido en uno de los puntos clave en el tratamiento de la PA, principalmente de la PA grave. Hay indicación de nutrición especializada desde el ingreso, siendo de elección la NE (nutrición enteral) sobre la NPT (nutrición parenteral) administrada de forma precoz. Se recomienda la utilización de dietas poliméricas, en las que estén presentes los tres nutrientes básicos: proteínas, hidratos de carbono y grasas, acompañados de líquidos claros. En PA grave, intolerancia a la vía oral o cuando se agravan los signos clínicos de PA con la NE, está indicada la NPT; aun así se recomienda mantener una mínima perfusión de NE para preservar el efecto trófico de la mucosa intestinal.
Antibióticos
La PA es una inflamación estéril, solo un tercio de los casos desarrollan PAN infectada con riesgo significativo de muerte >50%. El uso de antibióticos debe reservarse ante la sospecha o la confirmación de infecciones locales o extrapancreáticas como neumonías, infección del tracto urinario, colangitis, sepsis, flebitis en sitio de venopunción; o como recomiendan las guías clínicas de la AGA y ACG, restringiéndolos a pacientes con PAN con necrosis del páncreas >30%, o bien si se presenta una necrosis pancreática o extrapancreática infectada. Estos cuadros deben ser sospechados ante la aparición de un deterioro clínico o una escasa mejoría del paciente después de 7-10 días de tratamiento hospitalario. También están indicados en la presencia de sepsis, por lo que deben realizarse cultivos simultáneamente (sangre, orina, otros fluidos corporales y de tráquea), cambiar las vías de acceso vascular y realizar métodos diagnósticos de imagen para identificar su etiología. Su administración debe realizarse según antibiograma, y la duración depende de la respuesta clínica y la negatividad de los cultivos.
Otros fármacos
El uso de heparina (de preferencia las de bajo peso molecular) en PA moderadamente grave a grave se asocia a una mejor evolución, con menor incidencia de necrosis, mejoría de la microcirculación pancreática y presencia de un efecto antiinflamatorio al reducir la estimulación de macrófagos y monocitos; además estudios experimentales revelan que reducen los niveles de amilasa, endotelina-1, citoquinas inflamatorias y FNT-α, y activación de NF-kB [4]. La simvastatina es un fármaco prometedor para la profilaxis de nuevos episodios de PA recurrente. Varios ensayos clínicos demuestran beneficio del uso de Anti-FNT-α en pacientes seleccionados, ya que el FNT-α juega un papel central en la patogénesis de las complicaciones locales y sistémicas de PA.
Se estudió un modelo clínico-bioquímico de inducción de PA intersticial con análogos de secretagogos pancreáticos en ratas, específicamente la ceruleina. Dicha sustancia incrementa la expresión y actividad de la heparanasa (endoglucósido regulador de varios procesos fisiológicos y patológicos, así como de la angiogénesis, cáncer metastásico e inflamación), la cual está altamente implicada en la patogénesis de la PA. El uso de sus inhibidores disminuye marcadamente el edema y la inflamación. Actualmente son utilizados en fase I/II de ensayos clínicos en pacientes con cáncer, por lo que se espera que sean también beneficiosos en PA.
Tratamiento endoscópico
La CPRE con esfinterotomía disminuye la mortalidad y las posibles complicaciones comparada con los casos de pacientes que no han sido esfinterotomizados. Su uso se limita a enfermos con colangitis sobreagregada a PA biliar(y debe ser urgente, realizada en las primeras 24 horas), o bien como tratamiento en coledocolitiasis documentada por imágenes o si existen hallazgos altamente sugestivos de cálculo persistente en el conducto biliar. Entre estos hallazgos debemos mencionar la presencia de ictericia, aumento progresivo de las pruebas de función hepática o dilatación persistente del conducto biliar. No hay beneficio alguno en ausencia de estas manifestaciones. La endoultrasonografía (UES) se utiliza como plataforma para tratamiento mínimamente invasivo de los pseudoquistes con necrosis de la pared pancreática.
Probióticos y prebióticos
El Grupo Dutch de estudio de PA encontró que el uso de un coctel probiótico incrementaba la muerte con alta significancia estadística, por lo tanto, están contraindicados. Lo mismo ocurre con los prebióticos.
Medicina alternativa
Una revisión Cochrane evaluó 15 estudios chinos valorando el uso en PA de la raíz de regaliz, ginseng, peonia y corteza de canela china; que aparecían como “presuntamente” capaces de reducir la mortalidad, pero la calidad de los estudios es muy baja.
PANCREATITIS CRÓNICA
Introducción
La pancreatitis crónica (PC) es una enfermedad inflamatoria crónica progresiva e irreversible que afecta a 4/100.000 personas/año. Hasta ahora existen dos formas reconocidas, una asociada a la calcificación de los conductos pancreáticos de mayor calibre, y la segunda es la variante de enfermedad de conductos pequeños. Las características distintivas de esta enfermedad son principalmente el dolor abdominal, la malabsorción intestinal, la aparición de diabetes y la presencia de calcificaciones pancreáticas. A pesar de los avances en los métodos de diagnóstico, la pancreatitis crónica continúa representando uno de los mayores desafíos de la gastroenterología y su etiología sigue siendo difícil de establecer.
Epidemiología
La PC es una enfermedad poco común con una prevalencia anual de 26/100 000 casos en Europa y una incidencia global que ha permanecido estable a lo largo de las últimas tres décadas de aproximadamente 4:100.000 personas-año. La incidencia y prevalencia de la PC no es bien conocida, aunque se cree que su frecuencia ha aumentado en las últimas décadas. La PC es de 2 a 4 veces más frecuente en el hombre y la edad promedio en el momento del diagnóstico oscila entre los 35 y los 55 años.
Etiología
Anteriormente se creía que el 90-95% de los pacientes adultos con PC, a excepción de aquellos con fibrosis quística, tenían como causa una enfermedad alcohólica o idiopática de fondo; sin embargo recientemente, el Grupo Norteamericano para el Estudio de la Pancreatitis (NSP2) determinó que el actual perfil epidemiológico de la PC s muy diferente de lo que se pensaba, mostrando que menos de la mitad, 44%, se deben al consumo excesivo de alcohol. El 27% tenían una etiología no alcohólica y el 29% eran de origen idiopático.
Alcohol
La PC está asociada, en su mayoría, a un consumo crónico de alcohol de al menos 150 gramos al día durante 6-12 años. A pesar de que el consumo crónico ha sido considerado como el factor etiológico más importante, es interesante resaltar que solo un 3% de los adultos con dependencia o abuso de alcohol desarrolla la enfermedad, lo cual sugiere la existencia de otros factores que podrían jugar un papel importante en el desarrollo de la misma.
El páncreas es capaz de procesar el alcohol de forma eficiente a través de una vía no oxidativa que produce ésteres etílicos de los ácidos grasos y por la oxidación por la vía del acetaldehído. In vitro, sus metabolitos dañan las células acinares y activan las células estrelladas; sin embargo, el consumo prolongado de alcohol no induce PC. En un estudio experimental, la exposición al alcohol exclusivamente, causa un daño mínimo a nivel pancreático, pero altera los acini pancreáticos, de manera que éstos se encuentran más sensibles ante agresiones debidas a otros factores de estrés.
Por lo tanto, se cree que el alcohol necesita de otros cofactores para provocar una respuesta patológica. Posiblemente existan factores genéticos y/o ambientales todavía no bien conocidos que podrían llegar a alterar la capacidad de adaptación-protección de las células pancreáticas ante la exposición al alcohol, originando muerte celular.
Tabaquismo
El humo del cigarrillo se ha convertido en un factor de riesgo importante e independiente para sufrir una PC. En un estudio sueco, el tabaquismo aumenta el riesgo de pancreatitis aguda no biliar, sobre todo cuando este está asociado al consumo de al menos 400 gramos de alcohol mensuales. Además, en este mismo estudio se evidenció, que el riesgo de pancreatitis aguda no biliar debido al hábito de fumar fue influenciado más por la duración del tabaquismo que por el número de cigarrillos diarios. Aun no se ha establecido una relación entre el tabaquismo y la pancreatitis aguda relacionada con la presencia de cálculos biliares. Un estudio danés publicado en el 2011, identificó el hábito tabáquico como el factor más importante relacionado con la progresión de la pancreatitis aguda a la crónica.
Autoinmune
La pancreatitis autoinmune (PAI) es una enfermedad inflamatoria crónica en la que se observa una infiltración linfocítica asociada a fibrosis lo que origina una disfunción del páncreas.
La PAI ha sido clasificada básicamente en 2 tipos: 1) el tipo 1 o esclerosante linfoplasmático y 2) tipo 2 o ducto-céntrica idiopática. Actualmente, la prevalencia de la PAI oscila entre un 5% y un 6%. La PAI es al menos dos veces más común en los hombres y la edad en el momento del diagnóstico oscila entre los 45-50 años.
Hereditaria/Genética
La pancreatitis hereditaria (PH) es una forma de PC que se hereda de forma autosómica dominante con aproximadamente 80% de penetrancia y con una expresión variable. La mayoría de individuos afectados desarrolla síntomas antes de los 20 años de edad y se ha asociado a un mayor riesgo de aparición de adenocarcinoma pancreático.
Los estudios genéticos de la enfermedad en los últimos 15 años han dado lugar a la identificación de cuatro genes de susceptibilidad firmemente establecidos, estos son: PRSS1, SPNIK1, CTRC y CFTR.
La PH es una enfermedad compleja causada por interacciones complejas entre un número indeterminado de genes y factores ambientales. La base genética de una gran fracción de los pacientes con pancreatitis crónica todavía sigue sin explicación.
Manifestaciones clínicas
Las dos manifestaciones clínicas primarias de la PC son el dolor abdominal y la insuficiencia pancreática.
El dolor abdominal es típicamente epigástrico y a menudo irradia hacia región dorsal, por lo que se asocia ocasionalmente con náuseas y vómitos. Suele empeorar después de la ingesta. Dos patrones han sido bien identificados, el primero consiste en repetidos brotes de dolor separados por intervalos libres de síntomas, predominante en los casos idiopáticos/hereditarios de aparición tardía. generalmente solo requiere un manejo conservador. El segundo patrón, predomina en los casos de PC asociados al alcohol o idiopático/ hereditarios de aparición temprana, y consiste en períodos prolongados de dolor persistente con exacerbaciones. Está usualmente va acompañada de complicaciones locales como el desarrollo de pseudoquistes o colestasis obstructiva.
La mayoría de los pacientes con PC desarrollará insuficiencia pancreática en algún momento debido a la pérdida de parénquima. La secreción de la lipasa pancreática es una de las primeras funciones afectadas en la insuficiencia exocrina del páncreas, lo que produce malabsorción de grasas o esteatorrea Aparecen entonces heces de gran volumen, que tienden a tener mal olor, grasa, y son difíciles de limpiar, posiblemente dejando un borde de grasa en el inodoro. La malabsorción de grasa esta normalmente acompañada de pérdida de peso y deficiencia de las vitaminas liposolubles A-D-E y K al igual que de la vitamina B-12. Debido a la insuficiencia endocrina, se está estudiando que parece aumentar la prevalencia de diabetes mellitus tras 20 años del inicio de la enfermedad.
Las personas con PC podrían presentar un aumento del riesgo de desarrollar cáncer de páncreas, aunque no existe todavía evidencia científica.
DIAGNÓSTICO
El diagnóstico de la PC se basa en la sospecha clínica y la realización de estudios de imagen, especialmente en estadios avanzados de la enfermedad. El estudio histológico es difícil de realizar de manera segura debido a la localización retroperitoneal de la glándula, incluso éste podría no proporcionar información fiable y definitiva. Varias clasificaciones y criterios diagnósticos han sigo descritos, entre otros, Rosemont, Mayo, Ammann’s; sin embargo, no han sido validadas.
Diagnóstico clínico
La presencia de dolor abdominal crónico en especial en la población con factores de riesgo debe hacer sospechar la presencia de PC. Sin embargo esta forma de presentación no es la más habitual, y son frecuentes los casos de PC con síntomas dispépticos inespecíficos, o con dolor abdominal inespecífico sin clara relación con la ingesta de alimentos. En pacientes con enfermedad avanzada pueden aparecer signos y síntomas de malabsorción, con esteatorrea y/o diabetes mellitus.
Pruebas de imagen
La presencia de calcificaciones pancreáticas en la radiografía simple de abdomen y/o en el ultrasonido es un hallazgo tardío y la ausencia de éstas, no debe nunca permitir que se excluya el diagnóstico de PC.

Figura 3. CPRE en un paciente con pancreatitis crónica mostrando cambios en el contorno y calibre del conducto pancreático principal y sus colaterales (“chain of lakes”).
La tomografía axial computarizada (TAC) puede demostrar la presencia de un conducto pancreático dilatado junto con una glándula aumentada o disminuida de tamaño, de contornos irregulares. Hallazgos patognomónicos son la existencia de calcificaciones dentro de los conductos pancreáticos, pseudoquistes, dilatación ductal, trombosis, pseudoaneurismas, necrosis y atrofia parenquimatosa. El método de imagen más sensible es la colangiopancreatografía retrógrada endoscópica (CPRE) (Figura 3), que permite detectar cambios mínimos en el contorno y calibre del conducto pancreático principal y sus colaterales. Debido al alto riesgo de complicaciones, la CPRE es raramente recomendada para realizar el diagnóstico.
Por no ser invasiva, la colangiopancreatografía por resonancia magnética está suplantando a la CPRE diagnóstica, sin embargo, su sensibilidad para la visualización de las ramas pancreáticas de segundo y tercer orden es claramente inferior a la CPRE.
Otra técnica utilizada es el ultrasonido endoscópico (EUS) el cual tiene una sensibilidad del 97% y una especificidad del 60%. El EUS ha surgido como una prueba de diagnóstico de primera línea para los estadios tempranos y para la evaluación de las lesiones quísticas o masas.
Diagnóstico funcional
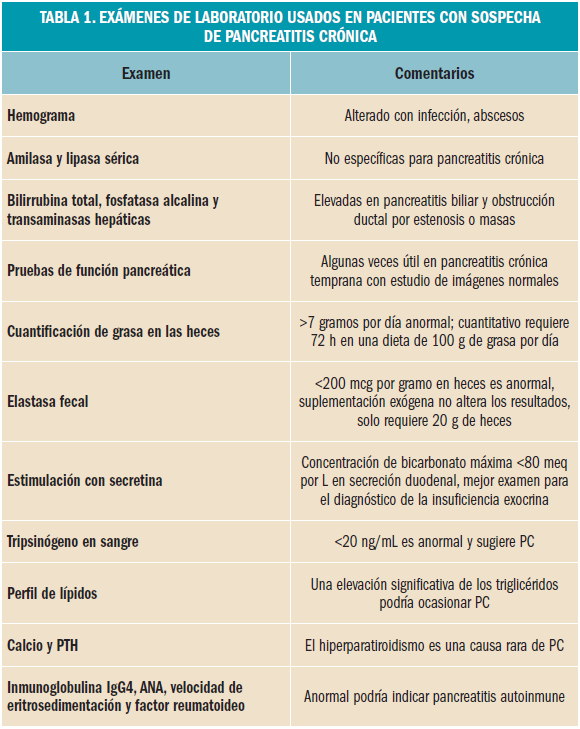
El test de mayor eficacia diagnóstica y, por ello, el gold estándar en el diagnóstico funcional de la enfermedad, es el test de secreción de la secretina pancreática. Sin embargo, la invasividad de esta prueba, la dificultad en el manejo correcto de las muestras de secreción duodenal obtenidas y la ausencia de estandarización de éste limitan su aplicabilidad clínica. La Tabla 1 muestra un resumen de los estudios de laboratorio usados en la evaluación de PC.
TRATAMIENTO
Los objetivos del tratamiento de la PC son aliviar el dolor, intentar prevenir los ataques recurrentes, corregir consecuencias metabólicas como pudieran ser la aparición de diabetes o malnutrición y el tratamiento de las complicaciones que puedan surgir. El tratamiento endoscópico, quirúrgico, o ambos, son necesarios sólo cuando el tratamiento médico óptimo no consigue aliviar el dolor y para tratar las complicaciones específicas asociadas a la PC.
Tratamiento médico
La base del tratamiento es la modificación del estilo de vida (por ejemplo, el cese de consumo de alcohol y tabaco) y cambios en la dieta (pobre en grasas, ingesta de pequeñas cantidades de alimento). El tratamiento médico gira en torno a los analgésicos, hidratación y suplementación con enzimas pancreáticas. Los antiinflamatorios no esteroideos y el paracetamol son los agentes de primera línea seguido por los opioides débiles tales como el tramadol, los cuales pueden ser asociados a un antidepresivo. La analgesia con narcóticos debe evitarse ya que estos fármacos pueden agravar los síntomas por sus efectos secundarios, como la gastroparesia.
Las indicaciones para la terapia de reemplazo con enzimas pancreáticas incluyen la pérdida de peso y la excreción de más de 15 g de grasa fecal diaria en una dieta de 100 g/día de grasa. Se aconseja que la dosis debe ser duplicada a aproximadamente 90.000 unidades USP de lipasa con las comidas que contienen 25 g o más de grasa. El momento de administración de las enzimas pancreáticas puede afectar a la eficacia terapéutica y una mezcla adecuada de los alimentos con las enzimas pancreáticas y la motilidad intestinal óptima son cruciales para la digestión satisfactoria de las grasas.
El manejo nutricional de la insuficiencia pancreática exocrina incluye modificación de la dieta, tales como la limitación del contenido de grasa en la dieta, y la administración de las vitaminas liposolubles calcio y vitamina B12. Las vitaminas liposolubles se pueden administrar oralmente usando preparaciones de formas solubles en agua.
El octreótido, un sintético de acción prolongada análogo de la somatostatina, inhibe las secreciones pancreáticas directa y también indirectamente mediante el bloqueo de la CCK y la liberación de secretina también, ha sido usado para el tratamiento de la PC. El octreótido se ha usado para bajar la presión intraductal y disminuir la proteólisis. Dado que el octreotido predispone a estasis biliar, los pacientes deben ser estrechamente monitorizados por el riesgo en la formación de cálculos biliares. En general, la terapia con octreotido no se ha aceptado ampliamente debido a las razones anteriores y porque su eficacia no se ha demostrado consistentemente.
Endoscópico
Los expertos estiman que el manejo endoscópico tiene un papel importante en los pacientes que no son candidatos óptimos para tratamientos quirúrgicos como una medida primaria terapéutica y en los que el tratamiento médico fracasa.
El objetivo de la terapia endoscópica es aliviar la obstrucción del conducto pancreático y reducir la presión en el conducto pancreático. La terapia endoscópica es más apropiada en presencia de una lesión obstructiva única con dilatación ductal, proximal al sitio de la obstrucción, y preferiblemente si la litiasis es menor de 1 cm, que ésta se encuentre en el conducto pancreático principal, o bien que no sean demasiado numerosas y fácilmente susceptibles a la manipulación endoscópica.
Quirúrgico
Para los pacientes que no responden a la terapia médica, la terapia quirúrgica se está convirtiendo en una opción viable, sobre todo para los enfermos con una clara anomalía anatómica corregible. Los objetivos de la cirugía son descomprimir los conductos obstruidos con el fin de preservar el tejido pancreático y órganos adyacentes. El procedimiento consiste en la realización de una pancreato-yeyunostomía lateral, procedimiento relativamente sencillo que se realiza con frecuencia. Las estenosis ductales son disecadas permitiendo a las piedras ser eliminadas. Produce alivio a corto plazo del dolo, aunque a largo plazo solo responden el 50% de los pacientes.
El procedimiento de Whipple clásico también se utiliza para la resección de lesiones a nivel de la cabeza del páncreas. Este procedimiento es curativo, trae consigo la resolución completa de los síntomas de la pancreatitis y también se considera si existe una obstrucción duodenal o si el diagnóstico de cáncer no ha podido ser excluido, previo a la cirugía; sin embargo, el procedimiento de Whipple sacrifica una porción extensa del parénquima pancreático funcional. Ha habido muchas modificaciones a este procedimiento, tales como la resección de la cabeza pancreática con preservación del duodeno conocido como procedimiento de Beger y el procedimiento de Frey, que apunta a preservar el duodeno y el píloro. Ambos procedimientos se asocian con baja morbilidad y mortalidad y demuestran un alto grado de alivio del dolor.
En resumen, los enfoques quirúrgicos han evolucionado considerablemente en los últimos años, la elección final del procedimiento adecuado debe guiarse, por la experiencia del cirujano individual y del centro médico.
El trasplante autólogo de islotes pancreáticos se ha utilizado con éxito para tratar la diabetes “quirúrgica” después de la pancreatectomía total (PT). Los métodos para el aislamiento de islotes pancreáticos después de la PT han mejorado, y se ha adquirido más experiencia, con más de 20 centros en todo el mundo capaces de llevar a cabo el procedimiento. Esta técnica también ha surgido como una opción atractiva para los pacientes con pancreatitis hereditaria, para la prevención de cáncer pancreático que se puede asociar con PH, para la preservación de una cierta función endocrina cuando la destrucción glandular final es inevitable y como último recurso para el tratamiento del dolor refractario. Actualmente, el procedimiento se realiza en pacientes con enfermedad dolorosa refractaria de pequeños conductos (cuando el conducto pancreático principal no está dilatado). En conclusión, debido a sus buenos resultados, este procedimiento puede ser ofrecido tempranamente en el curso de la historia natural de la PC.
Bibliografía