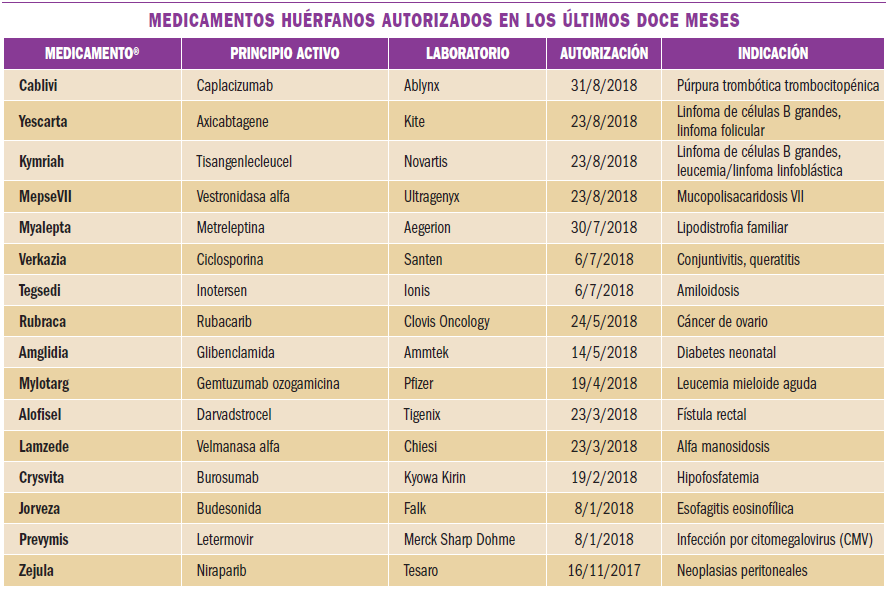
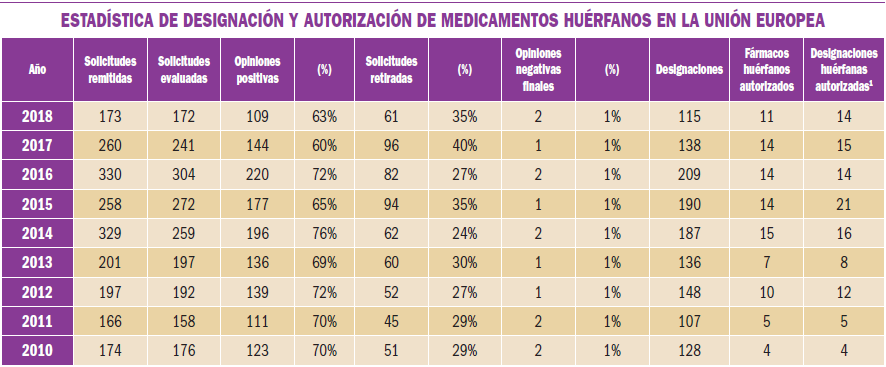
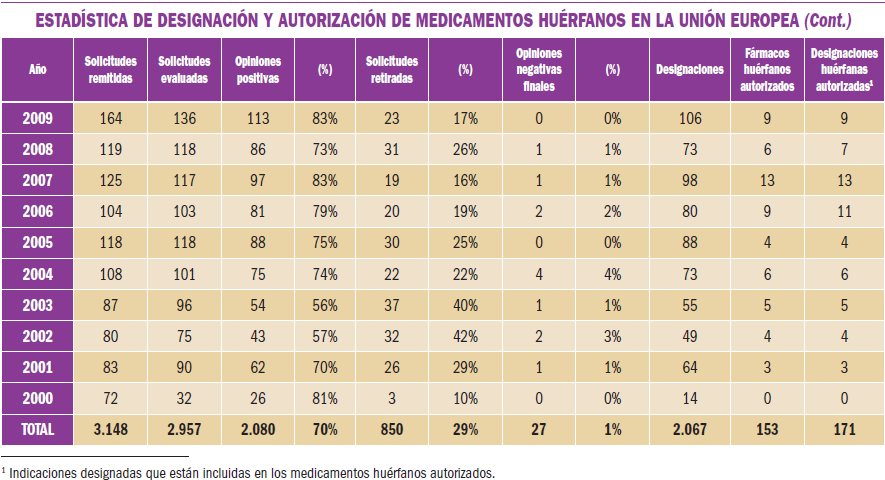
Infecciones virales
Recomendaciones 2018 para el tratamiento y prevención de la infección por VIH
Acaban de presentarse las nuevas recomendaciones la International Antiviral Society-USA, atendiendo a las nuevas evidencias recopiladas hasta abril de 2018 desde las últimas recomendaciones de 2016.
Un panel voluntario de expertos en investigación del VIH y atención al paciente ha recopilado la nueva evidencia hasta abril de 2018, desde las últimas recomendaciones de la International Antiviral Society-USA en 2016, a través de búsquedas bibliográficas de PubMed y EMBASE, así como de datos presentados en conferencias científicas revisadas por pares. En función de esta nueva evidencia, se actualizaron las recomendaciones anteriores (2016).
De acuerdo con ello, los expertos recomiendan que el tratamiento antirretroviral se realice para prácticamente todas las personas infectadas por VIH, tan pronto como sea posible después del diagnóstico. No obstante, el inicio precoz, si es clínicamente apropiado, requiere personal adecuado, servicios especializados y una cuidadosa selección de la terapia. En general, se recomienda un inhibidor de la transferencia de la cadena integrasa (InSTI) más 2 inhibidores nucleósidos de la transcriptasa inversa (INTI) para la terapia inicial. El recuento de células CD4, el nivel de copias en sangre del ARN del VIH, el genotipo y otras pruebas de laboratorio para la salud general y las coinfecciones se recomiendan en puntos específicos antes y durante la terapia antirretroviral (TAR). Si se indica un cambio de régimen, primero se debe evaluar el historial de tratamiento, la tolerabilidad, la adherencia y el historial de resistencia a los medicamentos; en cualquier caso, se recomiendan 2 o 3 medicamentos activos para un nuevo régimen. La prueba del VIH se recomienda al menos una vez para cualquier persona que alguna vez haya sido sexualmente activa y más a menudo para personas en riesgo continuo de infección. Se recomienda la profilaxis previa a la exposición con tenofovir disoproxil fumarato / emtricitabina y una monitorización adecuada para las personas con riesgo de VIH.