El programa incluye información codificada sobre las retiradas de lotes de medicamentos publicadas por la AEMPS.
Desde el Consejo General se informa puntualmente a los Colegios y a los colegiados sobre la información profesional que publica la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) relativa a notificaciones sobre seguridad y/o calidad de los medicamentos. Además de enviarse por Circular y publicarse en PORTALFARMA, esta información oficial se incorpora a Bot PLUS de forma codificada para que, al acceder a la ficha del medicamento afectado, el programa avise sobre esta posible alerta y ofrezca información adicional al respecto. A continuación se describen las opciones de consulta de esta información:
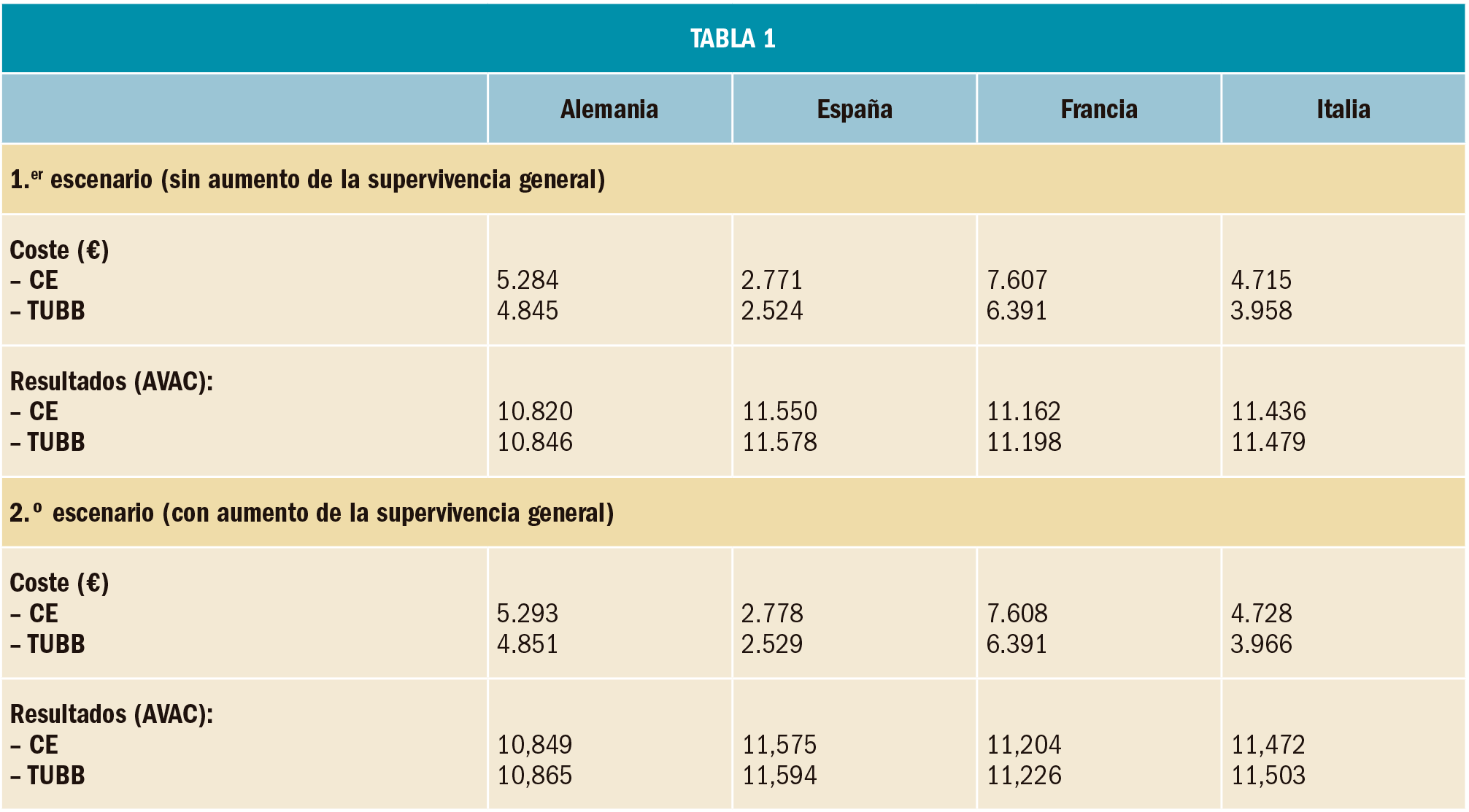
Mediante pictograma, asociados a los correspondientes mensajes de advertencia, se puede visualizar de forma rápida medicamentos afectados por alguna alerta de seguridad o de defectos de calidad, con tan solo entrar en su ficha:

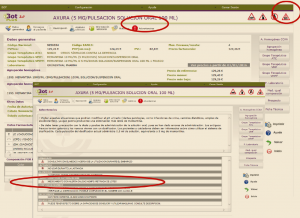
Figura 1. Pictograma y mensaje asociado a las alertas por defectos de calidad que suponen una retirada de lotes de medicamentos.
* Existe otro mensaje del mismo tipo asociado al mismo pictograma para el caso de las INMOVILIZACIONES de LOTES.
Esta información la podemos encontrar también dentro de la pestaña de “Advertencias” de medicamentos (Figura 1).
Al acceder a la ficha de un medicamento afectado por una retirada, se visualizará un mensaje con la advertencia “Medicamento con lotes retirados por Alerta AEMPS. Ver más información en ‘Alertas Calidad’”. Se mostrará también una pestaña específica, “Alertas Calidad”, en la que se podrá consultar los lotes concretos que han sido retirados, con sus respectivas fechas de caducidad, así como la descripción del defecto de calidad detectado y las medidas a adoptar. En esa misma pestaña, también se podrá acceder directamente al documento (pdf) de esa alerta publicada por la AEMPS (Figura 2).
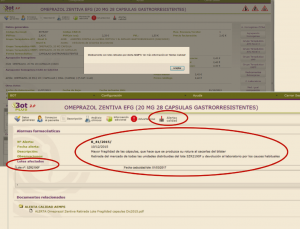
Figura 2. Información ampliada sobre retiradas de lotes por defectos de calidad.
Además, toda esta información puede ser explotada a través de las búsquedas libres, lo que nos permitirá obtener listados específicos de medicamentos afectados por estas informaciones; por ejemplo, podremos obtener un listado de medicamentos con con lotes retirados. Para ello, en la pantalla de búsquedas libres están disponibles los cuatro mensajes de advertencia mencionados anteriormente que permitirán buscar medicamentos para los que la AEMPS ha publicado alguna nota sobre alertas de farmacovigilancia y/o defectos de calidad, según el mensaje de advertencia que se seleccione (Figura 3).
Ejemplo de retiradas lotes de medicamentos con valsartán
Tras las Alertas Farmacéuticas publicadas en los meses de julio y agosto de 2018 por la AEMPS, relativas a la retirada de ciertos lotes de medicamentos que incluyen valsartán en su composición, se codificó esta información en Bot PLUS, con el detalle de los lotes afectados.
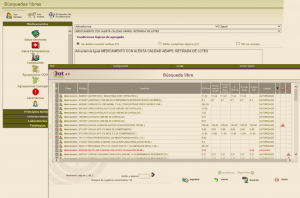
Figura 3. Búsqueda libre de medicamentos que llevan el mensaje de advertencia sobre retirada de lotes por alerta de calidad.
Para facilitar la búsqueda de los códigos nacionales con lotes afectados por estas retiradas, se procedió a crear los siguientes mensajes de advertencia para cada una de las dos notas informativas:
- MEDICAMENTO CON VALSARTÁN CON LOTES AFECTADOS POR ALERTA FARMACÉUTICA DE 5 DE JULIO DE 2018.
- MEDICAMENTO CON VALSARTÁN CON LOTES AFECTADOS POR ALERTA FARMACÉUTICA DE 17 DE AGOSTO DE 2018.
Además, se creó un tercer mensaje que agrupa a todos los medicamentos con valsartán con lotes retirados durante los meses de julio y agosto de 2018 (los 119 códigos nacionales publicados en julio más el código nacional publicado en agosto y que no había sido anteriormente publicado en julio):
- MEDICAMENTO CON VALSARTÁN CON LOTES AFECTADOS POR ALERTAS FARMACÉUTICAS DE JULIO Y AGOSTO DE 2018.
Estas codificaciones específicas mediante mensajes de advertencia, permiten buscar de forma activa los códigos nacionales con lotes afectados por alguna de estas alertas, mediante la opción de búsquedas libres, de forma que obtengamos los medicamentos de uso humano que contengan alguno de los mensajes de advertencia que se han creado a tal efecto, bien los afectados por las alertas de julio, las de agosto, o en su caso, por ambas.
Para ello, entraremos en la búsqueda libre de la aplicación, localizada en el espacio de Búsquedas especiales de la pantalla de inicio (Figura 4).

Figura 4. Acceso a la búsqueda libre de Bot PLUS.
Al pinchar en este icono, accedemos a la búsqueda libre. Para obtener el listado de todos los medicamentos con lotes afectados, debemos hacer clic en el icono de advertencias (Figura 5; punto 1), y una vez seleccionada esta opción, desplegar todos los mensajes de advertencia y buscar aquel que indica MEDICAMENTO CON VALSARTÁN CON LOTES AFECTADOS POR ALERTAS FARMACÉUTICAS DE JULIO Y AGOSTO DE 2018 (Figura 5; punto 2).
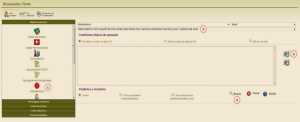
Figura 5. Búsqueda de medicamentos con valsartán con lotes afectados a través de la búsqueda libre de Bot PLUS.
En el caso concreto de que nos interesase obtener únicamente el listado de códigos nacionales afectados por las alertas de julio o bien únicamente los afectados por las alertas de agosto, se seleccionarían uno de los mensajes específicos citados anteriormente:
Una vez seleccionado el mensaje deseado, se debe pinchar en el icono de añadir la condición seleccionada a la búsqueda (Figura 5; punto 3). A continuación pincharemos en el botón “Buscar” (Figura 5; punto 4), y obtendremos el listado de medicamentos con lotes afectados.
El listado generado puede posteriormente imprimirse o exportarse a un fichero Excel, dándonos la opción Bot PLUS en este último caso de personalizar nuestro listado, exportando los campos que nos pudieran interesar (Figura 6).
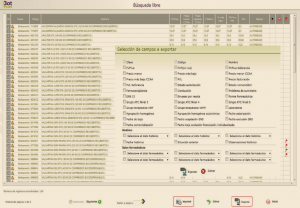
Figura 6. Pantalla de resultados de la búsqueda libre y opciones de exportación del listado.
Toda esta información permanece constantemente actualizada con las nuevas informaciones publicadas por la AEMPS.
Por último, cabe destacar que esta codificación de los lotes retirados, es una información puesta a disposición de todos los usuarios, con el objetivo de ofrecer una nueva información capaz de integrarse con otros sistemas de información y mejorar la gestión e identificación de estos medicamentos, en los que la labor asistencial y de control del farmacéutico es fundamental.