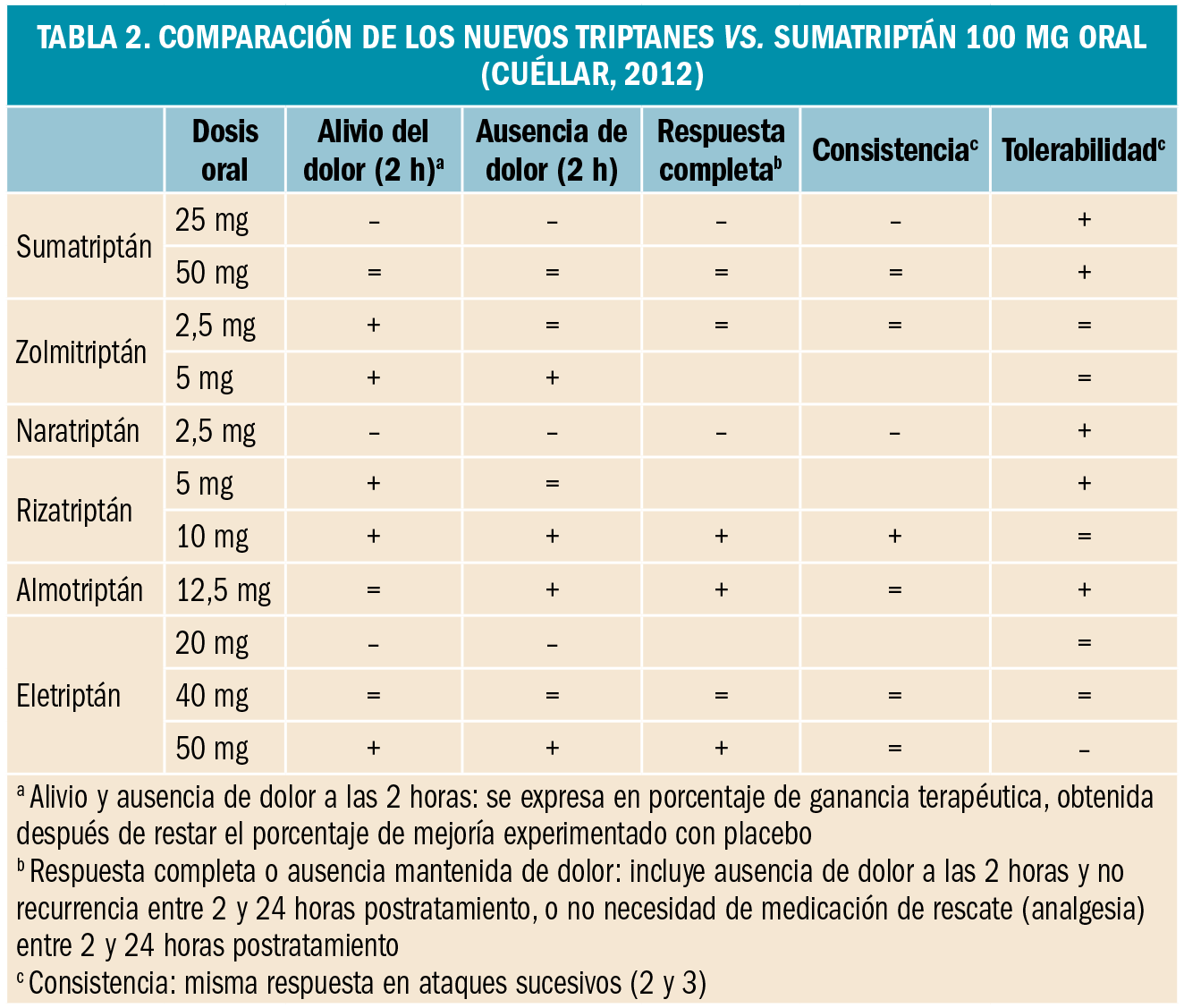
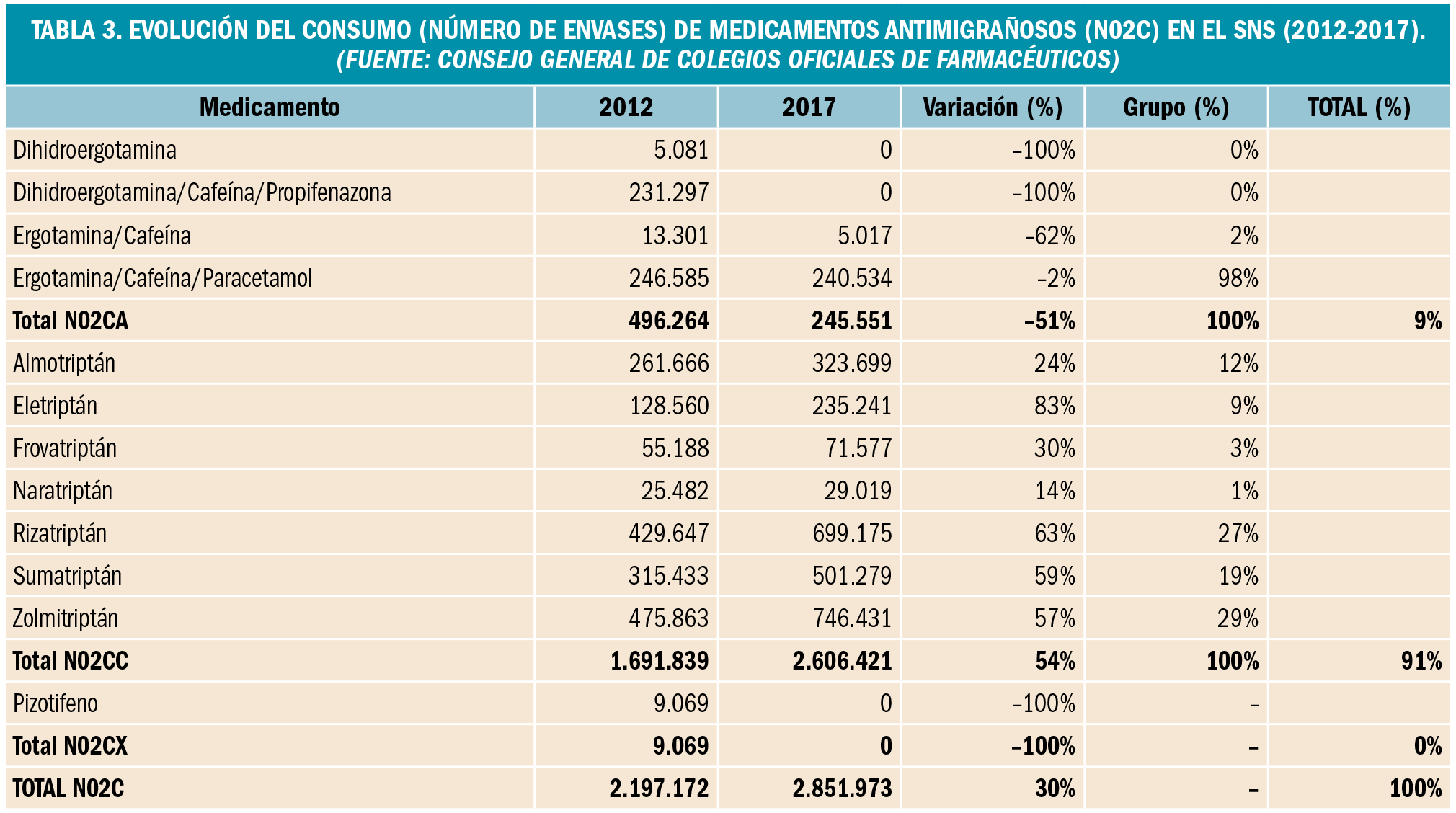
resumen
Las hormonas tiroideas son determinantes para el desarrollo tanto mental como somático del niño y para la actividad metabólica del adulto. La existencia de una cantidad adecuada de estas hormonas en el organismo se regula a través de la TSH o tirotropina. Las alteraciones del tiroides pueden aparecer por hipofuncionamiento de la glándula (hipotiroidismo) o bien por hiperfunción glandular (hipertiroidismo), pudiendo aparecer un bocio (aumento del tamaño del tiroides) en cualquiera de ambas situaciones. La presencia de nódulos tiroideos, obliga al estudio de los mismos en función de sus características ecográficas y de la existencia o no de alteraciones analíticas, para descartar, si procede, una neoplasia tiroidea. El tratamiento de las neoplasias tiroideas es siempre quirúrgico.
INTRODUCCIÓN
La glándula tiroides es un órgano situado en la región anterior del cuello. Pesa unos 20 g en el adulto sano y surge desde el punto de vista embriológico de una proliferación del suelo de la faringe en la tercera semana del desarrollo. Compuesta de dos lóbulos simétricos que están unidos entre sí por el istmo. La formación desciende hasta alcanzar su situación definitiva, permaneciendo unida a su origen primitivo por el denominado conducto tirogloso. La parte distal de este conducto persiste en el adulto y puede crecer constituyendo el lóbulo piramidal (Figura 1). En ocasiones, alteraciones en el mecanismo de descenso embriológico pueden originar quistes tiroglosos o tejido tiroideo aberrante. Excepcionalmente el tiroides no desciende a su posición normal y puede quedar como glándula única en una situación anómala (tiroides lingual).
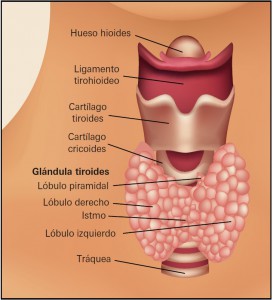
Figura 1. Anatomía del tiroides.
Presenta una rica vascularización, a partir de las dos arterias tiroideas superiores que nacen de las carótidas externas y de las dos arterias tiroideas inferiores procedentes de la subclavia.
Está inervado por los sistemas adrenérgico y colinérgico, con ramas procedentes respectivamente de los ganglios cervicales y del nervio vago. Esta inervación regula el sistema vasomotor y a través de éste, la irrigación de la glándula. Tiene especial interés las relaciones anatómicas que se establecen con los nervios recurrentes y con las glándulas paratiroides, sobre todo han de tenerse presente por los cirujanos que debe conocerlas con exactitud para evitar su lesión durante la cirugía tiroidea.
Microscópicamente la glándula está constituida por folículos cerrados de tamaño variable (15-500 µm de diámetro) revestidos de células epiteliales cilíndricas y conteniendo la sustancia coloide. El principal elemento del coloide es una glucoproteína, la tiroglobulina, cuya molécula contiene las hormonas tiroideas. Cuando la secreción de hormonas ha entrado en los folículos, la sangre debe absorberla de nuevo a través del epitelio folicular para llevarla a la circulación sistémica. Junto a las células foliculares pueden identificarse otro tipo de células denominadas células C o parafoliculares, secretoras de calcitonina.
Existen dos tipos de hormonas tiroideas activas biológicamente: la tiroxina (T4), que corresponde al 93% de hormona secretada por la glándula tiroides, y la triyodotironina (T3) constituyendo ésta tan sólo el 7% Existe también otra forma denominada rT3 (triyodotironina inversa) que no posee actividad biológica. La pérdida de un átomo de yodo en la posición 5´ de T4 da lugar a la formación de T3, que es más activa biológicamente. Si la pérdida de yodo se produce en la posición 5 se forma rT3 (inactivación de la T4).
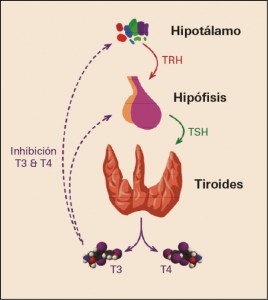
Figura 2. Retrorregulación de las hormonas tiroideas.
Las hormonas tiroideas son determinantes para el desarrollo tanto mental como somático del niño y para la actividad metabólica del adulto. La existencia de una cantidad adecuada de estas hormona en el organismo se regula a través de la TSH o tirotropina, una hormona adenohipofisaria que aumenta la secreción de T3 y T4 por la glándula tiroidea, su secreción está controlada por una hormona hipotalámica, la hormona liberadora de tirotropina (TRH), transportada hasta la adenohipófisis por la circulación portal hipotálamo-hipofisaria (Figura 2).
Cuando se producen alteraciones en los niveles hormonales ocurren diversas patologías en función de si lo que se produce es un aumento o una disminución hormonal, a continuación resumiremos las principales enfermedades tiroideas.
SíNDROME DE EUTIROIDEO ENFERMO O ENFERMEDAD SISTÉMICA NO TIROIDEA
Es un conjunto de alteraciones de la función tiroidea asociado a enfermedades graves, estrés fisiológico o traumatismos, que alteran el transporte y metabolismo periférico de las hormonas tiroideas e incluso su regulación hipotalámica, afectando a la concentración de hormonas circulantes. Analíticamente se presenta como disminución de T3 con aumento de rT3, con niveles normales o bajos de T4 y TSH.
BOCIO
Consiste en el aumento de tamaño de la glándula tiroidea de cualquier etiología. Dentro de esta patología debemos diferenciar el bocio simple que se presenta con función tiroidea normal, sin nódulos y cuya etiología no es ni inflamatoria ni tumoral, pudiendo ser esporádico o endémico cuando afecta a más del 5% de la población. En este tipo de bocio no existe alteración de la función tiroidea y la clínica suele ser mayoritariamente producida por síntomas compresivos a nivel local (disfagia, disnea, molestias locales, disfonía). El diagnóstico se realiza mediante exploración y técnicas de imagen (ecografía, gammagrafía, RX y TAC de tórax, estas dos últimas son utilizadas para valorar si existe desplazamiento traqueal o compresión de vía aérea). El tratamiento es quirúrgico en caso de que existan síntomas compresivos; realizándose tiroidectomía subtotal o casi total. En caso de no existir síntomas compresivos se valora el tratamiento a seguir en función de la situación concomitante del paciente. Observación y ver evolución, administración de levotiroxina como terapia supresora, o bien radioyodo o sal yodada en casos de que exista déficit de yodo. Otro caso sería el bocio multinodular, en el que se presenta un aumento del volumen de la glándula a expensas de múltiples nódulos tiroideos. Entre las causas más importantes que producen esta patología se encuentra el déficit de yodo. La mayoría de los nódulos son benignos y, a menos que sean mayores de 1,5 cm, no precisan estudio con PAAF. Sí deben ser investigados los nódulos predominantes. El tratamiento es similar al bocio simple.
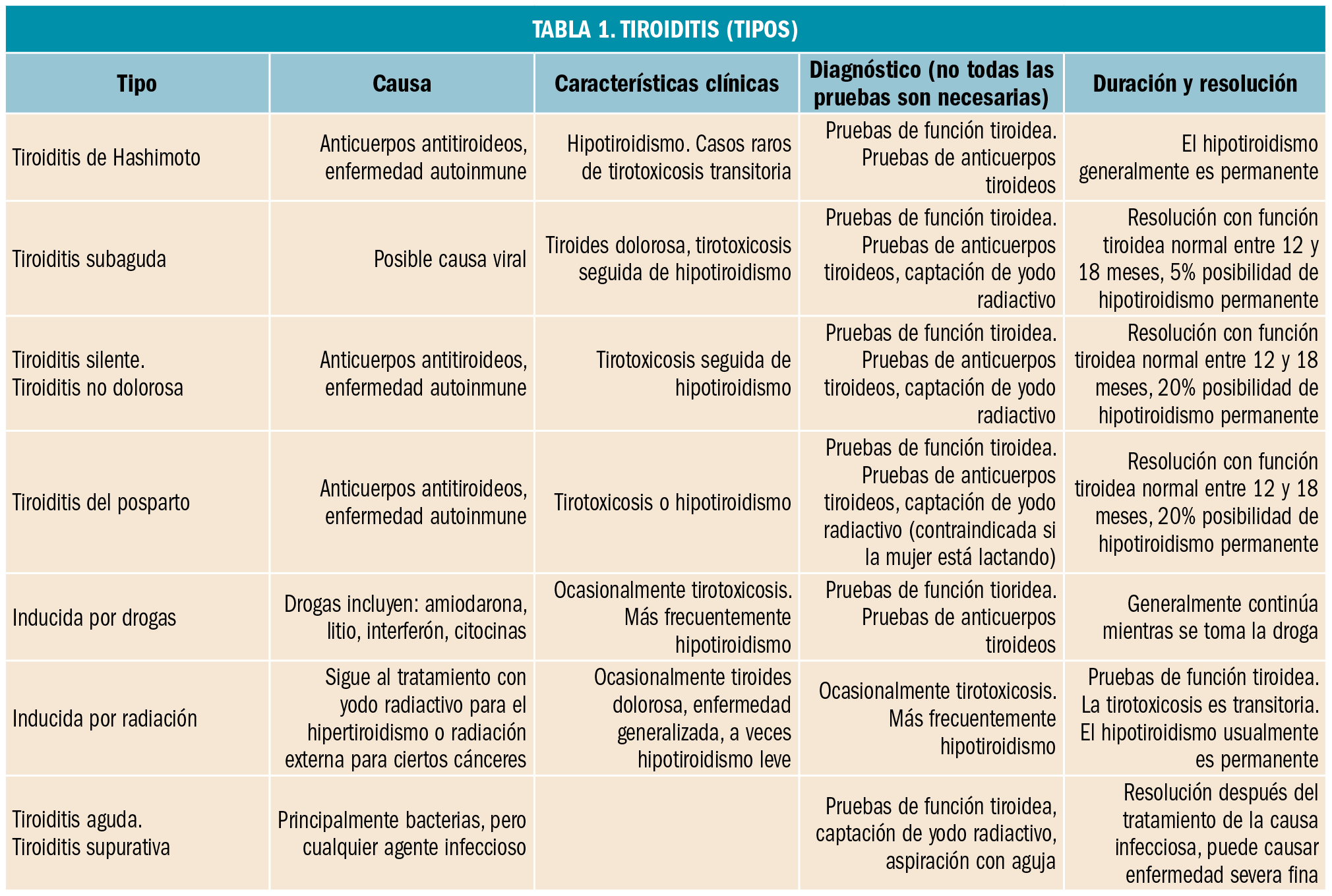
TIROIDITIS
Son un conjunto de patologías de diversa etiología y manifestaciones clínicas muy diferentes.
- Aguda bacteriana o supurativa: Se produce infección por extensión desde la vía hematógena o linfática, o bien por acceso directo a la glándula del agente infeccioso. Se manifiesta con dolor, calor, tumefacción local y síntomas generales de infección. Para su tratamiento se precisa de antibióticos y drenaje.
- Subaguda viral o de Quervain: Suele presentarse tras una infección de vías respiratorias altas. Aparece malestar general, febrícula y dolor, en su mayoría de carácter unilateral. La glándula tiroidea aparece aumentada de tamaño, con mayor sensibilidad a la palpación y de textura nodular. En momentos iniciales se manifiesta como un hipertiroidismo que se va regulando a medida que la glándula se vacía de hormonas. Los casos más leves pueden controlarse con AINE, siendo necesaria la utilización de esteroides en los que presentan mayor gravedad.
- Linfocitaria con tirotoxicoisis transitoria o silente e indolora: Aparece a cualquier edad aunque principalmente en mujeres después del parto. Se manifiesta como un aumento de tamaño de la glándula, indolora y de consistencia aumentada; con elevación de hormonas tiroideas y TSH suprimida. Se piensa que este cuadro pude tener un origen autoinmunitario, pero su etiología es desconocida hasta el momento. Se manifiesta como un hipertiroidismo inicial que pasa a una siguiente fase de hipotiroidismo pudiéndose cronificar.
- Tiroiditis linfocitaria crónica. Es un proceso inflamatorio crónico en el que intervienen factores autoinmunitarios. Su principal manifestación es el bocio. Conforme avanza la enfermedad se desarrolla hipotiroidismo franco.
- Tiroiditis fribosante o de Riedel: A la exploración se encuentra una glándula aumentada de tamaño, dura e inmóvil. Puede existir hipotiroidismo en un 25% de los casos, siendo los anticuerpos antitiroideos positivos o negativos. El tratamiento es quirúrgico si existen síntomas de compresión.
HIPOTIROIDISMO
Nos referimos a la situación clínica resultante de la falta de efecto de la hormona tiroidea sobre los tejidos del organismo. El 95% es debido a causa primaria, es decir, afectación de la propia glándula tiroidea, siendo la causa más frecuente el déficit de yodo. En los países desarrollados el primer puesto es ocupado por la tiroiditis de Hashimoto de origen autoinmune. Entre otras causas de hipotiroidismo primario se encuentra el paso transplacentario de anticuerpos bloqueantes del receptor TSH, postcirugía, tras la utilización de radioyodo o radioterapia cervical, por ingesta excesiva de yodo (efecto Wolf-Chaikoff), tiroiditis subaguda o silente, hipoplasia o aplasia tiroidea, tiroides ectópico, déficit congénito de síntesis hormonal, la utilización de algunos fármacos como el litio, amiodarona, antitiroideos e inhibidores de tirosinkinasas. También hay que tener presente el hipotiroidismo hipotalámico aunque solo es responsable del 5% de todos los hipotiroidismos, y se presenta como un hipopituitarismo (congénito, adenoma hipofisario, cirugía o radioterapia hipofisaria y enfermedades infiltrativas).
En caso de que el hipotiroidismo sea congénito, cosa que ocurre en 1/3.000-3.500 recién nacidos, se manifiesta con ictericia fisiológica, llanto ronco, estreñimiento, somnolencia y problemas de alimentación. El diagnóstico de sospecha es clínico por lo que se realiza cribado sistemático a todos los recién nacidos en las primeras 24-48 horas de vida. En caso de no corregirse la afectación, aparecen los rasgos físicos de cretinismo, manifestándose con talla baja, rasgos toscos, lengua prominente, nariz ancha, abdomen prominente, retraso en la edad ósea, alteración en el desarrollo mental y retraso de la dentición.
Si la disminución hormonal se presenta en adultos, la clínica tiene un inicio progresivo y poco específico, siendo especialmente significativa la aparición de fatiga, letargia, intolerancia al frío y aumento de peso. En ocasiones se pueden observar también estreñimiento, alteraciones menstruales, perdida de vello, y bradicardia con inversión de onda T. El mixedema se presenta en cuadros muy evolucionados y se manifiesta con anemia, palidez y frialdad dérmica, edema periorbitario y macroglosia. A nivel cardiaco puede aumentar el tamaño de corazón, con dilatación y derrame pericárdico. El coma mixedematoso es una situación de urgencia que puede llegar a ser mortal. Éste se manifiesta con estupor e hipotermia y la causa desencadenante más frecuente suele ser la exposición al frío o la realización de una cirugía en un paciente hipotiroideo incorrectamente tratado. También puede presentarse en pacientes que suspenden de manera brusca la medicación.
El diagnóstico se realiza mediante la determinación de TSH, que aparecerá aumentada en el hipotiroidismo primario (afectación de la glándula tiroidea) y está normal o disminuida en el hipotiroidismo hipofisario. En este último caso, debe complementarse el estudio con T4.
Hablamos de hipotiroidismo subclínico cuando aparece TSH elevada con T4 y T3 dentro de los límites de la normalidad. En estos pacientes el tratamiento deberá realizarse de manera individualizada, pero no deben tratarse aquellos pacientes cuyas cifras de TSH sean menores de 10 uU/ml, ni en ancianos o pacientes con cardiopatía isquémica. En el resto de pacientes con hipotiroidismo el tratamiento se realiza con levotiroxina sintética 1 vez al día, que debe iniciarse de manera gradual hasta alcanzar 1,7 mU/kg/día. Para controlar la respuesta al tratamiento en el hipotiroidismo primario se usa la determinación de TSH mientras que en el central es más útil la medición de T3-T4. Ha de tenerse en cuenta que durante el embarazo aumentan los requerimientos diarios de levotiroxina entre un 30-50% a partir de la 4-6 semana de gestación, volviendo a valores habituales tras el parto. En el caso de coma mixedematoso debe ser tratado de manera inmediata para lo que se usa T4 intravenosa junto con hidrocortisona para evitar desencadenar una crisis suprarrenal. En el caso de que la sospecha del hipotiroidismo sea de origen hipofisario o hipotalámico no debe iniciarse el tratamiento sustitutivo hasta no comprobar la normalidad del eje hipotálamo-hipofisario-suprarrenal.
HIPERTIROIDISMO
Es la situación clínica y analítica que resulta del efecto que producen cantidades excesivas de hormonas tiroideas circulantes sobre los diversos órganos (Figura 3). Tiene una prevalencia del 1% y al igual que el resto de patología tiroidea es más frecuente en el sexo femenino.
Figura 3. Hipotiroidismo e hipertiroidismo.
Clínicamente se caracteriza por un estado catabólico con incremento en el consumo de oxigeno y aumento del tono simpático, lo que condiciona la mayoría de sus manifestaciones clínicas. El paciente presenta nerviosismo, sudoración excesiva e intolerancia al calor, tránsito intestinal acelerado, aumento del apetito con pérdida de peso paradójica, labilidad emocional y disminución del rendimiento. A nivel cardiaco se puede manifestar como taquicardia tanto sinusal como supraventricular paroxística, fibrilación auricular y extrasístoles ventriculares. Puede ser una de las causas tratables de insuficiencia cardiaca. Existe una situación especial en los ancianos llamado hipertiroidismo apático o enmascarado y que se manifiesta con debilidad, depresión, apatía, y lentitud mental en ausencia de manifestaciones típicas de hiperfunción tiroidea. Esta entidad ha de tenerse presente en pacientes mayores, en los que suele pasar desapercibida al confundirse con una evolución normal del proceso de envejecimiento.
El diagnóstico, al igual que en el caso de hipotiroidismo se realiza mediante la determinación de TSH, que se encuentra suprimida. La presencia de niveles normales de esta hormona siempre excluye la existencia de un hipertiroidismo primario. La confirmación diagnostica del hipertiroidismo requiere la determinación de los niveles de T4 libre. La T3 también suele estar elevada. Existen situaciones especiales conocida como tirotoxicosis T3, que consiste en la elevación aislada de T3 y suele presentarse en ancianos con nódulos hiperfuncionantes y algunos casos de enfermedad de Graves.
El diagnostico etiológico se realiza mediante gammagrafía tiroidea realizada con isótopos de yodo (I-131 e I-123) o con Tc-99 y la determinación de autoanticuerpos antitiroglobulina (anti-TG), antiperoxidasa (anti-TPO) y anticuerpos frente al receptor de TSH (TSI).
Casi todos los pacientes con hipertiroidismo por hiperfunción tiroidea, independientemente de su etiología, pueden ser controlados eficazmente con tratamiento farmacológico:
TRATAMIENTO FARMACOLÓGICO
- Antitiroideos (metimazol, carbimazol y propiltiouracilo1) constituyen la base del tratamiento antitiroideo. Son capaces de inhibir la síntesis de hormonas tiroideas mediante inhibición de la acción de peroxidasa tiroidea, además inhiben la conversión periférica de T4 en T3 (inhibición de desyodasas). Debe vigilarse para evitar la aparición de agranulocitosis, siendo este su efecto adverso más grave.
- Betabloqueantes: Son útiles como tratamiento coadyuvante ya que producen una rápida mejoría de la sintomatología adrenérgica que acompaña al hipertiroidismo (palpitaciones, ansiedad, temblor). Debe tenerse en cuenta que no se puede usar como tratamiento exclusivo, pues no ayuda a controlar la liberación y síntesis de hormonas tiroideas. Tiene especial importancia el propanolol que a su acción antiadrenérgica ya mencionada se le suma la capacidad para inhibir la conversión periferica de T4 a T3.
- Yoduro inorgánico: Usado en dosis farmacológicas, es capaz de limitar su propio transporte en las células tiroideas y de inhibir la organificación, impidiendo la síntesis de yodotirosinas (efecto Wolff-Chaikoff) y la liberación de hormonas tiroideas. El mayor problema que puede presentar este fármaco es su acción limitada, ya que produce un fenómeno de escape, de agotamiento de su eficacia, aproximadamente a las 2 semanas del inicio de su uso.
- Glucocorticoides: Inhiben la conversión periférica de T4 a T3, así como la secreción hormonal tiroidea en pacientes con enfermedad de Graves. Se usa fundamentalmente en el tratamiento de la crisis tirotóxica.
- Yodo radiactivo: Antes de su uso se recomienda tratar al paciente con antitiroideos al menos durante un mes, con el objeto de normalizar la función tiroidea, sobre todo en pacientes ancianos. Estos antitiroideos deben suspenderse 3-7 días antes de la administración terapéutica de radioyodo y deben restablecerse una semana después, en espera del efecto de la destrucción glandular que puede tardar hasta 3-12 meses. El mecanismo de acción de este fármaco, consiste en la captación del mismo por las células tiroideas produciendo en ellas lesión celular con la consecuente reducción de la cantidad de tejido tiroideo funcionante. Los efectos adversos indeseables más importantes son la persistencia del hipertiroidismo, o el desarrollo de hipotiroidismo. Puede aparecer tiroiditis tras el uso de I-131 por la liberación de hormonas tiroideas al plasma, con exacerbación del hipertiroidismo que puede acompañarse de dolor local y aumento de tamaño del tiroides. Este fármaco no puede usarse en gestantes ni durante la lactancia o ante sospecha de malignidad, tampoco es recomendado en menores de 20 años.
TRATAMIENTO QUIRÚRGICO
La tiroidectomía subtotal o casi total es la técnica de elección. Los pacientes que van a recibir este tratamiento deben prepararse previamente con el uso de antitiroideos hasta alcanzar el eutiroidismo para evitar crisis tirotóxicas tras la intervención. Como complicaciones de la cirugía, deben tenerse en cuenta el posible daño del nervio laríngeo recurrente durante el acto quirúrgico, pudiendo aparecer en caso de verse afectado parálisis transitoria o permanente de la cuerda vocal (disfonía), sangrado masivo, hipoparatiroidismo y un posible hipotiroidismo permanente.
CUADROS DE HIPERTIROIDISMO
Enfermedad de Graves
Es la causa más frecuente de hipertiroidismo en edades medias de la vida, sobre todo mujeres jóvenes. Tiene un origen autoinmunitario y carácter multisistémico. Caracterizado por la presencia de bocio difuso, hipertiroidismo, oftalmopatía en el 50% de los casos y afectación dérmica en el 5-10% de los pacientes (manifestándose como mixedema pretibial). Es característica la presencia en el suero de autoanticuerpos estimulantes de tiroides responsables de la hipersecreción hormonal mediante interacción con el receptor de membrana para TSH. Existe clara predisposición genética, relacionándose su aparición con determinados haplotipos, sobre todo HLA-DR3 Y HLA B8. El tratamiento de primera elección son los antitiroideos durante periodos prolongados de hasta 12-18 meses. En caso de falta de respuesta a este tratamiento o recidiva de la sintomatología, se realiza un tratamiento ablativo con yodo radiactivo o cirugía (en la mayoría de los casos se elige yodo radiactivo a no ser que existan contraindicaciones. En los bocios grandes con síntomas compresivos la cirugía ablativa debe considerarse el tratamiento de primera elección. También debe considerarse esta opción si se sospecha malignidad, si existe oftalmopatía de Graves y en embarazadas a partir del 2º trimestre, con mal control de la función tiroidea o se presenta intolerancia a los antitiroideos.
Bocio multinodular hiperfuncionante
Es la causa más frecuente de hipertiroidismo en el anciano. En la gammagrafía se observa un tiroides con nódulos hiperfuncionantes (calientes) alternando con otros normofuncionantes o hipofuncionantes (fríos). El tratamiento de elección es el radioyodo dado que suele presentarse en pacientes de edad avanzada.
Adenoma tóxico
Ocurre en el 20% de los pacientes portadores de un adenoma tiroideo. Gammagráficamente se visualiza un nódulo único que concentra el radiotrazador, a lo que se añade la supresión casi total de la captación en el resto de la glándula. El tratamiento de elección, como ocurre en el caso del bocio multinodular hiperfuncionante, es el yodo radiactivo.
Fenómeno Jod-Basedow
Consiste en la aparición de un estado de hipertiroidismo producido como consecuencia de la administración de cantidades elevadas de yodo en sus diversas formas, a pacientes que presentan nódulos con capacidad de funcionamiento autónomo.
Struma ovarii y metástasis de carcinomas tiroideos
Son capaces de producir de manera excepcional hipersecreción ectópica de hormonas tiroideas.
Mola hidatiforme, coriocarcinoma y embarazo
Es estas situaciones se produce una elevación de HCG, si excede de 3.000 Ul/ml pueden estimular los receptores de TSH y como consecuencia desarrollar un hipertiroidismo. Dicho cuadro se resolverá tras el tratamiento de la causa primaria.
Tiroiditis
En la enfermedad subaguda yen la de tipo linfocitario se produce una destrucción inicial y transitoria de la glándula con liberación plasmática de las hormonas previamente sintetizadas. También puede ocurrir esta misma situación tras el tratamiento con I-131, causante de destrucción tisular. El hipertiroidismo asociado a esta patología suele ser leve y poco duradero, generalmente no precisa tratamiento y, si las manifestaciones son llamativas, puede ser bien controlado con bloqueantes B adrenérgicos, pero no está indicado el tratamiento con antitiroideos.
Yatrogenia
Puede aparecer en casos de administración de dosis tóxicas de hormonas tiroideas, pero también puede ocurrir con la administración de dosis terapéuticas sobre todo en pacientes con bocios uninodulares o multinodulares en situación de autonomía funcional.
Hipertiroidismo por amiodarona
Este fármaco contiene yodo en su estructura química. Puede producir hipotiroidismo (efecto Wolff-Chaikoff) bocio simple o hipertiroidismo. Esta última situación puede acontecer de dos maneras, bien generando una hiperfunción (efecto Jod-Basedow) o bien por la aparición de una tiroiditis.
TUMORES MALIGNOS DEL TIROIDES
La incidencia de esta patología es del 5% en los bocios multinodulares, la misma incidencia que en cada nódulo individual. El tiroides es un órgano donde se localizan más metástasis de melanoma, pulmón, mama y esófago que tumores primarios. La presencia de nódulos tiroideos es frecuente en la población general, aumentando dicha incidencia a medida que aumenta la edad, y llegándose a detectar su presencia en aproximadamente el 50% de personas mayores de 60 años. Pero un nódulo solitario apenas entraña mayor complicación, presentando estos una tasa de malignidad inferior al 5%. Ante el hallazgo de un nódulo solitario se debe complementar el diagnóstico con niveles de TSH y ecografía cervical, aunque la prueba que ofrece mayor rentabilidad diagnóstica es la punción-aspiración con aguja fina (PAAF) del nódulo, que constituye el primer paso sobre el que se sustenta el algoritmo diagnóstico del nódulo solitario.
Esta prueba, aunque de carácter invasivo, permite diferenciar de manera certera los nódulos malignos de los benignos, excepto en los casos de lesiones con abundante celularidad. Aunque también en el caso de nódulos foliculares, entonces debemos demostrar la invasión vascular para discernir entre lesiones malignas y benignas. Aunque la PAAF aporta claras ventajas diagnósticas, no está exenta de errores, pudiendo existir falsos positivos y falsos negativos. Es por ello que los factores de riesgo del paciente y la evolución del nódulo son importantes a la hora de tomar decisiones. En caso de realizarse una PAAF no concluyente, debe repetirse dicha prueba de manera ecoguiada. También es importante tener en cuenta que este apoyo visual es de gran ayuda en casos de nódulos no accesibles por palpación o con gran componente quístico.
El uso de la gammagrafía ha quedado relegado por las técnicas más novedosas con mayor especificidad, puesto que en la gammagrafía la demostración de un nódulo frío (ausencia de captación del radiotrazador) constituye un parámetro sugestivo de carcinoma. Bien es cierto que solo el 20% de los nódulos fríos son malignos, siendo en su mayoría quistes coloides o adenomas no funcionantes. Por ello, en la actualidad, se desaconseja esta prueba como primer paso en la investigación del nódulo tiroideo.
La ecografía permite diferenciar el nódulo solitario del predominante en un bocio multinodular. Los nódulos mixtos o sólidos sugieren malignidad, así como la presencia de microcalcificaciones, la hipoecogenicidad, la presencia de un halo irregular y el incremento de la vascularización intranodular. Por otra parte los nódulos quísticos suelen indicar que la lesión es benigna.
Las pruebas diagnósticas de laboratorio carecen de utilidad para diferenciar entre nódulo maligno y benigno. La función tiroidea suele ser normal y los marcadores tumorales carecen de interés, salvo en el caso de pacientes con carcinoma medular. En este caso es útil la determinación de calcitonina y de CEA para su seguimiento, para valorar su respuesta al tratamiento, así como para el diagnóstico de síndromes de agregación familiar.
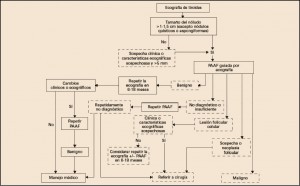
Figura 4. Algoritmo diagnóstico del nódulo solitario.
El tratamiento en el carcinoma de tiroides es siempre la cirugía, siendo de elección la tiroidectomía total si se demuestra malignidad mediante la PAAF. En caso de una primera prueba diagnóstica dudosa o no concluyente pero con factores de riesgo para lesión maligna se debe realizar extirpación ampliada de la lesión (hemitiroidectomía con istmectomía) realizando posteriormente biopsia de la pieza quirúrgica. En caso de confirmar la lesión, se debe completar la tiroidectomía en un segundo tiempo.
Después del tratamiento quirúrgico inicial, se recomienda la ablación de los restos tiroideos con yodo radiactivo 131I, aunque esto no será necesario en pacientes con carcinomas papilares menores de 1 cm o multifocales con todos los focos menores de 1 cm y sin factores de riesgo de recurrencia. Los carcinomas operados deben recibir tratamiento con hormona tiroidea en dosis suprafisiológica para mantener TSH suprimida. En los pacientes con carcinoma folicular, el tratamiento debe ser más agresivo, pues el pronóstico de estos es más desfavorable.
LINFOMA TIROIDEO
Es poco común, solo representa el 5% o menos de todos los tumores tiroideos. Su manifestación más frecuente es en forma de linfoma B difuso de células grandes. Suele estar relacionado con el padecimiento previo de tiroiditis de Hashimoto o presencia de anticuerpos antiperoxidasa positivo. Para su tratamiento se precisa quimioterapia y radioterapia.
CARCINOMA MEDULAR DE TIROIDES
Es productor de calcitonina al originarse desde células C parafoliculares. Puede aparecer de manera esporádica (80%), o bien existir un cierto grado de agregación familiar (20%) o formando parte del síndrome MEN TIPO 2A O 2B. Se ha identificado el gen responsable en los casos familiares, encontrándose mutaciones en el protoncogén cRET. Este hallazgo permite el diagnóstico precoz en familiares de pacientes afectos. La calcitonina y la CEA son usadas como marcadores tumorales para detectar enfermedad residual después del tratamiento. La elección siempre es la cirugía (tiroidectomía total con linfadenectomía central profiláctica), debido a la presencia de formas familiares que pueden asociarse a la presencia de feocromocitoma. Cuando se sospeche un carcinoma medular de tiroides, deben realizarse determinaciones de catecolaminas en plasma o en orina de 24 h, para detectar la posible existencia de un feocromocitoma; y en caso positivo intervenir éste en primer lugar.
CARCINOMA PAPILAR
Este es el tumor más frecuente (70%) y a su vez el de mejor pronóstico. Su aparición esta incrementada en áreas geográficas donde existe una elevada ingesta de yodo. Tiene un ritmo de crecimiento lento, propagándose a través de la cápsula tiroidea hacia estructuras vecinas del cuello, siendo infrecuente la diseminación hematógena. En el 50% de los casos se ha descrito la mutación en el gen BRAF lo cual parece aportar un peor pronóstico, pues está relacionada con invasión extratiroidea y diseminación linfática. La presencia de cuerpos de Psamoma (calcificaciones en grano de arena) es rara de encontrar, pero si se detecta, es característica diagnóstica de este tipo de tumor. El pronóstico aunque alentador en la mayoría de los casos, está condicionado por la edad del paciente, la existencia de afectación ganglionar fuera del compartimento central y la presencia de metástasis a distancia.
CARCINOMA FOLICULAR
Constituye el 15-20% de los tumores tiroideos. Suele aparecer en sujetos de edad avanzada. La diferencia entre este tumor y el adenoma folicular benigno, es la presencia de invasión de la capsula o a nivel vascular, siendo entonces muy agresivo con tendencia a propagarse rápidamente por vía hematógena, lo cual aumenta la incidencia de metástasis en pulmón, hueso y sistema nervioso central.
CARCINOMA ANAPLÁSICO
Es poco común, solo 5% de los tumores tiroideos. Suele aparecer en la 6.ª-7.ª década de la vida. Presenta un crecimiento rápido, tendencia invasiva y compromiso de estructuras vecinas de manera precoz, y pudiendo manifestarse como ulceraciones dérmicas. El pronóstico es muy desfavorable con una supervivencia no mayor a un año a pesar de tratamiento con cirugía radical.
Bibliografía