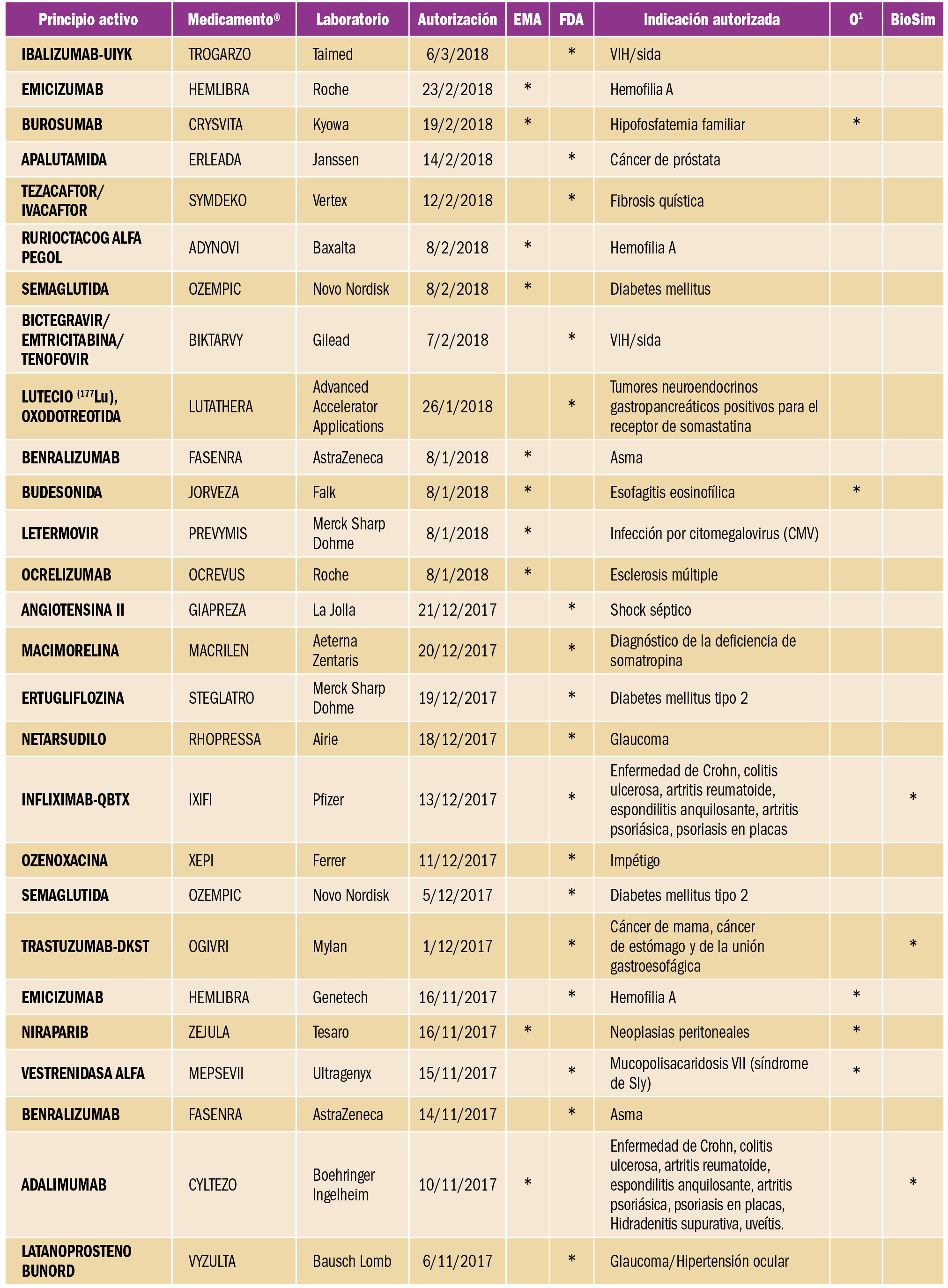
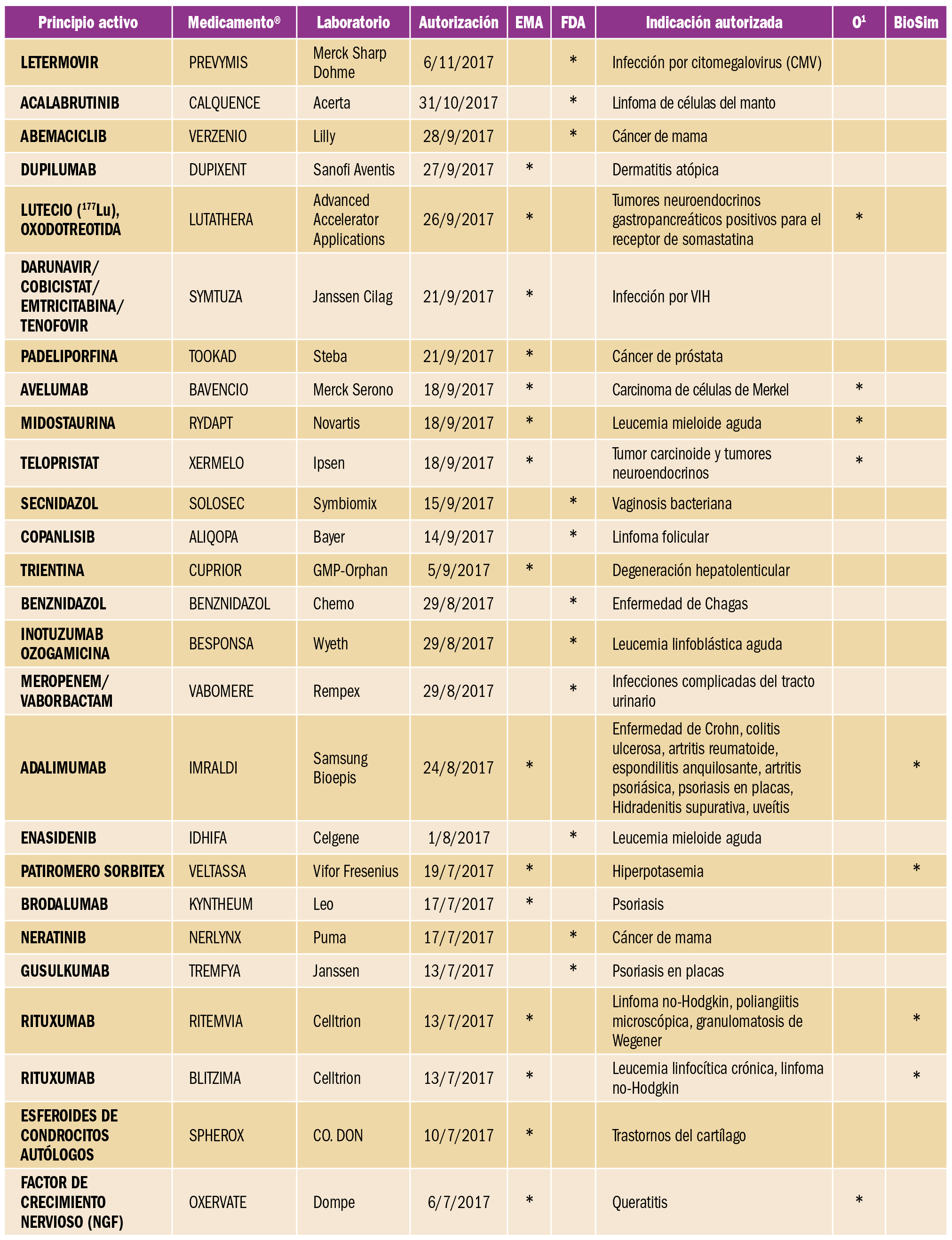
Cáncer hepático
El tiosulfato sódico reduce sustancialmente la ototoxicidad del cisplatino
La adición de tiosulfato de sodio, administrado 6 horas después de la quimioterapia con cisplatino, redujo la incidencia de pérdida auditiva inducida por cisplatino en niños con hepatoblastoma, sin afectar a la eficacia antitumoral.
La quimioterapia empleada en pacientes pediátricos frecuentemente incluye al cisplatino, cuya ototoxicidad está bien documentada, mediada por alteración de los procesos biomecánicos de las células pilosas cocleares y daño en la estría vascular. La quimioterapia con cisplatino, junto con la cirugía, son tratamientos efectivos para niños con hepatoblastoma pero, como se indicaba anteriormente, puede causar una pérdida de audición considerable e irreversible. Un reciente ensayo ha comparado el cisplatino con cisplatino más administración tardía de tiosulfato de sodio, con el objetivo de reducir la incidencia y la gravedad de los efectos ototóxicos relacionados con cisplatino sin poner en peligro los resultados del tratamiento.
No es la primera vez que se emplea este procedimiento para limitar la ototoxicidad del cisplatino, sin embargo en estudios anteriores la supervivencia de los pacientes parecía ser menor entre aquellos con enfermedad metastásica que recibieron tiosulfato sódico. En este estudio se asignó aleatoriamente a niños mayores de 1 mes y menores de 18 años que tenían hepatoblastoma de riesgo estándar (≤3 sectores hepáticos involucrados, sin enfermedad metastásica y un nivel de alfafetoproteína >100 ng/ml) a recibir por vía IV cisplatino solo (80 mg/m2, durante un período de 6 horas) o cisplatino más tiosulfato de sodio (20 g/m2, durante un período de 15 minutos, 6 horas después de la interrupción de cisplatino) para cuatro ciclos preoperatorios y dos postoperatorios. La variable primaria fue el umbral auditivo absoluto, medido por audiometría de tonos puros, a una edad mínima de 3,5 años. La pérdida de audición se evaluó de acuerdo con el grado de Brock (en una escala de 0 a 4, con grados más altos que indican una mayor pérdida de audición). Las variables secundarias consistieron en la supervivencia global y la supervivencia libre de eventos a los 3 años.
Un total de 109 niños fueron asignados aleatoriamente para recibir cisplatino más tiosulfato de sodio (57 niños) o cisplatino solo (52). El umbral de audición absoluta se evaluó en 101 niños. La pérdida auditiva de grado 1 o superior ocurrió en 18 de 55 niños (33%) en el grupo de cisplatino-tiosulfato de sodio, en comparación con 29 de 46 (63%) en el grupo de cisplatino solo, lo que indica una reducción del 48% en la incidencia de audición en el grupo de cisplatino-tiosulfato de sodio (riesgo relativo, RR=0,52; IC95% 0,33 a 0,81; p=0,002). Tras una mediana de 52 meses de seguimiento, las tasas de supervivencia libre de eventos a los 3 años fueron del 82% (IC95% 69 a 90) en el grupo tratado con cisplatino-tiosulfato sódico y del 79% (IC95% 65 a 88) en el grupo de cisplatino solo, y las tasas de supervivencia global a 3 años fueron del 98% (IC95% 88 a 100) y 92% (IC95% 81 a 97), respectivamente. El tiosulfato de sodio se asoció con pocos efectos tóxicos de alto grado.